Содержание
Что такое технология редактирования генома CRISPR-CaS9 и почему она стала такой спорной?
Биология
20.01.2021
1 363 3 минут чтения
Технология редактирования генов, возможно, является самой быстроразвивающейся отраслью науки в 21 веке. Изобретение метода CRISPR-Cas9 положило начало революции в области изменения генов, поскольку он дешевле и эффективнее предыдущих методов. Основатели получили Нобелевскую премию по химии 2020 года, тем не менее, существует много споров по поводу этических проблем генетических манипуляций.
CRISPR-Cas в природе
Защита ДНК у прокариот
CRISPR (короткие палиндромные повторы, регулярно расположенные группами) — это семейство систем ДНК бактерий и архей в естественном мире. Он играет важную роль в иммунной системе организмов. Механизм довольно простой. Фрагменты ДНК CRISPR берутся из генома (полный набор генетических инструкций организма. Каждый геном содержит всю информацию, необходимую для построения этого организма и обеспечения его роста и развития) вируса, инфицировавшего бактерии-бактериофаг. Клетка использует их для идентификации и уничтожения бактериофага, если он снова попытается заразить организм. Более того, бактерии могут передавать гены друг другу, так что клетки могут передавать информацию о вирусе от одного к другому.
Клетка использует их для идентификации и уничтожения бактериофага, если он снова попытается заразить организм. Более того, бактерии могут передавать гены друг другу, так что клетки могут передавать информацию о вирусе от одного к другому.
Фермент Cas9
Cas9 — это фермент, который использует информацию CRISPR в качестве уведомления. Он использует данные последовательностей для поиска фрагментов ДНК, которые «подходят» к последовательности CRISPR. Это означает, что CRISPR имеет последовательность, которая образует пары с ДНК вируса. Когда две последовательности «совпадают», мы называем их взаимодополняющими.
Визуализация системы CRISPR-Cas
Система CRISPR-Cas9
Наконец, CRISPR и фермент Cas9 создают мощный инструмент иммунной системы, известный как CRISPR-Cas9. Он широко распространен среди бактерий — мы можем найти его более чем в половине всех геномов и 90% геномов архей. Это основная система защиты клетки от бактериофагов, что делает ее необходимой для жизни и эволюции бактерий.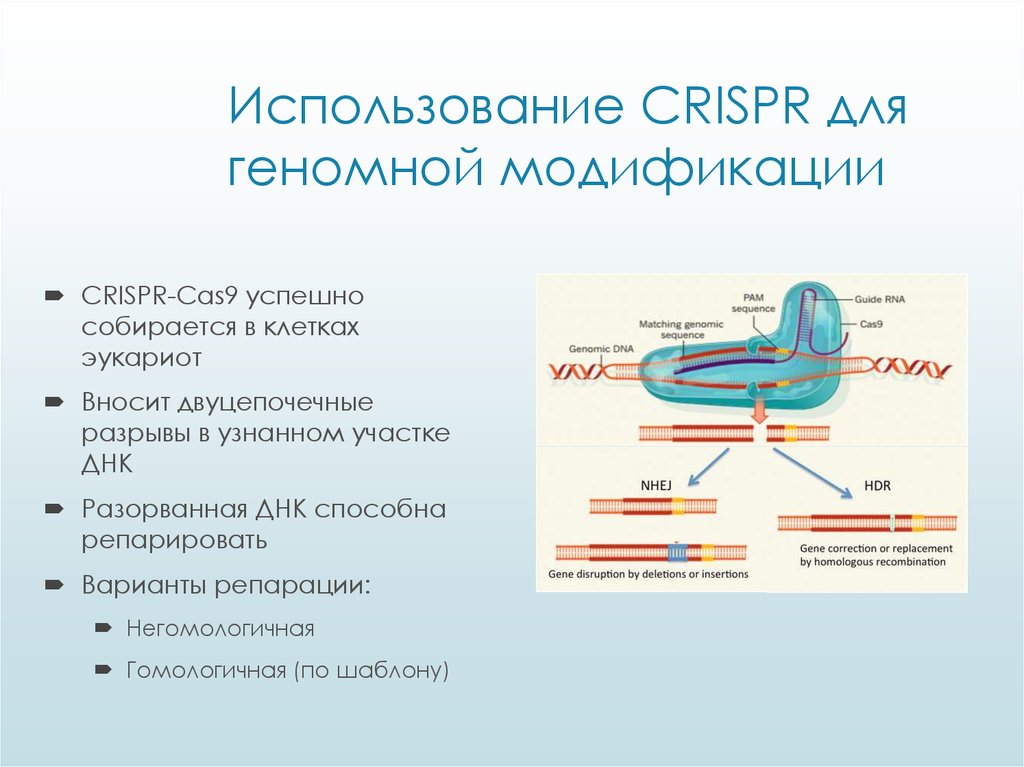 Как тогда этот механизм используется при редактировании генов?
Как тогда этот механизм используется при редактировании генов?
Механизм редактирования генома с помощью CRISPR
Молекулярные ножницы
Технология CRISPR-Cas9 позволяет ученым удалять, изменять или добавлять участки ДНК. Белок Cas9 действует как молекулярные ножницы. Он разрезает нити ДНК в определенном месте, позволяя внести изменения. Затем направляющая РНК (гРНК), состоящая из небольшого кусочка специально разработанного фрагмента РНК CRISPR в более расширенной последовательности. Более длинная часть связывается с матричной ДНК, тогда как CRISPR направляет Cas9 в нужное место в геноме, точно так же, как это происходит у бактерий и архей.
Часть CRISPR является комплементарной только для одной области генома, поэтому она не будет связываться где-либо еще, что делает технологию точной. Когда Cas9 находит комплементарный фрагмент, он разрезает ДНК. Клетка распознает разрез как повреждение и восстанавливает его, комбинируя мутацию (более крупный кусок) со своей ДНК.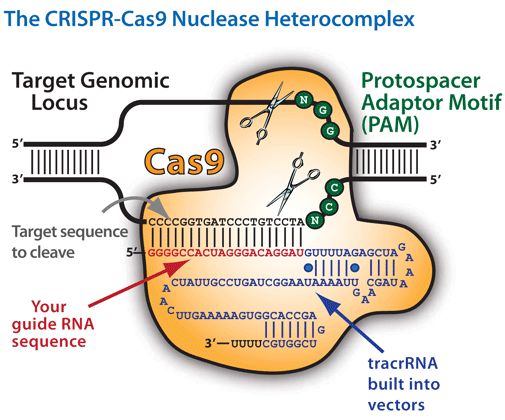 В результате получается функционирующий геном с определенной мутацией.
В результате получается функционирующий геном с определенной мутацией.
Механизм CRISPR-Cas9.
Применение технологии CRISPR-Cas9
ДНК содержит гены — подробную информацию о белках и их создании. Генетическая экспрессия — это когда определенные структуры транслируют информацию, позволяя создавать различные молекулы. В совокупности информация в ДНК и факторы, влияющие на экспрессию, создают нас. ДНК состоит из информации о каждом отдельном белке, из которого мы построены — его структуре, местонахождении, способах экспрессии, функциях и многом другом. Следовательно, изменение ДНК изменяет организм на молекулярном уровне. Это делает CRISPR-Cas9 таким мощным инструментом. Используя правильные последовательности, мы можем изменить образ жизни организмов и настроить их в соответствии с нашими потребностями. Конечно, существуют проблемы, связанные с тем, какие гены использовать, куда их вставить и как они повлияют на организмы.
Нобелевская премия 2020 и споры
Нобелевская премия 2020
Нобелевская премия по химии 2020 года была присуждена Эммануэль Мари Шарпантье и Дженнифер Даудна — пионерам метода CRISPR-Cas9. Шарпантье — французский профессор, микробиологический исследователь и основатель независимого исследовательского института имени Макса Планка по науке о патогенах. Дженнифер Даудна — профессор химии в Университете Беркли, Калифорния. Она также является исследователем в медицинском институте Говарда Хьюза. Их награда — первая научная Нобелевская премия, полученная двумя женщинами.
Шарпантье — французский профессор, микробиологический исследователь и основатель независимого исследовательского института имени Макса Планка по науке о патогенах. Дженнифер Даудна — профессор химии в Университете Беркли, Калифорния. Она также является исследователем в медицинском институте Говарда Хьюза. Их награда — первая научная Нобелевская премия, полученная двумя женщинами.
Основатели метода CRISPR-Cas9 были удостоены Нобелевской премии 2020 г.
Полемика
Эти две женщины не единственные, кто заявляет, что они изобрели этот метод. Команда из Массачусетского технологического института утверждает, что открыла его самостоятельно. Две команды теперь судятся друг с другом за права на патент. Все сводится к тому, кто первым изобрел метод CRISPR-Cas9.
Технология редактирования генов — одна из самых многообещающих и одна из самых противоречивых в современной науке. Люди боятся «играть в бога», манипулировать детскими геномами или создавать новые превосходные виды. Хотя это, безусловно, сопряжено с большой ответственностью и возможной угрозой, это также может значительно улучшить нашу жизнь и понимание мира. «Ничего в жизни не следует бояться; это нужно только понять«, — сказала Мария Кюри. С этой мыслью мы должны использовать CRISPR-Cas9, чтобы сделать мир лучше, понимая риски и ответственность, связанные с властью.
«Ничего в жизни не следует бояться; это нужно только понять«, — сказала Мария Кюри. С этой мыслью мы должны использовать CRISPR-Cas9, чтобы сделать мир лучше, понимая риски и ответственность, связанные с властью.
Подпишитесь на нас:Дзен.Новости / Вконтакте / Telegram
Back to top button
В геномный редактор CRISPR/Cas9 встроили программируемый «выключатель» — Наука
© Gregor Fischer/picture alliance via Getty Images
ТАСС, 9 апреля. Молекулярные биологи из США создали новую форму геномного редактора CRISPR/Cas9. Его структуру изменили так, что теперь его можно использовать для программируемого отключения и включения произвольных генов. Результаты исследования опубликовал научный журнал Cell.
На эту тему
«Теперь у нас есть инструмент, с помощью которого можно произвольно отключать подавляющее большинство генов. Мы можем делать это, не повреждая саму нить ДНК и сохраняя возможность отмены всех изменений», – рассказал один из авторов исследования, профессор Массачусетского технологического института Джонатан Вайссман.
Геномный редактор CRISPR/Cas9 открыли в начале 2010-х три группы генетиков, две из которых в 2020 году получили за это Нобелевскую премию по химии. С тех пор этот инструмент несколько раз модернизировали, благодаря чему его можно использовать для «точечного» редактирования генома почти со стопроцентной точностью.
CRISPR/Cas9 представляет собой своеобразный генетический «антивирус», который бактерии используют, чтобы найти в своем геноме вирусную ДНК и вырезать ее. Ключевая часть редактора – белок Cas9, который использует короткие РНК-шаблоны, чтобы распознавать и удалять определенные последовательности нуклеотидов внутри ДНК микроба или уничтожать копии вирусной РНК.
Он отличается простотой и высокой точностью редактирования. Однако у CRISPR/Cas9 есть один большой недостаток – его нельзя избирательно включать или выключать в произвольных клетках. Вайссман и его коллеги решили эту проблему.
Они поменяли то, какую именно часть двойной спирали ДНК пытается изменить белок Cas9. Структуру его молекулы ученые модифицировали так, что этот фермент начал не вырезать участки генома, которые совпадали по структуре с шаблоном РНК, а наносить на них так называемые эпигенетические метки.
Структуру его молекулы ученые модифицировали так, что этот фермент начал не вырезать участки генома, которые совпадали по структуре с шаблоном РНК, а наносить на них так называемые эпигенетические метки.
На эту тему
Так ученые называют короткие молекулы, которые клетка может присоединять к нити ДНК или к ее белковой оболочке. Благодаря этому меняется характер считывания этого сегмента генома. Это позволяет живым организмам гибко управлять активностью генов в ответ на изменения внешней среды, не меняя при этом структуры генома.
Биологи создали две новых формы Cas9 – CRISPRoff и CRISPRon. Первая с помощью РНК-шаблонов наносит эпигенетические метки и подавляет работу генов, а вторая удаляет их. После долгой череды проб и ошибок ученые подобрали такую структуру этих ферментов, чтобы порожденные ими изменения не только сохранялись на протяжении всей жизни клетки, но и передавались по наследству.
Работу новой версии редактора ученые проверили на стволовых клетках. Биологи отключали в них произвольные гены и заставляя их превращаться в нейроны и другие типы «взрослых» клеток. Опыты показали, что в результате трансформации стволовых клеток ранее отключенный ген не включился повторно. Это подтвердило, что благодаря новой версии CRISPR/Cas9 можно надежно включать и отключать отдельные участки ДНК.
Опыты показали, что в результате трансформации стволовых клеток ранее отключенный ген не включился повторно. Это подтвердило, что благодаря новой версии CRISPR/Cas9 можно надежно включать и отключать отдельные участки ДНК.
По словам Вайссмана и его коллег, их разработку можно использовать не только для изучения свойств генов, но и для лечения болезней, связанных со сбоями в работе отдельных участков ДНК. В частности, ученые уже провели опыты по отключению гена MAPT, мутации в котором предположительно приводят к развитию болезни Альцгеймера. Это дает надежду на создание генной терапии, которая защитила бы пожилых людей от развития старческой деменции, подытожили исследователи.
Теги
ГенетикаБиологияЭпигенетика
Что такое CRISPR? — Разъяснено Дженнифер Дудна и экспертами IGI
Инновационный
Институт геномики
Меню
Что такое КРИСПР?
Краткое введение в технологию, использование и этику редактирования генома CRISPR от Дженнифер Дудна и экспертов IGI
CRISPR 101
Мы можем редактировать нашу ДНК, но давайте делать это с умом. В своем выступлении на TED Talk основатель IGI Дженнифер Дудна подробно рассказала о том, как CRISPR-Cas9система позволяет ученым переписывать последовательности ДНК в любой клетке. Она объясняет, что этот революционный инструмент генной инженерии предоставил монументальную возможность вылечить генетические заболевания и одновременно заставляет нас решать сложные моральные дилеммы.
В своем выступлении на TED Talk основатель IGI Дженнифер Дудна подробно рассказала о том, как CRISPR-Cas9система позволяет ученым переписывать последовательности ДНК в любой клетке. Она объясняет, что этот революционный инструмент генной инженерии предоставил монументальную возможность вылечить генетические заболевания и одновременно заставляет нас решать сложные моральные дилеммы.
«… на всех нас лежит огромная ответственность тщательно учитывать как непредвиденные последствия, так и предполагаемые последствия научного прорыва».
Как работает редактирование генома CRISPR?
ДНК — это руководство по жизни на Земле. Он кодирует фундаментальные свойства организма — как он живет, растет и размножается. Изменение последовательности ДНК в живой клетке известно как редактирование генома или редактирование генов . Долгое время это было либо невозможно, либо чрезвычайно сложно.
Открытие технологии редактирования генома CRISPR значительно упростило этот процесс. В 2012 году основатель IGI Дженнифер Дудна, Эммануэль Шарпантье и их команды разработали метод перепрофилирования бактериальной иммунной системы под названием CRISPR — аббревиатура, расшифровывающаяся как 9.0022 C блестящий R равномерный I с интервалами S короткий P алиндромный R повторный — для разрывов ДНК в определенных местах с помощью фермента, связанного с CRISPR (белок Cas9), для разрезания наподобие ножниц (белок Cas9). ДНК. Теперь ученые могут редактировать геном живых организмов, добавляя новые фрагменты ДНК, чтобы клетка использовала их в качестве шаблона, когда восстанавливает разрыв в ДНК. Таким образом, ученые могут заменить вызывающую болезнь мутацию здоровой последовательностью или внести другие изменения в геном.
В 2012 году основатель IGI Дженнифер Дудна, Эммануэль Шарпантье и их команды разработали метод перепрофилирования бактериальной иммунной системы под названием CRISPR — аббревиатура, расшифровывающаяся как 9.0022 C блестящий R равномерный I с интервалами S короткий P алиндромный R повторный — для разрывов ДНК в определенных местах с помощью фермента, связанного с CRISPR (белок Cas9), для разрезания наподобие ножниц (белок Cas9). ДНК. Теперь ученые могут редактировать геном живых организмов, добавляя новые фрагменты ДНК, чтобы клетка использовала их в качестве шаблона, когда восстанавливает разрыв в ДНК. Таким образом, ученые могут заменить вызывающую болезнь мутацию здоровой последовательностью или внести другие изменения в геном.
В качестве альтернативы ученые могут использовать этот метод для полного «выключения» гена — метод, который часто используется для изучения функций генов — или для модификации частей генома, влияющих на экспрессию генов, известных как «эпигенетическое редактирование». .» Вместе эти методы дают ученым новые мощные инструменты для лечения болезней, улучшения сельского хозяйства и изучения фундаментальных вопросов биологии.
.» Вместе эти методы дают ученым новые мощные инструменты для лечения болезней, улучшения сельского хозяйства и изучения фундаментальных вопросов биологии.
Radiolab объясняет CRISPR
В этом выпуске WNYC Radiolab 2015 года с добавленным обновлением от 2017 года Джад и Роберт исследуют мир CRISPR вместе с Дженнифер Дудна, Юджином В. Кунином, Бет Шапиро и Карлом Циммером.
«Внутри некоторых из самых маленьких организмов в мире спрятан один из самых мощных инструментов, с которыми когда-либо сталкивались ученые. Это защитная система, которая существовала в бактериях миллионы лет, и однажды она может позволить нам изменить ход человеческой эволюции. .»
Больше аудио
Ныряй глубже
Прочитай книгу
Трещина в творении отправляет читателя в научное путешествие, живо изучая неожиданное открытие, изменившее будущее человечества.
Исполнительный директор IGI Дженнифер Дудна написала эту научно-популярную книгу о своем личном и профессиональном опыте исследований CRISPR. В соавторстве с ее бывшим аспирантом Сэмом Штернбергом, Трещина в творчестве предлагает закулисный взгляд на развитие технологии редактирования генома CRISPR, ее применения и этические последствия.
В соавторстве с ее бывшим аспирантом Сэмом Штернбергом, Трещина в творчестве предлагает закулисный взгляд на развитие технологии редактирования генома CRISPR, ее применения и этические последствия.
Смотреть документальный фильм
История CRISPR полна неожиданных открытий, эклектичных персонажей и провокационных вопросов.
От исполнительного продюсера Дэна Рэзера и режиссера Адама Болта, Human Nature раскрывает науку, лежащую в основе CRISPR, вооружая и побуждая зрителей задуматься о потенциальных последствиях одной из самых революционных инноваций в истории.
Посетите веб-сайт фильма, чтобы получить информацию о том, как смотреть фильм, и дополнительные образовательные ресурсы.
Что такое CRISPR-Cas9 и как он используется в исследованиях рака?
Нобелевская премия по химии 2020 года присуждена стипендиатам Академии AACR
Эммануэль Шарпантье, доктор философии, и Дженнифер А. Дудна, доктор философии, за новаторскую разработку системы редактирования генома CRISPR-Cas9.
Эта технология позволяет исследователям точно удалять, добавлять или изменять определенные области генома и доказала свою ценность в различных областях исследований, включая исследования рака.
Что такое система CRISPR-Cas9?
CRISPR-Cas – это широко распространенная природная система разрезания ДНК у бактерий и других микроорганизмов, которая была первоначально идентифицирована в 1980-е годы. Совсем недавно, в начале 2000-х годов, было обнаружено, что система CRISPR-Cas в этих организмах служит защитным механизмом от вирусов. В бактериях вторгающаяся вирусная ДНК фрагментируется на короткие сегменты и включается в геном хозяина, организованный в массивы, известные как «кластеризованные палиндромные повторы с регулярными интервалами» или «CRISPR». Если тот же вирус заразит бактерии в будущем, молекулы РНК, полученные из массива CRISPR, будут направлять расщепляющий ДНК белок под названием Cas (что означает «связанный с CRISPR») к соответствующей вирусной ДНК. Здесь Cas будет функционировать как своего рода «генетические ножницы», разрезая вирусную ДНК на множество частей, тем самым приводя к ее разрушению.
В знаменательной статье, опубликованной в Science в 2012 году, Дудна и Шарпантье продемонстрировали, что этот естественный процесс может быть преобразован в инструмент редактирования генома. Подобно процессу у бактерий, опосредованное CRISPR-Cas9 редактирование генома зависит от последовательности РНК, называемой «направляющей РНК», которая направляет белок Cas9 в правильный участок ДНК. Как только белок Cas9 направляется в правильный геномный сайт, он переваривает ДНК, тем самым удаляя целевой ген.
У бактерий направляющая РНК образуется естественным путем в ответ на вирусную инфекцию, но в случае редактирования генома направляющая РНК тщательно разрабатывается исследователем для нацеливания на конкретную область генома. В некоторых исследованиях исследователи разрабатывают свои CRISPR-Cas9просто удалить ген, в то время как в других они вставляют другой ген на место того, который был удален. Модификации, которые инактивируют активность Cas9 по расщеплению ДНК, также иногда используются, чтобы позволить белку Cas9 связываться с ДНК, но не переваривать ее. Это связывание может инактивировать целевой ген, не удаляя его.
Это связывание может инактивировать целевой ген, не удаляя его.
Обзор системы редактирования генома CRISPR-Cas9. Изображение предоставлено Национальным институтом рака
По сравнению с другими инструментами редактирования генома CRISPR-Cas9 дешевле, быстрее и точнее. В отличие от предыдущих методов, таких как нуклеазы цинковых пальцев и TALEN, CRISPR-Cas9метод требует лишь короткого участка РНК для нацеливания на геномный сайт, что упрощает его разработку и использование. Кроме того, повышенная точность CRISPR-Cas9 по сравнению с этими другими методами снижает вероятность побочных эффектов, что делает его более безопасным для потенциальных клинических применений.
Как CRISPR-Cas9 используется в исследованиях рака?
С момента своего создания технология редактирования генома CRISPR-Cas9 использовалась во множестве фундаментальных исследований рака. Путем удаления, инактивации или иного изменения специфических генов в культивируемых клетках или на животных моделях исследователи смогли изучить роль этих генов в развитии и прогрессировании рака, что дало представление о том, как предотвратить или лечить определенные виды рака.
В некоторых случаях CRISPR-Cas9 использовался для изучения роли конкретного интересующего гена, например, в исследовании, опубликованном в прошлом месяце в журнале AACR Cancer Research. В этом исследовании исследователи использовали этот метод, чтобы понять, как инактивация гена BRG1, который обычно мутирует при немелкоклеточном раке легкого, способствует прогрессированию рака. Они использовали редактирование CRISPR-Cas9 для удаления BRG1 в клеточных линиях рака легкого и обнаружили, что клетки с дефицитом BRG1 имеют повышенный стресс репликации и чувствительны к фармакологическому ингибированию белка контрольной точки ATR, раскрывая механизм прогрессирования рака и потенциальную терапевтическую возможность для лечение рака легких.
Дополнительным приложением CRISPR-Cas9 является генетический скрининг, при котором сотни генов удаляются по отдельности для идентификации ключевых регуляторных белков, потенциальных мишеней для лекарств и/или для относительно быстрого тестирования реакции на экспериментальные препараты .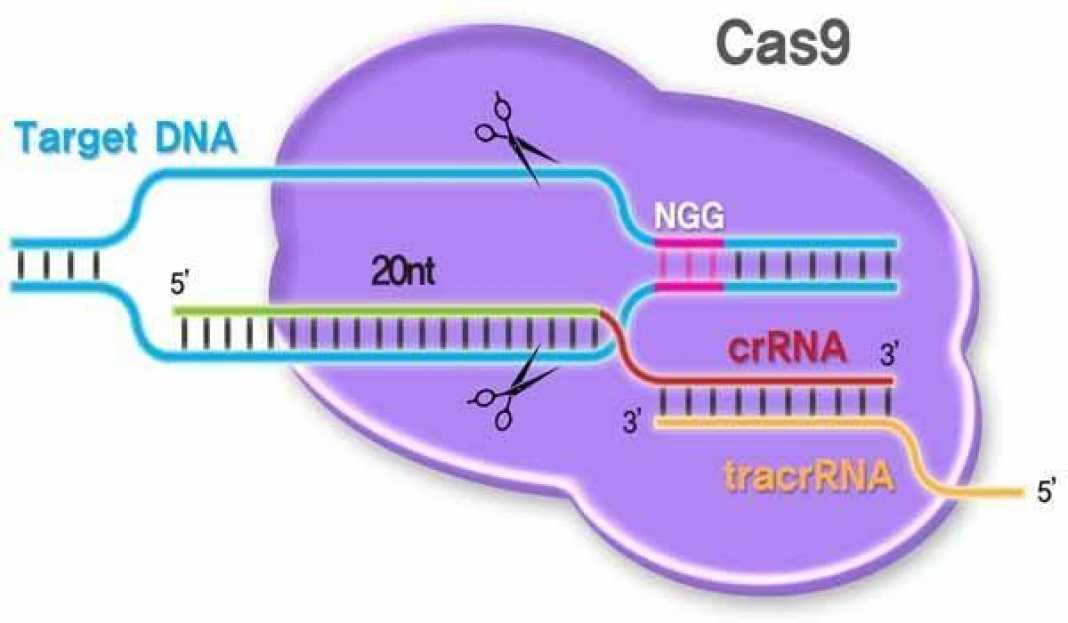 Примером такого подхода стало другое исследование, опубликованное в прошлом месяце в Cancer Research , , в котором использовался генетический скрининг CRISPR-Cas9 для выявления потенциальных терапевтических мишеней при раке легких. Удалив по отдельности более 500 различных генов, которые взаимодействуют с хроматином или модифицируют его, исследователи определили, что удаление гистонового шапероненуклеофосмина 1 значительно снижает прогрессирование опухоли in vitro и in vivo, тем самым определяя потенциальную мишень для лекарств.
Примером такого подхода стало другое исследование, опубликованное в прошлом месяце в Cancer Research , , в котором использовался генетический скрининг CRISPR-Cas9 для выявления потенциальных терапевтических мишеней при раке легких. Удалив по отдельности более 500 различных генов, которые взаимодействуют с хроматином или модифицируют его, исследователи определили, что удаление гистонового шапероненуклеофосмина 1 значительно снижает прогрессирование опухоли in vitro и in vivo, тем самым определяя потенциальную мишень для лекарств.
Можно ли использовать CRISPR-Cas9 для лечения рака?
Помимо широкого использования в основных исследованиях рака, система CRISPR-Cas9 также изучается как способ улучшить лечение рака. В основном докладе, сделанном на Виртуальной специальной конференции AACR: Гетерогенность опухолей, иммунолог, онколог и научный сотрудник Академии AACR Карл Джун, доктор медицины, описал потенциальную полезность CRISPR-Cas9 в адоптивной клеточной терапии, форме терапии рака, которая использует собственные иммунные клетки пациента, чтобы уничтожить раковые клетки.
При адоптивной клеточной терапии Т-клетки (тип иммунных клеток, обнаруживаемых в крови) извлекаются из организма пациента, конструируются для экспрессии Т-клеточного рецептора, который распознает рак пациента, размножается и повторно вводится пациенту. Адаптивная клеточная терапия успешно применяется для лечения многих видов рака крови как у взрослых, так и у детей; тем не менее, остается несколько проблем для широкого использования этой терапии, включая активацию иммунных контрольных точек, опосредованную раком.
Иммунные контрольные точки представляют собой нормальный регуляторный процесс, который предотвращает чрезмерную активацию иммунного ответа и последующее повреждение нормальной ткани. Иммунные контрольные точки активируются путем связывания определенных рецепторов (PD-1 или CTLA-4) на поверхности Т-клеток с их лигандами (PD-L1 или B7 соответственно) на клетках-мишенях.
Некоторые раковые клетки экспрессируют высокие уровни лигандов PD-L1 или B7 даже при отсутствии иммунной активации, что позволяет раковым клеткам активировать иммунные контрольные точки, отключать Т-клеточный ответ и обходить иммунную систему. Это создает проблему для адоптивной клеточной терапии: хотя сконструированные Т-клетки могут распознавать рак пациента, они инактивируются до того, как смогут вызвать противоопухолевый иммунный ответ.
Это создает проблему для адоптивной клеточной терапии: хотя сконструированные Т-клетки могут распознавать рак пациента, они инактивируются до того, как смогут вызвать противоопухолевый иммунный ответ.
Изображение предоставлено Национальным институтом рака.
Одним из подходов к решению этой проблемы является использование CRISPR-Cas9 для удаления гена, экспрессирующего рецептор PD-1, в Т-клетках пациента. Исследователи предполагают, что отсутствие контрольной точки иммунитета позволит Т-клеткам оставаться активными. Различные исследования показали, что эта стратегия улучшает ответы на доклинических моделях, но осуществимость этого подхода у пациентов остается неясной.
В своей презентации Джун обсудил результаты первого испытания CRISPR-Cas9 на людях.-модифицированная Т-клеточная терапия, которые были опубликованы ранее в этом году. В этом исследовании Джун и его коллеги использовали CRISPR-Cas9 для удаления из Т-клеток гена, экспрессирующего PD-1, а также генов, экспрессирующих эндогенные рецепторы Т-клеток, чтобы предотвратить конкуренцию со сконструированным рецептором Т-клеток. CRISPR-Cas9-модифицированные Т-клетки вводили трем пациентам с распространенным раком, в том числе двум пациентам с рефрактерной распространенной меланомой и одному пациенту с рефрактерной метастатической саркомой. Стабильные уровни Т-клеток были обнаружены в крови всех трех пациентов через несколько месяцев после инфузии.
CRISPR-Cas9-модифицированные Т-клетки вводили трем пациентам с распространенным раком, в том числе двум пациентам с рефрактерной распространенной меланомой и одному пациенту с рефрактерной метастатической саркомой. Стабильные уровни Т-клеток были обнаружены в крови всех трех пациентов через несколько месяцев после инфузии.
Ни у одного из пациентов не было серьезных побочных эффектов от лечения, и не было никаких признаков аутоиммунитета или синдрома высвобождения цитокинов, потенциально летального побочного эффекта, который может быть связан с адоптивной клеточной терапией. Сконструированные клетки смогли распознать и уничтожить раковые клетки у всех трех пациентов, а лечение привело к стабилизации заболевания у двух пациентов. У третьего пациента был смешанный ответ, который включал 50-процентное уменьшение одной из их опухолей, но прогрессирование других опухолей.
Анализ экспрессии генов влитых клеток у одного пациента показал, что сконструированные Т-клетки имели повышенную экспрессию генов, связанных с памятью Т-клеток, но не истощение Т-клеток, что позволяет предположить, что делеция PD-1 могла предотвратить активацию иммунные контрольно-пропускные пункты.
