Содержание
как технология редактирования генома изменила мир
08 июля 2022
10:11
Ольга Мурая
Технология CRISPR позволяет изменять фрагменты ДНК с невиданной ранее скоростью и эффективностью.
Фото Sangharsh Lohakare/Unsplash.
Редкое открытие может наделать столько шума и оказать столь глубокое влияние на науку всего за одно десятилетие.
Когда десять лет назад, 28 июня 2012 года, в журнале Science вышла статья с громоздким названием «Программируемая двойная РНК-управляемая ДНК-эндонуклеаза в адаптивном бактериальном иммунитете», СМИ не обратили на это особенного внимания.
Оглядываясь назад, соавтор той знаковой работы доктор Дженнифер Дудна, сегодня известная на весь мир, отмечает, что выбрала бы другое название, если писала бы эту работу сегодня.
Находка исследователей указывала на новый метод редактирования ДНК, который может сделать возможным даже изменение человеческих генов. Речь идёт о технологии CRISPR, которую разработали учёные, вдохновившись природными механизмами изменения ДНК.
Всего за десятилетие метод CRISPR стал одним из самых знаменитых изобретений современной биологии. Он полностью меняет то, как исследователи-медики изучают болезни сегодня.
Врачи используют CRISPR для редактирования генов, вызывающих наследственные заболевания, а также для лечения таких серьёзных болезней, как ВИЧ и боковой амиотрофический склероз.
Учёные могут не только убирать, но и добавлять мутации с помощью CRISPR: к примеру, чтобы снизить уровень холестерина в организме.
Но влияние CRISPR распространяется далеко за пределы медицины. Биологи-эволюционисты используют эту технологию для изучения мозга неандертальцев и, к примеру, того, как наши предки-обезьяны потеряли свои хвосты.
Биологи уже редактируют гены растений, чтобы получить урожай с новыми витаминами или со способностью противостоять болезням. Некоторые из них в ближайшие годы даже смогут попасть на полки супермаркетов.
Некоторые из них в ближайшие годы даже смогут попасть на полки супермаркетов.
При этом первоначальная система CRISPR, известная как CRISPR-Cas9, оставляет много возможностей для улучшения. Эти молекулы хорошо «вырезают» кусочки ДНК, но не так хорошо вставляют на их место новые фрагменты. Иногда CRISPR-Cas9 не попадает в цель, разрезая ДНК не в том месте. И даже когда молекулы выполняют свою работу правильно, клетки могут ошибаться, восстанавливая свободные концы ДНК.
Ряд учёных, включая наших соотечественников, разрабатывает новые версии CRISPR, которые не имеют некоторых из этих недостатков.
CRISPR оказал такое быстрое и глубокое влияние, что доктор Дудна и её соавтор Эммануэль Шарпантье получили Нобелевскую премию по химии 2020 года. Нобелевская ассамблея назвала их исследование 2012 года «эпохальным экспериментом».
Создатели метода прекрасно понимали, что со временем CRISPR поставит ряд сложных этических вопросов. И через 10 лет после его разработки эти вопросы стали даже более актуальными, чем когда-либо.
Сможет ли грядущая волна изменённых CRISPR-культур накормить мир и помочь бедным фермерам? Или же она только обогатит гигантов агробизнеса, которые инвестируют в новую технологию? Улучшит ли медицина на основе метода CRISPR здоровье людей во всём мире или будет стоить миллионы долларов и станет доступна лишь богачам?
Самый глубокий этический вопрос, связанный с CRISPR, заключается в том, как будущие поколения будут использовать эту технологию. И не захотят ли они, к примеру, изменять с её помощью человеческие эмбрионы.
Эта проблема была просто мысленным экспериментом до 2018 года, когда Хе Цзянькуй, биофизик из Китая, отредактировал ген в человеческих эмбрионах, чтобы придать им устойчивость к ВИЧ. Три модифицированных эмбриона были имплантированы женщинам в китайском городе Шэньчжэнь.
В 2019 году суд приговорил доктора Хэ к тюремному заключению за «незаконную медицинскую практику». В апреле 2022 года стало известно, что он был освобождён.
При этом мало что известно о здоровье троих детей, которым сейчас не меньше двух лет.
В течение следующих четырёх лет после нашумевшего эксперимента доктора Хе учёные продолжали использовать CRISPR на человеческих эмбрионах. Но они изучали эмбрионы только тогда, когда они представляли собой крошечные скопления клеток, чтобы собрать новые данные о самых ранних стадиях их развития. После эмбрионы уничтожались.
Эти исследования потенциально могут привести к новым методам лечения бесплодия. К слову, год назад Международное общество исследования стволовых клеток разрешило учёным при определённых условиях проводить исследования эмбрионов дольше двух недель после оплодотворения яйцеклетки сперматозоидом.
Станет ли в будущем приемлемым и даже обычным делом удалять нежелательные гены у жизнеспособных эмбрионов? К примеру, в 2019 году российский учёный заявил о готовности исправить «мутацию глухоты» у будущих детей, и даже нашёл пять супружеских пар, готовых поучаствовать в эксперименте.
А что, если родители захотят добавить будущему ребёнку черты, которые им больше нравятся, например, выбрать их рост, цвет глаз или интеллектуальные способности?
Франсуаза Бейлис, биоэтик из Университета Дэлхаузи в Канаде, считает, что люди ещё не готовы решать такие вопросы.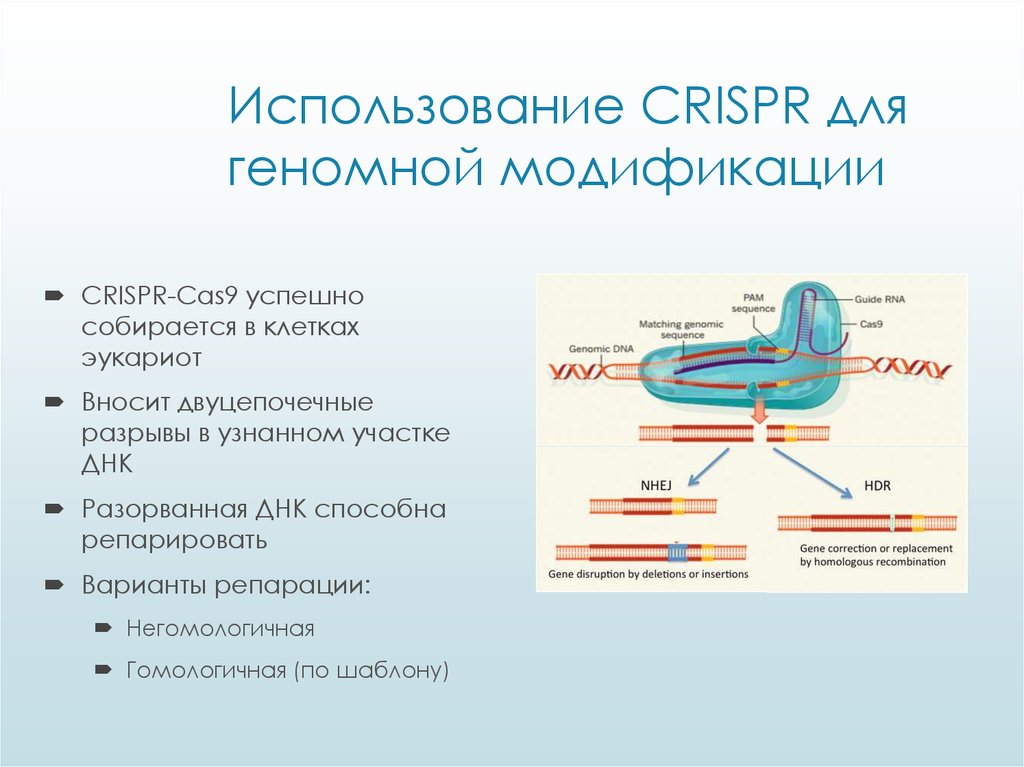 Она сомневается в том, что общество действительно понимает все риски, которые влечёт за собой создание ГМ-модифицированных людей.
Она сомневается в том, что общество действительно понимает все риски, которые влечёт за собой создание ГМ-модифицированных людей.
И дело не только в том, что последствия редактирования генов до сих пор остаются непредсказуемыми.
Например, недавнее исследование показало, что выключение «гена агрессии» у хомяков привело к учащению агрессивного поведения как у самцов, так и у самок, которым оно обычно несвойственно.
Как подобные генетические модификации повлияют на сложнейший внутренний мир человека, остаётся лишь догадываться.
При этом существует серьёзная разница между тем, чтобы делать людей совершеннее, и тем, чтобы создавать совершенных людей, добавляет доктор Бейлис.
Второй вариант может усугубить неравенство и расколоть мир на части гораздо сильнее, чем любые войны и эпидемии сегодняшнего дня.
Но пока этот рубеж остаётся нетронутым, мы можем по достоинству оценить другие научные достижения, совершённые с помощью технологии CRISPR.
Так, на основе системы CRISPR-Cas в России была создана новая технология распознавания коронавируса SARS-CoV-2.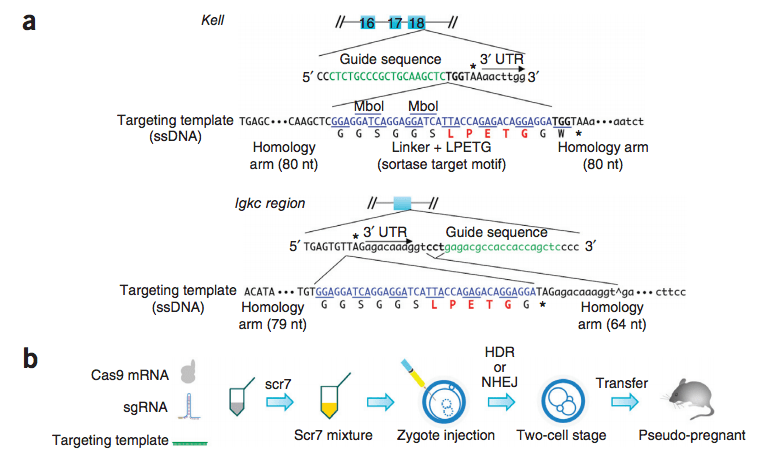 А в США человеку не так давно впервые пересадили ГМ-сердце свиньи. Правда, пациент прожил после успешной пересадки всего несколько месяцев.
А в США человеку не так давно впервые пересадили ГМ-сердце свиньи. Правда, пациент прожил после успешной пересадки всего несколько месяцев.
Также метод CRISPR позволяет создавать устойчивые к туберкулёзу поголовья скота и гипоаллергенные цветы, а ещё уничтожать малярийных комаров.
Пока что большинство учёных мира относятся к открывшимся возможностям с большой ответственностью.
Больше интересных новостей из мира науки вы найдёте в разделе «Наука» на медиаплатформе «Смотрим».
наука
медицина
генетика
ДНК
CRISPR
редактирование ДНК
общество
новости
Потеря хромосомы при редактировании генома Т-клетки и другие новости недели — PCR News
Мышечная дистрофия
1. Ученые из США
выяснили, как миотоническая дистрофия I типа (МД 1) связана на молекулярном уровне с когнитивными нарушениями. Миотоническая дистрофия первого типа — это аутосомно-доминантное наследственное заболевание, вызванное увеличением числа повторов CTG в 3′-нетранслируемой области гена миотонической протеинкиназы дистрофии (DMPK).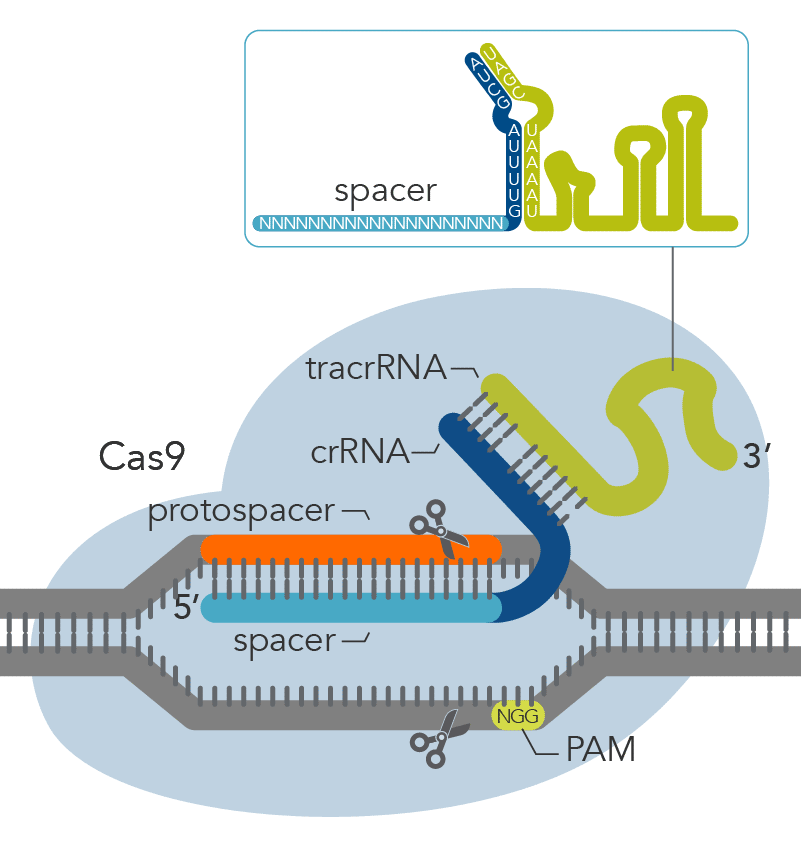 В отличие от других типов мышечной дистрофии, у пациентов с МД1 часто проявляются прогрессирующие симптомы когнитивных нарушений, а также трудности в обучении и социализации, напоминающие расстройства аутистического спектра. Молекулярный механизм, ответственный за эти нарушения при МД 1, ранее был неизвестен. В экспериментах на органоидах коры мозга, полученных из индуцированных плюрипотентных стволовых клеток, ученые показали, что на ранней стадии созревания органоидов наблюдается гиперфосфорилирование белка CELF2. Снижение взаимодействия этого белка с его РНК-субстратом приводит к неправильной регуляции генов, важных для синаптической передачи сигналов в глутаматергических нейронах. В частности, происходит
В отличие от других типов мышечной дистрофии, у пациентов с МД1 часто проявляются прогрессирующие симптомы когнитивных нарушений, а также трудности в обучении и социализации, напоминающие расстройства аутистического спектра. Молекулярный механизм, ответственный за эти нарушения при МД 1, ранее был неизвестен. В экспериментах на органоидах коры мозга, полученных из индуцированных плюрипотентных стволовых клеток, ученые показали, что на ранней стадии созревания органоидов наблюдается гиперфосфорилирование белка CELF2. Снижение взаимодействия этого белка с его РНК-субстратом приводит к неправильной регуляции генов, важных для синаптической передачи сигналов в глутаматергических нейронах. В частности, происходит
дерегуляция работы MECP2, белка, связывающего метилированную ДНК; как известно, подобные нарушения ведут к когнитивным дефектам. Авторы статьи обнаружили, что антагонисты NMDA-рецепторов позволяют облегчить проявления заболевания в модели органоидов, а значит, в перспективе могут предотвратить когнитивные нарушения у молодых пациентов с миодистрофией и существенно улучшить качество их жизни.
2. В Университете Британской Колумбии (Канада)
обнаружили, что лекарство от рака может лечить мышечную дистрофию Дюшенна. Препарат, известный как ингибитор рецептора колониестимулирующего фактора 1 (CSF1R), замедлил прогрессирование мышечной дистрофии Дюшенна у мышей за счет повышения эластичности мышечных волокон. Можно сказать, что открытие было сделано случайно, ведь исследователи изначально планировали изучить роль резидентных макрофагов в регенерации мышц. Во время экспериментов на мышах они обнаружили, что ингибиторы CSF1R, которые вызывают истощение пула резидентных макрофаги, делают мышечные волокна более устойчивыми к повреждениям. Препарат изменяет тип мышечных волокон — с чувствительного к повреждениям типа IIB на устойчивый к повреждениям тип IIA/IIX. Мыши, получавшие ингибиторы CSF1R, оказались более устойчивыми к повреждениям мышечных волокон, лучше выполняли физические упражнения с меньшим вредом для мышц. Ученые планируют проверить, будет ли препарат так же эффективен у людей с диагнозом «миодистрофия Дюшенна».
Иммунология
3. После избавления от инфекции небольшой пул Т-клеток памяти циркулируют по всему телу, а другие накапливаются в нишах органов, чтобы охранять границы организма от патогенов. Авторы статьи в Nature Immunology
описали резидентные Т-клетки памяти, находящиеся не в крови, а в тканях почки, селезенки, тонкого кишечника и печени мыши. Данные, полученные из различных типов тканей, позволили понять, какими уникальными процессами управляются популяции Т-клеток в различных органах. Авторы выполнили RNA-seq единичных клеток и проанализировали экспрессию генов и доступность генома мышиных CD8+ T-клеток памяти из органов, реагирующих на вирусную инфекцию, причем выявили как общие, так и тканеспецифические транскрипционные и эпигенетические сигнатуры. T-клетки памяти в кишечнике и слюнных железах экспрессировали гены, индуцированные трансформирующим фактором роста (TGF)-β. Моделирование регуляторных сетей показало, что репрессор транскрипции Hic1 является критическим регулятором дифференцировки Т-клеток памяти в тонком кишечнике. Информация о том, как клетки памяти адаптируются к различным тканевым средам, дает возможность разработать способы усиления защитных реакций в местах, наиболее уязвимых для инфекции.
Информация о том, как клетки памяти адаптируются к различным тканевым средам, дает возможность разработать способы усиления защитных реакций в местах, наиболее уязвимых для инфекции.
Онкология
4. В Nature опубликовано
исследование, авторы которого показали, что модификации митохондриальной РНК вызывают метастазирование раковой опухоли. Так, развитию метастазов рака головы и шеи способствует модификация m5C (5-метилцитозин) в митохондриальной тРНК, несущей метионин. Эта модификация активирует синтез белка в митохондриях, что усиливает выработку компонентов дыхательной цепи. В результате клетка увеличивает продукцию энергии, необходимой ей для выхода из опухоли и метастазирования. За модификацию m5C РНК отвечает специфический фермент — метилтрансфераза NSUN3. При его отключении уменьшилось метастатическое инвазивное распространение клеток человеческого рака шеи, подсаженного мыши. Тем не менее отсутствие модификации m5C не повлияло на жизнеспособность и рост клеток опухоли. Также оказалось, что митохондриальная генная сигнатура у пациентов с раком головы и шеи позволяет прогнозировать вероятность метастазирования. Наконец, исследователи подтвердили, что ингибирование NSUN3 in vivo препятствует распространению метастазов на доклинической модели. В перспективе данные будут проверены на пациентах с раком головы и шеи.
Также оказалось, что митохондриальная генная сигнатура у пациентов с раком головы и шеи позволяет прогнозировать вероятность метастазирования. Наконец, исследователи подтвердили, что ингибирование NSUN3 in vivo препятствует распространению метастазов на доклинической модели. В перспективе данные будут проверены на пациентах с раком головы и шеи.
Эволюция
5. Ученые из Музея естественной истории Университета Колорадо в Боулдере
секвенировали гены 16S рибосомной РНК микробиома из образца улитки, 98 лет хранившегося в музее, чтобы определить видовой состав микробиома и сравнить его с микробиомом современных улиток. Выяснилось, что за это время кишечный микробиом улитки Oreohelix strigosa существенно не изменился. Но открытие ученых состоит в другом, ведь они показали, что так можно изучать микробиом животных, образцы которых музеи хранят в этаноле, таких как пауки, лягушки и змеи. А значит, миллионы экспонатов из музеев всего мира могут быть использованы для метагеномных исследований.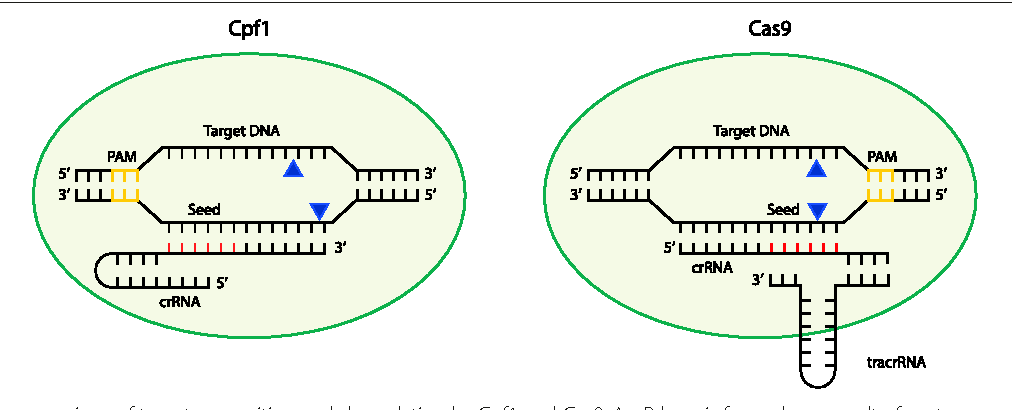 (Об исследовании собственной ДНК законсервированных экспонатов PCR.NEWS писал
(Об исследовании собственной ДНК законсервированных экспонатов PCR.NEWS писал
на этой неделе.)
6. Жуки семейства усачей (Cerambycidae) распространены по всему миру и известны своей способностью питаться древесиной. Почему
ферменты группы GH5_2, позволяющие расщеплять целлюлозу, лигнин и другие компоненты древесин, до сих пор были обнаружены только у жуков-усачей,
узнали исследователи из Института химической экологии Макса Планка и Канадской службы леса. Первоначально Cerambycidae приобрели GH5_2 от бактериального донора с помощью горизонтального переноса генов, и эволюция этих ферментов в организме жуков улучшала их способность питаться древесиной. Ученые проанализировали 113 вариантов GH5_2, из 25 видов, охватывающих большинство подсемейств Cerambycidae. Дупликации предковых генов привели к появлению пяти четко определенных групп с явной специфичностью к субстрату, что позволило жукам расщеплять не только целлюлозу, но еще и ксилоглюкан, ксилан и маннаны. Воссоздание предковой формы фермента показало, что он был
Воссоздание предковой формы фермента показало, что он был
целлюлазой, способной расщеплять глюкоманнан и ксилан. Авторы предполагают, что успешной радиации жуков-усачей способствовали оба этих процесса — приобретение гена целлюлазы от бактерии и его дупликация и специализация в ходе эволюции.
Нанотехнологии
7. Одна из фундаментальных целей нанотехнологии — программируемый синтез рационально сконструированных кристаллических структур с точным расположением молекул. В частности, центральное ядро для сборки трехмерных решеток можно собирать из разветвленных соединений ДНК. Среди них наиболее известны соединения Холлидея, которые в природе образуются при
гомологичной рекомбинации хромосом. Ученые из США и Чехии методом
кристаллографии
проанализировали влияние на образование кристаллической структуры всех 36 возможных соединения Холлидея из ДНК с разными последовательностями нуклеотидов. Кристаллы удалось вырастить из всех вариантов, кроме шести. Некоторые сочетания нуклеотидов увеличивали разрешение или приводили к уникальной симметрии кристаллов. Моделирование молекулярной динамики несобравшихся кристаллов из шести «фатальных» соединений Холлидея показало, что в них отсутствуют два сайта связывания ионов, ключевых для кристаллизации. Подобные необычные соединения ДНК могут быть использованы в молекулярной инженерии, наноэлектронике и нанофотонике.
Некоторые сочетания нуклеотидов увеличивали разрешение или приводили к уникальной симметрии кристаллов. Моделирование молекулярной динамики несобравшихся кристаллов из шести «фатальных» соединений Холлидея показало, что в них отсутствуют два сайта связывания ионов, ключевых для кристаллизации. Подобные необычные соединения ДНК могут быть использованы в молекулярной инженерии, наноэлектронике и нанофотонике.
Редактирование генома
8. Для Т-клеточной терапии врачи и ученые часто используют сайт-специфические нуклеазы, такие как CRISPR-Cas9, чтобы разрушить ген Т-клеточного рецептора (TCR) или другие гены. Ученые из Израиля провели секвенирование РНК единичных Т-клеток человека после редактирования генома и
выяснили, что при этом часто теряются целые хромосомы или их участки. Клетки были трансфицированы генами CRISPR-Cas9 и гидовых РНК, нацеленных на гены TCR и PD1. Через четыре дня после трансфекции в 9% клеток была обнаружена потеря хромосомы 14, несущей локус TCRα. В 9,9% клеток была укорочена хромосома 7, несущая локус TCRβ. Наблюдаемые аберрации подтвердили с помощью флуоресцентной гибридизации in situ
В 9,9% клеток была укорочена хромосома 7, несущая локус TCRβ. Наблюдаемые аберрации подтвердили с помощью флуоресцентной гибридизации in situ
и ПЦР. Анеуплоидия была связана с индуцированной активацией p53 и гибелью клеток, поэтому ученые предположили, что со временем такие клетки должны будут элиминироваться из пула. Однако даже через 11 дней после трансфекции в 0,9% Т-клеток все еще отсутствовала хромосома 14. Таким образом, при клиническом применении CRISPR-Cas9. необходимо отслеживать события анеуплоидии и укорочения хромосом.
Фармакология, ВИЧ и синдром Дауна
9. Согласно результатам исследования, проведенного Центром геномной регуляции (CRG) в Барселоне, ламивудин, антиретровирусный препарат для лечения ВИЧ,
улучшает когнитивные функции у мышей с синдромом Дауна. Механизм этого феномена заключается в подавлении активности ретротранспозонов — фрагментов ДНК, которые меняют свое положение в геноме, создавая РНК-копии самих себя, внедряющиеся в ДНК в другом месте. При этом они могут случайно встроиться в участки, стимулирующие гены, которые связаны с нейродегенеративными заболеваниями, и усилить их активность. Ретротранспозоны имеют некое сходство с ВИЧ по механизму распространения, кроме того, частота ретротранспозиций увеличивается с возрастом и по мере клеточного старения.
При этом они могут случайно встроиться в участки, стимулирующие гены, которые связаны с нейродегенеративными заболеваниями, и усилить их активность. Ретротранспозоны имеют некое сходство с ВИЧ по механизму распространения, кроме того, частота ретротранспозиций увеличивается с возрастом и по мере клеточного старения.
Известно, что у людей с синдромом Дауна повышен риск нейродегенеративных нарушений, так как локус гена APP (белка-предшественника амилоида, вовлеченного во многие подобные заболевания) находится в 21 хромосоме. Авторы исследования предположили, что ингибиторы репликации ВИЧ может также блокировать ретротранспозоны и, как следствие, замедлить процесс нейродегенерации. Эксперименты проводили на мышах линии Ts65Dn, это наиболее изученная на сегодняшний день животная модель синдрома Дауна. В течение четырех месяцев мышей поили водой с добавлением ламивудина, в то время как контрольная группа получала обычную воду. Поведенческие эксперименты, предназначенные для проверки двигательной активности, памяти и уровня стресса, показали, что ламивудин может снизить пагубное влияние синдрома Дауна на когнитивные способности.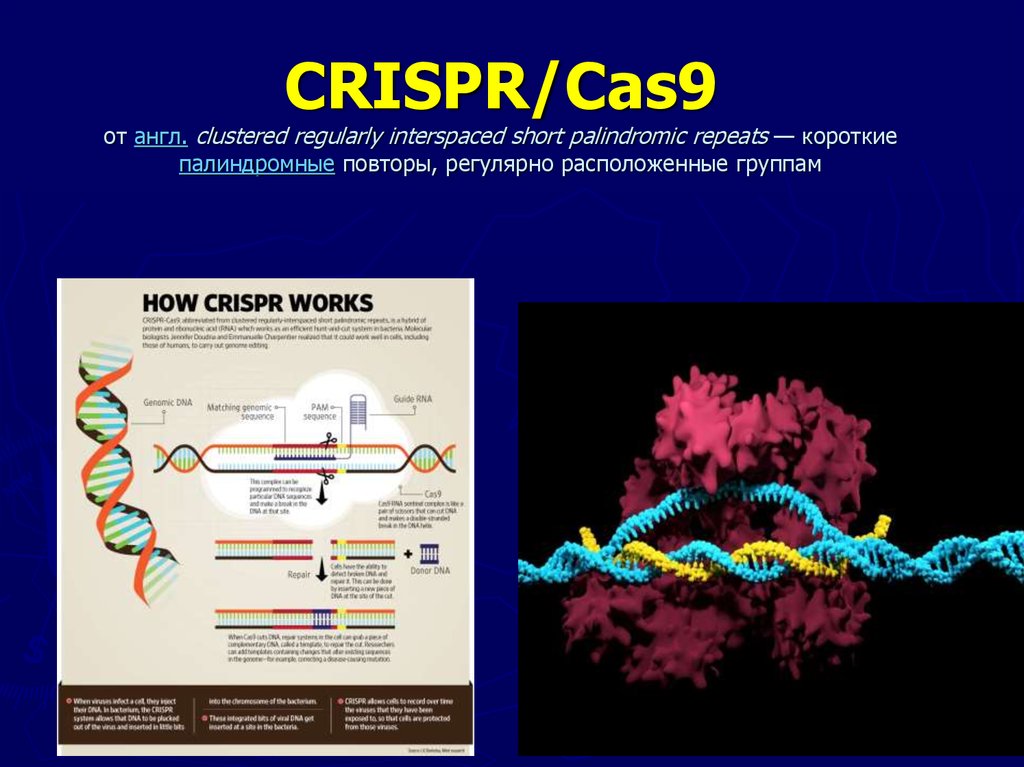 Исследователи надеются, что эффект также будет проверен на людях.
Исследователи надеются, что эффект также будет проверен на людях.
Метаморфоз
10. Смотреть под водой — совсем не то же самое, что смотреть над водой. Многим организмам приходится приспосабливаться и к той, и к другой среде, а некоторые даже меняют специализацию в ходе жизненного цикла. Группа исследователей из США и Великобритании при помощи секвенирования РНК
изучила изменения экспрессии генов в глазах у головастиков леопардовой лягушки и у молодых лягушек, а также проверила методом микроспектрометрии, к красной или синей части светового спектра приспособлены фоторецепторные клетки в глазах амфибии на разных этапах жизни. Удивительно, но 42% генов, задействованных в зрительном восприятии, по-разному экспрессировались в глазах головастиков по сравнению с молодыми взрослыми особями. Микроспектрофотометрия фоторецепторов подтвердила сдвиг в спектральной чувствительности, предсказанный по
экспрессии генов. Максимум поглощения фоторецепторов у головастика смещен в красную область по сравнению со взрослой амфибией, что логично: пресная вода содержит растворенные органические вещества и твердые частицы, которые поглощают более коротковолноый свет (фиолетовый и синий). Ученые предполагают, что специализированная экспрессия генов возникла под влиянием противоположно направленного давления
Ученые предполагают, что специализированная экспрессия генов возникла под влиянием противоположно направленного давления
отбора на разных стадиях жизненного цикла.
Молекулярная диагностика
11. Быстрые диагностические тесты на малярию, основанные на обнаружении генов HRP2 и HRP3 плазмодиев в каплях крови человека, очень ценны для борьбы с этим заболеванием. Такой тест стоит менее 1 доллара США и проводится примерно за 15 минут практически в любых условиях. Но в районах, где у малярийных плазмодиев наблюдается делеция HRP2 или HRP3, тесты могут давать ложноотрицательные результаты. Коллектив ученых, работавший в различных точках планеты,
объявил об успешной разработке нового метода обнаружения генов HRP2 и HRP3. Метод основан на капельной цифровой полимеразной цепной реакции (кцПЦР, ddPCR). Образцы крови разделяют примерно на 15 000 микрокапель и проводят ПЦР одновременно для каждой из них. На одной пластине можно параллельно анализировать 96 образцов. По сравнению с более традиционными методами кцПЦР более чувствительна.
По сравнению с более традиционными методами кцПЦР более чувствительна.
Сначала ученые сравнили эффективность метода ddPCR с обычным методом вложенной ПЦР (nPCR), протестировав 248 образцов крови от людей с бессимптомной формой инфекции в Кении. Результаты вложенной ПЦР ошибочно определили, что у 8% плазмодиев отсутствуют гены HRP2 или HRP3, а метод ddPCR показал, что ни в одном из образцов не было этих делеций. Затем они использовали ddPCR на образцах крови 830 пациентов из Бразилии, Эквадора, Эфиопии, Кении и Занзибара. В Кении и Занзибаре ddPCR не обнаружил делеций генов HRP2 или HRP3. В Эфиопии около 2% образцов имели делецию HRP2 и почти 75% — делецию HRP3. В Бразилии в 62% образцов отсутствовал ген HRP3, а в 46% отсутствовали и HRP2, и HRP3. В Эквадоре ни у одного образца не было делеций HRP2, но около 54% имели делеции HRP3. Таким образом, новый
тест позволяет оценить распространенность делеций исследуемых генов в различных точках земного шара и оценить, насколько применимы в той или иной области
быстрые диагностические тесты на HRP2 и HRP3.
12. Команда из Японии разработала
улучшенный метод РНК-секвенирования. Метод основан на твердофазной амплификации и секвенировании кДНК с помощью терминатора (TAS-Seq) и требует простых реактивов. Для TAS-Seq нужен независимый от состава матрицы фермент, амплифицирующий кДНК, — терминальная трансфераза (TdT). Также для терминации амплификации кДНК используется дидезоксинуклеотидфосфат (ddNTP), что стохастическим образом останавливает чрезмерное удлинение полиN-хвоста TdT и значительно снижает технические трудности реакции. TAS-Seq можно выполнять на привычной платформе для scRNA-seq на основе нанолунок/шариков, которая позволяет изолировать отдельные клетки в образцах тканей.
Исследователи проверили эффективность TAS-Seq и сравнили ее с широко применяемыми методами РНК-секвенирования единичных клеток 10X Chromium V2 и Smart-seq2 на образцах легочной ткани мыши и человека. По их данным, TAS-Seq не только обнаруживает больше генов, но и лучше идентифицирует их вариабельность. Разработка TAS-Seq приведет к новым достижениям в области пространственной транскриптомики, которая также опирается на твердофазный синтез кДНК.
Разработка TAS-Seq приведет к новым достижениям в области пространственной транскриптомики, которая также опирается на твердофазный синтез кДНК.
Новости компаний
13. Британская компания по разработке лекарств MultiOmic Health и сингапурский стартап Mesh Bio
заявили о сотрудничестве для улучшения диагностики и лечения хронических метаболических заболеваний. В рамках партнерства Mesh Bio будет работать со своей клиентской сетью поставщиков медицинских услуг для привлечения пациентов, а MultiOmic — получать и обрабатывать геномные, протеомные и метаболомные данные из образцов. «Это партнерство дает нам доступ к населению Азии, где наблюдается рост распространенности состояний, связанных с метаболическим синдромом», — заявил Роберт Тонг, соучредитель и генеральный директор MultiOmic. В отличие от большинства исследований этих заболеваний, в которых участвовали пациенты европеоидной расы, новое партнерство позволит получить данные о специфических характеристиках метаболического синдрома у населения Азии.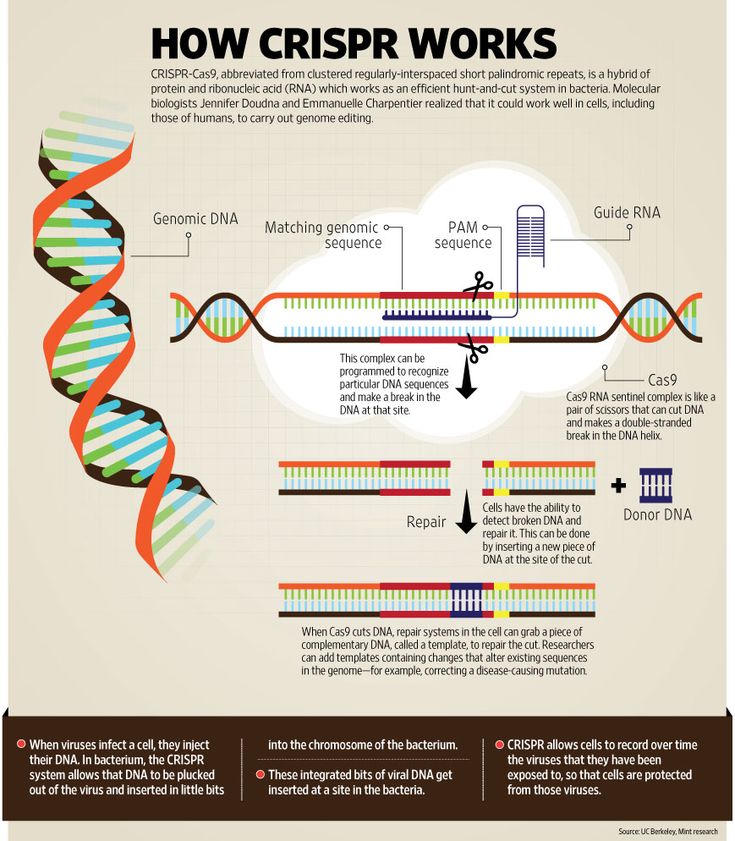
14. Стартап в области геномики Sequential Skin со штаб-квартирами в Великобритании и Сингапуре
получил грант Innovate UK SMART в размере 500 000 долларов США для изучения микробиома здоровой и больной кожи с использованием наборов компании. Компания Sequential Skin ранее выпустила на рынок набор для количественного тестирования микробиома кожи на основе ПЦР, востребованный в индустрии личной гигиены. Новый проект будет посвящен исследованиям атопического дерматита, хронического и рецидивирующего кожного заболевания. Sequential заявила, что будет работать вместе с дерматологами Национальной службы здравоохранения Великобритании, чтобы набирать в
исследования пациентов с атопическим дерматитом и тестировать их по мере прогрессирования заболевания в надежде разработать инструменты для диагностики. «Мы видим будущее, в котором пациенты с рецидивирующими и изнурительными кожными заболеваниями получают диагноз с высокой точностью, после чего может быть назначено эффективное и целенаправленное лечение», — заявил генеральный директор и соучредитель Sequential Оливер Уорсли.
Биолог рассказал о перспективах системы редактирования генома человека
Источник: ria.ru
© Fotolia/ peshkov
МОСКВА, 23 ноя — РИА Новости. Технология редактирования генов CRISPR/Cas9 несложна, при этом важно убедиться в ее безопасности для человека, но в перспективе она может демократизировать исследования в науках о жизни, рассказал РИА Новости доктор биологических наук, профессор Сколковского института науки и технологий (Сколтех) и американского университета Ратгерс Константин Северинов.
Ранее СМИ сообщили, что впервые удалось отредактировать геном человека при помощи технологии CRISPR/Cas9, позволяющей вырезать определенные участки ДНК, которые определяют предрасположенность организма к определенным заболеваниям. Группа китайских ученых ввела клетки с отредактированным при помощи CRISPR/Cas9 геномом в тело пациента, страдающего неизлечимым раком легких.
Как рассказал Северинов, технология CRISPR/Cas9 совсем новая, практическое применение ее для геномного редактирования началось в 2013 году. Саму систему CRISPR/Cas открыли около 10 назад: с помощью таких систем бактерии борются с вирусами – это система бактериального иммунитета, которую ученые научились использовать во благо человека. Сам механизм действия CRISPR иммунитета заключается в том, что вирус, заражая бактерию, может оставлять небольшой кусочек своей ДНК в клеточной ДНК, и такая клетка становится фактически вакцинированной: используя имеющийся вирусной участок, как матрицу, система “примеряет” к различным участкам ДНК, находящимся в клетке, и при нахождении соответствующих участков – уничтожает их. То есть клетка, имеющая участок-“воспоминание” о вирусе, становится устойчивой в дальнейшем к таким же вирусам.
Саму систему CRISPR/Cas открыли около 10 назад: с помощью таких систем бактерии борются с вирусами – это система бактериального иммунитета, которую ученые научились использовать во благо человека. Сам механизм действия CRISPR иммунитета заключается в том, что вирус, заражая бактерию, может оставлять небольшой кусочек своей ДНК в клеточной ДНК, и такая клетка становится фактически вакцинированной: используя имеющийся вирусной участок, как матрицу, система “примеряет” к различным участкам ДНК, находящимся в клетке, и при нахождении соответствующих участков – уничтожает их. То есть клетка, имеющая участок-“воспоминание” о вирусе, становится устойчивой в дальнейшем к таким же вирусам.
Эффективность и простота
“В принципе, эта технология эффективна, и применять ее несложно. Но есть только одна серьезная проблема: геном человека очень большой, гарантировать, что вы провели редактирование только в том месте, в котором нужно, а не сделали каких-то дополнительных изменений в других местах генома, очень сложно”, — сказал Северинов.
Для наглядности он предложил представить, в скольких книгах разместится человеческий геном, состоящий из трех миллиардов “букв” ДНК.
“Представьте, что перед вами стоит задача найти одну-единственную опечатку-“мутацию” в этом книжном массиве, чтобы гарантированно исправить только ее, а не что-то другое. Это очень сложно. Поэтому нельзя гарантировать, что при редактировании целевых участков не происходит возникновение мутаций в других местах генома”, — пояснил он.
Молекулярные “ножницы”
“Cas9 – это бактериальный белок, который связывает небольшой кусочек нуклеиновой кислоты вируса и после узнавания расщепляет соответствующую им ДНК. Выяснилось, что такой белок можно ввести в клетки млекопитающих, например человека, а вместо небольшого участка нуклеиновой кислоты, который в природных условиях происходит из вируса, можно брать любой другой фрагмент ДНК, и он будет наводить белок Cas9 (сам по себе белок Cas9 – это молекулярные “ножницы”) на участок выбранный, фактически запрограммированный вами”, — отметил Северинов.
По его словам, с помощью технологии CRISPR/Cas9 можно заставить белок Cas9 узнать фактически любое место генома и произвести в нем разрыв и затем “починить”.
“Представьте, что в каком-то месте произошла мутация, изменение одного основания ДНК на другое и за счет которой возникло какое-то генетическое заболевание. Так вот, с помощью технологии CRISPR/Cas9 это измененное место можно узнать, а потом заменить его на правильное, то есть отредактировать геном”, — сказал эксперт.
Практическое применение
“Китайские ученые взяли у нескольких пациентов, у которых был мелкоклеточный рак легких, иммунные клетки, и потом геном этих клеток в лаборатории был изменен с помощью технологии CRISPR/Cas9 так, чтобы сделать эти клетки более активными с точки зрения распознавания раковых клеток. Потом отредактированные клетки были размножены в лабораторных условиях. То, что началось сейчас, – это клинические испытания”, — рассказал Северинов.
Он отметил, что теперь каждому пациенту по несколько раз будут вводиться его собственные отредактированные клетки, и в течение нескольких месяцев будут смотреть, не вредно ли это, ведь такие гиперактивированные иммунные клетки могут привести к нежелательным последствиям.
“Так что пока речь о лечении не идет, речь идет о клинических испытаниях. Пациенты не будут вылечены, сейчас просто проверяется, что им хуже не станет: испытания на безопасность. Аналогические клинические испытания скоро начнутся в Соединенных Штатах. Я думаю, что для некоторых видов рака, но далеко не для всех, технология будет работать. В пределах двух лет можно ждать опытов на волонтерах уже с лечением”, — сообщил эксперт.
Перспективы в России
Северинов рассказал, что CRISPR/Cas технологии стремительно развиваются и коммерциализуются в США, Китая и странах Западной Европы. Количество ученых в России, которые занимаются подобными работами, очень невелико, а условия их работы несравнимы с условиями работы в развитых в научном отношении странах.
“Поэтому ни о каком лидерстве России или хотя бы заметной роли российских ученых, работающих внутри страны, в CRISPR-революции говорить не приходится, но какие-то исследования делаются сейчас, в частности у нас в Сколтехе. Надо понимать, что, в принципе, это простая технология, редактировать гены можно у себя “в гараже”, нужно только знать, что и зачем ты делаешь. В недалеком будущем эта технология позволит очень демократизировать исследования в науках о жизни, сделает их более доступными”, — подытожил он.
Надо понимать, что, в принципе, это простая технология, редактировать гены можно у себя “в гараже”, нужно только знать, что и зачем ты делаешь. В недалеком будущем эта технология позволит очень демократизировать исследования в науках о жизни, сделает их более доступными”, — подытожил он.
*protected email*
Редактирование генома CRISPR-Cas9 — Последние исследования и новости
- Atom
- RSS-канал
Редактирование генома CRISPR-Cas9 использует систему CRISPR-Cas для целенаправленной модификации генома. Руководствуясь РНК, эндонуклеаза Cas9 разрывает ДНК в целевой последовательности. Неточная репарация двухцепочечного разрыва может привести к инсерционным или делеционным мутациям, в то время как пути репарации могут быть сконструированы для введения специфических точечных мутаций или инсерций.
Последние исследования и обзоры
Протоколы
|
Этот протокол представляет собой безферментный метод достижения целевого деметилирования ДНК на основе стерических затруднений с помощью dCas9, связанного с представляющими интерес сайтами CpG или рядом с ними, для выявления меток метилирования ДНК, являющихся причиной измененной экспрессии генов.
- Даниил М. Сапожников
- и Моше Шиф
Протоколы природы, 1-44
Исследовательская работа
|
Открытый доступОсновное редактирование позволяет вводить точные точечные мутации, небольшие вставки или короткие делеции, не требуя шаблонов донорской ДНК.
 Здесь авторы разрабатывают стратегию совместного отбора, чтобы облегчить первичное редактирование в клетках человека, и предлагают принципы дизайна для предотвращения образования нежелательных побочных продуктов редактирования в целевом сайте.
Здесь авторы разрабатывают стратегию совместного отбора, чтобы облегчить первичное редактирование в клетках человека, и предлагают принципы дизайна для предотвращения образования нежелательных побочных продуктов редактирования в целевом сайте.- Себастьен Левеск
- , Диана Майорга
- и Яник Дойон
Природные коммуникации 13, 5909
Исследовательская работа
|
Детальное понимание механизма каталитического расщепления ДНК-мишени с помощью CRISPR-Cas9 отсутствует. Теперь ключевая модулирующая роль Mg 2+ в конформационной активации Cas9и продемонстрировано влияние остатков активного центра на состояние протонирования каталитического H840, что в конечном итоге раскрывает каталитический механизм.
- Лукаш Нежвицкий
- , Кайл В. Ист
- и Джулия Палермо
Природный катализ, 1-11
Исследовательская работа
|
Открытый доступМолекулярные механизмы, лежащие в основе полифенизма крыльев, остаются плохо изученными. Здесь авт. используют личинки растений, чтобы показать, что развитие длиннокрылых и короткокрылых морф уравновешивается относительной активностью каскадов передачи сигналов Zfh2-FoxO и инсулина.
- Цзинь-Ли Чжан
- , Сун-Цзе Чен
- и Хай-Цзюнь Сюй
Nature Communications 13, 5670
Исследовательская работа
|
Открытый доступНуклеазы CRISPR-Cas12f могут быть эффективно упакованы в AAV для генной терапии, но отсутствует систематическая оценка результатов редактирования. Здесь авторы проводят всестороннюю оценку 4 белков Cas12f и сравнивают их с Cas9.и два белка Cas12a в ряде сайтов.
- Чанчан Синь
- , Цзяньхан Инь
- и Цзячжи Ху
Nature Communications 13, 5623
Исследовательская работа
|
Открытый доступСтабильно молчащие гены с метилированным CpG в промоторе невосприимчивы к существующим системам активации CRISPR. Здесь авторы создают более надежную систему активации, TETact, которая рекрутирует ДНК-деметилирующий TET1 с активаторами транскрипции.
- Винг Фук Чан
- , Ханна Д. Кофлан
- и Рис С. Аллан
Nature Communications 13, 5582
Все исследования и обзоры
Новости и комментарии
Основные результаты исследований
|
В исследовании Nature описывается «пишущая машинка ДНК», технология записи ДНК на основе простого редактирования, которая может фиксировать порядок большого количества различных молекулярных событий в клетках млекопитающих.
- Кирсти Минтон
Nature Reviews Genetics 23, 521
Новости
|
Испытание генной терапии открывает ключевой год для метода точного редактирования генома, известного как редактирование базы.
- org/Person»> Хайди Ледфорд
Природа 607, 647
Новости
|
Растения, богатые предшественником витамина, могут помочь восполнить дефицит, но им предстоит пройти долгий путь на рынок.
- Хайди Ледфорд
Природа
Новости и просмотры
|
Объединенные экраны CRISPR с базовым и первичным редактированием раскрывают функции генетических вариантов с беспрецедентным разрешением.
- Питер П. Ду
- , Кэтрин Лю
- и Гэлен Т. Хесс
Природа Биотехнология 40, 834-836
Новости
|
Но некоторые задаются вопросом, удержит ли заявление правительства ученых от проведения исследований, нарушающих этические нормы.

- Смрити Маллапати
Природа 605, 15-16
Все новости и комментарии
CRISPR/Cas9 | Последние новости, фото и видео
КРИСПР/Cas9 | Последние новости, фото и видео | WIRED
Перейти к основному содержанию
История сохранена
Чтобы вернуться к этой статье, перейдите в раздел «Мой профиль» и выберите Просмотреть сохраненные истории.
crisprcas9
SearchSearch
Наука
Может ли Crispr изменить устойчивость к инсектицидам?
Эмили Маллин
Наука
Взломщик кодов Хроника Crispr, которую вам нужно прочитать
org/Person»> Меган Молтени0223
By Megan Molteni
Science
Human Embryo Gene Editing Gets a Road Map—Not a Green Light
By Megan Molteni
Science
The WIRED Guide to Crispr
By Megan Molteni and Grace Huckins
Science
Родился теленок Crispr. Это определенно мальчик
Меган Молтени
Наука
История происхождения Криспра оживает в новом документальном фильме
Меган Молтени
Наука
Клетки Crispr’d показали многообещающие результаты в первом американском испытании на безопасность человека
org/Person»> Меган Молтени
Наука
Китайские ученые пытаются вылечить одного человека от ВИЧ с помощью Crispr
Меган Молтени
Всемирная организация здравоохранения говорит «нет» Подробнее о младенцах с отредактированными генами
Меган Молтени
Наука
Редактирование генов сложнее, чем ожидалось, но исправления не за горами
Меган Молтени
Наука
Эпическая патентная борьба Crispr изменила курс биологии
Меган Молтени
Наука
Crispr остановил мышечную дистрофию у собак.
 Люди следующие?
Люди следующие?
от Megan Molteni
Science
С редактированием на базе эмбрионов, Китай получает еще один CRISPR First
от Megan Molteni
Science
Debatists Drecate a Results Embreos 9023
4244224 By By By Amad. Европейское правление может замедлить стремление Африки к выращиванию Crispr
от Eric Niiler
Science
Все, что вам нужно знать об редактировании генов CRISPR
от Megan Molteni
Science
Ученые выращивают новый набор кожи для вылечения генетической болезни
org/Person»> на мегане.
Crispr может вылечить все генетические заболевания за один день
Меган Молтени
Наука
Хотите лучшего пива? Хороший. Вот лучший геном ячменя
Адам Роджерс
Science
Патентное решение по редактированию генов CRISPR подарки MIT
Адама Роджерса и Эрика Ниилера
Science
Trump’s Ban не просто Inhumane — It Make America Dumber
от Emily Dreyfuss
Ncience
от Emily Dreyfuss
9999999999999999999999999999999999992999999299999999999999999999999999999999999999999929292929ня
org/Person»>. Китай использовал Crispr для борьбы с раком у настоящего живого человека
Меган Молтени
Наука
Можете ли вы отличить настоящие проекты Crispr от поддельных?
Сара Чжан
Еще новости
Будущее CRISPR уже сейчас
- AAMCНовости
CRISPR революционизирует экспериментальные методы лечения генетических заболеваний, начиная от серповидно-клеточной анемии и заканчивая слепотой, но где общество должно провести черту в редактировании генов?
Прошло больше года с тех пор, как Маркус Мапара, доктор медицинских наук, профессор медицины и директор по трансплантации крови и костного мозга в Медицинском центре Колумбийского университета в Ирвинге в Нью-Йорке, впервые применил экспериментальную терапию с помощью редактирования генов CRISPR у пациента с серповидноклеточная анемия, наследственное заболевание крови, которое может вызвать сильную боль, повреждение органов и преждевременную смерть.
Хотя клинические испытания все еще находятся на ранних стадиях и были протестированы лишь на нескольких пациентах, пока результаты обнадеживают.
«[Пациент] чувствует себя феноменально хорошо», — говорит Мапара, гематолог, онколог и врач по пересадке крови. «У него не было ни одного кризиса».
Серповидно-клеточная анемия, от которой в настоящее время страдают около 100 000 человек, проживающих в Соединенных Штатах, и миллионы людей во всем мире, является результатом генетической мутации, которая приводит к образованию аномального типа гемоглобина, белка, который эритроциты используют для доставки кислорода по всему телу. Аномальные клетки приобретают серповидную или изогнутую форму и могут сгущаться в узких кровеносных сосудах.
«Это огромная проблема для здоровья этих пациентов, — говорит Мапара. «Это оказывает огромное влияние на их качество жизни и благополучие».
На данный момент трансплантация костного мозга от здорового донора является единственным методом лечения, но этот подход может иметь серьезные осложнения.
«Вы рискуете ввести реципиенту чужеродные клетки, — говорит Мапара. «[Тело] может их отвергнуть, или донорские клетки могут атаковать реципиента».
Но с развитием CRISPR (что означает сгруппированные короткие палиндромные повторы с регулярными интервалами) открылись новые возможности для лечения с использованием собственных клеток пациентов.
«[CRISPR — это] инструмент, который ученые и клиницисты во всем мире используют для понимания нашей генетики, генетики всех живых существ и, что наиболее важно, для вмешательства в генетические заболевания».
Дженнифер Дудна, доктор философии, Калифорнийский университет, Беркли
CRISPR, как он известен сегодня, был разработан двумя учеными: Дженнифер Дудна, доктором философии, которая руководит лабораторией Калифорнийского университета в Беркли, и Эммануэль Шарпантье, доктором философии, научным и управляющим директором подразделения Макса Планка для Science of Pathogens в Берлине, Германия, которые были удостоены Нобелевской премии по химии 2020 года за работу над этой технологией.![]()
Ученые работали вместе, чтобы выяснить, как именно бактерии эволюционировали, чтобы бороться с вирусами, и применить тот же процесс для создания человеческих клеток. В частности, Дудна и Шарпантье обнаружили, что фермент, известный как Cas9, может управляться программируемой РНК для обнаружения определенных генетических последовательностей в любом организме. Затем фермент работает как ножницы, разрезая двойную спираль ДНК и позволяя удалять, добавлять или заменять последовательности.
«Это инструмент, который ученые и врачи во всем мире используют для понимания нашей генетики, генетики всех живых существ и, что наиболее важно, для вмешательства в генетические заболевания», — сказал Дудна во время выступления на Learn Serve Lead 2021: Виртуальный опыт, ежегодное собрание AAMC, в ноябре.
В научном сообществе эта технология была отмечена как значительное достижение, которое изменило способ проведения исследований в разных областях. CRISPR использовался для экспериментов с отредактированными генами комаров, чтобы уменьшить распространение малярии, для создания сельского хозяйства, чтобы противостоять изменению климата, и в клинических испытаниях на людях для лечения ряда заболеваний, от рака до транстиретинового амилоидоза, редкого белкового расстройства, которое опустошает. нервы и органы.
нервы и органы.
Тем не менее, технология сопряжена со значительными этическими последствиями, включая обеспечение того, чтобы она не имела непреднамеренных негативных последствий, чтобы она использовалась справедливо и чтобы был достигнут консенсус относительно того, где провести черту в использовании технологии.
AAMCNews побеседовал с исследователями, врачами, специалистами по этике и преподавателями о передовых технологиях CRISPR и рассказал о их огромном потенциале как во благо, так и во вред будущему человечества.
Потенциал к лучшему — клинические испытания показывают многообещающие результаты
Серповидно-клеточная анемия и бета-талассемия
Клинические испытания, в которые Мапара включил своего пациента в прошлом году, были одной из первых попыток использовать CRISPR для лечения генетического расстройства у людей.
Хотя исследователи и врачи проводят несколько обработок генной терапией для серповидно-клеточной анемии и бета-талассемии, аналогичного заболевания крови, этот подход нацелен на ген, который останавливает производство фетального гемоглобина. Эксперты обнаружили, что люди производят фетальный гемоглобин примерно до трех месяцев после рождения, после чего их клетки начинают производить взрослый гемоглобин, объясняет Мапара. Именно взрослый гемоглобин у людей с серповидно-клеточной анемией и бета-талассемией принимает неправильную форму и вызывает проблемы со здоровьем.
Эксперты обнаружили, что люди производят фетальный гемоглобин примерно до трех месяцев после рождения, после чего их клетки начинают производить взрослый гемоглобин, объясняет Мапара. Именно взрослый гемоглобин у людей с серповидно-клеточной анемией и бета-талассемией принимает неправильную форму и вызывает проблемы со здоровьем.
«Для врача-ученого это сбывшаяся мечта, когда вы можете стать частью и стать свидетелем разработки революционно нового метода лечения».
Маркус Мапара, доктор медицинских наук, Медицинский центр Колумбийского университета в Ирвинге
«Вы избавляетесь от репрессора и увеличиваете выработку — опять же — фетального гемоглобина», — говорит он, объясняя, что пациенты, у которых теперь вырабатывается большее количество фетального гемоглобина, а не мутировавшего гемоглобина взрослого человека, испытывают меньше кризисов.
Национальное общественное радио документирует путешествие первого человека, присоединившегося к клиническому испытанию, Виктории Грей, с момента ее первого лечения в 2019 году.
«Это действительно изменило мою жизнь», — сказал Грей NPR в декабре прошлого года.
Мапара говорит, что первоначальные результаты клинических испытаний были опубликованы в декабре 2020 года, и что последующие результаты продолжают быть очень многообещающими.
«Это действительно может изменить правила игры для этих пациентов», — говорит он. «Для врача-ученого это сбывшаяся мечта, когда вы можете стать частью и стать свидетелем разработки революционно нового метода лечения».
Врожденный амавроз Лебера
CRISPR также используется в клинических испытаниях, направленных на лечение врожденного амавроза Лебера, генетически детерминированной прогрессирующей формы врожденной потери зрения и слепоты.
Хотя существует более 300 генов, связанных с дефектами зрения, это исследование посвящено одной мутации гена, вызывающей особенно тяжелую форму дегенерации.
«Это то, что мы называем проблемой сплайсинга мРНК», — говорит Марк Пеннеси, доктор медицинских наук, который возглавляет участие Орегонского университета здравоохранения и науки в исследовании и является профессором офтальмологии имени Кеннета С. Свона в Медицинской школе OHSU. и руководитель отдела офтальмологической генетики Пола Х. Кейси Института глаза Кейси OHSU. «Мутация создает небольшой знак «стоп» в последовательности, поэтому весь белок не вырабатывается… [для лечения, руководство] РНК будут нацеливаться на последовательности по обе стороны от знака «стоп», белок Cas [связанный с CRISPR] будет резать их, и ДНК восстановит себя. Надеюсь, клетки начнут вырабатывать белок».
Свона в Медицинской школе OHSU. и руководитель отдела офтальмологической генетики Пола Х. Кейси Института глаза Кейси OHSU. «Мутация создает небольшой знак «стоп» в последовательности, поэтому весь белок не вырабатывается… [для лечения, руководство] РНК будут нацеливаться на последовательности по обе стороны от знака «стоп», белок Cas [связанный с CRISPR] будет резать их, и ДНК восстановит себя. Надеюсь, клетки начнут вырабатывать белок».
«Это революционно. Глаз — одна из самых доступных частей мозга, и зрение очень важно для человека. Это действительно открывает двери для многих других методов лечения».
Марк Пеннеси, доктор медицинских наук, Орегонский медицинский факультет Университета здоровья и науки
В прошлом году клиницисты Глазного института Кейси при OHSU провели процедуру CRISPR на пациенте, что стало первым случаем применения CRISPR у человека in vivo или внутри тела вместо удаления генетического материала для редактирования.
«Это революционно, — говорит Пеннеси. «Глаз — одна из самых доступных частей мозга, а зрение — очень важная вещь для людей. Это действительно открывает двери для многих других методов лечения… Мы надеемся, что сможем использовать CRISPR при неврологических или мышечных заболеваниях».
Первоначальные результаты клинических испытаний с участием шести пациентов показывают, что процедура безопасна и может улучшить зрение.
«Об одном пациенте, пролеченном в нашем центре, стало известно», — говорит он. «У нее улучшилась острота зрения, она может видеть объекты и чувствует, что на самом деле видит цвет».
Пеннеси говорит, что они будут продолжать увеличивать дозы лечения, чтобы следить за улучшением результатов, и добавляет, что они надеются в конечном итоге сделать это лечение доступным для детей, которые с большей вероятностью будут испытывать меньше последствий дегенерации.
«Это действительно прекрасное время для работы в этой области, потому что она превращается из области, где у нас не было выбора, в область, где у нас есть», — говорит он.
Рак
CRISPR также вызывает ажиотаж в области лечения рака.
В Пенсильванском университете в Филадельфии врачи и исследователи использовали CRISPR для генной инженерии иммунных клеток, чтобы лучше бороться с опухолями.
Эдвард Штадтмауэр, доктор медицинских наук, руководитель отдела гематологических злокачественных новообразований в Медицинской школе Перельмана Пенсильванского университета и главный исследователь клинических испытаний, начал работать над этим проектом примерно в 2016 году, когда технология CRISPR была еще совсем новой.
Stadtmauer долгое время работал с CAR T-клеточной терапией, которая модифицирует иммунные T-клетки, добавляя снаружи боеголовку, нацеленную на раковые клетки. Хотя этот метод оказался чрезвычайно эффективным при многих видах рака крови, Штадтмауэр предположил, что CRISPR может вывести лечение на новый уровень.
Используя эту технологию, Штадтмауэр и его команда смогли взять Т-клетки пациента, удалить три гена и добавить один ген, которые вместе продлили жизнь иммунной клетки и сделали ее более эффективной в борьбе с раком.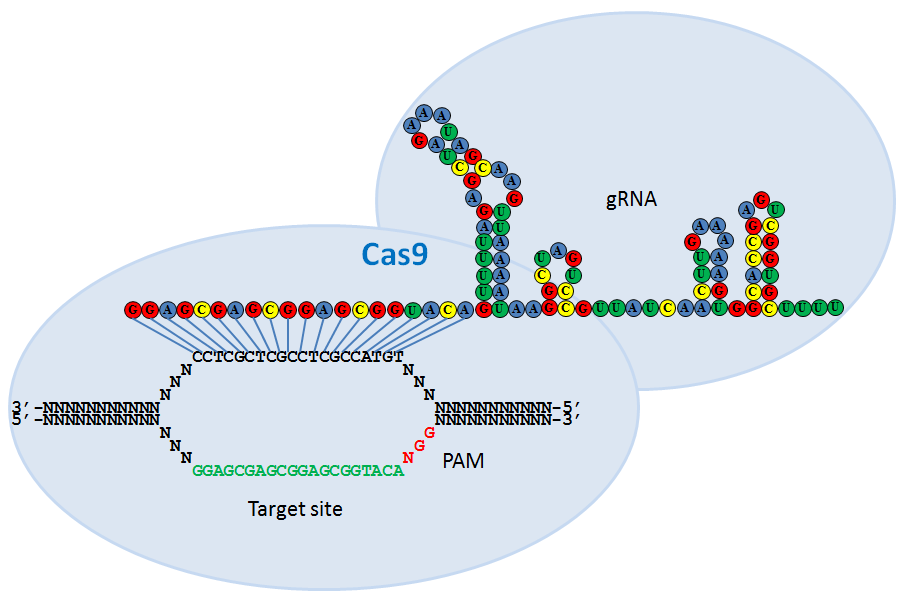 Это было первое исследовательское использование множественных правок с CRISPR для изменения генома человека.
Это было первое исследовательское использование множественных правок с CRISPR для изменения генома человека.
«Примечательно и, возможно, для меня самым важным открытием исследования было то, что эти клетки с тройным редактированием генов с дополнительной вставкой другого гена на самом деле обладали огромной способностью к пролиферации и экспансии и продолжают выживать от девяти месяцев до года. позже без каких-либо признаков того, что их число уменьшилось», — говорит Штадтмауэр. Он добавляет, что пациенты, получившие отредактированные клетки, не испытали каких-либо серьезных непредвиденных последствий или серьезных побочных эффектов. «Эти вещи были обнадеживающими и почему мы считаем это безопасным».
Хотя эти результаты являются многообещающими, предстоит еще много исследований, чтобы максимально использовать потенциал технологии в лечении рака. Образцы крови трех пациентов, участвовавших в исследовании, показали, что отредактированные клетки процветали, но ни один из пациентов не ответил на терапию.
«Одним из ограничений использования ваших собственных клеток является то, что клетки могут быть не такими функциональными у пациента, как клетки здорового молодого человека из-за возраста или воздействия химиотерапии», — говорит Штадтмауэр. «И еще одна проблема заключается в том, что может пройти месяц или около того со дня, когда пациент получает клетки, до фактического введения клеток, и это требует, чтобы пациенты, больные своим заболеванием, проходили какую-то промежуточную терапию, чтобы поддерживать их. пока продукт не создан. Таким образом, наиболее захватывающий современный подход состоит в том, чтобы использовать аллогенные или донорские иммунные клетки в качестве источника готового продукта, который можно своевременно вводить и направлять на любые антигены, которые вы хотите… и в настоящее время проводится огромное количество исследований. прямо сейчас в этой перспективной области».
Прогресс с заботой о справедливости
Одной из самых замечательных особенностей технологии CRISPR является то, насколько быстро она развивается. Но как бы это ни было интересно для развития науки и медицины, эксперты в самых разных областях, от исследований до биоэтики, в том числе Дудна, предупредили, что прогресс не должен опережать решение возникающих этических сложностей.
Но как бы это ни было интересно для развития науки и медицины, эксперты в самых разных областях, от исследований до биоэтики, в том числе Дудна, предупредили, что прогресс не должен опережать решение возникающих этических сложностей.
Среди них определение того, кто будет иметь доступ к передовой генной терапии.
«Мы действительно должны бороться за равенство и доступность», — сказал Дудна на ежегодном собрании AAMC. «Мы должны знать, как убедиться, что каждый, кто может извлечь выгоду из этой технологии, имеет к ней доступ».
Это вопрос, о котором Эрик Кмиек, доктор философии, думал в 2015 году, когда он стал директором-основателем Института редактирования генов в ChristianaCare в Ньюарке, штат Делавэр, единственного в своем роде института, который базируется в общественная система здравоохранения.
«При всем уважении к крупным медицинским центрам — они делают потрясающую работу — но почему-то общественный онкологический центр всегда казался мне лидером в области рака», — говорит Кмиек. «Мы должны подумать о том, как эти технологии повлияют на всех людей».
«Мы должны подумать о том, как эти технологии повлияют на всех людей».
В Институте редактирования генов есть то, что Кмиек называет «парадигмой от скамейки до постели». У него и его исследователей есть офисы в том же здании, где онкологи принимают пациентов. Они посещают большие обходы и придерживаются политики открытых дверей с врачами. Хирург-онколог регулярно посещает собрания лаборатории, на которых обсуждаются исследования.
«Общение с клиницистами почти каждый день научило меня многому о том, насколько сложной является эта чертова вещь [лечение рака]», — говорит Кмиек. «Многие действительно умные люди годами работали над терапией рака… мы должны формировать наш подход на основе того, что нам говорят клиницисты… обычно [исследователи] приходят и рассказывают клиницистам, как использовать технологии. Мы сделали наоборот».
Учащиеся средней технической школы Сент-Джорджес на юге округа Нью-Касл, штат Делавэр, стали первыми учащимися старших классов в Соединенных Штатах, которые использовали инновационный образовательный инструментарий CRISPR in a Box™ Института редактирования генов ChristianaCare на уроках естественных наук.
Предоставлено Институтом редактирования генов в ChristianaCare
Приверженность института справедливости выходит за рамки разработки методов лечения, которые охватывают малообеспеченные слои населения; это также распространяется на диверсификацию рекрутинговой базы для следующего поколения ученых CRISPR. В сотрудничестве с Техническим общественным колледжем Делавэра компания создала CRISPR in a Box™, образовательный набор, который дает учащимся старших классов и муниципальных колледжей инструменты для изучения и использования CRISPR в классе. Ресурс сопровождался согласованными усилиями по распространению информации, которые включают учебные видеоролики и возможности для студентов общаться с учеными через Zoom, чтобы помочь объяснить технологию.
Кмиек надеется, что зажечь искру интереса к CRISPR и показать молодым людям, особенно цветным людям и выходцам из малообеспеченных сообществ, что использование этой технологии не требует ученой степени, вдохновит более разнообразную рабочую силу в будущее.
«Мы хотим привлекать цветные сообщества не только к тому, чтобы узнать о чем-то, о чем мы уже знаем, но и непосредственно участвовать в [этом развитии]», — говорит Кмиец. «[Таким образом] группы меньшинств будут стоять с нами на финише».
CRISPR и этика — где провести черту?
Остин Килер, доктор философии, аспирант Университета Вирджинии, использует CRISPR в лаборатории для изменения генетического состава эмбрионов мышей с целью создания трансгенных животных для исследований. Хотя он находит потенциал CRISPR захватывающим, он много размышляет об этических последствиях в вопросах, которые в настоящее время больше напоминают научную фантастику, чем реальность. Эти мысли вдохновили его на создание курса, который он читает для студентов бакалавриата под названием «Homo CRISPR — Future Humans?»
Килер предоставляет своим студентам ресурсы, чтобы объяснить, как работает редактирование генов, а затем открывает классное время для обсуждения различных его текущих и потенциальных применений: от редактирования генов комаров для борьбы с распространением малярии до использования CRISPR в косметике. изменения у человека.
изменения у человека.
«Я хотел показать, как быстро мы перешли к этой технологии и каков ее потенциал, чтобы коренным образом изменить нашу жизнь», — говорит Килер. «Это будет иметь глубокие последствия в их взрослой жизни и в жизни их детей. Я не уверен, что многое из того, что происходит, вышло за пределы академических кругов».
Эти этические проблемы попали в заголовки газет в последние годы. В 2018 году китайский биофизик Хэ Цзянькуй объявил миру, что создал первых генетически измененных детей. Он использовал CRISPR для редактирования зародышевой линии трех эмбрионов, чтобы сделать их менее восприимчивыми к ВИЧ.
Это заявление было встречено возмущением со стороны как ученых, так и специалистов по этике, и в конечном итоге он был приговорен китайским правительством к трем годам тюремного заключения за незаконную медицинскую практику. Это было напоминание о том, что технология, которая настолько эффективна и проста в использовании, может быть использована без четких правил и надзора.
«Как и любая новая технология, CRISPR сопряжена с рисками, — сказал Дудна на ежегодном собрании AAMC. «С самого начала было ясно, что возникнут настоящие этические проблемы».
Стремясь способствовать публичному обсуждению этих проблем, Дудна примет участие в Третьем международном саммите по редактированию генома человека в марте 2022 года, где заинтересованные стороны со всего мира обсудят текущее состояние науки, а также этические и культурные аспекты. соображения, разработка нормативных актов и роль общественности в направлении программы исследований, среди прочих вопросов.
Кристофер Скотт, доктор философии, биоэтик и профессор медицинской этики и политики в области здравоохранения Далтона Томлина в Медицинском колледже Бейлора в Хьюстоне, штат Техас, в настоящее время работает над проектом, финансируемым Национальным институтом здравоохранения, который станет первым всеобъемлющим эмпирическим исследованием. как общество могло бы регулировать этическое использование редактирования генома в будущем.
«Как и любая новая технология, CRISPR сопряжена с рисками… С самого начала было ясно, что возникнут серьезные этические проблемы».
Дженнифер Дудна, доктор философии, Калифорнийский университет, Беркли
Команда Скотта встретилась с десятками людей, в том числе с юристами, защитниками прав людей с инвалидностью, специалистами по этике и футуристами, но также сосредоточилась на привлечении представителей общественности, которые не регулярно участвуют в дискуссиях о научных технологиях.
«Мы получаем их отзывы об их мнениях и ценностях», — говорит Скотт о представителях общественности. «Результаты были очень ошеломляющими».
В рамках исследования группам неспециалистов были представлены различные сценарии будущего, связанные с редактированием генов, и их спросили об их уровне комфорта с ними. Скотт обнаружил, что в целом существует большое различие между редактированием соматических клеток, которое представляет собой изменение часто вызывающих болезни генов, не участвующих в репродукции, и редактированием зародышевой линии, которое изменяет наследуемые признаки.
«При редактировании зародышевой линии ответ, как правило, был: «Мы пока не должны этого делать», — говорит Скотт. «Один [заданный] вопрос звучал так: «Если бы это было настолько безопасно, насколько мы могли бы это сделать, [следует ли это делать?]… Было не так уж много единодушных мнений, безусловно, да, мы должны это сделать [ответы]».
Киллер заметила подобные сомнения среди учеников своего класса. Многих студентов беспокоила мысль о том, что генетические черты человека могут быть изменены без их согласия. Некоторые опасались, что, если когда-нибудь удастся улучшить определенные черты, которые считаются полезными, это может еще больше увеличить неравенство между «супер» элитой и людьми, не имеющими таких улучшений.
«У вас есть все обычные этические проблемы, которые возникают в контексте использования технологий, которые могут быть использованы способами, которые могут показаться проблематичными», — говорит Инмакулада де Мело-Мартин, доктор медицинских наук, профессор медицинской этики в медицине в Weill Cornell Medicine.

 Здесь авторы разрабатывают стратегию совместного отбора, чтобы облегчить первичное редактирование в клетках человека, и предлагают принципы дизайна для предотвращения образования нежелательных побочных продуктов редактирования в целевом сайте.
Здесь авторы разрабатывают стратегию совместного отбора, чтобы облегчить первичное редактирование в клетках человека, и предлагают принципы дизайна для предотвращения образования нежелательных побочных продуктов редактирования в целевом сайте.