Содержание
CRISPR «для чайников»: краткий путеводитель по главной биотехнологии
Сергей КоленовФото: Jennifer Doudna / UC Berkeley
CRISPR — одна из самых перспективных технологий последних лет, и в ближайшие годы ее роль будет только расти. Однако далеко не все понимают, как именно работает генное редактирование. Издание Vox представило простой справочник, который поможет разобраться в CRISPR даже человеку, далекому от биологии.
Говоря вкратце, CRISPR — точнее, CRISPR/Cas9 — мощный инструмент редактирования геномов. Он основан на элементе защитной системы бактерий, который биологи приспособили для внесения изменений в ДНК растений, животных и даже людей. Технология позволяет внести поправки всего за несколько дней, а не недель или месяцев. Никогда прежде у человечества не было столь точного орудия для манипуляции генами.
История CRISPR началась в 1987 году, когда японские ученые, изучавшие кишечную палочку Escherichia coli, обнаружили в ее ДНК необычные повторяющиеся последовательности. Их биологическое значение выяснить не удалось, однако вскоре аналогичные фрагменты были найдены в геноме других бактерий и архей. Последовательности получили название CRISPR — короткие палиндромные повторы, регулярно расположенные группами (Clustered Regular Interspaced Short Palindromic Repeats).
Их биологическое значение выяснить не удалось, однако вскоре аналогичные фрагменты были найдены в геноме других бактерий и архей. Последовательности получили название CRISPR — короткие палиндромные повторы, регулярно расположенные группами (Clustered Regular Interspaced Short Palindromic Repeats).
Их функция оставалась загадкой до 2007 года, когда специалисты по бактерии Streptococcus, которая используется для приготовления кисломолочных продуктов, определили: эти фрагменты — часть иммунной системы бактерий.
Дело в том, что бактерии постоянно должны отражать атаки вирусов — своих естественных врагов. Для этого они производят специальные ферменты. Каждый раз, когда бактерии удается убить вирус, она разрезает остатки его генетического материала и сохраняет их внутри последовательностей CRISPR. Затем эта информация используется в случае новой вирусной атаки. При нападении бактерия производит белки Cas9, которые несут фрагмент генетического материала вируса. Если этот участок и ДНК атакующего вируса совпадают, Cas9 разрезает генетический материал последнего и нейтрализует угрозу.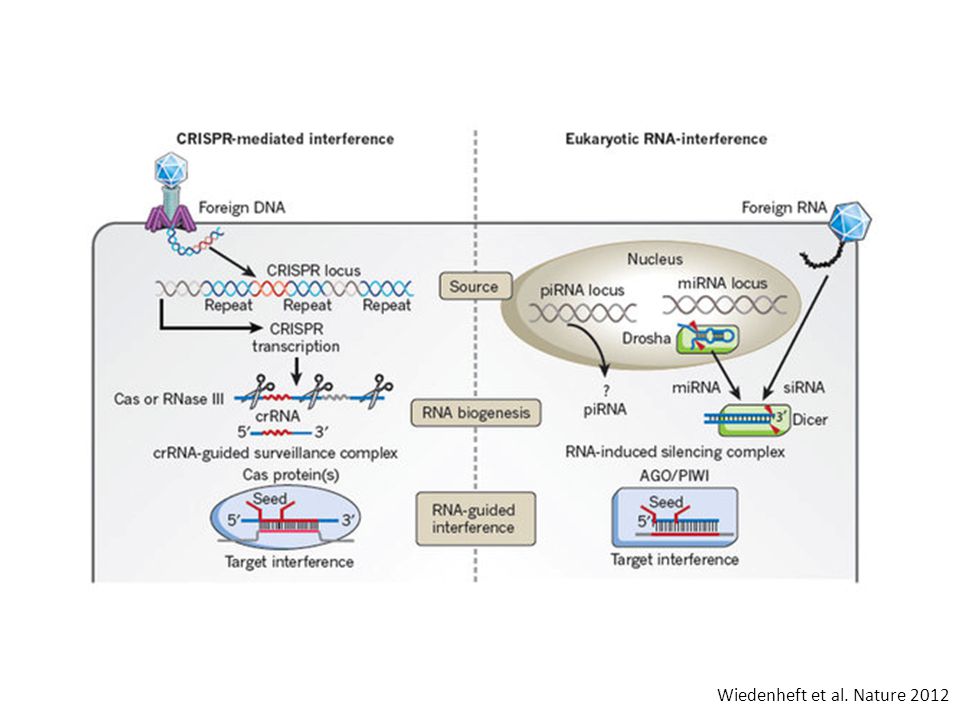
Некоторое время это открытие было интересно только микробиологам. Однако все изменилось в 2011 году, когда биологи Дженнифер Дудна и Эммануэль Шарпантье решили точнее изучить механизм CRISPR. Они обнаружили, что белок Cas9 можно обмануть, дав ему искусственную РНК. Белок, несущий такую РНК, будет искать генетические фрагменты, совпадающие с тем, что он несет на себе. Обнаружив соответствие с чужой ДНК, он начнет измельчать ее, независимо от того, кому она принадлежит — вирусу, растению или животному. Как отметили в статье 2012 года Дудна и Шарпантье, этот механизм можно использовать для разрезания любого генома в нужном месте.
В феврале 2013 года было доказано, что CRISPR/Cas9 можно использовать для редактирования ДНК в культуре клеток мышей и человека. Более того. выяснилось, что технология позволяет не только удалять ненужные гены, но и вставлять на их место другие. Для этого достаточно добавить ферменты, восстанавливающие ДНК.
Ученые быстро поняли огромные перспективы CRISPR.
Если в 2011 году было опубликовано всего 100 работ о ней, то к 2017 году эта цифра достигла более 14 000.
Помимо прочего, в них описывались аналоги белков Cas9. Например, Cas13 может редактировать не ДНК, а РНК.
Идея генной модификации не нова, и различные ее методики существуют уже много лет. Однако CRISPR превосходит все известные до сих пор технологии благодаря доступности и точности. Редактирование одного гена обойдется всего в $75 и займет несколько часов. И, что немаловажно, технология работает с любым организмом на Земле.
Существует почти бесконечное множество потенциальных применений технологии. Во-первых, CRISPR позволяет ученым выяснить функцию различных генов. Достаточно просто вырезать изучаемый ген из ДНК и увидеть, какие функции организма оказались затронуты. Однако общественность намного сильнее интересуют практические применения. Их можно разделить на несколько пунктов:
1) Изменения в сельском хозяйстве
CRISPR позволяет сделать сельскохозяйственные культуры более питательными, более вкусными и устойчивыми к жаре и стрессу. Можно придать растениям и другие свойства: например, вырезать из арахиса ген аллергена, а в бананы внедрить устойчивость к смертельному грибку. Технологию можно применить и для редактирования генома домашних животных — например, коров.
Можно придать растениям и другие свойства: например, вырезать из арахиса ген аллергена, а в бананы внедрить устойчивость к смертельному грибку. Технологию можно применить и для редактирования генома домашних животных — например, коров.
2) Борьба с наследственными заболеваниями
Ученые намерены использовать CRISPR, чтобы вырезать из человеческого генома мутации, ответственные за целый ряд заболеваний, например, серповидноклеточную анемию. Технология также позволят вырезать гены хореи Хантингтона или мутаций BRCA-1 и 2, связанных с раком молочной железы и яичников. Теоретически CRISPR-атака даже может остановить развитие ВИЧ.
Однако специалистам предстоит убедиться в безопасности методики, прежде чем ее начнут применять в больницах. Ферменты Cas9 иногда ошибаются и редактируют ДНК в неожиданных местах, что может вызвать серьезные последствия для здоровья.
3) Новые антибиотики и противовирусные препараты
Бактерии развивают устойчивость к антибиотикам, а разрабатывать новые дорого и сложно. Технология CRISPR дает возможность с высокой точностью уничтожать опредленные виды бактерий, хотя конкретную методику еще предстоит разработать. Ряд исследователей также работает над CRISPR-системами, нацеленными на вирусы.
Технология CRISPR дает возможность с высокой точностью уничтожать опредленные виды бактерий, хотя конкретную методику еще предстоит разработать. Ряд исследователей также работает над CRISPR-системами, нацеленными на вирусы.
4) Генетический драйв
С помощью CRISPR можно изменить не просто геном отдельного животного и растения, но и генофонд целого вида. Эта концепция известна как «генетический драйв». Обычно любой организм передает потомству половину своих генов. Однако использование CRISPR позволяет повысить вероятность передачи генов по наследству почти до 100%. Это позволит нужному признаку быстро распространиться по всей популяции.
Используя эту технологию, можно, например, модифицировать комаров так, чтобы в их популяции рождались только самки. Через какое-то время популяция исчезнет.
В более щадящем варианте можно сделать комаров устойчивыми к заражению малярийным плазмодием. Они не смогут передавать паразита людям, и малярии будет положен конец.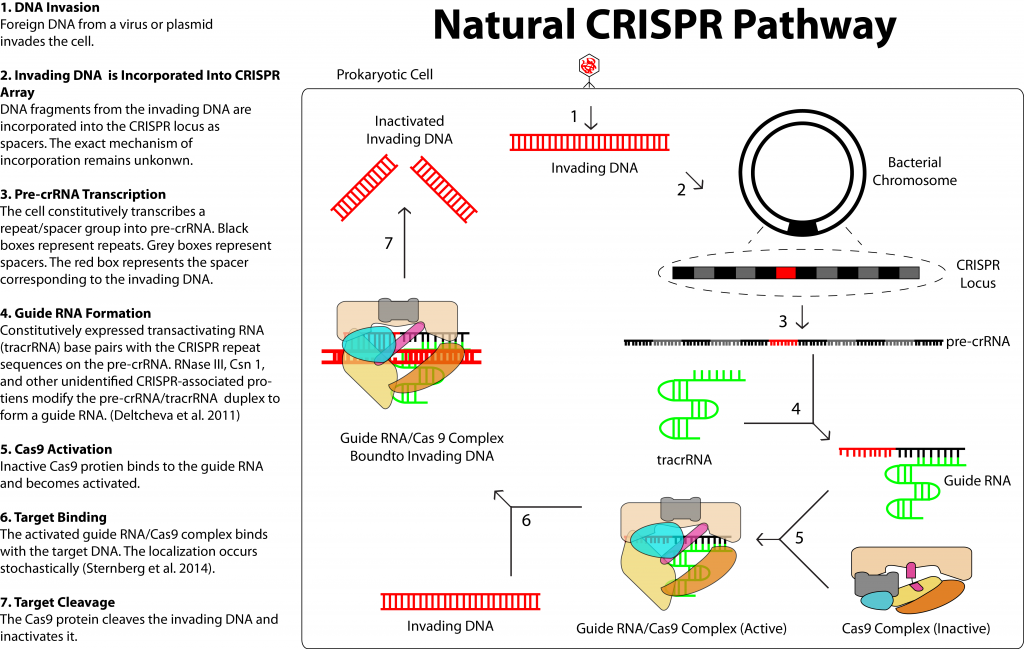 Однако для осуществления таких проектов нужно преодолеть сомнения скептиков, которые протестуют против столь масштабного вторжения в природу.
Однако для осуществления таких проектов нужно преодолеть сомнения скептиков, которые протестуют против столь масштабного вторжения в природу.
5) Создание «дизайнерских младенцев»
Этот пункт привлекает больше всего общественного внимания. Однако, по словам ученых, пока наши технологические возможности не позволяют создавать детей с заданными качествами. Например, за уровень интеллекта отвечают тысячи генов, и скорректировать их всех пока невозможно. Возможно, в будущем технологии достигнут нужного уровня, но пока беспокоиться не о чем.
Не все ученые считают CRISPR безопасной технологией. Например, согласно недавним исследованиям, генное редактирование может вызвать обширные нецелевые мутации. Авторы другой работы отмечают, что CRISPR ошибается в 15% случаев.
Генетические ножницы: острым по живому
Декабрь 2020 г.
Джеймс Нертон, внештатный журналист
7 октября 2020 г. Нобелевская премия по химии была присуждена директору подразделения Общества Макса Планка по изучению патогенов профессору Эмманюэль Шарпантье (Берлин, Германия) и исследователю из Калифорнийского университета в Беркли профессору Дженнифер А. Дудне (США) «за метод редактирования генома». Открытые ими «генетические ножницы» CRISPR-Cas9 — одно из важнейших научных достижений этого столетия. Это открытие способно кардинально изменить сельское хозяйство и медицину и даже помочь в лечении наследственных болезней, таких как болезнь Гентингтона, муковисцидоз и некоторые виды рака. Вместе с тем, как отмечают сами исследователи, оно порождает сложные этические, патентные и политические вопросы, изучение которых только начинается.
Дудне (США) «за метод редактирования генома». Открытые ими «генетические ножницы» CRISPR-Cas9 — одно из важнейших научных достижений этого столетия. Это открытие способно кардинально изменить сельское хозяйство и медицину и даже помочь в лечении наследственных болезней, таких как болезнь Гентингтона, муковисцидоз и некоторые виды рака. Вместе с тем, как отмечают сами исследователи, оно порождает сложные этические, патентные и политические вопросы, изучение которых только начинается.
Профессор Дженнифер А. Дудна (слева) и профессор Эмманюэль Шарпантье (справа) совместно удостоились Нобелевской премии по химии за открытие «генетических ножниц» CRISPR-Cas9, ставших одним из важнейших научных достижений XXI века. (Фото: KEYSTONE/dpa/Alexander Heinl)
Сотрудничество между профессором Шарпантье и профессором Дудной позволило им объединить свой опыт в области изучения патогенных бактерий и РНК-интерференции соответственно. Оно началось в 2011 г. и оказалось, по словам профессора Шарпантье, «непродолжительным и интенсивным», но его результаты будут влиять на нашу жизнь в течение многих лет. Главным достижением ученых было обнаружение того, что CRISPR — встроенный в ДНК бактерий естественный защитный механизм — и фермент Cas9 можно запрограммировать на разрезание молекулы ДНК в любой точке.
Главным достижением ученых было обнаружение того, что CRISPR — встроенный в ДНК бактерий естественный защитный механизм — и фермент Cas9 можно запрограммировать на разрезание молекулы ДНК в любой точке.
Как объяснил председатель Нобелевского комитета по химии профессор Клас Густафссон в статье, опубликованной Шведской королевской академией наук , «создание этой технологии позволило ученым изменять нуклеотидные последовательности ДНК в самых разных клетках и организмах. Манипуляции с геномом более не представляют трудностей при проведении экспериментов. Сегодня технология CRISPR-Cas9 широко используется в фундаментальной науке, биотехнологиях и при разработке терапевтических средств будущего».
ДНК (дезоксирибонуклеиновая кислота) — присутствующая во всех клетках молекула, которая содержит генетические инструкции.
РНК (рибонуклеиновая кислота) — одноцепочечная молекула, которую иногда называют «сородичем» ДНК.
CRISPR (короткие палиндромные повторы, регулярно расположенные группами) — группы повторяющихся последовательностей ДНК.
Cas — CRISPR-ассоциированные белки, которые вырезают вирусную ДНК. Известно 93 таких белка, один из которых — Cas9.
TracrRNA — транс-активационная РНК, благодаря которой длинная РНК, созданная на основе последовательности CRISPR, переходит в активную форму.
Революционный инструмент для создания биологических систем
“CRISPR-Cas9 — эффективный инструмент, который сделал редактирование генов более быстрым, точным, дешевым и простым. Эта технология способна также кардинально изменить жизнь общества и может применяться во многих сферах, в том числе в медицине, сельском хозяйстве и производстве биотоплива», — отмечает директор Центра права, медицины и наук о жизни Кембриджского университета доктор Кэти Лидделл (Соединенное Королевство). Согласно данным Реестра исследований в области редактирования генома человека Всемирной организации здравоохранения, по состоянию на октябрь 2020 г. проводилось 115 клинических исследований с применением технологий редактирования генома человека, в том числе для лечения широко распространенных генетических заболеваний, таких как серповидноклеточная анемия и бета-талассемия. В марте 2020 г. генная терапия с использованием технологии CRISPR-Cas9 была впервые проведена у человека, а именно у пациента с редким заболеванием — амаврозом Лебера (тип 10), который приводит к развитию слепоты у детей и в настоящее время не поддается лечению никакими другими методами. В данном случае генная терапия была использована для удаления в соответствующем гене (CEP290) мутации, вызывающей амавроз Лебера.
В марте 2020 г. генная терапия с использованием технологии CRISPR-Cas9 была впервые проведена у человека, а именно у пациента с редким заболеванием — амаврозом Лебера (тип 10), который приводит к развитию слепоты у детей и в настоящее время не поддается лечению никакими другими методами. В данном случае генная терапия была использована для удаления в соответствующем гене (CEP290) мутации, вызывающей амавроз Лебера.
Вместе с тем технология CRISPR-Cas9 получила и порцию критики — из-за затяжных (и все еще не закончившихся) патентных тяжб и этических споров о «детях на заказ». По словам профессора Колледжа права Иллинойского университета в Урбане-Шампейне (США) Джейкоба C. Шеркова, это подтверждает тот факт, что CRISPR-Cas9 является «важнейшим достижением в области биотехнологий за последние 40 лет». «Эта технология позволяет ученым, исследователям и разработчикам точно редактировать геном живой клетки. Другими словами, можно редактировать программное обеспечение, которое делает нас живыми», — добавляет он.
Ответственный подход к разработкам
Оба нобелевских лауреата еще на раннем этапе осознали значение своего открытия. Профессор Дудна рассказала о том, что к 2014 г. она стала ощущать все большую необходимость проведения широкого обсуждения этических аспектов. В начале 2020 г. она заявила корреспонденту газеты Financial Times: «Мы должны думать о более широких последствиях этой грандиозной технологии и о том, как использовать ее возможности ответственным образом». При содействии профессора Дудны был создан Институт инновационной геномики в Беркли (Калифорния, США), ректором и председателем правления которого она в настоящее время является. Задачи института заключаются в повышении осведомленности широкой общественности, предоставлении ресурсов широкому кругу субъектов и установлении ориентиров для этичного использования генных технологий.
Этические вопросы вышли на передний план в ноябре 2018 г., когда китайский ученый Хэ Цзянькуй объявил, что использовал технологию CRISPR-Cas9 в ходе эксперимента по рождению девочек-близнецов с отредактированным геномом. Другие ученые осудили это исследование, в том числе профессор Дудна, которая сразу же прилетела в Гонконг (САР) для проведения расследования. Впоследствии Хэ Цзянькуй был уволен из университета, в котором работал, оштрафован и приговорен к трем годам лишения свободы.
Другие ученые осудили это исследование, в том числе профессор Дудна, которая сразу же прилетела в Гонконг (САР) для проведения расследования. Впоследствии Хэ Цзянькуй был уволен из университета, в котором работал, оштрафован и приговорен к трем годам лишения свободы.
Манипуляции с геномом более не представляют трудностей при проведении экспериментов.
Это был из ряда вон выходящий случай: исследование Хэ Цзянькуя не было регламентировано, а его результаты не были опубликованы и вообще вызывают сомнение с научной точки зрения (к его заявлению о том, что генетически модифицированные эмбрионы будут невосприимчивы к ВИЧ, отнеслись с изрядным скептицизмом). Профессор Шерков отмечает, что этические споры о редактировании человеческих эмбрионов с целью предотвратить генетические заболевания или добиться определенных черт не являются чем-то новым и ведутся с момента появления экстракорпорального оплодотворения (ЭКО) в 1970-х гг. «Некоторые опасения по поводу CRISPR-Cas9 сильно преувеличены. Эта технология не так уж и отличается от методов, используемых в настоящее время», — отмечает он.
Эта технология не так уж и отличается от методов, используемых в настоящее время», — отмечает он.
С ним согласна и доктор Лидделл, которая отмечает следующее: «Например, у нас, в Соединенном Королевстве, имеется опыт широкого, прагматичного обсуждения спорных с этической точки зрения вопросов, таких как ЭКО и пренатальный скрининг. Важно внимательно изучить аргументы о том, действительно ли редактирование унаследованных генов наносит реальный вред обществу или общечеловеческим ценностям». Во многих странах (включая Соединенное Королевство) исследования в области экстракорпорального оплодотворения регулируются тем или иным государственным органом, что позволяет обсуждать и решать новые вопросы по мере их возникновения.
Роль патентной системы
Этические вопросы, возникающие в связи с CRISPR-Cas9, не ограничиваются редактированием зародышевой линии человека. Возможность использования данной технологии для преобразования биологических систем порождает следующие вопросы: кто должен решать, каким образом и кем эта технология может использоваться и какие способы ее применения безопасны и социально приемлемы; каким исследованиям необходимо отдавать приоритет; как обеспечить справедливый доступ к передовым терапевтическим средствам, один курс лечения которыми может стоить миллионы долларов, особенно в финансируемых государством системах здравоохранения; каковы социально-экономические последствия модификации генов сельскохозяйственных или энергетических культур для фермеров и сельскохозяйственных рабочих и какое влияние такое использование этой технологии окажет на экологические системы.
Некоторые из этих вопросов неизбежно касаются роли патентной системы, которая призвана стимулировать инновации на благо всего общества. За последнее десятилетие ученые подали тысячи патентных заявок, связанных с технологией CRISPR, что свидетельствует о важности патентов в привлечении и стимулировании инвестиций в научные исследования и технологические разработки. Как сказала сама профессор Дудна: «Создан огромный пласт ИС [интеллектуальной собственности]. Интересно, во что все это выльется в будущем, когда у нас появятся реально полезные продукты». Компания MPEG LA, занимающаяся лицензированием использования стандартов, предложила даже создать совместную платформу для лицензирования CRISPR-Cas9 (патентный пул) в целях расширения доступа к соответствующим запатентованным технологиям.
Хронология исследований
1953 г.: Фрэнсис Крик и Джеймс Уотсон устанавливают молекулярную структуру ДНК.
1987 г.: Йоcидзуми Исино обнаруживает повторяющиеся структуры в ДНК прокариотов.
1993 г.: Франсиско Хуан Мартинес Мохика придумывает термин «CRISPR».
2005 г.: Мохика выдвигает предположение о том, что CRISPR обеспечивает защиту от внедрения чужеродной ДНК.
2008 г.: Эрик Сонтеймер и Лучано Маррафинни определяют, что механизм CRISPR представляет собой инструмент для редактирования генов.
Весна 2011 г.: микробиолог Эмманюэль Шарпантье и биохимик Дженнифер Дудна проводят встречу во время конференции в Пуэрто-Рико и впервые обсуждают CRISPR-Cas9.
Июнь 2012 г.: профессор Шарпантье и профессор Дудна вместе с другими исследователями публикуют в журнале Science результаты своего исследования под названием «Программируемая двойная-РНК-направляемая эндонуклеаза ДНК в адаптивном иммунитете бактерий» (A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity).
Март 2013 г.: Венский университет и Калифорнийский университет подают в США заявку на патент под названием «Способы и композиции для направляемой РНК целевой модификации ДНК и для направляемой РНК модуляции транскрипции» (Methods and compositions for RNA-directed target DNA modification and for RNA-directed modulation of transcription) (дата приоритета — 25 мая 2012 г. ). В числе изобретателей указаны профессор Шарпантье и профессор Дудна.
). В числе изобретателей указаны профессор Шарпантье и профессор Дудна.
Декабрь 2012 г.: Фэн Чжан из Института Бродов публикует статью, демонстрирующую, что CRISPR работает в клетках эукариотов, а затем подает заявки на патенты в США. В ВПТЗ США начинается серия разбирательств между Калифорнийским университетом в Беркли и Институтом Бродов по делу о столкновении патентных притязаний, последнее решение по которому опубликовано в сентябре 2020 г.
Октябрь 2020 г.: профессор Шарпантье и профессор Дудна удостоены Нобелевской премии по химии «за разработку метода редактирования генома».
И грянут патентные битвы
Профессор Шарпантье и профессор Дудна подали первую заявку в США в 2013 г., и на основании Договора о патентной кооперации (опубликован под условным обозначением WO/2013/176772) ее действие распространяется на многие другие страны. С 2015 г. Калифорнийский университет в Беркли и Венский университет (заявители на получение патента) ведут в Ведомстве США по патентам и товарным знакам (ВПТЗ США) спор по делу о столкновении патентных притязаний с Институтом Бродов (США) с целью определить, является ли заявка последнего действительной.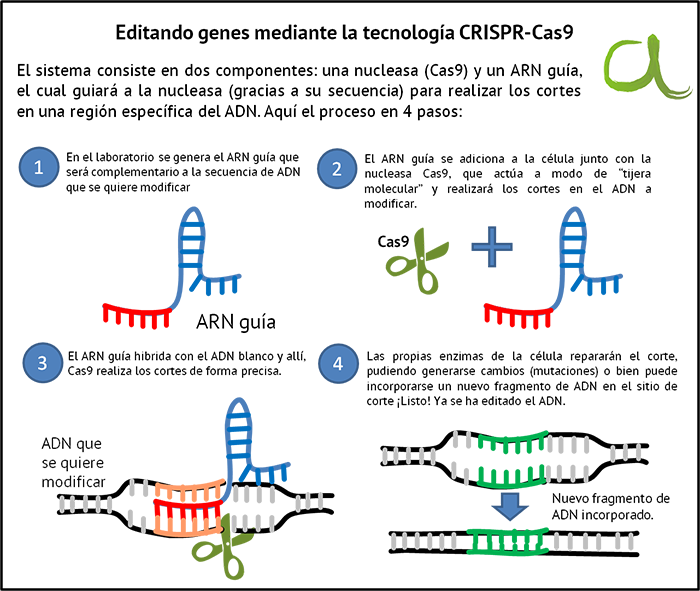 Споры между ними ведутся и в других юрисдикциях. Эти споры все еще рассматриваются, что, по словам профессора Шеркова, повышает вероятность дальнейших судебных разбирательств. «Один из основных вопросов заключается в том, почему эти споры не урегулированы и кто не желает их урегулирования. Ставки очень высоки, и мы еще можем увидеть масштабное разбирательство относительно того, кто первым придумал “единую направляющую РНК”, и различные ученые будут в этом разбирательстве свидетелями», — отмечает Шерков.
Споры между ними ведутся и в других юрисдикциях. Эти споры все еще рассматриваются, что, по словам профессора Шеркова, повышает вероятность дальнейших судебных разбирательств. «Один из основных вопросов заключается в том, почему эти споры не урегулированы и кто не желает их урегулирования. Ставки очень высоки, и мы еще можем увидеть масштабное разбирательство относительно того, кто первым придумал “единую направляющую РНК”, и различные ученые будут в этом разбирательстве свидетелями», — отмечает Шерков.
До сих пор, что может показаться удивительным, патентные споры касались широты охраны и приоритета, а не патентоспособности объектов. По словам директора Научно-исследовательского института интеллектуальной собственности Королевы Марии Лондонского университета (Соединенное Королевство) профессора Дункана Мэтьюса патентная система является «частью механизма регулирования технологий», таких как CRISPR-Cas9. В частности, во многих законах о патентах предусмотрена возможность признания изобретения непатентоспособным в случае нарушения принципов морали или общественного порядка. Соответствующие положения определены в национальном патентном законодательстве и рассматриваются в документе , подготовленном Постоянным комитетом ВОИС по патентному праву (последнее обновление — в апреле 2020 г.). «Я считаю, что патентные эксперты Европейского патентного ведомства, которое применяет положение о признании изобретения непатентоспособным в случае нарушения принципов морали, отлично работают, не отклоняя заявки полностью, а принимая притязания на комбинации или векторные системы (способы доставки) для редактирования генома. Они следуют букве закона», — отмечает профессор Мэттьюс, который создал экспертную группу по патентам и редактированию генома для изучения этого вопроса. «Что касается других патентных систем, то, возможно, еще слишком рано судить [как будут толковаться такие положения], и еще не было споров, касающихся признания изобретений непатентоспособными на том основании, что они нарушают принципы морали или представляют собой продукты природы».
Соответствующие положения определены в национальном патентном законодательстве и рассматриваются в документе , подготовленном Постоянным комитетом ВОИС по патентному праву (последнее обновление — в апреле 2020 г.). «Я считаю, что патентные эксперты Европейского патентного ведомства, которое применяет положение о признании изобретения непатентоспособным в случае нарушения принципов морали, отлично работают, не отклоняя заявки полностью, а принимая притязания на комбинации или векторные системы (способы доставки) для редактирования генома. Они следуют букве закона», — отмечает профессор Мэттьюс, который создал экспертную группу по патентам и редактированию генома для изучения этого вопроса. «Что касается других патентных систем, то, возможно, еще слишком рано судить [как будут толковаться такие положения], и еще не было споров, касающихся признания изобретений непатентоспособными на том основании, что они нарушают принципы морали или представляют собой продукты природы».
Мы должны думать о более широких последствиях этой грандиозной технологии и о том, как использовать ее возможности ответственным образом.
Дженнифер А. Дудна
Патенты в качестве механизма регулирования технологий
Профессор Мэттьюс считает, что в работе больше внимания следует уделять вопросу о том, должны ли патентные ведомства позволять патентовать изобретения в области генома: «До настоящего момента дебаты о редактировании генома человека, как правило, не касались патентов. Недавно я удостоился чести выступить перед Консультативным комитетом экспертов ВОЗ, который занимается вопросом о патентах в качестве части механизма регулирования редактирования генома человека». Международная группа экспертов ВОЗ была создана в декабре 2018 г., а в июле 2019 г. опубликовала заявление по вопросам контроля и надзора.
Профессор Мэттьюс отмечает, что патентная система может стать средством предотвращения недобросовестных исследований: «Патенты можно было бы использовать ответственным образом, чтобы не допустить бесконтрольного использования технологий с помощью системы оценки соответствия этическим нормам».
Открытие профессора Шарпантье и профессора Дудны показало, что молекулу ДНК можно «разрезать» в любой точке, используя для этого CRISPR — встроенный в ДНК бактерий естественный защитный механизм — и фермент Cas9. (Фото: © Йохан Йарнеcтад/Шведская королевская академия наук)
Смелый взгляд в будущее
Хотя непосвященным детали технологии редактирования генома могут показаться сложными, ученые говорят об относительной простоте инструмента CRISPR-Cas9, благодаря которой он стал доступен исследователям во всем мире в самых разных областях. По словам профессора Шеркова, «в течение последних нескольких лет стали набирать обороты академические исследования, посвященные CRISPR», несмотря на широко освещаемые патентные битвы. «Возможности CRISPR ограничены лишь человеческой фантазией», — отмечает он.
Огромный вклад в эти исследования внесли нобелевские лауреаты, и имя каждого их них фигурирует в десятках патентных заявок. Профессор Шарпантье лицензировала ИС биотехнологическим компаниям CRISPR Therapeutics и ERS Genomics, а профессор Дудна стала одним из учредителей компаний Caribou Biosciences, Intellia Therapeutics и Mammoth Biosciences.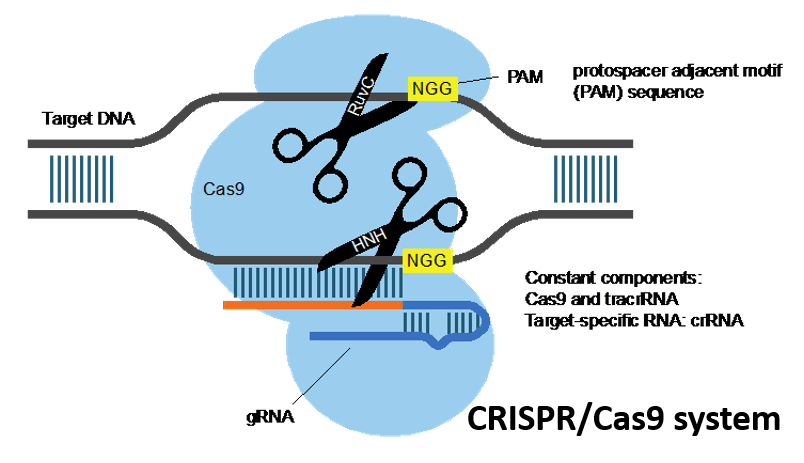 «Впервые в истории Нобелевскую премию по химии разделили две женщины, и они станут примером для подражания, особенно для увлеченных наукой девушек во всем мире», — говорит доктор Лидделл.
«Впервые в истории Нобелевскую премию по химии разделили две женщины, и они станут примером для подражания, особенно для увлеченных наукой девушек во всем мире», — говорит доктор Лидделл.
Возможности CRISPR ограничены лишь человеческой фантазией.
Джейкоб C. Шерков
Их работа вдохновила сотни других исследователей, опубликовавших статьи о применении CRISPR-Cas9 в различных организмах. Ученые исследуют потенциал и других систем, связанных с CRISPR, таких как Cas12a и Cas13, в том числе для диагностики и лечения COVID-19. В некоторых из этих исследований используются мощные инструменты на основе искусственного интеллекта, включая машинное обучение и глубокое обучение, с тем чтобы добиться большей предсказуемости и уменьшить вероятность побочных эффектов. Менее чем за 10 лет, прошедших после эпохального открытия профессора Шарпантье и профессора Дудны, уже удалось добиться огромных успехов, и, кажется, не за горами и другие достижения.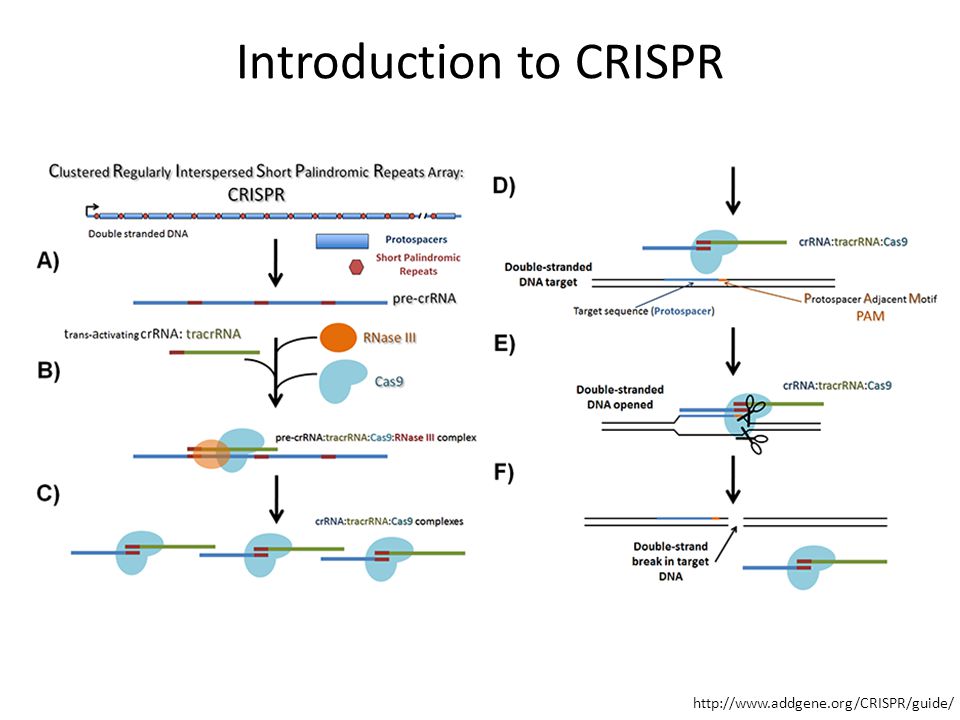
Что такое CRISPR? | New Scientist
Технология, которую можно использовать для редактирования генов
CRISPR — это технология, которую можно использовать для редактирования генов, и поэтому она, скорее всего, изменит мир.
Суть CRISPR проста: это способ найти определенный фрагмент ДНК внутри клетки. После этого следующим шагом редактирования гена CRISPR обычно является изменение этого фрагмента ДНК. Однако CRISPR также был адаптирован для других целей, таких как включение или выключение генов без изменения их последовательности.
Существовали способы редактирования геномов некоторых растений и животных до того, как в 2012 году был представлен метод CRISPR, но это заняло годы и стоило сотни тысяч долларов. CRISPR сделал это дешевым и простым.
CRISPR уже широко используется в научных исследованиях, и в недалеком будущем многие растения и животные на наших фермах, в садах или домах могут быть изменены с помощью CRISPR. На самом деле, некоторые люди уже едят CRISPR-продукты.
Реклама
Технология CRISPR также может изменить медицину, позволяя нам не только лечить, но и предотвращать многие заболевания. Мы можем даже решить использовать его для изменения геномов наших детей. Попытка сделать это в Китае была осуждена как преждевременная и неэтичная, но некоторые считают, что в будущем это может принести пользу детям.
CRISPR также используется для самых разных целей, от снятия отпечатков пальцев клеток и регистрации того, что происходит внутри них, до направления эволюции и создания генных драйвов.
Ключом к CRISPR является множество разновидностей белков «Cas», обнаруженных в бактериях, где они помогают защищаться от вирусов. Белок Cas9 наиболее широко используется учеными. Этот белок можно легко запрограммировать на поиск и связывание практически с любой желаемой последовательностью-мишенью, просто дав ему фрагмент РНК, который будет направлять его в поисках.
Когда белок CRISPR Cas9 добавляется в клетку вместе с фрагментом направляющей РНК, белок Cas9 соединяется с направляющей РНК и затем перемещается по цепям ДНК, пока не найдет и не свяжется с 20-буквенной ДНК длиной последовательность, совпадающая с частью последовательности направляющей РНК. Это впечатляет, учитывая, что ДНК, упакованная в каждую из наших клеток, состоит из шести миллиардов букв и имеет длину два метра.
Это впечатляет, учитывая, что ДНК, упакованная в каждую из наших клеток, состоит из шести миллиардов букв и имеет длину два метра.
Дальнейшие действия могут различаться. Стандартный белок Cas9 разрезает ДНК по мишени. Когда разрез восстанавливается, вводятся мутации, которые обычно отключают ген. Это, безусловно, наиболее распространенное использование CRISPR. Это называется редактированием генома или редактированием генов, но обычно результаты не так точны, как следует из этого термина.
CRISPR также можно использовать для внесения точных изменений, таких как замена неисправных генов — настоящее редактирование генома, — но это гораздо сложнее.
Были созданы специализированные белки Cas, которые не разрезают ДНК и не изменяют ее каким-либо образом, а просто включают или выключают гены: CRISPRa и CRISPRi соответственно. Третьи, называемые базовыми редакторами, меняют одну букву кода ДНК на другую.
Так почему же мы называем это CRISPR? Белки Cas используются бактериями для разрушения вирусной ДНК. Они добавляют фрагменты вирусной ДНК в свой собственный геном, чтобы управлять белками Cas, и необычные структуры этих фрагментов ДНК дали название CRISPR: сгруппированные короткие палиндромные повторы с регулярными промежутками. Michael Le Page
Они добавляют фрагменты вирусной ДНК в свой собственный геном, чтобы управлять белками Cas, и необычные структуры этих фрагментов ДНК дали название CRISPR: сгруппированные короткие палиндромные повторы с регулярными промежутками. Michael Le Page
Что такое CRISPR? | Живая наука
Что такое CRISPR?
CRISPR — это мощный инструмент для редактирования геномов, который позволяет исследователям легко изменять последовательности ДНК и изменять функции генов. Он имеет множество потенциальных применений, включая исправление генетических дефектов, лечение и предотвращение распространения болезней, а также улучшение роста и устойчивости сельскохозяйственных культур. Однако, несмотря на свои обещания, эта технология также вызывает этические проблемы.
В популярном использовании «CRISPR» (произносится как «четче») является сокращением от «CRISPR-Cas9». CRISPR — это специализированные участки ДНК , а белок Cas9 — где Cas означает «связанный с CRISPR» — представляет собой фермент , который действует как пара молекулярных ножниц, способных разрезать нити ДНК.
Технология CRISPR была адаптирована из механизмов естественной защиты бактерий и архей, домена относительно простых одноклеточных микроорганизмов. Эти организмы используют производные от CRISPR РНК , молекулярный родственник ДНК, и различные белки Cas для отражения атак вирусов . Чтобы предотвратить атаки, организмы измельчают ДНК вирусов, а затем встраивают фрагменты этой ДНК в свой собственный геном, чтобы использовать их в качестве оружия против чужеземных захватчиков, если эти вирусы снова атакуют.
Когда компоненты CRISPR переносятся в другие, более сложные организмы, эти компоненты затем могут манипулировать генами. Этот процесс называется «редактированием генов». Никто на самом деле не знал, как выглядит этот процесс до 2017 года, когда группа исследователей под руководством Микихиро Сибаты из Канадзавского университета в Японии и Хироши Нисимасу из Токийского университета впервые показала, как выглядит CRISPR. в действии, Живая наука ранее сообщала о .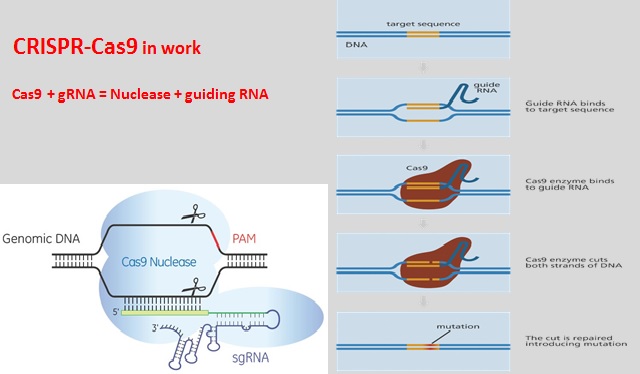
Связанные: Генетика в цифрах: 10 дразнящих историй
Ключевые компоненты CRISPR
ДНК представляет собой двухцепочечную молекулу, чьи «перекладины» состоят из одной пары дениновых оснований: с тимином или цитозином в паре с гуанином. (Изображение предоставлено Shutterstock)
(открывается в новой вкладке)
CRISPR: Термин «CRISPR» означает «кластеры регулярно расположенных коротких палиндромных повторов» и описывает область ДНК, состоящую из коротких повторяющихся последовательностей. с так называемыми «спейсерами», зажатыми между каждым повтором.
Когда мы говорим о повторах в генетическом коде, мы имеем в виду порядок ступеней в спиральной лестнице молекулы ДНК. Каждая ступенька содержит два связанных друг с другом химических основания: основание, называемое аденином (А), соединяется с другим основанием, называемым тимином (Т), а основание гуанин (G) соединяется с цитозином (С).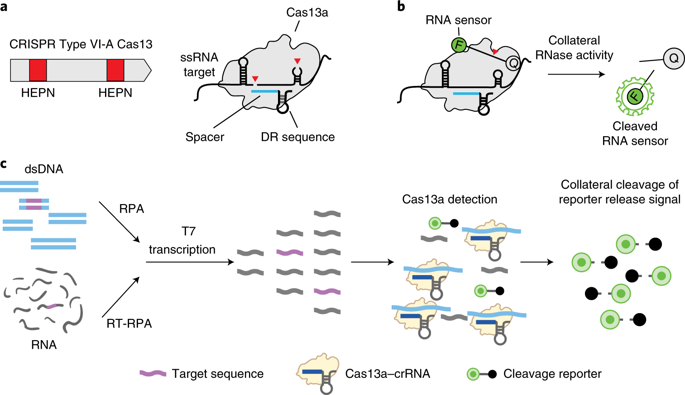
В области CRISPR эти основания появляются в одном и том же порядке несколько раз, и в этих повторяющихся сегментах они образуют так называемые «палиндромные» последовательности, согласно данным Института Макса Планка . Палиндром, как и слово «гоночная машина», читается одинаково вперед и назад; точно так же в палиндромной последовательности основания на одной стороне лестницы ДНК совпадают с основаниями на противоположной стороне, когда вы читаете их в противоположных направлениях.
Например, сверхпростая палиндромная последовательность может выглядеть так:
- Сторона 1 — GATC
- Сторона 2 — CTAG
Короткие палиндромные повторы появляются во всех областях CRISPR ДНК, причем каждый повтор замыкается «спейсерами». Бактерии стирают такие спейсеры с атаковавших их вирусов, то есть включают часть вирусной ДНК в свой собственный геном. Эти спейсеры служат банком воспоминаний, который позволяет бактериям распознавать вирусы, если они когда-либо снова атакуют. Вы также можете думать о разделителях, таких как плакаты «Разыскивается», на которых изображены плохие парни, чтобы их можно было легко обнаружить и привлечь к ответственности.
Вы также можете думать о разделителях, таких как плакаты «Разыскивается», на которых изображены плохие парни, чтобы их можно было легко обнаружить и привлечь к ответственности.
Родственный: Становление вирусным: 6 новых открытий о вирусах
Родольф Баррангу и группа исследователей из Danisco, компании по производству пищевых ингредиентов, впервые продемонстрировали этот процесс экспериментально. В статье 2007 года, опубликованной в журнале Science, исследователи использовали бактерию Streptococcus thermophilus , которая обычно встречается в йогурте и других молочных культурах, в качестве модели, согласно Объединенному институту генома 9.0042, часть Министерства энергетики США. Они заметили, что после вирусной атаки бактерии включили новые спейсеры в свои области CRISPR. Более того, последовательность ДНК этих спейсеров была идентична частям генома вируса.
Команда также манипулировала спейсерами, удаляя их и вставляя на их место новые последовательности вирусной ДНК. Таким образом, исследователи смогли изменить устойчивость бактерий к атаке определенного вируса, подтвердив роль CRISPR в регуляции бактериального иммунитета.
Таким образом, исследователи смогли изменить устойчивость бактерий к атаке определенного вируса, подтвердив роль CRISPR в регуляции бактериального иммунитета.
CRISPR РНК (crRNA) : участки ДНК CRISPR действуют как своего рода банк вирусной памяти; но для того, чтобы эта хранимая информация могла быть полезной в другом месте клетки, она должна быть скопирована или «транскрибирована» в другую генетическую молекулу, называемую РНК. В отличие от последовательностей ДНК, которые остаются внутри молекулы ДНК, эта РНК CRISPR (crРНК) может перемещаться по клетке и объединяться с белками — то есть молекулярными ножницами, разрезающими вирусы на кусочки.
РНК также отличается от ДНК тем, что состоит только из одной цепи, а не из двух, что означает, что она выглядит как половинка лестницы. Чтобы построить молекулу РНК, одна часть CRISPR действует как матрица, а белки, называемые полимеразами, набрасываются, чтобы построить молекулу РНК, которая является «комплементарной» к этой матрице, а это означает, что основания двух цепей будут соединяться вместе, как кусочки головоломки. Например, G в молекуле ДНК будет транскрибироваться как C в РНК.
Например, G в молекуле ДНК будет транскрибироваться как C в РНК.
Каждый фрагмент РНК CRISPR содержит копию повтора и спейсер из области ДНК CRISPR, согласно обзору 2014 года Дженнифер Дудна и Эммануэль Шарпантье, опубликованному в журнале Science. КрРНК взаимодействует с белком Cas9 и другим типом РНК, называемым «трансактивирующей крРНК» или tracrРНК, чтобы помочь бактериям отбиваться от вирусов.
Cas9: Белок Cas9 представляет собой фермент, разрезающий чужеродную ДНК. Белок связывается с crРНК и tracrРНК, которые вместе направляют Cas9.к целевому участку на цепи ДНК вируса, где белок сделает свой разрез. ДНК-мишень, которую разрезает Cas9, комплементарна 20-нуклеотидному участку crРНК, где «нуклеотид» представляет собой строительный блок ДНК, содержащий одно основание.
Используя две отдельные области или «домены» в своей структуре, Cas9 разрезает обе нити двойной спирали ДНК, создавая так называемый «двухцепочечный разрыв», согласно статье Science 2014 года.
Имеется встроенный предохранительный механизм, гарантирующий, что Cas9не просто разрезает где-нибудь в геноме. Короткие последовательности ДНК, известные как «мотивы, прилегающие к протоспейсерам» или PAM, служат в качестве меток и располагаются рядом с последовательностью ДНК-мишени. Если комплекс Cas9 не увидит PAM рядом со своей последовательностью ДНК-мишенью, он не будет разрезаться. Это одна из возможных причин того, что Cas9 никогда не атакует область CRISPR у бактерий, согласно обзору 2014 года, опубликованному в Nature Biotechnology (открывается в новой вкладке).
Как CRISPR работает как инструмент редактирования генома
Вот описание того, как работает редактирование генов Crispr. (Изображение предоставлено: ttz через Getty Images)
(открывается в новой вкладке)
Геномы кодируют серию сообщений и инструкций в своих последовательностях ДНК, а редактирование генома включает изменение этих последовательностей, тем самым изменяя содержащиеся в них сообщения.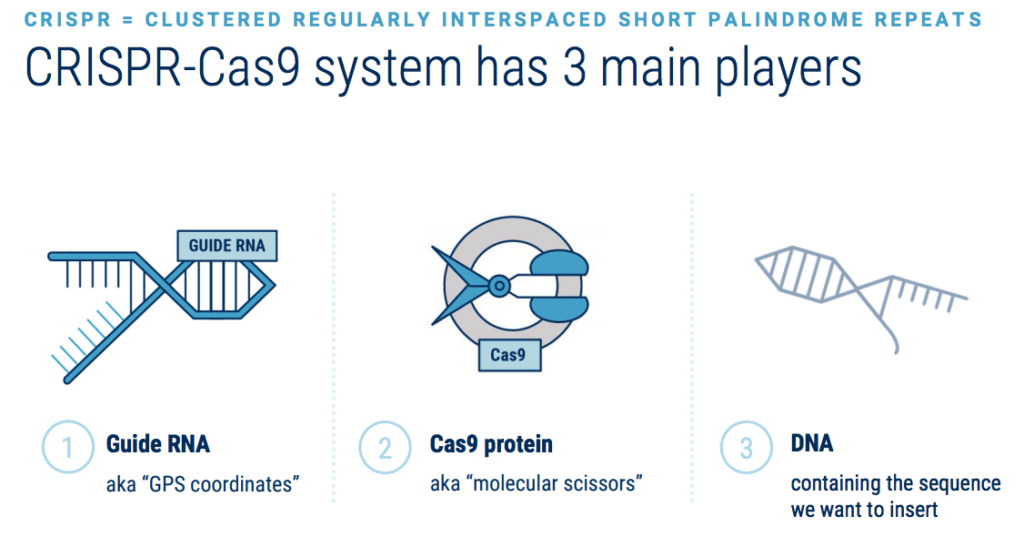 Это можно сделать, вставив разрез или разрыв в ДНК и обманув естественные механизмы восстановления ДНК клетки, чтобы внести целевые изменения. CRISPR-Cas9 предоставляет для этого средства.
Это можно сделать, вставив разрез или разрыв в ДНК и обманув естественные механизмы восстановления ДНК клетки, чтобы внести целевые изменения. CRISPR-Cas9 предоставляет для этого средства.
В 2012 году в журналах Science и PNAS были опубликованы две основные исследовательские статьи , в которых описывалось, как бактериальный CRISPR-Cas9 можно использовать для измельчения любой ДНК, а не только ДНК вирусов. Таким образом, природную систему CRISPR можно превратить в простой программируемый инструмент редактирования генома.
Чтобы заставить Cas9 отрезать определенный участок ДНК, ученые могут просто изменить последовательность crРНК, которая связывается с комплементарной последовательностью в ДНК-мишени, заключили исследования. В статье Science 2012 года Мартин Джинек и его коллеги далее упростили систему, объединив crRNA и tracrRNA для создания единой «направляющей РНК». Таким образом, для редактирования генома требуется всего два компонента: направляющая РНК и Cas9. белок.
белок.
«Оперативно вы создаете участок из 20 пар оснований, который соответствует гену, который вы хотите отредактировать», и исходя из этого можно выяснить, какой будет комплементарная последовательность крРНК, Джордж Черч, профессор генетики в Гарвардском медицинском университете. Школа, рассказала Live Science. Черч подчеркнул важность обеспечения того, чтобы нуклеотидная последовательность находилась только в гене-мишени и больше нигде в геноме.
«Тогда РНК плюс белок [Cas9] разрежут — как ножницы — ДНК в этом месте и, в идеале, нигде больше», — объяснил Черч. Как только ДНК разрезается, вступают в действие естественные механизмы восстановления клетки, которые работают, чтобы собрать ДНК воедино, и в этот момент в геном можно внести изменения. Это может произойти двумя способами:
Согласно проекту Huntington’s Outreach Project в Стэнфордском университете , один из методов ремонта заключается в склеивании двух порезов. Этот метод, известный как «негомологичное соединение концов», имеет тенденцию вносить ошибки, когда нуклеотиды случайно вставляются или удаляются, что приводит к мутациям, которые могут нарушить работу гена.
Во втором методе разрыв фиксируется путем заполнения пробела последовательностью нуклеотидов. Для этого клетка использует короткую нить ДНК в качестве матрицы. Ученые могут предоставить шаблон ДНК по своему выбору, тем самым вписав любой ген, который они хотят, или исправив мутацию.
Кто открыл CRISPR?
Исследователи впервые обнаружили характерные нуклеотидные повторы и спейсеры Crisprs в кишечных бактериях под названием E. Coli, показанных здесь в виде кластера на изображении, полученном с помощью сканирующей электронной микрофотографии. (Изображение предоставлено: Callista Images/Getty Images)
(открывается в новой вкладке)
Ученые впервые обнаружили CRISPR в бактериях в 1987 году, но изначально они не понимали биологического значения последовательностей ДНК, и они еще не поняли этого. назовите их «CRISPR», согласно Quanta Magazine (открывается в новой вкладке). Йошизуми Ишино и его коллеги из Университета Осаки в Японии впервые обнаружили характерные нуклеотидные повторы и спейсеры в кишечном микробе Escherichia coli , а по мере совершенствования технологии генетического анализа в 1990-х годах другие исследователи обнаружили CRISPR во многих других микробах.
Франсиско Мохика, ученый из Университета Аликанте в Испании, первым описал отличительные характеристики CRISPR и обнаружил последовательности у 20 различных микробов, согласно отчет за 2016 год (открывается в новой вкладке) в журнале Cell. В какой-то момент он назвал последовательности «короткими регулярно расположенными повторами» (SRSR), но позже предложил вместо этого называть их CRISPR. Термин CRISPR впервые появился в отчете 2002 года, опубликованном в журнале Molecular Microbiology и написанном Руудом Янсеном из Утрехтского университета, с которым Мохика вел переписку.
В последующие годы ученые также открыли гены Cas и функцию ферментов Cas, и они выяснили, что спейсеры в CRISPR происходят от инвазивных вирусов, сообщает Quanta.
Среди этих новаторских исследователей была Дженнифер Дудна, профессор биохимии, биофизики и структурной биологии Калифорнийского университета в Беркли, которая впоследствии разделила Нобелевскую премию по химии 2020 года с Эммануэль Шарпантье, директором подразделения Макса Планка.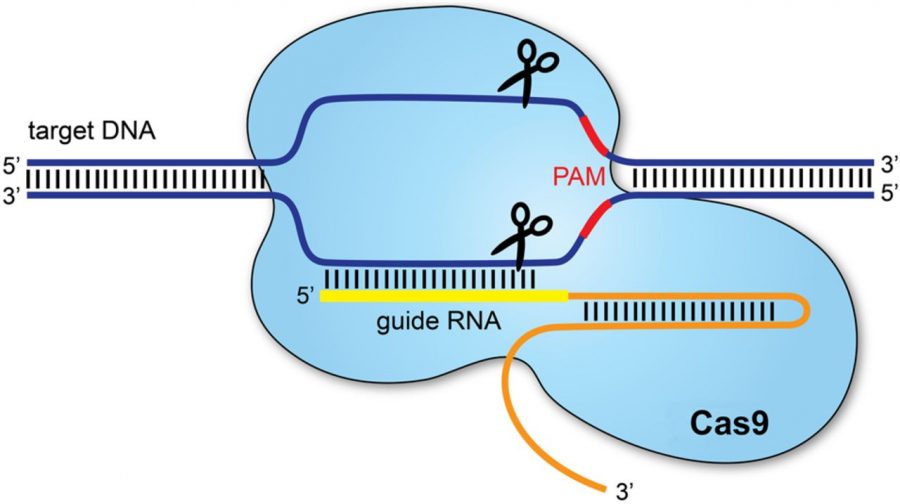 для науки о патогенах. Ранее Live Science сообщала, что двум ученым приписывают адаптацию бактериальной системы CRISPR/Cas в удобный инструмент для редактирования генов.
для науки о патогенах. Ранее Live Science сообщала, что двум ученым приписывают адаптацию бактериальной системы CRISPR/Cas в удобный инструмент для редактирования генов.
Связанные: Нобелевская премия по химии: с 1901 г. по настоящее время
Шарпантье впервые открыл tracrRNA при изучении бактерий Streptococcus pyogenes , которые вызывают ряд заболеваний от тонзиллита до сепсиса. Обнаружив tracrRNA как ранее неизвестный компонент системы CRISPR/Cas, Шарпантье начал сотрудничать с Дудной, чтобы воссоздать эту систему в пробирке. В 2012 году команда опубликовала свою основополагающую работу в журнале Science, объявив, что они успешно упростили молекулярные ножницы до инструмента для редактирования генов.
Некоторые считали, что биохимик Фэн Чжан из Института Броуда также может получить Нобелевскую премию за свою отдельную работу с системой CRISPR, журнал Science Magazine сообщил . Чжан продемонстрировал, что система CRISPR работает в клетках млекопитающих, и на основе этой работы Институт Броуда получил первый патент на использование технологии редактирования генов CRISPR в эукариотах или сложных клетках с ядрами, содержащими их ДНК.
Как используется CRISPR?
(Изображение предоставлено: KEITH CHAMBERS/SCIENCE PHOTO LIBRARY через Getty Images)
(открывается в новой вкладке)
В 2013 году исследователи в лабораториях Черча и Чжан опубликовали первые отчеты, описывающие использование CRISPR-Cas9 для редактирования человека клеток в экспериментальных условиях. Исследования, проведенные в лабораторных чашках и на животных моделях заболеваний человека, продемонстрировали, что технология может эффективно исправлять генетические дефекты. Примеры таких заболеваний включают муковисцидоз, катаракту и анемию Фанкони, согласно — обзорная статья за 2016 год (откроется в новой вкладке), опубликованная в журнале Nature Biotechnology. Эти исследования проложили путь для терапевтического применения у людей.
В области медицины CRISPR прошел клинические испытания на ранней стадии в качестве терапии рака и лечения наследственного заболевания, вызывающего слепоту.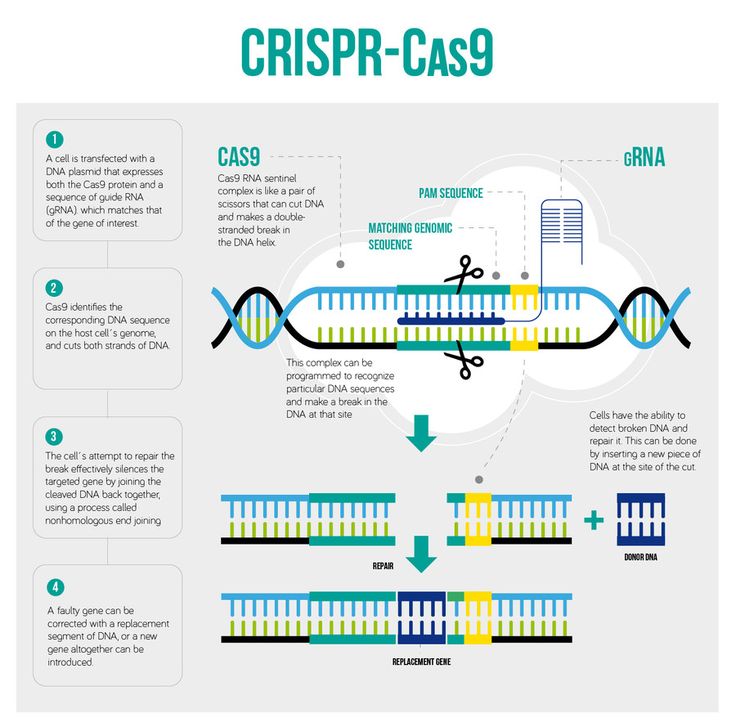 Его также исследовали как стратегию предотвращения распространения болезни Лайма и малярии от вирусных векторов к людям, а также изучали на животных моделях ВИЧ как способ избавить инфицированные клетки от вируса, Живая наука ранее сообщала о . Одна исследовательская группа в Китае попыталась вылечить ВИЧ пациента-человека с помощью CRISPR, и хотя лечение не помогло вылечить инфекцию, генная терапия также не вызвала никаких вредных последствий, сообщает Live Science .
Его также исследовали как стратегию предотвращения распространения болезни Лайма и малярии от вирусных векторов к людям, а также изучали на животных моделях ВИЧ как способ избавить инфицированные клетки от вируса, Живая наука ранее сообщала о . Одна исследовательская группа в Китае попыталась вылечить ВИЧ пациента-человека с помощью CRISPR, и хотя лечение не помогло вылечить инфекцию, генная терапия также не вызвала никаких вредных последствий, сообщает Live Science .
«Я думаю, что общественное восприятие CRISPR очень сосредоточено на идее клинического использования редактирования генов для лечения болезней», — сказал Невилл Санджана из Нью-Йоркского центра генома и доцент кафедры биологии, неврологии и физиологии в Нью-Йоркском университете. «Это, без сомнения, захватывающая возможность, но это только один маленький кусочек».
Связанный: 10 удивительных вещей, которые только что сделали ученые с CRISPR
Технология CRISPR также применялась в пищевой и сельскохозяйственной промышленности для создания пробиотических культур и для вакцинации промышленных культур (например, йогурта) против вирусов. Он также используется в сельскохозяйственных культурах для повышения урожайности, засухоустойчивости и питательных свойств.
Он также используется в сельскохозяйственных культурах для повышения урожайности, засухоустойчивости и питательных свойств.
Еще одним потенциальным применением является создание генных драйвов , метода генной инженерии, который увеличивает шансы передачи определенного признака от родителя к потомству; Этот вид генной инженерии основан на природном явлении, при котором более вероятно наследование определенных версий генов. В конце концов, в течение поколений этот признак распространяется на целые популяции, согласно Институт Висса . Согласно отчету 2014 года, опубликованному в журнале Science , генные драйвы могут использоваться для различных целей, таких как искоренение инвазивных видов или изменение устойчивости сельскохозяйственных культур к пестицидам и гербицидам.
Во время пандемии COVID-19 система CRISPR-Cas9 использовалась для разработки различных диагностических тестов на вирусную инфекцию, сообщает BBC News .
Кроме того, в последнее время CRISPR используется в следующих целях:
- В апреле 2017 года группа исследователей опубликовала в журнале Science исследование о том, что они запрограммировали молекулу CRISPR для обнаружения штаммов вирусов, таких как вирус Зика, в сыворотке крови, моче и слюне.

- 2 августа 2017 года ученые сообщили в журнале Nature, что они успешно удалили порок сердца у эмбриона с помощью CRISPR.
- 2 января 2018 года исследователи объявили, что они могут остановить грибки и другие проблемы, которые угрожают производству шоколада, используя CRISPR, чтобы сделать растения более устойчивыми к болезням.
- Согласно исследованию, опубликованному журналом BioNews, 16 апреля 2018 года исследователи модернизировали CRISPR, чтобы редактировать тысячи генов одновременно.
Однако, несмотря на широкий спектр применения, инструмент не лишен недостатков.
«Я думаю, что самым большим ограничением CRISPR является то, что он не на сто процентов эффективен», — сказал Черч в интервью Live Science. Это означает, что в данном эксперименте CRISPR может успешно отредактировать только часть ДНК-мишени. Согласно статье Дудны и Шарпантье в Science 2014 года, в исследовании, проведенном на рисе, редактирование генов произошло почти в 50% клеток, получивших Cas9. -РНК комплекс. Между тем, другие исследования показали, что в зависимости от цели эффективность редактирования может достигать 80% и более.
-РНК комплекс. Между тем, другие исследования показали, что в зависимости от цели эффективность редактирования может достигать 80% и более.
Эта технология также может создавать «нецелевые эффекты», когда ДНК разрезается в местах, отличных от намеченной цели. Это может привести к введению непреднамеренных мутаций. Кроме того, отметил Черч, даже когда система попадает в цель, есть вероятность, что редактирование не будет точным. Он назвал это «геномным вандализмом».
Потенциальные риски и этические проблемы использования CRISPR
Множество потенциальных применений технологии CRISPR поднимают вопросы об этических достоинствах и последствиях вмешательства в геномы. В частности, множество этических дебатов разгорелось в 2018 году, когда Хэ Цзянькуй, бывший биофизик Южного университета науки и технологии в Шэньчжэне, объявил, что его команда отредактировала ДНК человеческих эмбрионов и таким образом создала первый в мире отредактированный геном дети.
Впоследствии он был приговорен к трем годам тюремного заключения и оштрафован на 3 миллиона юаней (560 000 долларов США) за медицинскую практику без лицензии, нарушение китайских правил репродуктивных технологий с помощью человека и фабрикацию документов этического обзора, Живая наука ранее сообщала о . Но даже после вынесения приговора эксперименты Хэ вызвали вопросы о том, как следует регулировать использование CRISPR в будущем, особенно с учетом того, что эта технология все еще довольно нова.
Но даже после вынесения приговора эксперименты Хэ вызвали вопросы о том, как следует регулировать использование CRISPR в будущем, особенно с учетом того, что эта технология все еще довольно нова.
Связанный: Вот что мы знаем о безопасности CRISPR
Незаконные эксперименты на человеческих эмбрионах, конечно, представляют собой крайне неправильное использование CRISPR, но даже кажущееся этичным использование технологии может быть сопряжено с риском, говорят ученые.
Как правило, внесение генетических модификаций в человеческие эмбрионы и репродуктивные клетки, такие как сперматозоиды и яйцеклетки, известно как редактирование зародышевой линии. Поскольку изменения в этих клетках могут передаваться последующим поколениям, использование технологии CRISPR для внесения изменений в зародышевую линию вызвало ряд этических проблем.
Переменная эффективность, нецелевые эффекты и неточное редактирование — все это создает риски для безопасности.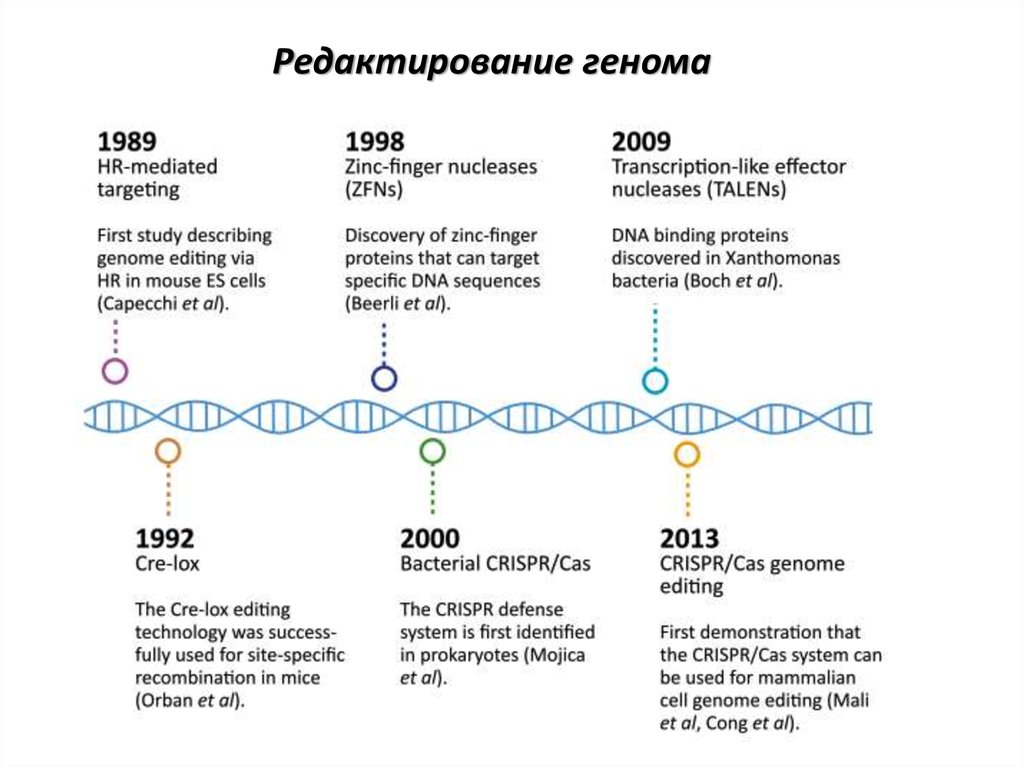 Кроме того, есть многое, что до сих пор неизвестно научному сообществу. В a 2015 статья , опубликованном в журнале Science, Дэвид Балтимор и группа ученых, специалистов по этике и юристов отмечают, что редактирование зародышевой линии повышает вероятность непредвиденных последствий для будущих поколений, «потому что наши знания о генетике человека, взаимодействии генов и окружающей среды ограничены». заболевания (включая взаимодействие между одним заболеванием и другими состояниями или заболеваниями у одного и того же пациента)».
Кроме того, есть многое, что до сих пор неизвестно научному сообществу. В a 2015 статья , опубликованном в журнале Science, Дэвид Балтимор и группа ученых, специалистов по этике и юристов отмечают, что редактирование зародышевой линии повышает вероятность непредвиденных последствий для будущих поколений, «потому что наши знания о генетике человека, взаимодействии генов и окружающей среды ограничены». заболевания (включая взаимодействие между одним заболеванием и другими состояниями или заболеваниями у одного и того же пациента)».
В статье Science 2014 года Ойе и его коллеги указывают на потенциальные экологические последствия использования генных драйвов. Внедренный признак может распространяться за пределы целевой популяции на другие организмы посредством скрещивания. Генные драйвы также могут снизить генетическое разнообразие целевой популяции, что может снизить ее способность к выживанию.
Другие этические проблемы более тонкие. Должны ли мы вносить изменения, которые могут коренным образом повлиять на будущие поколения, без их согласия? Что, если использование редактирования зародышевой линии превратится из терапевтического инструмента в инструмент улучшения различных характеристик человека?
Чтобы решить эти проблемы, Национальные академии наук, инженерии и медицины составили всеобъемлющий отчет с рекомендациями и рекомендациями по редактированию генома.
Хотя Национальные академии призывают к осторожности при редактировании зародышевой линии, они подчеркивают, что «осторожность не означает запрет». Они рекомендуют проводить редактирование зародышевой линии только тех генов, которые приводят к серьезным заболеваниям, и только тогда, когда нет других разумных альтернатив лечения. Среди других критериев они подчеркивают необходимость сбора данных о рисках и преимуществах для здоровья и постоянного наблюдения за клиническими испытаниями. Они также рекомендуют, чтобы после завершения испытания его организаторы связались с семьями участников на протяжении нескольких поколений, чтобы увидеть, какие изменения сохраняются в геноме с течением времени.
Дополнительные ресурсы
- Посмотрите анимацию из TEDEd , чтобы узнать, как CRISPR позволяет ученым редактировать ДНК.
- Послушайте, как Дженнифер Дудна прочтет свою Нобелевскую лекцию после получения премии в 2020 году.
Эта статья включает дополнительный отчет Алины Брэдфорд, автора Live Science.

 Если в 2011 году было опубликовано всего 100 работ о ней, то к 2017 году эта цифра достигла более 14 000.
Если в 2011 году было опубликовано всего 100 работ о ней, то к 2017 году эта цифра достигла более 14 000.
