Содержание
Анализ выдыхаемого воздуха в диагностике сердечно-сосудистых заболеваний | Быкова
1. Organisation mondiale de la santé. Global status report on noncommunicable diseases 2014: attaining the nine global noncommunicable diseases targets; a shared responsibility. — Geneva: World Health Organization; 298 с. ISBN 978-92-4-156485-4
2. Копылов Ф. Ю., Сыркин А. Л., Чомахидзе П. Ш., Быкова А. А., Шалтаева Ю. Р., Беляков В. В. и др. Перспективы диагностики различных заболеваний по составу выдыхаемого воздуха. Клиническая медицина. 2013;91(10):16–21
3. Amann A, Miekisch W, Schubert J, Buszewski B, Ligor T, Jezierski T et al. Analysis of Exhaled Breath for Disease Detection. Annual Review of Analytical Chemistry. 2014;7(1):455–82. DOI: 10.1146/annurev-anchem-071213-020043
4. Вакс В. Л., Домрачева Е. Г., Собакинская Е. А., Черняева М. Б. Анализ выдыхаемого воздуха: физические методы, приборы и медицинская диагностика. Успехи физических наук. 2014;184(7):739–58. DOI: 10.3367/UFNr. 0184.201407d.0739
0184.201407d.0739
5. Карабиненко А. А., Петренко Ю. М., Ильченко Л. Ю., Надеждинский А. И., Понуровский Я. Я., Преснова Е. Д. и др. Феномены, обнаруживаемые методом диодно-лазерной спектрометрии газообразных метаболитов выдыхаемого воздуха человека при его различных функциональных состояниях. Wschodnioeuropejskie Czasopismo Naukowe (East European Scientific Journal). 2018;1-1(29):30–9
6. Золин П. П., Конвай В. Д. Измерение включения изотопной метки в выдыхаемый CO2. Биомедицина. 2017;3:60–70
7. Weitz ZW, Birnbaum AJ, Sobotka PA, Zarling EJ, Skosey JL. High breath pentane concentrations during acute myocardial infarction. Lancet (London, England). 1991;337(8747):933–5. PMID: 1678029
8. Samara MA, Tang WHW, Cikach F, Gul Z, Tranchito L, Paschke KM et al. Single Exhaled Breath Metabolomic Analysis Identifies Unique Breathprint in Patients With Acute Decompensated Heart Failure. Journal of the American College of Cardiology. 2013;61(13):1463–4. DOI: 10.1016/j.jacc.2012. 12.033
12.033
9. Pabst F, Miekisch W, Fuchs P, Kischkel S, Schubert JK. Monitoring of oxidative and metabolic stress during cardiac surgery by means of breath biomarkers: an observational study. Journal of Cardiothoracic Surgery. 2007;2(1):37. DOI: 10.1186/1749-8090-2-37
10. Phillips M, Boehmer JP, Cataneo RN, Cheema T, Eisen HJ, Fallon JT et al. Heart allograft rejection: detection with breath alkanes in low levels (the HARDBALL study). The Journal of Heart and Lung Transplantation: The Official Publication of the International Society for Heart Transplantation. 2004;23(6):701–8. PMID: 15366430
11. King J, Kupferthaler A, Unterkofler K, Koc H, Teschl S, Teschl G et al. Isoprene and acetone concentration profiles during exercise on an ergometer. Journal of Breath Research. 2009;3(2):027006. DOI: 10.1088/1752-7155/3/2/027006
12. Karl T, Prazeller P, Mayr D, Jordan A, Rieder J, Fall R et al. Human breath isoprene and its relation to blood cholesterol levels: new measurements and modeling.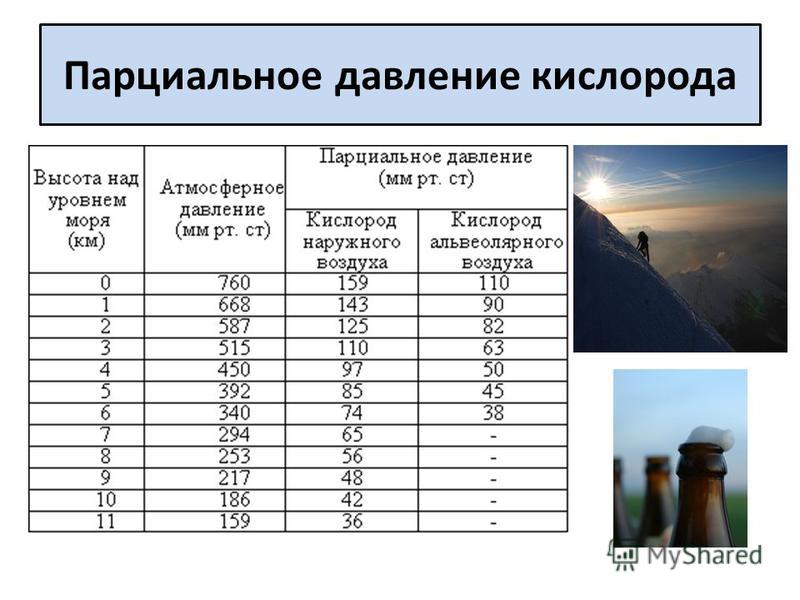 Journal of Applied Physiology. 2001;91(2):762–70. DOI: 10.1152/jappl.2001.91.2.762
Journal of Applied Physiology. 2001;91(2):762–70. DOI: 10.1152/jappl.2001.91.2.762
13. Mendis S, Sobotka PA, Euler DE. Expired hydrocarbons in patients with acute myocardial infarction. Free Radical Research. 1995;23(2):117–22. PMID: 7581809
14. McGrath LT, Patrick R, Silke B. Breath isoprene in patients with heart failure. European Journal of Heart Failure. 2001;3(4):423–7. PMID: 11511427
15. Bartelds B, van der Leij FR, Kuipers JR. Role of ketone bodies in perinatal myocardial energy metabolism. Biochemical Society Transactions. 2001;29(Pt 2):325–30. PMID: 11356176
16. Wende AR, Brahma MK, McGinnis GR, Young ME. Metabolic Origins of Heart Failure. JACC: Basic to Translational Science. 2017;2(3):297–310. DOI: 10.1016/j.jacbts.2016.11.009
17. Lommi J, Kupari M, Koskinen P, Näveri H, Leinonen H, Pulkki K et al. Blood ketone bodies in congestive heart failure. Journal of the American College of Cardiology. 1996;28(3):665–72. PMID: 8772754
18. Marcondes-Braga FG, Gutz IGR, Batista GL, Saldiva PHN, AyubFerreira SM, Issa VS et al. Exhaled Acetone as a New Biomarker of Heart Failure Severity. Chest. 2012;142(2):457–66. DOI: 10.1378/chest.11-2892
Exhaled Acetone as a New Biomarker of Heart Failure Severity. Chest. 2012;142(2):457–66. DOI: 10.1378/chest.11-2892
19. Marcondes-Braga FG, Batista GL, Gutz IGR, Saldiva PHN, Mangini S, Issa VS et al. Impact of Exhaled Breath Acetone in the Prognosis of Patients with Heart Failure with Reduced Ejection Fraction (HFrEF). One Year of Clinical Follow-up. PLOS ONE. 2016;11(12):e0168790. DOI: 10.1371/journal.pone.0168790
20. Yokokawa T, Sato T, Suzuki S, Oikawa M, Yoshihisa A, Kobayashi A et al. Elevated exhaled acetone concentration in stage C heart failure patients with diabetes mellitus. BMC Cardiovascular Disorders. 2017;17(1):280. DOI: 10.1186/s12872-017-0713-0
21. Bykova A. A., Kopylov Ph. Yu., Chomakhidze P. Sh., Malinovskaya L. K., Kuznetsova M. V., Betelin V. B. et al. 6042: Biomarkers of heart failure in exhaled breath. European Heart Journal. 2015;36(suppl 1):1053. [Av. at: https://academic.oup.com/eurheartj/article/36/suppl_1/849/434480. DOI: 10.1093/eurheartj/ehv401
22. Shaltaeva YR, Vasilev VK, Yakovlev DY, Kopylov FI, Syrkin AL, Chomakhidze PS et al. Detection heart failures (HF) biomarkers by proton transfer reaction — mass spectrometry and ion mobility spectrometry. IOP Conference Series: Materials Science and Engineering. 2016;151:012017. DOI: 10.1088/1757-899X/151/1/012017
Shaltaeva YR, Vasilev VK, Yakovlev DY, Kopylov FI, Syrkin AL, Chomakhidze PS et al. Detection heart failures (HF) biomarkers by proton transfer reaction — mass spectrometry and ion mobility spectrometry. IOP Conference Series: Materials Science and Engineering. 2016;151:012017. DOI: 10.1088/1757-899X/151/1/012017
23. Malinovskaya L. K., Bykova A. A., Chomakhidze P. Sh., Syrkin A. L., Kopylov Ph. Yu., Betelin V. B. et al. P1915. Mass spectrometry for detection heart failure with preserved ejection fraction. European Journal of Heart Failure. 2017;19(Suppl S1):481. [Av. at: https://onlinelibrary.wiley.com/doi/epdf/10.1002/ejhf.833. DOI: 10.1002/ejhf.833
24. Bykova A. A., Malinovkaya L. K., Kopylov Ph. Yu., Chomakhidze P. Sh., Syrkin A. L., Betelin V. B. et al. P568. Exhaled breath analysis in diagnostics of heart failure with preserved ejection fraction. European Journal of Heart Failure. 2016;18(Suppl 1):146. [Av. at: https://onlinelibrary.wiley.com/doi/epdf/10.1002/ejhf.539. DOI: 10.1002/ejhf.539
DOI: 10.1002/ejhf.539
25. Horváth I, MacNee W, Kelly FJ, Dekhuijzen PN, Phillips M, Döring G et al. “Haemoxygenase-1 induction and exhaled markers of oxidative stress in lung diseases”, summary of the ERS Research Seminar in Budapest, Hungary, September, 1999. The European Respiratory Journal. 2001;18(2):420–30. PMID: 11529303
26. Cheng S, Lyass A, Massaro JM, O’Connor GT, Keaney JF, Vasan RS. Exhaled Carbon Monoxide and Risk of Metabolic Syndrome and Cardiovascular Disease in the Community. Circulation. 2010;122(15):1470–7. DOI: 10.1161/CIRCULATIONAHA.110.941013
27. Tang WHW, Hazen SL. The contributory role of gut microbiota in cardiovascular disease. Journal of Clinical Investigation. 2014;124(10):4204–11. DOI: 10.1172/JCI72331
28. Huang F, Zhang F, Xu D, Zhang Z, Xu F, Tao X et al. Enterococcus faecium WEFA23 from infants lessens high-fat-diet-induced hyperlipidemia via cholesterol 7-alpha-hydroxylase gene by altering the composition of gut microbiota in rats. Journal of Dairy Science. 2018;101(9):7757–67. DOI: 10.3168/jds.2017-13713
Journal of Dairy Science. 2018;101(9):7757–67. DOI: 10.3168/jds.2017-13713
29. Bu J, Wang Z. Cross-Talk between Gut Microbiota and Heart via the Routes of Metabolite and Immunity. Gastroenterology Research and Practice. 2018;2018:1–8. DOI: 10.1155/2018/6458094
30. Wang Z, Klipfell E, Bennett BJ, Koeth R, Levison BS, DuGar B et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature. 2011;472(7341):57–63. DOI: 10.1038/nature09922
31. Zhu W, Gregory JC, Org E, Buffa JA, Gupta N, Wang Z et al. Gut Microbial Metabolite TMAO Enhances Platelet Hyperreactivity and Thrombosis Risk. Cell. 2016;165(1):111–24. DOI: 10.1016/j.cell.2016.02.011
32. Seldin MM, Meng Y, Qi H, Zhu W, Wang Z, Hazen SL et al. Trimethylamine N-Oxide Promotes Vascular Inflammation Through Signaling of Mitogen-Activated Protein Kinase and Nuclear Factor-κB. Journal of the American Heart Association. 2016;5(2):e002767. DOI: 10.1161/JAHA.115.002767
33. Pagonas N, Vautz W, Seifert L, Slodzinski R, Jankowski J, Zidek W et al. Volatile Organic Compounds in Uremia. PLoS ONE. 2012;7(9):e46258. DOI: 10.1371/journal.pone.0046258
Volatile Organic Compounds in Uremia. PLoS ONE. 2012;7(9):e46258. DOI: 10.1371/journal.pone.0046258
Анализ выдыхаемого воздуха в диагностике хронической сердечной недостаточности co сниженной фракцией выброса левого желудочка
Введение
В ряду кардиальных заболеваний выделяют нозологические формы, которые особенно трудно верифицировать при рутинном обследовании пациентов. В частности, диагноз различных форм хронической сердечной недостаточности (ХСН) является итогом комплексного дорогостоящего обследования пациентов. Скрининговое применение лабораторного определения мозгового натрийуретического пептида (МНУП) не всегда доступно. Учитывая неспецифический характер жалоб при ХСН и значительную схожесть клинической картины с другими сердечно-сосудистыми заболеваниями, еще труднее становится выделение группы лиц с наиболее вероятным наличием ХСН среди множества пациентов, предъявляющих жалобы на одышку, снижение переносимости нагрузки, отеки ног.
Известно, что состав выдыхаемого человеком воздуха зависит от метаболизма практически всех систем и органов. При ХСН резко замедляется метаболизм в мышечной ткани, снижается функция почек, печени и легких [1]. В связи с этим предположение о специфическом изменении состава выдыхаемого воздуха у пациентов с ХСН в зависимости от давности и тяжести заболевания представляется обоснованным.
При ХСН резко замедляется метаболизм в мышечной ткани, снижается функция почек, печени и легких [1]. В связи с этим предположение о специфическом изменении состава выдыхаемого воздуха у пациентов с ХСН в зависимости от давности и тяжести заболевания представляется обоснованным.
Выдыхаемый воздух представляет собой комплексную матрицу, содержащую не менее 1% летучих органических веществ (ЛОС). На основании анализа спектра ЛОС в выдыхаемом воздухе можно составить представление о состоянии метаболизма. Кроме того, показано, что спектр ЛОС в выдыхаемом воздухе изменяется при ряде заболеваний [2, 3].
Не менее 874 ЛОС можно определить в выдыхаемом воздухе. Около 200 ЛОС достаточно надежно определяются с помощью современной аналитической техники. Не менее 80 ЛОС связаны с курением, и только для нескольких (ацетон, изопрен) из них известны метаболические пути [4].
Выдыхаемый воздух — сложный аналитический объект, включающий неорганические и органические вещества, содержание которых колеблется в широких пределах.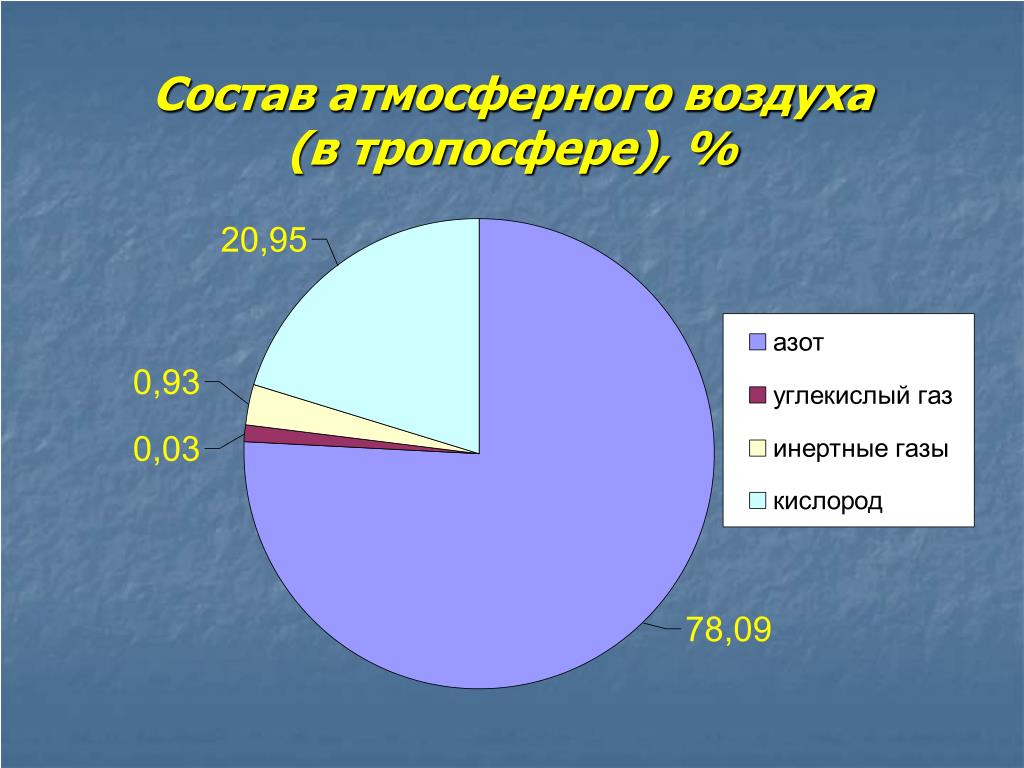 Концентрация газов (в том числе в выдыхаемом воздухе) измеряется в ppm (part per million, частица на 1 млн, 10–6), ppb (part per billion, частица на биллион, 10–9), ppt (part per trillion, частица на триллион, 10–12). В настоящее время используют следующие методы анализа [3] — газовая хроматография с масс-спектрометрией, протонная масс-спектрометрия (PTR-MS), протонная масс-спектрометрия с времяпролетным анализатором (PTR-TOF-MS), масс-спектрометрии с выделенными ионными потоками (SIFT-MS) [5], спектрометрия ионной подвижности [2], диодная лазерная спектроскопия поглощения [6—8].
Концентрация газов (в том числе в выдыхаемом воздухе) измеряется в ppm (part per million, частица на 1 млн, 10–6), ppb (part per billion, частица на биллион, 10–9), ppt (part per trillion, частица на триллион, 10–12). В настоящее время используют следующие методы анализа [3] — газовая хроматография с масс-спектрометрией, протонная масс-спектрометрия (PTR-MS), протонная масс-спектрометрия с времяпролетным анализатором (PTR-TOF-MS), масс-спектрометрии с выделенными ионными потоками (SIFT-MS) [5], спектрометрия ионной подвижности [2], диодная лазерная спектроскопия поглощения [6—8].
В исследованиях определено лишь несколько веществ в выдыхаемом воздухе, которые, возможно, связаны с патологией сердечно-сосудистой системы. Это пентан, ацетон, монооксид углерода и триметиламиноксид. При этом наибольшее количество работ по выдыхаемому воздуху при ХСН посвящено ацетону. Повышение содержания ацетона в выдохе пациентов с ХСН имеет патофизиологическое обоснование.
Кетоновые тела (ацетон, ацетонуксусная кислота и бета-оксимасляная кислота) являются одним из источников энергии для миокарда: в норме около 7% кислорода, потребляемого левым желудочком, расходуется на окисление кетоновых тел (КТ) [9]. Скорость этого процесса зависит от доступности КТ в крови. Ацетоацетат и β-гидроксибутират метаболизируются сердцем в случаях, когда они синтезируются в печени вследствие повышения доступности жирных кислот (голодание, длительная физическая нагрузка, кетогенная диета, неконтролируемый сахарный диабет 1-го типа, ХСН) [10].
В ряде исследований было отмечено, что при сердечной недостаточности может увеличиваться продукция К.Т. Так, в работе J. Lommi и соавт. [11], включавшей 45 пациентов с ХСН и 14 здоровых добровольцев, уровень кетоновых тел (ацетоацетат и бета-гидроксибутират) был достоверно выше у пациентов с ХСН. Концентрация К.Т. коррелировала с фракцией выброса, давлением в легочной артерии и уровнем норэпинефрина. Считается, что усиление продукции КТ у больных с ХСН вторично симпатической активации. Повышенный уровень норэпинефрина усиливает кетогенез через активацию липолиза в жировой ткани, повышая уровень свободных жирных кислот в крови.
Повышенный уровень норэпинефрина усиливает кетогенез через активацию липолиза в жировой ткани, повышая уровень свободных жирных кислот в крови.
Цель исследования — поиск маркеров, характерных для пациентов с верифицированной ХСН, с помощью анализа выдыхаемого воздуха методом протонной масс-спектрометрии.
Материал и методы
Нами было проведено проспективное клиническое исследование, в которое входили пациенты с ХСН и сниженной ФВ ЛЖ согласно классификации, предложенной Обществом специалистов по сердечной недостаточности (2016), госпитализированные в ГКБ им. С.С. Юдина и Университетскую клиническую больницу № 1 Первого МГМУ им. И.М. Сеченова в период с октября 2014 г. по апрель 2016 г.
Критерии включения: возраст старше 18 лет, наличие симптомов и/или физикальных признаков ХСН, ФВ ЛЖ менее 40%.
Критерии исключения: беременность, онкологические заболевания, острые воспалительные или обострение хронических воспалительных заболеваний, бронхиальная астма, острый коронарный синдром (впервые возникшая стенокардия, нестабильная стенокардия, инфаркт миокарда в течение предыдущего месяца), цирроз печени, печеночная недостаточность, дыхательная недостаточность любой степени (SpO2 <90%), анемия средней и тяжелой степени (гемоглобин менее 90 г/л у женщин и 100 г/л у мужчин), хронический алкоголизм, наркотическая зависимость и психические расстройства. Все подходящие по критериям включения и исключения пациенты ознакомились с информацией об исследовании и дали письменное информированное согласие на участие в нем.
Все подходящие по критериям включения и исключения пациенты ознакомились с информацией об исследовании и дали письменное информированное согласие на участие в нем.
Протокол исследования был одобрен локальным этическим комитетом Первого МГМУ им. И.М. Сеченова (Сеченовский Университет) Минздрава России.
Всего были включены 42 пациента с ХСН со сниженной ФВ ЛЖ и 24 пациента с другими сердечно-сосудистыми заболеваниями в контрольную группу. У пациентов проводился забор выдыхаемого воздуха в мешки Tedlar емкостью 1 л. Пациенты были проинструктированы воздерживаться от принятия пищи, питья, курения и приема препаратов за 12 ч до процедуры, чтобы уменьшить влияние этих факторов на концентрацию ЛОС в выдыхаемом воздухе. Непосредственно перед забором воздуха пациентам было предложено тщательно прополоскать рот водой. Далее в течение 1 сут анализ выдыхаемого воздуха выполняли с помощью протонного масс-спектрометра (Сompact PTR-MS, «Ionicon», Австрия).
Учитывая пилотный характер работы, была выбрана методика анализа не отдельных каналов, а спектра всех значений m/z (отношения массы к заряду) подряд в определенном диапазоне. Диапазон исследуемого спектра значений m/z составлял 21—141, исключая каналы 21, 30, 32 и 37-й, которые соответствуют концентрациям ионов, генерируемых в дрейфовой камере.
Диапазон исследуемого спектра значений m/z составлял 21—141, исключая каналы 21, 30, 32 и 37-й, которые соответствуют концентрациям ионов, генерируемых в дрейфовой камере.
Статистический анализ результатов проводился с использованием программного обеспечения SPSS Statistics 23.0. Для оценки нормальности распределения данных был проведен тест Колмогорова—Смирнова. Для переменных с нормальным распределением данные представлены как среднее и стандартное отклонение, для переменных с непараметрическим распределением — в виде медианы с указанием интерквартильного интервала (значения 25-го и 75-го процентилей указаны в скобках). Основные характеристики групп сравнивались с использованием критерия χ2 и точного критерия Фишера для порядковых переменных, U-критерия Манна—Уитни и критерия Краскела—Уоллиса для независимых выборок для непрерывных переменных с распределением, отличным от нормального. Корреляционные связи устанавливали в расчете коэффициента корреляции по Пирсону. Характеристические ROC-кривые построены в статистической программе SPSS. Различия считались достоверными при p<0,05.
Характеристические ROC-кривые построены в статистической программе SPSS. Различия считались достоверными при p<0,05.
Результаты
Демографические и клинические характеристики пациентов с ХСН и группы контроля представлены в табл. 1. Таблица 1. Демографические и клинические характеристики пациентов Примечание. САД — систолическое артериальное давление, СКФ — скорость клубочковой фильтрации, ЛПНП — липопротеины низкой плотности, КДР — конечный диастолический размер, БРА — блокаторы рецепторов ангиотензина.
Большая часть больных в группе ХСН была мужского пола (90,5% против 59,3%). Средний возраст и основные сопутствующие заболевания достоверно не различались между группами, кроме перенесенного инфаркта миокарда, чаще встречавшегося в группе пациентов с ХСН (p=0,021). Выявлены достоверные различия между группами в уровне общего холестерина и ЛПНП, билирубина и N-концевого МНУП. У пациентов с ХСН ФВ ЛЖ была достоверно ниже по сравнению с группой контроля (44% против 61%; р<0,0001). Также достоверные различия между группами касались применения различных групп лекарственных средств (β-блокаторы, дигоксин, петлевые диуретики, антагонисты минералокортикоидных рецепторов, антикоагулянты и антиагреганты достоверно чаще использовались среди пациентов с ХСН).
Также достоверные различия между группами касались применения различных групп лекарственных средств (β-блокаторы, дигоксин, петлевые диуретики, антагонисты минералокортикоидных рецепторов, антикоагулянты и антиагреганты достоверно чаще использовались среди пациентов с ХСН).
Всем пациентам выполнен анализ выдыхаемого воздуха на протонном масс-спектрометре. Усредненные спектрограммы выдыхаемого воздуха пациентов с ХСН и группы контроля представлены на рис. 1. Рис. 1. Усредненные спектрограммы выдыхаемого воздуха пациентов с ХСН и группы контроля.
После анализа данных выявлены различия по 36 параметрам выдыхаемого воздуха между пациентами с ХСН и группой контроля (табл. 2). Таблица 2. Результаты анализа выдыхаемого воздуха у пациентов с ХСН и в контрольной группе
Как видно из табл. 2, большая часть веществ определялась в следовых концентрациях (23 вещества с концентрацией менее 1·10–9). Все 5 веществ, выявлявшиеся в значительной концентрации (более 100·10–9), различались между группами с высокой достоверностью.
Учитывая то, что только для ацетона известен механизм образования при ХСН, дальнейший анализ проводился только для этого вещества. При анализе корреляционных связей выявлены достоверные корреляции умеренной силы выдыхаемого ацетона с NT-концевым мозговым натрийуретическим пропептидом, мочевиной, мочевой кислотой и общим билирубином в крови и отдельными эхокардиографическими показателями (ФВ, СДЛА и размер левого предсердия) (табл. 3). Таблица 3. Корреляционные связи ацетона выдыхаемого воздуха с лабораторными и инструментальными показателями
Также было проанализировано содержание ацетона у пациентов с различным ФК ХСН. Выявлены достоверные различия в содержании ацетона в выдыхаемом воздухе между пациентами 2 и 4 ФК по NYHA (рис. 2). Рис. 2. Содержание ацетона в выдыхаемом воздухе у пациентов с ХСН со сниженной ФВ ЛЖ в зависимости от функционального класса.
Для оценки диагностической значимости ацетона в выдыхаемом воздухе как маркера ХСН проведен ROC-анализ. Получено высокое значение AUC (площадь под ROC-кривой) — 0,811 (95% ДИ 0,707—0,915; р<0,0001), что соответствует очень хорошему качеству диагностического теста. Аналогичный показатель для NТ-концевого мозгового натрийуретического пропептида составляет 0,894 (95% ДИ 0,797—0,99; р=0,001).
Получено высокое значение AUC (площадь под ROC-кривой) — 0,811 (95% ДИ 0,707—0,915; р<0,0001), что соответствует очень хорошему качеству диагностического теста. Аналогичный показатель для NТ-концевого мозгового натрийуретического пропептида составляет 0,894 (95% ДИ 0,797—0,99; р=0,001).
Учитывая известную взаимосвязь выдыхаемого ацетона с декомпенсацией сахарного диабета, проанализирована корреляционная связь между ацетоном в выдыхаемом воздухе и глюкозой плазмы крови (рис. 3), Рис. 3. Корреляционная связь ацетона в выдыхаемом воздухе с глюкозой плазмы крови. а также наличием или отсутствием диагноза сахарного диабета (r =–0,216; p=0,097). Значимых взаимосвязей не выявлено.
Обсуждение
Поиск новых скрининговых маркеров ХСН представляет несомненную практическую значимость для современного здравоохранения. На настоящий момент диагностический алгоритм для ХСН со сниженной ФВ ЛЖ включает физикальный осмотр, а также комплекс инструментальных и лабораторных тестов. Помимо временных затрат, для выполнения этого алгоритма необходимо наличие диагностической аппаратуры и соответствующих специалистов.
Помимо временных затрат, для выполнения этого алгоритма необходимо наличие диагностической аппаратуры и соответствующих специалистов.
В ряде случаев (амбулаторное звено, приемное отделение стационара) для быстрого принятия решения (дифференциальный диагноз одышки) требуется скрининговый метод, позволяющий быстро исключить ХСН как причину одышки. В настоящее время таким методом является определение МНУП или его NT-концевого предшественника в крови. Метод имеет ряд ограничений. Во-первых, это инвазивная методика (требуется забор крови), во-вторых, не каждое учреждение имеет возможность выполнения экспресс-теста, и, в-третьих, на пороговые значения МНУП влияют возраст, функция почек, индекс массы тела, наличие фибрилляции предсердий [12].
Анализ выдыхаемого воздуха имеет ряд преимуществ: процедура неинвазивна (требуется подышать в маску воздухозаборника), анализ пробы воздуха занимает около 20 мин, при разработке программного обеспечения возможно получение автоматического анализа результатов исследования.
В нескольких исследованиях последних лет было показано, что ацетон выдыхаемого воздуха является диагностическим маркером ХСН [13, 14]. В одном исследовании показано также влияние этого маркера на прогноз заболевания [15].
Учитывая то, что продукция кетоновых тел печенью является неспецифической реакцией на избыток жирных кислот, можно предположить, что повышение содержания ацетона в выдыхаемом воздухе может возникнуть еще при ряде состояний, в первую очередь при декомпенсации сахарного диабета. В настоящее время есть всего несколько публикаций (включая нашу работу) об уровне ацетона у больных с ХСН и сахарным диабетом. Все подобные работы продемонстрировали отсутствие влияния сахарного диабета на уровень ацетона у больных с ХСН. Общим ограничением этих работ является отсутствие среди участников исследования пациентов с декомпенсацией С.Д. Тем не менее корреляции между уровнем глюкозы, гликозилированного гемоглобина и ацетоном в выдыхаемом воздухе обнаружено не было.
Следует обратить внимание на то, что повышение ацетона в выдыхаемом воздухе у пациентов с ХСН может быть обусловлено не только усилением продукции кетоновых тел печенью в ответ на активацию симпатической нервной системы (и соответственно активацию липолиза в жировой ткани). Не последнюю роль в увеличении концентрации ацетона в выдыхаемом воздухе может играть повышение проницаемости легочных капилляров при ХСН. Это косвенно подтверждает различие в концентрации ацетона в выдыхаемом воздухе у пациентов с различными функциональными классами сердечной недостаточности. Так, содержание ацетона в выдыхаемом воздухе больного с IV ФК ХСН достоверно выше, чем у пациента с II ФК. В литературе также есть указания на подобную взаимосвязь. Так, в работе T. Yokokawa и соавт. [16] показано, что уровень ацетона в выдыхаемом воздухе у пациентов с декомпенсацией ХСН достоверно выше, чем у стабильных больных. В другой работе [17] этих же авторов выявлена достоверная корреляция между уровнем выдыхаемого ацетона и давлением заклинивания легочной артерии.
Также необходимо отметить, что в нашей работе выдох пациентов с ХСН отличался от выдоха пациентов из контрольной группы по 36 параметрам. Таким образом, вероятно, речь идет не об анализе вероятности наличия болезни по одному параметру (ацетон), а о создании матрицы (паттерна) изменений, характерных для данной категории больных.
В заключение, анализ выдыхаемого воздуха является новым перспективным методом исследования у пациентов с ХСН, позволяющим неинвазивно, в режиме реального времени оценить вероятность наличия заболевания у больного с одышкой.
К ограничениям исследования необходимо отнести небольшую выборку пациентов, достоверно большее количество мужчин в группе ХСН по сравнению с контролем, что, хотя и является характерной особенностью подобных исследований (ХСН со сниженной ФВ ЛЖ), но затрудняет оценку влияния пола на состав выдыхаемого воздуха. Также следует отметить, что в контрольную группу входили не здоровые добровольцы, а пациенты с другими сердечно-сосудистыми заболеваниями (но не с ХСН). Необходимо отметить, что данное ограничение является общим для всех подобных работ.
Необходимо отметить, что данное ограничение является общим для всех подобных работ.
До широкого внедрения метода в практику необходимы дальнейшие исследования, направленные на оценку выявленных маркеров ХСН в выдыхаемом воздухе в зависимости от типа ХСН (с сохранной и промежуточной ФВ ЛЖ), стадии заболевания, динамики маркеров в течение болезни и возможность раннего выявления застоя у пациентов с ХСН.
Публикация выполнена в рамках государственного задания ФГУ ФНЦ «НИИСИ» РАН (проведение фундаментальных научных исследований) по теме № 0065−2019−0017 «Применение метода протонной масс-спектрометрии выдыхаемого воздуха в диагностике сердечно-сосудистых заболеваний» (№АААА-А19−119011590099−5).
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Быкова А.А. — https://orcid.org/0000-0002-2035-2340; e-mail: [email protected]
Малиновская Л. К. — https://orcid.org/0000-0003-3882-6564
К. — https://orcid.org/0000-0003-3882-6564
Трушина О.В. — https://orcid.org/0000-0002-9101-180X
Чомахидзе П.Ш. — https://orcid.org/0000-0002-2035-2340
Шалтаева Ю.Р. — https://orcid.org/0000-0002-9856-6031
Прошляков А.Ю. — https://orcid.org/0000-0003-3938-3822
Сердитенко Е.В. — https://orcid.org/0000-0002-4275-1035
Сыркин А.Л. — https://orcid.org/0000-0002-6452-1222
Бетелин В.Б. — https://orcid.org/0000-0001-6646-2660
Копылов Ф.Ю. — https://orcid.org/0000-0001-5124-6383
Автор, ответственный за переписку: Быкова А.А. — e-mail: [email protected]
Быкова А.А., Малиновская Л.К., Трушина О.В., Чомахидзе П.Ш., Шалтаева Ю.Р., Прошляков А.Ю., Сердитенко Е.В., Сыркин А.Л., Бетелин В.Б., Копылов Ф.Ю. Анализ выдыхаемого воздуха в диагностике хронической сердечной недостаточности co сниженной фракцией выброса левого желудочка. Кардиология и сердечно—сосудистая хирургия. 2019;12(6):568-576. https://doi.org/10.17116/kardio201912061
https://doi.org/10.17116/kardio201912061
Диагностика заболеваний легких на основе протеомного анализа конденсата выдыхаемого воздуха | Анаев
1. Konstantinidi E.M., Lappas A.S., Tzortzi A.S., Behrakis P.K. Exhaled Breath Condensate: Technical and Diagnostic Aspects. Scientific World Journal. 2015; 2015: 435160. DOI: 10.1155/2015/435160.
2. Borrill Z.L., Roy K., Singh D. Exhaled breath condensate biomarkers in COPD. Eur. Respir. J. 2008; 32 (2): 472–486. DOI: 10.1183/09031936.00116107.
3. Bloemen K., Hooyberghs J., Desager K. et al. Non-invasive biomarker sampling and analysis of the exhaled breath proteome. Proteomics Clin. Appl. 2009; 3 (4): 498–504. DOI: 10.1002/prca.200800095.
4. Lin J.L., Bonnichsen M.H., Nogeh E.U. et al. Proteomics in detection and monitoring of asthma and smoking-related lung diseases. Exp. Rev. Proteomics. 2010; 7 (3): 361–372. DOI: 10.1586/epr.10.9.
5. Lim M.Y., Thomas P.S. Biomarkers in exhaled breath condensate and serum of chronic obstructive pulmonary disease and non-small-cell lung cancer. Int. J. Chronic Dis. 2013; 2013: 578613. DOI: 10.1155/2013/578613.
Int. J. Chronic Dis. 2013; 2013: 578613. DOI: 10.1155/2013/578613.
6. Nobakht M. Gh B.F., Aliannejad R., Rezaei-Tavirani M. et al. The metabolomics of airway diseases, including COPD, asthma and cystic fibrosis. Biomarkers. 2015; 20 (1): 5–16. DOI: 10.3109/1354750X.2014.983167.
7. Terracciano R., Pelaia G., Preiano M., Savino R. Asthma and COPD proteomics: current approaches and future directions. Proteomics Clin. Appl. 2015; 9 (1–2): 203–220. DOI: 10.1002/prca.201400099.
8. Czitrovszky A., Szymanski W., Nagy A., Jani P. A new method for the simultaneous measurement of particle size, complex refractive index and particle density. Meas Sci. Technol. 2002; 13: 303–308.
9. Horvath I., Lazar Z., Gyulai N. et al. Exhaled biomarkers in lung cancer. Eur. Respir. J. 2009; 34 (1): 261–275. DOI: 10.1183/09031936.00142508.
10. Lee Y.T., Chen S.C., Shyu L.Y. et al. Significant elevation of plasma cathepsin B and cystatin C in patients with community-acquired pneumonia. Clin. Chim. Acta. 2012; 413 (5–6): 630–635. DOI: 10.1016/j.cca.2011.12.010.
Clin. Chim. Acta. 2012; 413 (5–6): 630–635. DOI: 10.1016/j.cca.2011.12.010.
11. Buszewski B., Kesy M., Ligor T., Amann A. Human exhaled air analytics: biomarkers of diseases. Biomed Chromatogr. 2007; 21 (6): 553–566.
12. Conrad D.H., Goyette J., Thomas P.S. Proteomics as a method for early detection of cancer: a review of proteomics, exhaled breath condensate, and lung cancer screening. J. Gen. Intern. Med. 2008; 23 (Suppl. 1): 78–84. DOI: 10.1007/s11606-007-0411-1.
13. Horvath I., Hunt J., Barnes P.J. Exhaled breath condensate: methodological recommendations and unresolved questions. Eur. Respir. J. 2005; 26 (3): 523–548.
14. Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких. Пересмотр 2014 года. Доступно на: http://goldcopd.org/wp-content/uploads/2016/04/GOLD-Report-Russian2014.pdf
15. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Российское респираторное общество (РРО). Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ). Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых. Пульмонология. 2014; (4): 13–48.
Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых. Пульмонология. 2014; (4): 13–48.
16. Бычков М.Б., Горбунова В.А. Ассоциация онкологов России. Клинические рекомендации по диагностике и лечению больных раком легкого. М.; 2014. Доступно на: http://oncology-association.ru/docs/recomend/may2015/19vz-rek.pdf
17. Kurova V., Anaev E., Kononikhin A. et al. Proteomics of exhaled breath: methodological nuances and pitfalls. Clin. Chem. Lab. Med. 2009; 47 (6): 706–712. DOI: 10.1515/CCLM.2009.166.
18. Ishihama Y., Rappsilber J., Andersen J.S., Mann M. Microcolumns with self-assembled particle frits for proteomics. J. Chromatogr. A. 2002; 979 (1–2): 233–239.
19. Nesvizhskii A., Keller A., Kolker E., Aebersold R. A statistical model for identifying proteins by tandem mass spectrometry. Anal. Chem. 2003; 75 (17): 4646–4658.
20. Hoffmann H., Tabaksblat L., Enghild J., Dahl R. Human skin keratins are the major proteins in exhaled breath condensate. Eur. Respir. J. 2008; 31 (2): 380–384. DOI: 10.1183/09031936.00059707.
Eur. Respir. J. 2008; 31 (2): 380–384. DOI: 10.1183/09031936.00059707.
21. Schittek B., Hipfel R., Sauer B. et al. Dermcidin: a novel human antibiotic peptide secreted by sweat glands. Nat. Immunol. 2001; 2 (12): 1133–1137.
22. Ghosh R., Maji U.K., Bhattacharya R., Sinha A.K. The role of dermcidin isoform 2: a two-faceted atherosclerotic risk factor for coronary artery disease and the effect of acetyl salicylic acid on it. Thrombosis. 2012; 2012: 987932. DOI: 10.1155/2012/987932.
23. Lee Motoyama J.P., Kim-Motoyama H., Kim P. et al. Identification of dermcidin in human gestational tissue and characterization of its proteolytic activity. Biochem. Biophys. Res. Commun. 2007; 35 7(4): 828–833.
24. Cunningham T.J., Hodge L., Speicher D. et al. Identification of a survival-promoting peptide in medium conditioned by oxidatively stressed cell lines of nervous system origin. J. Neurosci. 1998; 18: 7047–7060.
25. Stewart G.D., Skipworth R.J., Pennington C.J. et al. Variation in dermcidin expression in a range of primary human tumours and in hypoxic/oxidatively stressed human cell lines. Br. J. Cancer. 2008; 99 (1): 126–132. DOI: 10.1038/sj.bjc.6604458.
Variation in dermcidin expression in a range of primary human tumours and in hypoxic/oxidatively stressed human cell lines. Br. J. Cancer. 2008; 99 (1): 126–132. DOI: 10.1038/sj.bjc.6604458.
26. Yano C.L., Ventrucci G., Field W.N. et al. Metabolic and morphological alterations induced by proteolysis-inducing factor from Walker tumour-bearing rats in C2C12 myotubes. BMC Cancer. 2008; 8: 24. DOI: 10.1186/1471-2407-8-24.
27. Urade Y., Hayaishi O. Prostaglandin D synthase: Structure and function. Vitam. Horm. 2000; 58: 89–120.
28. Mizon C., Piva F., Queyrel V. et al. Urinary bikunin determination provides insight into proteinase / proteinase inhibitor imbalance in patients with inflammatory diseases. Clin. Chem. Lab. Med. 2002; 40 (6): 579–586.
29. Leclerc E.A., Gazeilles L., Serre G. et al. The ubiquitous dermokine delta activates Rab5 function in the early endocytic pathway. PLoS One. 2011; 6 (3): e17816. DOI: 10.1371/journal.pone.0017816.
30. Hasegawa M., Higashi K. , Yokoyama C. et al. Altered expression of dermokine in skin disorders. J. Eur. Acad. Dermatol. Venereol. 2013; 27 (7): 867–875. DOI: 10.1111/j.1468-3083.2012.04598.x.
, Yokoyama C. et al. Altered expression of dermokine in skin disorders. J. Eur. Acad. Dermatol. Venereol. 2013; 27 (7): 867–875. DOI: 10.1111/j.1468-3083.2012.04598.x.
31. Kinnula V.L., Vuorinen K., Ilumets H. et al. Thiol proteins, redox modulation and parenchymal lung disease. Curr. Med. Chem. 2007; 14 (2): 213–222.
32. Poschmann G., Sitek B., Sipos B. et al. Identification of proteomic differences between squamous cell carcinoma of the lung and bronchial epithelium. Mol. Cell Proteomics. 2009; 8 (5): 1105–1116. DOI: 10.1074/mcp.M800422MCP200.
33. Spik I., Brenuchon C., Angeli V. et al. Activation of the prostaglandin D2 receptor DP2/CRTh3 increases allergic inflammation in mouse. J. Immunol. 2005; 174 (6): 3703–3708.
34. Wei N., Deng X.W. The COP9 signalosome. Annu. Rev. Cell Dev. Biol. 2003; 19: 261–286. DOI:10.1146/annurev.cellbio.19.111301.112449.
35. Wang Q., Li X., Ren S. et al. Serum levels of the cancertestis antigen POTEE and its clinical significance in nonsmall-cell lung cancer. PLoS One. 2015; 10 (4): e0122792. DOI: 10.1371/journal.pone.0122792.
PLoS One. 2015; 10 (4): e0122792. DOI: 10.1371/journal.pone.0122792.
36. Wood L., Maher J., Bunton T., Resar L. The oncogenic properties of the HMG-I gene family. Cancer Res. 2000; 60 (15): 4256–4261.
37. Resar L. The high mobility group A1 gene: transforming inflammatory signals into cancer? Cancer Res. 2010; 70 (2): 436–439. DOI: 10.1158/0008-5472.CAN-09-1212.
38. Walmer D., Padin C., Wrona M. et al. Malignant transformation of the human endometrium is associated with overexpression of lactoferrin messenger RNA and protein. Cancer Res. 1995; 55: 1168–1175.
39. Ziolkowski P., Wozniak M., Dus K., Wisniewski J. The NUCKS: A novel tumor biomarker. J. Mol. Biomark. Diagn. 2013; 4 (145): 1000145.
Диагностика дыхания
У ВАС ЕСТЬ АПНОЭ ВО СНЕ?
90% ЛЮДЕЙ, СТРАДАЮЩИХ АПНОЭ СНА, НЕ ДИАГНОЗИРОВАНЫ. ТЫ ОДИН ИЗ НИХ?
УЗНАТЬ +
ПРИНЯТА СТРАХОВКА
Мы принимаем основные медицинские страховки PPO. Позвоните нам для бесплатной проверки страховки.
ПОЗВОНИТЕ НАМ +
Как ты спишь?
Пройдите нашу экспресс-оценку сна и узнайте.
* Получение этой оценки не означает, что вы спите расстройство. Это просто руководство по повышению осведомленности.
ПОЛУЧИТЕ ОЦЕНКУ СНА +
ЧАСЫ РАБОТЫ
ЧАСЫ РАБОТЫ
Понедельник 9:00–18:00
Вторник 9:00–18:00
Среда 9:00–18:00
Четверг 9:00–18:00
Пятница 9:00–18:00
ЛАБОРАТОРНЫЕ ЧАСЫ
Ежедневно 20:00–6:00
РАБОЧИЕ ЧАСЫ
Понедельник 9:00–18:00
Вторник 9:00 – 18:00
Среда 9:00–18:00
Четверг 9:00–18:00
Пятница 9:00–18:00
ЛАБОРАТОРНЫЕ ЧАСЫ
Ежедневно с 8:00 до 18:00
Наши местоположения
Шерман Оукс, CA
4515 Van Nuys Blvd #202
Sherman Oaks, CA 91403
(888) 538-4663 9004
9003 4214 Green River Rd, Ste 100 ТУР КОРОНА 23332 Hawthorne Blvd, Ste 201 ТУР ТОРРАНС УСЛУГ, СВЯЗАННЫХ С РАССТРОЙСТВАМИ СНА Наша респираторная группа предлагает высококачественные, экономически эффективные услуги и клинический опыт Наша бригада пульмонологов предлагает высококачественные, экономичные услуги и клинический опыт пациентам, страдающим от проблем со сном. Наши инновационные лабораторные услуги улучшают здоровье сна. ИССЛЕДОВАНИЯ СНА Тест сна — это комплексное диагностическое исследование сна, проводимое для исключения апноэ во сне и других нарушений сна. Мы можем планировать исследования сна в один и тот же день 7 дней в неделю. ДОМАШНЕЕ ИССЛЕДОВАНИЕ ЭЭГ Мы можем предоставить как стандартные, так и расширенные амбулаторные видео-ЭЭГ исследования (до 96 часов), не выходя из дома. Все исследования можно провести в тот же день в любой точке Южной Калифорнии. ИССЛЕДОВАНИЯ СНА Тест сна — это комплексное диагностическое исследование сна, проводимое для исключения апноэ во сне и других нарушений сна. Мы можем планировать исследования сна в один и тот же день 7 дней в неделю. ДОМАШНЕЕ ИССЛЕДОВАНИЕ ЭЭГ Мы можем предоставить как стандартные, так и расширенные амбулаторные видео-ЭЭГ исследования (до 96 часов), не выходя из дома. Все исследования можно провести в тот же день в любой точке Южной Калифорнии. Мы занимаем лидирующие позиции в исследованиях сна и услугах ЭЭГ , предоставляя расширенное тестирование и поддержку для широкого спектра потребностей, включая все виды нарушений сна и неврологические состояния.
(888).
Corona, CA 92880
(888) 538-4663 Торранс, Калифорния
Торранс, Калифорния
(888) 538-4663 ПРЕДЛАГАЕТ ШИРОКИЙ СПЕКТР
пациентам, страдающим от проблем со сном. Наши инновационные лабораторные услуги улучшают здоровье сна.
Наши инновационные лабораторные услуги улучшают здоровье сна.

НАША МИССИЯ
Наша миссия проста. Мы здесь, чтобы служить вам.
Мы посвящаем наши дни тому, чтобы переломить ситуацию с серьезными нарушениями сна, прерывающими жизнь, и расширить границы науки, чтобы изменить вашу жизнь.
- Мы верим, что нужно находить время, чтобы внимательно выслушать наших пациентов.
- Мы заботимся о наших пациентах.
- Мы придерживаемся самых высоких стандартов профессионального поведения.

- Мы стремимся постоянно обновлять наши знания о последних достижениях в области медицины сна, чтобы открывать новые и лучшие способы обслуживания наших пациентов.
- Мы верим в создание альянсов с нашими пациентами и их семьями для обеспечения наилучшего ухода.
КАК СПОН?
Пройдите нашу экспресс-оценку сна и узнайте.
* Прохождение этой оценки не означает, что у вас расстройство сна. Это просто руководство по повышению осведомленности.
ПОЛУЧИТЕ ОЦЕНКУ СНА +
ПОЛУЧИТЕ ОЦЕНКУ СНА +
НАИБОЛЕЕ РАСПРОСТРАНЕННЫЕ ИССЛЕДОВАНИЯ
Наша лаборатория предоставляет комплексные междисциплинарные услуги по изучению сна. В рамках регулярного осмотра, для постановки диагноза или, возможно, для установления эталона, ваш врач может запросить один или несколько лабораторных анализов.
Вот список наиболее часто заказываемых тестов, от исследований сна до ЭЭГ. Мы здесь, чтобы помочь ответить на любые вопросы.
ПЕРЕЧЕНЬ ИСПЫТАНИЙ
Полисомнограмма
Исследование титрования ПАП
Множественный тест задержки сна
Раздельное ночное исследование
Домашний тест на сон
Педиатрические исследования сна
Видео амбулаторная ЭЭГ
НАИБОЛЕЕ РАСПРОСТРАНЕННЫЕ ТЕСТЫ
Наша лаборатория предоставляет комплексные междисциплинарные услуги по лечению сна. В рамках регулярного осмотра, для постановки диагноза или, возможно, для установления эталона, ваш врач может запросить один или несколько лабораторных анализов.
Вот список наиболее часто заказываемых тестов, от исследований сна до ЭЭГ. Мы здесь, чтобы помочь ответить на любые вопросы.
ПЕРЕЧЕНЬ ИСПЫТАНИЙ
Полисомнограмма
Исследование титрования ПАП
Множественный тест задержки сна
Раздельное ночное исследование
Домашний тест на сон
Педиатрические исследования сна
Видео амбулаторная ЭЭГ
Диагностика, от которой захватывает дух
После десятилетий исследований и разработок устройства для обнаружения инфекционных агентов в выдыхаемом воздухе наконец-то совершенствуются, а SARS-CoV-2 ускоряет прогресс. Об этом сообщает Кэрри Арнольд.
Об этом сообщает Кэрри Арнольд.
Авторы и права: Shapes: smartboy10 / DigitalVision Vectors / Getty; фон: GoodGnom/DigitalVision Vectors/Getty
Вместо того, чтобы брать мазок из носа, представьте, что вы делаете простой дыхательный тест на COVID-19. С самого начала пандемии предпринимались усилия по поиску химических признаков инфекции SARS-CoV-2 в выдыхаемом воздухе. 14 апреля Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) объявило о первом разрешении на экстренное использование (EUA) теста для обнаружения COVID-19 в выдыхаемом воздухе; Согласно данным исследования, представленным в FDA, алкотестер InspectIR Systems для COVID-19 обладает чувствительностью и специфичностью, чтобы конкурировать с золотым стандартом: ПЦР-тестами.
InspectIR присоединяется к ряду других разрабатываемых устройств для проверки дыхания, некоторые из которых прошли проверку регулирующими органами (таблица 1). Достижения в области молекулярной идентификации и обнаружения в сочетании с усовершенствованием компьютерных алгоритмов и искусственного интеллекта (ИИ) приближают эти устройства к цели идентификации тысяч органических соединений из выдыхаемых газов.
Таблица 1 Разрабатываемые анализаторы дыхания
Полноразмерная таблица
Но в полевых условиях требуется устройство с доказанной надежностью, которое работает во многих условиях и среди населения, чтобы получить широкое коммерческое применение. В 2021 году запуск на рынок амстердамской компании Breathomix SpiroNose был приостановлен менее чем через неделю, когда устройство пропустило 25 положительных результатов на COVID-19.случаи. Тем не менее Кристина Дэвис, инженер-механик и аэрокосмический инженер из Калифорнийского университета в Дэвисе, говорит, что окупаемость не за горами. «Это действительно захватывающее время для всей области, потому что все видят перспективы того, что может сделать быстрая диагностика», — говорит она. Джейн Хилл, биоинженер из Университета Британской Колумбии, соглашается: «Дыхание — это новая кровь».
Нос от болезней
Ежедневно мы дышим в среднем 22 000 раз. Большая часть того, что покидает наши легкие, — это атмосферные газы: кислород, углекислый газ и азот. Но небольшая часть этого воздуха — менее 1% — состоит из небольших молекул на основе углерода, называемых летучими органическими соединениями (ЛОС), которые быстро распространяются по воздуху. Эти летучие органические соединения являются не только последствиями обеда с добавлением чеснока, но и содержат ценные сведения об обмене веществ в организме. Воздух из глубины наших легких — так называемое альвеолярное дыхание — выбрасывается в конце каждого вдоха и содержит богатые информацией летучие органические соединения, которые могут дать ключ к пониманию здоровья. Микроскопические капли воды, присутствующие во всех частях дыхания, содержат свой собственный набор нуклеиновых кислот, белков и других полярных молекул, отдельных от летучих органических соединений, известных под общим названием конденсаты или аэрозоли.
Но небольшая часть этого воздуха — менее 1% — состоит из небольших молекул на основе углерода, называемых летучими органическими соединениями (ЛОС), которые быстро распространяются по воздуху. Эти летучие органические соединения являются не только последствиями обеда с добавлением чеснока, но и содержат ценные сведения об обмене веществ в организме. Воздух из глубины наших легких — так называемое альвеолярное дыхание — выбрасывается в конце каждого вдоха и содержит богатые информацией летучие органические соединения, которые могут дать ключ к пониманию здоровья. Микроскопические капли воды, присутствующие во всех частях дыхания, содержат свой собственный набор нуклеиновых кислот, белков и других полярных молекул, отдельных от летучих органических соединений, известных под общим названием конденсаты или аэрозоли.
Для древних греков и представителей других культур летучие органические соединения в дыхании содержали кладезь информации. Гиппократ утверждал, что ни одно медицинское обследование не считается полным, если врач не нюхает дыхание человека. Это была не просто эксцентричность. Избыток хлора, вырабатываемый детьми с муковисцидозом, придает им слегка соленый вкус при поцелуях. А неспособность диабетиков использовать глюкозу заставляет их организм полагаться на кетоны. Организм в конечном итоге расщепляет их на ацетон, что отражается в характерном фруктовом запахе людей с неконтролируемым уровнем сахара в крови.
Это была не просто эксцентричность. Избыток хлора, вырабатываемый детьми с муковисцидозом, придает им слегка соленый вкус при поцелуях. А неспособность диабетиков использовать глюкозу заставляет их организм полагаться на кетоны. Организм в конечном итоге расщепляет их на ацетон, что отражается в характерном фруктовом запахе людей с неконтролируемым уровнем сахара в крови.
Просеивание молекул в чьем-то дыхании мало чем отличается от частного сыщика, роющегося в чьем-то мусорном баке, говорит Стивен Грэм, генеральный директор Breathe BioMedical, канадской биотехнологической компании, разрабатывающей дыхательные тесты. Так же, как большинство бытовых отходов должны быть отправлены в компост, рециркуляцию или мусорные баки, клеточные отходы также имеют ограниченное количество путей эвакуации. Помимо очевидных экскрементов, таких как моча и фекалии, организм может удалять нежелательные химические вещества через пот, рвоту и дыхание. Глубоко в легких ЛОС, растворенные в крови, могут проникать в альвеолы, а затем выдыхаться. Поскольку все части тела связаны через кровоток, дыхание может содержать ключи не только к респираторным заболеваниям, но и ко множеству заболеваний.
Поскольку все части тела связаны через кровоток, дыхание может содержать ключи не только к респираторным заболеваниям, но и ко множеству заболеваний.
Однако первый толчок к тестированию на основе дыхания исходил от юристов, а не от медиков. Отмена сухого закона в Соединенных Штатах в 1933 году совпала с появлением автомобилей. Всплеск новых водителей на дорогах и их недавний беспрепятственный доступ к алкоголю означали резкий рост смертности за рулем в нетрезвом виде. Однако, чтобы объявить вождение в нетрезвом виде незаконным, полиции нужен был способ измерить уровень опьянения человека.
Ученые и инженеры ухватились за проблему, создав всевозможные устройства Руба Голдберга. Несмотря на изобретательность, машины были привередливы в эксплуатации и часто были слишком сложными и громоздкими для повседневного использования. Что изменилось в 1950-е годы с изобретением алкотестера. Роберт Боркенштейн построил устройство, которое регистрировало изменение цвета при реакции этанола с дихроматом калия, превращая его из красного в зеленый. Что действительно сделало устройство революционным, так это его портативность и простота использования, благодаря которым они стали стандартной проблемой для полиции.
Что действительно сделало устройство революционным, так это его портативность и простота использования, благодаря которым они стали стандартной проблемой для полиции.
Хотя Алкотестер показал, что тесты на дыхание возможны, врачи, пытавшиеся разработать тесты на болезни, а не на интоксикацию, столкнулись с серьезными препятствиями. Этанол легко обнаружить, потому что обычно он не обнаруживается в высоких концентрациях в выдыхаемом воздухе и действительно присутствует в высоких концентрациях, когда человек в состоянии алкогольного опьянения выдыхает. Более того, ученым нужно было идентифицировать только одну молекулу из бесчисленного множества других химических веществ в среднем человеческом дыхании. Первоначальные надежды связать конкретную молекулу с конкретным состоянием были быстро развеяны учеными, занимающимися ранним дыханием в 19-м веке.60-е и 1970-е годы — за двумя исключениями: инфекций Helicobacter pylori (причина язвы желудка) и избыточного бактериального роста в тонкой кишке. Первый можно обнаружить, выпив раствор, содержащий 13 C-меченую мочевину. H. pylori вырабатывает уреазу, которая расщепляет мочевину на аммиак и углекислый газ. Помеченный CO 2 можно обнаружить в выдыхаемом воздухе с помощью инфракрасной (ИК) спектроскопии. Дыхательный тест на избыточный бактериальный рост в тонком кишечнике основан на наличии повышенного уровня метана. Однако для большинства заболеваний обнаружение признаков дыхания молекул, связанных с клеточным метаболизмом, «является настоящей иголкой в стоге сена», — говорит Грэм.
Первый можно обнаружить, выпив раствор, содержащий 13 C-меченую мочевину. H. pylori вырабатывает уреазу, которая расщепляет мочевину на аммиак и углекислый газ. Помеченный CO 2 можно обнаружить в выдыхаемом воздухе с помощью инфракрасной (ИК) спектроскопии. Дыхательный тест на избыточный бактериальный рост в тонком кишечнике основан на наличии повышенного уровня метана. Однако для большинства заболеваний обнаружение признаков дыхания молекул, связанных с клеточным метаболизмом, «является настоящей иголкой в стоге сена», — говорит Грэм.
Становится основным направлением деятельности
Для определения ряда соединений, присутствующих в концентрациях, составляющих части на миллиард, в этой области очень рано обратились к масс-спектрометрии как предпочтительному инструменту, и, по словам Дэвиса, она остается золотым стандартом (рис. 1). ). Разделение ЛОС с помощью газовой хроматографии перед масс-спектрометрическим анализом обеспечивает большее разрешение. Но разделить спектры сложной смеси непросто, особенно когда молекулы очень похожи. Масс-спектрометры также могут быть капризны в работе, а обычные приборы слишком велики и медленны, чтобы их можно было использовать в полевых условиях.
Но разделить спектры сложной смеси непросто, особенно когда молекулы очень похожи. Масс-спектрометры также могут быть капризны в работе, а обычные приборы слишком велики и медленны, чтобы их можно было использовать в полевых условиях.
Рис. 1: Отпечаток летучих органических соединений методом газовой хроматографии.
Технология газовой хроматографии (ГХ) позволяет собирать выдыхаемый воздух и улавливать ЛОС. Затем их выпускают для анализа с помощью растворителя или термической десорбции. Отдельные молекулярные компоненты можно оценить с помощью ГХ, за которой обычно следует масс-спектрометрия (ГХ-МС) или пламенно-ионизационное детектирование (ГХ-ПИД). (Перепечатано из K.D. van der Kant et al., Respir. Res . 13, 117 (2012), CC BY 2.0 Generic).
Полноразмерное изображение
Чтобы диагностика дыхания стала общепринятой, инженерам нужно было создать устройство, больше похожее на алкотестер. Для этого ученые черпали вдохновение в обонятельных системах млекопитающих.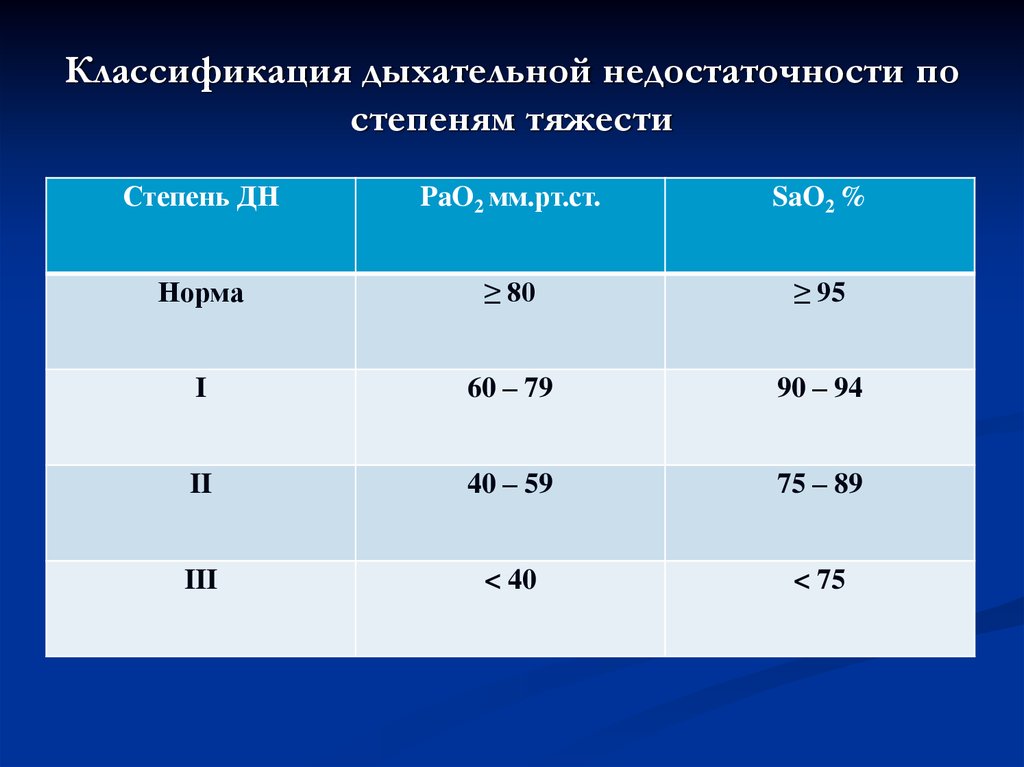 Наш мозг распознает запах, не выделяя конкретное химическое вещество, а анализируя закономерности активации обонятельных рецепторов. Чтобы воспроизвести это в устройстве, инженеры построили машину, которая была заполнена массивами электрохимических датчиков, часто покрытых оксидами металлов. Когда летучие органические соединения из дыхания связываются с датчиком, это меняет электрический ток в датчике. Затем электронный нос «считывал» модели текущих изменений, создаваемых чьим-то дыханием, не идентифицируя сами молекулы. Точно так же, как люди могут распознать характерный аромат печенья с шоколадной крошкой или брызг скунса, не оценивая запах молекулу за молекулой, то же самое может сделать и электронный нос. Принцип был здравым, говорит Оливер Гулд, химик-аналитик из Университета Западной Англии в Бристоле, но первые устройства были «мусором».
Наш мозг распознает запах, не выделяя конкретное химическое вещество, а анализируя закономерности активации обонятельных рецепторов. Чтобы воспроизвести это в устройстве, инженеры построили машину, которая была заполнена массивами электрохимических датчиков, часто покрытых оксидами металлов. Когда летучие органические соединения из дыхания связываются с датчиком, это меняет электрический ток в датчике. Затем электронный нос «считывал» модели текущих изменений, создаваемых чьим-то дыханием, не идентифицируя сами молекулы. Точно так же, как люди могут распознать характерный аромат печенья с шоколадной крошкой или брызг скунса, не оценивая запах молекулу за молекулой, то же самое может сделать и электронный нос. Принцип был здравым, говорит Оливер Гулд, химик-аналитик из Университета Западной Англии в Бристоле, но первые устройства были «мусором».
Многочисленные неудачи вынудили ученых, занимающихся исследованием дыхания, вернуться к чертежной доске — и вернуться от электрохимических датчиков к масс-спектрометрии. С научной точки зрения, говорит Лиуве Бос, врач и исследователь дыхания из Университета Амстердама, масс-спектрометрия имеет то преимущество, что она является нецелевым подходом. «Вам не нужно заранее знать, какие молекулы находятся в выдыхаемом воздухе, чтобы идентифицировать и количественно их определять», — говорит Бос.
С научной точки зрения, говорит Лиуве Бос, врач и исследователь дыхания из Университета Амстердама, масс-спектрометрия имеет то преимущество, что она является нецелевым подходом. «Вам не нужно заранее знать, какие молекулы находятся в выдыхаемом воздухе, чтобы идентифицировать и количественно их определять», — говорит Бос.
Первые попытки измерить химические вещества в дыхании часто терпели неудачу из-за множества химических веществ, которые могли меняться в зависимости от всего, от времени дня до чьего-то последнего приема пищи. Более того, эта большая изменчивость часто затмевала более тонкие изменения, связанные с болезнью. Изысканная чувствительность и детализация масс-спектрометрического анализа человеческого дыхания дали подсказки, которые помогли выделить очень слабые характерные сигналы из почти оглушительного шума. Дэвис говорит, что инженеры экспериментировали с различными сорбентами (материалами, которые предпочтительно поглощают определенные молекулы), чтобы предпочтительно улавливать летучие органические соединения и другие интересующие молекулы, а также с различными типами инертного пластика для улавливания дыхания для последующего анализа, мало чем отличающегося от очень причудливого воздушного шара. Но волна миниатюризации в последнее десятилетие позволила исследователям разработать портативные анализаторы выдыхаемого воздуха на основе масс-спектрометрии.
Но волна миниатюризации в последнее десятилетие позволила исследователям разработать портативные анализаторы выдыхаемого воздуха на основе масс-спектрометрии.
Компания Breathonix из Сингапура, созданная Чжунан Цзя и ее коллегами из Национального университета Сингапура, разработала устройство, основанное на масс-спектрометрическом анализе, по тем же причинам, что и Хилл и Дэвис. «Многие молекулы в дыхании имеют очень похожую структуру и химические свойства, и их можно рассматривать как имеющие одинаковый рисунок на датчиках», — говорит Цзя.
Устройство Breathonix высотой по пояс, размером с мини-холодильник, соединяется с длинной подвижной рукой, закрытой одноразовой пластиковой крышкой, которая улавливает дыхание человека. Газ подвергается прямому анализу с помощью масс-спектрометрии в реальном времени (DART-MS), которая позволяет количественно определять ряд химических веществ. Аппарат сравнивает характер дыхания тестируемого ЛОС с профилями, взятыми у пациентов, о которых известно, что у них есть COVID-19. и может предоставить результаты менее чем за 60 секунд. Breathonix протестировала свое устройство на более чем 50 000 человек, сообщив о 85,7% чувствительности и 97% специфичности. Джиа говорит, что их большая база данных образцов дыхания помогает им совершенствовать свои алгоритмы и предоставляет ценные данные для разработки тестов дыхания на рак легких и другие заболевания.
и может предоставить результаты менее чем за 60 секунд. Breathonix протестировала свое устройство на более чем 50 000 человек, сообщив о 85,7% чувствительности и 97% специфичности. Джиа говорит, что их большая база данных образцов дыхания помогает им совершенствовать свои алгоритмы и предоставляет ценные данные для разработки тестов дыхания на рак легких и другие заболевания.
Кембридж, Великобритания Компания Owlstone Medical, со своей стороны, миниатюризировала свой пробоотборник, но не масс-спектрометр. Их ReCIVA Breath Sampler представляет собой портативное устройство, которое улавливает летучие органические соединения и конденсаты из образцов дыхания на адсорбирующих трубках. Затем исследователи анализируют соединения с помощью ГХ/МС или полевой асимметричной спектрометрии ионной подвижности (FAIMS), которая использует флуктуирующее электрическое поле для разделения и идентификации ионов. Поскольку устройство не дает результатов на месте, его нельзя использовать для скрининга больших скоплений людей, но соучредитель и генеральный директор Билли Бойл говорит, что компромисс заключается в превосходном анализе и точности для таких состояний, как рак, когда точный результат важнее портативности или скорости.
Помимо масс-спектрометрии
Сегодня масс-спектрометрия — не единственный аналитический метод, используемый для скрининга дыхания и диагностики. ИК-спектроскопия использует инфракрасное излучение для возбуждения ковалентных связей в органических молекулах и измеряет изменение вращательного и колебательного состояний для идентификации соединения. Хотя это не считается «золотым стандартом», Дэвис говорит, что многие компании находят меньший размер большинства ИК-спектрометров привлекательным для использования в местах оказания медицинской помощи.
Компания Breathe Biomedical, базирующаяся в Монктоне, Нью-Брансуик, Канада, использует тип ИК-спектроскопии, называемый спектроскопией кольцевой полости. Компания начала свою деятельность с технологии, разработанной в Университете Альберты для анализа выбросов и утечек газа на месторождениях нефтеносных песков. Дыхание создает аналогичную проблему. Компания разработала настольное устройство, которое может улавливать альвеолярное дыхание на сорбентных трубках. Затем пробирки анализируются с помощью IR-CRDS (спектроскопия с кольцевым сканированием полости) в штаб-квартире компании. Компания по-прежнему сосредоточена на скрининге на рак молочной железы и легких, а также начинает работу по прогнозированию развития длительного COVID-19.. Онколог Энтони Рейман из региональной больницы Сент-Джон, который провел полевые испытания прототипа этой системы, говорит, что даже если технология Breathe будет работать лучше всего в качестве инструмента скрининга, она все равно будет невероятно ценной. В настоящее время низкодозовая компьютерная томография (LDCT) рекомендуется для скрининга лиц с высоким риском рака легких, но эти тесты дороги и требуют воздействия низких доз радиации, что может объяснить, почему только 12,7% курильщиков с высоким риском в Соединенных Штатах Штаты прошли испытание. Переход на более дешевый и безопасный тест может помочь увеличить количество таких скринингов.
Затем пробирки анализируются с помощью IR-CRDS (спектроскопия с кольцевым сканированием полости) в штаб-квартире компании. Компания по-прежнему сосредоточена на скрининге на рак молочной железы и легких, а также начинает работу по прогнозированию развития длительного COVID-19.. Онколог Энтони Рейман из региональной больницы Сент-Джон, который провел полевые испытания прототипа этой системы, говорит, что даже если технология Breathe будет работать лучше всего в качестве инструмента скрининга, она все равно будет невероятно ценной. В настоящее время низкодозовая компьютерная томография (LDCT) рекомендуется для скрининга лиц с высоким риском рака легких, но эти тесты дороги и требуют воздействия низких доз радиации, что может объяснить, почему только 12,7% курильщиков с высоким риском в Соединенных Штатах Штаты прошли испытание. Переход на более дешевый и безопасный тест может помочь увеличить количество таких скринингов.
«Мне кажется, что одной из самых больших возможностей для тестирования дыхания является скрининг рака», — говорит Рейман. Даже если дыхательные тесты просто сократят число людей, нуждающихся в более дорогих и инвазивных обследованиях, они принесут пользу.
Даже если дыхательные тесты просто сократят число людей, нуждающихся в более дорогих и инвазивных обследованиях, они принесут пользу.
Другие группы, такие как Sotech Health в Далласе; BreathPass от Тампере, финские алгоритмы глубокого восприятия; а NA-NOSE, разработанный в Израильском технологическом институте, позволяет по-новому взглянуть на электронные носы. Все эти устройства являются портативными и портативными, размером с два телевизионных пульта, соединенных спиной к спине, и все они обещают быстрые и точные результаты для COVID-19.или другие заболевания. Все электронные носы состоят из газовых сенсоров (часто типа оксидно-металлического полупроводника или сенсора углерода, встроенных в наночастицы золота, электрическая проводимость которых изменяется в присутствии определенных типов молекул), соединенных с программным обеспечением для распознавания образов. Достижения в области микроэлектроники позволили инженерам уменьшить размер, стоимость и энергопотребление электронных носов, сделав их пригодными для использования за пределами исследовательских лабораторий.
Каде Франс, технический директор Sotech Health, говорит, что электронный нос идеально подходит для этого, поскольку тесты выявляют сдвиги в соотношении летучих органических соединений, вырабатываемых организмом, а не определяют конкретный биомаркер, поэтому способность устройств смысловые шаблоны идеально подходят.
«Мы обнаруживаем с помощью нашего датчика триллионные доли ампера. Он очень, очень маленький, и узоры можно принять за шум», — говорит Франс. «Мы действительно находимся в зачаточном состоянии того, что мы можем сделать». По его словам, вывод устройства на рынок означает устранение оставшихся недостатков.
Последние достижения в области машинного обучения открыли новые возможности для электронных носов, требующих сложных алгоритмов. Вот почему генеральный директор Deep Sensing Algorithms Пекка Риссанен говорит, что его компания, специализирующаяся на машинном обучении, первой подключилась к этому процессу. «Мы обучаем наши алгоритмы примерно так же, как вы дрессируете собаку-искателя», — говорит он. «Мы берем здоровых людей, берем больных, выделяем их для алгоритма, а затем спрашиваем, чем они отличаются».
«Мы берем здоровых людей, берем больных, выделяем их для алгоритма, а затем спрашиваем, чем они отличаются».
Не все проходит гладко
Хотя все эти методы имеют теоретическую силу, на практике результаты были далеко не блестящими. Диагностика на основе дыхания, будь то COVID-19, рак или любое другое состояние, означает тестирование сотен или тысяч людей для выявления почти бесконечно малых сдвигов в профиле летучих органических соединений. На местах они сталкивались с неудачей за неудачей.
«Дыхание — это новая кровь». — Джейн Хилл, Университет Британской Колумбии
В 2021 году правительство Нидерландов прекратило испытания SpiroNose от Breathomix после того, как устройство дало небольшое, но тревожное количество ложноотрицательных результатов. (Компания утверждает, что проблемы были вызваны ошибкой пользователя, а не самим устройством).Алкотестер показывает, что тесты на дыхание становятся все более надежными, чувствительными и избирательными, хотя Бойл из Owlstone будет оставаться скептичным, пока не увидит данные, представленные в FDA.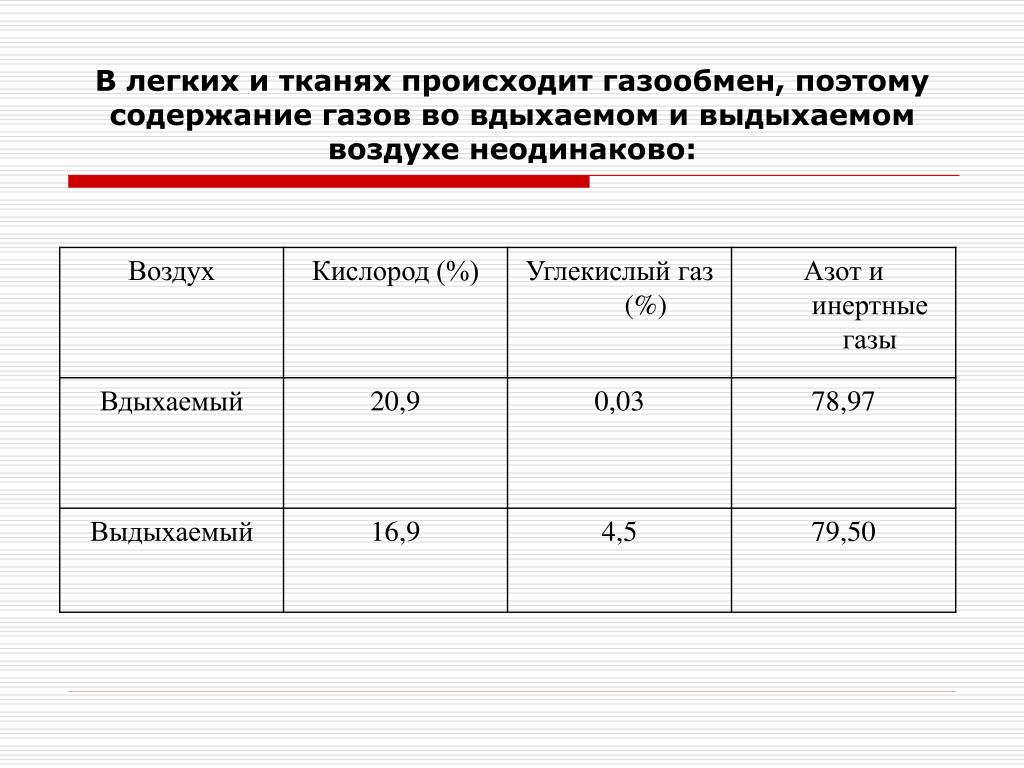 «Я знаю нескольких из нас в дыхательном сообществе, которые хотели бы увидеть больше данных», — говорит он.
«Я знаю нескольких из нас в дыхательном сообществе, которые хотели бы увидеть больше данных», — говорит он.
Возможно, самая большая проблема для детекторов на основе дыхания заключалась в проверке небольших исследований на более крупных и разнообразных популяциях. Врожденная изменчивость человеческого дыхания — самая большая сила испытания и его ахиллесова пята. Та же самая изменчивость, которая делает дыхание богатым информационным источником для диагностики, также означает, что необходимо предпринять дополнительные шаги для выявления реальных различий между здоровьем и болезнью, а не только таких факторов, как комната, в которой был взят образец дыхания, или то, что людям, возможно, приходилось делать. есть непосредственно перед тестом.
«Если вы остановились, чтобы заправиться по дороге в больницу [для анализа], то это повысит содержание алканов в вашем дыхании», — говорит Бос. Это затрудняет для ученых определение того, какие химические вещества меняются из-за болезни, а какие изменяются на основе других факторов.
Вот почему израильская команда из Научного института Вейцмана в Израиле начала тестировать воздух, выдыхаемый через ноздри, а не через рот. Их работа, опубликованная в PLoS ONE, показала, что PEN3 eNose от Airsense Analytics, который использует десять различных датчиков оксида металла для обнаружения соединений, выдыхаемых через нос в одноразовый пластиковый картридж размером чуть больше зажигалки, может надежно обнаруживать SARS CoV-2. заражение через воздух, выдыхаемый через нос. «Мы получаем довольно впечатляющие результаты, результаты, которые позволяют надеяться на медицинские приложения», — говорит первый автор Коби Снитц.
По словам Бойла, в этой области больше, чем в очередной изящной штуковине, нуждается какая-то фундаментальная научная работа. По его словам, у исследователей до сих пор нет представления о том, что можно найти в «нормальном» дыхании, и до тех пор, пока у них нет ответа, любой тест, основанный на дыхании, будет сопряжен с неопределенностью. Но деньги на такие эксперименты трудно найти, что приводит к клинической проверке в слишком маленьких группах людей.
«Люди пытались в течение 40 лет, и ни один из них не прошел путь от первоначального экспериментального наблюдения до чего-то, что было развернуто», — говорит Бойл. «Очень легко думать, что вы нашли сигнал, но на самом деле то, что вы нашли, — это просто химический шум». Сказав это, Бойл надеется, что новое устройство InspectIR может оказаться исключением; он с нетерпением ждет опубликованных результатов.
Непрекращающиеся проблемы разработки надежного дыхательного теста заставили других переосмыслить роль дыхательного теста в медицине. Рейман видит большой потенциал дыхательных тестов как быстрого и дешевого скрининга рака. Если бы исследователи могли идентифицировать сигнатуру дыхания, не связанную с раком, это можно было бы использовать для сокращения числа более инвазивных скринингов рака, таких как колоноскопия и компьютерная томография.
Пандемия предоставила разработчикам дыхательных тестов новый шанс показать, насколько их продукты могут блестеть, говорит Франс. «COVID-19была легкой победой в краткосрочной перспективе, и я думаю, что всего через несколько лет мы сможем продемонстрировать впечатляющий набор продуктов».
«COVID-19была легкой победой в краткосрочной перспективе, и я думаю, что всего через несколько лет мы сможем продемонстрировать впечатляющий набор продуктов».
Разработка неинвазивного теста выдыхаемого воздуха для диагностики рака головы и шеи
Резюме
История вопроса
Улучшение возможности выявления плоскоклеточного рака головы и шеи на ранней стадии (ПГШШ) может улучшить результаты лечения и улучшить состояние пациента заболеваемость. Мы стремились определить диагностическую точность анализа дыхания как неинвазивного теста для выявления HNSCC.
Методы
Стандартизированные образцы дыхания были взяты у 181 пациента с подозрением на HNSCC до любого лечения. Для анализа выдыхаемого воздуха на наличие летучих органических соединений использовали выбранный масс-спектрометр с ионной проточной трубкой. Диагноз был подтвержден гистологическим исследованием. Модель биномиальной логистической регрессии использовалась для дифференциации профилей дыхания у пациентов с раком и контрольной группой (доброкачественное заболевание) на основе переменных, полученных с помощью масс-спектрометрии.
Результаты
Всего у 66% участников были первичные опухоли на ранней стадии (Т1 и Т2), а у 58% были метастазы в регионарные лимфатические узлы. Оптимизированная модель логистической регрессии с использованием трех переменных имела чувствительность и специфичность 80% и 86%, соответственно, с AUC для ROC-кривой 0,821 (95% ДИ 0,625–1,0) в тестируемой когорте.
Выводы
Анализ дыхания для неинвазивной диагностики HNSCC представляется практичным и точным. Будущие исследования следует проводить в учреждениях первичной медико-санитарной помощи, чтобы определить применимость анализа дыхания для раннего выявления HNSCC.
История вопроса
Плоскоклеточный рак слизистых оболочек головы и шеи (HNSCC) возникает в носоглотке, ротоглотке, гортаноглотке, гортани и полости рта. Классические факторы риска для HNSCC включают потребление табака и алкоголя. Однако совсем недавно в США был зарегистрирован всплеск рака ротоглотки, связанного с вирусом папилломы человека (ВПЧ) 9. 0257 1 Канада 2 и Великобритания. 3 Эти виды рака также поражают гораздо более молодое население без классических факторов риска ПРГШ. 4 Во всем мире на HNSCC приходится 6% всех случаев рака и до 2% смертей, связанных с раком. 5 Современные методы лечения эффективны при лечении ранних стадий заболевания с ограниченной заболеваемостью; однако поздние проявления распространены и часто связаны с плохим прогнозом и высокой заболеваемостью, связанной с лечением. 6 Таким образом, методы раннего выявления необходимы для улучшения результатов лечения пациентов с ПРГШ.
0257 1 Канада 2 и Великобритания. 3 Эти виды рака также поражают гораздо более молодое население без классических факторов риска ПРГШ. 4 Во всем мире на HNSCC приходится 6% всех случаев рака и до 2% смертей, связанных с раком. 5 Современные методы лечения эффективны при лечении ранних стадий заболевания с ограниченной заболеваемостью; однако поздние проявления распространены и часто связаны с плохим прогнозом и высокой заболеваемостью, связанной с лечением. 6 Таким образом, методы раннего выявления необходимы для улучшения результатов лечения пациентов с ПРГШ.
Поскольку первичная оценка всех верхних дыхательных путей пищеварительного тракта технически ограничена, требуется третичное направление для расследования подозрения на рак головы и шеи, что в значительной степени определяется симптомами. 7 Критический анализ таких симптомов у большой группы пациентов ( n = 4715) в Великобритании показал, что наиболее чувствительным (45,4%) индикатором является необъяснимая опухоль на шее, присутствующая более 3 недель, но это имел специфичность только 79,6%.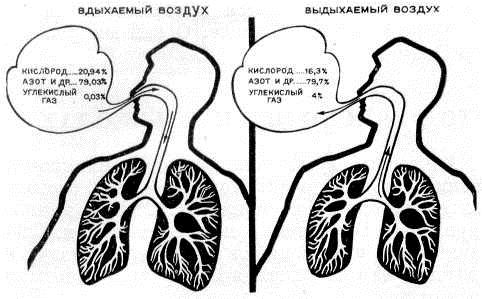 7 Наличие краниальной невропатии обеспечивало наилучшую положительную прогностическую ценность (66,7%). Однако комбинированная модель симптомов дает только максимальную площадь под кривой (AUC) 0,78. 7 Когда у пациента развивается объемное образование на шее или краниальные невропатии, стадия HNSCC, вероятно, будет запущена. 4 Таким образом, необходима более ранняя диагностика, а исследования биомаркеров для раннего выявления рака могут расширить и улучшить существующие методы обнаружения HNSCC на основе симптомов. 8
7 Наличие краниальной невропатии обеспечивало наилучшую положительную прогностическую ценность (66,7%). Однако комбинированная модель симптомов дает только максимальную площадь под кривой (AUC) 0,78. 7 Когда у пациента развивается объемное образование на шее или краниальные невропатии, стадия HNSCC, вероятно, будет запущена. 4 Таким образом, необходима более ранняя диагностика, а исследования биомаркеров для раннего выявления рака могут расширить и улучшить существующие методы обнаружения HNSCC на основе симптомов. 8
В последнее десятилетие летучие органические соединения (ЛОС) вызывают интерес в качестве биомаркеров для выявления рака. ЛОС представляют собой органические молекулы с высоким давлением пара при температуре окружающей среды, и их можно измерить с помощью масс-спектрометров и газовых детекторов. Люди выделяют ряд летучих органических соединений из различных жидкостей организма, включая выдыхаемый воздух, при этом недавний метаанализ выявил более 250 летучих органических соединений, которые могут обнаруживать рак человека с помощью анализа дыхания. 8 Двадцать четыре из этих соединений из четырех исследований смогли обнаружить HNSCC. 9,10,11,12 Несмотря на эти многообещающие результаты, в этих исследованиях не анализировался полный профиль дыхания (полные масс-спектры) пациента, потенциально «отсутствующие» новые биомаркеры дыхания для HNSCC. Цель этого многоцентрового исследования состояла в том, чтобы определить, можно ли использовать профиль дыхания для различения пациентов с ПРГШ и без него.
8 Двадцать четыре из этих соединений из четырех исследований смогли обнаружить HNSCC. 9,10,11,12 Несмотря на эти многообещающие результаты, в этих исследованиях не анализировался полный профиль дыхания (полные масс-спектры) пациента, потенциально «отсутствующие» новые биомаркеры дыхания для HNSCC. Цель этого многоцентрового исследования состояла в том, чтобы определить, можно ли использовать профиль дыхания для различения пациентов с ПРГШ и без него.
Методы
Этическое одобрение и согласие
Этическое одобрение (код HREC HREC/16/SAC/70) было получено от Комитета по этике человека местной сети здравоохранения Южной Аделаиды, а также одобрение для конкретного места для Медицинского центра Флиндерс и Королевской больницы Аделаиды, Аделаида, Южная Австралия. Информированное согласие было получено от всех участников до сбора образцов. Соблюдались местные и международные рекомендации в соответствии с Хельсинкской декларацией для исследований с участием людей.
Пациенты
Пациенты, направленные в клиники головы и шеи Медицинского центра Флиндерс и Королевской больницы Аделаиды после оценки опытным отоларингологом с клиническим подозрением на HNSCC, были набраны для этого исследования. У всех этих пациентов был гистологический диагноз SCC, возникающий в слизистой оболочке полости рта, ротоглотки или гортани, на основании биопсии первичного рака под общей анестезией или метастатических участков. Контрольная группа состояла из здоровых взрослых пациентов, которые поступили на панэндоскопию с симптомами верхних дыхательных путей и клиническим подозрением на HNSCC, но впоследствии имели нормальные результаты панэндоскопического исследования или гистологически доброкачественные результаты биопсии.
Критерии исключения включали гистологический диагноз дисплазии высокой степени, пациентов с другими сопутствующими злокачественными новообразованиями или злокачественными новообразованиями в анамнезе, пациентов со злокачественными новообразованиями кожи головы и шеи, пациентов в возрасте до 18 лет и пациентов с активным воспалительным состоянием или инфекцией. Пациенты с плоскоклеточным раком в шейных лимфатических узлах без идентифицируемой первичной опухоли слизистой оболочки (неизвестный первичный HNSCC) также были исключены.
Пациенты с плоскоклеточным раком в шейных лимфатических узлах без идентифицируемой первичной опухоли слизистой оболочки (неизвестный первичный HNSCC) также были исключены.
Пациентам с первичным поражением ротоглотки также была проведена иммуногистохимическая характеристика р16 как непрямого суррогатного (прогностического) маркера вируса папилломы человека (ВПЧ). Пациенты с HNSCC были стадированы с использованием Руководства по стадированию рака 8-го издания Американского объединенного комитета по раку (AJCC). 13 Сопутствующие заболевания и прием лекарств регистрировались и классифицировались на основе оценки Американского общества анестезиологов (ASA) (таблица 1).
Таблица 1. Сравнение демографических данных, сопутствующих заболеваний и лекарств в группах больных раком и в контрольной группе.
Полноразмерный стол
Сбор образцов дыхания
С пациентами, которым планировалась плановая процедура, связывались за день до сбора образцов, и для уменьшения контаминации образцов дыхания их проинструктировали не пользоваться парфюмерными или дезодорантными спреями, не чистить зубы щеткой. зубы, не курить и не пользоваться жидкостью для полоскания рта утром в день взятия образца. Пациенты в основном соблюдали все вышеуказанные инструкции, за исключением 73% пациентов, которые чистили зубы перед взятием проб. Среднее время между чисткой зубов и сбором дыхания составляло 3 часа (диапазон 2–6 часов). 14 Пациенты голодали в течение ночи в течение как минимум 6 часов в соответствии с требованиями к анестезии для запланированных хирургических процедур. Все образцы выдыхаемого воздуха были собраны проспективно в периоперационных условиях до любых хирургических процедур или введения анестезии.
зубы, не курить и не пользоваться жидкостью для полоскания рта утром в день взятия образца. Пациенты в основном соблюдали все вышеуказанные инструкции, за исключением 73% пациентов, которые чистили зубы перед взятием проб. Среднее время между чисткой зубов и сбором дыхания составляло 3 часа (диапазон 2–6 часов). 14 Пациенты голодали в течение ночи в течение как минимум 6 часов в соответствии с требованиями к анестезии для запланированных хирургических процедур. Все образцы выдыхаемого воздуха были собраны проспективно в периоперационных условиях до любых хирургических процедур или введения анестезии.
По прибытии в больницу пациентов просили отдохнуть в постели (в палате с четырьмя-шестью отсеками) в течение не менее пятнадцати минут до сбора образцов. В течение периода отдыха перед сбором образцов была собрана структурированная история болезни пациента с использованием вопросника. Это включало статус курения, годы курения, потребление алкоголя (дней в неделю), сопутствующие заболевания, рост, вес, время голодания, чистку зубов, использование жидкости для полоскания рта и использование жевательной резинки. Затем их попросили сделать глубокий вдох через нос с последующим однократным непрерывным форсированным выдохом через рот (с закрытыми ноздрями) в герметичный 3-литровый пакет FlexFoil® PLUS® (SKC Ltd, Пенсильвания, США). в пробе смешанного альвеолярного газа (смесь альвеолярного воздуха и воздуха мертвого пространства для дыхания). 15 В то время как вместимость мешков для образцов составляла 3 литра, объем выдыхаемого воздуха варьировался у разных пациентов (не измерялся). Проба комнатного воздуха была собрана в другой пакет FlexFoil® PLUS® сразу после сбора пробы дыхания для сравнения и проверки качества. Затем образцы транспортировали в термостабильный пакет (Esky®, Coleman Brands, Новый Южный Уэльс, Австралия) при температуре 37°C (изотермические прокладки Deltaphase®, Braintree Scientific Inc, Массачусетс, США) в лабораторию для немедленного анализа. Все мешки FlexFoil® PLUS® предварительно кондиционировали путем промывки 99% газообразный азот пять раз перед сбором образца дыхания.
Затем их попросили сделать глубокий вдох через нос с последующим однократным непрерывным форсированным выдохом через рот (с закрытыми ноздрями) в герметичный 3-литровый пакет FlexFoil® PLUS® (SKC Ltd, Пенсильвания, США). в пробе смешанного альвеолярного газа (смесь альвеолярного воздуха и воздуха мертвого пространства для дыхания). 15 В то время как вместимость мешков для образцов составляла 3 литра, объем выдыхаемого воздуха варьировался у разных пациентов (не измерялся). Проба комнатного воздуха была собрана в другой пакет FlexFoil® PLUS® сразу после сбора пробы дыхания для сравнения и проверки качества. Затем образцы транспортировали в термостабильный пакет (Esky®, Coleman Brands, Новый Южный Уэльс, Австралия) при температуре 37°C (изотермические прокладки Deltaphase®, Braintree Scientific Inc, Массачусетс, США) в лабораторию для немедленного анализа. Все мешки FlexFoil® PLUS® предварительно кондиционировали путем промывки 99% газообразный азот пять раз перед сбором образца дыхания.
Масс-спектрометрия
По прибытии в лабораторию образцы хранились в специальном инкубаторе при 37 °C и анализировались в течение трех часов с момента сбора с помощью масс-спектрометрии с выбранной ионной проточной трубкой (SIFT-MS; Voice 200 ® , Syft ® Technologies, Крайстчерч, Новая Зеландия). SIFT-MS калибровали два раза в день (утром и днем) с использованием стандартной газовой смеси (1,2,3,4-тетрафторбензол, бензол, этилен, изобутан, октафтортолуол, п-ксилол, перфторбензол, толуол и азот – специальность Scotty®). газы, Пенсильвания, США).
Для анализа проб перегородка мешка SKC ® FlexFoil ® PLUS ® была проколота иглой без сердцевины и присоединена непосредственно к SIFT-MS «дыхательная головка» (Voice 200 ® ). , Syft ® Technologies, Крайстчерч, Новая Зеландия). Все образцы (включая комнатный воздух) сканировали в режиме полномассового сканирования (15–250 m/z) с тремя ионами-реагентами (H 3 O + , NO + , O 2 + ). на 30 циклов. Приблизительно один литр пробы газа был использован для анализа SIFT-MS; однако чувствительность анализа SIFT-MS не зависит от объема. Интенсивности, скорректированные прибором, для всех соотношений массы и заряда были извлечены из файлов, сгенерированных прибором. В целом 15 мл образцов выдыхаемого воздуха также анализировали с помощью масс-спектрометрии с изотопным соотношением (Sercon®, Крю, Великобритания) для количественного определения углекислого газа. Образцы, в которых было обнаружено <3% углекислого газа в выдыхаемом воздухе, были исключены из дальнейшего анализа, так как это было бы меньшим, чем ожидалось, уровнем углекислого газа в образце смешанного альвеолярного дыхания. 16
на 30 циклов. Приблизительно один литр пробы газа был использован для анализа SIFT-MS; однако чувствительность анализа SIFT-MS не зависит от объема. Интенсивности, скорректированные прибором, для всех соотношений массы и заряда были извлечены из файлов, сгенерированных прибором. В целом 15 мл образцов выдыхаемого воздуха также анализировали с помощью масс-спектрометрии с изотопным соотношением (Sercon®, Крю, Великобритания) для количественного определения углекислого газа. Образцы, в которых было обнаружено <3% углекислого газа в выдыхаемом воздухе, были исключены из дальнейшего анализа, так как это было бы меньшим, чем ожидалось, уровнем углекислого газа в образце смешанного альвеолярного дыхания. 16
Анализ данных
Размер выборки, необходимый для статистического моделирования, был рассчитан на основе распространенности заболевания и фиксированной ошибки I рода с мощностью не менее 80%. Точечная распространенность HNSCC в нашем наборе данных была искусственно установлена на уровне 50% путем уравновешивания раковых и контрольных групп. Таблицы расчета размера выборки, опубликованные Bujang et al. 17 использовались для оценки минимального общего размера выборки, равного 62, с минимум 31 пациентом с ПРГШ, для проверки чувствительности 70% и специфичности 70% с мощностью 80%.
Таблицы расчета размера выборки, опубликованные Bujang et al. 17 использовались для оценки минимального общего размера выборки, равного 62, с минимум 31 пациентом с ПРГШ, для проверки чувствительности 70% и специфичности 70% с мощностью 80%.
Все статистические анализы проводились с использованием IBM ® SPSS ® (версия 26. Чикаго, США, с R © , версия 3.5 — расширения). Нормальность распределения данных проверяли с помощью критерия Колмогорова–Смирнова. Фиксированные факторы пациента сравнивали между онкологическими и контрольными группами с использованием критерия Манна-Уитни-U (MWU) для непрерывных фиксированных факторов пациента (возраст, годы курения и индекс массы тела [ИМТ]) и критерия хи-квадрат для категориальных фиксированных факторов пациента ( пол, статус курения, потребление алкоголя, класс ИМТ, ASA, сопутствующие заболевания, прием лекарств и статус чистки зубов) (таблица 1). Связи между категориальными факторами пациента и производными SIFT-MS переменными оценивались с использованием U-критерия Манна-Уитни (с поправкой Бонферрони). Ро-критерий Спирмена использовался для определения связи между непрерывными факторами пациента и производными переменными SIFT-MS. Статистически значимой ассоциацию считали, если р < 0,05.
Ро-критерий Спирмена использовался для определения связи между непрерывными факторами пациента и производными переменными SIFT-MS. Статистически значимой ассоциацию считали, если р < 0,05.
Был проведен анализ нулевого значения, в котором переменные с более чем 70% показаний нулевого значения были исключены, поскольку было трудно установить, связано ли нулевое показание с пределом обнаружения прибора или это было истинное нулевое показание для этого образец. Массы, о которых известно, что они конфликтуют с ионами реагентов (сообщается производителем прибора), также исключались из дальнейшего анализа. Переменные, которые указывали на значительную связь с фиксированными факторами пациента, также были исключены. После процесса оптимизации данных 440 переменных были доступны для прогностического анализа. Затем набор данных был случайным образом разделен на 70% ( n = 76) обучающих и 30% ( n = 24) тестовых наборов данных с использованием функции SPSS «Выбрать случаи» (дополнительная таблица 1). Рабочий процесс анализа данных кратко показан на рис. 1.
Рабочий процесс анализа данных кратко показан на рис. 1.
Рис. 1
Конвейер анализа данных для выбора случаев, оптимизации данных, разделения данных обучения/тестирования, уменьшения размеров, построения и тестирования модели.
Полноразмерное изображение
Уменьшение размерности и выбор предиктора
С помощью обучающего набора данных ROC-анализ с AUC был рассчитан и ранжирован для отдельных переменных, полученных с помощью SIFT MS. Два дополнительных метода были использованы для выбора предиктора. Сначала были извлечены 10 основных переменных для каждого из ионов реагента (дополнительная таблица 2). Во-вторых, были выбраны только статистически значимо отличающиеся переменные (смесь всех трех ионов реагентов) от базовой AUC 0,5 (дополнительная таблица 3).
Модель логистической регрессии
Пол пациента и ИМТ значительно различались в контрольной группе и группе больных раком (таблица 1). Поэтому прогностическая эффективность этих фиксированных факторов оценивалась индивидуально в модели логистической регрессии (дополнительная таблица 4). Ряд моделей логистической регрессии был создан с использованием обучающего набора данных на основе двух наборов переменных, выбранных выше, для достижения ROC AUC выше 0,8 с чувствительностью и специфичностью выше 70% в наборе тестовых данных при минимальном количестве используемых переменных (дополнительный Таблицы 5 и 6). Приведенные здесь доверительные интервалы были скорректированы на основе процедуры начальной загрузки 1000 выборок для повышения достоверности. Переменные, включенные в окончательные модели, были повторно протестированы на связанных факторах пациента, чтобы подтвердить отсутствие систематической ошибки, зависящей от фиксированного фактора (дополнительная таблица 7).
Ряд моделей логистической регрессии был создан с использованием обучающего набора данных на основе двух наборов переменных, выбранных выше, для достижения ROC AUC выше 0,8 с чувствительностью и специфичностью выше 70% в наборе тестовых данных при минимальном количестве используемых переменных (дополнительный Таблицы 5 и 6). Приведенные здесь доверительные интервалы были скорректированы на основе процедуры начальной загрузки 1000 выборок для повышения достоверности. Переменные, включенные в окончательные модели, были повторно протестированы на связанных факторах пациента, чтобы подтвердить отсутствие систематической ошибки, зависящей от фиксированного фактора (дополнительная таблица 7).
Результаты
Всего был набран 181 пациент. 74 пациента были исключены из-за рака в анамнезе ( n = 23), дисплазии высокой степени ( n = 7), неизвестного первичного ПРГШ ( n = 3), активной инфекции или низкой концентрации углекислого газа в дыхании. образец ( n = 41).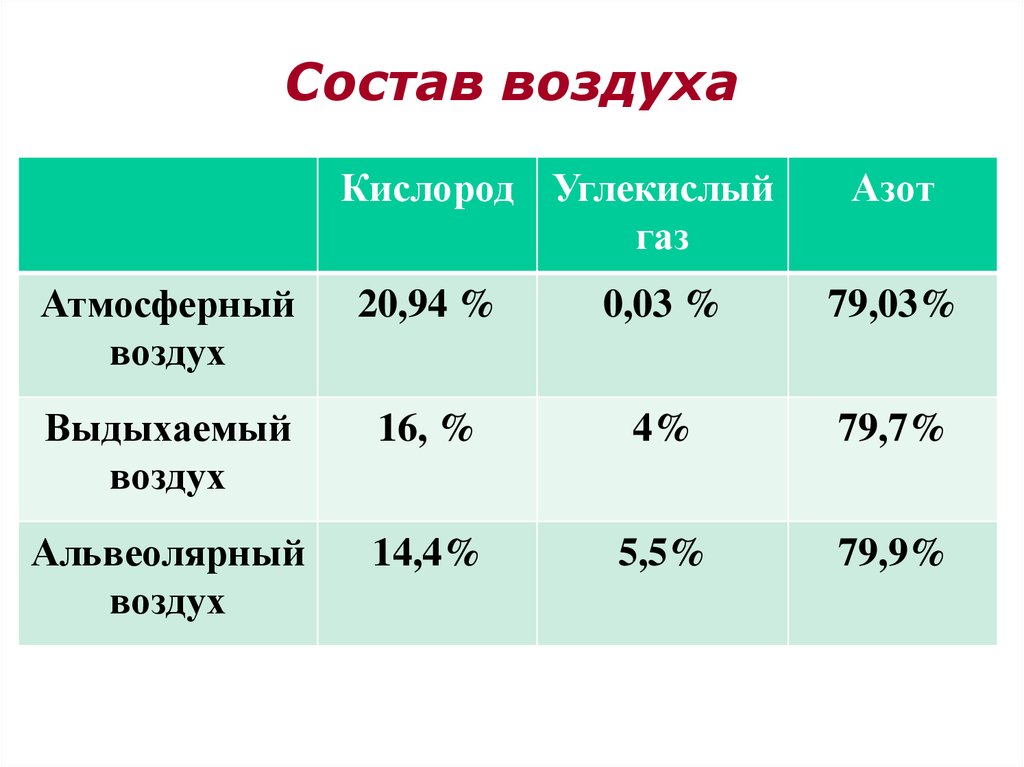 Из оставшихся 107 пациентов для дальнейшего анализа были выбраны последовательные контрольные ( n = 50) и пациенты с онкологическими заболеваниями ( n = 50) для дальнейшего анализа, чтобы поддерживать предтестовую вероятность на уровне 0,5 (50% — искусственная точечная распространенность). Отбор проб и обработка дыхания не привели к каким-либо неблагоприятным событиям. Общее время для сбора образца дыхания пациента после инструктажа и демонстрации составило приблизительно одну минуту.
Из оставшихся 107 пациентов для дальнейшего анализа были выбраны последовательные контрольные ( n = 50) и пациенты с онкологическими заболеваниями ( n = 50) для дальнейшего анализа, чтобы поддерживать предтестовую вероятность на уровне 0,5 (50% — искусственная точечная распространенность). Отбор проб и обработка дыхания не привели к каким-либо неблагоприятным событиям. Общее время для сбора образца дыхания пациента после инструктажа и демонстрации составило приблизительно одну минуту.
Пациенты контрольной группы имели нормальные результаты исследования верхних отделов пищеварительного тракта или доброкачественные результаты биопсии после гистологического анализа. Группа HNSCC состояла преимущественно из мужчин ( p = 0,001) и имела более низкий ИМТ, чем контрольная группа ( p = 0,002). Не было существенной разницы в возрасте, статусе курения, количестве выкуриваемых пачек в годах и потреблении алкоголя между группами ( p > 0,05). Большинство пациентов в контрольной группе имели оценку по ASA 2 или ниже без сопутствующих заболеваний, приводящих к потере трудоспособности. Однако четыре контрольных пациента были классифицированы как ASA 3 из-за патологического ожирения (таблица 1). Наблюдалась значительная разница между состоянием чистки зубов между онкологическими и контрольными группами пациентов (9).0255 p = 0,015). Специфические для рака факторы, включая область головы и шеи и стадию опухоли, представлены в таблице 2. Пациенты с HNSCC в основном состояли из ротоглоточного плоскоклеточного рака (46%), затем ротовой полости (32%) и гортанного плоскоклеточного рака (30%). Девятнадцать (83%) ПКР ротоглотки были положительными по p16. Метастазы в регионарные лимфатические узлы были обнаружены у 58% пациентов. У большинства (68%) пациентов с ПРГШ была ранняя Т-стадия (Т1 или Т2) (таблица 2).
Однако четыре контрольных пациента были классифицированы как ASA 3 из-за патологического ожирения (таблица 1). Наблюдалась значительная разница между состоянием чистки зубов между онкологическими и контрольными группами пациентов (9).0255 p = 0,015). Специфические для рака факторы, включая область головы и шеи и стадию опухоли, представлены в таблице 2. Пациенты с HNSCC в основном состояли из ротоглоточного плоскоклеточного рака (46%), затем ротовой полости (32%) и гортанного плоскоклеточного рака (30%). Девятнадцать (83%) ПКР ротоглотки были положительными по p16. Метастазы в регионарные лимфатические узлы были обнаружены у 58% пациентов. У большинства (68%) пациентов с ПРГШ была ранняя Т-стадия (Т1 или Т2) (таблица 2).
Таблица 2 Описание факторов, специфичных для рака.
Полноразмерная таблица
Прогностическое моделирование
Модели биномиальной логистической регрессии, созданные на основе переменных масс-спектрометрии, полученных из выдыхаемого воздуха, позволили классифицировать пациентов по раковым и контрольным группам. Точность этой классификации сохранялась при тестировании на независимой когорте с AUC до 0,9 с 15 переменными (дополнительная таблица 5). Тем не менее, сохранение чувствительности и специфичности модели и уменьшение переобучения данных привели к оптимальной модели с двумя переменными (Модель 1) с общей точностью классификации 83% (AUC 0,814·9).5% ДИ 0,611–1,000), чувствительность 80% и специфичность 86% (рис. 2). В этой модели использовались переменные R30P147 и R19P49. Эти переменные относятся к двум различным ионам-реагентам, и добавление третьей переменной (Модель 2) из другого иона-реагента (R32P135) незначительно улучшает общую модель (AUC 0,821, 95% ДИ 0,625–1,000, рис. 3).
Точность этой классификации сохранялась при тестировании на независимой когорте с AUC до 0,9 с 15 переменными (дополнительная таблица 5). Тем не менее, сохранение чувствительности и специфичности модели и уменьшение переобучения данных привели к оптимальной модели с двумя переменными (Модель 1) с общей точностью классификации 83% (AUC 0,814·9).5% ДИ 0,611–1,000), чувствительность 80% и специфичность 86% (рис. 2). В этой модели использовались переменные R30P147 и R19P49. Эти переменные относятся к двум различным ионам-реагентам, и добавление третьей переменной (Модель 2) из другого иона-реагента (R32P135) незначительно улучшает общую модель (AUC 0,821, 95% ДИ 0,625–1,000, рис. 3).
Рис. 2
Модель 1 — Рабочая кривая приемника тестируемой когорты на основе модели логистической регрессии с использованием двух переменных от разных ионов реагентов.
Изображение в натуральную величину
Рис. 3
Модель 2 — Кривая работы приемника тестируемой когорты на основе модели логистической регрессии с одной переменной от каждого иона-реагента (всего три переменные).
Полноразмерное изображение
Гендерный классификационный анализ Модели 1 с использованием тестируемой когорты показал общую точность 79 и 90% для мужских и женских когорт соответственно. Переменные, содержащиеся в модели 1 (R30P147 и R19P49), использовались для создания новых моделей с полом в качестве зависимой переменной (дополнительная таблица 8). Эти переменные как отдельные классификаторы, так и в комбинации плохо показали себя при прогнозировании пола с максимальным значением AUC для тренировочного набора, равным 0,59.1 (95% ДИ 0,458–0,723) и набор тестов AUC 0,5 (95% ДИ 0261–0,739). Не было линейной зависимости (на основе линейной регрессии) между ИМТ и переменными, используемыми в модели 1 или модели 2 (дополнительная таблица 7). Исследование данных с анализом основных компонентов с переменными, используемыми для модели 1 и модели 2, также не классифицировало пациентов по полу, ИМТ или статусу чистки зубов (дополнительный рисунок 1).
Независимая библиотека соединений Syft® была исследована с использованием программного обеспечения LabSyft® (версия 1. 5.1, Syft®, Крайстчерч, Новая Зеландия) для определения ЛОС, вносящих вклад в массу ионов продукта, включенных в описанное выше моделирование. ЛОС с плохим коэффициентом ветвления (<0,2), низкой скоростью реакции (<1,0 e -11 ), а изомеры с одинаковым первичным химическим составом были исключены. Два из десяти соединений, которые соответствовали базовому химическому составу производных переменных SIFT-MS, ранее были описаны как предикторы рака легких и полости рта (таблица 3). 18,19
5.1, Syft®, Крайстчерч, Новая Зеландия) для определения ЛОС, вносящих вклад в массу ионов продукта, включенных в описанное выше моделирование. ЛОС с плохим коэффициентом ветвления (<0,2), низкой скоростью реакции (<1,0 e -11 ), а изомеры с одинаковым первичным химическим составом были исключены. Два из десяти соединений, которые соответствовали базовому химическому составу производных переменных SIFT-MS, ранее были описаны как предикторы рака легких и полости рта (таблица 3). 18,19
Таблица 3 Летучие органические соединения, соответствующие ионам массы продукта.
Полноразмерная таблица
Обсуждение
В этом исследовании описывается новый дыхательный тест для выявления HNSCC с чувствительностью 80% и специфичностью 86% в оптимальной модели. Надежность этого дыхательного теста была продемонстрирована стабильно высокими показателями, отмеченными в независимой группе тестирования. Прогностическая способность этого теста значительно выше, чем та, о которой сообщается только для клинических симптомов и осмотра, 7 позволяет предположить, что необработанный масс-спектрометрический анализ дыхания для HNSCC может улучшить текущую клиническую практику. Кроме того, в этом исследовании представлен новый метод анализа исходных данных, полученных с помощью SIFT-MS.
Кроме того, в этом исследовании представлен новый метод анализа исходных данных, полученных с помощью SIFT-MS.
Пациенты с подозрением на рак головы и шеи часто обращаются в учреждения первичной медико-санитарной помощи с неспецифическими симптомами верхних дыхательных путей; однако полное обследование врачом общей практики ограничено техническими ограничениями. В то время как полость рта, часть ротоглотки и наружную часть шеи могут тщательно осмотреть врачи общей практики, носоглотку, основание языка и гортань можно осмотреть только в специализированных клиниках с использованием гибких эндоскопов. Кроме того, маловероятно, что на ранней стадии HNSCC будут проявляться явные макроскопические клинические признаки, и они могут быть не видны на изображениях поперечного сечения. Поэтому, когда пациент обращается к врачу первичного звена с симптомами верхних дыхательных путей без четкого профиля риска, связанного с HNSCC, вместо рассмотрения антибиотиков или принятия решения наблюдать и ждать, можно рассмотреть возможность проведения теста на выдыхаемый воздух.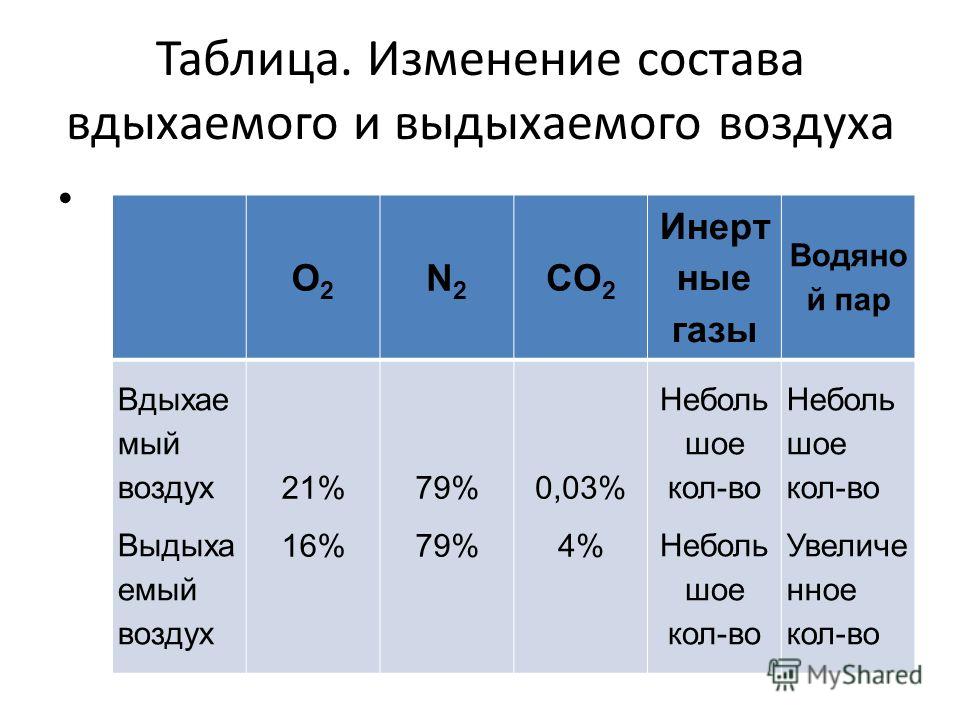 Учитывая высокую чувствительность и специфичность нашего дыхательного теста, мы предполагаем, что положительный результат может вызвать срочное направление к специалисту для дальнейшего обследования. Отрицательный результат может служить основанием для краткосрочного наблюдения или лечения с дальнейшими исследованиями, если симптомы сохраняются. Цель такого дыхательного теста не состоит в том, чтобы заменить клиническую экспертизу или диагностические процедуры, такие как панэндоскопия и биопсия под общей анестезией. Вместо этого дыхательный тест может обеспечить систему сортировки пациентов, которая позволит стратифицировать пациентов и потенциально снизит нагрузку со стороны ресурсов здравоохранения. 20
Учитывая высокую чувствительность и специфичность нашего дыхательного теста, мы предполагаем, что положительный результат может вызвать срочное направление к специалисту для дальнейшего обследования. Отрицательный результат может служить основанием для краткосрочного наблюдения или лечения с дальнейшими исследованиями, если симптомы сохраняются. Цель такого дыхательного теста не состоит в том, чтобы заменить клиническую экспертизу или диагностические процедуры, такие как панэндоскопия и биопсия под общей анестезией. Вместо этого дыхательный тест может обеспечить систему сортировки пациентов, которая позволит стратифицировать пациентов и потенциально снизит нагрузку со стороны ресурсов здравоохранения. 20
Признанным ограничением нашего исследования было то, что пол и ИМТ значительно различались между группами сравнения (таблица 1). С эпидемиологической точки зрения HNSCC преимущественно поражает мужское население 21 , а потеря веса является хорошо задокументированным отличительным признаком злокачественности и маркером плохого прогноза. 22 Мы использовали одномерные статистические сравнения до выбора классификатора, чтобы гарантировать, что переменные, используемые при создании модели, не были связаны с полом или ИМТ. Переменные, выбранные для этих моделей, не классифицировали пациентов по полу и ИМТ, что указывает на то, что выбранные классификаторы не зависят исключительно от этих факторов пациента (дополнительная таблица 7 и дополнительный рисунок 1). Кроме того, сообщается, что соединения выдыхаемого воздуха относятся к полу 9.0257 23 и ИМТ 24 не были связаны с производными переменными SIFT-MS, включенными в нашу окончательную модель. Будущие исследования показаны с использованием более крупных когорт для проверки моделей на основе пола или конкретных групп ИМТ.
22 Мы использовали одномерные статистические сравнения до выбора классификатора, чтобы гарантировать, что переменные, используемые при создании модели, не были связаны с полом или ИМТ. Переменные, выбранные для этих моделей, не классифицировали пациентов по полу и ИМТ, что указывает на то, что выбранные классификаторы не зависят исключительно от этих факторов пациента (дополнительная таблица 7 и дополнительный рисунок 1). Кроме того, сообщается, что соединения выдыхаемого воздуха относятся к полу 9.0257 23 и ИМТ 24 не были связаны с производными переменными SIFT-MS, включенными в нашу окончательную модель. Будущие исследования показаны с использованием более крупных когорт для проверки моделей на основе пола или конкретных групп ИМТ.
Между группами сравнения наблюдалось значительное несоответствие в отношении статуса чистки зубов до выборки (таблица 1). В этом исследовании связь между статусом чистки зубов и классификаторами рассматривалась с использованием одномерного статистического сравнения и исключалась до создания модели. Вадхвана и др. сообщили о влиянии различных методов очистки полости рта на пробы ЛОС выдыхаемого воздуха, которые были отобраны сразу после очистки полости рта, обнаруживая различия в зависимости от типа очищающего средства, интересующего соединения и времени между указанной очисткой и отбором проб выдыхаемого воздуха. 14 Концентрации ментона, декана, додекана и п-крезола в выдыхаемом воздухе увеличились, в то время как концентрации аммиака, бутановой кислоты и диметилдисульфида снизились, при этом не сообщалось об изменении уровней альдегидов, алкоголя и некоторых углеводородов после чистки зубов. 14 В нашем исследовании участники, которые чистили зубы, делали это по крайней мере за три часа до отбора проб выдыхаемого воздуха, что сводило к минимуму любое потенциальное воздействие на сообщаемые летучие органические соединения в выдыхаемом воздухе. Кроме того, не было обнаружено связи между соединениями, которые могут меняться в зависимости от чистки зубов, и переменными, выбранными для создания модели в этом исследовании (таблица 3).
Вадхвана и др. сообщили о влиянии различных методов очистки полости рта на пробы ЛОС выдыхаемого воздуха, которые были отобраны сразу после очистки полости рта, обнаруживая различия в зависимости от типа очищающего средства, интересующего соединения и времени между указанной очисткой и отбором проб выдыхаемого воздуха. 14 Концентрации ментона, декана, додекана и п-крезола в выдыхаемом воздухе увеличились, в то время как концентрации аммиака, бутановой кислоты и диметилдисульфида снизились, при этом не сообщалось об изменении уровней альдегидов, алкоголя и некоторых углеводородов после чистки зубов. 14 В нашем исследовании участники, которые чистили зубы, делали это по крайней мере за три часа до отбора проб выдыхаемого воздуха, что сводило к минимуму любое потенциальное воздействие на сообщаемые летучие органические соединения в выдыхаемом воздухе. Кроме того, не было обнаружено связи между соединениями, которые могут меняться в зависимости от чистки зубов, и переменными, выбранными для создания модели в этом исследовании (таблица 3). Тем не менее, будущие валидационные исследования на более крупных когортах должны быть направлены на определение оптимального и последовательного метода очистки полости рта непосредственно перед сбором выдыхаемого воздуха.
Тем не менее, будущие валидационные исследования на более крупных когортах должны быть направлены на определение оптимального и последовательного метода очистки полости рта непосредственно перед сбором выдыхаемого воздуха.
SIFT-MS позволяет проводить полное сканирование массы образца, а также вычислять концентрации отдельных летучих органических соединений и подробно описано Spanel et al. 25 . Используя масс-спектры продуктов SIFT-MS, можно исследовать полный профиль дыхания участника, устраняя любую погрешность, связанную с расчетами концентрации летучих органических соединений. 25 Этот метод потенциально позволяет проводить кросс-платформенное сравнение наборов данных, облегчая проведение многоцентровых исследований. Шумцхард и др. сообщили об анализе необработанных масс-спектров образцов дыхания для HNSCC с использованием масс-спектрометрии реакции переноса протона, 26 сравнение масс продукта H 3 O + между HNSCC ( n = 22) и контрольными пациентами (доброкачественные, с высоким риском и после лечения). Они обнаружили 42 массы, которые значительно различались между группами, но не сообщали о чувствительности или специфичности для прямого сравнения. Хотя ни об одном из них (или о соответствующих ЛОС, идентифицированных с помощью библиотеки Syft®) не сообщалось в недавнем метаанализе Hanna et al. как предвестник рака. 8 Мы идентифицировали формальдегид и метилмеркаптан как потенциальные ЛОС, связанные с раком, с массой продукта 49на основе реагента H 3 O + (табл. 3). Сообщалось, что выдыхаемый формальдегид предсказывает первичный рак легких 18 , и считается, что он вызван метилотрофными бактериями, присутствующими в аэропищеварительном тракте. 27,28 Сообщалось о микробном дисбактериозе при раке, который может способствовать характерному профилю ЛОС. Точно так же метилмеркаптан представляет собой летучее соединение серы, обнаруживаемое в ротовой полости человека и часто вызывающее заболевания пародонта и неприятный запах изо рта.
Они обнаружили 42 массы, которые значительно различались между группами, но не сообщали о чувствительности или специфичности для прямого сравнения. Хотя ни об одном из них (или о соответствующих ЛОС, идентифицированных с помощью библиотеки Syft®) не сообщалось в недавнем метаанализе Hanna et al. как предвестник рака. 8 Мы идентифицировали формальдегид и метилмеркаптан как потенциальные ЛОС, связанные с раком, с массой продукта 49на основе реагента H 3 O + (табл. 3). Сообщалось, что выдыхаемый формальдегид предсказывает первичный рак легких 18 , и считается, что он вызван метилотрофными бактериями, присутствующими в аэропищеварительном тракте. 27,28 Сообщалось о микробном дисбактериозе при раке, который может способствовать характерному профилю ЛОС. Точно так же метилмеркаптан представляет собой летучее соединение серы, обнаруживаемое в ротовой полости человека и часто вызывающее заболевания пародонта и неприятный запах изо рта. 19 Клинически пациенты со злокачественными новообразованиями полости рта имеют сопутствующий неприятный запах изо рта. Хотя плохая гигиена полости рта или неприятный запах изо рта не являются прямым фактором риска развития рака, объективное измерение неприятного запаха изо рта с помощью летучих соединений серы, таких как метилмеркаптан, может помочь в стратификации риска у пациентов с плохой гигиеной полости рта.
19 Клинически пациенты со злокачественными новообразованиями полости рта имеют сопутствующий неприятный запах изо рта. Хотя плохая гигиена полости рта или неприятный запах изо рта не являются прямым фактором риска развития рака, объективное измерение неприятного запаха изо рта с помощью летучих соединений серы, таких как метилмеркаптан, может помочь в стратификации риска у пациентов с плохой гигиеной полости рта.
Четыре предшествующих исследования с использованием анализа дыхания для выявления ПРГШ показали чувствительность в диапазоне от 77% до 100% и специфичность в диапазоне от 76% до 92%. 9,10,11,12 Общий размер выборки в этих исследованиях варьировался от 41 до 62 с неравными группами. 9,10,11,12 Хотя эти результаты являются многообещающими, статистическая мощность, основанная только на размере выборки, низка. Для сравнения, в нашем исследовании был больший размер выборки, с 50 онкологическими и 50 контрольными пациентами, обеспечивающий 80% статистическую мощность для определения чувствительности и специфичности выше 70%, для независимой проверки потребовалась бы гораздо большая выборка. 17 Однако только у 30% пациентов с ПРГШ в нашем текущем исследовании были стадии Т1 и Т2 без метастазов в лимфатических узлах, что ограничивает статистическую мощность для определения точности этой модели для выявления ПРГШ на ранней стадии. Следовательно, прежде чем рекомендовать этот дыхательный тест для рутинного клинического использования, необходимо провести крупномасштабное исследование точности диагностики в условиях первичной медико-санитарной помощи. Учитывая относительно низкую заболеваемость HNSCC, для адекватной мощности (> 80%) исследования первичной медико-санитарной помощи потребуется более 5000 участников. Крупномасштабное многоцентровое исследование (исследование PAN, ClinicalTrials.gov, идентификатор: NCT0375659).7) для исследования анализа дыхания для выявления раннего рака у пациентов по всей Великобритании представляет собой пример дизайна исследования, необходимого для проверки этой новой технологии. 29
17 Однако только у 30% пациентов с ПРГШ в нашем текущем исследовании были стадии Т1 и Т2 без метастазов в лимфатических узлах, что ограничивает статистическую мощность для определения точности этой модели для выявления ПРГШ на ранней стадии. Следовательно, прежде чем рекомендовать этот дыхательный тест для рутинного клинического использования, необходимо провести крупномасштабное исследование точности диагностики в условиях первичной медико-санитарной помощи. Учитывая относительно низкую заболеваемость HNSCC, для адекватной мощности (> 80%) исследования первичной медико-санитарной помощи потребуется более 5000 участников. Крупномасштабное многоцентровое исследование (исследование PAN, ClinicalTrials.gov, идентификатор: NCT0375659).7) для исследования анализа дыхания для выявления раннего рака у пациентов по всей Великобритании представляет собой пример дизайна исследования, необходимого для проверки этой новой технологии. 29
С клинической точки зрения наиболее удобным использованием дыхательного теста было бы его использование в качестве устройства для оказания медицинской помощи, обеспечивающего немедленный результат для принятия клинического решения. Усовершенствованные интеллектуальные датчики газа (электронные носы) обычно используются в агентствах по обороне и охране окружающей среды для обнаружения токсичных газов в окружающей среде. 30 Различные датчики на основе наноматериалов также были разработаны для конкретных свойств обнаружения летучих органических соединений при разработке устройств для оказания медицинской помощи. 31 Эти массивы очень чувствительных детекторов газа могут профилировать сложные образцы газа, такие как дыхание человека, используя компьютеризированное распознавание образов, чтобы отличить рак от здоровых пациентов. 9,10 Таким образом, массы ионов-продуктов, определенные в этом исследовании, потенциально могут быть использованы для калибровки этих устройств для специфического выявления HNSCC, тем самым представляя путь для клинического применения.
Усовершенствованные интеллектуальные датчики газа (электронные носы) обычно используются в агентствах по обороне и охране окружающей среды для обнаружения токсичных газов в окружающей среде. 30 Различные датчики на основе наноматериалов также были разработаны для конкретных свойств обнаружения летучих органических соединений при разработке устройств для оказания медицинской помощи. 31 Эти массивы очень чувствительных детекторов газа могут профилировать сложные образцы газа, такие как дыхание человека, используя компьютеризированное распознавание образов, чтобы отличить рак от здоровых пациентов. 9,10 Таким образом, массы ионов-продуктов, определенные в этом исследовании, потенциально могут быть использованы для калибровки этих устройств для специфического выявления HNSCC, тем самым представляя путь для клинического применения.
Заключение
Это крупнейшее исследование на людях с использованием теста выдыхаемого воздуха для выявления HNSCC, и в нем была определена панель летучих органических соединений с чувствительностью 80% и специфичностью 86%. Следующим этапом является определение диагностической точности для HNSCC на ранней стадии по сравнению с контрольной группой без рака в условиях первичной медико-санитарной помощи. Перекрестная проверка этих результатов также важна для прямого сравнения с другими методами анализа дыхания. Тем не менее, этот дыхательный тест является многообещающим в качестве дополнения для улучшения выявления HNSCC.
Следующим этапом является определение диагностической точности для HNSCC на ранней стадии по сравнению с контрольной группой без рака в условиях первичной медико-санитарной помощи. Перекрестная проверка этих результатов также важна для прямого сравнения с другими методами анализа дыхания. Тем не менее, этот дыхательный тест является многообещающим в качестве дополнения для улучшения выявления HNSCC.
Ссылки
Xu, L., Dahlstrom, K.R., Lairson, D.R. & Sturgis, E.M. Прогноз заболеваемости раком ротоглотки среди мужчин среднего возраста. Зав. Шея 41 , 3226–3234 (2019).
Артикул
Google ученый
Лаприс, К., Мадатил, С.А., Шлехт, Н.Ф., Кастонгуай, Г., Сульерес, Д., Нгуен-Тан, П.Ф. и др. Повышенный риск рака ротоглотки, опосредованный оральной папилломавирусной инфекцией человека: результаты канадского исследования.
 Зав. Шея 41 , 678–685 (2019).
Зав. Шея 41 , 678–685 (2019).Артикул
Google ученый
Лехнер, М., Джонс, О.С., Бриз, К.Е. и Гилсон, Р. Гендерно-нейтральная вакцинация против ВПЧ в Великобритании, рост частоты рака ротоглотки у мужчин и отсутствие осведомленности о ВПЧ. Ланцет Заражение. Дис. 19 , 131–132 (2019).
Артикул
Google ученый
Дешлер, Д. Г., Ричмон, Дж. Д., Харивала, С. С., Феррис, Р. Л. и Ван, М. Б. «Новый» пациент с раком головы и шеи — молодой, некурящий, непьющий, положительный на ВПЧ: оценка. Отоларингол. Глава. Шея Surg. 151 , 375–380 (2014).
Артикул
Google ученый
Брей, Ф., Ферлей, Дж., Соэрджоматарам, И., Сигел, Р.Л., Торре, Л.А. и Джемал, А. Глобальная статистика рака 2018: Globocan оценки заболеваемости и смертности во всем мире для 36 видов рака в 185 странах.
 CA Рак J. Clin. 68 , 394–424 (2018).
CA Рак J. Clin. 68 , 394–424 (2018).Артикул
Google ученый
Герстнер А. О. Раннее выявление рака головы и шеи — текущее состояние и перспективы на будущее. Текущий номер GMS. Топ Оториноларингол. Хирургия шеи головы . 7 , Doc06 (2008 г.).
ПабМед
Google ученый
Тикка, Т., Праси, П. и Палери, В. Уточнение руководящих принципов направления больных раком головы и шеи: двухцентровый анализ 4715 направлений. клин. Отоларингол. 41 , 66–75 (2016).
КАС
СтатьяGoogle ученый
Ханна, Г. Б., Бошир, П. Р., Маркар, С. Р., и Романо, А. Точность и методологические проблемы тестов выдыхаемого воздуха на основе летучих органических соединений для диагностики рака, систематический обзор и метаанализ.
 JAMA Oncol . https://doi.org/10.1001/jamaoncol.2018.2815 (2019 г.).
JAMA Oncol . https://doi.org/10.1001/jamaoncol.2018.2815 (2019 г.).Леунис, Н., Буманс, М.Л., Кремер, Б., Дин, С., Стобберинг, Э., Кесселс, А.Г. и др. Применение электронного носа в диагностике рака головы и шеи. Ларингоскоп 124 , 1377–1381, https://doi.org/10.1002/lary.24463 (2014).
КАС
Статья
пабмедGoogle ученый
Хаким М., Биллан С., Тиш У., Пэн Г., Дворокинд И., Маром О. и др. Диагностика рака головы и шеи по выдыхаемому воздуху. руб. Дж. Рак 104 , 1649–1655 (2011).
КАС
СтатьяGoogle ученый
Грубер М., Тиш У., Джерис Р., Амаль Х., Хаким М., Ронен О. и др. Анализ выдыхаемого воздуха для диагностики плоскоклеточного рака головы и шеи: технико-экономическое обоснование. руб. Дж. Рак 111 , 790–798 (2014).

КАС
СтатьяGoogle ученый
Чандран, Д., Оои, Э. Х., Уотсон, Д. И., Холмуродова, Ф., Джениш, С., и Язбек, Р. Использование выбранной технологии масс-спектрометрии с ионным потоком для идентификации летучих органических соединений при обнаружение плоскоклеточного рака головы и шеи: экспериментальное исследование. Медицина . https://doi.org/10.3390/medicina55060306 (2019 г.).
Lydiatt, W.M., Patel, S.G., O’Sullivan, B., Brandwein, M.S., Ridge, J.A., Migliacci, J.C. et al. Рак головы и шеи — основные изменения в руководстве по стадированию рака восьмого издания американского объединенного комитета по раку. CA Cancer J. Clin. 67 , 122–137 (2017).
Артикул
Google ученый
Вадхвана Б., Беллуомо И., Бошир П. Р., Павлу К., Спанел П. и Ханна Г. Б. Влияние стратегий очистки полости рта на уровни летучих органических соединений в выдыхаемом воздухе.
 Быстрое общение. Масс-спектр. 34 , e8706 (2020).
Быстрое общение. Масс-спектр. 34 , e8706 (2020).КАС
СтатьяGoogle ученый
Маркар С.Р., Виггинс Т., Антонович С., Чин С.Т., Романо А., Николич К. и др. Оценка неинвазивного теста выдыхаемого воздуха для диагностики рака пищевода и желудка. JAMA Oncol. 4 , 970–976 (2018).
Артикул
Google ученый
Прейсс, Д. А., Азами, Т. и Урман, Р. Д. Для расчета легочного кровотока можно использовать вариации выделения углекислого газа при дыхании. Дж. Клин. Мед. Рез. 7 , 83–90 (2015).
Артикул
Google ученый
Буджанг, М. А. и Аднан, Т. Х. Требования к минимальному размеру выборки для анализа чувствительности и специфичности. Дж. Клин. Диагн. Рез. 10 , YE01–YE06 (2016).

ПабМед
ПабМед ЦентральныйGoogle ученый
Вехингер А., Шмид А., Мещеряков С., Ледоховски М., Грабмер К., Гастл Г. А. и соавт. Обнаружение рака легких с помощью масс-спектрометрического анализа выдыхаемого человеком газа реакции переноса протона. Междунар. Дж. Масс-спектр. 265 , 49–59 (2007).
КАС
СтатьяGoogle ученый
Сабо А., Тарнаи З., Берковиц С., Новак П., Мохачи А., Брауницер Г. и соавт. Измерение летучих соединений серы с помощью oralchroma(tm): методологическое усовершенствование. Дж. Дыхание. Рез. 9 , 016001 (2015).
Артикул
Google ученый
Park, J. & Look, K.A. Бремя расходов на здравоохранение при лечении рака в Соединенных Штатах. Запрос 56 , 1–9 (2019).
Артикул
Google ученый
«>Лангиус, Дж. А., Баккер, С., Ритвельд, Д. Х., Круизенга, Х. М., Лангендейк, Дж. А., Вейс, П. Дж. и соавт. Критическая потеря массы тела является основным прогностическим показателем специфической для заболевания выживаемости у пациентов с раком головы и шеи, получающих лучевую терапию. Бр. Дж. Рак 109 , 1093–1099 (2013).
КАС
СтатьяGoogle ученый
Дас М.К., Бишвал С.К., Дас А., Дабрал Д., Варшней А., Бадиредди В.К. и др. Исследование специфического для пола волатома выдыхаемого воздуха у людей с помощью gcxgc-tof-ms. Анал. хим. 86 , 1229–1237 (2014).

КАС
СтатьяGoogle ученый
Алкхури, Н., Энг, К., Сикач, Ф., Патель, Н., Ян, К., Бриндл, А. и др. Отпечатки детского ожирения: изменения летучих органических соединений у детей с ожирением по сравнению с контрольной группой. Педиатр. Обес. 10 , 23–29 (2015).
КАС
СтатьяGoogle ученый
Спэнел, П. и Смит, Д. Выбранная ионная трубка: метод количественного анализа следовых газов в воздухе и дыхании. Мед. биол. англ. вычисл. 34 , 409–419 (1996).
КАС
СтатьяGoogle ученый
Schmutzhard, J., Rieder, J., Deibl, M., Schwentner, I.M., Schmid, S., Lirk, P. et al. Пилотное исследование: летучие органические соединения как диагностический маркер опухолей головы и шеи. Зав. Шея 30 , 743–749 (2008).

Артикул
Google ученый
Ковалева О. В., Ромашин Д., Зборовская И. Б., Давыдов М. М., Шогенов М. С., Грачев А. Микробиом легких человека на пути к раку. J Иммунол. Рез . https://doi.org/10.1155/2019/1394191 (2019 г.).
Анести, В., Макдональд, И. Р., Рамасвами, М., Уэйд, В. Г., Келли, Д. П. и Вуд, А. П. Выделение и молекулярное обнаружение метилотрофных бактерий, встречающихся во рту человека. Окружающая среда. микробиол. 7 , 1227–1238 (2005).
КАС
СтатьяGoogle ученый
Abderrahman, B. Биопсия выдыхаемого воздуха: новая парадигма обнаружения рака. Онкол будущего. 15 , 1679–1682 (2019).
КАС
СтатьяGoogle ученый
Фэн С., Фарха Ф., Ли К., Ван Ю.
 , Сюй Ю., Чжан Т. и др. Обзор интеллектуальной технологии обнаружения газа. Датчики . https://doi.org/10.3390/s19173760 (2019).
, Сюй Ю., Чжан Т. и др. Обзор интеллектуальной технологии обнаружения газа. Датчики . https://doi.org/10.3390/s19173760 (2019).Броза Ю.Ю., Вишинкин Р., Бараш О., Наклех М.К. и Хейк Х. Синергизм между наноматериалами и летучими органическими соединениями для неинвазивной медицинской оценки. Хим. соц. Ред. 47 , 4781–4859 (2018).
КАС
СтатьяGoogle ученый
Benchetrit, L., Torabi, S.J., Tate, J.P., Mehra, S., Osborn, H.A., Young, M.R. et al. Гендерные различия в участии и лечении химиотерапии рака головы и шеи. Оральный. Онкол. 94 , 32–40 (2019).
Артикул
Google ученый
Ссылки на скачивание
Информация об авторе
Авторы и организации
Отделение оториноларингологии-хирургии головы и шеи, Медицинский центр Флиндерс, Бедфорд-Парк, Австралия
Нуван Дхармавардана, Чармейн Вудс и Энг Х. Оои
Дисциплина хирургии, Колледж медицины и общественного здравоохранения, Университет Флиндерс, Бедфорд Park, Australia
Nuwan Dharmawardana, Charmaine Woods, David I. Watson, Eng H. Ooi и Roger Yazbeck
Отделение респираторной медицины и медицины сна, Женская и детская больница, Северная Аделаида, Австралия
Томас Годдард
Авторы
- Нуван Дхармавардана
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Thomas Goddard
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Charmaine Woods
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - Дэвид И.
 Уотсон
УотсонПросмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Eng H. Ooi
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Roger Yazbeck
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Вклады
Н.Д. берет на себя полную ответственность за целостность данных и точность анализа данных. Концепция и дизайн исследования: Н.Д., Д.В., Э.О., Р.Ю. Сбор, анализ и интерпретация: Н.Д., Т.Г., Р.Ю. Составление статьи: Н.Д., Р.Ю. Критическая проверка статьи на предмет интеллектуального содержания: Н.Д., К.В., Д.В., Э.О., Р.Ю. Статистический анализ: Н.Д. Полученное финансирование: Н.Д., Э.О., Р.Ю. Административный: C.W. Руководство исследованием: E.O., R.Y. Ни один из авторов не сообщил о конфликте интересов.
Автор, ответственный за переписку
Переписка с
Нуван Дхармавардана.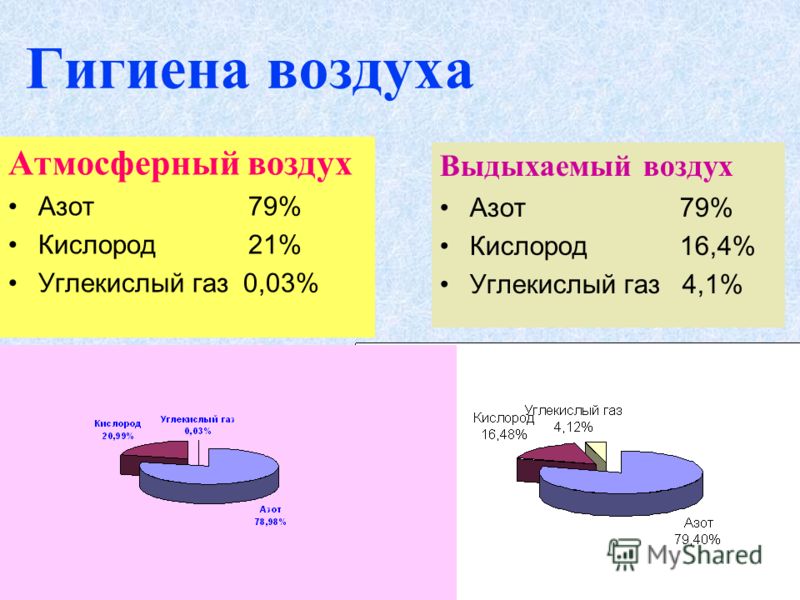
Декларации этики
Одобрение этики и согласие на участие
Одобрение этики (ссылочный номер HREC HREC/16/SAC/70) было получено от Комитета по этике человека местной сети здравоохранения Южной Аделаиды с утверждениями для конкретного места для Медицинского центра Флиндерс и Королевского Больница Аделаиды, Аделаида, Южная Австралия. Информированное согласие было получено от всех участников до сбора образцов. Соблюдались местные и международные рекомендации в соответствии с Хельсинкской декларацией для исследований с участием людей.
Доступность данных
Данные моделирования представлены в этой рукописи, а также в дополнительных таблицах. Деидентифицированные необработанные данные доступны по запросу.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Информация о финансировании
Д-р Дхармавардана финансировался Мемориальным фондом Гарнетта Пассе и Родни Уильямса — стипендией академического хирурга-ученого. Адъюнкт-профессор Оой и доктор Язбек финансировались Фондом Общества рака головы и шеи Австралии и Новой Зеландии. Д-р Язбек также получил поддержку исследовательской стипендии Кэтрин Мари Энрайт Келли.
Адъюнкт-профессор Оой и доктор Язбек финансировались Фондом Общества рака головы и шеи Австралии и Новой Зеландии. Д-р Язбек также получил поддержку исследовательской стипендии Кэтрин Мари Энрайт Келли.
Дополнительная информация
Примечание Эта работа опубликована на условиях стандартной лицензии на публикацию. Через 12 месяцев произведение станет свободно доступным, а условия лицензии изменятся на Creative Commons Attribution 4.0 International (CC BY 4.0).
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительный материал
Права и разрешения
Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы указываете соответствующие права на первоначальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения.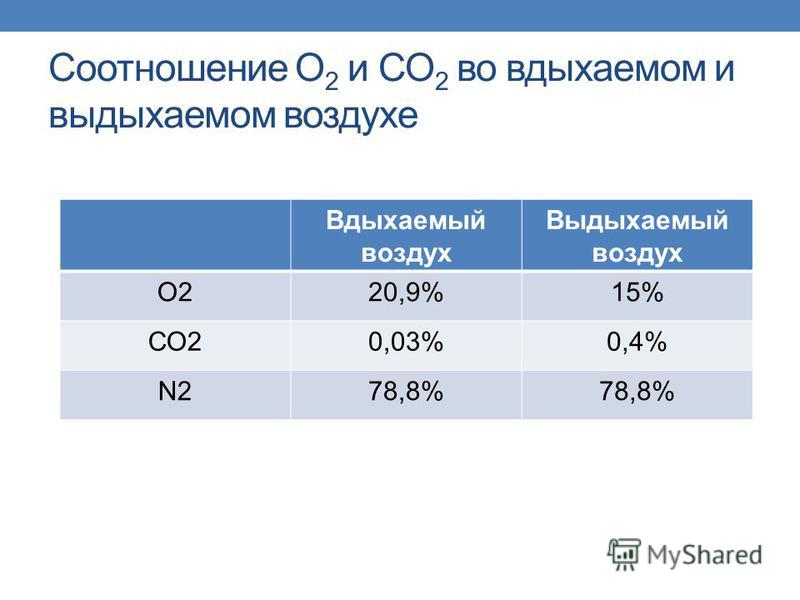

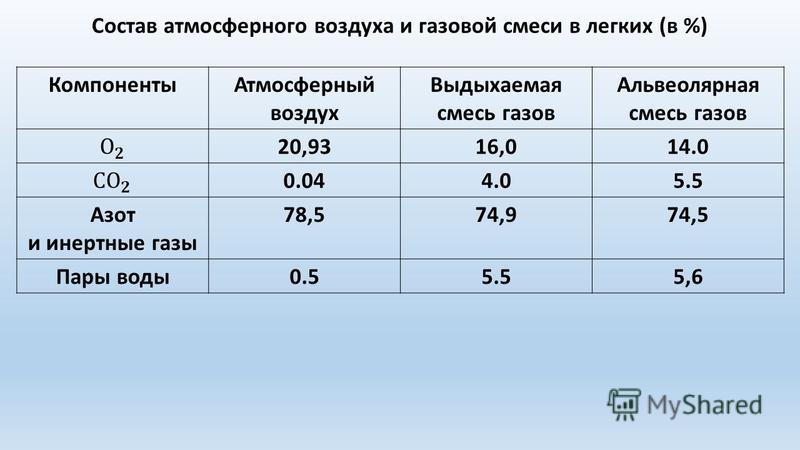
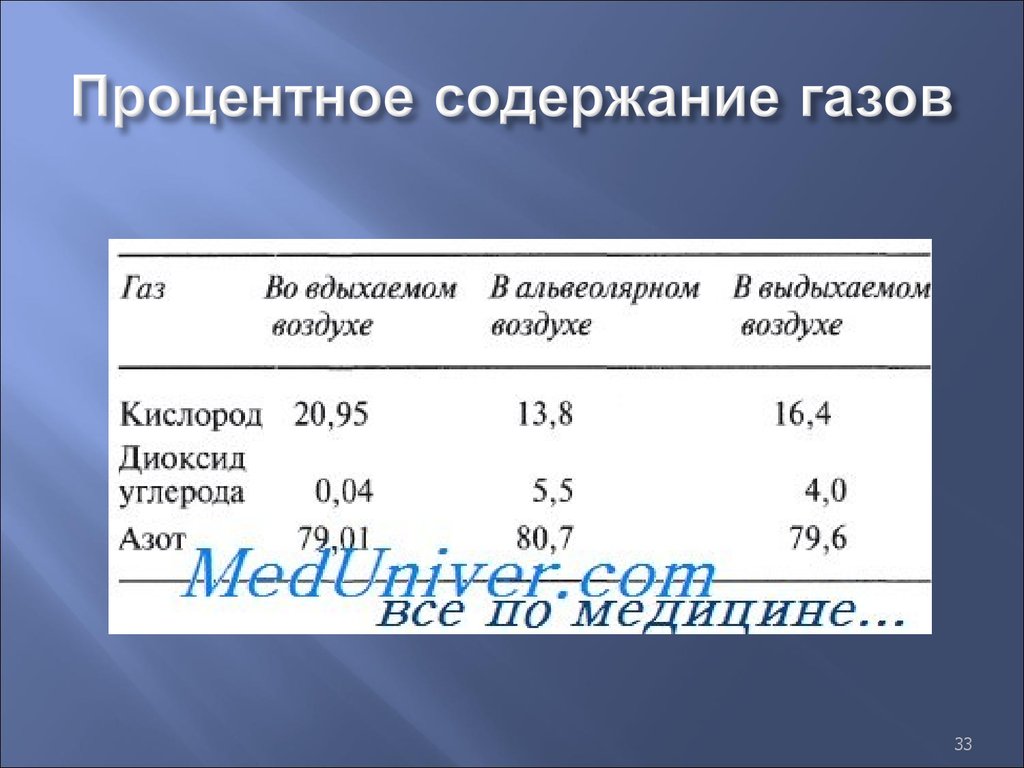 Зав. Шея 41 , 678–685 (2019).
Зав. Шея 41 , 678–685 (2019). CA Рак J. Clin. 68 , 394–424 (2018).
CA Рак J. Clin. 68 , 394–424 (2018).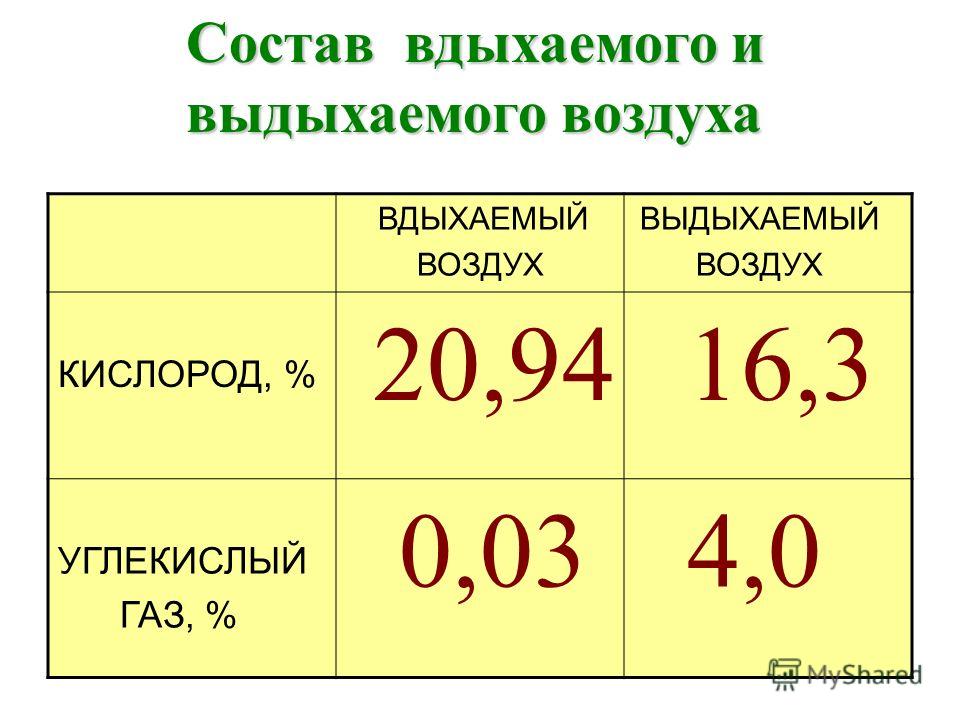 JAMA Oncol . https://doi.org/10.1001/jamaoncol.2018.2815 (2019 г.).
JAMA Oncol . https://doi.org/10.1001/jamaoncol.2018.2815 (2019 г.).
 Быстрое общение. Масс-спектр. 34 , e8706 (2020).
Быстрое общение. Масс-спектр. 34 , e8706 (2020).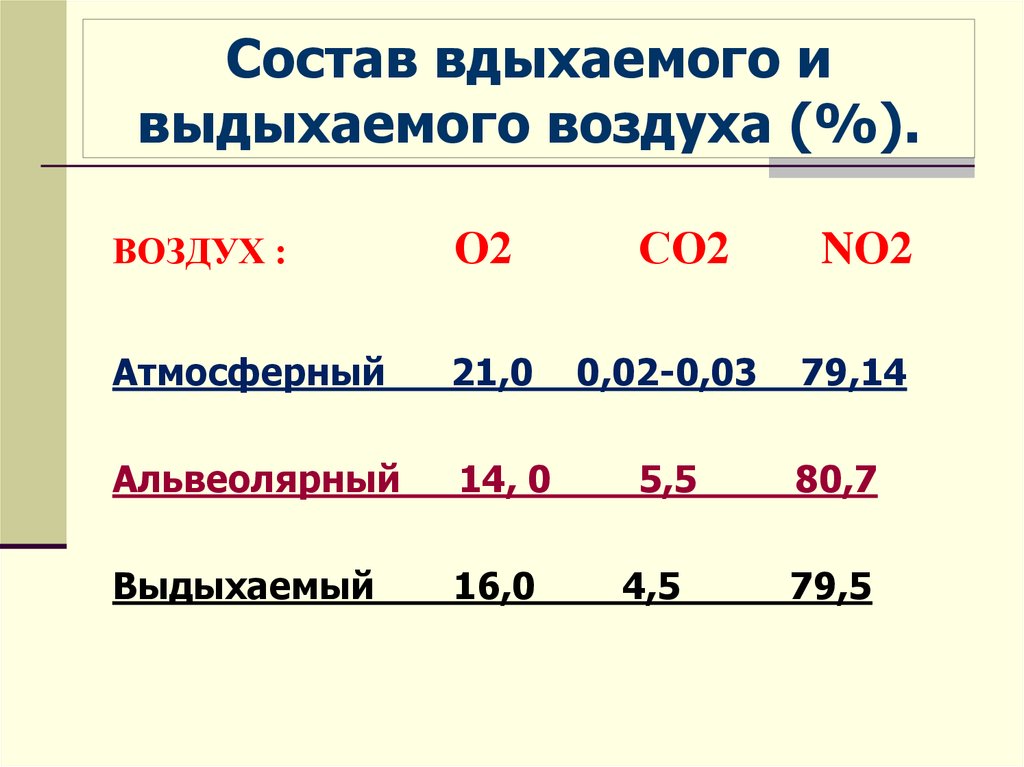
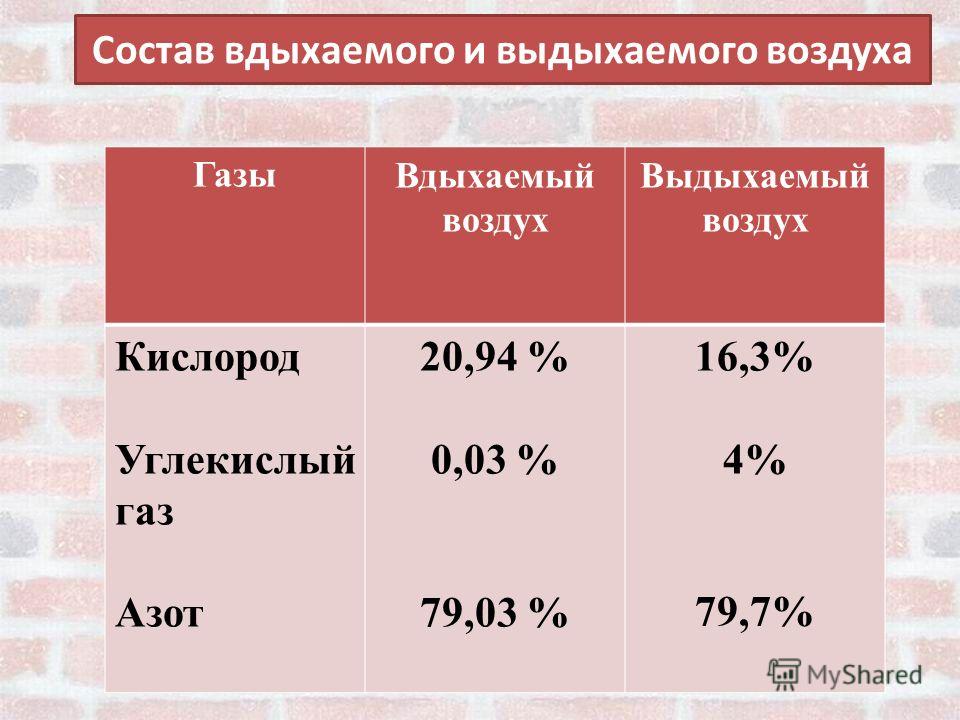
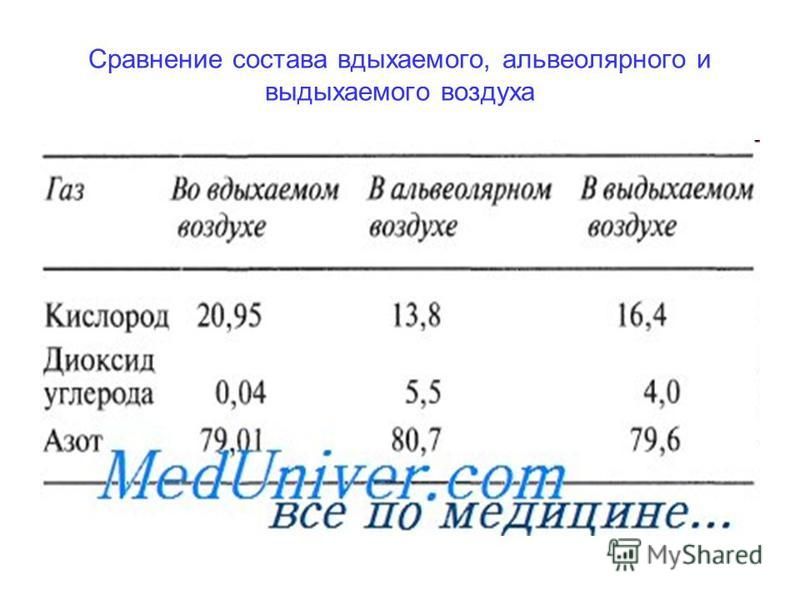
 , Сюй Ю., Чжан Т. и др. Обзор интеллектуальной технологии обнаружения газа. Датчики . https://doi.org/10.3390/s19173760 (2019).
, Сюй Ю., Чжан Т. и др. Обзор интеллектуальной технологии обнаружения газа. Датчики . https://doi.org/10.3390/s19173760 (2019).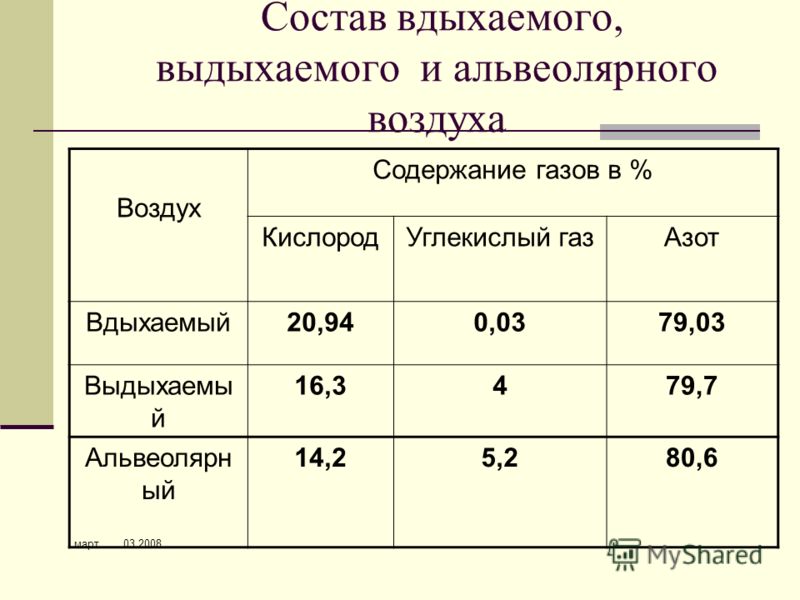 Уотсон
Уотсон