Содержание
Бактерии используют левозакрученную ДНК в качестве каркаса для биопленок
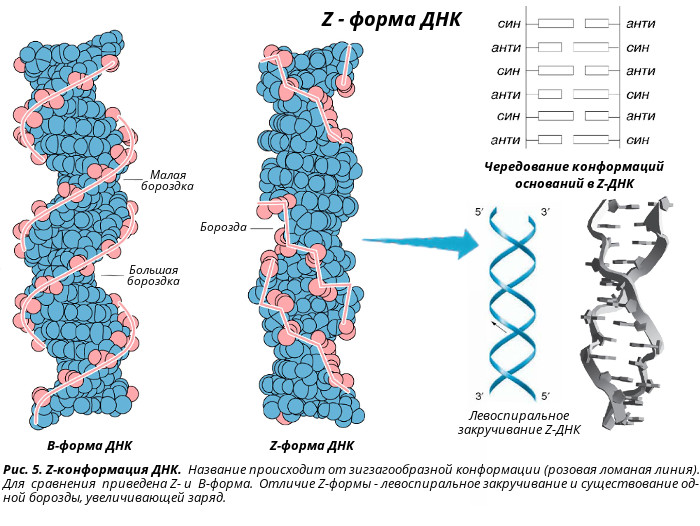
Двойные спирали молекул ДНК в живых клетках могут существовать в трех формах, различающихся геометрическими свойствами: правозакрученные A-ДНК и B-ДНК и левозакрученная Z-ДНК. Основная форма — B-ДНК, поэтому на нее «рассчитано» большинство клеточных белков, специализирующихся на взаимодействии с ДНК. Благодаря этому Z-ДНК, которая слишком сильно отличается от B-формы, для большинства клеточных ферментов недоступна. Как показано в недавнем исследовании, этим успешно пользуются некоторые бактерии, которые строят биопленки (в частности, на поверхности органов других организмов). Поскольку сами по себе молекулы ДНК довольно прочные, они хорошо подходят на роль каркаса биопленок. В процессе формирования биопленки бактерии при помощи специальных белков преобразуют выделяемую посредством аутолиза во внешнюю среду B-ДНК в Z-ДНК. Это делает каркас биопленки практически неуязвимым для иммунных клеток организма-хозяина.
Несмотря на то, что в мире бактерий отсутствует истинная многоклеточность, многие бактерии, в том числе и патогены человека, формируют сложно устроенные сообщества — биопленки. Биопленки покрывают, например, зубы, подводные камни и другие поверхности, на которых могут жить бактерии (а жить они могут почти везде).
Биопленка представляет собой матрикс сложного состава, в который погружены бактериальные клетки. В состав матрикса входят белки, липиды, полисахариды и прочие биополимеры, а также внеклеточная ДНК, которая играет роль «арматуры», обеспечивающей структурную целостность и жесткость матрикса. Бактериальную биопленку можно сравнить с многоквартирным домом, все жильцы которого имеют крышу над головой и равный доступ к электричеству, водопроводу, газу и прочим коммуникациям (для бактерий аналогом всего этого служат питательные вещества и другие ресурсы, необходимые для метаболизма).
Бактерии в биопленке становятся практически неуязвимыми для антибиотиков и других противомикробных агентов, а если речь идет о бактериях, обитающих в организме животного, — то и для иммунной системы хозяина. Дело в том, что матрикс биопленки, окружающий бактериальные клетки, препятствует их непосредственному взаимодействию с антибиотиками. Продолжая аналогию с многоквартирным домом, жильцы которого платят налоги и централизованно оплачивают капитальный ремонт, можно сказать, что бактериальные клетки в составе биопленки, секретируя ее компоненты, поддерживают, таким образом, целостность во всех отношениях выгодного для них сообщества, получая взамен питание и защиту.
Дело в том, что матрикс биопленки, окружающий бактериальные клетки, препятствует их непосредственному взаимодействию с антибиотиками. Продолжая аналогию с многоквартирным домом, жильцы которого платят налоги и централизованно оплачивают капитальный ремонт, можно сказать, что бактериальные клетки в составе биопленки, секретируя ее компоненты, поддерживают, таким образом, целостность во всех отношениях выгодного для них сообщества, получая взамен питание и защиту.
Из всех компонентов матрикса бактериальных пленок наиболее загадочным, пожалуй, является входящая в его состав внеклеточная ДНК. Чисто физически двойная спираль ДНК — это довольно жесткая и прочная протяженная молекула, которая, как железный прут, может играть роль опоры для желеобразного матрикса биопленки. Откуда берется внеклеточная ДНК? Оказывается, бактериальные клетки в составе биопленки обмениваются друг с другом сигнальными молекулами (это явление также известно как чувство кворума). Под действием определенных сигналов, испускаемых соседними клетками, часть клеток подвергается добровольной гибели и разрушению — аутолизу.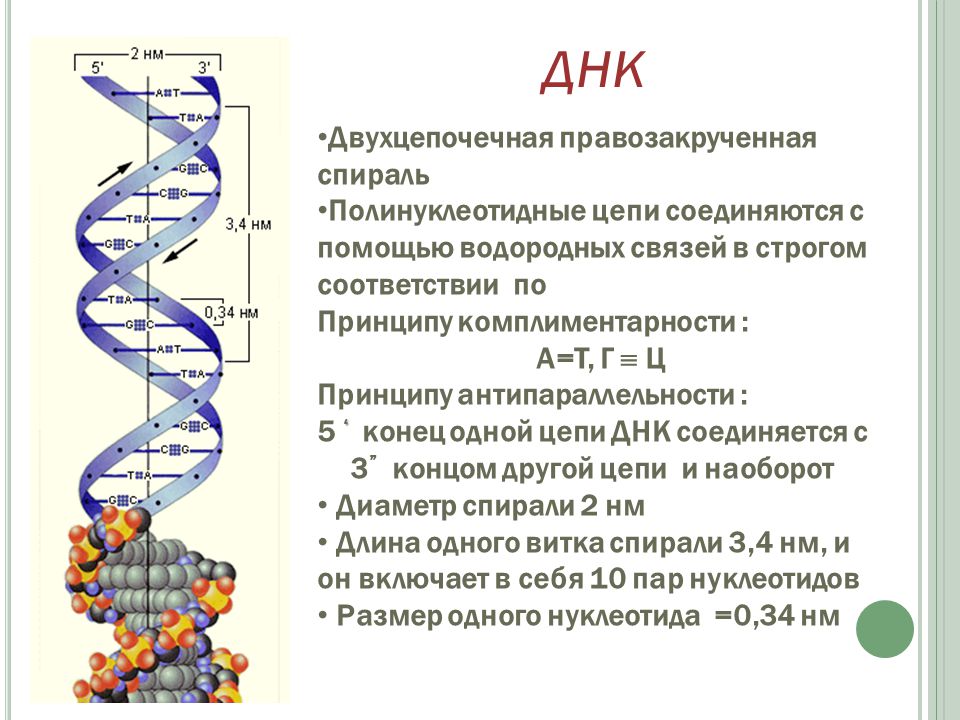 При лизисе клеток их ДНК выходит наружу и остается в матриксе биопленки (L. Montanaro et al., 2011. Extracellular DNA in biofilms).
При лизисе клеток их ДНК выходит наружу и остается в матриксе биопленки (L. Montanaro et al., 2011. Extracellular DNA in biofilms).
В биопленках ДНК связана с белками IHF и HU, относящимися к семейству DNABII (см. Bacterial DNA binding protein), которые поддерживают ее двойную спираль. Эксперименты показали, что в отсутствие DNABII биопленка буквально рассыпается, а бактерии, как жильцы разбитого бомбежкой дома, сталкиваются один на один с враждебной окружающей средой и в большинстве своем погибают.
А что будет, если в биопленке не будет ДНК? На самом деле, обработка сформировавшейся биопленки нуклеазами, расщепляющими ДНК, обычно не дает никаких результатов, и помешать формированию биопленки можно, только лишь обработав клетки нуклеазой на самой ранней стадии ее формирования. Почему же ДНК в составе биопленок не расщепляется нуклеазами? Ответу на этот вопрос посвящена недавняя работа, опубликованная в журнале Cell. Авторы исследования пришли к совершенно парадоксальному выводу: в зрелой биопленке большая часть ДНК представлена левозакрученной формой, или Z-ДНК, и потому нуклеазы никак на нее не действуют.
В живых клетках молекулы ДНК могут существовать в нескольких конформациях (рис. 1, см. также Nucleic acid double helix). Основная форма ДНК в клетках — это B-ДНК, и именно ее обычно имеют в виду, когда изображают красивую двойную спираль ДНК с большой и малой бороздками. A-ДНК отличается от B-формы ДНК по ряду геометрических параметров, в живой природе она встречается нечасто. Любопытно, что именно в форме A-ДНК находится ДНК в вирионах ряда вирусов архей, которые не так давно были выделены в отдельный реалм Adnaviria. И B-, и A-формы ДНК закручены вправо. Но в клетках также встречается, хотя и очень редко, левозакрученная форма, Z-ДНК. Как правило, она формируется при связывании специальных белков с последовательностями вида (GC)n.
Z-ДНК отличается от привычной нам B-ДНК не только направлением закрученности цепей, но и множеством других параметров, таких как ориентация азотистых оснований, конформация сахаров и других. И, самое главное, Z-ДНК не разрушается нуклеазами, которые расщепляют B-ДНК! Тем не менее, несмотря на множество геометрических различий, переход одной и той же последовательности из одной формы в ДНК в другую обратим и вполне возможен не только в пробирке при изменении ионной силы и других параметров раствора, но и в живой клетке — например, при связывании упоминавшихся выше специальных белков, которые способствуют изменению конформации ДНК.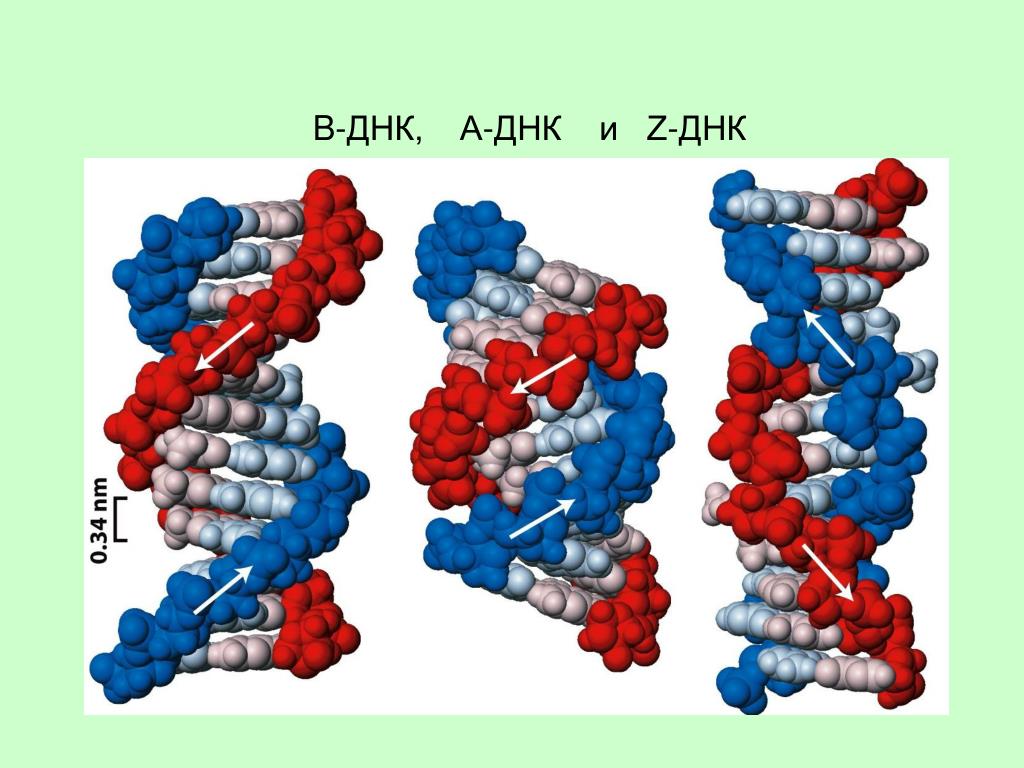
Функции Z-ДНК в клетках пока не до конца описаны. Известно, что ее формирование может влиять на экспрессию близлежащих генов: поскольку подавляющее большинство ДНК-связывающих белков, в том числе и факторов транскрипции, «заточено» под B-ДНК, то переход участков связывания транскрипционных факторов в Z-форму делает невозможным их взаимодействие с белками, что приводит к изменениям в экспрессии подконтрольных генов. Z-ДНК формируется в клетках под действием специальных белков, при ряде модификаций ДНК и некоторых других условиях. Помня о том, что Z-ДНК неуязвима для нуклеаз, авторы обсуждаемого исследования предположили, что в зрелых биопленках роль жесткого структурного каркаса играет именно левозакрученная ДНК. Отметим, что в живой клетке убрать Z-ДНК гораздо проще: связывание специальными белками обеспечивает ее переход в обычную B-ДНК.
Исследователи показали, что Z-ДНК присутствует в биопленках таких патогенных бактерий, как уропатогенная Escherichia coli, Klebsiella pneumoniae и Haemophilus influenza.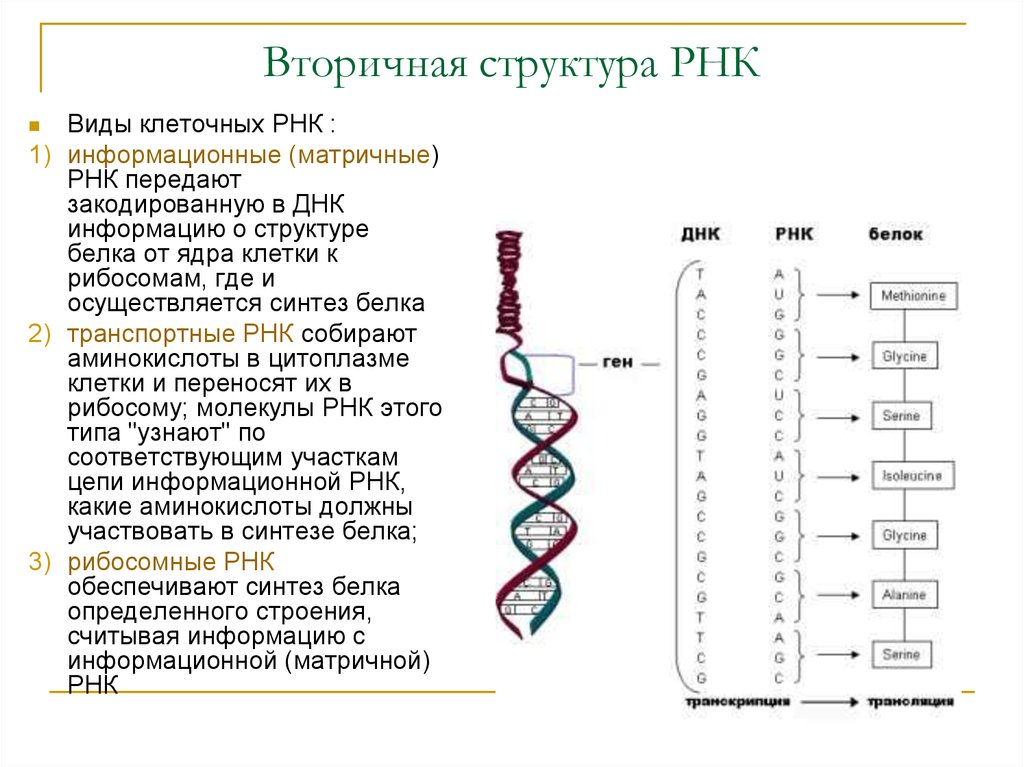 Выявить наличие Z-ДНК можно с помощью распознающих ее моноклональных антител. Авторы отметили, что в молодых биопленках доля ДНК в B-конформации превосходит таковую для Z-конформации, однако по мере созревания биопленки почти вся правозакрученная ДНК переходит в левозакрученную форму. Ученым удалось даже увидеть Z-ДНК в составе биопленок: она выглядит как толстые волокна (рис. 2).
Выявить наличие Z-ДНК можно с помощью распознающих ее моноклональных антител. Авторы отметили, что в молодых биопленках доля ДНК в B-конформации превосходит таковую для Z-конформации, однако по мере созревания биопленки почти вся правозакрученная ДНК переходит в левозакрученную форму. Ученым удалось даже увидеть Z-ДНК в составе биопленок: она выглядит как толстые волокна (рис. 2).
Как уже говорилось, Z-ДНК может сформироваться, если склонная к этому последовательность ДНК вида (GC)n будет связана белками, распознающими Z-ДНК. В качестве таких белков могут выступать специфичные по отношению к Z-ДНК моноклональные антитела, которые могут образовываться в организмах млекопитающих и в настоящее время даже коммерчески доступны. И действительно, в ходе проведенного авторами эксперимента обработка моноклональными антителами, специфично связывающими Z-ДНК, ускоряла формирование биопленки, активируя переход правозакрученной ДНК в составе матрикса в левозакрученную форму (рис.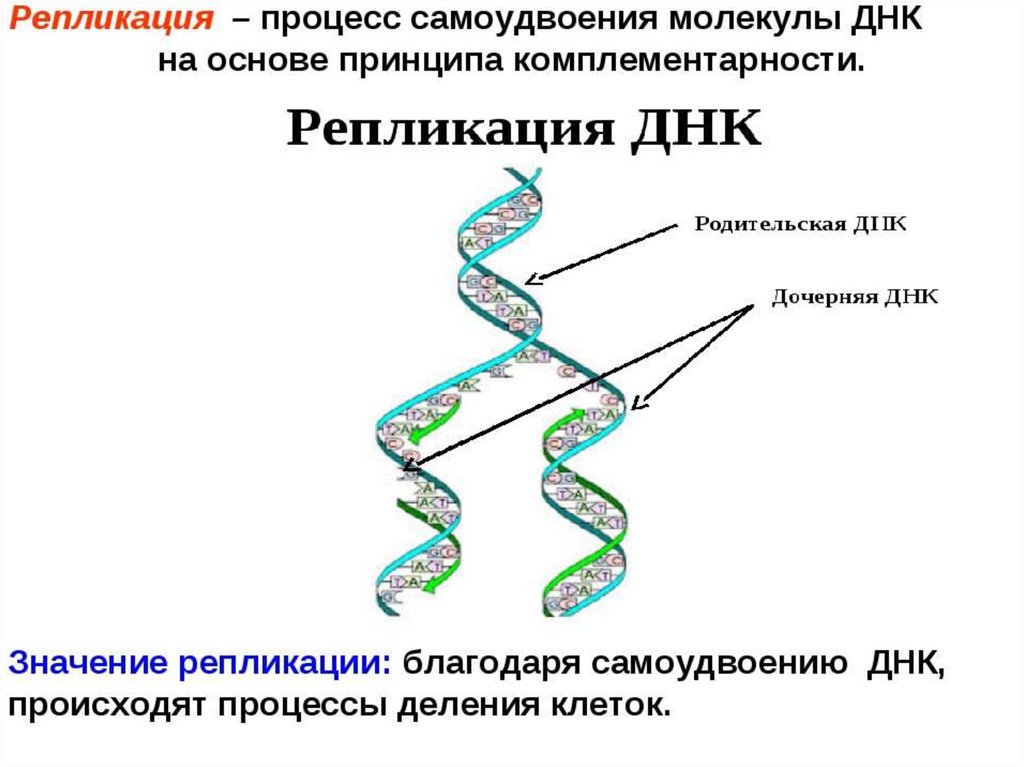 3).
3).
Склонить правозакрученную ДНК к переходу в левозакрученную можно и иным путем. Известно, что формированию Z-ДНК способствует хлорид церия (CeCl3). Хлорид церия связывается с сахарофосфатным остовом ДНК и нейтрализует электростатическое отталкивание между заряженными группами, делая левозакрученную конформацию энергетически выгодной. Обработка биопленок хлоридом церия приводила к их росту и увеличению массы бактериальных клеток в составе биопленки. Таким образом, смещение равновесия между B- и Z-формами ДНК в сторону последней способствует формированию биопленок. Более того, под действием хлорида церия повышался модуль Юнга биопленок, что свидетельствует о том, что увеличение количества Z-ДНК в биопленке повышает ее механическую жесткость.
Левозакрученную ДНК можно перевести в правозакрученную, обработав, например, хлорохином. Это вещество является интеркалятором, то есть внедряется в двойную спираль ДНК. Обработка биопленки хлорохином способствует ее развалу, поскольку под действием этого вещества доля Z-ДНК в биопленке уменьшается, из-за чего ее жесткость снижается.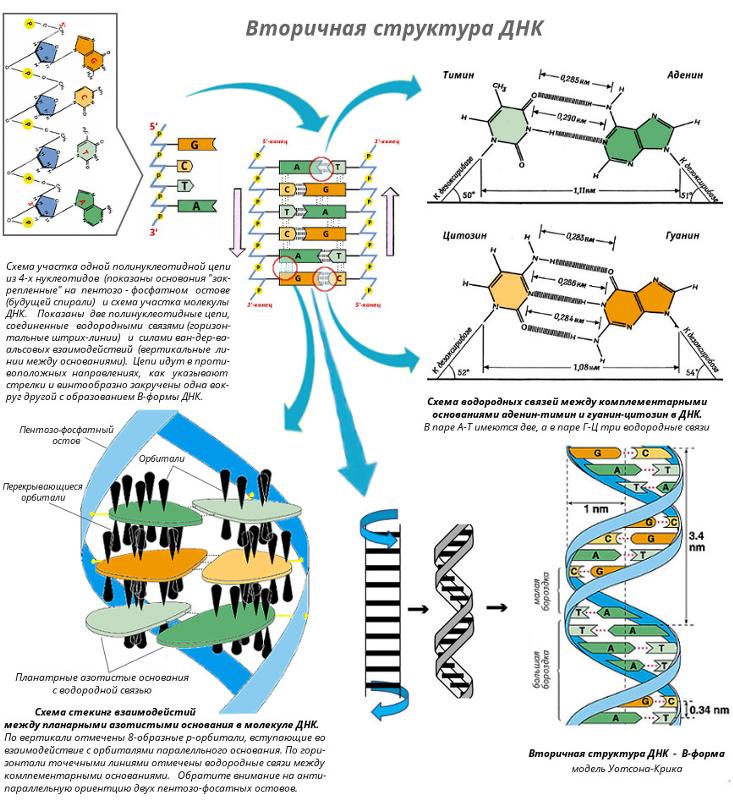 Более того, хлорохин действует на биопленки столь губительно, что бактериальные клетки начинают буквально вываливаться из них! После обработки хлорохином биопленки становятся чувствительными к действию нуклеаз, ведь ДНК переходит в распознаваемую этими ферментами правозакрученную форму.
Более того, хлорохин действует на биопленки столь губительно, что бактериальные клетки начинают буквально вываливаться из них! После обработки хлорохином биопленки становятся чувствительными к действию нуклеаз, ведь ДНК переходит в распознаваемую этими ферментами правозакрученную форму.
Каким образом Z-ДНК образуется при естественном формировании биопленки? Ученые показали, что вышеупомянутые белки группы DNABII способствуют переходу правозакрученной ДНК в левозакрученную. Возможность непосредственного взаимодействия DNABII с Z-ДНК пока не доказана и, вероятно, белки DNABII стабилизируют Z-ДНК, не связываясь с ней напрямую. По-видимому, на ранних этапах формирования биопленки, когда в ней преобладает B-форма ДНК и она сохраняет чувствительность к нуклеазам, белки DNABII запускают переход B-ДНК в Z-ДНК.
ДНК в составе биопленок не всегда имеет бактериальное происхождение. Нейтрофилы, главные фагоцитирующие клетки крови, в критической ситуации способны совершить «харакири» и «выплюнуть» свою геномную ДНК вместе с гистонами и различными бактерицидными белками во внеклеточную среду.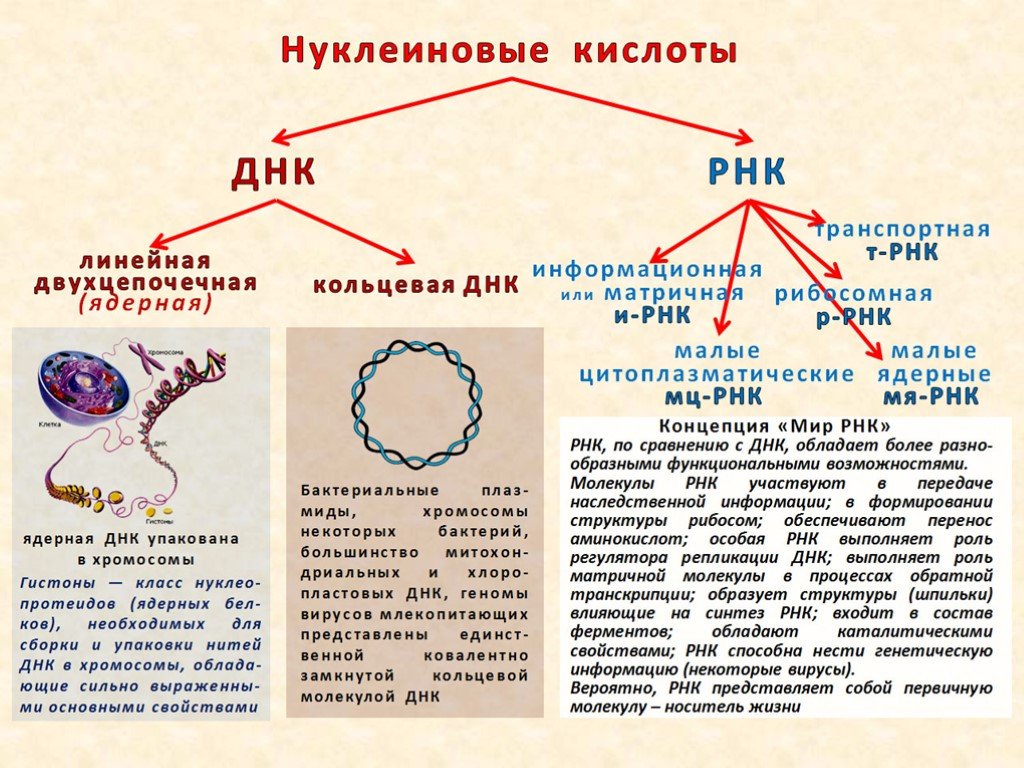 Сам нейтрофил, естественно, при этом погибает. Подобно рыболовной сети, эта мешанина из ДНК с гистонами, которую называют «внеклеточными ловушками нейтрофилов» (NET — neutrophil extracellular traps), опутывает бактериальные клетки и убивает их за счет бактерицидного действия связанных с ней белков. Впрочем, эффект от подобного акта самопожертвования может быть строго обратный. Авторы показали, что куски ДНК нейтрофилов тоже могут быть включены в состав бактериальной биопленки и под действием белков DNABII переведены в Z-форму. Таким образом, бактерии в составе биопленки не только нейтрализуют ловушки нейтрофилов, но и встраивают их куски в состав матрикса. Кроме того, антибактериальные белки, связывающие B-ДНК, оказываются бессильны против бактерий, поскольку с Z-ДНК они взаимодействовать не могут.
Сам нейтрофил, естественно, при этом погибает. Подобно рыболовной сети, эта мешанина из ДНК с гистонами, которую называют «внеклеточными ловушками нейтрофилов» (NET — neutrophil extracellular traps), опутывает бактериальные клетки и убивает их за счет бактерицидного действия связанных с ней белков. Впрочем, эффект от подобного акта самопожертвования может быть строго обратный. Авторы показали, что куски ДНК нейтрофилов тоже могут быть включены в состав бактериальной биопленки и под действием белков DNABII переведены в Z-форму. Таким образом, бактерии в составе биопленки не только нейтрализуют ловушки нейтрофилов, но и встраивают их куски в состав матрикса. Кроме того, антибактериальные белки, связывающие B-ДНК, оказываются бессильны против бактерий, поскольку с Z-ДНК они взаимодействовать не могут.
Авторы исследования отмечают, что образование антител к Z-ДНК в ходе адаптивного иммунного ответа на вторжение бактерий может не только не помешать развитию инфекции, но и способствовать ее переходу в хроническую форму, ведь антитела, связывающие Z-ДНК, стабилизируют ее и, следовательно, укрепляют бактериальные биопленки.
Источник: John R. Buzzo, Aishwarya Devaraj, Erin S. Gloag, Joseph A. Jurcisek, Frank Robledo-Avila, Theresa Kesler, Kathryn Wilbanks, Lauren Mashburn-Warren, Sabarathnam Balu, Joseph Wickham, Laura A. Novotny, Paul Stoodley, Lauren O. Bakaletz, Steven D. Goodman. Z-form extracellular DNA is a structural component of the bacterial biofilm matrix // Cell. 2021. DOI: 10.1016/j.cell.2021.10.010.
Елизавета Минина
ДЕЗОКСИРИБОНУКЛЕИНОВЫЕ КИСЛОТЫ • Большая российская энциклопедия
ДЕЗОКСИРИБОНУКЛЕИ́НОВЫЕ КИСЛО́ТЫ (ДНК), нуклеиновые кислоты, содержащие в качестве углеводного компонента дезоксирибозу. ДНК – осн. компонент хромосом всех живых организмов, вещество, из которого построены геномы всех про- и эукариот, а также внехромосомные наследств. элементы (плазмиды) и геномы мн. вирусов. В клетках прокариот ДНК организована в виде компактного образования – нуклеоида.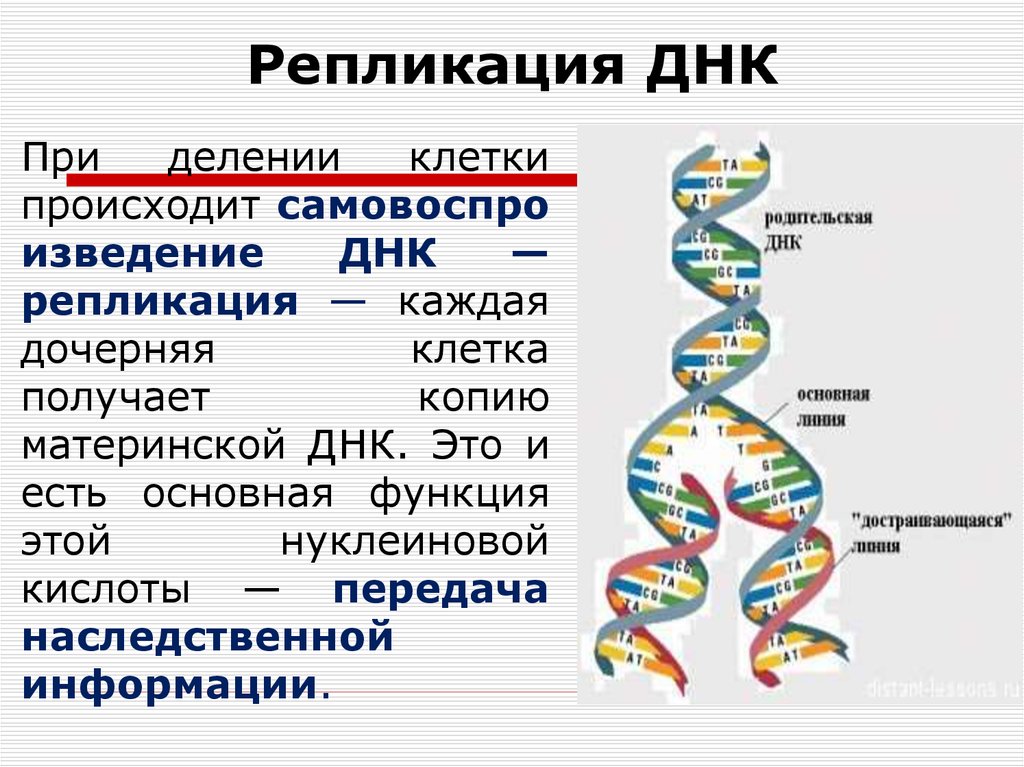 У эукариот она содержится в ядрах клеток и в органеллах – митохондриях и хлоропластах. В нуклеотидной последовательности ДНК записана (кодирована) генетич. информация о всех признаках вида и особенностях индивидуума. Все осн. генетич. процессы – репликация, транскрипция и рекомбинация связаны с функционированием молекулы ДНК.
У эукариот она содержится в ядрах клеток и в органеллах – митохондриях и хлоропластах. В нуклеотидной последовательности ДНК записана (кодирована) генетич. информация о всех признаках вида и особенностях индивидуума. Все осн. генетич. процессы – репликация, транскрипция и рекомбинация связаны с функционированием молекулы ДНК.
Впервые ДНК в виде комплексов с белками (дезоксирибонуклеопротеидов) была открыта в 1868 И. Ф. Мишером в ядрах клеток гноя и сперме рыб. Долгое время считалось, что ДНК содержится только в клетках животных, и лишь к сер. 1930-х гг. было доказано (А. Н. Белозерский), что ДНК – непременный компонент каждой живой клетки. В 1944 амер. микробиолог О. Эйвери с сотрудниками показали, что с помощью ДНК, тщательно очищенной от всех остальных клеточных компонентов, наследуемый биологич. признак может быть перенесён из одной клетки в другую. Тем самым была определена биологич. функция ДНК как вещества наследственности.
Тем самым была определена биологич. функция ДНК как вещества наследственности.
В кон. 19 – нач. 20 вв. было установлено, что ДНК представляют собой полимерные молекулы, мономерными составляющими которых служат дезоксирибонуклеотиды, содержащие остатки дезоксирибозы, фосфорной кислоты и одно из четырёх азотистых оснований: пуриновых – гуанина (G) и аденина (А) и пиримидиновых – цитозина (C) и тимина (Т). В кон. 1940-х – нач. 1950-х гг. в лаборатории А. Тодда было доказано, что единственным типом межнуклеотидной связи в полимерных цепях ДНК является 3’–5′-фосфодиэфирная связь. В это же время Э. Чаргафф с сотрудниками выяснили осн. закономерности нуклеотидного состава ДНК (правила Чаргаффа), наиболее важная из которых – равенство содержания остатков аденина и тимина (А = Т), а также гуанина и цитозина (G = C).
Рис. 1. Модель двойной спирали ДНК Уотсона – Крика (М. Б. – малая бороздка; Б. Б. – большая бороздка).
1. Модель двойной спирали ДНК Уотсона – Крика (М. Б. – малая бороздка; Б. Б. – большая бороздка).
Основываясь на этих данных, в 1953 Дж. Уотсон и Ф. Крик расшифровали рентгенограммы кристаллов ДНК, полученные в лабораториях Р. Франклин и М. Уилкинса, и сделали одно из выдающихся открытий совр. естествознания. Они установили, что молекула ДНК представляет собой регулярную спираль, состоящую из двух полинуклеотидных цепей (двойная спираль). Диаметр спирали постоянен на протяжении всей её длины и равен примерно 2 нм. Длина витка спирали составляет 3,4 нм. На один виток в одной цепи приходится примерно 10 нуклеотидных остатков, т. е. межнуклеотидное расстояние вдоль оси спирали равно 0,34 нм. Азотистые основания в двойной спирали ДНК лежат в одной плоскости, которая практически перпендикулярна её гл. оси. При этом основания, принадлежащие разным цепям и находящиеся напротив друг друга, образуют комплементарные пары, стабилизированные водородными связями таким образом, что аденин всегда спарен только с тимином, а гуанин – с цитозином (пары G – C связаны между собой тремя водородными связями, а пары А – Т лишь двумя). Для стабилизации структуры двойной спирали ДНК важное значение имеют также взаимодействия между плоскостями соседних оснований, принадлежащих одной и той же цепи (т. н. стэкинг-взаимодействия, от англ. stack – стог, складывать в стог, располагать один над другим).
Для стабилизации структуры двойной спирали ДНК важное значение имеют также взаимодействия между плоскостями соседних оснований, принадлежащих одной и той же цепи (т. н. стэкинг-взаимодействия, от англ. stack – стог, складывать в стог, располагать один над другим).
Из модели двойной спирали Уотсона – Крика прямо вытекает принцип самовоспроизведения (удвоения, репликации) молекулы ДНК (а следовательно, и любого генетич. материала): если две комплементарные цепи ДНК разделить, а затем на каждой, как на матрице, построить новые, строго комплементарные им цепи, то две дочерние двуспиральные молекулы будут идентичны материнской. Открытие этого принципа позволило на молекулярном уровне объяснить явление наследственности и положило начало молекулярной биологии. Принцип комплементарного спаривания оснований нуклеиновых кислот лежит в основе всех процессов передачи генетич.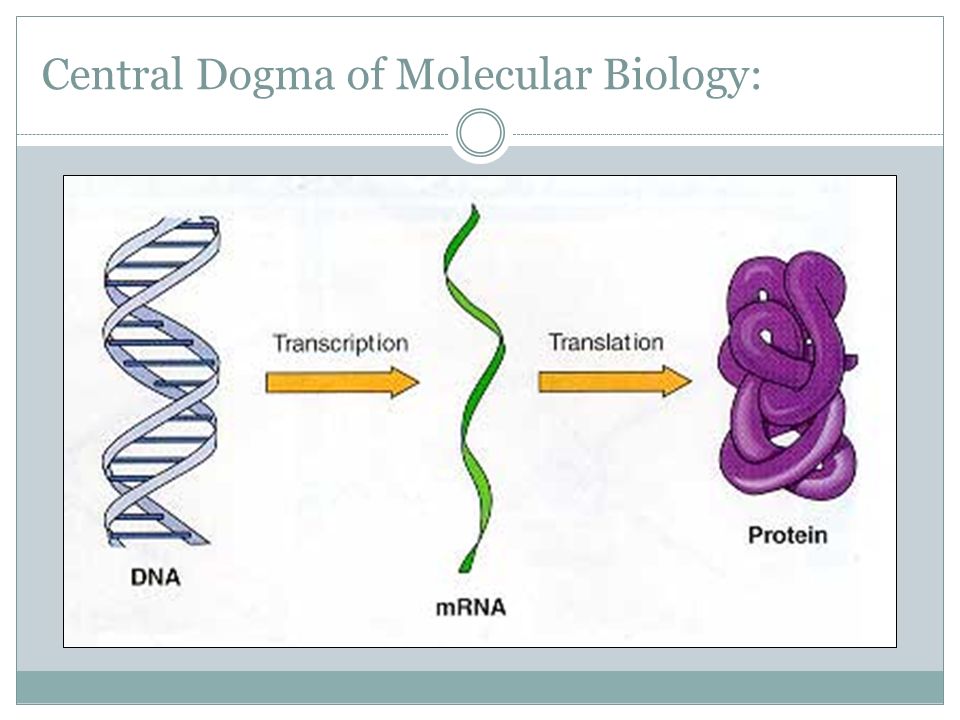 информации в клетке.
информации в клетке.
Рис. 2. Комплементарные уотсон-криковские пары в двуспиральной молекуле ДНК. Слева – пара аденин – тимин; справа – пара гуанин – цитозин. Приведены расстояния между атомами, связанными специфическими …
В двойной спирали ДНК сахарофосфатный остов полинуклеотидных цепей обращён наружу, а на поверхности спирали можно выделить две бороздки: большую – шириной 2,2 нм и малую – шириной 1,2 нм. Двойная спираль ДНК, описанная Дж. Уотсоном и Ф. Криком, – правозакрученная, а полинуклеотидные цепи в ней антипараллельны, т. е. направлены в противоположные стороны, так что 3′-конец одной цепи располагается напротив 5′-конца другой. Она была названа В-формой ДНК.
Оказалось, однако, что двойная спираль ДНК характеризуется существенным полиморфизмом и при изменении внешних условий может принимать пространственную структуру (конформацию), отличную от уотсон-криковской В-формы.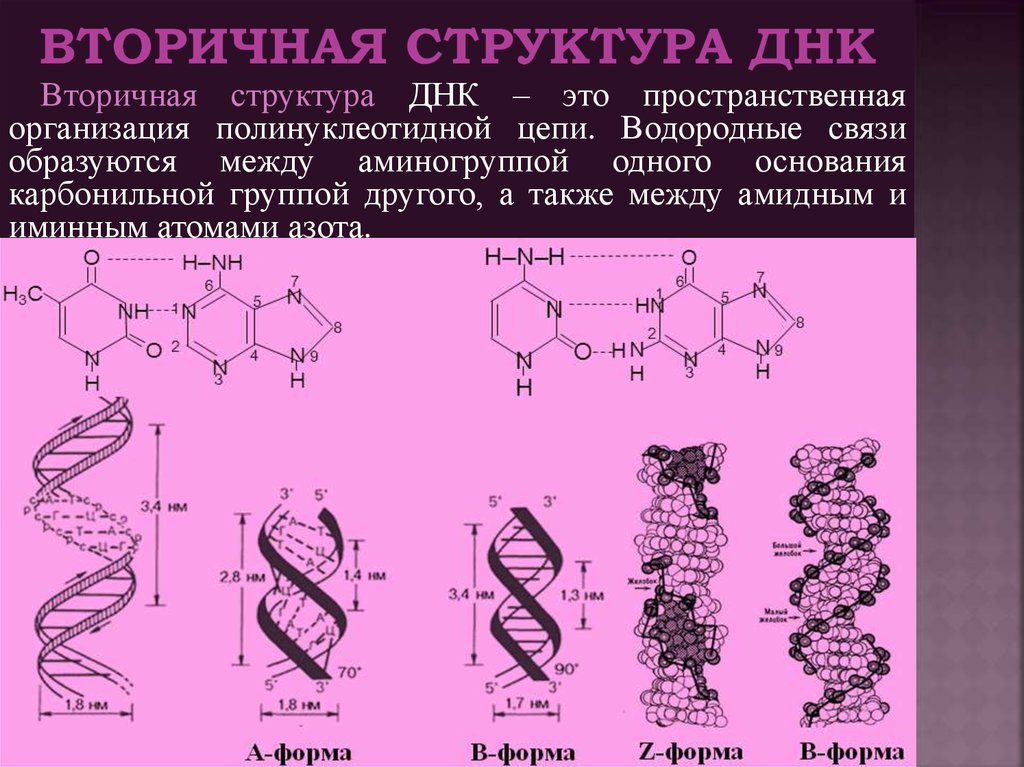 Так, при понижении влажности в препарате или, напр., при добавлении спирта к водному раствору ДНК она переходит в т. н. А-форму, отличающуюся от В-формы шириной и глубиной бороздок, увеличением диаметра спирали, смещением пар оснований к периферии спирали и их заметным наклоном по отношению к оси спирали, а внутри неё образуется полость диаметром 0,4 нм. В основе этих структурных превращений лежит изменение конформации остатка дезоксирибозы, что, в свою очередь, ведёт к изменению расстояния между фосфатными группами соседних нуклеотидных остатков одной цепи. При высокой концентрации солей участки двойных спиралей ДНК с чередующимися нуклеотидными последовательностями типа многократно повторяющегося гуанозин-цитозинового динуклеотида (GC) из правозакрученной формы переходят в левозакрученную. У этой формы ДНК линия, соединяющая фосфатные группы, через каждые две пары имеет излом и принимает зигзагообразный вид.
Так, при понижении влажности в препарате или, напр., при добавлении спирта к водному раствору ДНК она переходит в т. н. А-форму, отличающуюся от В-формы шириной и глубиной бороздок, увеличением диаметра спирали, смещением пар оснований к периферии спирали и их заметным наклоном по отношению к оси спирали, а внутри неё образуется полость диаметром 0,4 нм. В основе этих структурных превращений лежит изменение конформации остатка дезоксирибозы, что, в свою очередь, ведёт к изменению расстояния между фосфатными группами соседних нуклеотидных остатков одной цепи. При высокой концентрации солей участки двойных спиралей ДНК с чередующимися нуклеотидными последовательностями типа многократно повторяющегося гуанозин-цитозинового динуклеотида (GC) из правозакрученной формы переходят в левозакрученную. У этой формы ДНК линия, соединяющая фосфатные группы, через каждые две пары имеет излом и принимает зигзагообразный вид. Такая конформация ДНК называется Z-формой (от англ. zigzag). Хотя полиморфизм ДНК может играть существенную роль в регуляции активности генов, прямых данных о наличии у двойной спирали ДНК in vivo иных конформаций, кроме В-формы, пока нет.
Такая конформация ДНК называется Z-формой (от англ. zigzag). Хотя полиморфизм ДНК может играть существенную роль в регуляции активности генов, прямых данных о наличии у двойной спирали ДНК in vivo иных конформаций, кроме В-формы, пока нет.
Важным свойством двойных спиралей ДНК является их микрогетерогенность, обнаруживаемая рентгеноструктурным анализом высокого разрешения. Она обусловлена тонкими различиями в конформации нуклеотидных остатков, появление которых зависит от последовательности расположения нуклеотидов в цепи, и проявляется в образовании характерных изгибов и изломов. Такие особенности структуры молекулы ДНК, несомненно, должны быть связаны с её функционированием.
При наличии в молекуле ДНК повторяющихся последовательностей (палиндромов) могут формироваться пары не только между основаниями противоположных цепей, но и в пределах одной цепи, что создаёт возможность образования связанных водородными связями своеобразных шпилек с петлями.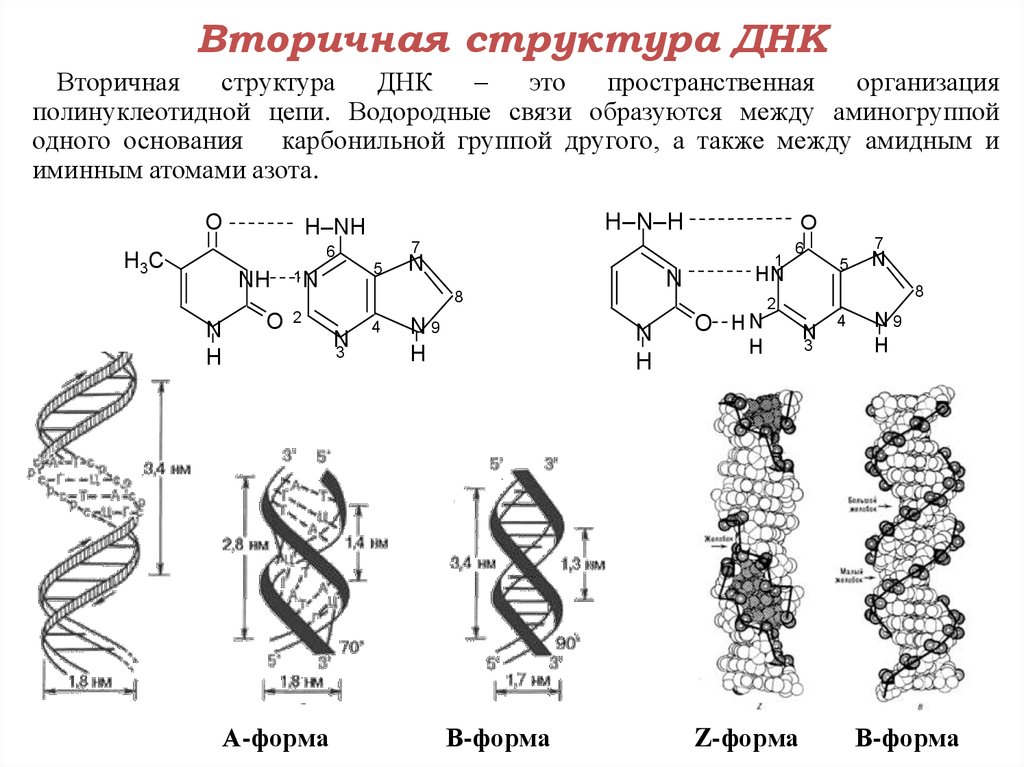
При повышении темп-ры или рН растворов ДНК, в присутствии ряда органич. веществ и др. соединений происходит денатурация ДНК – разрыв водородных связей между парами оснований и разрушение регулярной структуры двойной спирали, которое завершается полным разделением цепей. Благодаря кооперативному характеру внутримолекулярных взаимодействий, стабилизирующих двойную спираль, этот процесс напоминает фазовый переход и поэтому называется плавлением ДНК. В условиях, оптимальных для образования двойной спирали, отд. комплементарные цепи ДНК способны реассоциировать с восстановлением исходной двуспиральной структуры (ренатурация ДНК). Это свойство лежит в основе метода молекулярной гибридизации нуклеиновых кислот, который позволяет выявлять степень сходства нуклеотидных последовательностей молекул ДНК или ДНК и РНК, особенности их организации, в т. ч. наличие и число повторов (см. Нуклеотидные последовательности).
ч. наличие и число повторов (см. Нуклеотидные последовательности).
Последовательность чередования нуклеотидных остатков в ДНК (первичная структура) у разных организмов строго индивидуальна и служит важнейшей характеристикой, отличающей одну молекулу ДНК от другой и соответственно один ген или один регуляторный генетич. элемент от другого. Размеры молекул ДНК варьируют от нескольких тысяч пар нуклеотидов (т. п. н.) у плазмид и некоторых вирусов до сотен т. п. н. у высших организмов. Содержание ДНК в разных организмах также различно и по числу образующих её нуклеотидов составляет от 5·106 у бактерий до 2·1011 пар нуклеотидов (п. н.) у высших растений (в расчёте на гаплоидный геном). Эти гигантские молекулы чрезвычайно компактно упакованы в клетках или вирусах. В прокариотич. нуклеотиде такая укладка поддерживается небольшим количеством спец. белков и, вероятно, рибонуклеиновыми кислотами (РНК). Описано неск. уровней упаковки эукариотической ДНК с помощью универсального набора гистонов и некоторых негистоновых белков, приводящих к образованию осн. компонента хромосомы – хроматина. Напр., длина ДНК самой большой хромосомы человека равна 8 см, но в хромосоме (в состоянии митоза) она не превышает 5 мкм.
белков и, вероятно, рибонуклеиновыми кислотами (РНК). Описано неск. уровней упаковки эукариотической ДНК с помощью универсального набора гистонов и некоторых негистоновых белков, приводящих к образованию осн. компонента хромосомы – хроматина. Напр., длина ДНК самой большой хромосомы человека равна 8 см, но в хромосоме (в состоянии митоза) она не превышает 5 мкм.
В ядрах эукариот (за исключением гамет) ДНК представлена двумя копиями. Каждая про- и эукариотическая хромосома содержит только одну молекулу двуспиральной ДНК. Геном подавляющего большинства вирусов также представлен двуспиральной ДНК, и лишь некоторые фаги в качестве геномной содержат однотяжевую кольцевую или линейную молекулу ДНК.
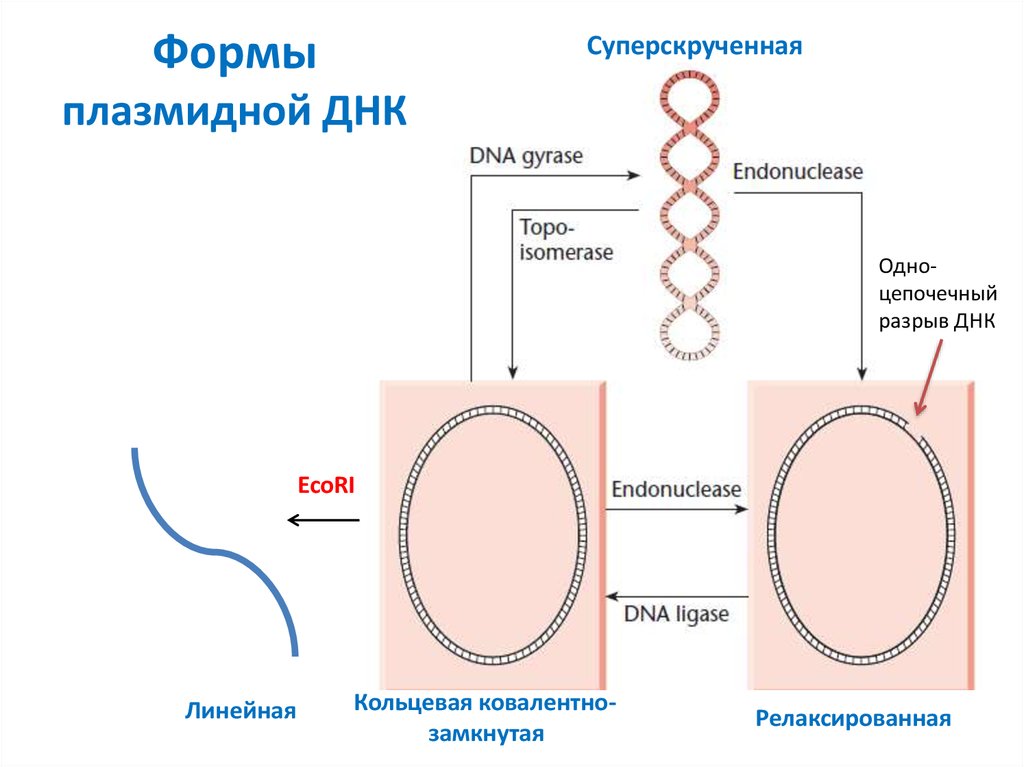
В кольцо замкнуты молекулы двунитевых ДНК прокариотич. хромосомы, плазмид и мн. вирусов, ДНК митохондрий и хлоропластов.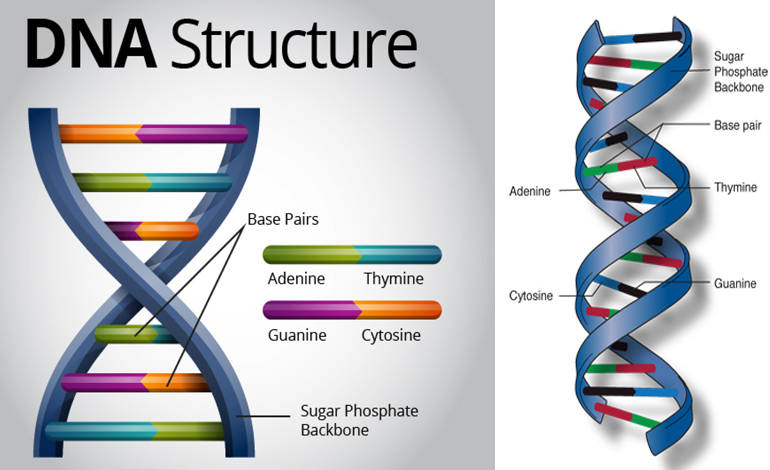 При этом если цепь ковалентно-непрерывна (т. е. все фосфодиэфирные связи замкнуты), то циклич. ДНК могут находиться в сверхспирализованной форме, когда нити двойной спирали многократно зацеплены друг с другом. В клетке сверхвитки создаются и разрушаются ферментами топоизомеразами. Циклическая сверхспирализованная ДНК обладает определённым запасом энергии по сравнению с её линейной формой, поэтому образование сверхвитков важно для функционирования ДНК (напр., позволяет разрешать топологич. трудности, возникающие при репликации). Кроме того, благодаря наличию сверхвитков могут образовываться необычные структуры в её макромолекуле: крестообразные структуры (в палиндромах), Z-форма, тринитевые участки, или т. н. Н-форма (в гомопурин-гомопиримидиновых блоках).
При этом если цепь ковалентно-непрерывна (т. е. все фосфодиэфирные связи замкнуты), то циклич. ДНК могут находиться в сверхспирализованной форме, когда нити двойной спирали многократно зацеплены друг с другом. В клетке сверхвитки создаются и разрушаются ферментами топоизомеразами. Циклическая сверхспирализованная ДНК обладает определённым запасом энергии по сравнению с её линейной формой, поэтому образование сверхвитков важно для функционирования ДНК (напр., позволяет разрешать топологич. трудности, возникающие при репликации). Кроме того, благодаря наличию сверхвитков могут образовываться необычные структуры в её макромолекуле: крестообразные структуры (в палиндромах), Z-форма, тринитевые участки, или т. н. Н-форма (в гомопурин-гомопиримидиновых блоках).
Биосинтез ДНК (репликация) осуществляется путём матричного синтеза при участии ферментов ДНК-полимераз совместно с большой группой вспомогат. белков и находится под контролем спец. регуляторных систем клетки. In vitro любой участок ДНК может быть амплифицирован с помощью полимеразной цепной реакции. В ходе репликации in vivo, а также после её окончания происходит метилирование небольшого числа определённых остатков цитозина с образованием 5-метилцитозина, представляющее собой специфич. процесс модификации ДНК, непосредственно связанный с её последующим функционированием. Метилирование и деметилирование ДНК играют важную роль в процессах эмбрио- и гаметогенеза.
белков и находится под контролем спец. регуляторных систем клетки. In vitro любой участок ДНК может быть амплифицирован с помощью полимеразной цепной реакции. В ходе репликации in vivo, а также после её окончания происходит метилирование небольшого числа определённых остатков цитозина с образованием 5-метилцитозина, представляющее собой специфич. процесс модификации ДНК, непосредственно связанный с её последующим функционированием. Метилирование и деметилирование ДНК играют важную роль в процессах эмбрио- и гаметогенеза.
В ходе жизнедеятельности организмов их ДНК под влиянием внешних факторов может подвергаться разл. повреждающим воздействиям, сопровождающимся нарушением структуры азотистых оснований. В ходе эволюции клетки выработали защитные механизмы, обеспечивающие восстановление исходной структуры – репарацию ДНК.
В клетке ДНК расщепляется специфич. ферментами – дезоксирибонуклеазами. Среди них наиболее известны эндонуклеазы рестрикции, защищающие клетку от чужеродной ДНК и широко применяемые в генетич. инженерии.
В нач. 1970-х гг. Ф. Сенгером и др. были разработаны эффективные методы определения последовательности нуклеотидов в молекулах ДНК (см. Секвенирование). В кон. 20 в. на основе этих методов создана мощная автоматизир. технология секвенирования ДНК, с помощью которой определена первичная структура ДНК полных геномов мн. вирусов, митохондрий, хлоропластов, бактерий, растений и животных. К 2004 было завершено определение нуклеотидной последовательности практически всего генома человека (более трёх млрд. п. н.). Эти работы стимулировали развитие биоинформатики и положили начало новому разделу молекулярной генетики – геномике.
Информация о нуклеотидных последовательностях ДНК широко используется при создании рекомбинантных ДНК – молекул с заданными свойствами, включающих структурные элементы ДНК разных организмов (см. Генетическая инженерия), а также при конструировании новых белков (см. Белковая инженерия). Знание первичной структуры ДНК важно при анализе наследств. и онкологич. заболеваний, идентификации личности (см. ДНК-типирование), при амплификации и выделении определённых генов, регуляторных элементов и др. функционально важных участков ДНК.
Структура и форма ДНК | Спросите у биолога
показать/скрыть слова, чтобы узнать
Хромосома: длинная нитевидная молекула, состоящая из химического вещества, называемого ДНК (дезоксирибонуклеиновая кислота), которая удерживается вместе с помощью специальных белков и видна (в сильный микроскоп) во время деление клетки. .. подробнее
.. подробнее
Молекула: химическая структура, состоящая из двух или более атомов, связанных друг с другом химической связью. Вода представляет собой молекулу из двух атомов водорода и одного атома кислорода (h3O)… подробнее
Структура ДНК
Изображение Madprime через Wikimedia Commons.
Более пристальный взгляд на химическую структуру ДНК показывает четыре основных строительных блока. Мы называем эти азотистые основания: аденин (А), тимин (Т), гуанин (Г) и цитозин (Ц). ДНК также включает сахара и фосфатные группы (состоящие из фосфора и кислорода). Они составляют фосфатно-дезоксирибозный остов.
Если представить структуру ДНК в виде лестницы, то ступени лестницы (куда бы вы положили руки) состоят из азотистых оснований. Эти основания соединяются, чтобы сделать каждую ступеньку лестницы. Они также только соединяются определенным образом. (A) всегда сочетается с (T), а (G) всегда сочетается с (C). Это очень важно, когда пришло время скопировать всю или часть ДНК.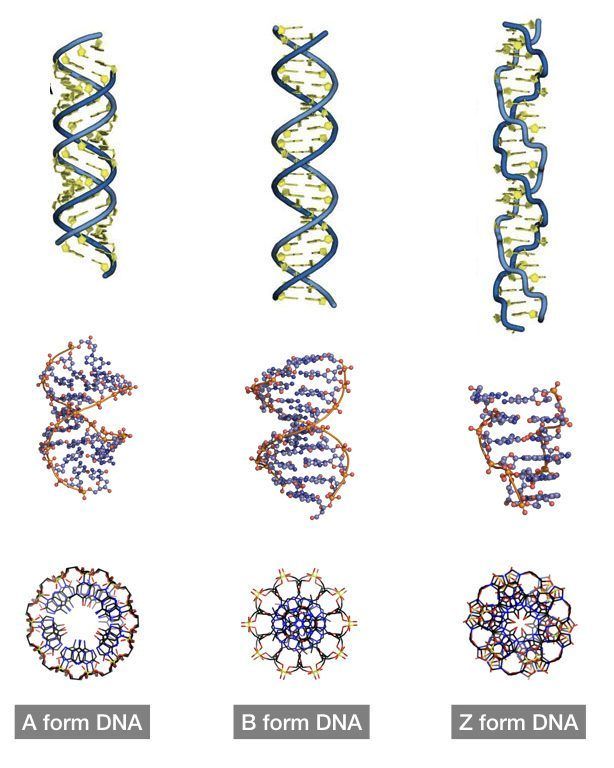
Форма ДНК
Самая распространенная форма ДНК, которую изображают художники и ученые, очень похожа на извилистую лестницу. Ученые называют это двойной спиралью. ДНК также сворачивается и скручивается в более сложные формы. Спиральная форма делает его очень маленьким. На самом деле, он достаточно мал, чтобы легко поместиться в любой из наших клеток. Это довольно удивительный подвиг, когда вы узнаете, что ДНК одной клетки, если ее развернуть, растянется на шесть футов (почти два метра).
ДНК не просто хранит информацию. Он также может создавать копии самого себя. Для этого он сначала должен распаковать азотистые основания. Все пары «AT» и «GC» разделены. Таким образом, ДНК состоит из двух одиночных цепей. В этот момент создаются новые пары вместе с новым фосфатным остовом, чтобы создать две новые копии ДНК. Каждая отдельная нить затем соединяется с правильным комплементарным основанием, чтобы создать новый двухцепочечный фрагмент ДНК. Копии будут совпадать, потому что только «A» соединяется с «T» и только «G» соединяется с «C».
Дополнительные изображения NIH.
Подробнее о: Основы ДНК
Просмотр цитирования
Библиографические данные:
- Статья: Структура и форма ДНК
- Автор(ы): д.б.н.
- Издатель: Школа естественных наук Университета штата Аризона Ask A Biologist
- Название сайта: ASU — Спросите у биолога
- Дата публикации: 24 апреля 2010 г.
- Дата обращения: 10 ноября 2022 г.
- Ссылка: https://askabiologist.asu.edu/dna-shape-and-structure
APA Style
Доктор биологии. (2010, 24 апреля). Структура и форма ДНК. АГУ — Спросите у биолога. Получено 10 ноября 2022 г. с https://askabiologist.asu.edu/dna-shape-and-structure
Американской психологической ассоциации. Для получения дополнительной информации см. http://owl.english.purdue.edu/owl/resource/560/10/
Чикагское руководство по стилю
Доктор биологии. «Структура и форма ДНК». АГУ — Спросите у биолога. 24 апреля 2010 г. https://askabiologist.asu.edu/dna-shape-and-structure
24 апреля 2010 г. https://askabiologist.asu.edu/dna-shape-and-structure
Для получения дополнительной информации см. http://owl.english.purdue.edu/owl/resource/717/04/
MLA 2017 Style
Доктор биологии. «Структура и форма ДНК». АГУ — Спросите у биолога. 24 апреля 2010 г. ASU — Спросите у биолога, Интернет. 10 ноября 2022 г. https://askabiologist.asu.edu/dna-shape-and-structure
Ассоциация современного языка, 7-е изд. Для получения дополнительной информации см. http://owl.english.purdue.edu/owl/resource/747/08/
Хромосомы человека свернуты в компактную форму. Каждая пара хромосом окрашена, чтобы ее было легче идентифицировать.
Как окружающая среда может влиять на ДНК? Узнайте больше в статье «Спросите антрополога», посвященной управлению кодом.
Увидеть ДНК
Примите участие в акции
Спросите у биолога
Выступив добровольно или просто отправив нам отзыв на сайте. Ученые, учителя, писатели, иллюстраторы и переводчики важны для программы. Если вы заинтересованы в помощи с веб-сайтом, у нас есть страница волонтеров, чтобы начать процесс.
Если вы заинтересованы в помощи с веб-сайтом, у нас есть страница волонтеров, чтобы начать процесс.
Пожертвовать
Поделиться этой страницей:
Опубликовать в Google Classroom
Форма ДНК, генетические коды и эволюция
1. King MC, Wilson AC. Эволюция на двух уровнях у человека и шимпанзе. Наука. 1975; 188: 107–116. [PubMed] [Google Scholar]
2. Добжанский Т. Ничто в биологии не имеет смысла, кроме как в свете эволюции. Американский учитель биологии. 1973; 35: 125–129. [Google Scholar]
3.
Parker SCJ, Hansen L, Abaan HO, Tullius TD, Margulies EH. Локальная топография ДНК коррелирует с функциональными некодирующими областями генома человека. Наука. 2009 г.;324:389–392. [Бесплатная статья PMC] [PubMed] [Google Scholar]
•• В этой статье представлен новый метод оценки эволюционных ограничений, основанный на форме ДНК, и показано, что более 10% генома человека находится в стадии отбора по структуре. Особое значение имеет тот факт, что большая часть функциональных геномных элементов встречается в областях, которые находятся под структурным ограничением.
Особое значение имеет тот факт, что большая часть функциональных геномных элементов встречается в областях, которые находятся под структурным ограничением.
4. Консорциум проекта ENCODE Идентификация и анализ функциональных элементов в 1% генома человека в рамках пилотного проекта ENCODE. Природа. 2007;447:799–816. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5.
Ицковиц С., Ходис Э., Сигал Э. Перекрывающиеся коды в последовательностях, кодирующих белок. Геном Res. 2010;20:1582–1589. [Бесплатная статья PMC] [PubMed] [Google Scholar]
•• В этом исследовании представлен умный метод измерения содержания информации в кодирующих последовательностях. Авторы обнаружили, что кодирующие последовательности разных типов кодируют информацию, выходящую за рамки стандартного генетического кода.
6. Lampe X, Samad OA, Guiguen A, Matis C, Remacle S, Picard JJ, Rijli FM, Rezsohazy R. Ультраконсервативный чувствительный элемент Hox-Pbx находится в кодирующей последовательности Hoxa2 и активен в ромбомере 4.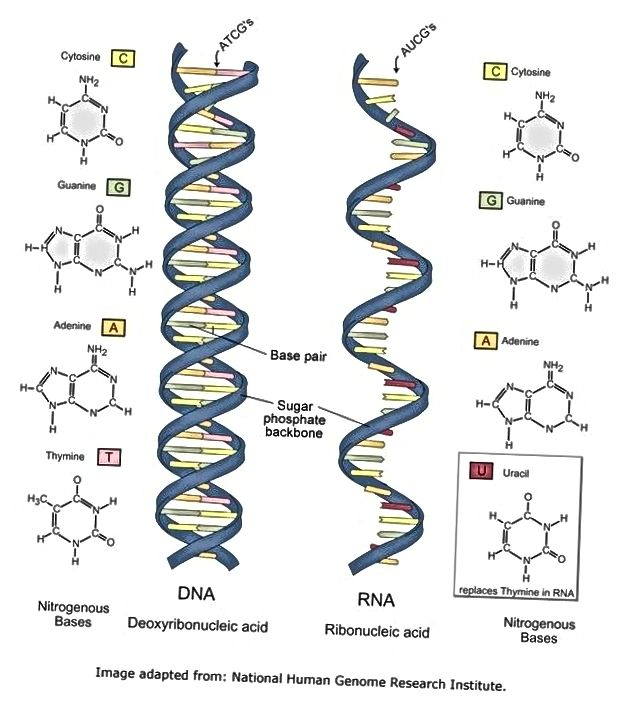 Нуклеиновые Кислоты Res. 2008; 36:3214–3225. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res. 2008; 36:3214–3225. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Донг Х, Навратилова П., Фредман Д., Драйвнес
Ø
, Беккер Т.С., Ленхард Б. Экзонные остатки дупликации всего генома обнаруживают цис-регуляторную функцию кодирующих экзонов. Нуклеиновые Кислоты Res. 2010;38:1071–1085. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Barthel KKB, Liu X. Усилитель транскрипции из кодирующей области ADAMTS5. ПЛОС ОДИН. 2008;3:e2184. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Tümpel S, Cambronero F, Sims C, Krumlauf R, Wiedemann LM. Регуляторный модуль, встроенный в кодирующую область Hoxa2, контролирует экспрессию в ромбомере 2. Proc Natl Acad Sci U S A. 2008;105:20077–20082. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Чен Х.П., Лин А., Блум Дж.С., Хан А.Х., Парк К.С., Смит Д.Дж. Скрининг выявляет консервативные и неконсервативные регуляторные элементы транскрипции, включая энхансер кодирующей области АРОЕ, зависящий от аллеля Е3/Е4. Геномика. 2008; 92: 292–300. [PubMed] [Google Scholar]
Геномика. 2008; 92: 292–300. [PubMed] [Google Scholar]
11. Baisnée PF, Baldi P, Brunak S, Pedersen AG. Гибкость генетического кода по отношению к структуре ДНК. Биоинформатика. 2001; 17: 237–248. [PubMed] [Google Scholar]
12. Рохс Р., Уэст С.М., Лю П., Хониг Б. Нюанс двойной спирали и ее роль в распознавании белок-ДНК. Curr Opin Struct Biol. 2009 г.;19:171–177. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Gaffney DJ, Blekhman R, Majewski J. Избирательные ограничения в экспериментально определенных регуляторных регионах приматов. Генетика PLoS. 2008;4:e1000157. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Санчес-Грасиа А., Ромеро-Посуэло Дж., Феррус А. Два фрекенина у дрозофилы: раскрытие эволюционной истории необычного дублирования нейронного датчика кальция (NCS). БМС Эвол Биол. 2010;10:54. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Неварез П.А., ДеБовер К.М., Фриланд Б.Дж., Куитт М.А., Буш Э.К. Смещения, зависящие от контекста, варьируются в пределах генома человека.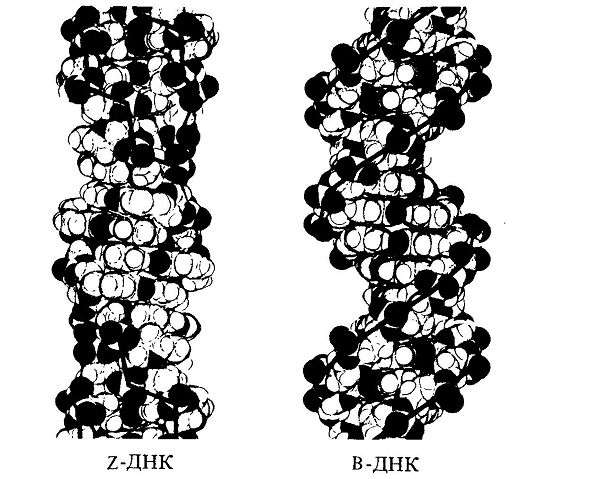 Биоинформатика BMC. 2010;11:462. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Биоинформатика BMC. 2010;11:462. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Chen C-H, Chuang T-J, Liao B-Y, Chen F-C. Сканирование сигнатур положительного отбора для вставок и делеций, специфичных для человека. Геном Биол Эвол. 2009; 1: 415–419. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Сатьяприя Р., Виджаябаскар М.С., Вишвешвара С. Взгляд на взаимодействие белок-ДНК с помощью структурного сетевого анализа. PLoS Comput Biol. 2008;4:e1000170. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Мидер С., Понтинг С.П., Лунтер Г. Массовый обмен функциональной последовательностью в геномах человека и других млекопитающих. Геном Res. 2010;20:1335–1343. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Meireles-Filho ACA, Stark A. Сравнительная геномика генной регуляции-консервации и расхождения цис-регуляторной информации. Curr Opin Genet Dev. 2009; 19: 565–570. [PubMed] [Google Scholar]
20. Gardiner EJ, Hunter C, Lu X, Willett P. Анализ структурного сходства двойной спирали ДНК. Дж Мол Биол. 2004;343:879–889. [PubMed] [Google Scholar]
Анализ структурного сходства двойной спирали ДНК. Дж Мол Биол. 2004;343:879–889. [PubMed] [Google Scholar]
21. Гринбаум Дж. А., Панг Б., Туллиус Т. Построение структурной карты в масштабе генома с разрешением в один нуклеотид. Геном Res. 2007; 17: 947–953. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22.
Рохс Р., Уэст С.М., Сосинский А., Лю П., Манн Р.С., Хониг Б. Роль формы ДНК в распознавании белков-ДНК. Природа. 2009; 461:1248–1253. [Бесплатная статья PMC] [PubMed] [Google Scholar]
•• Эта важная статья установила широко распространенный механизм селективного распознавания ДНК. Ключевой особенностью этого механизма распознавания является то, что он основан на взаимодействии формы ДНК и электростатического потенциала малой бороздки и, таким образом, представляет собой геномный сигнал, кодируемый формой ДНК.
23.
Китайнер М., Розенберг Х., Рохс Р., Суад О., Рабинович Д., Хониг Б., Шакед З. Разнообразие в распознавании ДНК p53, выявленное кристаллическими структурами с парами оснований Хугстина. Nature Struct Mol Biol. 2010; 17: 423–429. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Nature Struct Mol Biol. 2010; 17: 423–429. [Бесплатная статья PMC] [PubMed] [Google Scholar]
•• В этой статье сообщается о замечательном открытии пар оснований Хугстина в комплексе р53-ДНК. Узкая малая бороздка и сопутствующий отрицательный электростатический потенциал, возникающие в результате пары оснований Хугстина, распознаются незаменимым аргининовым остатком p53. Эта структура открывает новый способ изменения формы ДНК для формирования сайта узнавания.
24.
Стелла С., Касио Д., Джонсон Р.С. Форма малой бороздки ДНК определяет связывание ДНК-изгибающего белка Fis. Джинс Девель. 2010; 24:814–826. [Бесплатная статья PMC] [PubMed] [Google Scholar]
• В этой статье используется очень большой набор рентгеновских структур комплексов Fis-ДНК для уточнения деталей того, как белок распознает сайт связывания с высоким сродством. Наличие этого замечательного каталога структур ДНК-белкового комплекса позволяет вывести механизм распознавания, зависящего от формы ДНК.
25.
Locasale JW, Napoli AA, Chen S, Berman HM, Lawson CL. Признаки узнавания белок-ДНК в свободных сайтах связывания ДНК. Дж Мол Биол. 2009; 386:1054–1065. [Бесплатная статья PMC] [PubMed] [Google Scholar]
•• Эта статья представляет веские аргументы в пользу решения трехмерных структур голых молекул ДНК, которые также связаны с белком в комплексе белок-ДНК. К сожалению, в настоящее время существует очень мало примеров, но из результатов, представленных в этой статье, становится ясно, что из таких структурных сравнений можно будет извлечь важную информацию о распознавании белок-ДНК.
26. Li WH, Wu CI, Luo CC. Новый метод оценки синонимичных и несинонимичных скоростей замены нуклеотидов с учетом относительной вероятности изменений нуклеотидов и кодонов. Мол Биол Эвол. 1985; 2: 150–174. [PubMed] [Google Scholar]
27. Jiang C, Pugh BF. Позиционирование нуклеосом и регуляция генов: прогресс в геномике. Природа Преподобный Жене. 2010;10:161–172. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Radman-Livaja M, Rando O. Позиционирование нуклеосом: как оно установлено и почему это важно? Дев биол. 2010;339: 258–266. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Radman-Livaja M, Rando O. Позиционирование нуклеосом: как оно установлено и почему это важно? Дев биол. 2010;339: 258–266. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Segal E, Widom J. Что контролирует положение нуклеосом? Тенденции Жене. 2009; 25: 335–343. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Иошихес И.П., Альберт I, Зантон С.Дж., Пью Б.Ф. Положения нуклеосом, предсказанные с помощью сравнительной геномики. Природа Жене. 2006; 38: 1210–1215. [PubMed] [Google Scholar]
31. Kaplan N, Moore I, Fondufe-Mittendorf Y, Gossett A, Tillo D, Field Y, Leproust E, Hughes T, Lieb J, Widom J, et al. ДНК-кодируемая нуклеосомная организация эукариотического генома. Природа. 2009 г.;458:362–366. [PMC free article] [PubMed] [Google Scholar]
32. Толсторуков М.Ю., Коласанти А.В., МакКэндлиш Д., Олсон В.К., Журкин В.Б. Новый механизм укладки ДНК в хроматине «катись и скользи». Последствия для нуклеосомного позиционирования. Дж Мол Биол. 2007; 371: 725–738.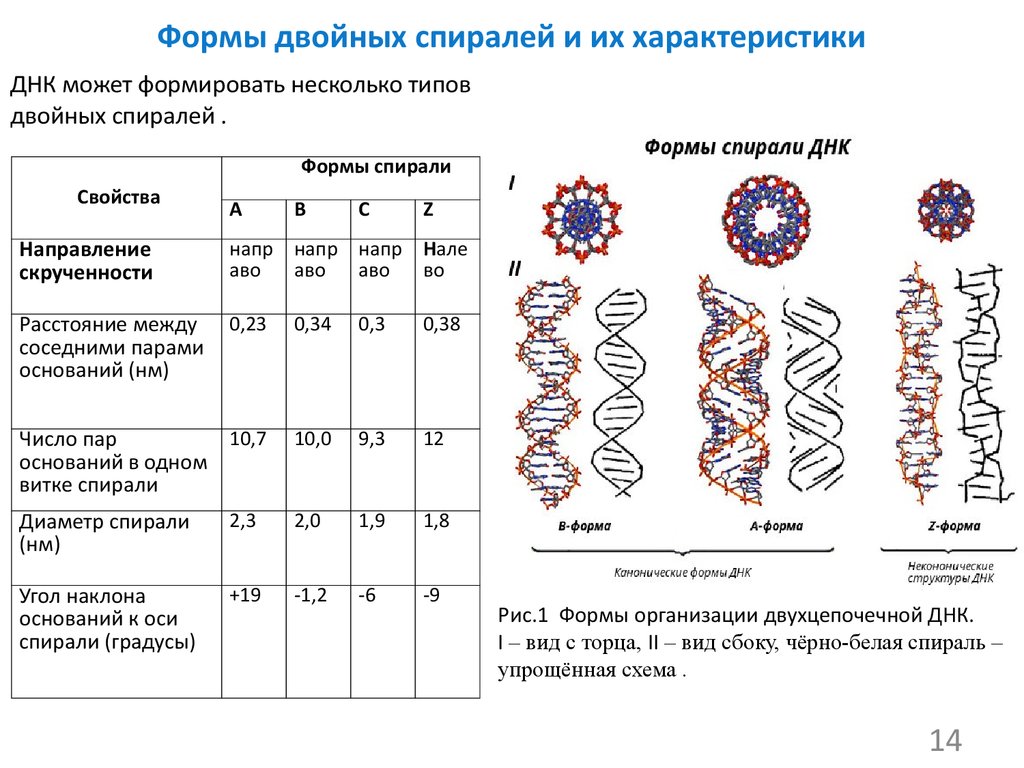 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Tillo D, Hughes TR. Содержание G + C доминирует над внутренней занятостью нуклеосом. Биоинформатика BMC. 2009;10:442. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Hughes A, Rando OJ. «Программирование» хроматина последовательностью — есть ли в нуклеосомном коде нечто большее, чем %GC? Дж. Биол. 2009 г.;8:96. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Segal E, Widom J. Поли(dA:dT) тракты: основные детерминанты организации нуклеосом. Curr Opin Struct Biol. 2009;19:65–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Sugihara F, Kasahara K, Kokubo T. Сильно перекрывающаяся функция нескольких AT-богатых последовательностей в качестве основных промоторных элементов в промоторе RPS5 без TATA Saccharomyces cerevisiae. Нуклеиновые Кислоты Res. 2011;39:59–75. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Miele V, Vaillant C, d’Aubenton-Carafa Y, Thermes C, Grange T.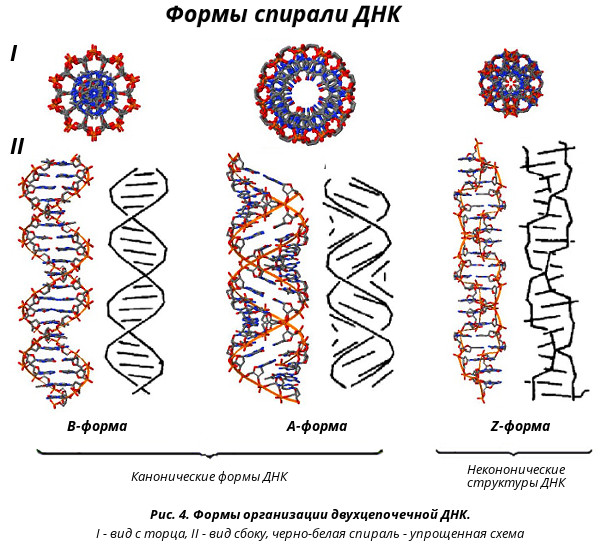 Физические свойства ДНК определяют занятость нуклеосомами от дрожжей до мух. Нуклеиновые Кислоты Res. 2008; 36: 3746–3756. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Физические свойства ДНК определяют занятость нуклеосомами от дрожжей до мух. Нуклеиновые Кислоты Res. 2008; 36: 3746–3756. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Бэббит Г.А., Ким Ю. Вывод естественного отбора на мелкомасштабную организацию хроматина у дрожжей. Мол Биол Эвол. 2008; 25:1714–1727. [PubMed] [Google Scholar]
39. Бэббит Г.А., Толсторуков М.Ю., Ким Ю. Молекулярная эволюция позиционирования нуклеосом посредством зависимой от последовательности деформации полимера ДНК. J Biomol Struct Dynam. 2010;27:765–780. [PubMed] [Академия Google]
40.
Кенигсберг Э., Бар А., Сегал Э., Танай А. Широко распространенная компенсаторная эволюция сохраняет кодируемую ДНК нуклеосомную организацию у дрожжей. PLoS Comput Biol. 2010;6:e1001039. [Бесплатная статья PMC] [PubMed] [Google Scholar]
•• Тщательный анализ паттернов замен у дрожжей в сочетании с данными о позиционировании нуклеосом с высоким разрешением показал, что существует пространственное сцепление компенсаторных мутаций. Эти паттерны мутаций служат для поддержания позиционирования нуклеосом, демонстрируя прямую связь между организацией хроматина и эволюцией последовательности.
Эти паттерны мутаций служат для поддержания позиционирования нуклеосом, демонстрируя прямую связь между организацией хроматина и эволюцией последовательности.
41.
Бэббит Г.А., Коттер С.Р. Функциональная консервация образования нуклеосом избирательно искажает предположительно нейтральную молекулярную изменчивость в геномах дрожжей. Геном Биол Эвол. 2011;3:15–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
•• В этом исследовании сообщается о сильной антикорреляции между паттернами замещения в дрожжах и основанной на энергетике моделью образования нуклеосом. Эта антикорреляция наиболее высока в точках на остове ДНК, которые взаимодействуют с поверхностью нуклеосомы. Таким образом, существует четкая связь между эволюцией структурных свойств ДНК и позиционированием нуклеосом.
42.
Коханим А.Б., Харан Т.Е. Сосуществование кода позиционирования нуклеосом с генетическим кодом в геномах эукариот. Нуклеиновые Кислоты Res. 2009; 37: 6466–6476. [Бесплатная статья PMC] [PubMed] [Google Scholar]
• В этом исследовании измерялось наличие A- и G-трактов в экзонах дрожжей, червей, арабидопсиса, рыбок данио и человека.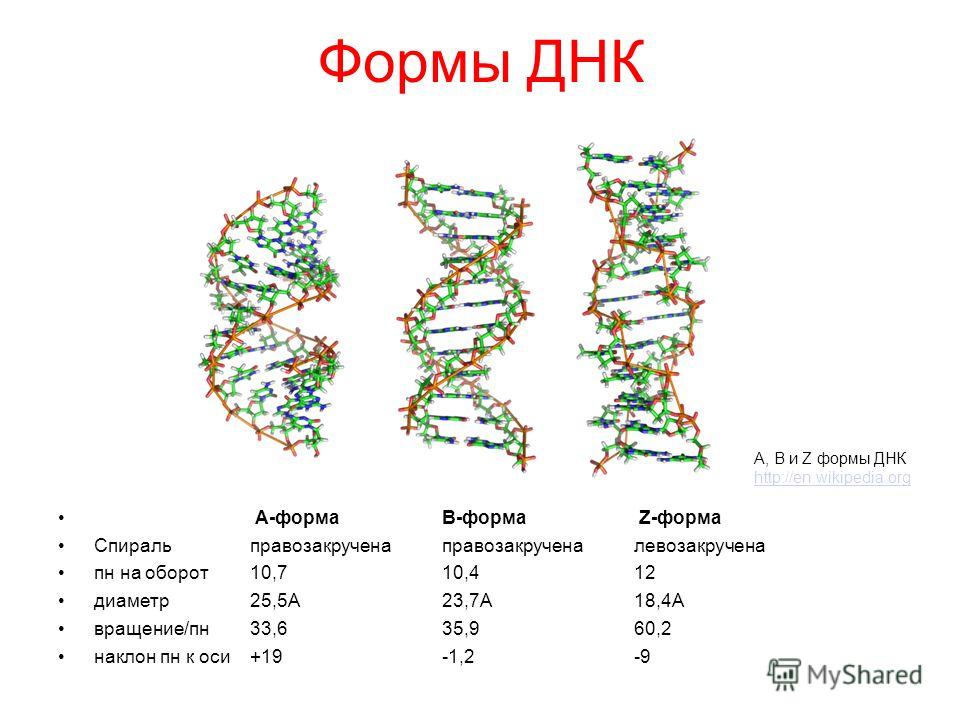 Сравнение с данными позиционирования нуклеосом показало, что избегание А-тракта специфично для областей экзонов с хорошо расположенными нуклеосомами, а не для линкерных областей. Эти результаты показывают, что эукариотические геномы используют известные сигналы позиционирования нуклеосом в кодирующих областях.
Сравнение с данными позиционирования нуклеосом показало, что избегание А-тракта специфично для областей экзонов с хорошо расположенными нуклеосомами, а не для линкерных областей. Эти результаты показывают, что эукариотические геномы используют известные сигналы позиционирования нуклеосом в кодирующих областях.
43. Купер Д.Н., Чен Дж.-М., Болл Э.В., Хауэллс К., Морт М., Филлипс А.Д., Чужанова Н., Кравчак М., Керер-Савацки Х., Стенсон П.Д. Гены, мутации и наследственные заболевания человека на заре эпохи персонализированной геномики. Хум Мут. 2010; 31: 631–655. [PubMed] [Google Scholar]
44. Feero WG, Guttmacher AE, Collins FS. Геномная медицина — обновленный учебник для начинающих. НЭЖМ. 2010;362:2001–2011. [PubMed] [Google Scholar]
45. Hindorff LA, Sethupathy P, Junkins HA, Ramos EM, Mehta JP, Collins FS, Manolio TA. Потенциальные этиологические и функциональные последствия полногеномных ассоциаций локусов для болезней и признаков человека. Proc Natl Acad Sci U S A.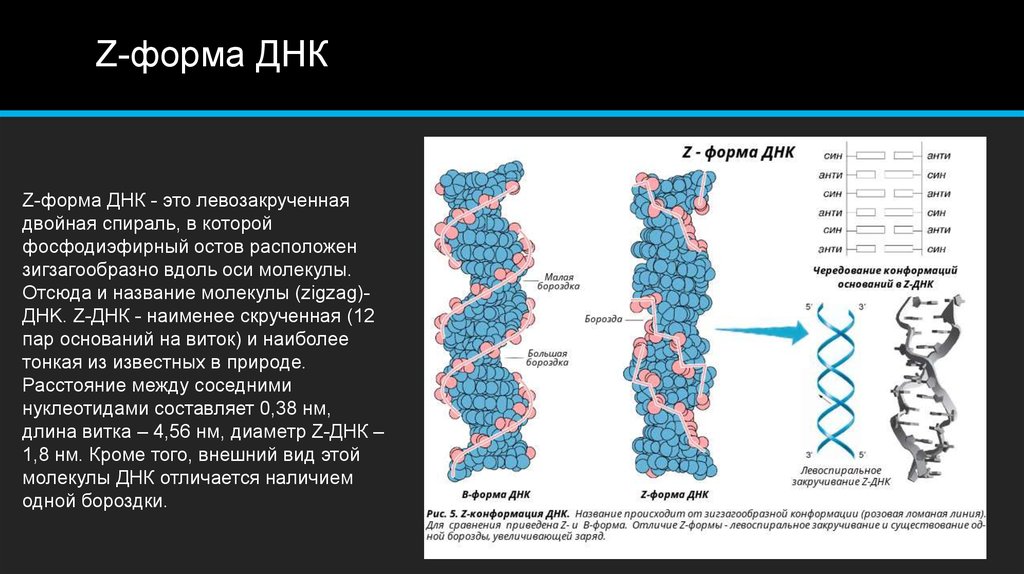 2009;106:9362–9367. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2009;106:9362–9367. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46.
Stitzel ML, Sethupathy P, Pearson DS, Chines PS, Song L, Erdos MR, Welch R, Parker SCJ, Boyle AP, Scott LJ, et al. Глобальный эпигеномный анализ первичных островков поджелудочной железы человека дает представление о локусах предрасположенности к диабету 2 типа. Клеточный метаб. 2010;12:443–455. [Бесплатная статья PMC] [PubMed] [Google Scholar]
•• В этом тщательном исследовании авторы использовали различные методы для идентификации регуляторных областей островковых клеток поджелудочной железы человека. Некоторые области встречаются в известных локусах, связанных с диабетом 2 типа, а подмножество проявляет аллель-специфическую энхансерную активность. Это исследование подчеркивает важность всестороннего понимания того, как некодирующие вариации влияют на биологическую функцию.
47.
Sommer WH, Lidström J, Sun H, Passer D, Eskay R, Parker SCJ, Witt SH, Zimmermann US, Nieratschker V, Rietschel M, et al.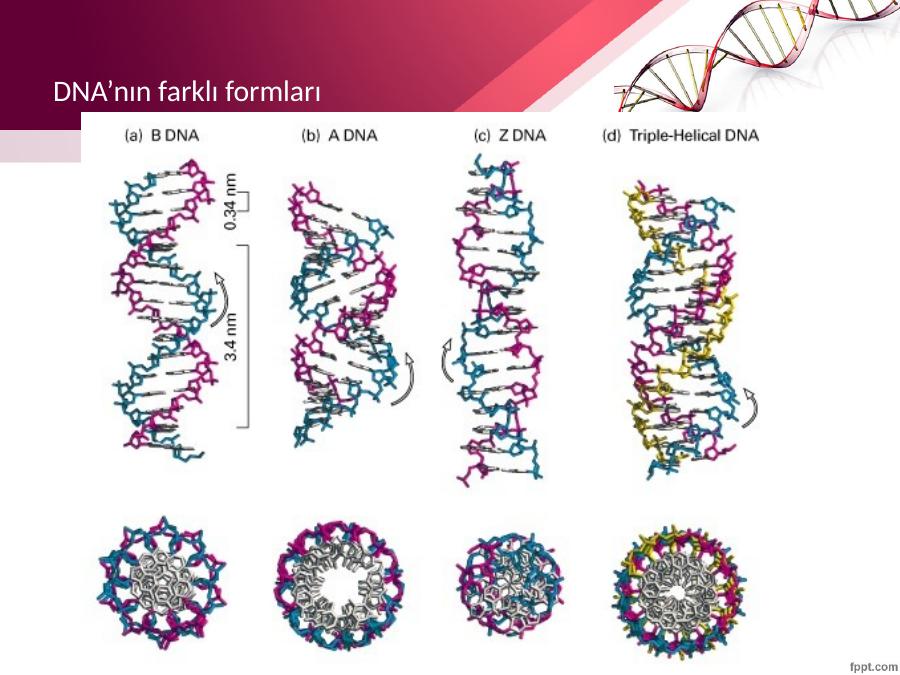 Вариация промотора NPY человека rs16147:T>C как модератор экспрессии префронтального гена NPY и негативного влияния. Хум Мут. 2010; 31: E1594–1608. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вариация промотора NPY человека rs16147:T>C как модератор экспрессии префронтального гена NPY и негативного влияния. Хум Мут. 2010; 31: E1594–1608. [Бесплатная статья PMC] [PubMed] [Google Scholar]
•• Изменения формы ДНК, вызванные полиморфизмом одного нуклеотида в некодирующей области генома, связанные с реакцией на стресс, использовались для обнаружения потенциально функциональных некодирующих вариантов. Последующие анализы выявили измеримые биохимические изменения связывания белков и регуляции генов, связанные с этим изменением.
48.
Петри К.Л., Джойс Г.Ф. Глубокий анализ последовательности мутаций, возникающих в результате включения аналогов dNTP. Нуклеиновые Кислоты Res. 2010; 38:8095–8104. [Бесплатная статья PMC] [PubMed] [Google Scholar]
•• Эта статья представляет собой замечательную иллюстрацию того, как высокопроизводительное секвенирование ДНК может дать новый взгляд на проблему, которая была хорошо изучена в прошлом с использованием менее прямого экспериментального считывания.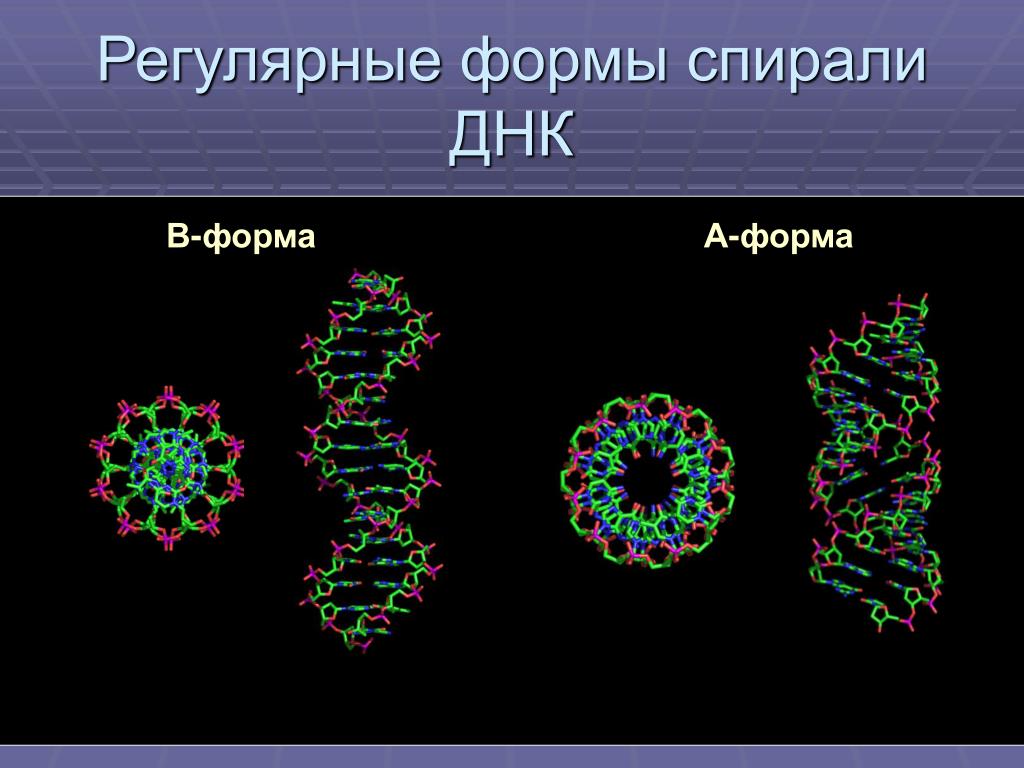 Вывод авторов о том, что «генотип … имеет значительный фенотип», является провокационным и потенциально далеко идущим по своим последствиям.
Вывод авторов о том, что «генотип … имеет значительный фенотип», является провокационным и потенциально далеко идущим по своим последствиям.
49. Gerstein MB, Lu ZJ, Van Nostrand EL, Cheng C, Arshinoff BI, Liu T, Yip KY, Robilotto R, Rechtsteiner A, Ikegami K, et al. Интегративный анализ генома Caenorhabditis elegans в рамках проекта modENCODE. Наука. 2010; 330:1775–1787. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Консорциум modENCODE Идентификация функциональных элементов и регуляторных цепей дрозофилы modENCODE. Наука. 2010; 330:1787–1797. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Weirauch MT, Hughes TR. Консервативное выражение без консервативной регуляторной последовательности: чем больше вещи меняются, тем больше они остаются неизменными. Тенденции Жене. 2010;26:66–74. [PubMed] [Google Scholar]
52. Schmidt D, Wilson MD, Ballester B, Schwalie PC, Brown GD, Marshall A, Kutter C, Watt S, Martinez-Jimenez CP, Mackay S, et al.