После генной терапии пациентка стала биологически моложе. Элизабет пэрриш bioviva
Первое в мире успешное генное омоложение: минус 20 лет
Элизабет Пэрриш, руководитель американской научно-исследовательской компании BioViva, стала первым человеком, на котором была успешно испытана омолаживающая генная терапия.
Несмотря на то, что первые возрастные изменения мы отмечаем по внешним признакам, процессы старения формируются и развиваются внутри — на клеточном уровне. Концевые участки хромосом называют теломерами. Они не несут генетической информации, но защищают хромосомы, выполняя роль своеобразного «буфера» против износа. Однако каждый раз, когда делится клетка, теломеры постепенно уменьшаются, пока не станут настолько короткими, что больше не могут защищать хромосомы. Как результат, клетка стареет и больше не может выполнять свои функции.
Фермент под названием теломераза способен достраивать короткие теломеры. Стареющие клетки организма благодаря теломеразе снова приобретают способность делиться, подобно молодым и здоровым клеткам. До сих пор методика удлинения теломер испытывалась лишь на культурах выращенных клеток и лабораторных животных.
Первый эксперимент по испытанию уникальной методики омоложения на человеке стартовал в сентябре 2015 года, когда 44-летняя Элизабет решилась пройти два экспериментальных курса генной терапии, разработанных её сотрудниками для замедления старения. Первый курс предназначен для предотвращения потерь мышечной массы с возрастом, а второй направлен на увеличение выработки теломеразы. Инъекции были сделаны Элизабет в Колумбии, так как препараты не одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA).
Теперь стали известны первые результаты генной терапии — и они ошеломляют! Анализы показали, что препараты действительно остановили укорачивание теломер. Лейкоциты в крови Пэрриш стали биологически моложе, а теломеры «удлинились» на 20 лет. Открытие компании BioViva привлекло внимание как учёных, так и инвесторов, а эксперимент тем временем продолжается и исследователи тщательно следят за здоровьем Пэрриш.
Что такое генная терапия, читайте в нашей статье:
Генная терапия: как лечат генетические заболевания
www.popmech.ru
Бессмертие Элизабет Пэрриш - vechnayamolodost.ru
Как учёные ищут рецепт продления жизни
Александра Христич, журнал «Кот Шрёдингера»
Статья опубликована на сайте «Российской газеты»
Элизабет Пэрриш. Фото: bioviva-science.com
В сентябре 2015 года Элизабет Пэрриш, директор американской фармацевтической компании BioViva, первой в мире решилась изменить свои гены, чтобы отсрочить старость. С помощью специального вируса она активировала в организме фермент теломеразу. Он известен тем, что делает клетки человека бессмертными. Есть гипотеза, что таким способом можно продлить молодость, и Элизабет надеется подтвердить это на собственном опыте.
Почему мы стареем?
Со временем большинство клеток изнашивается, и организм стареет. Отчего так происходит, учёные до сих пор не знают. Десятилетиями спорят: мы дряхлеем из-за поломок и механического износа органов или из-за программы старения, включающейся по сигналу из мозга? Но есть и хорошая новость: мы уже знаем, как стареют клетки. Когда они делятся, каждая хромосома теряет небольшой кусок. В новом поколении клеток хромосомы становятся короче. Затем ещё короче. Ещё…
Чтобы новые клетки не страдали, на концах хромосом размещены специальные повторяющиеся фрагменты – теломеры. Они ненесут важной информации, поэтому их укорачивание не вредит клеткам. Но неизбежно наступает точка невозврата: примерно после 50-70 делений теломеры заканчиваются – клетка больше не может делиться и погибает. Это число называется пределом Хейфлика, по фамилии учёного, открывшего этот эффект (Леонард Хейфлик – профессор анатомии Калифорнийского университета в Сан-Франциско). Считается, что укорачивание теломер – одна из причин старания людей.
Образ жизни может влиять на длину теломер. Больше всего не повезло курильщикам и людям, которые не занимаются спортом и часто волнуются: у них теломеры короче, чем у людей, ведущих здоровую и спокойную жизнь. А вот алкоголики могут вздохнуть спокойно: употребление спиртного никак не отражается на длине теломер. Впрочем, длину измеряли только в лейкоцитах.
Вечно молодые
Некоторым клеткам позарез необходимо быть бессмертными. Например, стволовым – своеобразным поставщикам клеток для всего тела. Стволовая клетка может превратиться в какую угодно. Иными словами, это команда запасных, которые всегда готовы заменить выбывших из строя по причине болезни или травмы. Половым клеткам тоже надо быть бессмертными, ведь они дают начало новому человеку. Во взрослом человеке около 37 триллионов клеток. Чтобы получить такое количество, самой первой оплодотворённой яйцеклетке необходимо поделиться как минимум 45 раз. В принципе, длины теломер должно на это хватить, но как быть с обновлением тканей? И будущими детьми? Получается, чтобы люди росли и растили детей, половым клеткам необходимо решить проблему укорачивания теломер.
Для этого есть специальный фермент теломераза. Она удлиняет теломеры и позволяет клетке делиться бесконечно долго. О том, что такой фермент существует, догадался советский биолог Алексей Оловников ещё в 1973 году. Через 11 лет учёные из Калифорнийского университета в Беркли выделили теломеразу из клеток. И в 2009-м получили за это открытие Нобелевскую премию. Как выразился Леонард Хейфлик, «проницательное предположение Оловникова получило экспериментальное подтверждение».
Многие россияне обиделись на Нобелевский комитет, хотя сам Алексей Матвеевич не стал комментировать его решение, а некоторое время спустя выдвинул новую теорию, ещё более смелую.
На самом деле Оловников отказался от теломерной гипотезы старения и взамен неё предложил т.н. редусомную теорию, предполагающую укорочение структур (принтомер и хрономер) в т. н. «латеральной ДНК» еще в начале 2000-х – ВМ.
Он предположил, что теломеры – лишь немые свидетели старения, а вызывают его другие специальные молекулы ДНК. Их он назвал хрономерами. По версии Оловникова, хрономеры находятся в клетках мозга и постепенно укорачиваются, отсчитывая время нашей жизни. Иными словами, хрономеры – это физическое воплощение биологических часов. Самое же неординарное предположение заключается в том, что на укорачивание хрономер влияет смена фаз Луны, возможно, через её гравитационное поле. Экспериментальных подтверждений этой экстравагантной гипотезы пока нет.
– Эксперты при виде моих гипотез традиционно чешут в затылках, – говорит Алексей Оловников. Но он не отчаивается и в статьях заранее благодарит экспериментаторов, которые смогут подтвердить его теорию. Так же как учёные из Калифорнийского университета подтвердили его догадку о существовании теломеразы более 30 лет назад.
Одна из причин старения – укорачивание теломер. Теломеры – это повторяющиеся фрагменты на концах хромосом. Примерно после 50-70 делений клетки теломеры заканчиваются, клетка больше не может делиться и погибает. Фото: depositphotos.com
В конце XX века выяснилось, что активация теломеразы в отдельных клетках приводит к их бессмертию. Но что значит «активация»? Строго говоря, ген теломеразы есть во всех клетках организма, но они, как правило, не подозревают о его существовании, поскольку ген выключен. В стволовых и половых клетках он, наоборот, включён, и теломераза удлиняет теломеры при малейшей необходимости. Получается, что, искусственно включив этот ген, можно заставить теломеразу работать в любой клетке и фактически обессмертить её. Более того, с помощью определенных вирусов ген теломеразы можно встроить в любую клетку – даже ту, в которой его и в помине не было.
Это открытие заинтриговало весь мир. У учёных появился инструмент, способный делать клетки бессмертными. Можно ли обессмертить самих людей? Однозначного ответа на этот вопрос до сих пор нет, однако за годы исследований накопилось множество любопытных данных.
Как вырастить мышь-долгожителя
В конце 1990-х биологи вывели генетически модифицированные породы мышей, чтобы детально изучить свойства теломеразы. Грызуны, у которых она от рождения не работала, имели множество проблем с внутренними органами и старели значительно раньше обычных животных. С другой стороны, у них возникало меньше злокачественных опухолей. Другие мыши, которые от рождения имели чрезмерно активную теломеразу, чаще болели раком. И тоже жили меньше обычного. Почему? Дело в том, что раковые клетки научились включать ген теломеразы гораздо раньше учёных и пользуются этим для того, чтобы делиться бесконечно. Таким образом, в организме мыши с выключенной теломеразой раковой опухоли гораздо сложнее появиться, чем у животного с активно работающим ферментом.
Ещё один интересный эксперимент провели на породе мышей, от рождения склонных к раку: опухоли вырастают у них очень легко, почти не встречая сопротивления со стороны организма. Биологи отключили у этих мышек теломеразу в надежде, что они будут меньше болеть раком. Результат оказался противоположным: без фермента грызуны покрылись опухолями значительно раньше, чем их сородичи.
Не совсем понятно, почему это происходит. Одна из версий заключается в том, что, если теломераза не работает, стволовые клетки теряют свои теломеры и стареют. А ведь из стволовых клеток получаются клетки иммунной системы, наши главные защитники от опухолей. Из старых стволовых клеток борцы с раком выходят так себе. Другая версия состоит в том, что, как только молекулы ДНК лишаются теломер и оголяют свои концы, клетка хочет как-нибудь их соединить. Но склеивать случайные молекулы ДНК – не самая лучшая идея, это приводит к мутациям и повышает вероятность рака.
Что будет с человеком, если отключить его теломеразу? Такой эксперимент, понятное дело, не поставишь, но можно изучить болезни, связанные с неправильной работой фермента. Одна из них называется врождённый дискератоз. Он проявляется в преждевременном старении: у больных рано седеют волосы и выпадают зубы, они часто болеют раком и редко доживают до 50 лет.
Омолодить старика
Чтобы понять, может ли включение теломеразы повернуть старение вспять, понадобились специальные мыши. Они были устроены хитрым образом: учёные выключили их ген теломеразы, но его можно было включить, скормив зверькам особое вещество. Изначально эти мышки быстро старели: у них раньше, чем у обычных особей, появлялись старческие нарушения работы семенников, селезёнки, кишечника и мозга, ухудшалось обоняние. Включение теломеразы омолодило животных: их внутренние органы стали лучше работать, мыши начали точнее распознавать запахи.
Наиболее впечатляющие результаты получили в 2012 году учёные из Испанского национального центра по исследованию рака. Они экспериментировали на самых обыкновенных мышах. Особи были двух возрастов: взрослые, то есть те, кому исполнился год, и престарелые, двухлетние. Исследователи заразили грызунов вирусом, который активирует теломеразу. В результате престарелые мыши стали жить на 13% дольше, а взрослые – аж на 24%. Что примечательно, заболеваемость раком не выросла.
44-летняя американка Элизабет Пэрриш решила повторить этот опыт на себе. BioViva – американская фармацевтическая компания, которую она возглавляет, основана в 2015 году и занимается разработкой и патентованием методов генной терапии. Два основных проекта – генная конструкция с теломеразой и конструкция с ингибитором миостатина (белок, вызывающий атрофию мышц, – Элизабет вколола себе и её). Клинические испытания, подтверждающие безопасность этих методов, не проводились.
Исследователи заразили лабораторных мышей вирусом, который активирует теломеразу – фермент, который удлиняет теломеры и позволяет клетке делиться бесконечно долго. В результате эксперимента престарелые мыши стали жить на 13% дольше, а взрослые – на 24%. Фото: depositphotos.com
Укол вирусом делали в некой лаборатории за пределами США, её название не обнародовалось. Использовали ослабленный вирус AAV (аденоассоциированный вирус), предварительно вставив в него ген теломеразы. Вирус внедряется в 19-ю хромосому в клетках крови, и в результате в них постоянно экпрессируется теломераза. Как сообщает официальный сайт компании BioViva, в апреле 2016-го, спустя полгода после инъекции, длина теломер Элизабет увеличилась на 9%, что соответствует омоложению тканей на 20 лет. Длину теломер измеряла независимая компания SpectraCell в Техасе. Звучит ободряюще, однако вряд ли стоит воспринимать этот результат как доказательство молодильной силы теломеразы. Во-первых, измерение длины теломер имеет большую погрешность – целых 8%. Во-вторых, тестирование настоящих лекарств – процесс более сложный.
Как минимум необходимы контрольная группа и большое количество испытуемых. Об этом нам рассказала Мария Бласко, руководитель группы испанских учёных, поставивших исходный эксперимент с активацией теломеразы:
– Любая новая терапия, генная в том числе, должна быть одобрена регулирующими органами и получить соответствующие разрешения для проведения клинических испытаний. Ведь клинические исследования должны гарантировать пациентам безопасность и максимальный шанс на успех. Наша группа проверяет терапию теломеразой на мышиных моделях, чтобы потом провести валидные клинические испытания и достоверно оценить пользу для пациентов.
«Кот Шрёдингера» попросил учёных-первооткрывателей механизмов клеточного старения прокомментировать поступок Пэрриш. Вот что сказал лауреат Нобелевской премии за открытие теломеразы Джек Шостак:
– Я не одобряю подобные трюки. Это совершенно ненаучный подход к сложной проблеме. Его единственная цель – одурачить доверчивых людей и выманить у них деньги на «лекарство», которое может оказаться весьма опасным.
Леонард Хейфлик к поступку Элизабет тоже отнёсся без энтузиазма:
– Я не поддерживаю опыты на себе в отсутствие рациональных объяснений. С древнейших времён люди экспериментируют, пытаясь отсрочить старость. Но по разным причинам успеха пока никто не достиг. Более того, у нас нет средства для определения эффекта. Люди веками считают, что их знаний по биологии достаточно, чтобы понять, как победить старение. Но поскольку этот процесс – результат второго закона термодинамики, вероятность успешного вмешательства близка к нулю. Всё во Вселенной стареет.
Хейфлик добавил, что не понимает саму идею поиска вечной молодости:
– Я бы не хотел, чтобы тираны, диктаторы и убийцы жили дольше.
А вот Алексей Оловников говорит об Элизабет менее категорично:
– Я восхищён её мужеством. В поступке Пэрриш есть две составляющих: смелость и желание пропиарить свою фирму BioViva.
Так или иначе, сама возмутительница спокойствия настроена решительно. Она планирует запатентовать свой метод омоложения, а пока путешествует по миру в поисках фирмы, которая согласится провести настоящие клинические исследования. Этим летом она побывала в Москве, где провела пресс-конференцию. Элизабет сообщила, что своим экспериментом хотела ускорить проведение клинических испытаний антивозрастной генной терапии. По её словам, учёные уже нашли способ продлить молодость, и она не видит смысла скрывать его.
Но на самом деле учёные пока боятся повторить этот опыт на людях и спорят о том, может ли вообще активация теломеразы продлить жизнь. Энтузиасты считают этот фермент настоящим эликсиром молодости, ведь если результаты эксперимента будут такими же, как на мышах, люди будут жить на целых 18 лет дольше. Скептики опасаются раковых опухолей и других побочных эффектов. Они сравнивают активацию теломеразы с окрашиванием седых волос, имея в виду, что, даже если теломеры удлинятся, это не обязательно устранит причину старения клеток. Да и означает ли омоложение клеток омоложение организма как суммы этих клеток? Со временем мы узнаем ответы на все эти вопросы, а пока нам остаётся самое интересное – искать их.
Портал «Вечная молодость» http://vechnayamolodost.ru 21.10.2016
www.vechnayamolodost.ru
Бессмертие Элизабет Пэрриш
В сентябре 2015 года Элизабет Пэрриш, директор фармацевтической компании BioViva, первой в мире решилась изменить свои гены, чтобы отсрочить старость. С помощью специального вируса она активировала в организме фермент теломеразу. Он известен тем, что делает клетки человека бессмертными. Есть гипотеза, что таким способом можно продлить молодость, и Элизабет надеется подтвердить это на собственном опыте.
Почему мы стареем?
Со временем большинство клеток изнашивается, и организм стареет. Отчего так происходит, учёные до сих пор не знают. Десятилетиями спорят: мы дряхлеем из-за поломок и механического износа органов или из-за программы старения, включающейся по сигналу из мозга?
Леонард Хейфлик. В 1960-е годы открыл ограничение числа делений у клеток человека: клетки умирают приблизительно после 40–60 делений (предел Хейфлика). Последовательно выступает против терапии старения и продления жизни. Отрицает как желательность, так и возможность антивозрастной медицины.
Но есть и хорошая новость: мы уже знаем, как стареют клетки. Когда они делятся, каждая хромосома теряет небольшой кусок. В новом поколении клеток хромосомы становятся короче. Затем ещё короче. Ещё…
Чтобы новые клетки не страдали, на концах хромосом размещены специальные повторяющиеся фрагменты — теломеры. Они не несут важной информации, поэтому их укорачивание не вредит клеткам. Но неизбежно наступает точка невозврата: примерно после 50 делений теломеры заканчиваются — клетка больше не может делиться и погибает. Это число называется пределом Хейфлика, по фамилии учёного, открывшего этот эффект. Считается, что укорачивание теломер — одна из причин старания людей.
Образ жизни может влиять на длину теломер. Больше всего не повезло курильщикам и людям, которые не занимаются спортом и часто волнуются: у них теломеры короче, чем у тех, кто ведёт здоровую и спокойную жизнь. А вот алкоголики могут вздохнуть спокойно: употребление спиртного никак не отражается на длине теломер. Впрочем, длину измеряли только в лейкоцитах.
Вечно молодые
Некоторым клеткам позарез необходимо быть бессмертными. Например, стволовым — своеобразным поставщикам клеток для всего тела. Стволовая клетка может превратиться в какую угодно. Иными словами, это команда запасных, которые всегда готовы заменить выбывших из строя по причине болезни или травмы. Половым клеткам тоже надо быть бессмертными, ведь они дают начало новому человеку. Во взрослом человеке 37 200 000 000 000 клеток. Чтобы получить такое количество, самой первой оплодотворённой яйцеклетке необходимо поделиться как минимум 45 раз. В принципе, длины теломер должно на это хватить, но как быть с обновлением тканей? И будущими детьми? Получается, чтобы люди росли и растили детей, половым клеткам необходимо решить проблему укорачивания теломер.
Для этого есть специальный фермент теломераза. Она удлиняет теломеры и позволяет клетке делиться бесконечно долго. О том, что такой фермент существует, догадался советский биолог Алексей Оловников ещё в 1973 году. Через 11 лет учёные из Калифорнийского университета в Беркли выделили теломеразу из клеток. И в 2009-м получили за это открытие Нобелевскую премию. Как выразился Леонард Хейфлик, «проницательное предположение Оловникова получило экспериментальное подтверждение».
Иллюстрация: Science Photo Library/East News / Компьютерное изображение хромосом.
Многие россияне обиделись на Нобелевский комитет, хотя сам Алексей Матвеевич не стал комментировать его решение, а некоторое время спустя выдвинул новую теорию, ещё более смелую. Он предположил, что теломеры — лишь немые свидетели старения, а вызывают его другие специальные молекулы ДНК. Их он назвал хрономерами. По версии Оловникова, хрономеры находятся в клетках мозга и постепенно укорачиваются, отсчитывая время нашей жизни. Иными словами, хрономеры — это физическое воплощение биологических часов. Самое же неординарное предположение заключается в том, что на укорачивание хрономер влияет смена фаз Луны, возможно, через её гравитационное поле. Экспериментальных подтверждений этой экстравагантной гипотезы пока нет.
— Эксперты при виде моих гипотез традиционно чешут в затылках, — говорит Алексей Оловников. Но не отчаивается и в статьях заранее благодарит экспериментаторов, которые смогут подтвердить его теорию. Так же как учёные из Калифорнийского университета подтвердили его догадку о существовании теломеразы более 30 лет назад.
В конце XX века выяснилось, что активация теломеразы в отдельных клетках приводит к их бессмертию. Но что значит «активация»? Строго говоря, ген теломеразы есть во всех клетках организма, но они, как правило, не подозревают о его существовании, поскольку ген выключен. В стволовых и половых клетках он, наоборот, включён, и теломераза удлиняет теломеры при малейшей необходимости. Получается, что, искусственно включив этот ген, можно заставить теломеразу работать в любой клетке и фактически обессмертить её. Более того, с помощью определённых вирусов ген теломеразы можно встроить в любую клетку — даже ту, в которой его и в помине не было.
Это открытие заинтриговало весь мир. У учёных появился инструмент, способный делать клетки бессмертными. Можно ли обессмертить самих людей? Однозначного ответа на этот вопрос до сих пор нет, однако за годы исследований накопилось множество любопытных данных.
Как вырастить мышь-долгожителя
В конце 1990-х биологи вывели генетически модифицированные породы мышей, чтобы детально изучить свойства теломеразы. Грызуны, у которых она от рождения не работала, имели множество проблем с внутренними органами и старели значительно раньше обычных животных. С другой стороны, у них возникало меньше злокачественных опухолей. Другие мыши, которые от рождения имели чрезмерно активную теломеразу, чаще болели раком. И тоже жили меньше обычного. Почему? Дело в том, что раковые клетки научились включать ген теломеразы гораздо раньше учёных и пользуются этим для того, чтобы делиться бесконечно. Таким образом, в организме мыши с выключенной теломеразой раковой опухоли гораздо сложнее появиться, чем у животного с активно работающим ферментом.
Ещё один интересный эксперимент провели на породе мышей, от рождения склонных к раку: опухоли вырастают у них очень легко, почти не встречая сопротивления со стороны организма. Биологи отключили у этих мышек теломеразу в надежде, что они будут меньше болеть раком. Результат оказался противоположным: без фермента грызуны покрылись опухолями значительно раньше, чем их сородичи.

Фото: Depositphotos / Эксперименты на мышах показали действенность терапии теломеразой.
Не совсем понятно, почему это происходит. Одна из версий заключается в том, что, если теломераза не работает, стволовые клетки теряют свои теломеры и стареют. А ведь из стволовых получаются клетки иммунной системы, наши главные защитники от опухолей. Из старых стволовых клеток борцы с раком выходят так себе.
Другая версия состоит в том, что, как только молекулы ДНК лишаются теломер и оголяют свои концы, клетка хочет как-нибудь их соединить. Но склеивать случайные молекулы ДНК — не самая лучшая идея, это приводит к мутациям и повышает вероятность рака.
Что будет с человеком, если отключить его теломеразу? Такой эксперимент, понятное дело, не поставишь, но можно изучить болезни, связанные с неправильной работой фермента. Одна из них называется врождённый дискератоз. Он проявляется в преждевременном старении: у больных рано седеют волосы и выпадают зубы, они часто болеют раком и редко доживают до 50 лет.
Омолодить старика
Чтобы понять, может ли включение теломеразы повернуть старение вспять, понадобились специальные мыши. Они были устроены хитрым образом: учёные выключили их ген теломеразы, но его можно было включить, скормив зверькам особое вещество. Изначально эти мышки быстро старели: у них раньше, чем у обычных особей, появлялись старческие нарушения работы семенников, селезёнки, кишечника и мозга, ухудшалось обоняние. Включение теломеразы омолодило животных: их внутренние органы стали лучше работать, мыши начали точнее распознавать запахи.
BioViva — американская фармацевтическая компания, основанная в 2015 году. Разрабатывает и патентует методы генной терапии. Два основных проекта — генная конструкция с теломеразой и конструкция с ингибитором миостатина (белок, вызывающий атрофию мышц, — Элизабет вколола себе и её). Клинические испытания, подтверждающие безопасность этих методов, не проводились.
Укол вирусом делали в некой лаборатории за пределами США, её название не сообщают. Длину теломер измеряла независимая компания SpectraCell в Техасе. В крови содержится много разных клеток с разной длиной теломер, этим объясняется большая погрешность их измерения. Использовали ослабленный вирус AAV (аденоассоциированный вирус), предварительно вставив в него ген теломеразы. Вирус внедряется в 19-ю хромосому в клетках крови, и в результате в них постоянно экспрессируется теломераза.
Наиболее впечатляющие результаты получили в 2012 году учёные из Испанского национального центра по исследованию рака. Они экспериментировали на самых обыкновенных мышах. Особи были двух возрастов: взрослые, то есть те, кому исполнился год, и престарелые, двухлетние. Исследователи заразили грызунов вирусом, который активирует теломеразу. В результате престарелые мыши стали жить на 13 % дольше, а взрослые — аж на 24 %. Что примечательно, заболеваемость раком не выросла.
Сорокачетырёхлетняя американка Элизабет Пэрриш решила повторить этот опыт на себе. Как сообщает официальный сайт компании BioViva, в апреле 2016-го, спустя полгода после инъекции вирусом, длина теломер Элизабет увеличилась на 9 %, что соответствует омоложению тканей на 20 лет. Звучит ободряюще, однако вряд ли стоит воспринимать этот результат как доказательство молодильной силы теломеразы. Во-первых, измерение длины теломер имеет большую погрешность — целых 8 %. Во-вторых, тестирование настоящих лекарств — процесс более сложный. Как минимум необходимы контрольная группа и большое количество испытуемых. Об этом нам рассказала Мария Бласко, руководитель группы испанских учёных, поставивших исходный эксперимент с активацией теломеразы:
— Любая новая терапия, генная в том числе, должна быть одобрена регулирующими органами и получить соответствующие разрешения для проведения клинических испытаний. Ведь клинические исследования должны гарантировать пациентам безопасность и максимальный шанс на успех. Наша группа проверяет терапию теломеразой на мышиных моделях, чтобы потом провести валидные клинические испытания и достоверно оценить пользу для пациентов.
«Кот Шрёдингера» попросил учёных — первооткрывателей механизмов клеточного старения прокомментировать поступок Пэрриш. Вот что сказал лауреат Нобелевской премии за открытие теломеразы Джек Шостак:
— Я не одобряю подобные трюки. Это совершенно ненаучный подход к сложной проблеме. Его единственная цель — одурачить доверчивых людей и выманить у них деньги на «лекарство», которое может оказаться весьма опасным.
Леонард Хейфлик к поступку Элизабет тоже отнёсся без энтузиазма:
— Я не поддерживаю опыты на себе в отсутствие рациональных объяснений. С древнейших времён люди экспериментируют, пытаясь отсрочить старость. Но по разным причинам успеха пока никто не достиг. Более того, у нас нет средства для определения эффекта. Люди веками считают, что их знаний по биологии достаточно, чтобы понять, как победить старение. Но поскольку этот процесс — результат второго закона термодинамики, вероятность успешного вмешательства близка к нулю. Всё во Вселенной стареет.
Фото: Depositphotos / Мезенхимальные стволовые клетки.
Хейфлик добавил, что не понимает саму идею поиска вечной молодости:
— Я бы не хотел, чтобы тираны, диктаторы и убийцы жили дольше.
А вот Алексей Оловников говорит об Элизабет менее категорично:
— Я восхищён её мужеством. В поступке Пэрриш есть две составляющие: смелость и желание пропиарить свою фирму BioViva.
Так или иначе, сама возмутительница спокойствия настроена решительно. Она планирует запатентовать свой метод омоложения, а пока путешествует по миру в поисках фирмы, которая согласится провести настоящие клинические исследования. Этим летом она побывала в Москве, где провела пресс-конференцию. Элизабет сообщила, что своим экспериментом хотела ускорить проведение клинических испытаний антивозрастной генной терапии. По её словам, учёные уже нашли способ продлить молодость, и она не видит смысла скрывать его.

Иллюстрация: Depositphotos / Схематичное изображение двойных спиралей ДНК.
Но на самом деле учёные пока боятся повторить этот опыт на людях и спорят о том, может ли вообще активация теломеразы продлить жизнь. Энтузиасты считают этот фермент настоящим эликсиром молодости, ведь если результаты эксперимента будут такими же, как на мышах, люди будут жить на 18 лет дольше. Скептики опасаются раковых опухолей и других побочных эффектов. Они сравнивают активацию теломеразы с окрашиванием седых волос, имея в виду, что, даже если теломеры удлинятся, это не обязательно устранит причину старения клеток. Да и означает ли омоложение клеток омоложение организма как суммы этих клеток? Со временем мы узнаем ответы на все эти вопросы, а пока нам остаётся самое интересное: искать их.
nauchkor.ru
Бессмертие Элизабет Пэрриш | Наука и техника
Два года прошло с начала небезынтересного эксперимента на человеке. В сентябре 2015 года Элизабет Пэрриш, директор фармацевтической компании BioViva, первой в мире решилась изменить свои гены, чтобы отсрочить старость. С помощью специального вируса она активировала в организме фермент теломеразу.
Он известен тем, что делает клетки человека бессмертными. Есть гипотеза, что таким способом можно продлить молодость, и Элизабет надеется подтвердить это на собственном опыте. Правда, за 2017 новая информация по этому эксперименту отсутствует (последнее официальное обследование проводилось в 2016 году).
Зато за это время произошел рад других знаковых событий, имеющих отношение к вопросам геронтологии. В частности, специалисты из Тилбургского университета (Нидерланды) провели исследование максимально возможной естественной продолжительности человеческой жизни (без вмешательства генных биотехнологий).
Это значение для женщин составило 115,7 лет, для мужчин — 114,1 лет. Отмечается, что за последние годы этот предел не увеличился, хотя число долгожителей в Нидерландах выросло втрое. По различным оценкам, предельный естественный срок жизни человека не может превышать 120-125 лет. Однако, генная терапия, возможно, способна раздвинуть эти рамки.
Нужно отметить, что Пэрриш, конечно, не единственный экспериментатор — сторонник «теломеразного подхода».
Например, Мария Бласко (María Blasco) из испанского Национального онкологического научного центра (Centro Nacional de Investigaciones Oncologicas, CNIO) попытались «омолодить» мышей, «достраивая» короткие теломеры (участки на концах хромосом). Ей удалось продлить как среднюю продолжительность жизни, так и максимальную, причем сразу в двух группах («взрослой» и «старой»): одна получила инъекции гена теломеразы (TERT, TERT-терапию) в возрасте 420 дней (увеличение медианной выживаемости на 24% и увеличение на 13% максимальной продолжительности жизни), а другая — в возрасте 720 дней (увеличение медианной выживаемости на 20% и увеличение максимальной продолжительности жизни на 13%).
Однако, инвесторы пока относятся к подобным экспериментам весьма скептически.Об этом свидетельствуют и неудачи Майкла Фоссела, профессора клинической медицины Университета штата Мичиган и СЕО компании Telocyte, который безуспешно пытается привлечь инвестиции для испытаний того же самого «теломеразного подхода» к лечению болезни Альцгеймера. Он одним из первых заговорил о том, что, возможно, не бета-амилоид или тау-белок, а старение является первопричиной возникновения болезни.
Произошло и еще одно важное событие, не относящееся непосредственно к вопросам старения, но делающее очередной шаг в «легализации» генной терапии как метода лечения.
Фармгигант Novartis, судя по всему, может положить начало широкому внедрению генной терапии в мировую клиническую практику: управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA) одобрило использование генной терапии для пациентов в возрасте от 3 до 25 лет, страдающих острым лимфобластным лейкозом. Метод лечения, предложенный Novartis, увеличил число выживших пациентов в 3-4 раза. Клинические испытания показали впечатляющие результаты: 83% пациентов, которым не помогла химиотерапия, смогли достичь частичной или полной ремиссии спустя три месяца после начала лечения CAR-T терапией. Спустя год 79% пациентов были живы. Ранее только от 16% до 30% больных этой формой рака имели шанс на спасение.
Рыночные эксперты предрекают этим областям бурный рост: рынок генной терапии рака прогнозируется в $4 млрд к 2024 году, рынок генной терапии в целом — в $11 млрд к 2025, а прогнозы для всей персонализированной медицины ещё более оптимистичны: от $149 млрд в 2020 году до $2,5 трлн к 2022.
Так что и теломеразная терапия косвенно обретает большую легитимность.
Но вернемся к эксперименту Пэрриш и к его предыстории.
Почему мы стареем?
Со временем большинство клеток изнашивается, и организм стареет. Отчего так происходит, учёные до сих пор не знают. Десятилетиями спорят: мы дряхлеем из-за поломок и механического износа органов или из-за программы старения, включающейся по сигналу из мозга?
Но есть и хорошая новость: мы уже знаем, как стареют клетки. Когда они делятся, каждая хромосома теряет небольшой кусок. В новом поколении клеток хромосомы становятся короче. Затем ещё короче. Ещё…
Чтобы новые клетки не страдали, на концах хромосом размещены специальные повторяющиеся фрагменты — теломеры. Они не несут важной информации, поэтому их укорачивание не вредит клеткам. Но неизбежно наступает точка невозврата: примерно после 50 делений теломеры заканчиваются — клетка больше не может делиться и погибает. Это число называется пределом Хейфлика, по фамилии учёного, открывшего этот эффект. Считается, что укорачивание теломер — одна из причин старания людей.
Образ жизни может влиять на длину теломер. Больше всего не повезло курильщикам и людям, которые не занимаются спортом и часто волнуются: у них теломеры короче, чем у тех, кто ведёт здоровую и спокойную жизнь. А вот алкоголики могут вздохнуть спокойно: употребление спиртного никак не отражается на длине теломер. Впрочем, длину измеряли только в лейкоцитах.
Вечно молодые
Некоторым клеткам позарез необходимо быть бессмертными. Например, стволовым — своеобразным поставщикам клеток для всего тела. Стволовая клетка может превратиться в какую угодно. Иными словами, это команда запасных, которые всегда готовы заменить выбывших из строя по причине болезни или травмы. Половым клеткам тоже надо быть бессмертными, ведь они дают начало новому человеку. Во взрослом человеке 37 200 000 000 000 клеток. Чтобы получить такое количество, самой первой оплодотворённой яйцеклетке необходимо поделиться как минимум 45 раз. В принципе, длины теломер должно на это хватить, но как быть с обновлением тканей? И будущими детьми? Получается, чтобы люди росли и растили детей, половым клеткам необходимо решить проблему укорачивания теломер.
Для этого есть специальный фермент теломераза. Она удлиняет теломеры и позволяет клетке делиться бесконечно долго. О том, что такой фермент существует, догадался советский биолог Алексей Оловников ещё в 1973 году. Через 11 лет учёные из Калифорнийского университета в Беркли выделили теломеразу из клеток. И в 2009-м получили за это открытие Нобелевскую премию. Как выразился Леонард Хейфлик, «проницательное предположение Оловникова получило экспериментальное подтверждение».
Многие россияне обиделись на Нобелевский комитет, хотя сам Алексей Матвеевич не стал комментировать его решение, а некоторое время спустя выдвинул новую теорию, ещё более смелую. Он предположил, что теломеры — лишь немые свидетели старения, а вызывают его другие специальные молекулы ДНК. Их он назвал хрономерами. По версии Оловникова, хрономеры находятся в клетках мозга и постепенно укорачиваются, отсчитывая время нашей жизни. Иными словами, хрономеры — это физическое воплощение биологических часов. Самое же неординарное предположение заключается в том, что на укорачивание хрономер влияет смена фаз Луны, возможно, через её гравитационное поле. Экспериментальных подтверждений этой экстравагантной гипотезы пока нет.
— Эксперты при виде моих гипотез традиционно чешут в затылках, — говорит Алексей Оловников. Но не отчаивается и в статьях заранее благодарит экспериментаторов, которые смогут подтвердить его теорию. Так же как учёные из Калифорнийского университета подтвердили его догадку о существовании теломеразы более 30 лет назад.
В конце XX века выяснилось, что активация теломеразы в отдельных клетках приводит к их бессмертию. Но что значит «активация»? Строго говоря, ген теломеразы есть во всех клетках организма, но они, как правило, не подозревают о его существовании, поскольку ген выключен. В стволовых и половых клетках он, наоборот, включён, и теломераза удлиняет теломеры при малейшей необходимости. Получается, что, искусственно включив этот ген, можно заставить теломеразу работать в любой клетке и фактически обессмертить её. Более того, с помощью определённых вирусов ген теломеразы можно встроить в любую клетку — даже ту, в которой его и в помине не было.
Это открытие заинтриговало весь мир. У учёных появился инструмент, способный делать клетки бессмертными. Можно ли обессмертить самих людей? Однозначного ответа на этот вопрос до сих пор нет, однако за годы исследований накопилось множество любопытных данных.
Как вырастить мышь-долгожителя
В конце 1990-х биологи вывели генетически модифицированные породы мышей, чтобы детально изучить свойства теломеразы. Грызуны, у которых она от рождения не работала, имели множество проблем с внутренними органами и старели значительно раньше обычных животных. С другой стороны, у них возникало меньше злокачественных опухолей. Другие мыши, которые от рождения имели чрезмерно активную теломеразу, чаще болели раком. И тоже жили меньше обычного. Почему? Дело в том, что раковые клетки научились включать ген теломеразы гораздо раньше учёных и пользуются этим для того, чтобы делиться бесконечно. Таким образом, в организме мыши с выключенной теломеразой раковой опухоли гораздо сложнее появиться, чем у животного с активно работающим ферментом.
Ещё один интересный эксперимент провели на породе мышей, от рождения склонных к раку: опухоли вырастают у них очень легко, почти не встречая сопротивления со стороны организма. Биологи отключили у этих мышек теломеразу в надежде, что они будут меньше болеть раком. Результат оказался противоположным: без фермента грызуны покрылись опухолями значительно раньше, чем их сородичи.
Не совсем понятно, почему это происходит. Одна из версий заключается в том, что, если теломераза не работает, стволовые клетки теряют свои теломеры и стареют. А ведь из стволовых получаются клетки иммунной системы, наши главные защитники от опухолей. Из старых стволовых клеток борцы с раком выходят так себе.
Другая версия состоит в том, что, как только молекулы ДНК лишаются теломер и оголяют свои концы, клетка хочет как-нибудь их соединить. Но склеивать случайные молекулы ДНК — не самая лучшая идея, это приводит к мутациям и повышает вероятность рака.
Что будет с человеком, если отключить его теломеразу? Такой эксперимент, понятное дело, не поставишь, но можно изучить болезни, связанные с неправильной работой фермента. Одна из них называется врождённый дискератоз. Он проявляется в преждевременном старении: у больных рано седеют волосы и выпадают зубы, они часто болеют раком и редко доживают до 50 лет.
Омолодить старика
Чтобы понять, может ли включение теломеразы повернуть старение вспять, понадобились специальные мыши. Они были устроены хитрым образом: учёные выключили их ген теломеразы, но его можно было включить, скормив зверькам особое вещество. Изначально эти мышки быстро старели: у них раньше, чем у обычных особей, появлялись старческие нарушения работы семенников, селезёнки, кишечника и мозга, ухудшалось обоняние. Включение теломеразы омолодило животных: их внутренние органы стали лучше работать, мыши начали точнее распознавать запахи.
Наиболее впечатляющие результаты получили в 2012 году учёные из Испанского национального центра по исследованию рака. Они экспериментировали на самых обыкновенных мышах. Особи были двух возрастов: взрослые, то есть те, кому исполнился год, и престарелые, двухлетние. Исследователи заразили грызунов вирусом, который активирует теломеразу. В результате престарелые мыши стали жить на 13 % дольше, а взрослые — аж на 24 %. Что примечательно, заболеваемость раком не выросла.
Сорокачетырёхлетняя американка Элизабет Пэрриш решила повторить этот опыт на себе. Как сообщает официальный сайт компании BioViva, в апреле 2016-го, спустя полгода после инъекции вирусом, длина теломер Элизабет увеличилась на 9 %, что соответствует омоложению тканей на 20 лет. Звучит ободряюще, однако вряд ли стоит воспринимать этот результат как доказательство молодильной силы теломеразы. Во-первых, измерение длины теломер имеет большую погрешность — целых 8 %. Во-вторых, тестирование настоящих лекарств — процесс более сложный. Как минимум необходимы контрольная группа и большое количество испытуемых. Об этом нам рассказала Мария Бласко, руководитель группы испанских учёных, поставивших исходный эксперимент с активацией теломеразы:
— Любая новая терапия, генная в том числе, должна быть одобрена регулирующими органами и получить соответствующие разрешения для проведения клинических испытаний. Ведь клинические исследования должны гарантировать пациентам безопасность и максимальный шанс на успех. Наша группа проверяет терапию теломеразой на мышиных моделях, чтобы потом провести валидные клинические испытания и достоверно оценить пользу для пациентов.
Журнал «Кот Шрёдингера» попросил учёных — первооткрывателей механизмов клеточного старения прокомментировать поступок Пэрриш. Вот что сказал лауреат Нобелевской премии за открытие теломеразы Джек Шостак:
— Я не одобряю подобные трюки. Это совершенно ненаучный подход к сложной проблеме. Его единственная цель — одурачить доверчивых людей и выманить у них деньги на «лекарство», которое может оказаться весьма опасным.
Леонард Хейфлик к поступку Элизабет тоже отнёсся без энтузиазма:
— Я не поддерживаю опыты на себе в отсутствие рациональных объяснений. С древнейших времён люди экспериментируют, пытаясь отсрочить старость. Но по разным причинам успеха пока никто не достиг. Более того, у нас нет средства для определения эффекта. Люди веками считают, что их знаний по биологии достаточно, чтобы понять, как победить старение. Но поскольку этот процесс — результат второго закона термодинамики, вероятность успешного вмешательства близка к нулю. Всё во Вселенной стареет.
Хейфлик добавил, что не понимает саму идею поиска вечной молодости:
— Я бы не хотел, чтобы тираны, диктаторы и убийцы жили дольше.
А вот Алексей Оловников говорит об Элизабет менее категорично:
— Я восхищён её мужеством. В поступке Пэрриш есть две составляющие: смелость и желание пропиарить свою фирму BioViva.
Так или иначе, сама возмутительница спокойствия настроена решительно. Она планирует запатентовать свой метод омоложения, а пока путешествует по миру в поисках фирмы, которая согласится провести настоящие клинические исследования. Этим летом (2016) она побывала в Москве, где провела пресс-конференцию. Элизабет сообщила, что своим экспериментом хотела ускорить проведение клинических испытаний антивозрастной генной терапии. По её словам, учёные уже нашли способ продлить молодость, и она не видит смысла скрывать его.
Но на самом деле учёные пока боятся повторить этот опыт на людях и спорят о том, может ли вообще активация теломеразы продлить жизнь. Энтузиасты считают этот фермент настоящим эликсиром молодости, ведь если результаты эксперимента будут такими же, как на мышах, люди будут жить на 18 лет дольше. Скептики опасаются раковых опухолей и других побочных эффектов. Они сравнивают активацию теломеразы с окрашиванием седых волос, имея в виду, что, даже если теломеры удлинятся, это не обязательно устранит причину старения клеток. Да и означает ли омоложение клеток омоложение организма как суммы этих клеток? Со временем мы узнаем ответы на все эти вопросы, а пока нам остаётся самое интересное: искать их.
autorp.ru
После генной терапии пациентка стала биологически моложе
Повторные анализы подтвердили успешность эксперимента, проведенного в сентябре 2015 года. Это первый в мире пример удлинения теломера посредством воздействия на хромосомы человека. До сих пор такие опыты ставились только на мышах, пишет EurekAlert.
Эксперимент был проведен компанией BioViva USA Inc. Ее прездидент, 44-летняя Элизабет Перриш, прошла две процедуры: по предотвращению потери мышечной массы с возрастом и по защите от истощения стволовых клеток, ответственных за развитие старческих болезней и немощей.
Теломеры — это короткие участки ДНК на концах каждой хромосомы, служащие защитой от износа. Они укорачиваются с каждым делением клетки, становясь все короче и со временем все хуже защищают хромосому. Это приводит к сбоям в деятельности клетки и старению организма.
BioViva обладает потенциалом раздвинуть границы генной терапии, обогнав другие компании на рынке биотехнологий, считает Дмитрий Каминский, основатель инвестиционного фонда DKLS.
Анализы, взятые у Перриш непосредственно до терапии, показали, что ее теломеры необычно короткие для человека ее возраста, что означало риск ранних старческих заболеваний. Вторичные тесты, сделанные уже в марте 2016, отметили удлинение теломеров примерно на 20 лет, то есть лейкоциты пациентки стали биологически моложе. Этот результат был подтвержден независимой организацией HEALES в Брюсселе и Фондом боиогеронтологических исследований в Великобритании.

Элизабет ПерришBioViva
«Современные методы лечения дают только незначительные улучшения в состоянии здоровья страдающих от старческих заболеваний, — говорит Перриш. — Вдобавок, изменения в образе жизни ограничивают воздействие таких видов терапии. Прогресс в биотехнологиях — лучшее решение, и если наши результаты хотя бы приблизительно точны, мы совершили исторический прорыв».
Bioviva продолжит наблюдать за состоянием Перриш в течение нескольких лет. Параллельно с этим компания проведет испытания новых типов генной терапии — возможно ли распространить успех в лейкоцитах на другие ткани и органы и закрепить его на других пациентах.
hightech.fm
Бессмертие Элизабет Пэрриш - Интернет портал

Фото: AFP/East News / Элизабет Пэрриш, директор фармацевтической компании BioViva.
В сентябре 2015 года Элизабет Пэрриш, директор фармацевтической компании BioViva, первой в мире решилась изменить свои гены, чтобы отсрочить старость. С помощью специального вируса она активировала в организме фермент теломеразу. Он известен тем, что делает клетки человека бессмертными. Есть гипотеза, что таким способом можно продлить молодость, и Элизабет надеется подтвердить это на собственном опыте.
Почему мы стареем?
Со временем большинство клеток изнашивается, и организм стареет. Отчего так происходит, учёные до сих пор не знают. Десятилетиями спорят: мы дряхлеем из-за поломок и механического износа органов или из-за программы старения, включающейся по сигналу из мозга?
Леонард Хейфлик. В 1960-е годы открыл ограничение числа делений у клеток человека: клетки умирают приблизительно после 40–60 делений (предел Хейфлика). Последовательно выступает против терапии старения и продления жизни. Отрицает как желательность, так и возможность антивозрастной медицины.
Но есть и хорошая новость: мы уже знаем, как стареют клетки. Когда они делятся, каждая хромосома теряет небольшой кусок. В новом поколении клеток хромосомы становятся короче. Затем ещё короче. Ещё…
Чтобы новые клетки не страдали, на концах хромосом размещены специальные повторяющиеся фрагменты — теломеры. Они не несут важной информации, поэтому их укорачивание не вредит клеткам. Но неизбежно наступает точка невозврата: примерно после 50 делений теломеры заканчиваются — клетка больше не может делиться и погибает. Это число называется пределом Хейфлика, по фамилии учёного, открывшего этот эффект. Считается, что укорачивание теломер — одна из причин старания людей.
Образ жизни может влиять на длину теломер. Больше всего не повезло курильщикам и людям, которые не занимаются спортом и часто волнуются: у них теломеры короче, чем у тех, кто ведёт здоровую и спокойную жизнь. А вот алкоголики могут вздохнуть спокойно: употребление спиртного никак не отражается на длине теломер. Впрочем, длину измеряли только в лейкоцитах.
Вечно молодые
Некоторым клеткам позарез необходимо быть бессмертными. Например, стволовым — своеобразным поставщикам клеток для всего тела. Стволовая клетка может превратиться в какую угодно. Иными словами, это команда запасных, которые всегда готовы заменить выбывших из строя по причине болезни или травмы. Половым клеткам тоже надо быть бессмертными, ведь они дают начало новому человеку. Во взрослом человеке 37 200 000 000 000 клеток. Чтобы получить такое количество, самой первой оплодотворённой яйцеклетке необходимо поделиться как минимум 45 раз. В принципе, длины теломер должно на это хватить, но как быть с обновлением тканей? И будущими детьми? Получается, чтобы люди росли и растили детей, половым клеткам необходимо решить проблему укорачивания теломер.
Для этого есть специальный фермент теломераза. Она удлиняет теломеры и позволяет клетке делиться бесконечно долго. О том, что такой фермент существует, догадался советский биолог Алексей Оловников ещё в 1973 году. Через 11 лет учёные из Калифорнийского университета в Беркли выделили теломеразу из клеток. И в 2009-м получили за это открытие Нобелевскую премию. Как выразился Леонард Хейфлик, «проницательное предположение Оловникова получило экспериментальное подтверждение».
Иллюстрация: Science Photo Library/East News / Компьютерное изображение хромосом.
Многие россияне обиделись на Нобелевский комитет, хотя сам Алексей Матвеевич не стал комментировать его решение, а некоторое время спустя выдвинул новую теорию, ещё более смелую. Он предположил, что теломеры — лишь немые свидетели старения, а вызывают его другие специальные молекулы ДНК. Их он назвал хрономерами. По версии Оловникова, хрономеры находятся в клетках мозга и постепенно укорачиваются, отсчитывая время нашей жизни. Иными словами, хрономеры — это физическое воплощение биологических часов. Самое же неординарное предположение заключается в том, что на укорачивание хрономер влияет смена фаз Луны, возможно, через её гравитационное поле. Экспериментальных подтверждений этой экстравагантной гипотезы пока нет.
— Эксперты при виде моих гипотез традиционно чешут в затылках, — говорит Алексей Оловников. Но не отчаивается и в статьях заранее благодарит экспериментаторов, которые смогут подтвердить его теорию. Так же как учёные из Калифорнийского университета подтвердили его догадку о существовании теломеразы более 30 лет назад.
В конце XX века выяснилось, что активация теломеразы в отдельных клетках приводит к их бессмертию. Но что значит «активация»? Строго говоря, ген теломеразы есть во всех клетках организма, но они, как правило, не подозревают о его существовании, поскольку ген выключен. В стволовых и половых клетках он, наоборот, включён, и теломераза удлиняет теломеры при малейшей необходимости. Получается, что, искусственно включив этот ген, можно заставить теломеразу работать в любой клетке и фактически обессмертить её. Более того, с помощью определённых вирусов ген теломеразы можно встроить в любую клетку — даже ту, в которой его и в помине не было.
Это открытие заинтриговало весь мир. У учёных появился инструмент, способный делать клетки бессмертными. Можно ли обессмертить самих людей? Однозначного ответа на этот вопрос до сих пор нет, однако за годы исследований накопилось множество любопытных данных.
Как вырастить мышь-долгожителя
В конце 1990-х биологи вывели генетически модифицированные породы мышей, чтобы детально изучить свойства теломеразы. Грызуны, у которых она от рождения не работала, имели множество проблем с внутренними органами и старели значительно раньше обычных животных. С другой стороны, у них возникало меньше злокачественных опухолей. Другие мыши, которые от рождения имели чрезмерно активную теломеразу, чаще болели раком. И тоже жили меньше обычного. Почему? Дело в том, что раковые клетки научились включать ген теломеразы гораздо раньше учёных и пользуются этим для того, чтобы делиться бесконечно. Таким образом, в организме мыши с выключенной теломеразой раковой опухоли гораздо сложнее появиться, чем у животного с активно работающим ферментом.
Ещё один интересный эксперимент провели на породе мышей, от рождения склонных к раку: опухоли вырастают у них очень легко, почти не встречая сопротивления со стороны организма. Биологи отключили у этих мышек теломеразу в надежде, что они будут меньше болеть раком. Результат оказался противоположным: без фермента грызуны покрылись опухолями значительно раньше, чем их сородичи.
Фото: Depositphotos / Эксперименты на мышах показали действенность терапии теломеразой.
Не совсем понятно, почему это происходит. Одна из версий заключается в том, что, если теломераза не работает, стволовые клетки теряют свои теломеры и стареют. А ведь из стволовых получаются клетки иммунной системы, наши главные защитники от опухолей. Из старых стволовых клеток борцы с раком выходят так себе.
Другая версия состоит в том, что, как только молекулы ДНК лишаются теломер и оголяют свои концы, клетка хочет как-нибудь их соединить. Но склеивать случайные молекулы ДНК — не самая лучшая идея, это приводит к мутациям и повышает вероятность рака.
Что будет с человеком, если отключить его теломеразу? Такой эксперимент, понятное дело, не поставишь, но можно изучить болезни, связанные с неправильной работой фермента. Одна из них называется врождённый дискератоз. Он проявляется в преждевременном старении: у больных рано седеют волосы и выпадают зубы, они часто болеют раком и редко доживают до 50 лет.
Омолодить старика
Чтобы понять, может ли включение теломеразы повернуть старение вспять, понадобились специальные мыши. Они были устроены хитрым образом: учёные выключили их ген теломеразы, но его можно было включить, скормив зверькам особое вещество. Изначально эти мышки быстро старели: у них раньше, чем у обычных особей, появлялись старческие нарушения работы семенников, селезёнки, кишечника и мозга, ухудшалось обоняние. Включение теломеразы омолодило животных: их внутренние органы стали лучше работать, мыши начали точнее распознавать запахи.
BioViva — американская фармацевтическая компания, основанная в 2015 году. Разрабатывает и патентует методы генной терапии. Два основных проекта — генная конструкция с теломеразой и конструкция с ингибитором миостатина (белок, вызывающий атрофию мышц, — Элизабет вколола себе и её). Клинические испытания, подтверждающие безопасность этих методов, не проводились.
Укол вирусом делали в некой лаборатории за пределами США, её название не сообщают. Длину теломер измеряла независимая компания SpectraCell в Техасе. В крови содержится много разных клеток с разной длиной теломер, этим объясняется большая погрешность их измерения. Использовали ослабленный вирус AAV (аденоассоциированный вирус), предварительно вставив в него ген теломеразы. Вирус внедряется в 19-ю хромосому в клетках крови, и в результате в них постоянно экспрессируется теломераза.
Наиболее впечатляющие результаты получили в 2012 году учёные из Испанского национального центра по исследованию рака. Они экспериментировали на самых обыкновенных мышах. Особи были двух возрастов: взрослые, то есть те, кому исполнился год, и престарелые, двухлетние. Исследователи заразили грызунов вирусом, который активирует теломеразу. В результате престарелые мыши стали жить на 13 % дольше, а взрослые — аж на 24 %. Что примечательно, заболеваемость раком не выросла.
Сорокачетырёхлетняя американка Элизабет Пэрриш решила повторить этот опыт на себе. Как сообщает официальный сайт компании BioViva, в апреле 2016-го, спустя полгода после инъекции вирусом, длина теломер Элизабет увеличилась на 9 %, что соответствует омоложению тканей на 20 лет. Звучит ободряюще, однако вряд ли стоит воспринимать этот результат как доказательство молодильной силы теломеразы. Во-первых, измерение длины теломер имеет большую погрешность — целых 8 %. Во-вторых, тестирование настоящих лекарств — процесс более сложный. Как минимум необходимы контрольная группа и большое количество испытуемых. Об этом нам рассказала Мария Бласко, руководитель группы испанских учёных, поставивших исходный эксперимент с активацией теломеразы:
— Любая новая терапия, генная в том числе, должна быть одобрена регулирующими органами и получить соответствующие разрешения для проведения клинических испытаний. Ведь клинические исследования должны гарантировать пациентам безопасность и максимальный шанс на успех. Наша группа проверяет терапию теломеразой на мышиных моделях, чтобы потом провести валидные клинические испытания и достоверно оценить пользу для пациентов.
«Кот Шрёдингера» попросил учёных — первооткрывателей механизмов клеточного старения прокомментировать поступок Пэрриш. Вот что сказал лауреат Нобелевской премии за открытие теломеразы Джек Шостак:
— Я не одобряю подобные трюки. Это совершенно ненаучный подход к сложной проблеме. Его единственная цель — одурачить доверчивых людей и выманить у них деньги на «лекарство», которое может оказаться весьма опасным.
Леонард Хейфлик к поступку Элизабет тоже отнёсся без энтузиазма:
— Я не поддерживаю опыты на себе в отсутствие рациональных объяснений. С древнейших времён люди экспериментируют, пытаясь отсрочить старость. Но по разным причинам успеха пока никто не достиг. Более того, у нас нет средства для определения эффекта. Люди веками считают, что их знаний по биологии достаточно, чтобы понять, как победить старение. Но поскольку этот процесс — результат второго закона термодинамики, вероятность успешного вмешательства близка к нулю. Всё во Вселенной стареет.
Фото: Depositphotos / Мезенхимальные стволовые клетки.
Хейфлик добавил, что не понимает саму идею поиска вечной молодости:
— Я бы не хотел, чтобы тираны, диктаторы и убийцы жили дольше.
А вот Алексей Оловников говорит об Элизабет менее категорично:
— Я восхищён её мужеством. В поступке Пэрриш есть две составляющие: смелость и желание пропиарить свою фирму BioViva.
Так или иначе, сама возмутительница спокойствия настроена решительно. Она планирует запатентовать свой метод омоложения, а пока путешествует по миру в поисках фирмы, которая согласится провести настоящие клинические исследования. Этим летом она побывала в Москве, где провела пресс-конференцию. Элизабет сообщила, что своим экспериментом хотела ускорить проведение клинических испытаний антивозрастной генной терапии. По её словам, учёные уже нашли способ продлить молодость, и она не видит смысла скрывать его.

Иллюстрация: Depositphotos / Схематичное изображение двойных спиралей ДНК.
Но на самом деле учёные пока боятся повторить этот опыт на людях и спорят о том, может ли вообще активация теломеразы продлить жизнь. Энтузиасты считают этот фермент настоящим эликсиром молодости, ведь если результаты эксперимента будут такими же, как на мышах, люди будут жить на 18 лет дольше. Скептики опасаются раковых опухолей и других побочных эффектов. Они сравнивают активацию теломеразы с окрашиванием седых волос, имея в виду, что, даже если теломеры удлинятся, это не обязательно устранит причину старения клеток. Да и означает ли омоложение клеток омоложение организма как суммы этих клеток? Со временем мы узнаем ответы на все эти вопросы, а пока нам остаётся самое интересное: искать их.
http://kot.sh/statya/3400/bessmertie-elizabet-perrish
portalinweb.com
Элизабет Пэрриш — первый в мире генно-модифицированный человек
Идея вечной молодости или хотя бы более долгой и здоровой жизни волновала человечество на всех этапах развития цивилизации. Ученых всегда интересовала возможность увеличения продолжительности жизни человека, и вот, когда достижения в области правильного питания и активного образа жизни были исчерпаны, они обратили свой взор в сторону генных изменений.
Когда мы видим сюжеты о том, что генетики проводят эксперименты на лабораторных животных, изменяют геном, например, с целью замедлить старение клеток, нам кажется, что все это из области фантастики и отдаленного будущего. Но, оказывается, что фантастика стала реальностью. На Земле уже живет человек с искусственно измененными генами.
Это американка Элизабет Пэрриш, которая согласилась на вмешательство генетиков ради того, чтобы остановить старение своего организма, ну и, разумеется, чтобы принести пользу миру. На самом деле она еще и является одним из руководителей научно-медицинской компании BioViva, которая и проводит этот смелый эксперимент.

Чтобы понять суть искусственных изменений, необходимо немного осветить проблему старения с точки зрения генетики. Сам процесс старения заложен в нашей ДНК, а начинается он с процесса уменьшения концевых отростков хромосом, так называемых теломер. Чем старше биологический возраст человека, тем короче его теломеры. В процессе роста клеток происходит деление ДНК, что сопровождается укорачиванием теломер и в конечном итоге приводит к старению и гибели клетки.
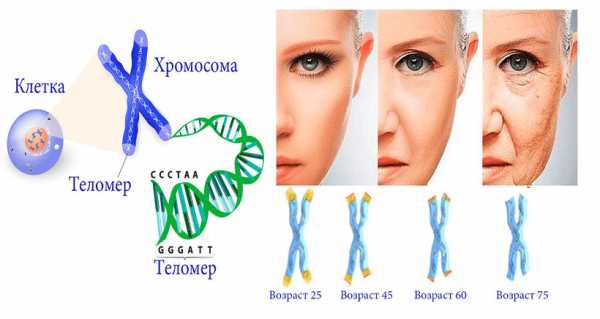
В конце 2015 года Элизабет Пэрриш ввели генетический материал, который, проникнув внутрь ядра каждой клетки ее организма, должен был запустить изменения, и способствовать увеличению длины теломер. Таким образом, по предположению ученых, будет остановлен процесс старения и произойдет общее омоложение организма.
Принимая во внимание то, что результаты такого эксперимента могут быть самыми непредсказуемыми, вплоть до летального исхода, Элизабет даже записала обращение, в котором подтверждала свое согласие на инъекцию и озвучила понимание серьезности генетического вмешательства. Для введения генетического материала ей даже пришлось ехать в Колумбию, так как на территории Соединенных Штатов подобные опыты с людьми запрещены законодательно.

И вот ученые уже обнародовали первые результаты эксперимента. Пока все выглядит более чем оптимистично: биологический возраст женщины уменьшился примерно на 20 лет. Это выражается в состоянии лейкоцитов ее крови, а также в теломерах хромосом, которые удлинились, вместо того, чтобы дальше разрушаться. Во внешности 45 летней женщины также произошли некоторые изменения. Ее кожа стала более упругой и улучшилось состояние волос.

Безусловно, окончательные выводы делать пока рано, но полученные результаты уже можно считать прорывом в области борьбы со старением человеческого организма. Ученые надеются, что подобная технология поможет миру в борьбе с возрастными заболеваниями, а также с некоторыми генетическими отклонениями.
www.time2travel.su