О Бактериофагах
Что такое бактериофаги?
xорошо известно, что бактериофаги умеют адаптироваться к новым условиям благодаря мутациям, но из признаков «живого» им присущи только способность к размножению и передаче потомкам наследственной информации. Именно эти свойства позволили человеку использовать их как альтернативу антибиотикам для борьбы с инфекциями и уничтожения болезнетворных бактерий.
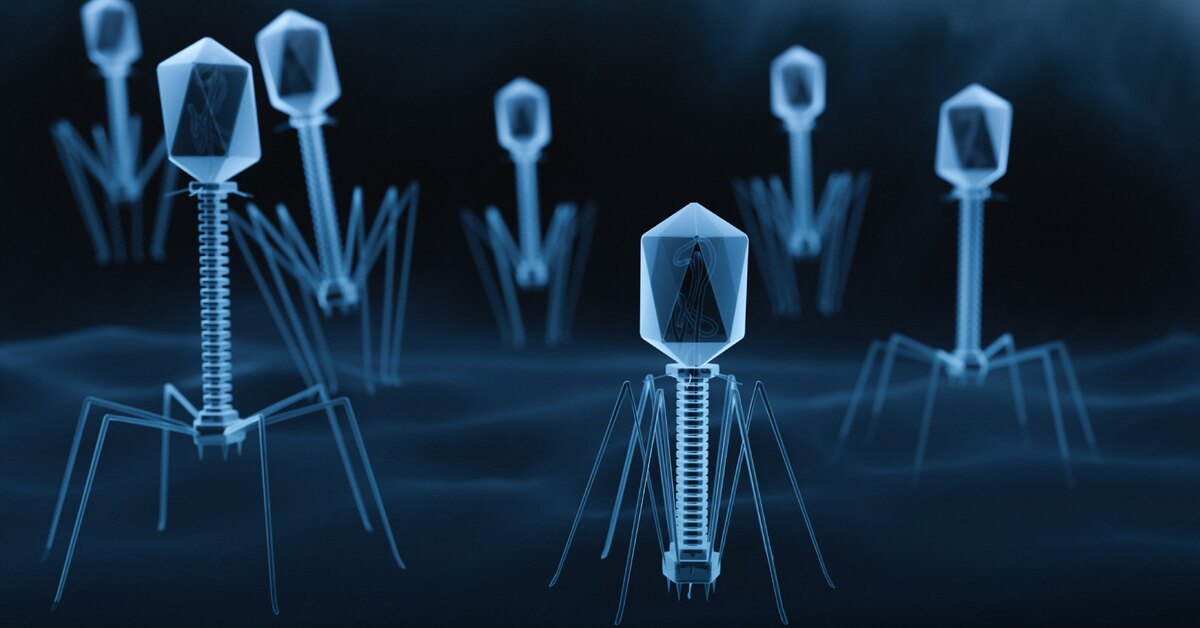
Бактериофаги — это вирусы, мельчайшие природные структуры, похожие на молекулярные кристаллы. Но, в отличие от большинства известных человечеству вирусов, они поражают не высшие организмы (например — человека), а только низшие — одноклеточные, недаром «бактериофаг» буквально переводится как «пожиратель бактерий». Бактериофаги устроены настолько просто, что даже не могут размножаться самостоятельно – для этого им, как и другим вирусам, нужна «чужая» живая клетка.
Из чего состоит бактериофаг
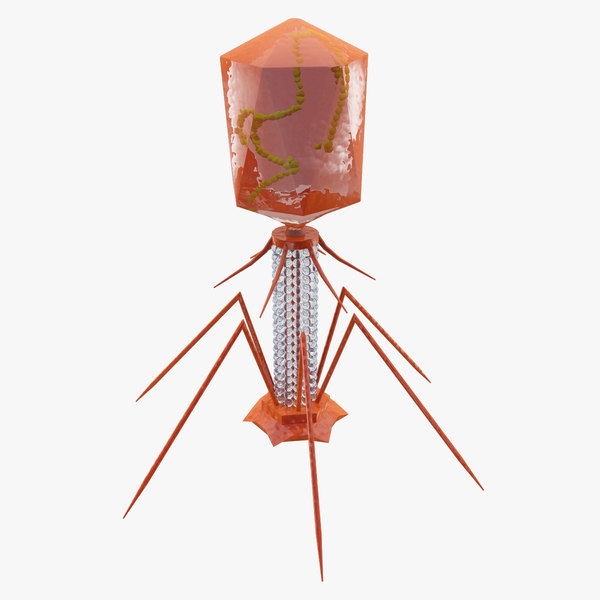
Типичный фаг состоит из «головы» с плотно упакованной генетической программой, состоящей из нуклеиновых кислот (ДНК или РНК), и «хвоста», с помощью которого «впрыскивает» свои гены в клетку бактерии. Зараженная бактерия начинает с помощью собственных внутриклеточных систем и ресурсов синтезировать белки и нуклеиновые кислоты, необходимые для сборки новых вирусных частиц. Зрелые фаги выходят на поиски новой добычи, а «родительская» бактериальная клетка погибает.
Зараженная бактерия начинает с помощью собственных внутриклеточных систем и ресурсов синтезировать белки и нуклеиновые кислоты, необходимые для сборки новых вирусных частиц. Зрелые фаги выходят на поиски новой добычи, а «родительская» бактериальная клетка погибает.
Благодаря последним исследованиям стало понятно, что бактериофаги играют важную для поддержания глобального «микробного баланса» роль в биосфере: каждые двое суток они уничтожают половину мировой популяции бактерий и тем самым препятствуют этим быстро размножающимся организмам покрыть толстым слоем земную поверхность.
Бактериофаги появляются везде, где живут бактерии: на суше и в океанах, в почве и в воде, в растениях и животных. Даже в желудочно-кишечном тракте человека содержится около 1012 бактериофагов – на порядок больше, чем звезд в нашей Галактике! И хотя размер фаговых частиц не превышает 0,0001 мм, биомасса фагов на планете достигает фантастической цифры – 1 млрд тонн. Поэтому эти невидимые глазом, но вездесущие создания называют иногда «темной материей» биосферы.
Преимущества бактериофагов
| |
| |
| |
Применение бактериофагов
Сразу после открытия бактериофагов, препараты на их основе стали использовать для борьбы с инфекционными болезнями человека.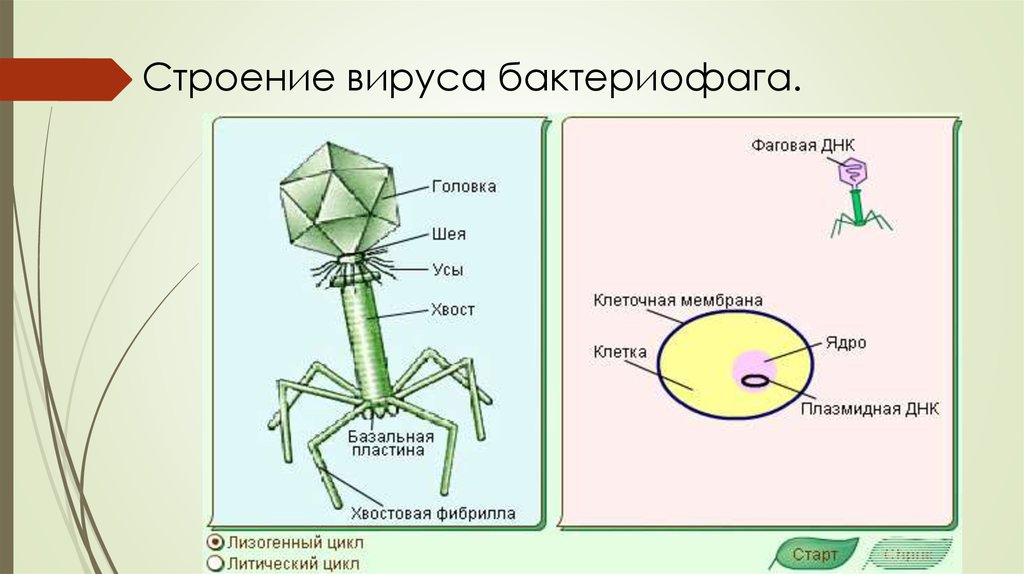 Однако в результате изобретения антибиотиков и недостатка знаний о бактериофагах их лечебный потенциал не был реализован.
Однако в результате изобретения антибиотиков и недостатка знаний о бактериофагах их лечебный потенциал не был реализован.
Спустя полстолетия бактериофагами заинтересовались молекулярные биологи. Они выяснили, что эти простые «наноустройства» с короткими генетическими программами являются удобными объектами для экспериментальных исследований по изучению устройства и работы генома. Дальнейшее изучение фагов и механизмов, с помощью которых бактерии защищаются от врагов, открыло науке один из самых эффективных инструментов редактирования генома – CRISPR-CAS, основанный на системе «бактериального иммунитета».
Фаги нашли применение в разных сферах человеческой деятельности, включая био- и нанотехнологии. Например, как простые системы для наработки белков с заданными свойствами или как основа для создания материалов с заданной архитектурой в каталитической химии.
В качестве «умных» молекулярных устройств их используют для транспорта лекарств в организме и как диагностические сенсоры – например, для выявления патогенных бактерий в продуктах питания.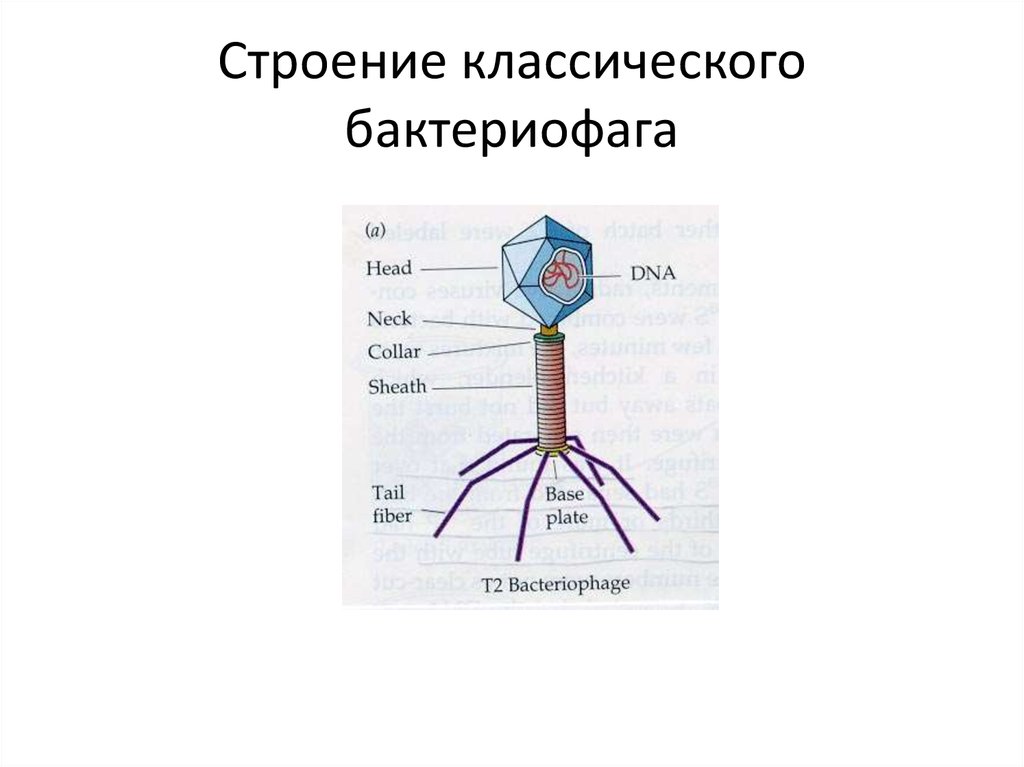 Препараты фагов применяются для дезинфекции в сельском хозяйстве и в пищевой промышленности. Это увеличивает экологическую чистоту продуктов.
Препараты фагов применяются для дезинфекции в сельском хозяйстве и в пищевой промышленности. Это увеличивает экологическую чистоту продуктов.
Но все-таки медицина, как и столетие назад, остается главной областью применения этих врагов бактерий. С ростом лекарственной устойчивости бактерий к химическим антибиотикам возросло значение фаготерапии для профилактики и лечения инфекционных болезней человека.
Бактериофаг | справочник Пестициды.ru
Бактериофаги были открыты микробиологами Федериком Уильямом Туортом (Англия) и Феликсом д’Эреллем (Канада). Ф. Туорт в статье 1915 года описал инфекционную болезнь стафилококков, вызванную инфекционным агентом, способным проходит через бактериальные фильтры и быть перенесенным от одной колонии бактерий к другой. Д’Эрелль (независимо от Туорта) 3 сентября 1917 года сообщил об открытии таких же инфекционных агентов и ввел термин «бактериофаг» – пожирающий бактерии (отгреч. phagos – пожирающий)[3][1].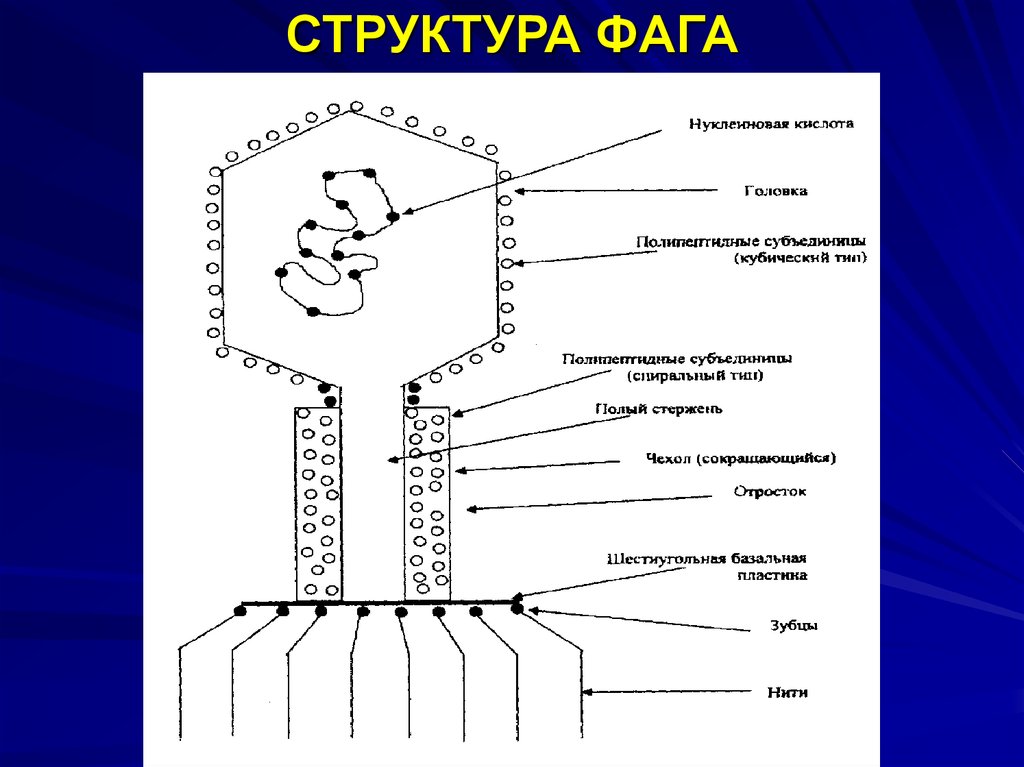
Скрыть
Содержание:
Скрыть
- Состояние вопроса
- Морфология и структура
- Морфологические типы
- Геномы
- Химический состав
- Классификация бактериофагов
- Жизненный цикл
- Реакция на химические и физические факторы
- Распространение
Состояние вопроса
В ходе длительных исследований достоверно установлено, что антибактериальный эффект препаратов бактериофагов основан на внедрении генома фага в клетку бактерии с последующим его размножением внутри ее и лизисом инфицированной клетки. После выхода во внешнюю среду фаги повторно инфицируют и лизируют другие клетки до полного уничтожения патогенных бактерий в очаге воспаления[3][1].
Бактериофаги отличаются высокой специфичностью действия в отношении штаммов-хозяев, отсутствием токсичности, не способностью вызывать аллергические реакции и дисбактериоз. Они могут применяться в качестве самостоятельного лекарственного средства, а так же совместно с антибиотиками и иммуноукрепляющими препаратами[3][1].
Они могут применяться в качестве самостоятельного лекарственного средства, а так же совместно с антибиотиками и иммуноукрепляющими препаратами[3][1].
Несмотря на масштабы накопленного научного материала многие вопросы, касающиеся биологических свойств бактериофагов, требуют дополнительных исследований. В частности не выяснена функция многих продуктов, синтезируемых фагами, нет единой схемы таксономии и морфологической классификации, нет стандартных наборов бактериофагов многих возбудителей, схем и регламента их применения[3][1].
Развитие бактериофага в культуре бактерий рода Xanthomonas
Развитие бактериофага в культуре бактерий рода
Xanthomonas
Морфология и структура
Как и прочие вирусы, во внеклеточной форме бактериофаги являются метаболически инертными частицами. Бактериофаги различаются по химической структуре, типу нуклеиновой кислоты, строению фаговой частицы, морфологии негативных колоний, характеру взаимодействия с микробными клетками[1].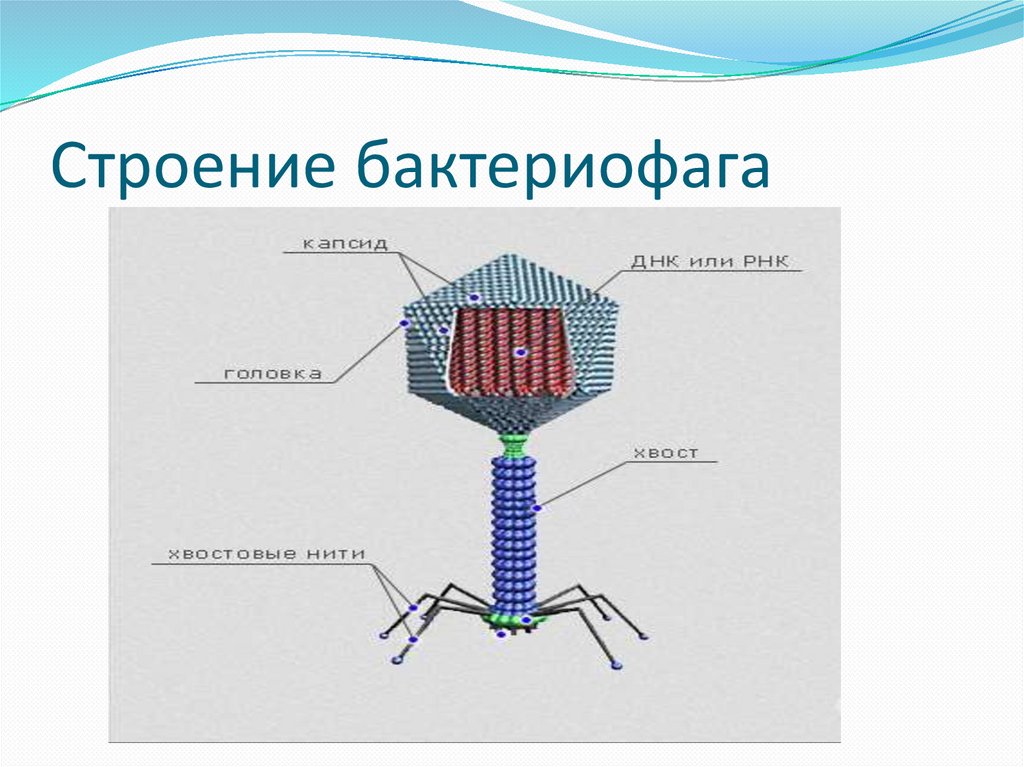
Для обозначения бактериофагов используются буквы латинского и греческого алфавитов. В частности хорошо изучены фаги кишечной палочки: λ, ϕX174, fd, f2, R17, Т2[1].
Большинство из фагов относятся к сложным вирусам и состоят из хорошо сформированной икосаэдрической (кубической) головки и хвоста (отростка) различной степени выраженности, иногда имеющего дополнительные структуры. Все структуры отростка имеют белковую природу. Размер фага колеблется от 20 до 200 нм. Средний диаметр головки – от 60 до 100 нм, длина отростка – 100–200 нм. Длина хвоста, как правило, в 2–4 разабольше диаметра головки[2][1].
Головка состоит из генетического материала (двух цепочечной или одноцепочечной нуклеиновой кислоты (РНК или ДНК) с ферментом транскрипаза в неактивном состоянии) и капсида (белковой оболочки). Нуклеиновая кислота и капсид вместе образуют нуклеокапсид[1].
Хвост представляет собой белковую полую трубку окруженную чехлом, содержащим сократительные белки. Чехол является продолжением белковой оболочки головки. В основании хвоста находится АТФ-аза, регенерирующая энергию для инъекции генетического материала (сокращения чехла отростка бактериофага). У некоторых вирусов чехол сокращается, обнажая часть стержня. На конце хвоста у многих фагов присутствует базальная пластинка с тонкими длинными нитями, способствующими прикреплению его к бактерии. Кроме того в области базальной пластинки присутствует фермент – бактериофаговый лизоцим, способный разрушать муреин клеточной стенки бактерии[2][1].
Чехол является продолжением белковой оболочки головки. В основании хвоста находится АТФ-аза, регенерирующая энергию для инъекции генетического материала (сокращения чехла отростка бактериофага). У некоторых вирусов чехол сокращается, обнажая часть стержня. На конце хвоста у многих фагов присутствует базальная пластинка с тонкими длинными нитями, способствующими прикреплению его к бактерии. Кроме того в области базальной пластинки присутствует фермент – бактериофаговый лизоцим, способный разрушать муреин клеточной стенки бактерии[2][1].
Морфологические типы
Описание структуры и морфологии бактериофагов приведенное выше соответствует наиболее изученным Т-фагам (типовым фагам). Они составляют группу коли-дизентерийных фагов, включающую 7 представителей: 4 нечетных Т1, ТЗ, Т5 и Т7 и 3 четных Т2, Т4, Т6[1].
Классические иди «хвостатые» фаги составляют основную массу бактериофагов, около 96%. Однако установлено, что тонкая структура фагов более разнообразна и сложна, чем структура фитопатогенных вирусов и зоопатогенных вирусов.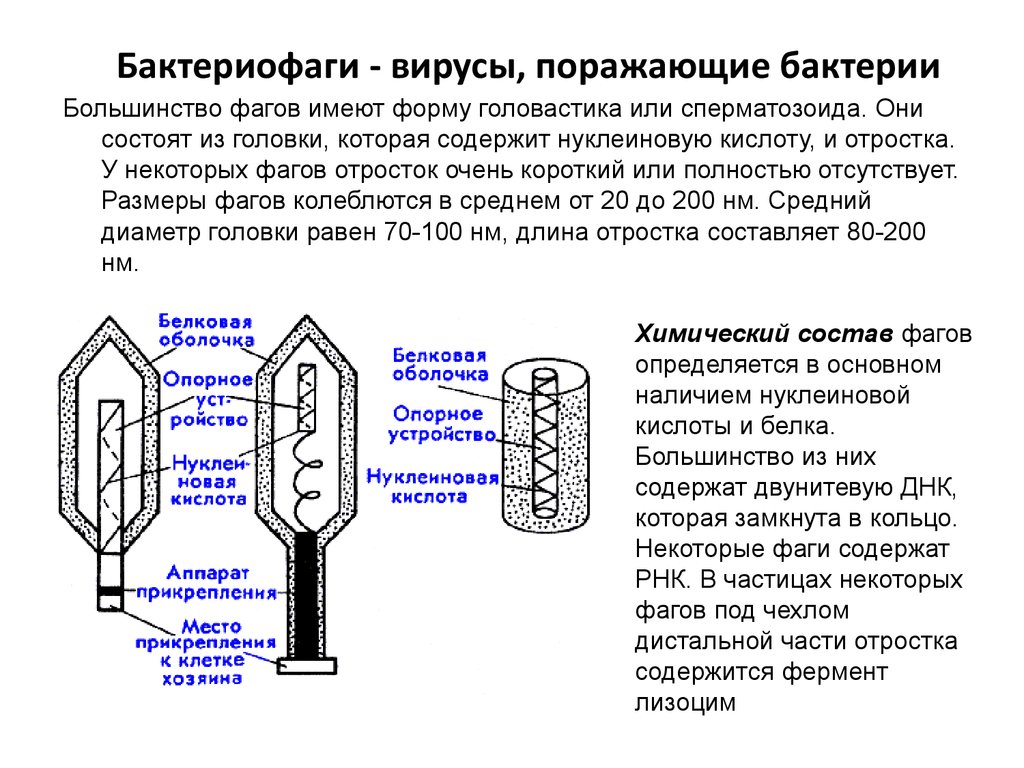 В настоящее время исследовано большое количество фагов с морфологией отличной от представленной выше[1].
В настоящее время исследовано большое количество фагов с морфологией отличной от представленной выше[1].
По форме вирусных частиц фаги делятся на шесть основных морфологических типов:
- Палочковидные или нитевидные[1].
- Головка без отростка[1].
- Головка и несколько небольших выступов (отростков)[1].
- Головка и один небольшой короткий отросток[1].
- Головка и длинный отросток, чехол которого не сокращается[1].
- Головка и длинный отросток, чехол которого сокращается[1].
Строение бактериофага (на примере Т-четного фага)
Строение бактериофага (на примере Т-четного фага)
1. Головка; 2. Хвост; 3. Нуклеиновая кислота; 4. Капсид; 5. «Воротничок»; 6. Белковый сократительный чехол вокруг полого стержня хвоста; 7. Фибриллы ( нити) хвостового отростка; 8. Шипы; 9. Базальная пластинка[1].
Шипы; 9. Базальная пластинка[1].
Геномы
Геномы бактериофагов характеризуются большим разнообразием. Объемы геномов варьируют от 20 до 700 kb. Длина большинства фаговых геномов составляет около 50 kb[2][1].
Длина самого крупного бактериофага (G) равна 670 kb. Это самый крупный из всех вирусных геномов. Его размер в четыре раза превышает самый маленький бактериальный геном[2][1].
Встречаются фаги, геном которых сегментирован, но в основном геномы представлены целыми линейными или кольцевыми молекулами нуклеиновых кислот. Большинство изученных бактериофагов имеют двухцепочечную ДНК. Однако обнаружены группы с одноцепочечной ДНК, двухцепочечной и одноцепочечной РНК[2][1].
Химический состав
Бактериофаги состоят из нуклеиновой кислоты и белка. Общее количество белка – 50–60%, нуклеиновых кислот – 40–50 %. В составе некоторых фагов имеются ДНК с азотистыми основаниями. Вместо цитозина может присутствовать5-оксиметилцитозин.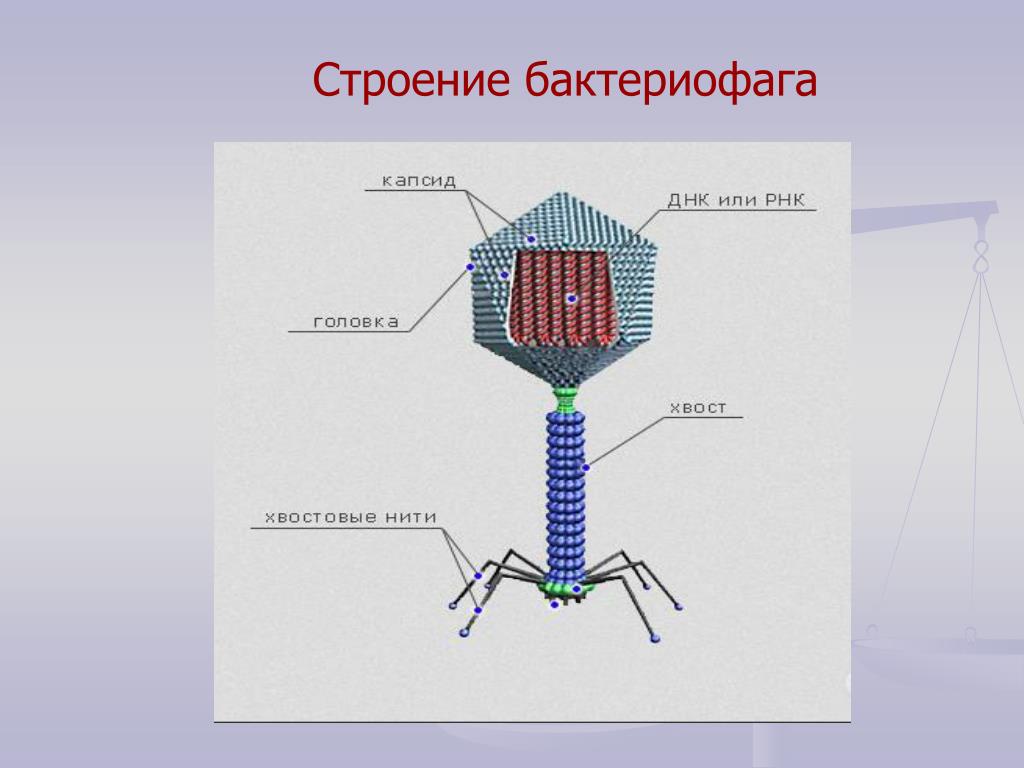 Внутри головки фага Т2 обнаружен белок с полиамидами в составе. Он способствует суперспирализации ДНК и способствует размещению достаточно длинной ДНК в головке небольшого размера. В частицах многих фагов под чехлом присутствует фермент лизоцим[2][1].
Внутри головки фага Т2 обнаружен белок с полиамидами в составе. Он способствует суперспирализации ДНК и способствует размещению достаточно длинной ДНК в головке небольшого размера. В частицах многих фагов под чехлом присутствует фермент лизоцим[2][1].
Электронная микроскопия бактериофагов
Электронная микроскопия бактериофагов
Морфологические типы.
Увеличение X 400 000–600 000
1. Палочковидные или нитевидные[1]; 2. Головка без отростка[1]; 3. Головка и несколько небольших выступов (отростков)[1]; 4. Головка и один небольшой короткий отросток[1]; 5. Головка и длинный отросток, чехол которого не сокращается[1]; 6. Головка и длинный отросток, чехол которого сокращается[1].
Классификация бактериофагов
Современная классификация бактериофагов основана на строении фаговой частицы и характеристике нуклеиновой кислоты. Прежде всего фаги, как и все остальные вирусы, делятся на РНК-содержащие и ДНК-содержащие. В соответствии с Международной классификацией и номенклатурой вирусов в настоящее время из наиболее исследованных бактериофагов выделяют 13 семейств, в том числе: Myoviridae (частица без оболочки с сократительным хвостом, двухцепочечная ДНК линейная), Rudiviridae (частица без оболочки, палочкообразная, двухцепочечная ДНК линейная), Bicaudaviridae (частица без оболочки, лимонообразна, двухцепочечная ДНК кольцевая)[1].
Прежде всего фаги, как и все остальные вирусы, делятся на РНК-содержащие и ДНК-содержащие. В соответствии с Международной классификацией и номенклатурой вирусов в настоящее время из наиболее исследованных бактериофагов выделяют 13 семейств, в том числе: Myoviridae (частица без оболочки с сократительным хвостом, двухцепочечная ДНК линейная), Rudiviridae (частица без оболочки, палочкообразная, двухцепочечная ДНК линейная), Bicaudaviridae (частица без оболочки, лимонообразна, двухцепочечная ДНК кольцевая)[1].
Отдельные семейства объединены в два порядка. Для большинства порядки не определены[1].
Жизненный цикл
[2]Как указывалось выше, бактериофаги характеризуются специфичностью к определенным видам бактерий. Однако, взаимоотношение между фагами и бактериями сложны и не всегда завершаются лизисом чувствительной к нему клетки и размножением фага[1].
В зависимости от специфичности различают:
- моновалентные бактериофаги – лизируют культуры бактерий определенного вида;
- типовые бактериофаги – лизируют отдельные штаммы внутри вида;
- поливалентные бактериофаги – вызывают лизис группы родственных видов микробов.

Инфекцию клетки, заканчивающуюся ее гибелью и размножением в ней фага, называют продуктивной[1].
Главная особенность бактериофагов: размножение происходит только в живых клетках, находящихся в состоянии развития и роста. В мертвых клетках и в продуктах клеточного обмена размножение фагов не происходит[1].
По характеру взаимодействия с бактериальными клетками различают две группы:
- Вирулентные бактериофаги – всегда лизируют зараженные бактерии и имеют только один путь развития – литический цикл[1][2].
- Умеренные бактериофаги – ведут себя двояко: после проникновения в клетку нуклеиновая кислота вируса может быть вовлечена в литический цикл или вступает с клеткой-хозяином в своеобразные симбиотические отношения. Она встраивается в хромосому бактерии и превращается в профаг, передаваясь всему потомству клетки (лизогенный путь). При этом бактерии, содержащие профаг, называют лизогенными бактеиями[1][2].

Умеренные и вирулентные бактериофаги на начальных этапах взаимодействия с бактериальной клеткой имеют одинаковый путь развития. Период с момента инфицирования клетки до ее лизиса называется латентным периодом. Первая половина латентного периода, когда фаг не удается обнаружить в клетке, называют скрытым периодом. Каждая система бактериофаг – бактерия характеризуются конкретными величинами латентного и скрытого периода. Продолжительность этих периодов зависит от температуры, состава среды и многих других факторов. Продолжительность латентного периода варьирует от 15 минут до 5 часов и более. При низкой температуре она увеличивается[1].
Реакция на химические и физические факторы
Бактериофаги проявляют большую устойчивость к действию физических и химических факторов окружающей среды, чем многие зоопатогенные и фитопатогенные вирусы. Большинство фагов активируются при температуре более +65°C–+70°C. Они хорошо переносят замораживание и длительно сохраняются при низких температурах и высушивании. 0,5% раствор сулема (хлористой ртути), 1,0% раствор фенола не оказывают на фаги инактивирующего действия. 10% раствор формалина инактивирует фаговые частицы в течение нескольких минут. Бактериофаги резистентны к воздействию ионизирующей радиации и ультрафиолетового излучения[3][1].
0,5% раствор сулема (хлористой ртути), 1,0% раствор фенола не оказывают на фаги инактивирующего действия. 10% раствор формалина инактивирует фаговые частицы в течение нескольких минут. Бактериофаги резистентны к воздействию ионизирующей радиации и ультрафиолетового излучения[3][1].
Распространение
Бактериофаги – наиболее многочисленная и широко распространенная в биосфере и скорее всего наиболее эволюционно древняя группа вирусов. Приблизительный размер популяции фагов насчитывает более 1030 фаговых частиц. Считается, что на одну бактерию приходится 10 фаговых частиц[1].
Бактериофаги обнаруживаются в воде, почве, сточных водах, организме человека и животных, в культурах бактерий. Фаги обнаруживаются в тех местах, где распространены чувствительные к ним бактерии[1].
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Иконникова Н. В. Бактериофаги – вирусы бактерий: учеб. пособие, Минск: ИВЦ Минфина, 2017. – 41 c
В. Бактериофаги – вирусы бактерий: учеб. пособие, Минск: ИВЦ Минфина, 2017. – 41 c
2.
Лысак В.В. Микробиология : учеб. пособие / В. В. Лысак. – Минск: БГУ, 2007 – 430 с
Источники из сети интернет:
3.
Колешко О.И., Завезенова Т.В. Микробиология с основами вирусологии,Иркутск: Изд-во Иркутского университета, 1999. – 452 с.
Изображения (переработаны):
4.
Xanthomonas leaf blight of onion (Xanthomonas axonopodis pv. allii) (Kadota et al. 2000) by Howard F. Schwartz & Jillian M. Lang
СвернутьСписок всех источников
Фаговый вирус | Спросите у биолога
показать/скрыть слова, чтобы узнать
СПИД: болезнь, из-за которой иммунная система работает не так, как обычно……подробнее
Антибиотик: вещество, ослабляющее или уничтожает бактерии.
Бактерии: одноклеточных микроскопических организмов, которые растут и размножаются повсюду на Земле.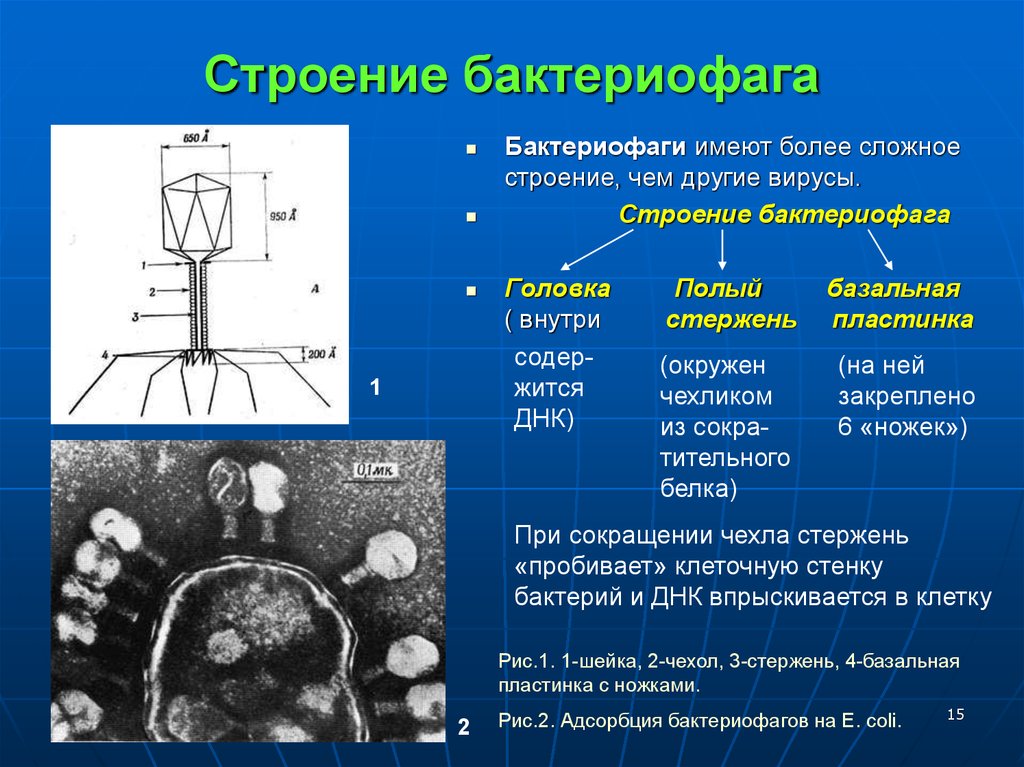 Они могут быть как полезными, так и вредными для животных… подробнее
Они могут быть как полезными, так и вредными для животных… подробнее
Бактериофаг: вирус, поражающий бактериальные клетки… подробнее
MRSA: сокращение от Метициллин-резистентный Staphylococcus aureus . Бактерия, устойчивая к определенным видам антибиотиков и вызывающая трудно поддающиеся лечению инфекции… подробнее
Вирус: сверхмаленький микроб, который можно увидеть только под микроскопом. Вирусам нужен хозяин, чтобы размножаться… подробнее
вернуться к комиксу
Фаговый вирус
На нашей планете существует множество видов вирусов. Некоторые вирусы поражают человека. Некоторые вирусные инфекции незначительны и раздражают, например, обычная простуда. Другие тяжелые и смертельные, как СПИД.
Знаете ли вы, что существуют вирусы, которые заражают только бактерии? Они полезны и важны. Ученые называют их бактериофагами, что означает «пожиратели бактерий».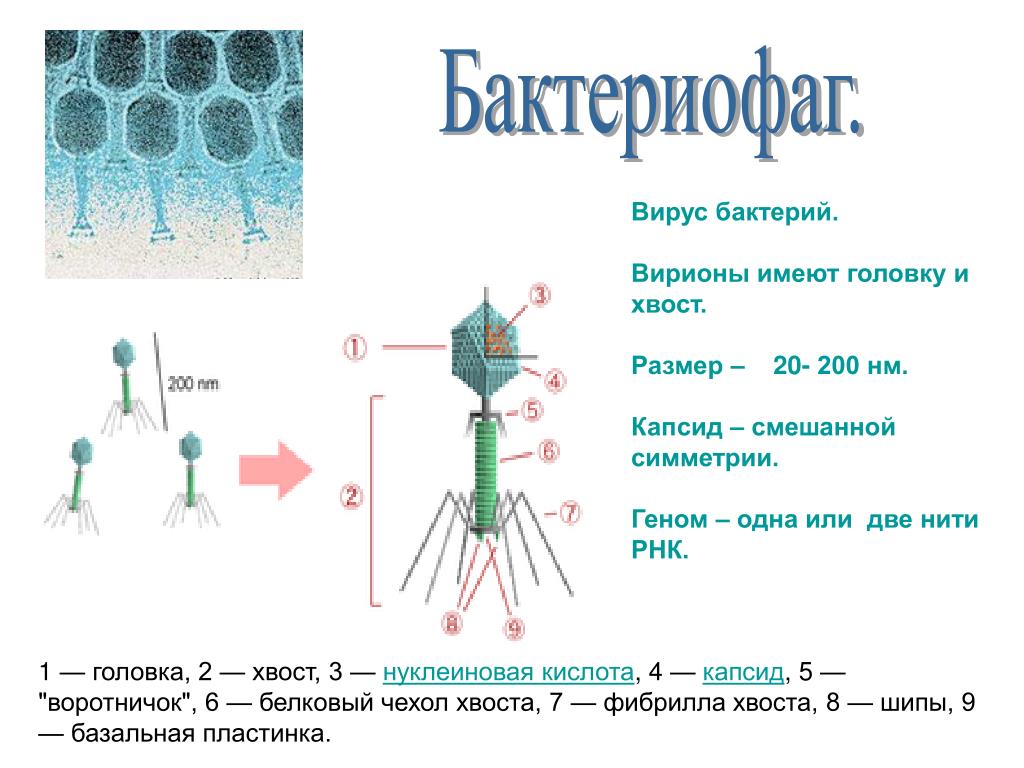 Для краткости мы можем назвать их фагами.
Для краткости мы можем назвать их фагами.
Фаги способны создавать копии самих себя. Для этого им нужна клетка-хозяин. Фаг прикрепляется к рецептору на поверхности клеточной стенки бактерии. Это почти как ключ, ищущий замок, к которому он подходит.
После прочного прикрепления фаг вводит свой генетический материал в клетку-хозяина. Фаги похожи на пиратов. Они берут на себя внутренние механизмы, которые бактерии используют для размножения. После заражения фагом бактерия перепрограммируется на создание копий этого фага.
Некоторые типы фагов заражают только определенные виды бактерий, поэтому они названы в честь типа бактерий, которые они заражают. Например, фаги, инфицирующие бактерий E. coli , называются колифагами.
Ученые заняты изучением и поиском способов использования фагов для борьбы с болезнями. Они используют их для заражения и уничтожения MRSA и других типов бактерий, которые стали устойчивыми к антибиотикам.
вернуться к комиксу
Дополнительные изображения из Викимедиа через C.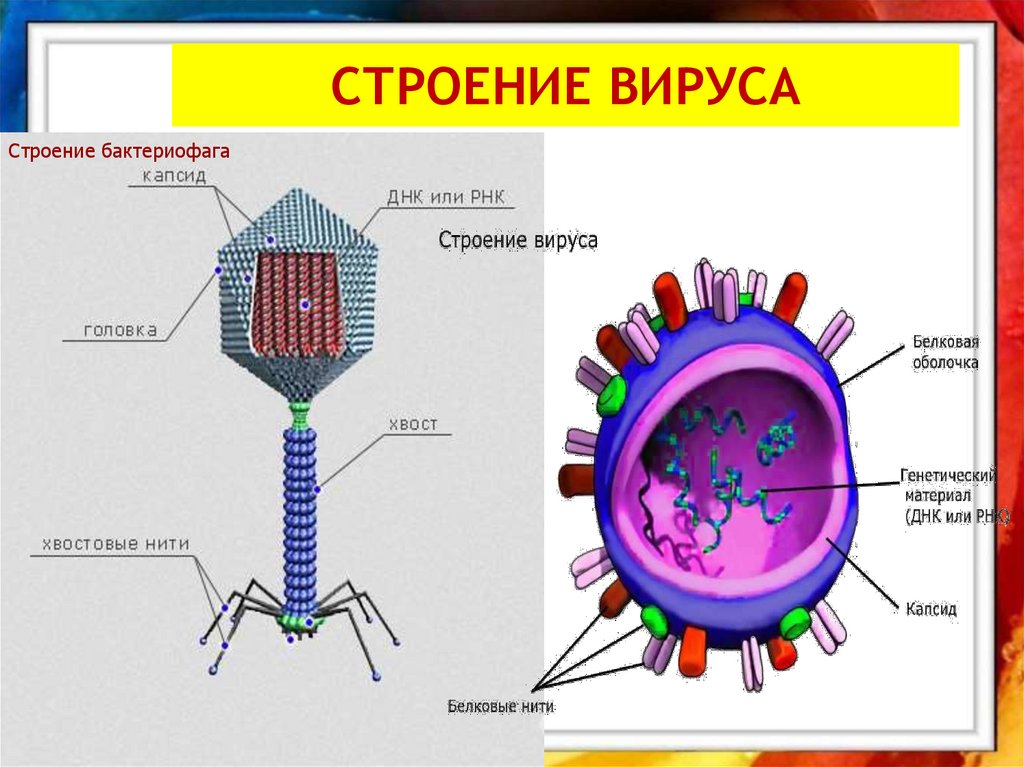 Goldsmith (вирус ВИЧ) и Webridge (бактериальная клетка).
Goldsmith (вирус ВИЧ) и Webridge (бактериальная клетка).
Подробнее о: Микробы
Просмотреть ссылку
Библиографические сведения:
- Статья: Фаговый вирус
- Автор(ы): д.б.н.
- Издатель: Школа естественных наук Университета штата Аризона Ask A Biologist
- Название сайта: ASU — Спросите у биолога
- Дата публикации: 9 июля 2014 г.
- Дата обращения: 10 ноября 2022 г.
- Ссылка: https://askabiologist.asu.edu/phage-virus
APA Style
Доктор биологии. (2014, 09 июля). Фаговый вирус. АГУ — Спросите у биолога. Получено 10 ноября 2022 г. с сайта https://askabiologist.asu.edu/phage-virus
Американской психологической ассоциации. Для получения дополнительной информации см. http://owl.english.purdue.edu/owl/resource/560/10/
Чикагское руководство по стилю
Доктор биологии. «Фаговый вирус». АГУ — Спросите у биолога. 09 июля 2014 г. https://askabiologist.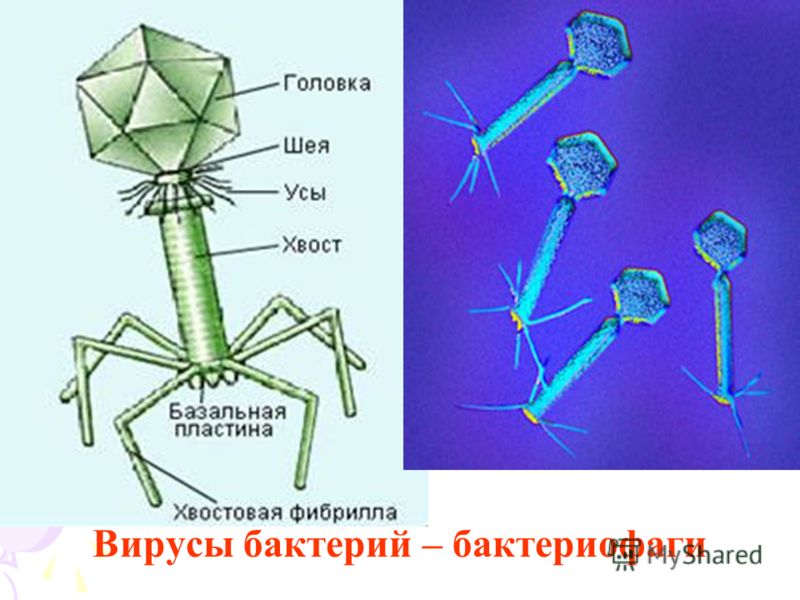 asu.edu/phage-virus
asu.edu/phage-virus
Для получения дополнительной информации см. http://owl.english.purdue.edu/owl/resource/717/04/
MLA 2017 Стиль
Доктор биологии. «Фаговый вирус». АГУ — Спросите у биолога. 09 июля 2014 г. ASU — Спросите у биолога, Интернет. 10 ноября 2022 г. https://askabiologist.asu.edu/phage-virus
Ассоциация современного языка, 7-е изд. Для получения дополнительной информации см. http://owl.english.purdue.edu/owl/resource/747/08/
На изображении выше вирус ВИЧ атакует клетку, чтобы клонировать себя и распространяться.
Примите участие в программе
Спросите у биолога
Выступив добровольно или просто отправив нам отзыв на сайте. Ученые, учителя, писатели, иллюстраторы и переводчики важны для программы. Если вы заинтересованы в помощи с веб-сайтом, у нас есть страница волонтеров, чтобы начать процесс.
Пожертвовать
Поделиться этой страницей:
Поделиться в Google Classroom
Вирус, выловленный из озера, возможно, спас жизнь человеку
Пруд Додж, расположенный на окраине Ист-Лайма, штат Коннектикут, — обычное озеро Новой Англии. Здесь обитают такие рыбы, как синежаберные и алевины, а также более мелкие организмы, такие как водяные блохи, водоросли и бактерии. В Dodge Pond тоже есть вирусы, большинство из которых заражают его бактерии. И один из вирусов Dodge Pond, известный как OMKO1, теперь заслужил место в истории медицины.
Здесь обитают такие рыбы, как синежаберные и алевины, а также более мелкие организмы, такие как водяные блохи, водоросли и бактерии. В Dodge Pond тоже есть вирусы, большинство из которых заражают его бактерии. И один из вирусов Dodge Pond, известный как OMKO1, теперь заслужил место в истории медицины.
Ранее в этом году в рамках экспериментального лечения врачи поместили 100 миллионов вирусов OMKO1 в грудь мужчины, чтобы спасти ему жизнь.
Недавно я встретил этого человека. Доктор Али Ходадуст — офтальмолог, работающий в Нью-Хейвене, в 40 милях к западу от пруда Додж. Когда я прибыл в приемную Ходадуста, он просматривал какие-то формы со своим секретарем. Его копна волос была почти такой же белой, как халат его доктора. Мы направились в его кабинет, Ходадуст шел медленно и настороженно. «Я могу опрокинуться в любой момент», — признался он.
реклама
Я бы тоже, если бы мне было 80 лет и последние четыре года я провел, борясь с разрушительной инфекцией.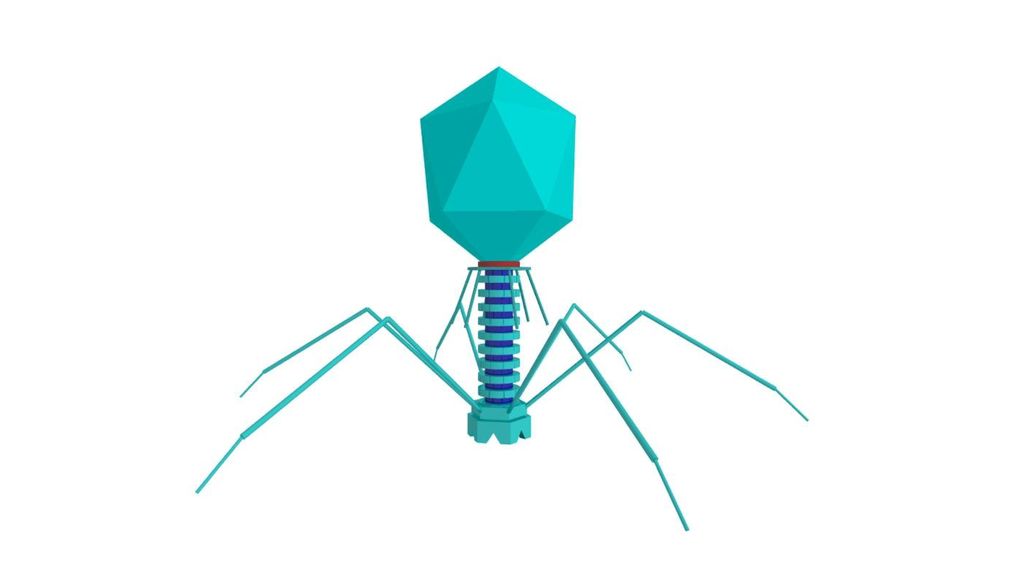 Судя по всему, Ходадуст был в добром здравии — определенно достаточно хорошем, чтобы болтать в течение двух часов об OMKO1, о его болезни, о его долгой карьере в области пересадки роговицы и обучении новых врачей.
Судя по всему, Ходадуст был в добром здравии — определенно достаточно хорошем, чтобы болтать в течение двух часов об OMKO1, о его болезни, о его долгой карьере в области пересадки роговицы и обучении новых врачей.
Во время нашего разговора он иногда осторожно вставал со стула, чтобы вести меня по коридорам, чтобы показать мне выцветшие фотографии в рамках, отражающие его работу в Университете Джонса Хопкинса и Йельском университете, а также в Ширазе, иранском городе, где он родился и куда он вернулся, чтобы построить глазную больницу.
реклама
В 2012 году все это остановилось. «В пятницу я работал в операционной, а в субботу ходил на пробежку, — сказал мне Ходадуст. «В конце пробежки я почувствовал очень легкую одышку. У двух моих братьев были сердечные приступы, поэтому я сказал, что проверю».
Ходадусту сделали коронарное шунтирование; его кардиолог залатал часть его аорты куском пластиковой сетки. Вся процедура прошла без сучка и задоринки, после чего Ходадуст отправился домой восстанавливаться.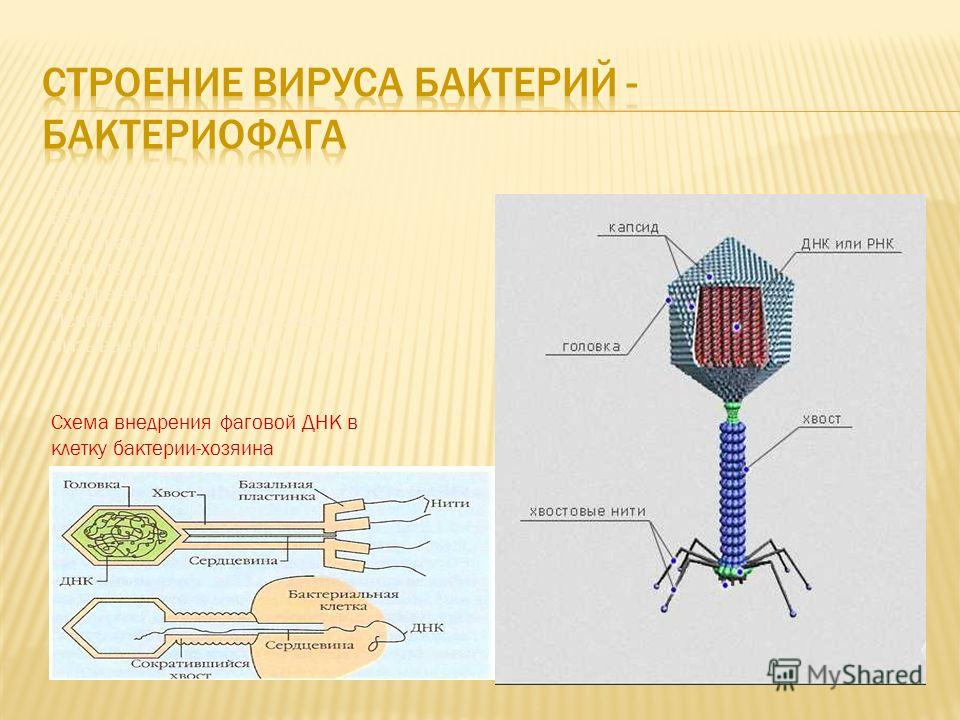 Но дело быстро пошло наперекосяк. В течение 48 часов у него поднялась сильная лихорадка, и его пришлось срочно доставить обратно в больницу. Когда хирурги вскрыли его грудную клетку, они обнаружили, что инфекция разрушила его грудину, а грудная полость была заполнена кровью и гноем.
Но дело быстро пошло наперекосяк. В течение 48 часов у него поднялась сильная лихорадка, и его пришлось срочно доставить обратно в больницу. Когда хирурги вскрыли его грудную клетку, они обнаружили, что инфекция разрушила его грудину, а грудная полость была заполнена кровью и гноем.
Когда доктор Дипак Нараян, хирург Йельского госпиталя Нью-Хейвен, осмотрел грудную клетку Ходадуста, он точно понял, что произошло. На его аорте было мшисто-зеленое пятно. Это должна была быть инфекция, вызванная распространенным видом бактерий под названием Pseudomonas aeruginosa. «Бросишь один взгляд и узнаешь, что это такое», — сказал Нараян.
Прежде чем Нараян и другие врачи смогли даже подумать о лечении инфекции, они должны были спасти жизнь Ходадуста. «Он был более чем болен — его сердце буквально разорвалось о стол», — сказал Нараян. Он и его коллеги зашили сердце Ходадуста кусочком легочной ткани, а затем дренировали и очистили его грудную полость. Когда они наконец закончили, они защитили его сердце жировой оболочкой от его живота, а затем закрыли брешь, где была его грудина, мышцами и кожей. Они сомневались, что он проживет долго.
Они сомневались, что он проживет долго.
Когда Ходадуст вспоминает то время, он вспоминает, что находился в абсолютной темноте. «Крошечная струна тянулась от меня в бесконечность», — сказал он.
Он чувствовал, что ему дали выбор. «Ты хочешь вернуться или нет? Быть или не быть? Я представил своих детей, я представил свою жену. Слезы на глазах». Ходадуст решил вернуться. — Как я могу помочь?
«Это была не жизнь»
Ходадуст пережил операцию. Но теперь Нараяну и другим врачам предстояло бороться с инфекцией, которая едва не убила их пациента. Pseudomonas aeruginosa безвредна для здоровых людей, но может быть смертельно опасна для людей с ослабленной иммунной системой. Люди с муковисцидозом могут заразиться Pseudomonas aeruginosa в легких, что может привести к смертельной пневмонии. Ходадуст, возможно, заразился крошечным пятном бактерий, которое выросло на сетке, используемой для фиксации его аорты.
Нараян и его коллеги прописали тяжелый курс антибиотиков, чтобы избавиться от инфекции.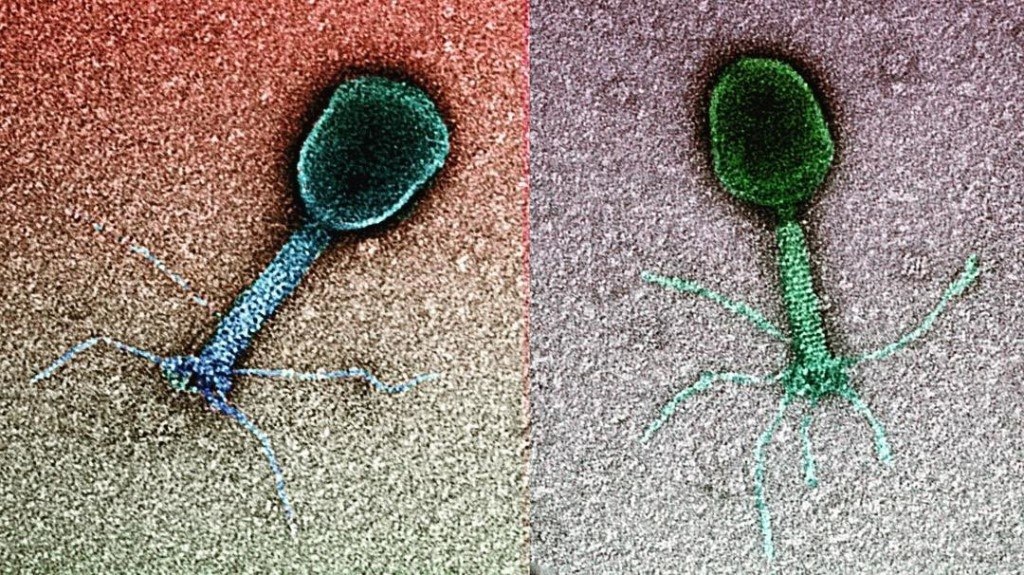 Но бактерии оказались устойчивыми и не могли быть уничтожены. Тем временем тело Ходадуста усугубило ситуацию. Он отреагировал на инфекцию, создав туннельную полость, называемую фистулой, которая образовала отверстие на поверхности его груди. Его Pseudomonas колонизировала и фистулу.
Но бактерии оказались устойчивыми и не могли быть уничтожены. Тем временем тело Ходадуста усугубило ситуацию. Он отреагировал на инфекцию, создав туннельную полость, называемую фистулой, которая образовала отверстие на поверхности его груди. Его Pseudomonas колонизировала и фистулу.
После трех месяцев лечения антибиотиками в больнице Ходадуста отпустили домой. У него все еще была серьезная инфекция, из-за которой он должен был держать внутривенный порт в груди. Три раза в день ему приходилось принимать огромные дозы антибиотиков, чтобы держать бактерии в страхе. Тем не менее, микробам все равно время от времени удавалось подавлять лекарства, вызывая сепсис и отправляя его обратно в больницу для еще более агрессивного лечения. Нараян и его коллеги исключили дальнейшую операцию. Если бы они попытались вынуть инфицированную пластиковую сетку или закрыть свищ, они могли бы распространить инфекцию еще больше и убить его.
«Они не смели меня тронуть», — сказал Ходадуст. — Я их не виню.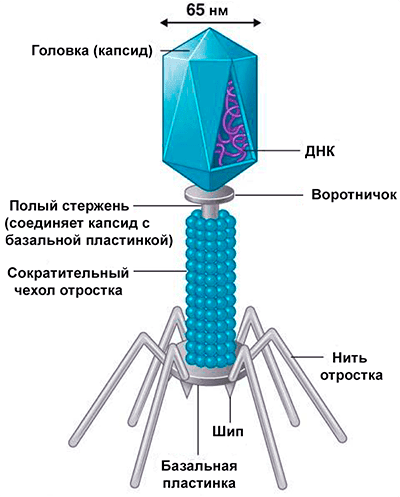
Ходадуст попал в жалкую медицинскую лимбо. «Жизнь не имела смысла с трубкой, подключенной к моей груди, и каждые восемь часов мне приходилось получать 8 граммов антибиотиков», — сказал он. «Это была не жизнь».
И тут совершенно неожиданно к Нараяну пришел человек с идеей. Его посетителем был молодой ученый по имени Бенджамин Чан. Чан задумался, не хочет ли Нараян испытать экспериментальное оружие против инфекций. Возможно, вирусы могут убивать бактерии, которых не могут антибиотики.
Чан вряд ли был первым ученым, которому пришла в голову эта идея. Вирусы, заражающие бактерии, известные как бактериофаги, были открыты столетие назад. Они зарабатывают на жизнь тем, что проникают внутрь своих микробов-хозяев и изменяют их биохимию, чтобы создать множество новых копий самих себя. Затем многие виды бактериофагов вырываются из своего хозяина, убивая его в процессе. Один из первооткрывателей бактериофагов, канадский врач Феликс д’Эрелль, сразу понял, что они могут лечить бактериальные инфекции.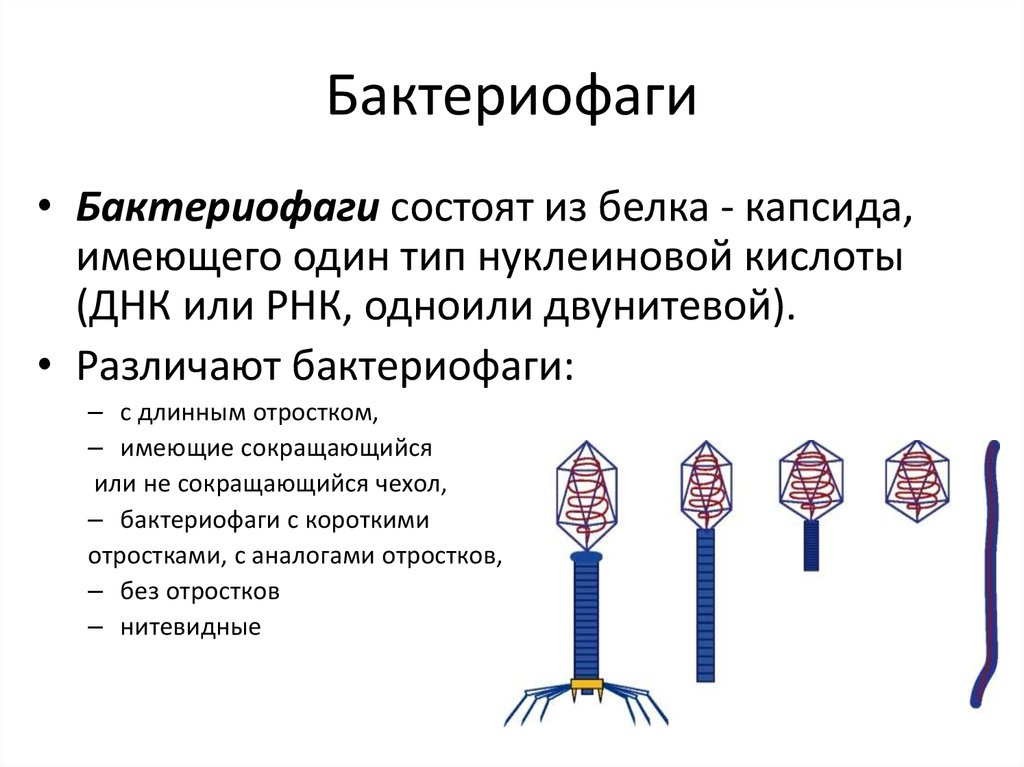
Лечение Д’Эреля стало известно как фаговая терапия. К 1920-м годам это было распространено в Европе и Северной Америке. Вы можете купить порошок с добавлением фага для лечения кожных инфекций без рецепта. Д’Эрель привез свои бактериофаги в страны, включая Египет и Индию, для борьбы со вспышками холеры и других болезней.
Однако с появлением антибиотиков фаговая терапия практически исчезла из большинства стран. Врачи стали больше доверять антибиотикам, потому что это были простые химические вещества, которые можно было тщательно протестировать. Бактериофаги, напротив, были загадочными, почти живыми существами, которые ученые до сих пор едва понимали. И, несмотря на очевидный успех фаготерапии, ее сторонники не сделали достаточно, чтобы доказать, что она надежно безопасна и эффективна.
Фаготерапия оставалась популярной в Советском Союзе. Во время Великой Отечественной войны солдатам Сталина лечили раны вирусами. После падения коммунизма некоторые бывшие советские исследователи принесли фаговую терапию на Запад, где на этот раз она вызвала больший интерес. Десятилетия назначений антибиотиков — наряду с безудержным использованием лекарств в животноводстве — привели к эволюции резистентных бактерий. Фаговая терапия может помочь там, где антибиотики не помогли.
Десятилетия назначений антибиотиков — наряду с безудержным использованием лекарств в животноводстве — привели к эволюции резистентных бактерий. Фаговая терапия может помочь там, где антибиотики не помогли.
Тем не менее, с тех пор исследования фаговой терапии продвинулись лишь в небольшом масштабе. Скептики подняли много вопросов о том, сможет ли он когда-нибудь подействовать на большое количество пациентов. И они обеспокоены тем, что при определенных обстоятельствах у бактерий может развиться устойчивость к бактериофагам, как и к антибиотикам. Если бы врачи вводили пациентам бактериофаги, они могли бы способствовать развитию резистентности.
«Вы воссоздаете первоначальную проблему», — сказал Пол Тернер, вирусолог из Йельского университета.
Тернер занимается изучением бактериофагов более двух десятилетий, а в последние годы он изучает, как применить свои знания в фаговой терапии. В 2013 году он нанял Чана в качестве младшего научного сотрудника, чтобы возглавить проект. Первым делом Чана была охота за новыми бактериофагами, которые они могли бы использовать для борьбы с инфекциями новыми способами.
Первым делом Чана была охота за новыми бактериофагами, которые они могли бы использовать для борьбы с инфекциями новыми способами.
Гиацинт Эмпинадо/STAT
Смелый план
Найти бактериофаги было несложно. Мировой запас этих вирусов невообразимо огромен — по одной оценке, на Земле насчитывается 10 000 000 000 000 000 000 000 000 000 000 бактериофагов.
Однако
Чан не хотел искать какой-то бактериофаг. Он хотел найти те, которые заражают виды, вызывающие оппортунистические инфекции, такие как Pseudomonas aeruginosa. И ему нужны были бактериофаги, которые могли бы работать с антибиотиками, а не заменять их.
Его логика была проста. Pseudomonas aeruginosa, например, устойчива к антибиотикам, создавая мощные насосы, которые быстро вымывают лекарства, прежде чем они смогут причинить вред. Чан и Тернер задались вопросом, существует ли бактериофаг, который заражает бактерии, приземляясь на эти насосы и вводя внутрь свои гены.
Если бы такой вирус существовал, он мог бы убить большое количество Pseudomonas aeruginosa при инфекции.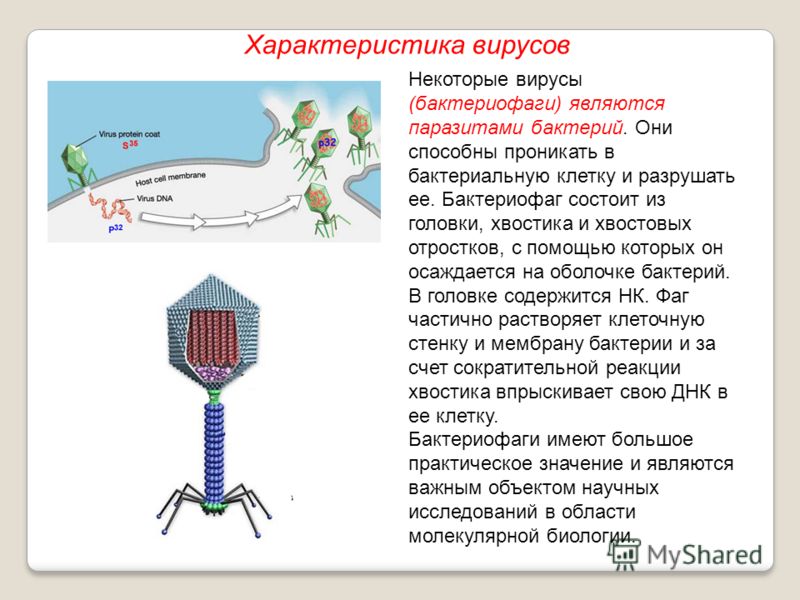 Единственный способ выжить для бактерий — это мутация, которая лишает их возможности создавать помпы. Бактериофаг не мог проникнуть в них. Но в процессе они сделают себя уязвимыми для антибиотиков. Возможно, после фаговой терапии антибиотиками удастся полностью уничтожить инфекцию.
Единственный способ выжить для бактерий — это мутация, которая лишает их возможности создавать помпы. Бактериофаг не мог проникнуть в них. Но в процессе они сделают себя уязвимыми для антибиотиков. Возможно, после фаговой терапии антибиотиками удастся полностью уничтожить инфекцию.
Чан начал поиск своего гипотетического вируса. Он исследовал образцы почвы, сточных вод, компоста и воды. Вытащив бактериофаги из образцов, он обрушил их на Pseudomonas aeruginosa, чтобы посмотреть, не заразит ли их кто-нибудь из них. Чтобы увидеть, использовали ли они насосы антибиотиков бактерий, он наблюдал, могут ли они заразить микробы, которые он сконструировал без насосов.
Он продолжал находить новые бактериофаги, но ни один из них не осуществил его мечту.
Затем Чен взял образец воды, который другой ученый в лаборатории получил несколькими месяцами ранее в пруду Додж. Он также нашел в воде несколько бактериофагов. «Просто посреди ночи я попробовал один из них, и он сработал», — говорит Чан.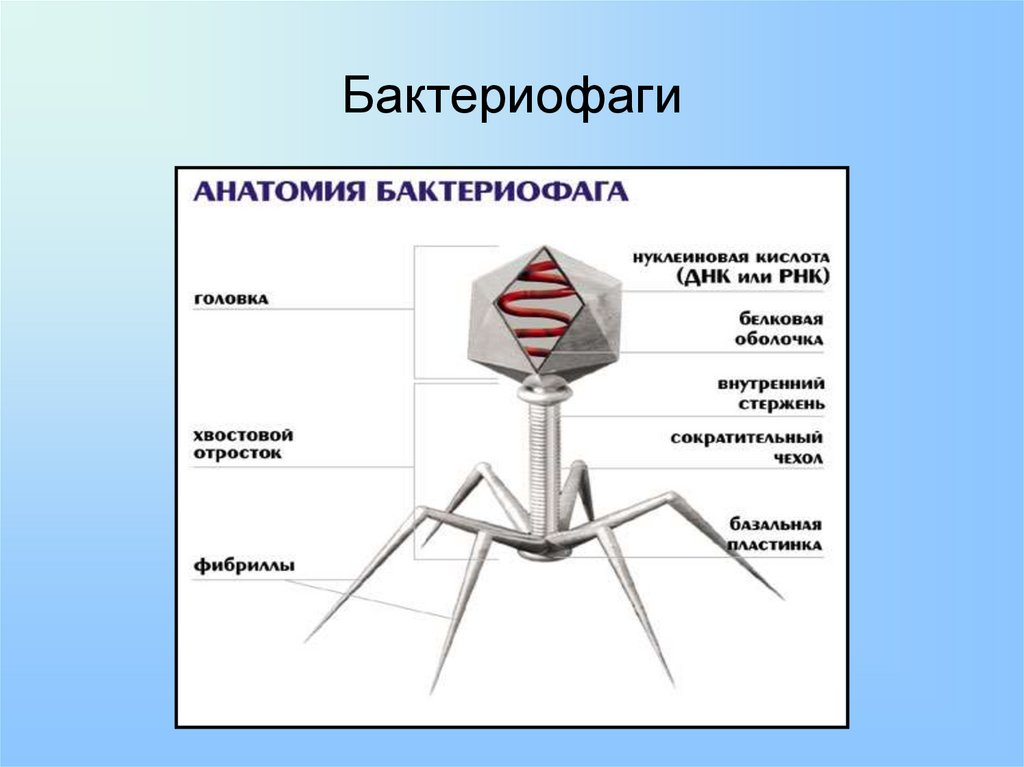 Он атаковал Pseudomonas через свою помпу, молекулу, называемую порином внешней мембраны М. Чан назвал вирус своей мечты OMKO1 (сокращение от фага № 1, зависимого от нокаута наружной мембраны порина М).
Он атаковал Pseudomonas через свою помпу, молекулу, называемую порином внешней мембраны М. Чан назвал вирус своей мечты OMKO1 (сокращение от фага № 1, зависимого от нокаута наружной мембраны порина М).
Чан и Тернер начали изучать OMKO1 и его бактериальных хозяев в чашках Петри. Но они хотели знать, может ли это на самом деле помочь людям. Фаготерапия не одобрена для регулярного использования Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов. Но Чан и Тернер задались вопросом, может ли агентство предоставить исключение «сострадательного использования» для пациентов, которых нельзя вылечить антибиотиками.
— Знаешь, — сказал Нараян Чану, — у меня есть для тебя пациент.
Нараян передал Чану Pseudomonas aeruginosa, выделенную из инфекции Ходадуста. Чан применил OMKO1 к бактериям, и, как он и надеялся, он уничтожил большинство микробов. Когда он осмотрел выживших, он обнаружил, что у них были измененные насосы, в которые бактериофаги не могли вторгнуться.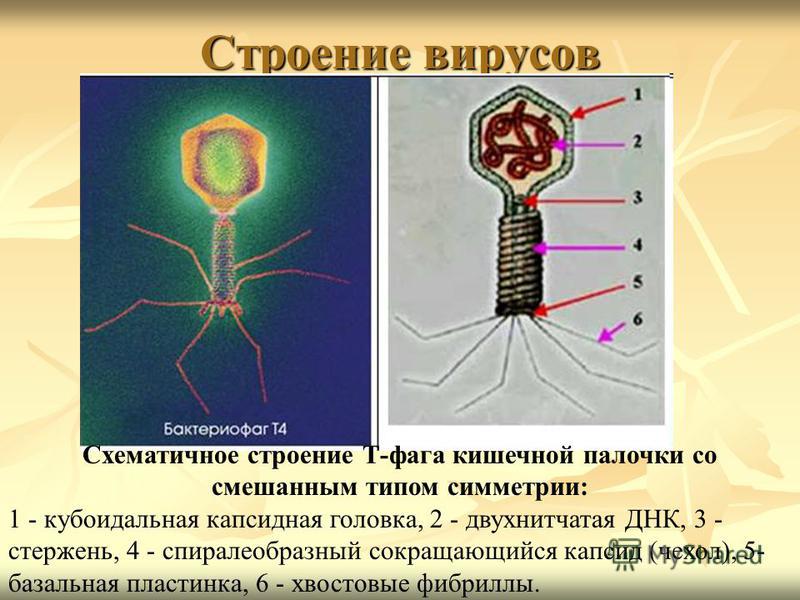 Но затем Чан мог убить их антибиотиками, которые ранее не могли вылечить Ходадуста. Эксперимент показал, что этот бактериофаг может избавить его от инфекции.
Но затем Чан мог убить их антибиотиками, которые ранее не могли вылечить Ходадуста. Эксперимент показал, что этот бактериофаг может избавить его от инфекции.
Нараян разработал подробный план процедуры, а затем получил одобрение FDA. Тем временем Чан вывел OMKO1, чтобы он стал еще более смертоносным против бактерий Ходадуста, отобрав вирусы, убивающие микробы быстрее всех, для создания следующего поколения. Затем он тщательно подготовил очищенную партию вирусов, которые затем должны были быть проверены на наличие загрязнителей в сторонней лаборатории.
Наконец, в январе 2016 года Чан добрался до Йельской больницы Нью-Хейвен со шприцем, наполненным смесью вирусов OMKO1 и антибиотика под названием цефтазидим.
Чана тошнило от беспокойства. Несмотря на то, что он сделал все возможное, чтобы процедура прошла хорошо, она все равно могла пойти не так. Вирусы могут не найти своих микробных жертв и смыться. Если бы они действительно заразили бактерии, ситуация могла бы даже ухудшиться.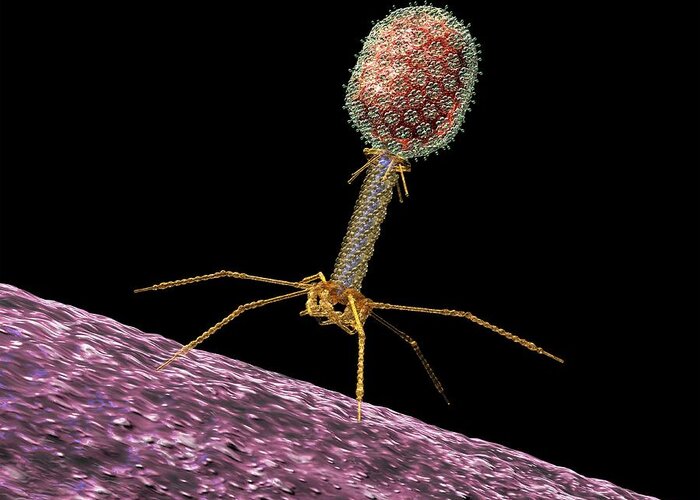 OMKO1 может убить сразу столько микробов, что Ходадуст может впасть в шок.
OMKO1 может убить сразу столько микробов, что Ходадуст может впасть в шок.
«Я отчетливо помню красную тележку, которую они привезли, со всем оборудованием, которое возвращает этого парня к жизни», — сказал Чан. «Я подумал: «О, чувак, это не может испортиться»» 9.0007
Нараян воткнул иглу в грудь Ходадуста и медленно продвинул ее. Однако когда игла достигла аорты, врачи обнаружили, что на стенке сосуда образовались толстые рубцы. Несмотря на многочасовые поиски, они не смогли найти место, где можно было бы ввести вирусы в место заражения. «Это была просто тонна стресса», — сказал Чан.
Нараян и его бригада хирургов остановились на плане Б. Они поместили бактериофаги и антибиотики в отверстие фистулы. Если им повезет, бактериофаги столкнутся там с бактериями и самостоятельно доберутся до аорты.
После процедуры Ходадуст отправился домой, возобновив ежедневный прием антибиотиков, а затем вернулся в Шираз, чтобы провести там время со своими родственниками. Через пять недель после фаговой терапии крошечный костяной шип вонзился в свищ Ходадуста, вызвав сильное кровотечение.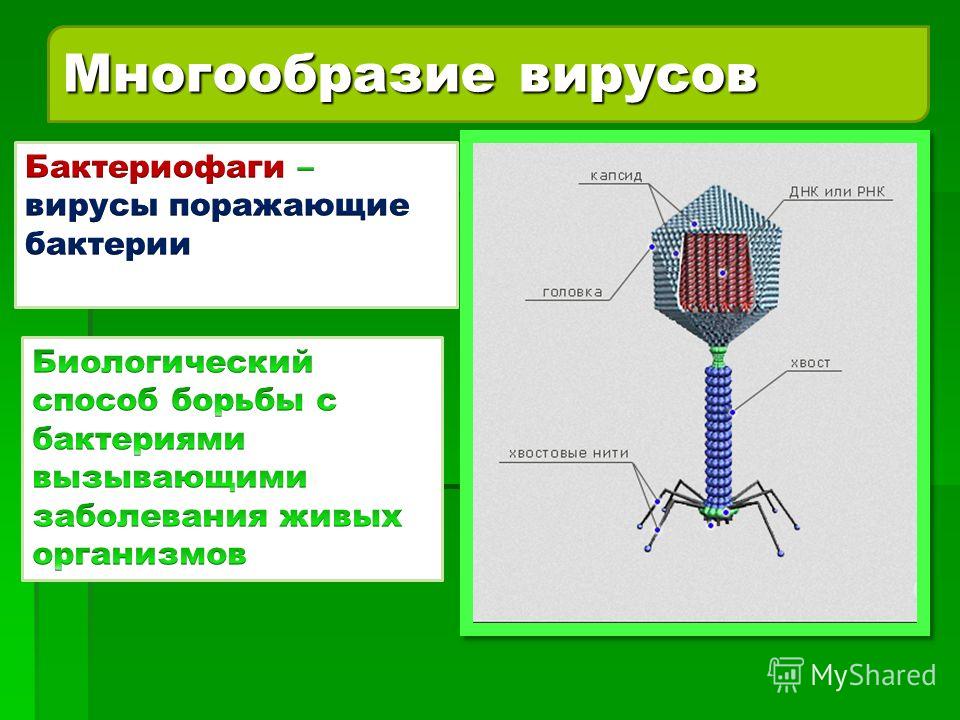 Несмотря на риски, его врачи в Иране решили, что им необходимо провести операцию.
Несмотря на риски, его врачи в Иране решили, что им необходимо провести операцию.
— У них не было особого выбора — он был бы мертв через две минуты, — сказал Нараян.
Врачи вновь вскрыли грудную клетку Ходадуста, устранили повреждение и заменили пластиковую сетку на новый трансплантат. Эта процедура спасла Ходадусту жизнь. Но что было еще более поразительным, так это то, что его врачи обнаружили, когда проверили ткань из груди Ходадуста на наличие Pseudomonas. Они ничего не нашли.
«Вы находитесь в эпицентре бури и не видите псевдомонад, так что очевидно, что что-то убило их», — сказал Нараян.
Летом Ходадуст появился в офисе Нараяна без капельницы в груди и без антибиотиков. Он полностью оправился от четырехлетней инфекции. «Я не мог в это поверить, — сказал Нараян. «Он выглядел на миллион долларов».
Дорога впереди
Этой осенью Нараян и его коллеги представили историю Ходадуста на медицинской конференции и публикуют отчеты об OMKO1 и тематическом исследовании.