Содержание
Коктейль Яманаки продлил жизнь мышам на 50% / Хабр
Это фото LAKI 4F мышей с факторами Яманаки при приеме доксициклина и без, а также долгоживущие WT мыши с доксициклином (антибиотик) и факторами Яманаки. Смотрите на кривую изгиба позвоночника.
LAKI — это быстростареющие мыши с мутацией в lamin A (LMNA). Долгоживущие мыши ставится тот же опыт, но им сейчас только 12 месяцев поэтому с средним сроком жизни в 3 года и максимальным на сегодня 5 лет результаты ожидать можно в 2018-2019 годах.
Сама статья в Cell. Для тех, у кого нет доступа — пользуйтесь sci-hub.io — пиратские научные статьи.
Опыт был проведен в институте Салка в Ла Холле, Южная Калифорния испанцем Бальмонте.
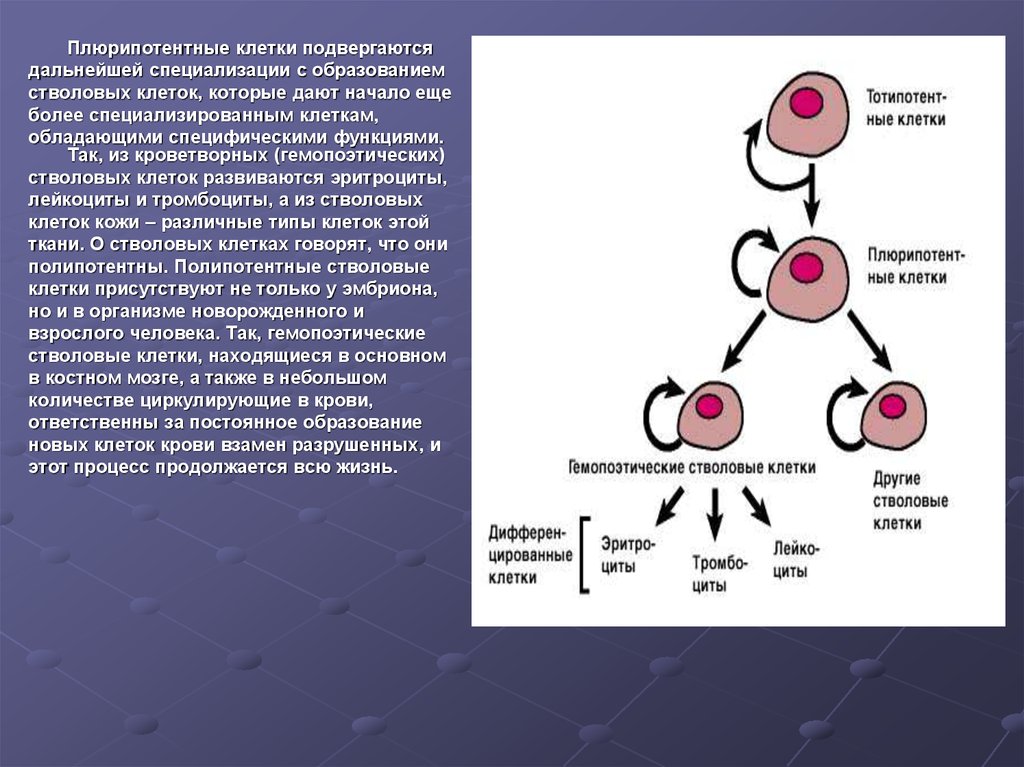
Все началось в 2006 году, когда японец Яманаки открыл 24 фактора (сейчас основные только 4 OSKM, с помощью которых и был проведен опыт) де-дифференциации или плюрипотентности клеток по обращению клеток, например кожи, обратно в стволовые клетки.
Затем, в 2013 году немец Хорватс нашел 353 эпигенитических маркера старения человека, по которым с точностью в 1. 5 года определялся хронологический возраст человека. Для стволовых клеток этот возраст равнялся 0.
5 года определялся хронологический возраст человека. Для стволовых клеток этот возраст равнялся 0.
Для тех, кто интересуется: недавно ученый Гарвардского и Московского университета Вадим Гладышев, получивший мегагрант, определил те же эпигенетические биомаркеры биологического возраста мыши — популярно об этом сказано в блоге fightaging. Это очень важно для ускоренных разработок новых терапий или геропротекторов на мышах.
И небольшой инсайд на десерт. Сейчас компания Calico проводит опыт на 1000 мышах в Jackson Lab Стэнфорд разделенных на две группы — обычные долгоживущие мыши и те же мыши но на голодной диете, продлевающий жизнь мышей на рекордные 50% (и всего на 5% по последним данным на приматах). Когда опыт завершится таким образом спинофф компании Гугл надеется установить биомаркеры биологического возраста мыши, которые нужны для ускоренной разработки терапий или геропротекторов.(очевидно в процессе они берут анализы крови).
Еще небольшой инсайд из статьи New Yorker Silicon Valley Quest for immortality переведенной на vc. ru — Нед Давид 49 из компании Unity Biotechnology получившей инвестиции в 116 миллионов долларов в основном на борьбу с сенесцентными клетками в прошлом году уже ездил к Бальмонте в декабре два раза и один в марте — они планируют новые эксперименты (при этом бюджет всего института Салка всего 117 миллионов, поэтому стартап по радикальному продлению жизни тут очень кстати).
ru — Нед Давид 49 из компании Unity Biotechnology получившей инвестиции в 116 миллионов долларов в основном на борьбу с сенесцентными клетками в прошлом году уже ездил к Бальмонте в декабре два раза и один в марте — они планируют новые эксперименты (при этом бюджет всего института Салка всего 117 миллионов, поэтому стартап по радикальному продлению жизни тут очень кстати).
Так вот оказалось, что процесс обнуления не бинарный (либо стволовая, либо нет), а вполне себе постепенный. И если по клетке не шарахать лошадиными дозами коктейля Яманаки, а дать ей его лишь отхлебнуть, то эпигенетические маркеры не обнуляются, а лишь откатываются назад. Клетка при этом не меняет свой фенотип и так клеткой кожи или сердца и остается (то есть, в отличии от плюрипотентной, ещё не экспрессирует маркер Nanog — это для ботанов).
Таким образом Бальмонте откатил эпигенетические часы мышей у которых в геноме были кассеты Яманаки, которые активировались доксициклином и продлил мышам жизнь максимум на 33% и по медиане на 50%.
Если лабораторные мыши пили воду с доксициклином, — но только два дня в неделю, — они жили более, чем на тридцать процентов дольше. У диких мышей (которым только 12 месяцев), подвергнутых такой же те терапии, обновились мышцы и поджелудочные железы.
Слайды выступления Юрия Дейгина на Научной Среде в Библиотека им. Братьев Гримм. Нововаганковский переулок 22.
Это график дожития LAKI 4F мышей без факторов Яманаки и с факторами Яманаки, без доксициклина, с доксициклином.
Снизились критические маркеры старения:
— маркеры сенесцентных клеток p16Ink4a и бета галактодиаза
— маркер двухцепочечных разрывов ДНК gamma-h3AX
— маркер противоракового белка p53
— метталопротеазы
— интерлейкин-6
— митохондриальные активные формы кислорода
— удлинились теломеры(по опыту М. Бласко поставленном в Барселонне на тех же LAKI)
Напомню что Бальмонте провел опыт не самым оптимальным путем (но опыт сын ошибок трудных) — он вывел трансгенную линию мышей с генами Яманаки OSKM, у которых включалась транскрипция этих генов при приеме доксициклина (антибиотик) два раза в неделю подряд после чего они 5 дней отдыхали.
Как видно из графика ниже, если доксициклин давать не 2, а 3 дня, то мыши уже начинают дохнуть, при чём на 5-й день терапии дохнет половина:
Теперь остается подобрать оптимальные пропорции и тайминг этих факторов, а также способ доставки и режим дозирования, которые смогут продлить жизнь мышам гораздо дольше.
Обзор простым языком про открытие Бальмонте в журнале Science.
Чтобы провести этот опыт на человеке нужен AAB вирусный носитель с факторами Яманаки. Как предлагает Юрий Дейгин можно упростить опыт и делать AAB заточенный исключительно на гипоталамус (ну или шишковидное тело или гипофиз) и другие модификаторы развития и старения головного мозга. Также перспективно вообще не давать организму проводить эпигенетический сдвиг, но опыт который докажет такую возможность пока неизвестен.
Тем временем открылся сайт пациенской организации Open Longevity Фонда Наука за продление жизни.
Грядут Клинические испытание геропротекторов, пока специалистами предложена комбинация сартаны+статины, но сайт индифферентен к любым терапиям, в том числе к приему таких будущих геропротекторов как магний,NAC — N-acetyl-L-cysteine, глицин, гинко билоба (GinkGo Leaf)
На нем можно загружать анализы крови по биомаркерам старения выбранным специалистами.
В том числе автоматическая загрузка данных по кодам анализов лаб ИнВитро.
Эти данные потом будут указывать ваш биологический возраст, а также будет открытые данные с возможностью кросс-сравнения и любого исследования на этих биомаркеров людей от 20 до 70 лет.
Внизу 7 часовое видео лекций со встречи 26 ноября в техноХабе Ключ.Москва.Трехгорная мануфактура.
→ Самая полная база данных геропротекторов для модельных организмов.
→ Самостоятельно можно сдать эпигенетические маркеры и рассчитать возраст по эпигенетическим часам Хорватса.
Наука: Наука и техника: Lenta.ru
Испанские ученые обнаружили, что при перепрограммировании мышей с помощью генной инженерии длина теломер в их клетках увеличивается. Это позволяет продлить им жизнь, однако необходимо пойти на некоторые ухищрения, чтобы на белый свет не появился настоящий монстр. «Лента.ру» рассказывает о рискованном методе омоложения постаревших клеток.
Теломеры — концевые участки хромосом, которые образованы повторяющимися участками ДНК, состоящие из шести нуклеотидов (TTAGGG). Несмотря на их кажущуюся бесполезность, они выполняют очень важную функцию. Дело в том, что при делении клеток хромосомы начинают копироваться, однако этот процесс не проходит для них бесследно. В новых хромосомах концы всегда немного короче, чем в родительских. Теломеры играют роль защитных «колпачков», поскольку не несут важной генетической информации.
Несмотря на их кажущуюся бесполезность, они выполняют очень важную функцию. Дело в том, что при делении клеток хромосомы начинают копироваться, однако этот процесс не проходит для них бесследно. В новых хромосомах концы всегда немного короче, чем в родительских. Теломеры играют роль защитных «колпачков», поскольку не несут важной генетической информации.
Материалы по теме:
Однако теломеры с каждым поколением клеток все больше укорачиваются, пока не наступает критический момент, называемый пределом Хейфлика. Клетки, достигнув этой границы, больше не делятся и умирают.
Некоторые клетки (стволовые, половые и ряд других) способны увеличивать длину своих теломер. Это происходит благодаря ферменту, называемому эндогенной теломеразой. Он добавляет тот самый фрагмент TTAGGG к концу хромосом, и если увеличить его количество в клетках, то те смогут делиться неограниченно долго, преодолевая предел Хейфлика.
Стволовые клетки во взрослом организме тоже постепенно стареют, поскольку теломеразы в них вырабатывается не очень много. Однако ее достаточно, чтобы живые организмы существовали долгие годы, снова и снова залечивая свои раны.
Однако ее достаточно, чтобы живые организмы существовали долгие годы, снова и снова залечивая свои раны.
Когда биологическая ткань повреждена, запускаются процессы ее регенерации. Стволовые клетки делятся, превращаясь в обычные соматические (составляющие тело) клетки. Такое «потомство» не только утрачивает плюрипотентность, то есть способность к трансформации (дифференцировке), но и лишается возможности синтезировать теломеразу. Организм, таким образом, позволяет неограниченно делиться только некоторым группам клеток, поскольку в противном случае риск образования раковых опухолей многократно бы увеличивался.
Стволовые клетки эмбриона
Фото: Nissim Benvenisty / Wikimedia
Что же превращает стволовые клетки в обычные? Хотя во всех клетках организма находятся одни и те же гены, в ткани определенного типа часть из них может быть выключена. Например, в нервных тканях мозга, по которым проходят электрические импульсы, работает один набор генов, а в островках Лангерганса, находящихся в поджелудочной железе и производящих инсулин, — другой. Включает и выключает гены система более высокого уровня, состоящая из эпигенетических факторов — молекул, присоединяющихся к ДНК и регулирующих ее функции. Вся совокупность прикрепленных к двойной спирали факторов образует эпигеном, и, естественно, в каждом типе тканей он разный.
Включает и выключает гены система более высокого уровня, состоящая из эпигенетических факторов — молекул, присоединяющихся к ДНК и регулирующих ее функции. Вся совокупность прикрепленных к двойной спирали факторов образует эпигеном, и, естественно, в каждом типе тканей он разный.
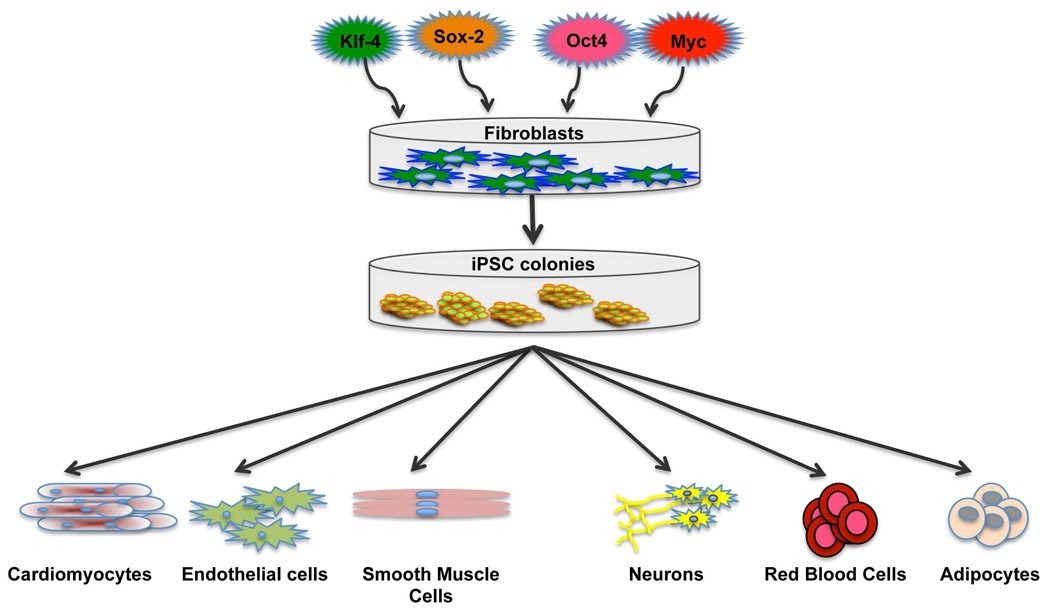
Отсюда следует логичный вывод: чтобы превратить клетку обратно в стволовую, нужно изменить ее эпигеном, иными словами, перепрограммировать. Этого можно добиться, внедрив в нее четыре специфических соединения, называемых факторами Яманаки (OSKM — Oct4, Klf4, Sox2 и c-Myc). Они также участвуют в эпигенетической регуляции, поддерживая способность клеток к дифференцировке. Их впервые в 2006 году применил японский исследователь Синъя Яманака, сумевший трансформировать фибробласты в индуцированные стволовые клетки (iPS-клетки). За это в 2012 году ученому присудили Нобелевскую премию.
Яманака фактически омолодил отдельные клетки, перепрограммировав их на эпигенетическом уровне и запустив процесс дедифференцировки. Возникает вопрос: можно ли сделать то же самое с целым организмом, хотя бы с мышью? Проблема в том, что этим мы нарушаем завет «не должно быть много стволовых клеток», поскольку, как уже говорилось, увеличивается риск возникновения рака. Кроме того, не имеет смысла превращать органы и ткани в сгустки однородных iPS-клеток — организм просто погибнет. Еще одна сложность состоит в том, что индуцированные стволовые клетки могут спонтанно развиваться в тератомы (от др.-греч. τέρατος — «чудовище») — опухоли в виде недоразвитых органов, например зубов, глаз или даже мозга.
Возникает вопрос: можно ли сделать то же самое с целым организмом, хотя бы с мышью? Проблема в том, что этим мы нарушаем завет «не должно быть много стволовых клеток», поскольку, как уже говорилось, увеличивается риск возникновения рака. Кроме того, не имеет смысла превращать органы и ткани в сгустки однородных iPS-клеток — организм просто погибнет. Еще одна сложность состоит в том, что индуцированные стволовые клетки могут спонтанно развиваться в тератомы (от др.-греч. τέρατος — «чудовище») — опухоли в виде недоразвитых органов, например зубов, глаз или даже мозга.
Однако избежать опухолей, как выяснилось, вполне реально. Так, можно не превращать соматические клетки в стволовые, лишая их функциональности, а лишь кратковременно активировать факторы Яманаки, чтобы слегка омолодить ткани. Для этого ученые создали трансгенных мышей, внедрив в их ДНК кассету с набором следующих друг за другом генов, кодирующих OSKM. Кассета, называемая полицистронной (цистрон — то же самое, что и ген), включается в присутствии полусинтетического антибиотика доксициклина. Тем самым начинают производиться факторы Яманаки. Без антибиотика перепрограммирование прекратится.
Тем самым начинают производиться факторы Яманаки. Без антибиотика перепрограммирование прекратится.
Теломераза (зеленые точки) в поджелудочной железе ГМ-мышей
Фото: Maria A. Blasco / CNIO
Испанские исследователи, изучая изменения в теломерах в перепрограммированных мышах, решили не усложнять себе задачу. Для их целей было достаточно активировать полицистронную кассету и проследить, что произойдет с концами хромосом. Наличие тератом и дисплазий в тканях животных свидетельствовало, что перепрограммирование прошло успешно.
Ученые выяснили, что при превращении соматических клеток в стволовые теломеры удлиняются. Это логично, учитывая, что iPS-клетки могут делиться неограниченно долго. Более того, исследователи определили, что важную роль в этом играет теломераза.
До сих пор генетики не располагали доказательствами того, что индуцировать эндогенную теломеразу можно во взрослом организме с помощью эпигенетических факторов. Но именно так все и происходит. Факторы Яманаки, по-видимому, переключают каскады генов, в конце концов активируя удлиняющий теломеры фермент.
Раковые клетки HeLa
Фото: Public Domain / Wikimedia
Подобный процесс сопровождает не только перепрограммирование соматических клеток, но и их озлокачествление. У раковой клетки много общего со стволовыми. Она может неограниченно долго делиться. Самый известный пример — «бессмертные» клетки линии HeLa. Они были выделены в 1951 году из опухоли шейки матки пациентки Генриетты Лакс, умершей в том же году, и до сих пор применяются в многочисленных экспериментах.
Раковые клетки — по сути, тоже перепрограммированные соматические. По мнению ученых, с теломерами в них происходят аналогичные изменения. Поэтому исследования с iPS-клетками позволят выяснить детали молекулярных процессов, протекающих при формировании опухолей.
Факторы Яманаки и частичное клеточное перепрограммирование
Сегодня мы ведем хронику прогресса частичного клеточного перепрограммирования и обсуждаем, как эта мощная техника может быть способна перепрограммировать клетки обратно в юношеское состояние, по крайней мере частично обращая вспять эпигенетические изменения, одно из предложенных причины, по которым мы стареем.
Факторы Яманаки и рождение частичного клеточного перепрограммирования
В 2006 году исследование доктора. Казутоши и Синья Яманака показали, что можно перепрограммировать клетки, используя всего четыре основных гена, названных Oct4, Sox2, Klf4 и c-Myc, или сокращенно OSKM [1]. Эти четыре фактора перепрограммирования часто называют факторами Яманаки в честь одного из их первооткрывателей.
До этого предполагалось, что яйцеклетки (ооциты) будут содержать сложный набор факторов, необходимых для перепрограммирования соматической клетки в эмбриональную клетку. В конце концов, умение трансформировать состарившуюся яйцеклетку и перепрограммировать ее для создания нового животного должно контролироваться многими факторами, присутствующими в яйцеклетке, по крайней мере, они так думали. Такахаши и Яманака перевернули эту идею с ног на голову, когда показали, что для достижения этой трансформации необходимы всего четыре фактора Яманаки.
Они использовали факторы Яманаки для перепрограммирования фибробластов взрослых мышей (клеток соединительной ткани) обратно в эмбриональное состояние, называемое плюрипотентностью, состояние, при котором клетка ведет себя как эмбриональная стволовая клетка и может стать любым другим типом клеток в организме.
Это открытие проложило путь к исследованиям того, как эти факторы Яманаки можно использовать для клеточного омоложения и потенциального способа борьбы с возрастными заболеваниями.
Факторы Яманаки для клеточного и животного омоложения
В 2011 году группа французских исследователей, в том числе Жан-Марк Леметр, впервые сообщила об клеточном омоложении с использованием факторов Яманаки [2]. В течение своей жизни клетки экспрессируют различные паттерны генов, и эти паттерны уникальны для каждой фазы жизни клетки от молодых до старых; этот профиль экспрессии генов позволяет легко идентифицировать старую или молодую клетку. В то время также было известно, что стареющие клетки, такие как фибробласты, имеют короткие теломеры и дисфункциональные митохондрии — две из девяти причин, по которым мы стареем [3].
Жан-Марк Леметр и его коллеги проверили влияние факторов Яманаки на старые фибробласты здоровых пожилых людей, а также здоровых людей старше 100 лет. Они добавили два дополнительных плюрипотентных генетических фактора в смесь OSKM, а именно NANOG и LIN28, и изучили влияние, которое это оказало на экспрессию генов, теломеры и митохондрии этих пожилых людей.
Они обнаружили, что вместе шесть факторов способны возвращать клетки старых доноров обратно в плюрипотентное состояние, а это означает, что они могут стать клетками любого другого типа в организме. Они стали известны как индуцированные плюрипотентные стволовые клетки (ИПСК).
Исследователи отметили, что клетки имели более высокую скорость роста, чем состарившиеся клетки, из которых они были перепрограммированы; у них также были более длинные теломеры, а также митохондрии, которые вели себя по-юношески и больше не были дисфункциональными. Другими словами, перепрограммирование клеток обратило вспять некоторые аспекты старения и вернуло клетки обратно в то же состояние, что и во время развития.
Факторы Яманаки, по-видимому, обращают вспять эпигенетическое старение
Последним шагом исследователей было направить эти иПСК, чтобы они снова стали фибробластами, используя другие факторы перепрограммирования. В результате эти перепрограммированные фибробласты больше не экспрессировали паттерны генов, связанные со старыми клетками, и имели профиль экспрессии генов, неотличимый от профилей молодых фибробластов. По сути, они показали, что эпигенетические изменения (изменения в паттернах экспрессии генов), являющиеся причиной нашего старения, обратились вспять.
В дополнение к этому они также показали, что длина теломер, функция митохондрий и уровни окислительного стресса вернулись к тем, которые обычно наблюдаются в молодых фибробластах. Истощение теломер и митохондриальная дисфункция — еще две причины, по которым мы стареем.
Это было первое доказательство того, что состарившиеся клетки, даже у очень старых людей, можно омолодить, и за этим последовало множество независимых исследований, подтверждающих эти результаты на тех же и других типах клеток.
Можно ли использовать факторы Яманаки на живых животных?
Было легко изолировать клетки в чашке, вернуть их в состояние развития, а затем направить их к тому типу клеток, который они хотели, используя факторы Яманаки. Но это было явно непрактично для живого животного, поскольку клетки не могли стереть свою память, поэтому они возвращались в плюрипотентное состояние. Представьте, если бы клетка сердца забыла, что она клетка сердца, в то время как она должна была помогать перекачивать кровь по всему телу!
Также высказывались опасения, что известно, что экспрессия факторов Яманаки вызывает рак у животных [4].
Некоторые исследователи полагали, что можно избежать рака и обратить вспять старение старых клеток, не возвращая их полностью к плюрипотентности. Другими словами, они думали, что у нас есть способ получить свой пирог и съесть его. Но никому не удавалось добиться этого на живых животных. Все должно было измениться в декабре 2016 года.
Профессор Хуан Карлос Изписуа Бельмонте и его группа исследователей из Института Солка сообщили о выводах своего исследования, которое впервые показало, что клетки и органы живого животного могут быть омолодился [5].
Для исследования исследователи использовали специально сконструированную прогерическую мышь, стареющую быстрее, чем обычно, а также сконструированную нормально стареющую линию мышей. Оба типа мышей были спроектированы таким образом, чтобы экспрессировать факторы Яманака, когда они вступали в контакт с антибиотиком доксициклином, который им давали с питьевой водой.
Они позволили факторам Яманака временно экспрессироваться, добавив доксициклин в воду на два дня, а затем удалили его, чтобы гены OSKM снова замолчали. Затем у мышей был пятидневный период отдыха перед еще двумя днями воздействия доксициклина; этот цикл повторялся на протяжении всего исследования.
Частичное клеточное перепрограммирование
Всего через шесть недель этого лечения, которое постоянно перепрограммировало клетки мышей, исследователи заметили улучшения в их внешнем виде, в том числе уменьшение возрастного искривления позвоночника.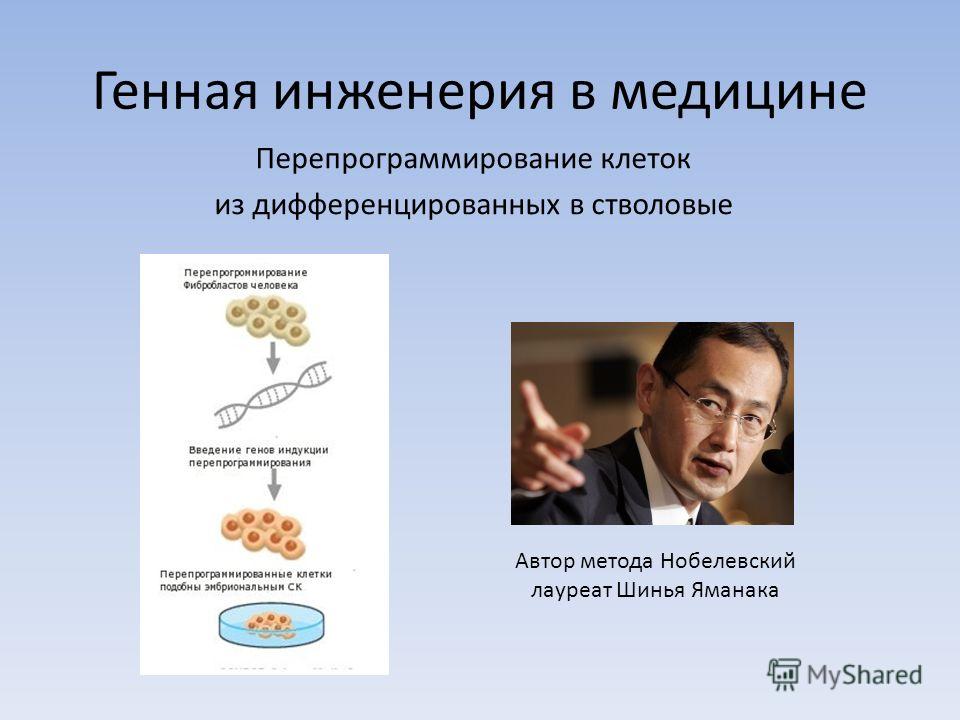 Некоторые мыши как из экспериментальной, так и из контрольной групп также были подвергнуты эвтаназии в этот момент, чтобы можно было исследовать их кожу, почки, желудки и селезенку. У контрольных мышей наблюдался ряд возрастных изменений по сравнению с обработанными мышами, у которых ряд признаков старения остановился или даже обратился вспять, включая некоторые эпигенетические изменения.
Некоторые мыши как из экспериментальной, так и из контрольной групп также были подвергнуты эвтаназии в этот момент, чтобы можно было исследовать их кожу, почки, желудки и селезенку. У контрольных мышей наблюдался ряд возрастных изменений по сравнению с обработанными мышами, у которых ряд признаков старения остановился или даже обратился вспять, включая некоторые эпигенетические изменения.
У обработанных мышей также наблюдалось 50%-ное увеличение среднего времени выживания по сравнению с контрольными мышами, не получавшими прогерик. Следует отметить, что не на все признаки старения влияло частичное клеточное перепрограммирование, и если лечение прекращалось, признаки старения возвращались.
Возможно, самое главное, хотя частичное клеточное перепрограммирование, проводимое таким периодическим образом, сбрасывало некоторые признаки эпигенетического старения, оно не сбрасывало дифференцировку клеток, что могло бы заставить клетку вернуться в эмбриональное состояние и забыть, какой она была прежде; как вы можете себе представить, это было бы плохо для живого животного.
Наконец, временная экспрессия факторов Yamanaka не только привела к частичному омоложению клеток и органов у прогерийных мышей, но также, по-видимому, улучшила регенерацию тканей в группе 12-месячных нормально стареющих мышей, подвергшихся генной инженерии. Исследователи заметили, что частичное перепрограммирование улучшило способность этих мышей регенерировать ткань поджелудочной железы, что привело к усилению пролиферации бета-клеток; кроме того, в скелетных мышцах наблюдалось увеличение сателлитных клеток. Оба этих типа клеток обычно уменьшаются в процессе старения.
Факторы Яманаки, используемые для улучшения когнитивных функций у старых мышей
В октябре 2020 года еще одно исследование сделало нас на шаг ближе к частичному клеточному перепрограммированию, дошедшему до клиники, когда исследователи показали, что частичное клеточное перепрограммирование улучшает память у старых мышей. Как показали предыдущие исследования, частичное клеточное перепрограммирование представляет собой баланс между эпигенетическим омоложением клеток и сбросом часов их старения без полного сброса их клеточной идентичности, чтобы они забыли, что это за клетки [6].
Предыдущие исследования также показали нам, что такое уравновешивание возможно и что при достаточно долгом воздействии на клетки факторов перепрограммирования возможно омоложение клетки без стирания ее клеточной идентичности.
Как и в предыдущем исследовании, о котором мы говорили, у мышей в этом исследовании были сконструированы клетки, реагирующие на доксициклин, распространенный антибиотик, используемый в ветеринарной практике, для экспрессии факторов перепрограммирования OSKM. Исследователи обнаружили, что достаточное воздействие на мышей улучшило их когнитивные функции без увеличения смертности в течение четырехмесячного периода.
Еще один шаг вперед к частичному перепрограммированию клеток
В конце 2020 года исследователи, в том числе доктор Дэвид Синклер, опубликовали исследование, которое показало, что им удалось восстановить утраченное зрение у старых мышей и мышей с поврежденными нервами сетчатки с помощью частичное клеточное репрограммирование [7].
Чтобы снизить риск рака, они решили попробовать частичное клеточное перепрограммирование минус один из факторов Яманака. Один из авторов исследования, доктор Юаньчэн Лу, искал более безопасный способ омоложения состарившихся клеток, поскольку были некоторые опасения, что использование c-Myc может вызвать рак при определенных обстоятельствах. В итоге они решили использовать только Oct4, Sox2 и Klf4 (OSK).
Хорошая новость заключалась в том, что даже OSK удалось омолодить поврежденные глазные нервы у мышей и восстановить зрение. Он также помог улучшить возрастное ухудшение зрения у мышей, получавших лечение, и у мышей, у которых наблюдалось повышенное глазное давление, имитация глаукомы.
Соавтор исследования, доктор Дэвид Синклер, сказал в статье в Nature: «Мы начали с вопроса: если эпигенетические изменения являются движущей силой старения, можно ли сбросить эпигеном?», или, другими словами, «Можете ли вы повернуть время вспять?». Ответ на этот вопрос звучит утвердительно!
Усовершенствование метода частичного клеточного перепрограммирования
В январе 2021 года исследователи показали, что частичное перепрограммирование омолаживает клетки человека на 30 лет, заставляя старые изношенные клетки функционировать как клетки человека в возрасте около 25 лет. Исследователи этого исследования использовали подход, который подвергал клетки воздействию достаточного количества факторов перепрограммирования, чтобы вытолкнуть их за пределы, при которых они считались соматическими, а не стволовыми клетками, но только чуть дальше [8].
Исследователи этого исследования использовали подход, который подвергал клетки воздействию достаточного количества факторов перепрограммирования, чтобы вытолкнуть их за пределы, при которых они считались соматическими, а не стволовыми клетками, но только чуть дальше [8].
Фибробласты, которые были перепрограммированы таким образом, сохранили достаточно своей эпигенетической клеточной памяти, чтобы снова стать фибробластами. Воздействие на эти клетки факторов OSKM проводилось с помощью лентивирусной упаковки, активированной доксициклином, как и в предыдущих исследованиях на животных.
Возможно, самое интересное, что, согласно многотканевым часам Хорвата 2013 г., образцы клеток, которым было чуть менее 60 лет, стали эпигенетически эквивалентными клеткам, которым было примерно 25 лет, после 13 дней частичного клеточного перепрограммирования, а кожа и кровь Хорвата 2018 г. часы показали, что клетки, которым было около 40 лет, также эпигенетически возвращались к клеткам 25-летнего человека. Похоже, что клетки возвращаются к эпигенетическому возрасту 25 лет или около того, предполагая, что это пик клеточного расцвета или оптимальный функциональный возраст для клеток.
Похоже, что клетки возвращаются к эпигенетическому возрасту 25 лет или около того, предполагая, что это пик клеточного расцвета или оптимальный функциональный возраст для клеток.
Проблемы частичного клеточного перепрограммирования
Безусловно, самым большим препятствием на пути частичного клеточного перепрограммирования к людям является необходимость найти способ активировать факторы Яманаки в наших клетках без необходимости конструировать наши тела, чтобы реагировать на препарат, например доксициклин. Это может потребовать от нас разработки лекарств, способных активировать OSKM, редактируя каждую клетку нашего тела, чтобы она реагировала на определенное соединение, такое как доксициклин, что было бы чрезвычайно сложно, хотя и правдоподобно.
Другой возможностью является редактирование зародышевой линии, чтобы наши дети рождались с такой модификацией, чтобы реагировать на выбранное соединение, идея, которая в настоящее время является этическим кошмаром даже для рассмотрения, не говоря уже о технических проблемах, связанных с ее успешным выполнением. Каким бы ни было решение, оно должно быть практичным.
Каким бы ни было решение, оно должно быть практичным.
Другим серьезным препятствием является поиск метода, пригодного для долгосрочного использования, который не требует постоянного ухода, чтобы признаки старения быстро не возвращались, как это произошло у мышей, когда лечение было прервано. Хотя есть некоторые основания полагать, что эти признаки не вернутся так быстро у людей, учитывая различия между метаболизмом мыши и человека и наши превосходные системы восстановления, они, вероятно, вернутся в свое время. Таким образом, поиск экономичного способа продолжения циклического лечения имеет первостепенное значение; это потенциально может быть достигнуто с помощью лекарств или временной генной терапии.
Будущие факторы Яманаки для борьбы со старением
Если предположить, что эти барьеры могут быть преодолены, а быстрый прогресс в области биотехнологии дает основания полагать, что они будут преодолены, то частичное клеточное перепрограммирование может иметь большой потенциал для предотвращения или даже лечения болезней старения.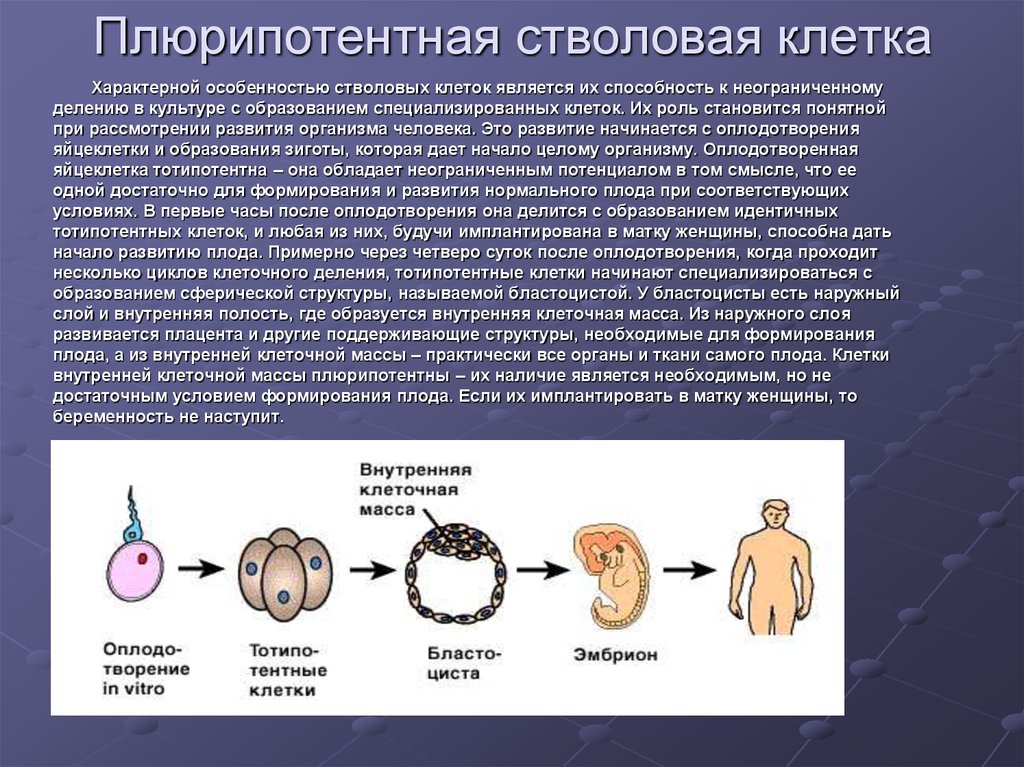
Можно было бы предусмотреть раннее, предварительное использование этого подхода в профилактических целях: пожилым людям с риском возрастных заболеваний можно было бы дать частичное перепрограммирование, чтобы остановить или, по крайней мере, значительно замедлить этот аспект старения и тем самым снизить риск развития возрастных заболеваний.
На более совершенных стадиях может использоваться более целенаправленно для восстановления определенного органа или ткани, поврежденных в результате травмы или болезни. В другом, более продвинутом сценарии можно попытаться постепенно омолодить все тело пожилых людей, чтобы полностью предотвратить возрастные заболевания и сохранить их здоровыми, активными и способными продолжать радоваться жизни.
Такие компании, как Google Calico, в настоящее время также изучают альтернативные способы частичного клеточного перепрограммирования без использования факторов Яманаки. Это еще одно направление исследований, которое может оказаться более практичным и безопасным, чем использование факторов Яманаки.
Быстрый прогресс медицинских технологий потенциально может означать, что такие методы частичного клеточного перепрограммирования могут стать доступными в недалеком будущем. Мы, конечно, на это надеемся.
Мы хотели бы попросить вас о небольшой услуге. Мы являемся некоммерческим фондом , и, в отличие от некоторых других организаций, у нас нет акционеров и продуктов для продажи вам. Мы стремимся к ответственной журналистике, свободной от коммерческого или политического влияния , что позволяет вам принимать обоснованные решения о своем будущем здоровье.
Все наши новости и образовательный контент бесплатны для всех, но это означает, что мы полагаемся на помощь таких людей, как вы. Каждый вклад, независимо от того, большой он или маленький, поддерживает независимую журналистику и поддерживает наше будущее. Вы можете поддержать нас, сделав пожертвование или другим способом бесплатно для вас.
Литература
[1] Такахаши, К.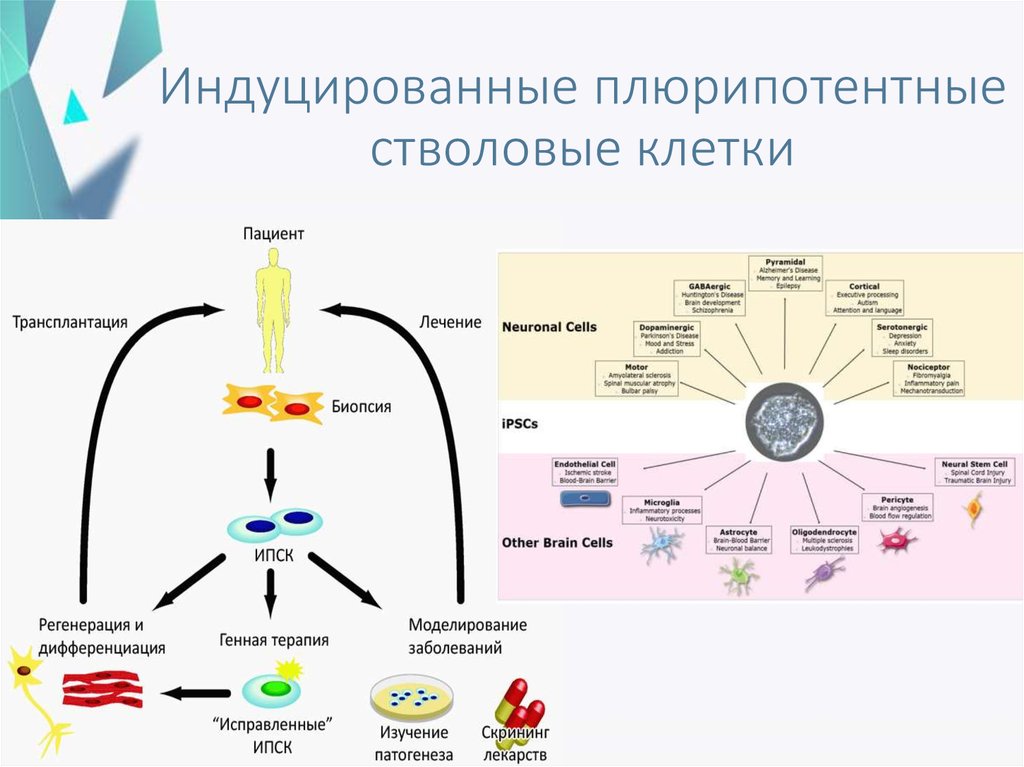 , и Яманака, С. (2006). Индукция плюрипотентных стволовых клеток из культур эмбриональных и взрослых фибробластов мыши с помощью определенных факторов. ячейка, 126(4), 663-676.
, и Яманака, С. (2006). Индукция плюрипотентных стволовых клеток из культур эмбриональных и взрослых фибробластов мыши с помощью определенных факторов. ячейка, 126(4), 663-676.
[2] Лапассе, Л., Милаве, О., Приер, А., Беснар, Э., Баблед, А., Айт-Хаму, Н., … и Леманн, С. (2011). Омоложение стареющих и столетних клеток человека путем перепрограммирования через плюрипотентное состояние. Гены и развитие, 25(21), 2248-2253.
[3] Лопес-Отин, К., Бласко, М.А., Партридж, Л., Серрано, М., и Кремер, Г. (2013). Признаки старения. Ячейка, 153(6), 1194-1217.
[4] Абад, М., Мостейро, Л., Пантоха, К., Канамеро, М., Район, Т., Орс, И., … и Мансанарес, М. (2013). При перепрограммировании in vivo образуются тератомы и iPS-клетки с признаками тотипотентности. Природа, 502(7471), 340.
[5] Окампо А., Редди П., Мартинес-Редондо П., Платеро-Луэнго А., Хатанака Ф., Хисида Т., Ли М., Лам Д., Курита М., Бейрет Э., Араока Т., Васкес-Феррер Э., Доносо Д., Роман JLXJ, Родригес-Эстебан С, Нуньес Г. , Нуньес Деликадо Э., Кампистол Х.М., Гильен И., Гильен П., Изписуа Бельмонте Х.К. In vivo улучшение возрастных признаков путем частичного перепрограммирования. Клетка. 2016; 167:1719–33.
, Нуньес Деликадо Э., Кампистол Х.М., Гильен И., Гильен П., Изписуа Бельмонте Х.К. In vivo улучшение возрастных признаков путем частичного перепрограммирования. Клетка. 2016; 167:1719–33.
[6] Родригес-Мателлан, А., Алькасар, Н., Эрнандес, Ф., Серрано, М., и Авила, Дж. (2020). Перепрограммирование in vivo улучшает признаки старения в клетках зубчатой извилины и улучшает память у мышей. Отчеты о стволовых клетках , 15 (5), 1056-1066.
[7] Лу, Ю., Броммер, Б., Тиан, X., Кришнан, А., Меер, М., Ван, К., … и Синклер, Д. А. (2020). Перепрограммирование для восстановления юношеской эпигенетической информации и восстановления зрения. Природа, 588 (7836), 124-129.
[8] Гилл Д., Парри А., Сантос Ф., Эрнандо-Эрраес И., Стаббс Т. М., Милагре И. и Рейк В. (2021). Мультиомное омоложение клеток человека путем временного перепрограммирования фазы созревания.
Технология iPS: четыре фактора, которые изменят мир
Подписывайтесь на нас:
You are here
Главная
>
Комментарии
>
Технология iPS: четыре фактора, которые изменят мир… когда-нибудь
| |||||||
Хотя они еще не выполнили свои обещания в терапии, иПС-клетки в настоящее время регулярно используются в огромном списке дисциплин, включая биологию развития и регенеративную биологию, неврологию, кардиологию, гепатологию, моделирование заболеваний и даже разработку лекарств. Эта технология позволила добиться значительных успехов в выяснении патологических механизмов многих заболеваний, таких как болезнь Альцгеймера и Паркинсона. Многие усилия были сосредоточены на дифференциации иПС-клеток человека, полученных от здоровых доноров или пациентов, в специализированные типы клеток, включая гепатоциты или кардиомиоциты, для проверки токсичности новых лекарств. Это может даже стать нормой в оценке безопасности лекарств однажды, с новой парадигмой инициативы CiPA (Комплексный анализ проаритмии in vitro) (6). Эта организация, объединяющая исследователей, медицинские агентства и некоммерческие организации со всего мира (США, Европе, Японии, Канаде и т.д.) и сосредоточившись на разработке оптимизированных правил для проверки потенциальной кардиотоксичности новых молекул, недавно предложили включить анализы in vitro на кардиомиоцитах, полученных из hiPS. из этих клеток, полученных из иПС, имеют незрелые характеристики, больше напоминающие эмбриональные, чем взрослые дифференцированные клетки, что требует оптимизированных протоколов и методов. В дополнение к этим ограничениям интересно думать, что мы до сих пор не до конца понимаем перепрограммирование. Амели Резза — менеджер инновационных проектов в компании genOway, специализирующаяся на передовых биотехнологиях. Каталожные номера:
|

 )
)  Тогда зачем продолжать использовать эти клетки? Что ж, если у вас есть клетки, которые могут генерировать различные ткани в организме, не только очень интересно узнать, как формируются эти ткани, но и получить прекрасное представление о том, как они регенерируют. А учитывая стремительное старение населения во всем мире, регенерация и регенеративная медицина концентрируют множество интересов.
Тогда зачем продолжать использовать эти клетки? Что ж, если у вас есть клетки, которые могут генерировать различные ткани в организме, не только очень интересно узнать, как формируются эти ткани, но и получить прекрасное представление о том, как они регенерируют. А учитывая стремительное старение населения во всем мире, регенерация и регенеративная медицина концентрируют множество интересов. (3) Обеспечивая практически неисчерпаемый источник человеческих клеток PS, технология iPS быстро распространилась практически во всех исследованиях. институт в мире.
(3) Обеспечивая практически неисчерпаемый источник человеческих клеток PS, технология iPS быстро распространилась практически во всех исследованиях. институт в мире. клетки. Это возобновилось в начале этого года, когда пациент впервые получил перепрограммированные клетки от донора (5), но на данный момент iPS-клетки произвели революцию больше в лабораториях, чем в прикроватных тумбочках.
клетки. Это возобновилось в начале этого года, когда пациент впервые получил перепрограммированные клетки от донора (5), но на данный момент iPS-клетки произвели революцию больше в лабораториях, чем в прикроватных тумбочках. Например, мы можем разделить процесс на последовательные этапы и можем подтвердить плюрипотентность перепрограммированных клеток многими различными способами, но мы все еще не знаем точно, как это работает, как четыре фактора могут вызвать такое резкое изменение судьбы. Учитывая, что эти и некоторые другие вопросы все еще не решены (риск онкогенности является реальным препятствием), наиболее вероятно, что нас еще ждут крупные прорывы в технологии iPS.
Например, мы можем разделить процесс на последовательные этапы и можем подтвердить плюрипотентность перепрограммированных клеток многими различными способами, но мы все еще не знаем точно, как это работает, как четыре фактора могут вызвать такое резкое изменение судьбы. Учитывая, что эти и некоторые другие вопросы все еще не решены (риск онкогенности является реальным препятствием), наиболее вероятно, что нас еще ждут крупные прорывы в технологии iPS.