Содержание
клетки кожи удалось омолодить на 30 лет
08 апреля 2022
18:49
Ольга Мурая
Обновлённые клетки кожи не только «выглядели» моложе, но и начали выполнять защитные функции с новой силой.
Фото Pixabay.
Новое исследование обещает прорыв в регенеративной медицине.
Исследователи заставили клетки кожи человека совершить «прыжок во времени», омолодив их на целых 30 лет. Что интересно, учёным удалось перевести часы старения клеток на десятилетия назад, не дав подопечным забыть о своём предназначении.
Если нынешнее исследование удастся расширить в целую область в регенеративной медицине, это достижение со временем сможет произвести настоящую революцию.
Напомним, с возрастом способность наших клеток функционировать снижается. В геноме накапливаются множественные следы старения, такие как мутации. Регенеративная биология направлена на восстановление или замену таких «уставших» от выполнения своей функции клеток.
Одним из важнейших инструментов регенеративной биологии сегодня является метод создания индуцированных плюрипотентных стволовых клеток (иСК). Эта технология «стирает» некоторые молекулярные метки, которые делают клетки специализированными. Данный процесс можно сравнить с превращением взрослого дяди, который выбрал для себя профессию строителя, обратно в мальчишку-школьника, которые пока даже не представляет, что такое бетон.
В теории такие клетки-школьники (иСК) могут стать клетками любого типа или выбрать для себя любую профессию. Однако учёные пока не научились надёжно воссоздавать условия для повторной дифференцировки (выбора профессии) стволовых клеток во все возможные типы клеток.
В 2012 году разработчики методики создания иСК Синъя Яманака и Джон Гёрдон получили за неё Нобелевскую премию по физиологии и медицине. Четыре ключевые молекулы, которые используются для «перепрограммирования» клеток называют факторами Яманаки.
Четыре ключевые молекулы, которые используются для «перепрограммирования» клеток называют факторами Яманаки.
Авторы новой работы поставили себе цель: запустить процесс «стирания памяти» особых клеток кожи — фибробластов — лишь частично. Зачем это было нужно? Условно говоря, учёные не хотели, чтобы взрослый дядя забыл полученные профессиональные знания — они лишь хотели его омолодить, чтобы тот лучше выполнял свою работу и меньше уставал.
Для этого они подвергли клетки воздействию факторов Яманаки не на 50 положенных дней, а всего на 13.
За это время удаляются возрастные изменения, и клетки временно теряют свою «индивидуальность». Частично перепрограммированным клеткам дали время для роста в нормальных условиях, чтобы посмотреть, вернётся ли к ним их специфическая функция (вспомнят ли они, что такое бетон и как работает башенный кран).
Анализ генома показал, что в клетках вновь появились маркеры, характерные именно для фибробластов. Это также было подтверждено в наблюдениях за перепрограммированными клетками: они вырабатывали коллаген.
Напомним, что коллаген — это своего рода строительные леса кожи. Чем старше мы становится, тем меньше коллагена вырабатывается в коже. Создание этого белка — одна из основных функций фибробластов, определяющих внешний вид кожи.
Чтобы показать, что клетки омолодились, исследователи изучили ряд известных на сегодняшний день признаков старения — ведь всем известно, что возраст это не просто цифра.
Во-первых, учёные «сверили» эпигенетические часы: химические метки в геноме, которые указывают на возраст клетки.
Затем исследователи изучили транскриптом: совокупность всех молекул РНК, производимых клеткой в процессе «считывания» генов.
По этим двум показателям перепрограммированные клетки оказались на 30 лет моложе, чем исходные!
Эта технология имеет огромный потенциал применения, ведь эти клетки не только «выглядели моложе», но и функционировали как молодые. То есть это вовсе не эстетическая процедура по подтягиванию лица, а реальное омоложение.
Тут стоит также вспомнить, что коллаген, составляющий основу соединительной ткани, участвует в заживлении ран. Многие люди в возрасте замечали, что раньше даже серьёзные раны на их коже затягивались за сутки-трое. Но с возрастом любой процесс восстановления замедляется, и у человека в годах даже неглубокая рана может зарастать неделю, а то и месяц.
Многие люди в возрасте замечали, что раньше даже серьёзные раны на их коже затягивались за сутки-трое. Но с возрастом любой процесс восстановления замедляется, и у человека в годах даже неглубокая рана может зарастать неделю, а то и месяц.
Исследователи протестировали частично омоложенные клетки, надрезав слой клеток в чашке Петри. Они обнаружили, что их «обновлённые» фибробласты перемещаются в зону повреждения быстрее, чем у старых клеток.
Как считают исследователи, это признак того, что новый метод однажды можно будет использовать для создания клеток, которые лучше заживляют раны.
Остаётся добавить, что результаты этой работы представляют собой большой шаг вперёд в понимании процессов перепрограммирования клеток. Авторы исследования пророчат своей разработке большое будущее.
Исследование было опубликовано в издании eLife.
Ранее мы писали о том, как из стволовых клеток впервые вырастили полностью функциональную кожу
Больше удивительных новостей из мира науки и медицины вы найдёте в разделах «Наука» и «Медицина» на медиаплатформе «Смотрим».
Подписывайтесь на наши страницы в соцсетях. «Смотрим» – Telegram и Яндекс.Дзен, Вести.Ru – Одноклассники, ВКонтакте, Яндекс.Дзен и Telegram.
наука
медицина
омоложение
регенерация
стволовые клетки
старение
кожа
общество
новости
Коктейль Яманаки продлил жизнь мышам на 50% / Хабр
Это фото LAKI 4F мышей с факторами Яманаки при приеме доксициклина и без, а также долгоживущие WT мыши с доксициклином (антибиотик) и факторами Яманаки. Смотрите на кривую изгиба позвоночника.
LAKI — это быстростареющие мыши с мутацией в lamin A (LMNA). Долгоживущие мыши ставится тот же опыт, но им сейчас только 12 месяцев поэтому с средним сроком жизни в 3 года и максимальным на сегодня 5 лет результаты ожидать можно в 2018-2019 годах.
Сама статья в Cell. Для тех, у кого нет доступа — пользуйтесь sci-hub.io — пиратские научные статьи.
Опыт был проведен в институте Салка в Ла Холле, Южная Калифорния испанцем Бальмонте.
Все началось в 2006 году, когда японец Яманаки открыл 24 фактора (сейчас основные только 4 OSKM, с помощью которых и был проведен опыт) де-дифференциации или плюрипотентности клеток по обращению клеток, например кожи, обратно в стволовые клетки.
Затем, в 2013 году немец Хорватс нашел 353 эпигенитических маркера старения человека, по которым с точностью в 1.5 года определялся хронологический возраст человека. Для стволовых клеток этот возраст равнялся 0.
Для тех, кто интересуется: недавно ученый Гарвардского и Московского университета Вадим Гладышев, получивший мегагрант, определил те же эпигенетические биомаркеры биологического возраста мыши — популярно об этом сказано в блоге fightaging. Это очень важно для ускоренных разработок новых терапий или геропротекторов на мышах.
И небольшой инсайд на десерт. Сейчас компания Calico проводит опыт на 1000 мышах в Jackson Lab Стэнфорд разделенных на две группы — обычные долгоживущие мыши и те же мыши но на голодной диете, продлевающий жизнь мышей на рекордные 50% (и всего на 5% по последним данным на приматах). Когда опыт завершится таким образом спинофф компании Гугл надеется установить биомаркеры биологического возраста мыши, которые нужны для ускоренной разработки терапий или геропротекторов.(очевидно в процессе они берут анализы крови).
Когда опыт завершится таким образом спинофф компании Гугл надеется установить биомаркеры биологического возраста мыши, которые нужны для ускоренной разработки терапий или геропротекторов.(очевидно в процессе они берут анализы крови).
Еще небольшой инсайд из статьи New Yorker Silicon Valley Quest for immortality переведенной на vc.ru — Нед Давид 49 из компании Unity Biotechnology получившей инвестиции в 116 миллионов долларов в основном на борьбу с сенесцентными клетками в прошлом году уже ездил к Бальмонте в декабре два раза и один в марте — они планируют новые эксперименты (при этом бюджет всего института Салка всего 117 миллионов, поэтому стартап по радикальному продлению жизни тут очень кстати).
Так вот оказалось, что процесс обнуления не бинарный (либо стволовая, либо нет), а вполне себе постепенный. И если по клетке не шарахать лошадиными дозами коктейля Яманаки, а дать ей его лишь отхлебнуть, то эпигенетические маркеры не обнуляются, а лишь откатываются назад. Клетка при этом не меняет свой фенотип и так клеткой кожи или сердца и остается (то есть, в отличии от плюрипотентной, ещё не экспрессирует маркер Nanog — это для ботанов).
Таким образом Бальмонте откатил эпигенетические часы мышей у которых в геноме были кассеты Яманаки, которые активировались доксициклином и продлил мышам жизнь максимум на 33% и по медиане на 50%.
Если лабораторные мыши пили воду с доксициклином, — но только два дня в неделю, — они жили более, чем на тридцать процентов дольше. У диких мышей (которым только 12 месяцев), подвергнутых такой же те терапии, обновились мышцы и поджелудочные железы.
Слайды выступления Юрия Дейгина на Научной Среде в Библиотека им. Братьев Гримм. Нововаганковский переулок 22.
Это график дожития LAKI 4F мышей без факторов Яманаки и с факторами Яманаки, без доксициклина, с доксициклином.
Снизились критические маркеры старения:
— маркеры сенесцентных клеток p16Ink4a и бета галактодиаза
— маркер двухцепочечных разрывов ДНК gamma-h3AX
— маркер противоракового белка p53
— метталопротеазы
— интерлейкин-6
— митохондриальные активные формы кислорода
— удлинились теломеры(по опыту М. Бласко поставленном в Барселонне на тех же LAKI)
Бласко поставленном в Барселонне на тех же LAKI)
Напомню что Бальмонте провел опыт не самым оптимальным путем (но опыт сын ошибок трудных) — он вывел трансгенную линию мышей с генами Яманаки OSKM, у которых включалась транскрипция этих генов при приеме доксициклина (антибиотик) два раза в неделю подряд после чего они 5 дней отдыхали.
Как видно из графика ниже, если доксициклин давать не 2, а 3 дня, то мыши уже начинают дохнуть, при чём на 5-й день терапии дохнет половина:
Теперь остается подобрать оптимальные пропорции и тайминг этих факторов, а также способ доставки и режим дозирования, которые смогут продлить жизнь мышам гораздо дольше.
Обзор простым языком про открытие Бальмонте в журнале Science.
Чтобы провести этот опыт на человеке нужен AAB вирусный носитель с факторами Яманаки. Как предлагает Юрий Дейгин можно упростить опыт и делать AAB заточенный исключительно на гипоталамус (ну или шишковидное тело или гипофиз) и другие модификаторы развития и старения головного мозга. Также перспективно вообще не давать организму проводить эпигенетический сдвиг, но опыт который докажет такую возможность пока неизвестен.
Также перспективно вообще не давать организму проводить эпигенетический сдвиг, но опыт который докажет такую возможность пока неизвестен.
Тем временем открылся сайт пациенской организации Open Longevity Фонда Наука за продление жизни.
Грядут Клинические испытание геропротекторов, пока специалистами предложена комбинация сартаны+статины, но сайт индифферентен к любым терапиям, в том числе к приему таких будущих геропротекторов как магний,NAC — N-acetyl-L-cysteine, глицин, гинко билоба (GinkGo Leaf)
На нем можно загружать анализы крови по биомаркерам старения выбранным специалистами.
В том числе автоматическая загрузка данных по кодам анализов лаб ИнВитро.
Эти данные потом будут указывать ваш биологический возраст, а также будет открытые данные с возможностью кросс-сравнения и любого исследования на этих биомаркеров людей от 20 до 70 лет.
Внизу 7 часовое видео лекций со встречи 26 ноября в техноХабе Ключ.Москва.Трехгорная мануфактура.
→ Самая полная база данных геропротекторов для модельных организмов.
→ Самостоятельно можно сдать эпигенетические маркеры и рассчитать возраст по эпигенетическим часам Хорватса.
Наука: Наука и техника: Lenta.ru
Испанские ученые обнаружили, что при перепрограммировании мышей с помощью генной инженерии длина теломер в их клетках увеличивается. Это позволяет продлить им жизнь, однако необходимо пойти на некоторые ухищрения, чтобы на белый свет не появился настоящий монстр. «Лента.ру» рассказывает о рискованном методе омоложения постаревших клеток.
Теломеры — концевые участки хромосом, которые образованы повторяющимися участками ДНК, состоящие из шести нуклеотидов (TTAGGG). Несмотря на их кажущуюся бесполезность, они выполняют очень важную функцию. Дело в том, что при делении клеток хромосомы начинают копироваться, однако этот процесс не проходит для них бесследно. В новых хромосомах концы всегда немного короче, чем в родительских. Теломеры играют роль защитных «колпачков», поскольку не несут важной генетической информации.
Материалы по теме:
Однако теломеры с каждым поколением клеток все больше укорачиваются, пока не наступает критический момент, называемый пределом Хейфлика. Клетки, достигнув этой границы, больше не делятся и умирают.
Клетки, достигнув этой границы, больше не делятся и умирают.
Некоторые клетки (стволовые, половые и ряд других) способны увеличивать длину своих теломер. Это происходит благодаря ферменту, называемому эндогенной теломеразой. Он добавляет тот самый фрагмент TTAGGG к концу хромосом, и если увеличить его количество в клетках, то те смогут делиться неограниченно долго, преодолевая предел Хейфлика.
Стволовые клетки во взрослом организме тоже постепенно стареют, поскольку теломеразы в них вырабатывается не очень много. Однако ее достаточно, чтобы живые организмы существовали долгие годы, снова и снова залечивая свои раны.
Когда биологическая ткань повреждена, запускаются процессы ее регенерации. Стволовые клетки делятся, превращаясь в обычные соматические (составляющие тело) клетки. Такое «потомство» не только утрачивает плюрипотентность, то есть способность к трансформации (дифференцировке), но и лишается возможности синтезировать теломеразу. Организм, таким образом, позволяет неограниченно делиться только некоторым группам клеток, поскольку в противном случае риск образования раковых опухолей многократно бы увеличивался.
Стволовые клетки эмбриона
Фото: Nissim Benvenisty / Wikimedia
Что же превращает стволовые клетки в обычные? Хотя во всех клетках организма находятся одни и те же гены, в ткани определенного типа часть из них может быть выключена. Например, в нервных тканях мозга, по которым проходят электрические импульсы, работает один набор генов, а в островках Лангерганса, находящихся в поджелудочной железе и производящих инсулин, — другой. Включает и выключает гены система более высокого уровня, состоящая из эпигенетических факторов — молекул, присоединяющихся к ДНК и регулирующих ее функции. Вся совокупность прикрепленных к двойной спирали факторов образует эпигеном, и, естественно, в каждом типе тканей он разный.
Отсюда следует логичный вывод: чтобы превратить клетку обратно в стволовую, нужно изменить ее эпигеном, иными словами, перепрограммировать. Этого можно добиться, внедрив в нее четыре специфических соединения, называемых факторами Яманаки (OSKM — Oct4, Klf4, Sox2 и c-Myc). Они также участвуют в эпигенетической регуляции, поддерживая способность клеток к дифференцировке. Их впервые в 2006 году применил японский исследователь Синъя Яманака, сумевший трансформировать фибробласты в индуцированные стволовые клетки (iPS-клетки). За это в 2012 году ученому присудили Нобелевскую премию.
Они также участвуют в эпигенетической регуляции, поддерживая способность клеток к дифференцировке. Их впервые в 2006 году применил японский исследователь Синъя Яманака, сумевший трансформировать фибробласты в индуцированные стволовые клетки (iPS-клетки). За это в 2012 году ученому присудили Нобелевскую премию.
Яманака фактически омолодил отдельные клетки, перепрограммировав их на эпигенетическом уровне и запустив процесс дедифференцировки. Возникает вопрос: можно ли сделать то же самое с целым организмом, хотя бы с мышью? Проблема в том, что этим мы нарушаем завет «не должно быть много стволовых клеток», поскольку, как уже говорилось, увеличивается риск возникновения рака. Кроме того, не имеет смысла превращать органы и ткани в сгустки однородных iPS-клеток — организм просто погибнет. Еще одна сложность состоит в том, что индуцированные стволовые клетки могут спонтанно развиваться в тератомы (от др.-греч. τέρατος — «чудовище») — опухоли в виде недоразвитых органов, например зубов, глаз или даже мозга.
Однако избежать опухолей, как выяснилось, вполне реально. Так, можно не превращать соматические клетки в стволовые, лишая их функциональности, а лишь кратковременно активировать факторы Яманаки, чтобы слегка омолодить ткани. Для этого ученые создали трансгенных мышей, внедрив в их ДНК кассету с набором следующих друг за другом генов, кодирующих OSKM. Кассета, называемая полицистронной (цистрон — то же самое, что и ген), включается в присутствии полусинтетического антибиотика доксициклина. Тем самым начинают производиться факторы Яманаки. Без антибиотика перепрограммирование прекратится.
Теломераза (зеленые точки) в поджелудочной железе ГМ-мышей
Фото: Maria A. Blasco / CNIO
Испанские исследователи, изучая изменения в теломерах в перепрограммированных мышах, решили не усложнять себе задачу. Для их целей было достаточно активировать полицистронную кассету и проследить, что произойдет с концами хромосом. Наличие тератом и дисплазий в тканях животных свидетельствовало, что перепрограммирование прошло успешно.
Ученые выяснили, что при превращении соматических клеток в стволовые теломеры удлиняются. Это логично, учитывая, что iPS-клетки могут делиться неограниченно долго. Более того, исследователи определили, что важную роль в этом играет теломераза.
До сих пор генетики не располагали доказательствами того, что индуцировать эндогенную теломеразу можно во взрослом организме с помощью эпигенетических факторов. Но именно так все и происходит. Факторы Яманаки, по-видимому, переключают каскады генов, в конце концов активируя удлиняющий теломеры фермент.
Раковые клетки HeLa
Фото: Public Domain / Wikimedia
Подобный процесс сопровождает не только перепрограммирование соматических клеток, но и их озлокачествление. У раковой клетки много общего со стволовыми. Она может неограниченно долго делиться. Самый известный пример — «бессмертные» клетки линии HeLa. Они были выделены в 1951 году из опухоли шейки матки пациентки Генриетты Лакс, умершей в том же году, и до сих пор применяются в многочисленных экспериментах.
Раковые клетки — по сути, тоже перепрограммированные соматические. По мнению ученых, с теломерами в них происходят аналогичные изменения. Поэтому исследования с iPS-клетками позволят выяснить детали молекулярных процессов, протекающих при формировании опухолей.
Перепрограммирование клеток обратило старение и продлило жизнь мышей
Медицина
На мышах
Сложность
6.6
Восстановление мышечной ткани у мышей без (слева) репрограммирования клеток и с ним (справа)
Salk Institute
Американские и испанские ученые обнаружили, что временное «включение»
факторов, преобразующих зрелые клетки в стволовые, способно частично обратить
признаки старения и продлить жизнь у мышей с моделью преждевременного старения
(прогерии) и пожилых обычных животных. Результаты работы опубликованы
Результаты работы опубликованы
в журнале Cell.
Ряд предыдущих работ привели
к фундаментальному открытию, что индукция совместной экспрессии четырех тесно
связанных с основными этапами жизненного цикла клетки факторов транскрипции: Oct4,
Sox2, Klf4 и c-Myc (OSKM, или факторы Яманаки),
переводит зрелые соматические клетки в плюрипотентные стволовые путем
эпигенетической регуляции клеточных процессов. Эти клетки, названные
индуцированными плюрипотентными стволовыми клетками (iPSC), подобно эмбриональным могут
дифференцироваться практически в любые клетки организма. За их получение
Синъя Яманака в 2012 году удостоился Нобелевской премии.
Однако попытки запустить тот же механизм в живых организмах,
а не клеточных культурах, могут привести к печальным последствиям: во-первых, перевод
большого числа зрелых функциональных клеток в плюрипотентные неминуемо приведет
к отказу органов, а во-вторых, бурная пролиферация стволовых клеток вызовет
развитие злокачественных опухолей из эмбриональных тканей — тератом.
Схема перепрограммирования фибробластов в iPSC с помощью OSKM
Yosef Buganim et al., Nature Reviews Genetics, 2013
Поделиться
Чтобы избежать этих осложнений, сотрудники Института Солка с
коллегами провели индукцию экспрессии факторов Яманаки не непрерывно, а
короткими циклами. Для этого они использовали содержащую их полицистронную
кассету (набор генов, который экспрессируется под управлением одного промотора),
которая «включается» под действием доксициклина. В клетки ее вводили при помощи
обезвреженного лентивируса.
На первом этапе экспериментов ученые применили эту методику
к культуре фибробластов мышей с прогерией — генетическим дефектом белка ламина
А, который приводит к быстрому старению организма (люди с этим заболеванием
умирают от старости в возрасте около 10 лет). Введение кассеты OSKM с
последующей обработкой доксициклином в течение от двух до четырех дней вызывало
процессы омоложения клеток: подавляло стрессорные гены сигнального пути p53,
снижало продукцию активных форм кислорода митохондриями, восстанавливало уровни
эпигенетических модификаций h4K9me3 и h5K20me3, отвечающих за состояние
гетерохроматина, и уменьшало число дефектов ДНК. При этом клетки оставались
При этом клетки оставались
дифференцированными: экспрессировали маркер фибробластов Thy1 и не вырабатывали
маркер плюрипотентности Nanog.
Аналогичных результатов удалось добиться на культурах
искусственно состаренных длительным ростом на питательной среде здоровых
фибробластов мыши и человека.
После этого метод опробовали на живых мышах с прогерией,
которым ввели одну копию кассеты. Постоянная индукция экспрессии OSKM приводила
к резкой потере массы тела и смерти спустя в среднем четыре дня. Назначение
доксициклина двухдневными циклами с пятидневным перерывом не производило
подобных эффектов даже после 35 циклов. При этом у животных после шести недель
терапии наблюдалось значительное уменьшение признаков старения кожи, внутренних
органов и иммунной системы, а их средняя продолжительность жизни увеличилась примерно
на 30 процентов. Такая же цикличная индукция, проводимая мышам с двумя копиями OSKM,
приводила к развитию тератом, чего у животных с одной копией не наблюдалось.
Применение цикличной индукции OSKM в мышцах и поджелудочной
железе нормальных пожилых мышей вызвало частичное восстановление возрастной
утраты массы и функций и способности к регенерации этих органов.
«Наша работа показала, что старение не обязательно должно
проходить в одном направлении. Оно обладает пластичностью, и при осторожной
модуляции его можно обратить», — подытожил
старший автор публикации Хуан Карлос Исписуа Бельмонте (Juan Carlos Izpisua
Belmonte).
Продление здоровой жизни и борьба со старением интересует
многих ученых. Значительные успехи в этой области, правда, в экспериментах на
животных, достигнуты путем ограничения потребляемых калорий, ингибирования клеточного
сигнального пути mTOR рапамицином, назначения
никотинамидрибозида, фармакологической «очистки»
организма от старых клеток и пересадки половых
желез молодых особей. Определенные перспективы имеют также эксперименты со
стволовыми клетками и манипуляции с теломерами.
Олег Лищук
Частичное репрограммирование омолодило клетки человека на пять лет
Биология
Медицина
Сложность
3. 1
1
Heiti Paves / Wikimedia Commons
Американские ученые проверили технологию частичного репрограммирования на клетках человека и мыши. Они выяснили, что 2-4 дня работы факторов репрограммирования сдвигают экспрессию генов так, что клетки от пожилых доноров становятся ближе к клеткам от молодых доноров. При этом их эпигенетический возраст также снижается. Кроме того, с помощью репрограммирования удалось обратить и функциональные дефекты — в клетках человеческого хряща и мышиной мышцы. Исследование опубликовано в журнале Nature Communications.
Технология репрограммирования клеток, то есть возвращения к зародышевому состоянию, известна уже почти 15 лет. Она состоит в том, чтобы тем или иным способом запустить в клетках работу четырех факторов транскрипции (факторов Яманаки), которые выключают гены, связанные со специализацией клетки, и она превращается в эмбриональную стволовую — то есть становится универсальным предшественником для любых клеточных типов.
Cтарение сопровождается истощением запасов стволовых клеток в организме, но и те клетки, что не способны делиться, теряют часть своих функций. Поэтому возникла идея омоложения через репрограммирование. Чтобы не превратить ткани в эмбриональные клетки, ученые пытаются использовать частичное репрограммирование, то есть «включать» работу факторов Яманаки на короткое время. Чтобы достичь этого на мышах, исследователи вывели трансгенных животных, у которых экспрессию факторов Яманаки можно было регулировать, добавляя в корм определенное лекарство. И оказалось, что репрограммирование частично способствует омоложению: ученые работали с ускоренно стареющими мышами и смогли продлить их жизнь.
Но с человеком это провернуть невозможно. Не только потому, что никто не рискнет вывести трансгенных людей, но и потому, что мышиные модели ускоренного старения не вполне повторяют человеческие болезни, а те, в свою очередь, не полностью соответствуют нормальному старению. Поэтому, если мы хотим использовать частичное репрограммирование для продления человеческой жизни, необходимо научиться применять эту технологию на обычных человеческих клетках.
За это взялась группа ученых под руководством Томаса Рэндо (Thomas Rando) из Медицинской школы Стэнфордского университета. В своих предыдущих работах исследователи разработали протокол репрограммирования, который не требует встраивания чужеродных генов в ДНК — они просто регулярно вводят в клетки РНК, кодирующие факторы Яманаки. После двух недель этой процедуры клетки превращаются в зародышевые. При этом, по подсчетам исследователей, примерно на пятый день в клетках появляются признаки стволовых клеток: это время они сочли точкой невозврата.
Чтобы достичь частичного репрограммирования, они вводили РНК факторов Яманаки в течение четырех дней в фибробласты и клетки эндотелия (стенки сосудов) человека. Для этого эксперимента они использовали клетки пожилых (60-90 лет) доноров, а затем сравнивали экспрессию генов в репрограммированных клетках с клетками молодых (25-35 лет) доноров. По профилю экспрессии репрограммированные клетки оказались ближе к молодым, чем к старым донорам. В то же время, в репрограммированных клетках исследователи не обнаружили маркеров стволовых клеток — это значит, что они не потеряли свою специализацию.
В то же время, в репрограммированных клетках исследователи не обнаружили маркеров стволовых клеток — это значит, что они не потеряли свою специализацию.
Затем ученые проверили, действительно ли репрограммирование связано с омоложением. Для этого они измерили эпигенетический возраст клеток до и после репрограммирования и обнаружили, что фибробласты пожилых доноров стали моложе в среднем на 1,84 года, а клетки эндотелия — на 4,94. Вместе с этим в них появились и другие признаки клеточной молодости: стало больше протеасом и аутофагосом — машин внутриклеточной «уборки» (p < 0,01), а клетки эндотелия стали выделять меньше провоспалительных молекул.
Свою методику исследователи опробовали и на других типах клеток. Например, они выделили клетки хрящевой ткани из суставов пациентов с остеоартритом. После репрограммирования в этих клетках снизилась экспрессия маркеров воспаления и окислительного стресса, они начали чаще делиться и производить больше энергии (p < 0,05). Затем ученые выделили стволовые клетки из мышц пожилых мышей, частично их репрограммировали и трансплантировали в поврежденные мышцы других пожилых мышей. После этого сила сокращения мышц выросла на треть, то есть стволовые клетки стали более активно участвовать в заживлении поврежденных участков.
После этого сила сокращения мышц выросла на треть, то есть стволовые клетки стали более активно участвовать в заживлении поврежденных участков.
Тем не менее, до начала экспериментов на людях этой технологии предстоит пройти еще множество проверок. Поскольку даже частичное омоложение клеток чревато приобретением способности к делению, исследователям потребуется неоднократно подтвердить, что в результате их манипуляций клетки не становятся опухолевыми. В этой работе ученые измерили длину теломер репрограммированных клеток и показали, что они не стали длиннее, однако для безопасного применения репрограммирования необходимо будет выяснить, не теряют ли клетки своих основных свойств и не получают ли какие-то новые.
Пока история с омоложением только начинает развиваться, технологию репрограммирования уже успешно используют, например, для лечения глазных болезней. А совсем недавно репрограммированные клетки впервые подсадили в сердце пациента. Кроме того, уже есть идеи того, как репрограммирование может помочь в случае бесплодия и болезни Гентингтона.
Полина Лосева
Возраст не помеха. Найден способ радикального омоложения
https://ria.ru/20220318/omolozhenie-1778326312.html
Возраст не помеха. Найден способ радикального омоложения
Возраст не помеха. Найден способ радикального омоложения — РИА Новости, 18.05.2022
Возраст не помеха. Найден способ радикального омоложения
Ученые из США и Испании перепрограммировали клетки мышей и обратили старение вспять. У животных помолодели ткани почек и кожи, причем без каких бы то ни было… РИА Новости, 18.05.2022
2022-03-18T08:00
2022-03-18T08:00
2022-05-18T18:24
наука
биология
здоровье
генетика
старение
синъя яманака
япония
сша
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/155159/83/1551598383_0:319:3072:2047_1920x0_80_0_0_ea67ef115b9d82f17c8005e922b28fc0.jpg
МОСКВА, 18 мар — РИА Новости, Владислав Стрекопытов. Ученые из США и Испании перепрограммировали клетки мышей и обратили старение вспять. У животных помолодели ткани почек и кожи, причем без каких бы то ни было побочных эффектов. Исследователи уверены: со временем эта методика поможет и людям.Клетки зрелые и не оченьЛюбой многоклеточный организм начинается с одной оплодотворенной яйцеклетки. В течение первых циклов деления из нее возникают универсальные, или тотипотентные, клетки, которые затем дифференцируются. Сначала образуются плюрипотентные стволовые клетки, развитие которых может пойти по разным сценариям, а затем — разнообразные унипотентные соматические клетки, отвечающие за определенные функции. Из них уже формируются внутренние органы, сосуды, кожа и прочие ткани.В основном дифференцировка заканчивается на внутриутробной стадии, но некоторое количество незрелых, не до конца дифференцированных стволовых клеток сохраняется на всю жизнь. Они вырабатываются в тканях костного мозга и при определенных условиях способны превратиться в клетки различных органов и тканей.
Ученые из США и Испании перепрограммировали клетки мышей и обратили старение вспять. У животных помолодели ткани почек и кожи, причем без каких бы то ни было побочных эффектов. Исследователи уверены: со временем эта методика поможет и людям.Клетки зрелые и не оченьЛюбой многоклеточный организм начинается с одной оплодотворенной яйцеклетки. В течение первых циклов деления из нее возникают универсальные, или тотипотентные, клетки, которые затем дифференцируются. Сначала образуются плюрипотентные стволовые клетки, развитие которых может пойти по разным сценариям, а затем — разнообразные унипотентные соматические клетки, отвечающие за определенные функции. Из них уже формируются внутренние органы, сосуды, кожа и прочие ткани.В основном дифференцировка заканчивается на внутриутробной стадии, но некоторое количество незрелых, не до конца дифференцированных стволовых клеток сохраняется на всю жизнь. Они вырабатываются в тканях костного мозга и при определенных условиях способны превратиться в клетки различных органов и тканей. Это своего рода ремкомплект на случай повреждений и травм. Чем старше организм, тем меньше в костном мозге стволовых клеток, способных к обновлению. Замедление их производства — следствие физического старения.У растений и некоторых низших форм животных существует обратный процесс — дедифференцировка, когда частично или полностью созревшая клетка возвращается в предыдущее состояние. Чаще всего это происходит при регенерации: например, когда из черенка, пустившего корни, появляется новое растение или отдельная часть тела дает начало новому организму.Ученые давно мечтали запустить процесс аналогичного омоложения клеток у человека или хотя бы для начала у лабораторных животных. Впервые это сделали японцы Синъя Яманака и Кадзутоси Такахаси в 2006-м. С помощью четырех белков, которые потом назовут «коктейль Яманаки» — Oct4, c-Myc, Sox2 и Klf4, они возвратили дифференцированные соматические клетки, фибробласты из кожи мыши, в плюрипотентное состояние. За это в 2012-м Синъя Яманака получил Нобелевскую премию по биологии и медицине.
Это своего рода ремкомплект на случай повреждений и травм. Чем старше организм, тем меньше в костном мозге стволовых клеток, способных к обновлению. Замедление их производства — следствие физического старения.У растений и некоторых низших форм животных существует обратный процесс — дедифференцировка, когда частично или полностью созревшая клетка возвращается в предыдущее состояние. Чаще всего это происходит при регенерации: например, когда из черенка, пустившего корни, появляется новое растение или отдельная часть тела дает начало новому организму.Ученые давно мечтали запустить процесс аналогичного омоложения клеток у человека или хотя бы для начала у лабораторных животных. Впервые это сделали японцы Синъя Яманака и Кадзутоси Такахаси в 2006-м. С помощью четырех белков, которые потом назовут «коктейль Яманаки» — Oct4, c-Myc, Sox2 и Klf4, они возвратили дифференцированные соматические клетки, фибробласты из кожи мыши, в плюрипотентное состояние. За это в 2012-м Синъя Яманака получил Нобелевскую премию по биологии и медицине. Индуцированные (обращенные с помощью коктейля Яманаки) плюрипотентные клетки весьма перспективны в области регенеративной медицины. Размножаясь, они могут давать начало клеткам любого типа — нейронам, клеткам сердца, поджелудочной железы, печени и другим. Перед эмбриональными стволовыми клетками, которые получают из пуповинной крови и используют для лечения рака, диабета первого типа, ДЦП и еще десятков тяжелых заболеваний, у иПСК есть важное преимущество — индивидуальность. Если когда-то биологи научатся управлять их дифференцировкой, можно будет выращивать не только новые ткани, но и целые органы. И решить проблему отторжения при трансплантации.В 2014-м Яманака и Такахаси пересадили пигментный эпителий сетчатки глаза, полученный из иПС-клеток пациентки. В Японии после этого запустили государственную программу создания банков иПСК, которая предусматривает, что каждый человек будет держать в таком банке «неприкосновенный запас» собственных стволовых клеток.Назад в молодостьТеоретически можно взять любую клетку у взрослого или даже пожилого человека и перепрограммировать ее для радикального омоложения.
Индуцированные (обращенные с помощью коктейля Яманаки) плюрипотентные клетки весьма перспективны в области регенеративной медицины. Размножаясь, они могут давать начало клеткам любого типа — нейронам, клеткам сердца, поджелудочной железы, печени и другим. Перед эмбриональными стволовыми клетками, которые получают из пуповинной крови и используют для лечения рака, диабета первого типа, ДЦП и еще десятков тяжелых заболеваний, у иПСК есть важное преимущество — индивидуальность. Если когда-то биологи научатся управлять их дифференцировкой, можно будет выращивать не только новые ткани, но и целые органы. И решить проблему отторжения при трансплантации.В 2014-м Яманака и Такахаси пересадили пигментный эпителий сетчатки глаза, полученный из иПС-клеток пациентки. В Японии после этого запустили государственную программу создания банков иПСК, которая предусматривает, что каждый человек будет держать в таком банке «неприкосновенный запас» собственных стволовых клеток.Назад в молодостьТеоретически можно взять любую клетку у взрослого или даже пожилого человека и перепрограммировать ее для радикального омоложения. В пользу этого говорят исследования теломеров — концевых участков хромосом, длина которых служит индикатором потенциала здоровья и долголетия.После перепрограммирования длина теломеров восстанавливалась вплоть до эмбрионального уровня, а затем, по мере дифференцировки иПСК, обратно в соматические клетки — ученые наблюдали их нормальное естественное укорачивание. Более того, омолаживались и митохондрии иПСК, восстанавливался уровень дыхания, характерный для молодых клеток.В 2020-м исследователи из Стэнфордского университета в экспериментах на мышах доказали, что клетки пожилой особи, подвергшиеся воздействию факторов Яманаки, могут омолодиться так, что их не отличить от более молодых аналогов.Однако ученые обнаружили несколько побочных эффектов. Перепрограммированные клетки на поверку оказались довольно опасными: легко разрастались в опухоли типа тератомы. Кроме того, из-за диссонанса в темпах развития омоложенных и окружающих их старых клеток инъекции иПСК часто приводили к аутоиммунным реакциям.
В пользу этого говорят исследования теломеров — концевых участков хромосом, длина которых служит индикатором потенциала здоровья и долголетия.После перепрограммирования длина теломеров восстанавливалась вплоть до эмбрионального уровня, а затем, по мере дифференцировки иПСК, обратно в соматические клетки — ученые наблюдали их нормальное естественное укорачивание. Более того, омолаживались и митохондрии иПСК, восстанавливался уровень дыхания, характерный для молодых клеток.В 2020-м исследователи из Стэнфордского университета в экспериментах на мышах доказали, что клетки пожилой особи, подвергшиеся воздействию факторов Яманаки, могут омолодиться так, что их не отличить от более молодых аналогов.Однако ученые обнаружили несколько побочных эффектов. Перепрограммированные клетки на поверку оказались довольно опасными: легко разрастались в опухоли типа тератомы. Кроме того, из-за диссонанса в темпах развития омоложенных и окружающих их старых клеток инъекции иПСК часто приводили к аутоиммунным реакциям. Специалисты из США и Испании под руководством профессора института Солка Хуана Карлоса Исписуа Бельмонте решили проверить, зависит ли риск негативных побочных реакций от длительности перепрограммирования и какой дозы достаточно для эффекта омоложения. Результаты исследования недавно опубликовали в журнале Nature Aging.Ученые создали генетически модифицированных мышей, у которых работал в ДНК регуляторный участок, запускающий в присутствии антибиотика доксициклина экспрессию факторов Яманаки. Одним мышам вводили доксициклин с 12-го по 22-й месяц жизни, другим — с 15-го по 22-й, а третьим — только один месяц, когда им было уже больше двух лет. Если сравнивать с людьми, то это, соответственно, — с 35 до 70, с 50 до 70 и после 80 лет.Исследователи проанализировали показатели старения у подопытных животных, сравнили их с контролем. И обнаружили, что в конце эксперимента мыши из первых двух групп по многим эпигенетическим параметрам напоминают молодых животных. Особенно отчетливо омоложение проявилось в клетках кожи и печени: регенерация кожи шла быстрее, чем у ровесников из контрольной группы, а в крови снизились уровни метаболических маркеров возрастных изменений, воспаления и стресса.
Специалисты из США и Испании под руководством профессора института Солка Хуана Карлоса Исписуа Бельмонте решили проверить, зависит ли риск негативных побочных реакций от длительности перепрограммирования и какой дозы достаточно для эффекта омоложения. Результаты исследования недавно опубликовали в журнале Nature Aging.Ученые создали генетически модифицированных мышей, у которых работал в ДНК регуляторный участок, запускающий в присутствии антибиотика доксициклина экспрессию факторов Яманаки. Одним мышам вводили доксициклин с 12-го по 22-й месяц жизни, другим — с 15-го по 22-й, а третьим — только один месяц, когда им было уже больше двух лет. Если сравнивать с людьми, то это, соответственно, — с 35 до 70, с 50 до 70 и после 80 лет.Исследователи проанализировали показатели старения у подопытных животных, сравнили их с контролем. И обнаружили, что в конце эксперимента мыши из первых двух групп по многим эпигенетическим параметрам напоминают молодых животных. Особенно отчетливо омоложение проявилось в клетках кожи и печени: регенерация кожи шла быстрее, чем у ровесников из контрольной группы, а в крови снизились уровни метаболических маркеров возрастных изменений, воспаления и стресса. У пожилых животных из третьей группы, получавших лечение всего один месяц, таких изменений не зафиксировали.По мнению авторов, все это говорит о том, что перепрограммирование клеток не просто останавливает старение, а обращает его вспять — но только при длительном воздействии иПСК. Исследователи доказали и безопасность нового способа: среди участвовавших в эксперименте животных не зафиксировали ни одного случая рака, изменений клеток крови или неврологических нарушений.Ученые планируют продолжить исследования, чтобы использовать созданный ими метод для улучшения функций отдельных органов, таких как сердце или мозг. Кроме того, они разрабатывают новые более безопасные способы доставки факторов генетического омоложения клеток в живой организм.
У пожилых животных из третьей группы, получавших лечение всего один месяц, таких изменений не зафиксировали.По мнению авторов, все это говорит о том, что перепрограммирование клеток не просто останавливает старение, а обращает его вспять — но только при длительном воздействии иПСК. Исследователи доказали и безопасность нового способа: среди участвовавших в эксперименте животных не зафиксировали ни одного случая рака, изменений клеток крови или неврологических нарушений.Ученые планируют продолжить исследования, чтобы использовать созданный ими метод для улучшения функций отдельных органов, таких как сердце или мозг. Кроме того, они разрабатывают новые более безопасные способы доставки факторов генетического омоложения клеток в живой организм.
https://ria.ru/20201126/molodost-1586487515.html
https://ria.ru/20210718/koronavirus-1741736828.html
япония
сша
испания
РИА Новости
1
5
4.7
96
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
2022
Владислав Стрекопытов
Владислав Стрекопытов
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
1920
1080
true
1920
1440
true
https://cdnn21.img.ria.ru/images/155159/83/1551598383_540:299:2872:2048_1920x0_80_0_0_de241265c1c09412b6d841daeb559217.jpg
1920
1920
true
РИА Новости
1
5
4.7
96
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Владислав Стрекопытов
биология, здоровье, генетика, старение, синъя яманака, япония, сша, испания, стэнфордский университет
Наука, биология, Здоровье, генетика, Старение, Синъя Яманака, Япония, США, Испания, Стэнфордский университет
МОСКВА, 18 мар — РИА Новости, Владислав Стрекопытов. Ученые из США и Испании перепрограммировали клетки мышей и обратили старение вспять. У животных помолодели ткани почек и кожи, причем без каких бы то ни было побочных эффектов. Исследователи уверены: со временем эта методика поможет и людям.
Ученые из США и Испании перепрограммировали клетки мышей и обратили старение вспять. У животных помолодели ткани почек и кожи, причем без каких бы то ни было побочных эффектов. Исследователи уверены: со временем эта методика поможет и людям.
Клетки зрелые и не очень
Любой многоклеточный организм начинается с одной оплодотворенной яйцеклетки. В течение первых циклов деления из нее возникают универсальные, или тотипотентные, клетки, которые затем дифференцируются. Сначала образуются плюрипотентные стволовые клетки, развитие которых может пойти по разным сценариям, а затем — разнообразные унипотентные соматические клетки, отвечающие за определенные функции. Из них уже формируются внутренние органы, сосуды, кожа и прочие ткани.
В основном дифференцировка заканчивается на внутриутробной стадии, но некоторое количество незрелых, не до конца дифференцированных стволовых клеток сохраняется на всю жизнь. Они вырабатываются в тканях костного мозга и при определенных условиях способны превратиться в клетки различных органов и тканей. Это своего рода ремкомплект на случай повреждений и травм. Чем старше организм, тем меньше в костном мозге стволовых клеток, способных к обновлению. Замедление их производства — следствие физического старения.
Это своего рода ремкомплект на случай повреждений и травм. Чем старше организм, тем меньше в костном мозге стволовых клеток, способных к обновлению. Замедление их производства — следствие физического старения.
У растений и некоторых низших форм животных существует обратный процесс — дедифференцировка, когда частично или полностью созревшая клетка возвращается в предыдущее состояние. Чаще всего это происходит при регенерации: например, когда из черенка, пустившего корни, появляется новое растение или отдельная часть тела дает начало новому организму.
Ученые давно мечтали запустить процесс аналогичного омоложения клеток у человека или хотя бы для начала у лабораторных животных. Впервые это сделали японцы Синъя Яманака и Кадзутоси Такахаси в 2006-м. С помощью четырех белков, которые потом назовут «коктейль Яманаки» — Oct4, c-Myc, Sox2 и Klf4, они возвратили дифференцированные соматические клетки, фибробласты из кожи мыши, в плюрипотентное состояние. За это в 2012-м Синъя Яманака получил Нобелевскую премию по биологии и медицине.
© Иллюстрация РИА НовостиСоматические клетки взрослого человека после перепрограммирования приобретают свойства плюрипотентных стволовых клеток
© Иллюстрация РИА Новости
Соматические клетки взрослого человека после перепрограммирования приобретают свойства плюрипотентных стволовых клеток
Индуцированные (обращенные с помощью коктейля Яманаки) плюрипотентные клетки весьма перспективны в области регенеративной медицины. Размножаясь, они могут давать начало клеткам любого типа — нейронам, клеткам сердца, поджелудочной железы, печени и другим. Перед эмбриональными стволовыми клетками, которые получают из пуповинной крови и используют для лечения рака, диабета первого типа, ДЦП и еще десятков тяжелых заболеваний, у иПСК есть важное преимущество — индивидуальность. Если когда-то биологи научатся управлять их дифференцировкой, можно будет выращивать не только новые ткани, но и целые органы. И решить проблему отторжения при трансплантации.
В 2014-м Яманака и Такахаси пересадили пигментный эпителий сетчатки глаза, полученный из иПС-клеток пациентки. В Японии после этого запустили государственную программу создания банков иПСК, которая предусматривает, что каждый человек будет держать в таком банке «неприкосновенный запас» собственных стволовых клеток.
В Японии после этого запустили государственную программу создания банков иПСК, которая предусматривает, что каждый человек будет держать в таком банке «неприкосновенный запас» собственных стволовых клеток.
Назад в молодость
Теоретически можно взять любую клетку у взрослого или даже пожилого человека и перепрограммировать ее для радикального омоложения. В пользу этого говорят исследования теломеров — концевых участков хромосом, длина которых служит индикатором потенциала здоровья и долголетия.
После перепрограммирования длина теломеров восстанавливалась вплоть до эмбрионального уровня, а затем, по мере дифференцировки иПСК, обратно в соматические клетки — ученые наблюдали их нормальное естественное укорачивание. Более того, омолаживались и митохондрии иПСК, восстанавливался уровень дыхания, характерный для молодых клеток.
В 2020-м исследователи из Стэнфордского университета в экспериментах на мышах доказали, что клетки пожилой особи, подвергшиеся воздействию факторов Яманаки, могут омолодиться так, что их не отличить от более молодых аналогов.
Однако ученые обнаружили несколько побочных эффектов. Перепрограммированные клетки на поверку оказались довольно опасными: легко разрастались в опухоли типа тератомы. Кроме того, из-за диссонанса в темпах развития омоложенных и окружающих их старых клеток инъекции иПСК часто приводили к аутоиммунным реакциям.
26 ноября 2020, 17:36Наука
Раскрыта тайна вечной молодости стволовых клеток
Специалисты из США и Испании под руководством профессора института Солка Хуана Карлоса Исписуа Бельмонте решили проверить, зависит ли риск негативных побочных реакций от длительности перепрограммирования и какой дозы достаточно для эффекта омоложения. Результаты исследования недавно опубликовали в журнале Nature Aging.
Ученые создали генетически модифицированных мышей, у которых работал в ДНК регуляторный участок, запускающий в присутствии антибиотика доксициклина экспрессию факторов Яманаки. Одним мышам вводили доксициклин с 12-го по 22-й месяц жизни, другим — с 15-го по 22-й, а третьим — только один месяц, когда им было уже больше двух лет. Если сравнивать с людьми, то это, соответственно, — с 35 до 70, с 50 до 70 и после 80 лет.
Если сравнивать с людьми, то это, соответственно, — с 35 до 70, с 50 до 70 и после 80 лет.
Исследователи проанализировали показатели старения у подопытных животных, сравнили их с контролем. И обнаружили, что в конце эксперимента мыши из первых двух групп по многим эпигенетическим параметрам напоминают молодых животных. Особенно отчетливо омоложение проявилось в клетках кожи и печени: регенерация кожи шла быстрее, чем у ровесников из контрольной группы, а в крови снизились уровни метаболических маркеров возрастных изменений, воспаления и стресса. У пожилых животных из третьей группы, получавших лечение всего один месяц, таких изменений не зафиксировали.
По мнению авторов, все это говорит о том, что перепрограммирование клеток не просто останавливает старение, а обращает его вспять — но только при длительном воздействии иПСК. Исследователи доказали и безопасность нового способа: среди участвовавших в эксперименте животных не зафиксировали ни одного случая рака, изменений клеток крови или неврологических нарушений.
Ученые планируют продолжить исследования, чтобы использовать созданный ими метод для улучшения функций отдельных органов, таких как сердце или мозг. Кроме того, они разрабатывают новые более безопасные способы доставки факторов генетического омоложения клеток в живой организм.
18 июля 2021, 12:34Распространение коронавируса
В Израиле разработали препарат от коронавируса на основе стволовых клеток
Эмбриональные клетки используют факторы Яманаки, чтобы бросить вызов гравитации развития | Институт биологии стволовых клеток и регенеративной медицины
20 февраля 2021 г.
Кристофер Вон
Уже давно общепризнанным принципом развития является то, что клетки дают начало другим клеткам, имеющим такой же или меньший потенциал для производства различных видов тканей. . Эмбриональные стволовые клетки могут дать начало стволовым клеткам крови и нервным стволовым клеткам, но нервные стволовые клетки никогда не дадут начало клеткам крови и иммунным клеткам вне лаборатории. Конрад Уоддингтон прекрасно проиллюстрировал этот процесс своим знаменитым пейзажем, изображающим шар, изображающий клетку, которая может скатиться с холма и направиться в ту или иную долину (ту или иную судьбу клетки). Но как только она выбрала путь крови и иммунитета, например, клетка не может перепрыгнуть через гребень в следующую долину и стать, например, мышечной клеткой. Считается, что в природе судьбы клеток постепенно ограничиваются — все остальное было бы подобно мячу, начинающему катиться в гору.
Конрад Уоддингтон прекрасно проиллюстрировал этот процесс своим знаменитым пейзажем, изображающим шар, изображающий клетку, которая может скатиться с холма и направиться в ту или иную долину (ту или иную судьбу клетки). Но как только она выбрала путь крови и иммунитета, например, клетка не может перепрыгнуть через гребень в следующую долину и стать, например, мышечной клеткой. Считается, что в природе судьбы клеток постепенно ограничиваются — все остальное было бы подобно мячу, начинающему катиться в гору.
Теперь, однако, исследователи в лаборатории ученого института Джоанны Высоцкой, доктора философии, с некоторой помощью лаборатории директора института Ирва Вайсмана, доктора медицины, показали, что некоторые ранние клетки могут эффективно игнорировать эпигенетическую гравитацию, сворачивая ландшафт Уоддингтона. и становится более плюрипотентным, а не менее. И, возможно, столь же удивительно, что клетки делают это, используя факторы, которые, как ранее показал Шинья Яманака, могут создавать плюрипотентные клетки в лаборатории. Работа Яманаки, которая принесла ему Нобелевскую премию, никогда не показывала, что она управляет развивающимися организмами. Высоцкая и ее коллеги недавно опубликовали свою работу в Journal Science.
Работа Яманаки, которая принесла ему Нобелевскую премию, никогда не показывала, что она управляет развивающимися организмами. Высоцкая и ее коллеги недавно опубликовали свою работу в Journal Science.
Лаборатория Высоцки долгое время изучала группу клеток раннего эмбриона, называемую нервным гребнем, сосредоточив внимание на определенной части, которая дает начало лицу. Клетки нервного гребня уже выбрали свой путь вниз по ландшафту Уоддингтона, чтобы стать эктодермой, дающей начало клеткам нервной системы. Эта эктодермальная ткань не должна давать начало мышечной, костной и соединительной ткани, которые обычно происходят из другого типа ткани, называемого мезодермой.
«Были некоторые идеи о том, как клетки нервного гребня могут дать начало очень разным типам клеток лица, например, возможно, существует небольшое подмножество клеток, которые сохранили свою плюрипотентность и способность производить мезенхимальные ткани», — сказал Высоцкая. .
Понимание того, что происходит, пришло после того, как исследователи начали проводить секвенирование РНК одиночных клеток в клетках нервного гребня, что позволило им посмотреть, какие белки вырабатывались конкретными клетками в разные периоды развития.
Знаменитый писатель Айзек Азимов однажды сказал, что самая захватывающая фраза, которую можно услышать в науке, та, которая предвещает новые открытия, — это не «Эврика!» но «это забавно…» Антуан Залк, доктор философии, научный сотрудник лаборатории Высоцкой и ведущий автор научной статьи, заметил нечто, что сначала показалось странным совпадением. «Я рассказывал о наших данных и отметил, что, как ни странно, эти клетки нервного гребня продуцируют Oct4 и Nanog», — сказал Залк, назвав два широко известных фактора, которые, как показал Яманака, можно использовать для трансформации зрелых клеток в плюрипотентные клетки в лаборатории.
Высоцка побудил его продолжить это наблюдение, и после гораздо большего секвенирования и анализа отдельных клеток, проведенного с Рахулом Синха, доктором философии и студентом-медиком Гунсагаром Гулати из лаборатории Вейсмана, они показали, что небольшое подмножество клеток в нервном гребне может сами экспрессируют факторы Яманака и обращают вспять процесс дифференцировки, превращаясь в клетки, которые могут дать начало клеткам, которые они не могли производить раньше. На какое-то время мяч Уоддингтона действительно может бросить вызов гравитации и катиться вверх по склону.
На какое-то время мяч Уоддингтона действительно может бросить вызов гравитации и катиться вверх по склону.
«Меня также удивляет, что клетки делают это, используя коктейль факторов Яманака», — сказал Высоцкая. «Вы могли бы подумать, что если увеличение плюрипотентности возможно, то может быть много других способов сделать это, но это предполагает, что в четырех факторах есть что-то универсальное, чего трудно достичь в других контекстах».
Теперь исследователь задается вопросом, что это означает для нашего понимания развития и других биологических процессов. «Эта работа меняет правила игры», — сказал Вайсман.
«Нервный гребень в процессе развития несколько уникален, но мне интересно, происходит ли эта реактивация более ранних генных программ в других случаях, например, при регенерации», — говорит Высоцка.
«Это свидетельствует о том, что совместная работа вычислительных и лабораторных биологов может привести к захватывающим открытиям.
Высоцка отмечает, что были наблюдения, что иногда факторы Яманаки, такие как Oct4, были обнаружены в раковых клетках, и это не принималось во внимание как Это несущественный признак того, насколько разрегулированными стали раковые клетки. «Теперь мы думаем, что, возможно, в некоторых случаях экспрессия этих факторов в раковых клетках может помочь им адаптироваться и колонизировать новые ниши», — сказала она.0003
«Теперь мы думаем, что, возможно, в некоторых случаях экспрессия этих факторов в раковых клетках может помочь им адаптироваться и колонизировать новые ниши», — сказала она.0003
Исследователи отмечают, что необходимо провести дополнительную работу, чтобы понять молекулярный процесс, происходящий в клетках нервного гребня в ответ на действие факторов Яманака. Более глубокое понимание того, как природа использует эти факторы, может привести к новым возможностям и более точному контролю их использования в лаборатории.
Исследователи также отмечают, что эта работа является свидетельством преимуществ междисциплинарных исследований. «В целом этому проекту очень помогло сотрудничество между различными лабораториями и дисциплинами», — сказал Гулати, который получает степень доктора медицины, а также докторскую степень в области биологии рака с упором на вычислительную биологию. «Это свидетельство того, как совместная работа вычислительных и лабораторных биологов может привести к захватывающим открытиям».
Другими исследователями из Стэнфорда, участвовавшими в работе, были Томек Свигут, старший научный сотрудник лаборатории Высоцкой, и Даниэль Веше, аспирант программы ISCBRM.
К исследованиям также были привлечены кафедры химической и системной биологии и биологии развития.
Ссылка: прочтите статью в журнале Science
Факторы Яманаки критически регулируют сигнальную сеть развития в эмбриональных стволовых клетках мыши
. 2008 Декабрь; 18 (12): 1177-89.
doi: 10.1038/cr.2008.309.
Сяосун Лю
1
, Цзиньян Хуан, Таотао Чен, Ин Ван, Шунмей Синь, Цзянь Ли, Ган Пей, Цзюхун Кан
Принадлежности
принадлежность
- 1 Лаборатория молекулярной клеточной биологии, Институт биохимии и клеточной биологии, Шанхайский институт биологических наук, Китайская академия наук, Шанхай 200031, Китай.

PMID:
1
24
DOI:
10.1038/кр.2008.309
Сяосун Лю и др.
Сотовый рез.
2008 декабрь
. 2008 Декабрь; 18 (12): 1177-89.
doi: 10.1038/cr.2008.309.
Авторы
Сяосун Лю
1
, Цзиньян Хуан, Таотао Чен, Ин Ван, Шунмей Синь, Цзянь Ли, Ган Пей, Цзюхун Кан
принадлежность
- 1 Лаборатория молекулярной клеточной биологии, Институт биохимии и клеточной биологии, Шанхайский институт биологических наук, Китайская академия наук, Шанхай 200031, Китай.

PMID:
1
24
DOI:
10.1038/кр.2008.309
Абстрактный
Факторы Яманаки (Oct3/4, Sox2, Klf4, c-Myc) в высокой степени экспрессируются в эмбриональных стволовых (ES) клетках, и их сверхэкспрессия может вызывать плюрипотентность как в соматических клетках мыши, так и в соматических клетках человека, что указывает на то, что эти факторы регулируют передачу сигналов в процессе развития. сеть, необходимая для плюрипотентности ЭС клеток. Однако системный анализ сигнальных путей, регулируемых факторами Яманаки, до сих пор полностью не описан. В этом исследовании мы идентифицировали целевые промоторы эндогенных факторов Яманаки в масштабе всего генома, используя ChIP (иммунопреципитация хроматина) на чипе в клетках ES мыши E14. 1, и мы обнаружили, что эти четыре фактора совместно занимали 58 промоторов. Интересно, что когда Oct4 и Sox2 были проанализированы как основные факторы, Klf4 функционировал, усиливая основные факторы регуляции развития, тогда как c-Myc, по-видимому, играет отчетливую роль в регуляции метаболизма. Анализ путей показал, что факторы Yamanaka коллективно регулируют сеть онтогенетических сигналов, состоящую из 16 онтогенетических сигнальных путей, девять из которых представляют ранее неизвестные пути в ES клетках, включая пути апоптоза и клеточного цикла. Далее мы проанализировали данные недавнего исследования факторов Яманаки в мышиных ES клетках. Интересно, что этот анализ также выявил 16 сигнальных путей развития, из которых 14 путей перекрываются с путями, обнаруженными в этом исследовании, несмотря на то, что гены-мишени и сигнальные пути, регулируемые каждым отдельным фактором Яманаки, значительно различаются между этими двумя наборами данных. Мы предполагаем, что факторы Yamanaka критически регулируют онтогенетическую сигнальную сеть, состоящую примерно из дюжины важных онтогенетических сигнальных путей, для поддержания плюрипотентности ES клеток и, возможно, также для индукции плюрипотентных стволовых клеток.
1, и мы обнаружили, что эти четыре фактора совместно занимали 58 промоторов. Интересно, что когда Oct4 и Sox2 были проанализированы как основные факторы, Klf4 функционировал, усиливая основные факторы регуляции развития, тогда как c-Myc, по-видимому, играет отчетливую роль в регуляции метаболизма. Анализ путей показал, что факторы Yamanaka коллективно регулируют сеть онтогенетических сигналов, состоящую из 16 онтогенетических сигнальных путей, девять из которых представляют ранее неизвестные пути в ES клетках, включая пути апоптоза и клеточного цикла. Далее мы проанализировали данные недавнего исследования факторов Яманаки в мышиных ES клетках. Интересно, что этот анализ также выявил 16 сигнальных путей развития, из которых 14 путей перекрываются с путями, обнаруженными в этом исследовании, несмотря на то, что гены-мишени и сигнальные пути, регулируемые каждым отдельным фактором Яманаки, значительно различаются между этими двумя наборами данных. Мы предполагаем, что факторы Yamanaka критически регулируют онтогенетическую сигнальную сеть, состоящую примерно из дюжины важных онтогенетических сигнальных путей, для поддержания плюрипотентности ES клеток и, возможно, также для индукции плюрипотентных стволовых клеток.
Похожие статьи
Более синергетическое взаимодействие факторов Яманаки в индуцированных плюрипотентных стволовых клетках, чем в эмбриональных стволовых клетках.
Хуан Дж., Чен Т., Лю Х, Цзян Дж., Ли Дж., Ли Д., Лю Х.С., Ли В., Кан Дж., Пей Г.
Хуан Дж. и др.
Сотовый рез. 2009 Октябрь; 19 (10): 1127-38. doi: 10.1038/cr.2009.106. Epub 2009 8 сентября.
Сотовый рез. 2009.PMID: 19736564
МикроРНК-145 регулирует OCT4, SOX2 и KLF4 и подавляет плюрипотентность в эмбриональных стволовых клетках человека.
Сюй Н., Папагианнакопулос Т., Пан Г., Томсон Дж. А., Косик К. С.
Сюй Н и др.
Клетка. 2009 15 мая; 137 (4): 647-58. doi: 10.1016/j.cell.2009.02.038. Epub 2009, 30 апреля.
Клетка. 2009.PMID: 19409607
Индуцированная плюрипотентность с эндогенными и индуцибельными генами.

Дуинсберген Д., Эрикссон М., ‘т Хоэн П.А., Фрисен Дж., Миккерс Х.
Дуинсберген Д. и соавт.
Разрешение ячейки опыта. 2008 15 октября; 314 (17): 3255-63. doi: 10.1016/j.yexcr.2008.06.024. Epub 2008 9 июля.
Разрешение ячейки опыта. 2008.PMID: 18656469
Индуцированные мышами плюрипотентные стволовые клетки.
Геохеган Э., Бирнс Л.
Геохеган Э. и др.
Int J Dev Biol. 2008;52(8):1015-22. doi: 10.1387/ijdb.082640eg.
Int J Dev Biol. 2008.PMID: 18956334
Обзор.
[Индукция и характеристика индуцированных плюрипотентных стволовых (iPS) клеток: обзор].
Ченг Д., Лэй Л., Лу З., Ли З., Ван Х.
Ченг Д. и др.
Шэн Ву Гун Ченг Сюэ Бао. 2010 апр; 26 (4): 421-30.
Шэн Ву Гун Ченг Сюэ Бао. 2010.
2010.PMID: 20575428
Обзор.
Китайский язык.
Посмотреть все похожие статьи
Цитируется
Углеродные квантовые точки для визуализации стволовых клеток и решения судьбы дифференцировки стволовых клеток.
Маджуд М., Гарг П., Чаурасия Р., Агарвал А., Моханти С., Мукерджи М.
Маджуд М. и др.
АСУ Омега. 2022 11 августа; 7(33):28685-28693. doi: 10.1021/acsomega.2c03285. Электронная коллекция 2022 23 августа.
АСУ Омега. 2022.PMID: 36033677
Бесплатная статья ЧВК.Обзор.
Биология островков во время COVID-19: прогресс и перспективы.
Дос Сантос Т., Галипо М., Шукаруча Гомес А., Гринберг М., Ларсен М., Ли Д., Магера Дж., Мулчандани К.М., Паттон М.
 , Перера И., Полишевска К., Рамдасс С., Шайеганпур К., Вафаеян К., Ван Аллен К., Ван Ю, Вайс Т, Эстолл Дж. Л., Малвихилл Э. Э., Скритон Р. А.; Diabetes Action Canada и Канадская сеть исследований и обучения островков.
, Перера И., Полишевска К., Рамдасс С., Шайеганпур К., Вафаеян К., Ван Аллен К., Ван Ю, Вайс Т, Эстолл Дж. Л., Малвихилл Э. Э., Скритон Р. А.; Diabetes Action Canada и Канадская сеть исследований и обучения островков.
Дос Сантос Т. и др.
Может ли диабет. 2022 июнь;46(4):419-427. doi: 10.1016/j.jcjd.2021.11.002. Epub 2021 23 ноября.
Может ли диабет. 2022.PMID: 35589534
Бесплатная статья ЧВК.Обзор.
Расшифровка эпигенома сетчатки во время развития, болезни и перепрограммирования: достижения, проблемы и перспективы.
Зибетти К.
Зибетти С.
Клетки. 2022 25 февраля; 11 (5): 806. doi: 10.3390/cells11050806.
Клетки. 2022.PMID: 35269428
Бесплатная статья ЧВК.Обзор.
LncRNA IPW ингибирует рост протоковой карциномы in situ путем подавления ID2 через miR-29c.

Дешпанде Р.П., Шарма С., Лю Ю., Пандей П.Р., Пей Х., Ву К., Ву С.И., Тяги А., Чжао Д., Мо Ю.Ю., Ватабе К.
Дешпанде Р.П. и соавт.
Рак молочной железы Res. 2022 25 января; 24(1):6. doi: 10.1186/s13058-022-01504-4.
Рак молочной железы Res. 2022.PMID: 35078502
Бесплатная статья ЧВК.Комбинация эстрадиола с фактором, ингибирующим лейкемию, стимулирует дифференцировку клеток гранулезы в ооцитоподобные клетки.
Юсефи С., Акбарзаде М., Сулейманирад Дж., Хамди К., Фарзади Л., Гасемзаде А., Махдипур М., Рахбаргази Р., Нури М.
Юсефи С. и др.
Ад Фарм Булл. 2021 сен; 11 (4): 712-718. doi: 10.34172/apb.2021.080. Epub 2020 26 июля.
Ад Фарм Булл. 2021.PMID: 34888218
Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Факторы Яманаки и частичное клеточное перепрограммирование
Сегодня мы ведем хронику прогресса частичного клеточного перепрограммирования и обсуждаем, как эта мощная техника может быть способна перепрограммировать клетки обратно в юношеское состояние, по крайней мере частично обращая вспять эпигенетические изменения, одно из предложенных причины, по которым мы стареем.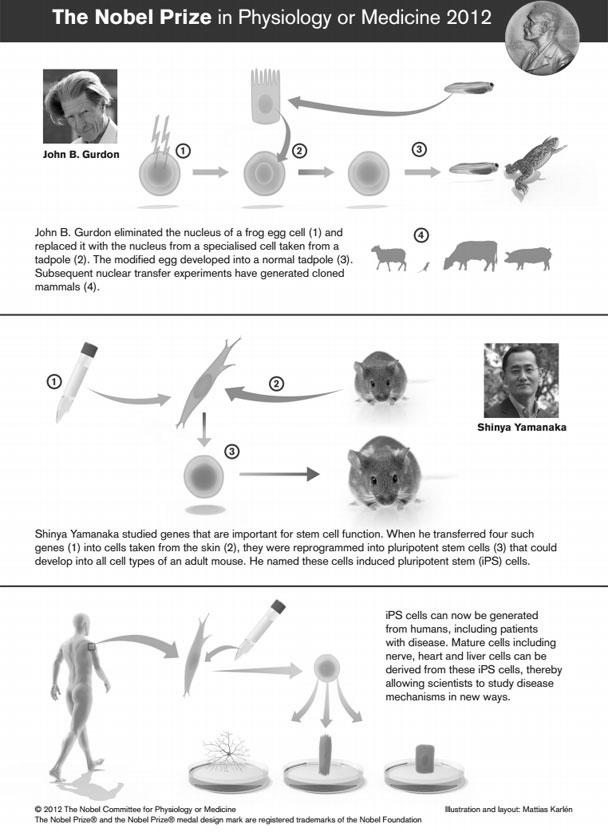
Факторы Яманаки и рождение частичного клеточного перепрограммирования
В 2006 году исследование доктора. Казутоши и Синья Яманака показали, что можно перепрограммировать клетки, используя всего четыре основных гена, названных Oct4, Sox2, Klf4 и c-Myc, или сокращенно OSKM [1]. Эти четыре фактора перепрограммирования часто называют факторами Яманаки в честь одного из их первооткрывателей.
До этого предполагалось, что яйцеклетки (ооциты) будут содержать сложный набор факторов, необходимых для перепрограммирования соматической клетки в эмбриональную клетку. В конце концов, трансформация состарившейся яйцеклетки и ее перепрограммирование для создания нового животного должны контролироваться многими факторами, присутствующими в яйцеклетке, по крайней мере, они так думали. Такахаши и Яманака перевернули эту идею с ног на голову, когда показали, что для достижения этой трансформации необходимы всего четыре фактора Яманаки.
Они использовали факторы Яманаки для перепрограммирования фибробластов взрослых мышей (клеток соединительной ткани) обратно в эмбриональное состояние, называемое плюрипотентностью, состояние, при котором клетка ведет себя как эмбриональная стволовая клетка и может стать любым другим типом клеток в организме.
Это открытие проложило путь к исследованиям того, как эти факторы Яманаки можно использовать для клеточного омоложения и потенциального способа борьбы с возрастными заболеваниями.
Факторы Яманаки для клеточного и животного омоложения
В 2011 году группа французских исследователей, в том числе Жан-Марк Леметр, впервые сообщила об клеточном омоложении с использованием факторов Яманаки [2]. В течение своей жизни клетки экспрессируют различные паттерны генов, и эти паттерны уникальны для каждой фазы жизни клетки от молодых до старых; этот профиль экспрессии генов позволяет легко идентифицировать старую или молодую клетку. В то время также было известно, что стареющие клетки, такие как фибробласты, имеют короткие теломеры и дисфункциональные митохондрии, две из девяти причин, по которым мы стареем [3].
Жан-Марк Леметр и его коллеги проверили влияние факторов Яманаки на старые фибробласты здоровых пожилых людей, а также здоровых людей старше 100 лет. Они добавили два дополнительных плюрипотентных генетических фактора в смесь OSKM, а именно NANOG и LIN28, и изучили влияние, которое это оказало на экспрессию генов, теломеры и митохондрии этих пожилых людей.
Они обнаружили, что вместе шесть факторов способны возвращать клетки старых доноров обратно в плюрипотентное состояние, а это означает, что они могут стать клетками любого другого типа в организме. Они стали известны как индуцированные плюрипотентные стволовые клетки (ИПСК).
Исследователи отметили, что клетки имели более высокую скорость роста, чем состарившиеся клетки, из которых они были перепрограммированы; у них также были более длинные теломеры, а также митохондрии, которые вели себя по-юношески и больше не были дисфункциональными. Другими словами, перепрограммирование клеток обратило вспять некоторые аспекты старения и вернуло клетки обратно в то же состояние, что и во время развития.
Факторы Яманаки, по-видимому, обращают вспять эпигенетическое старение
Последним шагом исследователей было направить эти иПСК, чтобы они снова стали фибробластами, используя другие факторы перепрограммирования. В результате эти перепрограммированные фибробласты больше не экспрессировали паттерны генов, связанные со старыми клетками, и имели профиль экспрессии генов, неотличимый от профилей молодых фибробластов. По сути, они показали, что эпигенетические изменения (изменения в паттернах экспрессии генов), являющиеся причиной нашего старения, обратились вспять.
В дополнение к этому они также показали, что длина теломер, функция митохондрий и уровни окислительного стресса вернулись к тем, которые обычно наблюдаются в молодых фибробластах. Истощение теломер и митохондриальная дисфункция — еще две причины, по которым мы стареем.
Это было первое доказательство того, что состарившиеся клетки, даже у очень старых людей, можно омолодить, и за этим последовало множество независимых исследований, подтверждающих эти результаты на тех же и других типах клеток.
Можно ли использовать факторы Яманаки на живых животных?
Было легко изолировать клетки в чашке, вернуть их в состояние развития, а затем направить их к тому типу клеток, который они хотели, используя факторы Яманаки. Но это было явно непрактично для живого животного, поскольку клетки не могли стереть свою память, поэтому они возвращались в плюрипотентное состояние. Представьте, если бы клетка сердца забыла, что она клетка сердца, в то время как она должна была помогать перекачивать кровь по всему телу!
Также высказывались опасения, что известно, что экспрессия факторов Яманаки вызывает рак у животных [4].
Некоторые исследователи полагали, что можно избежать рака и обратить вспять старение старых клеток, не возвращая их полностью к плюрипотентности. Другими словами, они думали, что у нас есть способ получить свой пирог и съесть его. Но никому не удавалось добиться этого на живых животных. Все должно было измениться в декабре 2016 года.
Профессор Хуан Карлос Изписуа Бельмонте и его группа исследователей из Института Солка сообщили о выводах своего исследования, которое впервые показало, что клетки и органы живого животного могут быть омолодился [5].
Для исследования исследователи использовали специально сконструированную прогерическую мышь, стареющую быстрее, чем обычно, а также сконструированную нормально стареющую линию мышей. Оба типа мышей были спроектированы таким образом, чтобы экспрессировать факторы Яманака, когда они вступали в контакт с антибиотиком доксициклином, который им давали с питьевой водой.
Они позволили факторам Яманака временно экспрессироваться, добавив доксициклин в воду на два дня, а затем удалили его, чтобы гены OSKM снова замолчали. Затем у мышей был пятидневный период отдыха перед еще двумя днями воздействия доксициклина; этот цикл повторялся на протяжении всего исследования.
Частичное клеточное перепрограммирование
Всего через шесть недель этого лечения, которое постоянно перепрограммировало клетки мышей, исследователи заметили улучшения в их внешнем виде, в том числе уменьшение возрастного искривления позвоночника. Некоторые мыши как из экспериментальной, так и из контрольной групп также были подвергнуты эвтаназии в этот момент, чтобы можно было исследовать их кожу, почки, желудки и селезенку. У контрольных мышей наблюдался ряд возрастных изменений по сравнению с обработанными мышами, у которых ряд признаков старения остановился или даже обратился вспять, включая некоторые эпигенетические изменения.
Некоторые мыши как из экспериментальной, так и из контрольной групп также были подвергнуты эвтаназии в этот момент, чтобы можно было исследовать их кожу, почки, желудки и селезенку. У контрольных мышей наблюдался ряд возрастных изменений по сравнению с обработанными мышами, у которых ряд признаков старения остановился или даже обратился вспять, включая некоторые эпигенетические изменения.
У обработанных мышей также наблюдалось 50%-ное увеличение среднего времени выживания по сравнению с контрольными мышами, не получавшими прогерик. Следует отметить, что не на все признаки старения влияло частичное клеточное перепрограммирование, и если лечение прекращалось, признаки старения возвращались.
Возможно, самое главное, хотя частичное клеточное перепрограммирование, проводимое таким периодическим образом, сбрасывало некоторые признаки эпигенетического старения, оно не сбрасывало дифференцировку клеток, что могло бы заставить клетку вернуться в эмбриональное состояние и забыть, какой она была прежде; как вы можете себе представить, это было бы плохо для живого животного.
Наконец, временная экспрессия факторов Yamanaka не только привела к частичному омоложению клеток и органов у прогерийных мышей, но также, по-видимому, улучшила регенерацию тканей в группе 12-месячных нормально стареющих мышей, подвергшихся генной инженерии. Исследователи заметили, что частичное перепрограммирование улучшило способность этих мышей регенерировать ткань поджелудочной железы, что привело к усилению пролиферации бета-клеток; кроме того, в скелетных мышцах наблюдалось увеличение сателлитных клеток. Оба этих типа клеток обычно уменьшаются в процессе старения.
Факторы Яманаки, используемые для улучшения когнитивных функций у старых мышей
В октябре 2020 года еще одно исследование сделало нас на шаг ближе к частичному клеточному перепрограммированию, дошедшему до клиники, когда исследователи показали, что частичное клеточное перепрограммирование улучшает память у старых мышей. Как показали предыдущие исследования, частичное клеточное перепрограммирование представляет собой баланс между эпигенетическим омоложением клеток и сбросом часов их старения без полной переустановки их клеточной идентичности, чтобы они забыли, что они за клетки [6].
Предыдущие исследования также показали нам, что такое уравновешивание возможно и что при достаточно долгом воздействии на клетки факторов перепрограммирования возможно омоложение клетки без стирания ее клеточной идентичности.
Как и в предыдущем исследовании, о котором мы говорили, у мышей в этом исследовании были сконструированы клетки, реагирующие на доксициклин, распространенный антибиотик, используемый в ветеринарной практике, для экспрессии факторов перепрограммирования OSKM. Исследователи обнаружили, что достаточное воздействие на мышей улучшило их когнитивные функции без увеличения смертности в течение четырехмесячного периода.
Еще один шаг вперед к частичному клеточному перепрограммированию
В конце 2020 года исследователи, в том числе доктор Дэвид Синклер, опубликовали исследование, которое показало, что им удалось восстановить утраченное зрение у старых мышей и мышей с поврежденными нервами сетчатки с помощью частичное клеточное репрограммирование [7].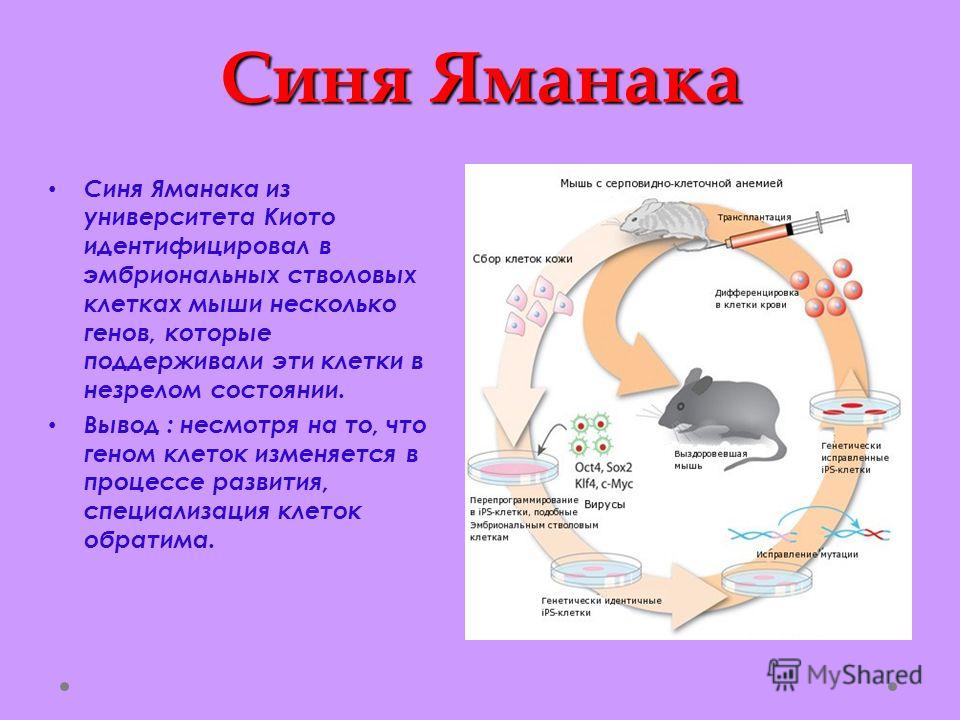
Чтобы снизить риск рака, они решили попробовать частичное клеточное перепрограммирование минус один из факторов Яманаки. Один из авторов исследования, доктор Юаньчэн Лу, искал более безопасный способ омоложения состарившихся клеток, поскольку были некоторые опасения, что использование c-Myc может вызвать рак при определенных обстоятельствах. В итоге они решили использовать только Oct4, Sox2 и Klf4 (OSK).
Хорошая новость заключалась в том, что даже OSK удалось омолодить поврежденные глазные нервы у мышей и восстановить зрение. Он также помог улучшить возрастное ухудшение зрения у мышей, получавших лечение, и у мышей, у которых наблюдалось повышенное глазное давление, имитация глаукомы.
Соавтор исследования, доктор Дэвид Синклер, сказал в статье в Nature: «Мы начали с вопроса: если эпигенетические изменения являются движущей силой старения, можно ли сбросить эпигеном?», или, другими словами, «Можете ли вы повернуть время вспять?». Ответ на этот вопрос звучит утвердительно!
Усовершенствование метода частичного клеточного перепрограммирования
В январе 2021 года исследователи показали, что частичное перепрограммирование омолаживает клетки человека на 30 лет, заставляя старые изношенные клетки функционировать как клетки человека в возрасте около 25 лет. Исследователи этого исследования использовали подход, который подвергал клетки воздействию достаточного количества факторов перепрограммирования, чтобы вытолкнуть их за пределы, при которых они считались соматическими, а не стволовыми клетками, но только чуть дальше [8].
Исследователи этого исследования использовали подход, который подвергал клетки воздействию достаточного количества факторов перепрограммирования, чтобы вытолкнуть их за пределы, при которых они считались соматическими, а не стволовыми клетками, но только чуть дальше [8].
Фибробласты, которые были перепрограммированы таким образом, сохранили достаточно своей эпигенетической клеточной памяти, чтобы снова стать фибробластами. Воздействие на эти клетки факторов OSKM проводилось с помощью лентивирусной упаковки, активированной доксициклином, как и в предыдущих исследованиях на животных.
Возможно, самое интересное, что, согласно многотканевым часам Хорвата 2013 г., образцы клеток, которым было чуть менее 60 лет, стали эпигенетически эквивалентными клеткам, которым было примерно 25 лет, после 13 дней частичного клеточного перепрограммирования, а кожа и кровь Хорвата 2018 г. часы показали, что клетки, которым было около 40 лет, также эпигенетически возвращались к клеткам 25-летнего человека. Похоже, что клетки возвращаются к эпигенетическому возрасту 25 лет или около того, предполагая, что это пик клеточного расцвета или оптимальный функциональный возраст для клеток.
Похоже, что клетки возвращаются к эпигенетическому возрасту 25 лет или около того, предполагая, что это пик клеточного расцвета или оптимальный функциональный возраст для клеток.
Проблемы частичного клеточного перепрограммирования
На сегодняшний день самым большим препятствием на пути частичного клеточного перепрограммирования к людям является необходимость найти способ активировать факторы Яманаки в наших клетках без необходимости конструировать наши тела, чтобы реагировать на препарат, например доксициклин. Это может потребовать от нас разработки лекарств, способных активировать OSKM, редактируя каждую клетку нашего тела, чтобы она реагировала на определенное соединение, такое как доксициклин, что было бы чрезвычайно сложно, хотя и правдоподобно.
Другой возможностью является редактирование зародышевой линии, чтобы наши дети рождались с такой модификацией, чтобы реагировать на выбранное соединение, идея, которая в настоящее время является этическим кошмаром даже для рассмотрения, не говоря уже о технических проблемах, связанных с ее успешным выполнением. Каким бы ни было решение, оно должно быть практичным.
Каким бы ни было решение, оно должно быть практичным.
Другим серьезным препятствием является поиск метода, пригодного для долгосрочного использования, который не требует постоянного ухода, чтобы признаки старения быстро не возвращались, как это произошло у мышей, когда лечение было прервано. Хотя есть некоторые основания полагать, что эти признаки не вернутся так быстро у людей, учитывая различия между метаболизмом мыши и человека и наши превосходные системы восстановления, они, вероятно, вернутся в свое время. Таким образом, поиск экономичного способа продолжения циклического лечения имеет первостепенное значение; это потенциально может быть достигнуто с помощью лекарств или временной генной терапии.
Будущие факторы Яманаки для борьбы со старением
Если предположить, что эти барьеры могут быть преодолены, а быстрый прогресс в области биотехнологии дает основания полагать, что они будут преодолены, то частичное клеточное перепрограммирование может иметь большой потенциал для предотвращения или даже лечения болезней старения.
Можно было бы предусмотреть раннее, предварительное использование этого подхода в профилактических целях: пожилым людям с риском возрастных заболеваний можно было бы дать частичное перепрограммирование, чтобы остановить или, по крайней мере, значительно замедлить этот аспект старения и тем самым снизить риск развития возрастных заболеваний.
На более совершенных стадиях может использоваться более целенаправленно для восстановления определенного органа или ткани, поврежденных в результате травмы или болезни. В другом, более продвинутом сценарии можно попытаться постепенно омолодить все тело пожилых людей, чтобы полностью предотвратить возрастные заболевания и сохранить их здоровыми, активными и способными продолжать радоваться жизни.
Такие компании, как Google Calico, в настоящее время также изучают альтернативные способы частичного клеточного перепрограммирования без использования факторов Яманаки. Это еще одно направление исследований, которое может оказаться более практичным и безопасным, чем использование факторов Яманаки.
Быстрый прогресс медицинских технологий потенциально может означать, что такие методы частичного клеточного перепрограммирования могут стать доступными в недалеком будущем. Мы, конечно, на это надеемся.
Литература
[1] Такахаши К. и Яманака С. (2006). Индукция плюрипотентных стволовых клеток из культур эмбриональных и взрослых фибробластов мыши с помощью определенных факторов. ячейка, 126(4), 663-676.
[2] Лапассе, Л., Милаве, О., Приер, А., Беснар, Э., Баблед, А., Айт-Хаму, Н., … и Леманн, С. (2011). Омоложение стареющих и столетних клеток человека путем перепрограммирования через плюрипотентное состояние. Гены и развитие, 25(21), 2248-2253.
[3] Лопес-Отин, К., Бласко, М.А., Партридж, Л., Серрано, М., и Кремер, Г. (2013). Признаки старения. Ячейка, 153(6), 1194-1217.
[4] Абад, М., Мостейро, Л., Пантоха, К., Канамеро, М., Район, Т., Орс, И., … и Мансанарес, М. (2013). При перепрограммировании in vivo образуются тератомы и iPS-клетки с признаками тотипотентности. Nature, 502(7471), 340.
Nature, 502(7471), 340.
[5] Окампо А., Редди П., Мартинес-Редондо П., Платеро-Луенго А., Хатанака Ф., Хисида Т., Ли М., Лам Д., Курита М., Бейрет Э., Араока Т. , Васкес-Феррер Э., Доносо Д., Роман Х.Л.Х.Дж., Родригес-Эстебан К., Нуньес Г., Нуньес Деликадо Э., Кампистоль Х.М., Гильен И., Гильен П., Изписуа Бельмонте Х.К. In vivo улучшение возрастных признаков путем частичного перепрограммирования. Клетка. 2016;167:1719–33.
[6] Родригес-Мателлан, А., Алькасар, Н., Эрнандес, Ф., Серрано, М., и Авила, Дж. (2020). Перепрограммирование in vivo улучшает признаки старения в клетках зубчатой извилины и улучшает память у мышей. Отчеты о стволовых клетках , 15 (5), 1056-1066.
[7] Лу, Ю., Броммер, Б., Тиан, X., Кришнан, А., Меер, М., Ван, К., … и Синклер, Д. А. (2020). Перепрограммирование для восстановления юношеской эпигенетической информации и восстановления зрения. Природа, 588 (7836), 124-129.
[8] Гилл Д., Парри А., Сантос Ф., Эрнандо-Эрраес И. , Стаббс Т. М., Милагре И. и Рейк В. (2021). Мультиомное омоложение клеток человека путем временного перепрограммирования фазы созревания.
, Стаббс Т. М., Милагре И. и Рейк В. (2021). Мультиомное омоложение клеток человека путем временного перепрограммирования фазы созревания.
Технология iPS: четыре фактора, которые изменят мир
Подписывайтесь на нас:
You are here
Home
>
Комментарии
>
Технология iPS: четыре фактора, которые изменят мир… когда-нибудь
| |||||||
Хотя они еще не выполнили свои обещания в терапии, иПС-клетки в настоящее время регулярно используются в огромном списке дисциплин, включая биологию развития и регенеративную биологию, неврологию, кардиологию, гепатологию, моделирование заболеваний и даже разработку лекарств. Эта технология позволила добиться значительных успехов в выяснении патологических механизмов многих заболеваний, таких как болезнь Альцгеймера и Паркинсона. Эта технология позволила добиться значительных успехов в выяснении патологических механизмов многих заболеваний, таких как болезнь Альцгеймера и Паркинсона. Многие усилия были сосредоточены на дифференциации иПС-клеток человека, полученных от здоровых доноров или пациентов, в специализированные типы клеток, включая гепатоциты или кардиомиоциты, для проверки токсичности новых лекарств. Это может даже стать нормой в оценке безопасности лекарств однажды, с новой парадигмой инициативы CiPA (Комплексный анализ проаритмии in vitro) (6). Эта организация, объединяющая исследователей, медицинские агентства и некоммерческие организации со всего мира (США, Европе, Японии, Канаде и т. д.) и сосредоточив внимание на разработке оптимизированных правил для проверки потенциальной кардиотоксичности новых молекул, недавно предложили включить анализы in vitro на кардиомиоцитах, полученных из hiPS. (7) Но — и, к сожалению, есть но — большинство из этих клеток, полученных из иПС, имеют незрелые характеристики, больше напоминающие эмбриональные, чем взрослые дифференцированные клетки, что требует оптимизированных протоколов и методов. В дополнение к этим ограничениям интересно думать, что мы до сих пор не до конца понимаем перепрограммирование. Например, мы можем разделить процесс на последовательные этапы и можем подтвердить плюрипотентность перепрограммированных клеток многими различными способами, но мы все еще не знаем точно, как это работает, как четыре фактора могут вызвать такое резкое изменение судьбы. Учитывая, что эти и некоторые другие вопросы все еще не решены (риск онкогенности является реальным препятствием), наиболее вероятно, что нас еще ждут крупные прорывы в технологии iPS. Амели Резза — менеджер инновационных проектов в genOway, специализирующаяся на передовых биотехнологиях. Каталожные номера:
|
Открытие факторов Яманаки — Исследование Нобелевского эксперимента Яманаки | by Henry Fu Official
Исследование и визуализация научного процесса, стоящего за одним из самых значительных открытий в области долголетия человека в этом столетии
Старение часто ошибочно отождествляют с течением времени, неостановимым и необратимым.
В 2006 году ученый Шинья Яманака и его команда доказали, что, активируя четыре фактора транскрипции, клетки млекопитающих способны деметилировать свой эпигеном и устранять все эффекты старения, которые они испытывали с момента зачатия. Повышающая регуляция этих четырех генетических последовательностей — теперь названных в честь их первооткрывателя Яманаки — вызывает клеточную плюрипотентность во взрослых соматических клетках, делая их функционально идентичными эмбриональным стволовым клеткам (ЭС). Плюрипотентные клетки способны дифференцироваться во все типы клеток и тканей человека, что делает их неотъемлемой частью многих существующих и будущих методов лечения, некоторые из которых потенциально могут лечить неизлечимые в настоящее время заболевания. В свете этого новаторского открытия, сделанного 15 лет назад, я решил воссоздать и объяснить процесс эксперимента Яманаки, получившего Нобелевскую премию. Пожалуйста, следуйте за мной через весь метод, который использовал Яманака и его команда, я постараюсь помочь вам визуализировать каждый шаг на этом пути.
С чего начать?
Обоснование этого эксперимента простое: вставьте последовательность гена в эмбриональные фибробласты мыши ( MEFs : клетки, которые синтезируют внеклеточный матрикс и производят структурный каркас для тканей животных), затем наблюдайте, отражают ли свойства клетки свойство плюрипотентная клетка. Встроенная последовательность гена нацелена на четыре фактора-кандидата, предположительно вызывающих плюрипотентность в клетках, а именно Sox2, Oct3/4, Klf4 и c-Myc. Это означает, что если какое-либо плюрипотентное свойство наблюдается в клетках со встроенной последовательностью гена, мы можем убедиться, что эти четыре фактора действительно связаны с клеточной плюрипотентностью.
Итак, во-первых, каковы четыре фактора Яманаки?
Итак, что такое факторы Яманаки? Во-первых, важно знать, что все четыре фактора Yamanaka (Sox2, Oct3/4, Klf4 и c-Myc; или OSKM) являются транскрипционными факторами . Это означает, что они представляют собой белок , экспрессируемый одним или несколькими конкретными генами ( ген : последовательность и участок ДНК), который регулирует, какие из других генов включены (гены, генерирующие белки, считаются «включенными»). ») и которые выключены. Проще говоря, подумайте о своем геноме как о цепочке огней. Факторы транскрипции, по сути, представляют собой отдельные переключатели, отвечающие за включение и выключение каждой лампочки в цепи.
Это означает, что они представляют собой белок , экспрессируемый одним или несколькими конкретными генами ( ген : последовательность и участок ДНК), который регулирует, какие из других генов включены (гены, генерирующие белки, считаются «включенными»). ») и которые выключены. Проще говоря, подумайте о своем геноме как о цепочке огней. Факторы транскрипции, по сути, представляют собой отдельные переключатели, отвечающие за включение и выключение каждой лампочки в цепи.
Линия света, каждая с индивидуальными переключателями
Каждый из четырех факторов регулируется одним или несколькими генами в геноме человека. Чтобы активировать факторы Яманаки в клетке, требуется процедура редактирования генов, которая вставляет регулирующие гены в геном клетки.
В своем эксперименте Яманака вставил каждый из этих четырех факторов, регулирующих гены, с помощью метода, называемого ретровирусной трансдукцией . Ретровирус — это тип вируса, который интегрирует свою РНК в геном клетки-хозяина, которую он заражает, вызывая необратимое изменение генома клетки (ВИЧ-1 и ВИЧ-2 — некоторые известные примеры ретровирусов человека). Ретровирусная трансдукция — это метод редактирования гена , в котором используется это свойство ретровируса, что делает его вектором ( вектор : транспортное средство, переносящее чужеродный генетический материал в клетку) для доставки генной вставки, активирующей четыре фактора Яманаки.
Ретровирус — это тип вируса, который интегрирует свою РНК в геном клетки-хозяина, которую он заражает, вызывая необратимое изменение генома клетки (ВИЧ-1 и ВИЧ-2 — некоторые известные примеры ретровирусов человека). Ретровирусная трансдукция — это метод редактирования гена , в котором используется это свойство ретровируса, что делает его вектором ( вектор : транспортное средство, переносящее чужеродный генетический материал в клетку) для доставки генной вставки, активирующей четыре фактора Яманаки.
Чтобы доставить эти целевые последовательности генов в образцы клеток, необходимо выполнить несколько шагов:
1.) Создание желаемой последовательности для вставки в геном клетки, конструирование плазмиды.
2.) Упаковка сконструированной плазмиды в вирусный вектор и ее репликация, или трансдукция и упаковка .
3.) Доставка последовательности гена в клетку с помощью созданного вирусного вектора или трансфекция .
Это организовано примерно в хронологическом порядке выполнения в лаборатории. Ниже я объясню каждый из этих трех шагов один за другим в указанном порядке.
Процесс синтеза правильных генов в форме ДНК для загрузки в ретровирусный вектор через клетки Plat-E. Я начну с науки, за ней может быть немного сложно следовать, но, пожалуйста, оставайтесь со мной. Более запутанные понятия я объясню по аналогии в « Визуализировать ».
The Science
Первым этапом конструирования плазмиды является создание плазмидной основы, которую можно загрузить в вирусный вектор. Это делается с помощью кассеты Gateway RFA. Кассета Gateway — это технология, изобретенная и коммерциализированная компанией Invitrogen для облегчения клонирования ( Клонирование : создание множества идентичных копий фрагмента ДНК) и вставки целевой последовательности гена в вирусный вектор. Кассета Gateway введена в эксплуатацию на площадках EcoRI/XhoI pMXs плазмида . Плазмида pMXs представляет собой ретровирусный загрузочный вектор с несколькими сайтами сплайсинга ( сайтов сплайсинга : сайты соединения экзонов) и акцепторными сайтами ( акцепторными сайтами : место, где рибосома связывается во время синтеза белка). Он обычно используется в процессе создания ретровируса с определенной полезной нагрузкой ( полезная нагрузка : последовательность РНК, которую ученые хотят вставить в клетку).
Плазмида pMXs представляет собой ретровирусный загрузочный вектор с несколькими сайтами сплайсинга ( сайтов сплайсинга : сайты соединения экзонов) и акцепторными сайтами ( акцепторными сайтами : место, где рибосома связывается во время синтеза белка). Он обычно используется в процессе создания ретровируса с определенной полезной нагрузкой ( полезная нагрузка : последовательность РНК, которую ученые хотят вставить в клетку).
На основе ранее созданной плазмиды pMXs необходимо создать средства для индукции экспрессии четырех желаемых факторов. Это можно разделить на 1.) индуцирующий ген мутация в родительской плазмиде и 2.) амплификация целевой последовательности.
Что касается мутаций, команда Яманаки индуцировала мутации в экспрессии β- катенина , Stat3 и c-Myc с помощью метода, называемого сайт-направленным мутагенезом на основе ПЦР . β- catenin представляет собой функциональный белок, регулирующий транскрипцию генов у человека. Обнаружено, что присутствие β- катенина усиливает экспрессию Klf4, Oct4 и Sox2, , таким образом связывая его с клеточной плюрипотентностью. Stat3 является еще одним фактором транскрипции, активация которого, как было установлено, является необходимым условием самообновления эмбриональных стволовых клеток. Это связывает активацию Stat3 с поддержанием плюрипотентности, что означает, что если экспериментальный образец индуцированных плюрипотентных клеток хочет поддерживаться в течение длительного периода времени, необходима активация Stat3. ПЦР или полимеразная цепная реакция — это распространенный метод, используемый для быстрой репликации последовательности генов. Сайт-направленный мутагенез на основе ПЦР представляет собой метод, использующий ПЦР для индуцирования специфического изменения в целевой последовательности генов.
β- catenin представляет собой функциональный белок, регулирующий транскрипцию генов у человека. Обнаружено, что присутствие β- катенина усиливает экспрессию Klf4, Oct4 и Sox2, , таким образом связывая его с клеточной плюрипотентностью. Stat3 является еще одним фактором транскрипции, активация которого, как было установлено, является необходимым условием самообновления эмбриональных стволовых клеток. Это связывает активацию Stat3 с поддержанием плюрипотентности, что означает, что если экспериментальный образец индуцированных плюрипотентных клеток хочет поддерживаться в течение длительного периода времени, необходима активация Stat3. ПЦР или полимеразная цепная реакция — это распространенный метод, используемый для быстрой репликации последовательности генов. Сайт-направленный мутагенез на основе ПЦР представляет собой метод, использующий ПЦР для индуцирования специфического изменения в целевой последовательности генов.
Диаграмма сайт-направленного мутагенеза на основе ПЦР, Kristian Laursen (2016) метод называется ОТ-ПЦР. ОТ-ПЦР, или ПЦР с обратной транскрипцией , представляет собой еще один вариант полимеразной цепной реакции, используемый для быстрой репликации ДНК с базовой матрицы РНК. Обратная транскрипция относится к процессу образования ДНК из РНК. Сгенерированный результат перемещается на вектор донора шлюза ( Донорный вектор шлюза : по сути, средство, помогающее интегрировать ген в плазмиду), а затем рекомбинируют с ранее созданным базовым вектором pMXs.
ОТ-ПЦР, или ПЦР с обратной транскрипцией , представляет собой еще один вариант полимеразной цепной реакции, используемый для быстрой репликации ДНК с базовой матрицы РНК. Обратная транскрипция относится к процессу образования ДНК из РНК. Сгенерированный результат перемещается на вектор донора шлюза ( Донорный вектор шлюза : по сути, средство, помогающее интегрировать ген в плазмиду), а затем рекомбинируют с ранее созданным базовым вектором pMXs.
ПЦР с обратной транскрипцией, МАГАТЭ (2020)
Для визуализации
Теперь представьте себе набор лего. В комплекте есть три компонента. Базовая доска, на которой вы можете строить свои вещи, уже построенная структура, которая вам не нравится, и крошечный кусочек на самом краю, который слишком мал, чтобы его можно было заметить. Основы плазмиды pMXs по сути подобны той базовой плате, на которой вы строите последовательность генов — структуры — на. Индуцированная генная мутация с помощью сайт-направленного мутагенеза на основе ПЦР в плазмиде направлена на то, чтобы справиться со встроенной, но нежелательной структурой, изменив ее (или мутируя ее) во что-то желаемое. Амплификация с помощью RT-PCR имеет дело с крошечным кусочком, который слишком мал, увеличивая его за счет самовоспроизводства. В целом, в конструировании плазмид вы построили структуру, которую хотите, на базовой плате, изменив структуру, которая вам не нравится, и увеличив некоторые непропорционально мелкие элементы.
Амплификация с помощью RT-PCR имеет дело с крошечным кусочком, который слишком мал, увеличивая его за счет самовоспроизводства. В целом, в конструировании плазмид вы построили структуру, которую хотите, на базовой плате, изменив структуру, которая вам не нравится, и увеличив некоторые непропорционально мелкие элементы.
Вот ваш генетический набор лего. Веселиться!
Теперь плазмида сгенерирована, переходим к следующему шагу; загрузка сконструированной плазмиды в вирусные векторы.
Загрузка ранее созданного генетического материала в ретровирусный вектор через упаковочную ячейку Plat-E.
The Science
Трансдукцию сконструированной плазмиды в ретровирусный вектор с помощью клеток Plat-E проводят in vitro в чашке для культивирования клеток. Примерно за 12 часов до трансдукции (Яманака упомянул накануне вечером, поэтому я предположил, что это 12 часов), клетки Plat-E высевали по 8*10⁶ клеток на 100-миллиметровую чашку. Клетки Plat-E представляют собой клеточную линию упаковки ретровируса, полученную из 29клеточная линия 3Т. Он способен вызывать сверхстабильную экспрессию вирусного структурного белка в полученных ретровирусных векторах. Культуру оставляют на ночь.
Клетки Plat-E представляют собой клеточную линию упаковки ретровируса, полученную из 29клеточная линия 3Т. Он способен вызывать сверхстабильную экспрессию вирусного структурного белка в полученных ретровирусных векторах. Культуру оставляют на ночь.
пример клеточной культуры, высеянной в чашку, Alvetex (2012)
На следующий день основанных на pMXs ретровирусных вектора вводят в клетки Plat-E с использованием реагента для трансфекции Fugene 6. Ретровирусный вектор на основе pMXs основан на вирусе мышиного лейкоза Молони или MMLV, векторе размером 5,9 т.п.н. (5,9 т.п.о.: общая длина РНК вектора составляет 5900 base) для доставки наследуемых генов в геном клеток. Для введения вирусного вектора в упаковочную клеточную линию требуется реагент для трансфекции. Реагент для трансфекции побуждает вирусные векторы высвобождать нуклеиновые кислоты в цитоплазму клеток Plat-E, облегчая проникновение вектора в клетку.
Сразу после предыдущего процесса 27 мкл реагента для трансфекции fugen 6 разводят в 300 мкл DMEM и инкубируют в течение 5 минут. DMEM, или модифицированная Дульбекко среда Игла, является обычной средой, поддерживающей рост многих клеток млекопитающих. После инкубации 9мкг плазмидной ДНК , ранее полученной при конструировании плазмиды, добавляют в смесь перед новой инкубацией в течение еще 15 минут. Смешивание плазмиды с реагентом для трансфекции облегчает проникновение плазмиды в клетки Plat-E, поэтому плазмиду не добавляют к образцам клеток отдельно. После периода инкубации смесь добавляют в культуру клеток Plat-E. Культуру оставляют инкубировать при 37°С в течение ночи с 5% углекислым газом. Этот инкубационный период позволяет плазмиде проникнуть в клетку и реплицироваться. На этом процесс трансдукции завершен.
DMEM, или модифицированная Дульбекко среда Игла, является обычной средой, поддерживающей рост многих клеток млекопитающих. После инкубации 9мкг плазмидной ДНК , ранее полученной при конструировании плазмиды, добавляют в смесь перед новой инкубацией в течение еще 15 минут. Смешивание плазмиды с реагентом для трансфекции облегчает проникновение плазмиды в клетки Plat-E, поэтому плазмиду не добавляют к образцам клеток отдельно. После периода инкубации смесь добавляют в культуру клеток Plat-E. Культуру оставляют инкубировать при 37°С в течение ночи с 5% углекислым газом. Этот инкубационный период позволяет плазмиде проникнуть в клетку и реплицироваться. На этом процесс трансдукции завершен.
Для визуализации
Собранную вами ранее конструкцию из лего нужно было упаковать. Вы отправляете свои лего на упаковочное предприятие, где много рабочих трудятся над упаковкой лего. Клетки Plat-E подобны рабочим на упаковочном предприятии, упаковывающим плазмиду в ретровирусные векторы. Тем не менее, вас не устраивает просто упакованная конструкция из лего, которую вы построили, вы хотите, чтобы она была произведена серийно . Работник упаковки говорит вам, что нет проблем, они на работе. Клетки Plat-E не только упаковывают плазмиду в ретровирусный вектор, но и реплицируют упакованные вирусные векторы. В общем, теперь у вас есть набор упакованных ретровирусных векторов с нужной вам генетической информацией.
Тем не менее, вас не устраивает просто упакованная конструкция из лего, которую вы построили, вы хотите, чтобы она была произведена серийно . Работник упаковки говорит вам, что нет проблем, они на работе. Клетки Plat-E не только упаковывают плазмиду в ретровирусный вектор, но и реплицируют упакованные вирусные векторы. В общем, теперь у вас есть набор упакованных ретровирусных векторов с нужной вам генетической информацией.
Клетка Plat-E похожа на центр репликации и упаковки ретровирусных векторов
Ретровирусные векторы окончательно упаковываются и реплицируются. Теперь вы готовы перейти к последнему шагу, доставке гена в образцы клеток.
Доставка ретровирусных векторов в образцы клеток и обеспечение интеграции инфекции и генетического материала в геном клетки.
The Science
Процесс трансфекции также будет завершен в условиях in vitro на чашке для культивирования клеток. Через 24 часа после завершения трансдукции целевой образец клеток мышиного эмбрионального фибробласта (MEF) высевают в количестве 3×10⁵ на чашку диаметром 100 мм. Перед посевом образца клеток чашка должна быть сначала кондиционирована , чтобы позволить произойти любой потенциальной индуцированной плюрипотентности. По этой причине на чашку сначала наносят обработанные митомицином С питающие клетки STO. Митомицин С представляет собой класс препаратов, связанных с противораковой химиотерапией, он предотвращает репликацию любой канцерогенной клетки в культуре. Питающие клетки STO являются неотъемлемой частью процесса создания и поддержания культуры плюрипотентных клеток, способствуя пролиферации клеток.
Через 24 часа после завершения трансдукции целевой образец клеток мышиного эмбрионального фибробласта (MEF) высевают в количестве 3×10⁵ на чашку диаметром 100 мм. Перед посевом образца клеток чашка должна быть сначала кондиционирована , чтобы позволить произойти любой потенциальной индуцированной плюрипотентности. По этой причине на чашку сначала наносят обработанные митомицином С питающие клетки STO. Митомицин С представляет собой класс препаратов, связанных с противораковой химиотерапией, он предотвращает репликацию любой канцерогенной клетки в культуре. Питающие клетки STO являются неотъемлемой частью процесса создания и поддержания культуры плюрипотентных клеток, способствуя пролиферации клеток.
Эмбриональные фибробласты мыши (MEF)
Через 24 часа после посева клеток из культуры Plat-E экстрагируют супернатанты, содержащие вирусные векторы. Затем жидкость фильтруют через 0,45-миллиметровый фильтр из ацетата целлюлозы перед добавлением полибрена в концентрации 4 мг/мл. Мембранные фильтры из ацетата целлюлозы обладают гидрофильными свойствами и очень низкой способностью связывать белок; это означает, что они являются идеальным фильтром для любого эксперимента, который требует извлечения большей части белка. Дополненный полибрен 4 мг/мл используется для повышения эффективности ретровирусной трансфекции в клеточных культурах. На этом этапе упакованный вирусный вектор извлекают из клеток Plat-E и очищают; подготовка его к фактическому процессу трансфекции.
Мембранные фильтры из ацетата целлюлозы обладают гидрофильными свойствами и очень низкой способностью связывать белок; это означает, что они являются идеальным фильтром для любого эксперимента, который требует извлечения большей части белка. Дополненный полибрен 4 мг/мл используется для повышения эффективности ретровирусной трансфекции в клеточных культурах. На этом этапе упакованный вирусный вектор извлекают из клеток Plat-E и очищают; подготовка его к фактическому процессу трансфекции.
Затем раствор после экстракции и фильтрации добавляют в чашку с целевым MEF и оставляют для инкубации в течение 4–12 часов (Яманака снова записал 4 часа на ночь, что, как я предположил, равно 12 часам). После периода инкубации клетки пересевают в 10 мл свежей среды. Еще через 3 дня добавляют раствор G418 с концентрацией 0,3 мг/мл. G418 по существу представляет собой метод фильтрации, используемый для отделения плюрипотентных клеток от неплюрипотентных клеток в культуре. Я объясню, как это работает позже в статье. Затем через 2–3 недели после этого проводят экспериментальное наблюдение.
Затем через 2–3 недели после этого проводят экспериментальное наблюдение.
Визуализировать
Теперь вы получили много упакованных лего, которые вы заказывали, чтобы сделать обратно. Пришло время доставить его своим друзьям и семьям, и вы много маленьких кузенов. Вместо того, чтобы ходить к ним по одному домой, вы пригласили их всех, чтобы вручить им подарок. Среда in vitro чем-то похожа на этот сбор, где вместо доставки векторов живой мыши вы извлекаете клетки и выращиваете их на чашке для культивирования. Твои друзья и семьи, а также многие твои двоюродные братья уже прибыли, так что ты преподносишь им подарок. Взрослые быстро понимают и наслаждаются деталями лего, но детям потребуется время. Это похоже на образец клетки. Скорость интеграции векторов в геном варьируется, и некоторым клеткам требуется некоторое время, прежде чем они считывают и отображают изменения. Вот почему могут длиться длительные инкубационные периоды.
Не каждая клетка реагирует сразу, как в семье.
Векторы доставляются в ваши клетки, и мы ждем результата. Но какой результат указывает на то, что клетка стала плюрипотентной? Давайте перейдем к методу, который Яманака и его команда использовали для проверки плюрипотентности.
Как узнать, является ли клетка плюрипотентной? Каким методом это проверить? Здесь я объясню, как Яманака и его команда использовали устойчивость к G418 как признак плюрипотентности.
The Science
Физически трудно различить, какая клетка является плюрипотентной, а какая нет. Пытаясь оценить плюрипотентные свойства клеток, Яманака и его команда разработали систему, основанную на устойчивости к G418. G418 — аминогликозидный антибиотик, способный ингибировать синтез белка. Нормальные взрослые клетки имеют очень низкую толерантность к воздействию G418 (чувствительны к любой концентрации выше 0,3 мг/мл). Чтобы дифференцировать плюрипотентные клетки от нормального уровня, Яманака и его команда вставили β 9Кассета 0404 geo (слияние генов устойчивости к b-галактозидазе и неомицину, оба похожих типа антибиотика) в мышиный ген Fbx15 путем гомологичной рекомбинации перед экспериментом. Гены Fbx15 экспрессируются исключительно в эмбриональных стволовых клетках мыши, хотя и не участвуют в поддержании их плюрипотентности. Затем отредактированную мышь подвергают обратному скрещиванию с родительской линией в течение 5 поколений перед проведением эксперимента.
Гены Fbx15 экспрессируются исключительно в эмбриональных стволовых клетках мыши, хотя и не участвуют в поддержании их плюрипотентности. Затем отредактированную мышь подвергают обратному скрещиванию с родительской линией в течение 5 поколений перед проведением эксперимента.
Вставка β 9Кассета 0404 geo по существу позволяет любой экспрессии гена Fbx15 обеспечить уровень устойчивости клетки к G418. Это означает, что любое проявление плюрипотентных свойств, которое активирует экспрессию генов Fbx15 в MEF, приведет к более высокому, чем обычно, уровню устойчивости к G418, что даст количественные показания плюрипотентности клетки. Экспериментальный результат показывает, что плюрипотентные клетки, активирующие этот модифицированный ген Fbx15, устойчивы к концентрации G418 до 12 мг/мл, что более чем в 30 раз превышает нормальное значение.
Визуализация
Я сам помешан на науке (очень горжусь), индикаторная бумага для измерения pH (по сути, буферный раствор) является обычным явлением. G418 и образцы клеток взаимодействуют по существу так же, как индикаторная бумага для измерения pH и кислый раствор. При высокой концентрации G418 клетка ведет себя определенным образом (а именно умирает), а при низкой концентрации клетка ведет себя иначе. Это изменение в поведении затем дает представление о свойстве плюрипотентности клеток.
G418 и образцы клеток взаимодействуют по существу так же, как индикаторная бумага для измерения pH и кислый раствор. При высокой концентрации G418 клетка ведет себя определенным образом (а именно умирает), а при низкой концентрации клетка ведет себя иначе. Это изменение в поведении затем дает представление о свойстве плюрипотентности клеток.
G418 взаимодействует с образцом клетки, как pH-бумага и кислый раствор
Теперь давайте рассмотрим несколько ключевых шагов, которые Яманака и его команда предприняли в своем методе индукции четырех факторов-кандидатов, связанных с клеточной плюрипотентностью.
Technical TL; DR
- Во-первых, желаемая последовательность гена конструируется на плазмиде pMXs с помощью сайт-направленного мутагенеза на основе ПЦР и ОТ-ПЦР. Основным методом, используемым в этом процессе, является мутация и амплификация генов, регулирующих четыре фактора Яманаки.
- Во-вторых, ранее сгенерированная плазмида упаковывается в ретровирусные векторы на основе pMXs клетками Plat-E до ее репликации.
 На этом этапе создаются ретровирусные векторы с желаемой присоединенной последовательностью гена.
На этом этапе создаются ретровирусные векторы с желаемой присоединенной последовательностью гена. - В-третьих, ретровирусный вектор доставляется к образцам клеток в среде in vitro. Перед наблюдением допускается длительный инкубационный период (2–3 недели) с добавлением раствора G418 через 72 часа инкубации.
- Наконец, наблюдение за плюрипотентностью образцов клеток проводится в соответствии с отличительным признаком устойчивости G418.
Процесс, созданный Яманакой и его командой, очень интересен с точки зрения сложной науки. Однако по-настоящему новаторским аспектом этого эксперимента является результат, полученный Яманакой. Во второй части этой статьи я объясню результат эксперимента Яманаки, его интерпретацию данных и исследования, проведенные в последующие годы. Как и человечество, всегда существовала тяга к омоложению нашего тела. До публикации исследования Яманаки в 2006 году это оставалось фантастикой. Значение этого открытия трудно переоценить, так как это один из немногих ключей человечества к остановке и потенциальному обращению вспять старения. Результат его эксперимента — как вы увидите в следующий раз — вселяет надежду в ту единственную мечту, которую мы, люди, имели для миллениалов; долголетие.
Результат его эксперимента — как вы увидите в следующий раз — вселяет надежду в ту единственную мечту, которую мы, люди, имели для миллениалов; долголетие.
Продолжить здесь: часть 2 скоро выйдет
Дополнительные ресурсы
Индукция плюрипотентных стволовых клеток из культур эмбриональных и взрослых фибробластов мыши с помощью определенных…
ядерное содержимое в ооциты или с помощью…
www.cell.com
Индукция плюрипотентных стволовых клеток из фибробластов взрослого человека с помощью определенных факторов
Успешное перепрограммирование дифференцированных соматических клеток человека в плюрипотентное состояние позволит создать…
www.cell.com
Спасибо за внимание! Я Генри, 17-летний технолог и энтузиаст долголетия, у которого есть миссия помочь продлить срок здоровья человека.
Если вы хотите следовать за мной в моем путешествии, подписывайтесь на меня в среде, где я буду публиковать статьи еженедельно. Кроме того, вы можете подписаться на мой ежемесячный информационный бюллетень или связаться со мной в LinkedIn. 😃
Кроме того, вы можете подписаться на мой ежемесячный информационный бюллетень или связаться со мной в LinkedIn. 😃
Панель антител iPSC — фактор Яманака (GTX300029)
Кат. № GTX300029
Заявка | Всемирный банк, ICC/IF, FACS, IHC |
|---|
Техническая спецификация
Технический паспорт
ТОВАР
Содержание продукта
GTX100622
Антитело Oct4
Заявление :
Всемирный банк, ICC/IF, FACS, IP
Реактивность:
Человек, Мышь
Упаковка :
25 мкл
GTX101507
Антитело SOX2 [N1C3]
Заявление :
WB, ICC/IF, IHC-P, IHC-Fr, FACS, IP
Реактивность:
Человек, мышь, крыса, лягушка, Ceratotherium simum
Упаковка :
25 мкл
GTX101508
антитело KLF4
Заявление :
WB, ICC/IF, IHC-P, FACS, IP
Реактивность:
Человек, Мышь, Крыса
Упаковка :
25 мкл
GTX109636
c-Myc антитело [N1], N-конец
Заявление :
ВБ
Реактивность:
Человек
Упаковка :
25 мкл
GTX213110-01
Козье антитело IgG к кролику (HRP)
Заявление :
WB, ICC/IF, IHC-P, Dot, ELISA
Реактивность:
Человек, Кролик
Упаковка :
25 мкл
GTX48037
Антитело SSEA-4 [MC-813-70]
Заявление :
Всемирный банк, ICC/IF, FACS, IP, IHC
Реактивность:
Человек
Упаковка :
25 мкл
СВОЙСТВА
Форма
Жидкость
Хранилище
Инструкции по хранению см. в технических описаниях каждого отдельного компонента.
в технических описаниях каждого отдельного компонента.
Примечание
Только для лабораторного использования. Не для любого клинического, терапевтического или диагностического использования у людей или животных. Не для потребления животными или людьми.
ЦЕЛЬ
Синонимы
иПСК , антитело OCT3/4 , антитело SOX2 , антитело KLF4 , индуцированные плюрипотентные стволовые клетки , антитело OCT4
ОБОЗНАЧЕНИЕ
ОБЗОР
В настоящее время нет обзоров для iPSC Antibody Panel — Yamanaka factor (GTX300029) . Будьте первым, кто поделится своим опытом использования этого продукта.
Отправить отзыв
Связаться с дистрибьютором
Биозол Диагностика Вертриб ГмбХ
| Leipziger Straße 4, 85386 Эхинг, Германия | |
| +49-(0)89-37-99-666-6 | |
| +49-(0)89-37-99-666-99 | |
https://www.
|

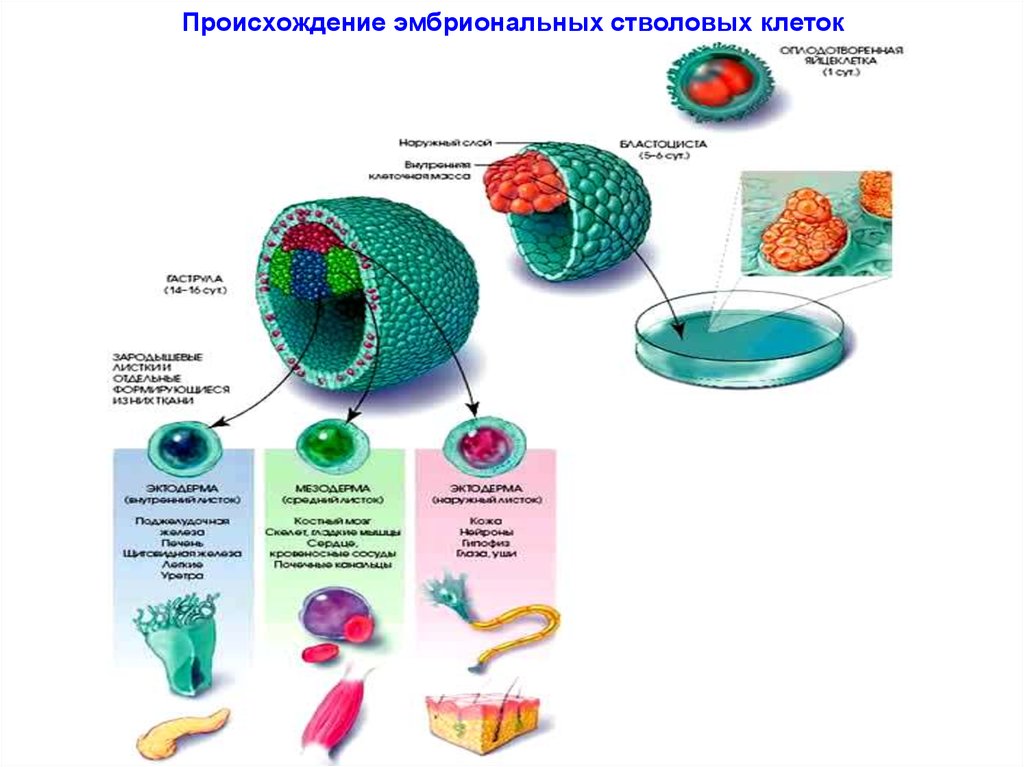

 2010.
2010. , Перера И., Полишевска К., Рамдасс С., Шайеганпур К., Вафаеян К., Ван Аллен К., Ван Ю, Вайс Т, Эстолл Дж. Л., Малвихилл Э. Э., Скритон Р. А.; Diabetes Action Canada и Канадская сеть исследований и обучения островков.
, Перера И., Полишевска К., Рамдасс С., Шайеганпур К., Вафаеян К., Ван Аллен К., Ван Ю, Вайс Т, Эстолл Дж. Л., Малвихилл Э. Э., Скритон Р. А.; Diabetes Action Canada и Канадская сеть исследований и обучения островков.