Содержание
Водород
|
Водород | |
|---|---|
|
Атомный номер |
1 |
|
Внешний вид простого вещества |
газ без цвета, вкуса и запаха |
|
Свойства атома | |
|
Атомная масса (молярная масса) |
1,00794 а.е.м. (г/моль) |
|
Радиус атома |
79 пм |
|
Энергия ионизации (первый электрон) |
1311,3 кДж/моль (эВ) |
|
Электронная конфигурация |
1s1 |
|
Химические свойства | |
|
Ковалентный радиус |
32 пм |
|
Радиус иона |
54 (−1 e) пм |
|
Электроотрицательность (по Полингу) |
2,20 |
|
Электродный потенциал |
|
|
Степени окисления |
1, −1 |
|
Термодинамические свойства простого вещества | |
|
Плотность вещества |
0,0000899 (при 273K (0 °C)) г/см³ |
|
Молярная теплоёмкость |
14,235 Дж/(K·моль) |
|
Теплопроводность |
0,1815 Вт/(м·K) |
|
Температура плавления |
14,01K |
|
Теплота плавления |
0,117 кДж/моль |
|
Температура кипения |
20,28K |
|
Теплота испарения |
0,904 кДж/моль |
|
Молярный объём |
14,1 см³/моль |
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
гексагональная |
|
Параметры решётки |
a=3,780 c=6,167 Å |
|
Отношение c/a |
1,631 |
|
Температура Дебая |
110 K |
|
H |
1 |
|
1,00794 | |
|
1s1 | |
|
Водород | |
Водород является первым элементом периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H— протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H— протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Трое из пяти изотопов водорода имеют собственные названия: 1H— протий (Н), 2H— дейтерий (D) и 3H— тритий (радиоактивен) (T).
Простое вещество водород— H2— лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
История водорода
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и М. В. Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Г. Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы.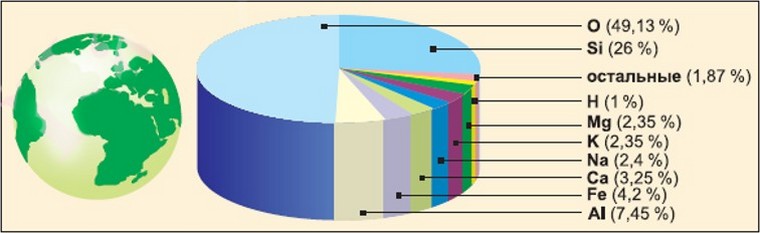 Французский химик А. Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Французский химик А. Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия водород
Лавуазье дал водороду название hydrogène (отὕδωρ— «вода» и γενναω— «рождаю»)— «рождающий воду». Русское наименование «водород» предложил химик М.Ф.Соловьев в 1824 году— по аналогии с ломоносовским «кислородом».
Распространённость водорода
Во Вселенной
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92% всех атомов (8% составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1%). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
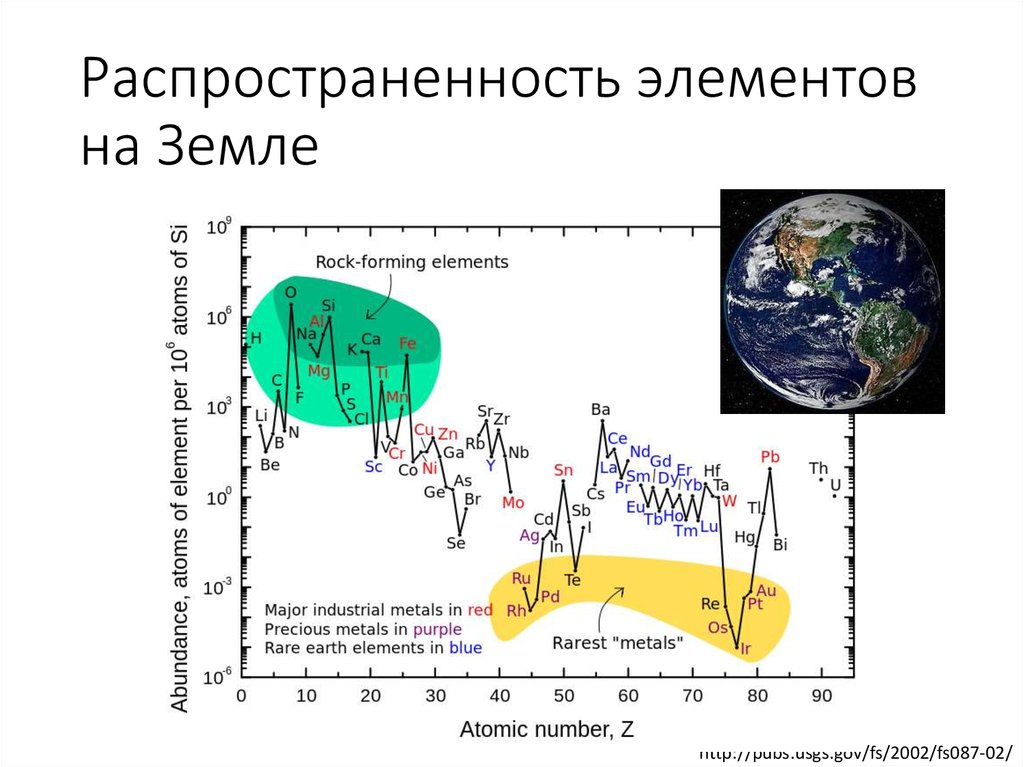
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1%— это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17% (второе место после кислорода, доля атомов которого равна ~52%). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005% по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50%.
Получение Водорода
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом— выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Так, кислород, имеющийся в свободном состоянии, получают физическим способом— выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода— реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
СН4 +2Н2O =CO2↑ +4Н2 −165 кДж
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который иногда применяется и в промышленности,— разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
Получение водорода в промышленности
1.Электролиз водных растворов солей:
2NaCl +2H2O → H2↑ +2NaOH +Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
H2O +C ⇄ H2↑ +CO↑
3.Из природного газа.
Конверсия с водяным паром:
CH4 +H2O ⇄ CO↑ +3H2↑ (1000°C)
Каталитическое окисление кислородом:
2CH4 +O2 ⇄ 2CO↑ +4H2↑
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
Получение водорода в лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn +2HCl → ZnCl2 +H2↑
2. Взаимодействие кальция с водой:|
Взаимодействие кальция с водой:|
Ca +2H2O → Ca(OH)2 +H2↑
3.Гидролиз гидридов:
NaH +H2O → NaOH +H2↑
4.Действие щелочей на цинк или алюминий:
2Al +2NaOH +6H2O → 2Na[Al(OH)4] +3H2↑
Zn +2KOH +2H2O → K2[Zn(OH)4] +H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ +2e— → H2↑ +2H2O
Дополнительная информация про Водород
Биореактор для производства водорода
Физические свойства Водорода
Спектр излучения водорода
Эмиссионный спектр водорода
Равновесная мольная концентрация пара-водорода
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвездной среды— с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвездной среды— с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9·106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Фазовая диаграмма водорода
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см3) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79% пара-Н2, 0,21% орто-Н2.
Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79% пара-Н2, 0,21% орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см3 (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии, пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Изотопы
Давление пара для различных изотопов водорода
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H— протий (Н), 2Н— дейтерий (D), 3Н— тритий (радиоактивный) (T).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1и 2. Содержание их в природе соответственно составляет 99,9885±0,0070% и 0,0115 ± 0,0070%. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
В литературе также приводятся данные об изотопах водорода с массовыми числами 4— 7и периодами полураспада 10−22— 10−23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
|
|
Температура плавления, K |
Температура кипения, K |
Тройная точка, K /kPa |
Критическая точка, K /kPa |
Плотность жидкий /газ, кг/м³ |
|---|---|---|---|---|---|
|
H2 |
13.  95 95 |
20,39 |
13,96 /7,3 |
32,98 /1,31 |
70,811 /1,316 |
|
HD |
16,60 |
22,13 |
16,60 /12,8 |
35,91 /1,48 |
114,80 /1,802 |
|
HT |
|
22,92 |
17,63 /17,7 |
37,13 /1,57 |
158,62 /2,310 |
|
D2 |
18,62 |
23,67 |
18,73 /17,1 |
38,35 /1,67 |
162,50 /2,230 |
|
DT |
|
24.38 |
19,71 /19,4 |
39,42 /1,77 |
211,54 /2,694 |
|
T2 |
|
25,04 |
20,62 /21,6 |
40,44 /1,85 |
260,17 /3,136 |
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Химические свойства
Доля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
-
Н2 =2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
-
Ca +Н2 =СаН2
и с единственным неметаллом— фтором, образуя фтороводород:
-
F2 +H2 =2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
-
О2 +2Н2 =2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
-
CuO +Н2 =Cu +Н2O
Записанное уравнение отражает восстановительные свойства водорода.
-
N2 +3H2 → 2NH3
С галогенами образует галогеноводороды:
-
F2 +H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
-
Cl2 +H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
-
C +2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
-
2Na +H2 → 2NaH -
Ca +H2 → CaH2 -
Mg +H2 → MgH2
Гидриды— солеобразные, твёрдые вещества, легко гидролизуются:
-
CaH2 +2H2O → Ca(OH)2 +2H2↑
Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
-
CuO +H2 → Cu +H2O
-
Fe2O3 +3H2 → 2Fe +3H2O
-
WO3 +3H2 → W+3H2O
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений.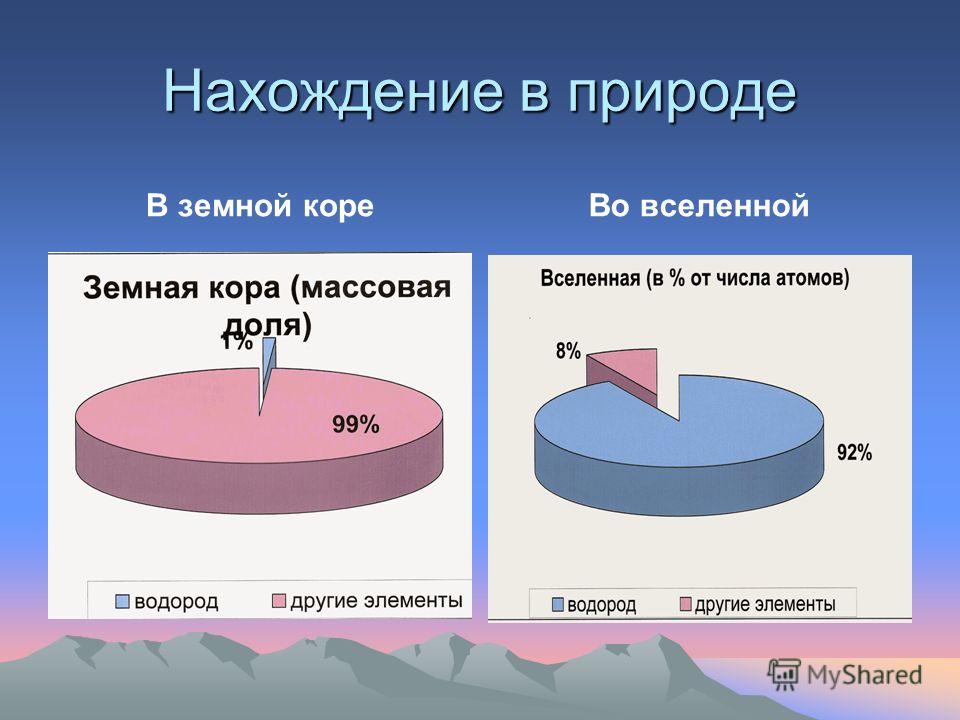 Эти процессы навзывают реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Эти процессы навзывают реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, гигантскими планетами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением. Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Особенности обращения
|
|
Применение водорода
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
При производстве аммиака, метанола, мыла и пластмасс
Пищевая промышленность
При производстве маргарина из жидких растительных масел.
Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ)
Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XXв. произошло несколько катастроф, когда дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием.
Топливо
Водород используют в качестве ракетного топлива. Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Водород, Hydrogenium, Н (1)
Как горючий (воспламеняемый) воздух водород известен довольно давно. Его получали действием кислот на металлы, наблюдали горение и взрывы гремучего газа Парацельс, Бойль, Лемери и другие ученые XVI— XVIII вв. С распространением теории флогистона некоторые химики пытались получить водород в качестве «свободного флогистона». В диссертации Ломоносова «О металлическом блеске» описано получение водорода действием «кислотных спиртов» (например, «соляного спирта», т. е. соляной кислоты) на железо и другие металлы; русский ученый первым (1745) выдвинул гипотезу, о том что водород («горючий пар»— vapor inflammabilis) представляет собой флогистон. Кавендиш, подробно исследовавший свойства водорода, выдвинул подобную же гипотезу в 1766 г. Он называл водород «воспламеняемым воздухом», полученным из «металлов» (Inflammable air from metals), и полагал, как и все флогистики, что при растворении в кислотах металл теряет свой флогистон. Лавуазье, занимавшийся в 1779 г. исследованием состава воды путем ее синтеза и разложения, назвал водород Hydrogine (гидроген), или Hydrogene (гидрожен), от греч. гидор— вода и гайноме— произвожу, рождаю.
Лавуазье, занимавшийся в 1779 г. исследованием состава воды путем ее синтеза и разложения, назвал водород Hydrogine (гидроген), или Hydrogene (гидрожен), от греч. гидор— вода и гайноме— произвожу, рождаю.
Номенклатурная комиссия 1787 г. приняла словопроизводство Hydrogene от геннао, рождаю. В «Таблице простых тел» Лавуазье водород (Hydrogene) упомянут в числе пяти (свет, теплота, кислород, азот, водород) «простых тел, относящихся ко всем трем царствам природы и которые следует рассматривать как элементы тел»; в качестве старых синонимов названия Hydrogene Лавуазье называет горючий газ (Gaz inflammable), основание горючего газа. В русской химической литературе конца XVIII и начала XIX в. встречаются два рода названий водорода: флогистические (горючий газ, горючий воздух, воспламенительный воздух, загораемый воздух) и антифлогистические (водотвор, водотворное существо, водотворный гас, водородный гас, водород). Обе группы слов представляют собой переводы французских названий водорода.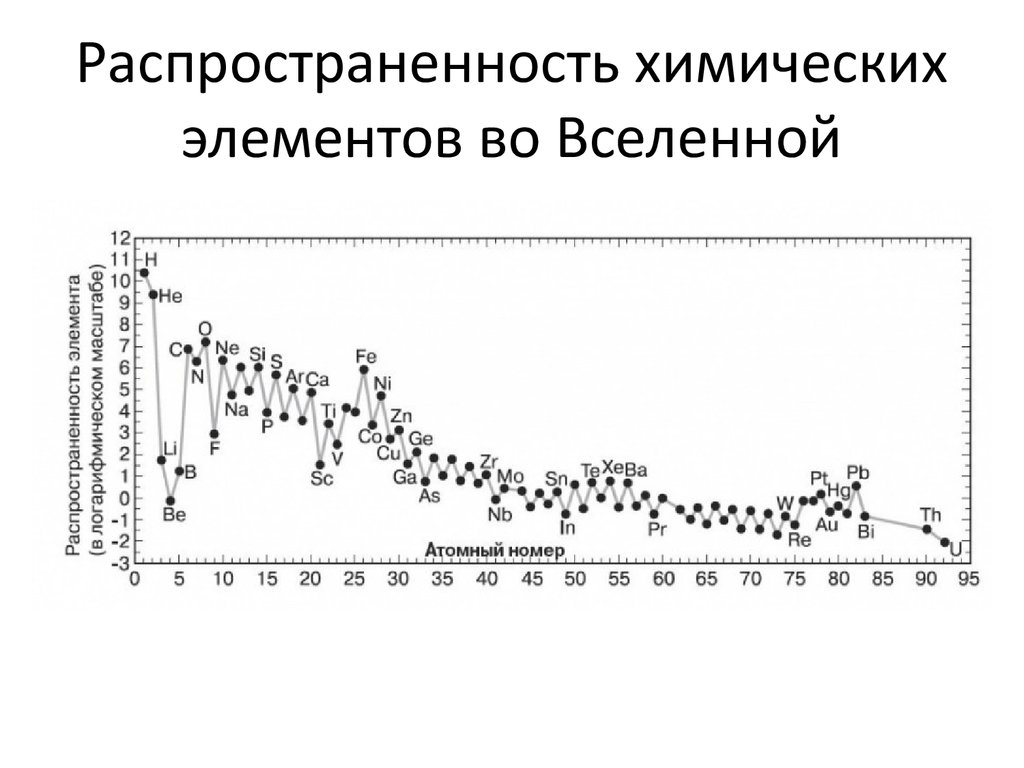
Изотопы водорода были открыты в 30-x годах текущего столетия и быстро приобрели большое значение в науке и технике. В конце 1931 г. Юри, Брекуэдд и Мэрфи исследовали остаток после длительного выпаривания жидкого водорода и обнаружили в нем тяжелый водород с атомным весом 2. Этот изотоп назвали дейтерием (Deuterium, D) от греч.— другой, второй. Спустя четыре года в воде, подвергнутой длительному электролизу, был обнаружен еще более тяжелый изотоп водорода 3Н, который назвали тритием (Tritium, Т), от греч.— третий.
Газ водород, физические свойства водорода, химические свойства водорода.
ПродажаПроизводствоДоставка
Газообразный
марка 4.6марка 5.0марка 6.0марка 7.0
особой чистоты марка «А»особой чистоты марка «Б»особой чистоты марка Втехнический марка «А»
технический марка «Б»технический марка «В»чистый I сорт
Жидкий
технический марка «А»технический марка «Б»технический марка «В»
Водород (лат. Hydrogenium; обозначается символом H) — первый элемент периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H — протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Hydrogenium; обозначается символом H) — первый элемент периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H — протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T).
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и рядеметаллов: железе, никеле, палладии, платине.
История
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия
Лавуазье дал водороду название hydrogène — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии сломоносовским «кислородом».
Распространённость
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
Получение
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
СН4 + 2Н2O = CO2↑ + 4Н2 −165 кДж
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который иногда применяется и в промышленности, — разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
В промышленности
1.Электролиз водных растворов солей:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C:
H2O + C ? H2 + CO
3.Из природного газа.
Конверсия с водяным паром:
CH4 + H2O ? CO + 3H2 (1000 °C)
Каталитическое окисление кислородом:
2CH4 + O2 ? 2CO + 4H2
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn + 2HCl → ZnCl2 + H2↑
2.Взаимодействие кальция с водой:
Ca + 2H2O → Ca(OH)2 + H2↑
3. Гидролиз гидридов:
Гидролиз гидридов:
NaH + H2O → NaOH + H2↑
4.Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e− → H2↑ + 2H2O
Физические свойства
Водород может существовать в двух формах (модификациях) — в виде орто- и пара- водорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.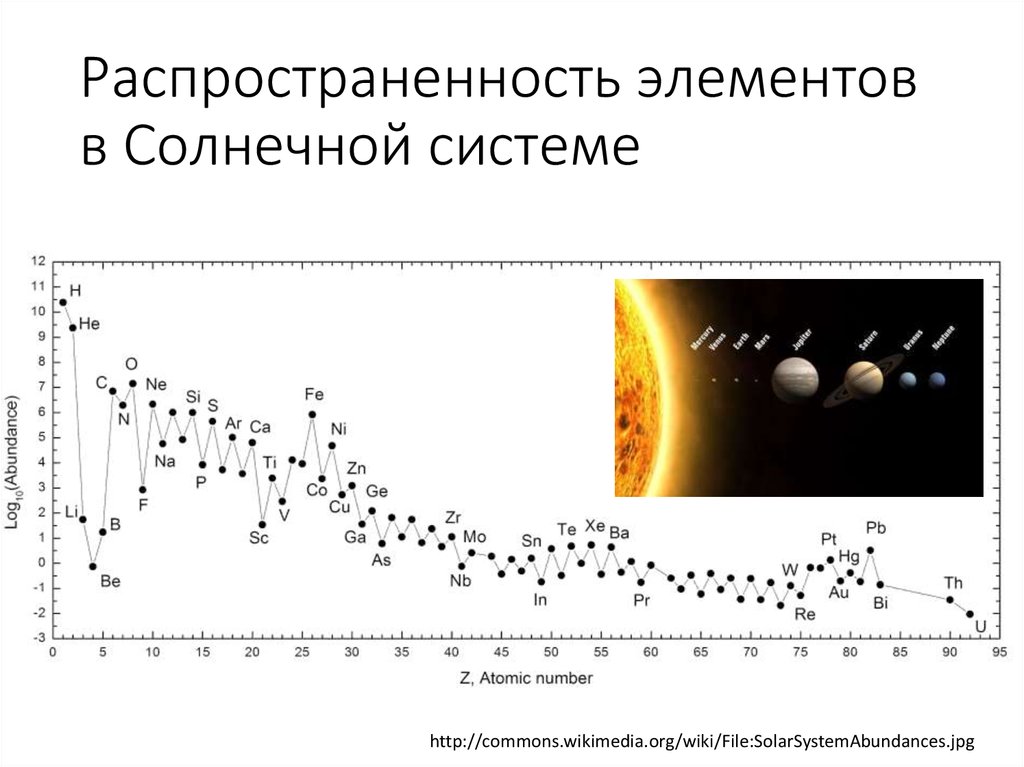
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвездной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9×106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см3) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см3 (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии,пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Изотопы
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (радиоактивный) (T).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
В литературе также приводятся данные об изотопах водорода с массовыми числами 4 — 7 и периодами полураспада 10−22 — 10−23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
|
|
Температура
|
Температура
|
Тройная
|
Критическая
|
Плотность
|
|
H2
|
13.
|
20,39
|
13,96 / 7,3
|
32,98 / 1,31
|
70,811 / 1,316
|
|
D
|
16,65
|
22,13
|
16,60 / 12,8
|
35,91 / 1,48
|
114,80 / 1,802
|
|
HT
|
|
22,92
|
17,63 / 17,7
|
37,13 / 1,57
|
158,62 / 2,310
|
|
D2
|
18,65
|
23,67
|
18,73 / 17,1
|
38,35 / 1,67
|
162,50 / 2,230
|
|
DT
|
|
24.
|
19,71 / 19,4
|
39,42 / 1,77
|
211,54 / 2,694
|
|
T2
|
20,63
|
25,04
|
20,62 / 21,6
|
40,44 / 1,85
|
260,17 / 3,136
|
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Химические свойства
Доля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2 = 2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2
и с единственным неметаллом — фтором, образуя фтороводород:
F2 + H2 = 2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
О2 + 2Н2 = 2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
CuO + Н2 = Cu + Н2O
Записанное уравнение отражает восстановительные свойства водорода.
N2 + 3H2 → 2NH3
С галогенами образует галогеноводороды:
F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
2Na + H2 → 2NaH
Ca + H2 → CaH2
Mg + H2 → MgH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
CuO + H2 → Cu + H2O
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений.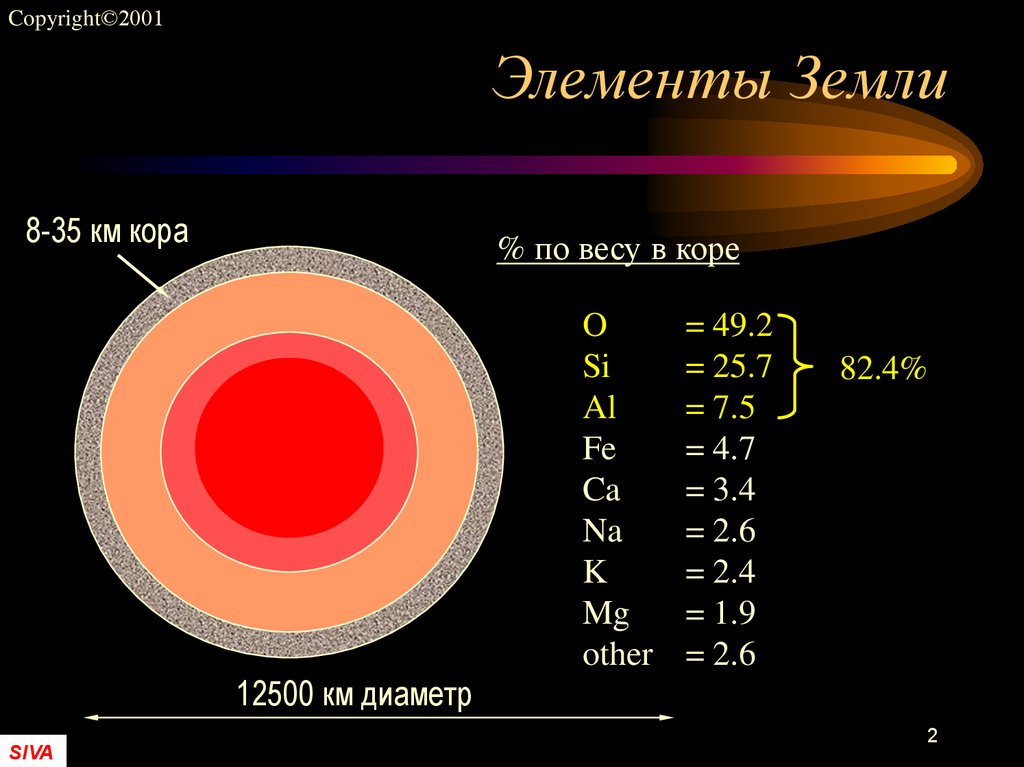 Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр.Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр.Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.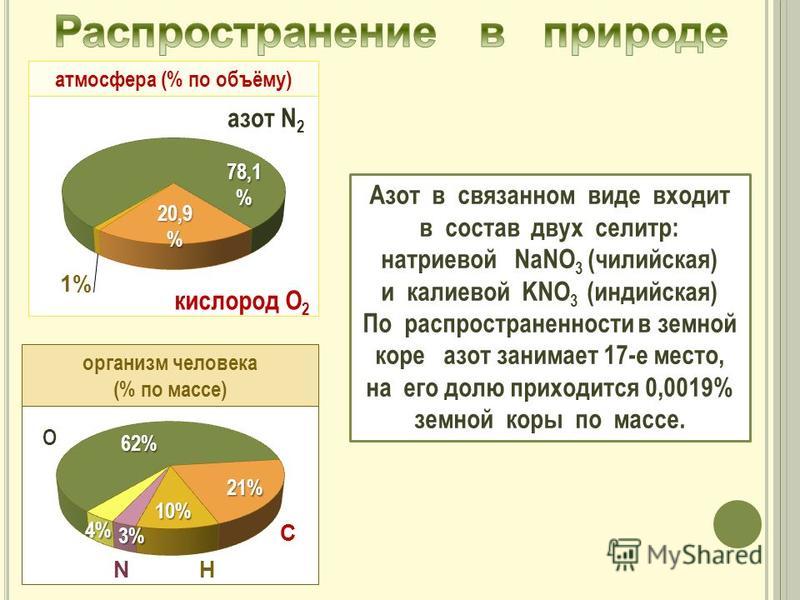
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением . Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Особенности обращения
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водородпожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75(74) % объёмных.
Экономика
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2-5$ за кг.
Применение
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
- При производстве аммиака, метанола, мыла и пластмасс
- При производстве маргарина из жидких растительных масел
- Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ)
Пищевая промышленность
Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколькокатастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Топливо
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.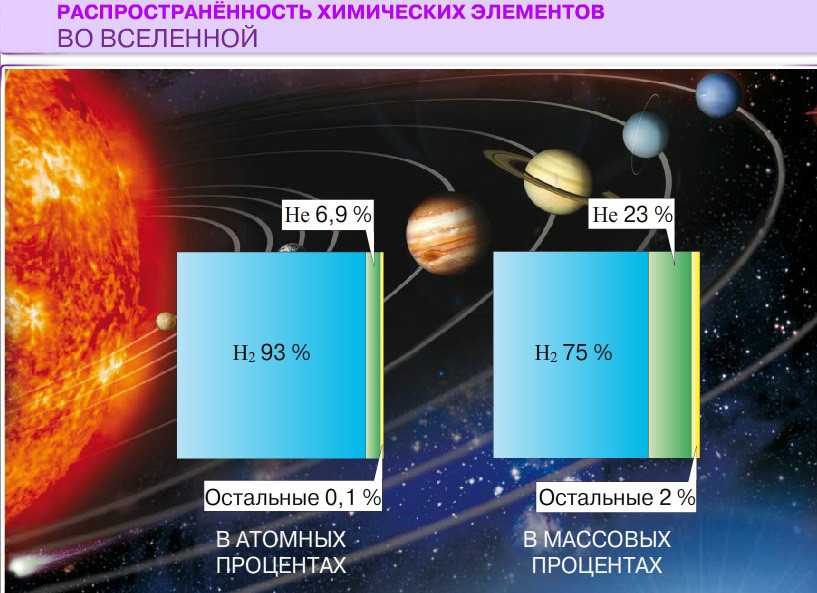
«Жидкий водород» («ЖВ») — жидкое агрегатное состояние водорода, с низкой удельной плотностью 0.07 г/см³ и криогенными свойствами с точкой замерзания 14.01 K (−259.14 °C) и точкой кипения 20.28 K (−252.87 °C). Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4-75 %. Спиновое соотношение изомеров в жидком водороде составляет: 99,79 % —параводород; 0,21 % — ортоводород. Коэффициент расширения водорода при смене агрегатного состояния на газообразное составляет 848:1 при 20°C.
Как и для любого другого газа, сжижение водорода приводит к уменьшению его объема. После сжижения «ЖВ» хранится в термически изолированных контейнерах под давлением. Жидкий водород (англ. Liquid hydrogen, Lh3, LH2) активно используется в промышленности, в качестве формы хранения газа, и в космическойотрасли, в качестве ракетного топлива.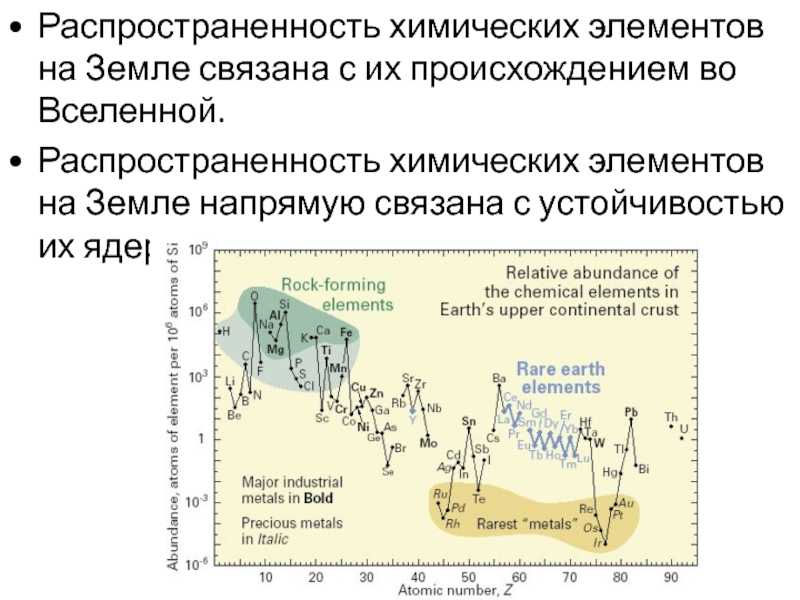
История
Первое документированное использование искусственного охлаждения в 1756 году было осуществлено английским ученым Вильямом Калленом, Гаспар Монж первым получил жидкое состояние оксида серы в 1784 году, Майкл Фарадей первым получил сжиженный аммиак, американский изобретатель Оливер Эванс первым разработал холодильный компрессор в 1805 году, Яков Перкинс первым запатентовал охлаждающую машину в 1834 году и Джон Гори первым в США запатентовалкондиционер в 1851 году. Вернер Сименс предложил концепцию регенеративного охлаждения в 1857 году, Карл Линде запатентовал оборудование для получения жидкого воздуха с использованием каскадного «эффекта расширения Джоуля — Томсона» и регенеративного охлаждения [6] в 1876 году. В 1885 году польскийфизик и химик Зигмунд Вро?блевский опубликовал критическую температуру водорода 33 K, критическое давление 13.3 атм. и точку кипения при 23 K. Впервыеводород был сжижен Джеймсом Дьюаром в 1898 году с использованием регенеративного охлаждения и своего изобретения, cосуда Дьюара. Первый синтез стабильного изомера жидкого водорода — параводорода — был осуществлен Полом Хартеком и Карлом Бонхеффером в 1929 году.
Первый синтез стабильного изомера жидкого водорода — параводорода — был осуществлен Полом Хартеком и Карлом Бонхеффером в 1929 году.
Спиновые изомеры водорода
Водород при комнатной температуре состоит в основном из спинового изомера, ортоводорода. После производства, жидкий водород находится в метастабильном состоянии и должен быть преобразован в параводородную форму, для того чтобы избежать взрывоопасной экзотермической реакции, которая имеет место при его изменении при низких температурах. Преобразование в параводородную фазу обычно производится с использованием таких катализаторов, как оксид железа, оксид хрома, активированный уголь, покрытых платиной асбестов, редкоземельных металлов или путем использования урановых или никелевых добавок.
Использование
Жидкий водород может быть использован в качестве формы хранения топлива для двигателей внутреннего сгорания и топливных элементов. Различные подлодки(проекты «212А» и «214», Германия) и концепты водородного транспорта были созданы с использованием этой агрегатной формы водорода (см. например «DeepC»или «BMW h3R»). Благодаря близости конструкций, создатели техники на «ЖВ» могут использовать или только модифицировать системы, использующие сжиженный природный газ («СПГ»). Однако из-за более низкой объемной плотности энергии для горения требуется больший объем водорода, чем природного газа. Если жидкий водород используется вместо «СПГ» в поршневых двигателях, обычно требуется более громоздкая топливная система. При прямом впрыске увеличившиеся потери во впускном тракте уменьшают наполнение цилиндров.
например «DeepC»или «BMW h3R»). Благодаря близости конструкций, создатели техники на «ЖВ» могут использовать или только модифицировать системы, использующие сжиженный природный газ («СПГ»). Однако из-за более низкой объемной плотности энергии для горения требуется больший объем водорода, чем природного газа. Если жидкий водород используется вместо «СПГ» в поршневых двигателях, обычно требуется более громоздкая топливная система. При прямом впрыске увеличившиеся потери во впускном тракте уменьшают наполнение цилиндров.
Жидкий водород используется также для охлаждения нейтронов в экспериментах по нейтронному рассеянию. Массы нейтрона и ядра водорода практически равны, поэтому обмен энергией при упругом столкновении наиболее эффективен.
Преимущества
Преимуществом использования водорода является «нулевая эмиссия» его применения. Продуктом его взаимодействия с воздухом является вода.
Препятствия
Один литр «ЖВ» весит всего 0. 07 кг. То есть его удельная плотность составляет 70.99 г/л при 20 K. Жидкий водород требует криогенной технологии хранения, такой как специальные термически изолированные контейнеры и требует особого обращения, что свойственно для всех криогенных материалов. Он близок в этом отношении к жидкому кислороду, но требует большей осторожности из-за пожароопасности. Даже в случае с контейнерами с тепловой изоляцией, его тяжело содержать при той низкой температуре, которая требуется для его сохранения в жидком состоянии (обычно он испаряется со скоростью 1 % в день). При обращении с ним также нужно следовать обычным мерам безопасности при работе с водородом — он достаточно холоден для сжижения воздуха, что взрывоопасно.
07 кг. То есть его удельная плотность составляет 70.99 г/л при 20 K. Жидкий водород требует криогенной технологии хранения, такой как специальные термически изолированные контейнеры и требует особого обращения, что свойственно для всех криогенных материалов. Он близок в этом отношении к жидкому кислороду, но требует большей осторожности из-за пожароопасности. Даже в случае с контейнерами с тепловой изоляцией, его тяжело содержать при той низкой температуре, которая требуется для его сохранения в жидком состоянии (обычно он испаряется со скоростью 1 % в день). При обращении с ним также нужно следовать обычным мерам безопасности при работе с водородом — он достаточно холоден для сжижения воздуха, что взрывоопасно.
Ракетное топливо
Жидкий водород является распространенным компонентом ракетных топлив, которое используется для реактивного ускорения ракет-носителей и космических аппаратов. В большинстве жидкостных ракетных двигателях на водороде, он сначала применяется для регенеративного охлаждения сопла и других частей двигателя, перед его смешиванием с окислителем и сжиганием для получения тяги. Используемые современные двигатели на компонентах H2/O2 потребляют переобогащенную водородом топливную смесь, что приводит к некоторому количеству несгоревшего водорода в выхлопе. Кроме увеличения удельного импульсадвигателя за счет уменьшения молекулярного веса, это еще сокращает эрозию сопла и камеры сгорания.
Используемые современные двигатели на компонентах H2/O2 потребляют переобогащенную водородом топливную смесь, что приводит к некоторому количеству несгоревшего водорода в выхлопе. Кроме увеличения удельного импульсадвигателя за счет уменьшения молекулярного веса, это еще сокращает эрозию сопла и камеры сгорания.
Такие препятствия использования «ЖВ» в других областях, как криогенная природа и малая плотность, являются также сдерживающим фактором для использования в данном случае. На 2009 год существует только одна ракета-носитель (РН «Дельта-4»), которая целиком является водородной ракетой. В основном «ЖВ» используется либо на верхних ступенях ракет, либо на блоках, которые значительную часть работы по выводу полезной нагрузки в космос выполняют в вакууме. В качестве одной из мер по увеличению плотности этого вида топлива существуют предложения использования шугообразного водорода, то есть полузамерзшей формы «ЖВ».
Происхождение элементов
Приблизительно 73% массы видимой Вселенной находится в форме водорода.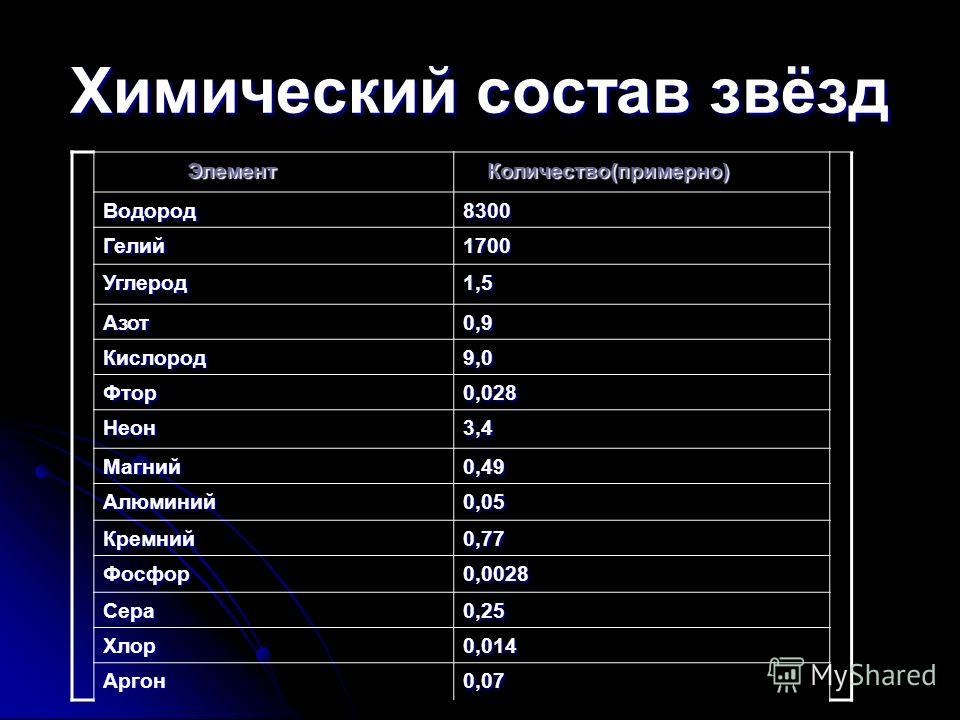 Гелий составляет около 25% массы, а все остальное составляет всего 2%. Хотя содержание этих более массивных («тяжелых», A > 4) элементов кажется довольно низким, важно помнить, что большинство атомов в наших телах и на Земле являются частью этой небольшой части материи Земли. вселенная. Элементы с малой массой, водород и гелий, были произведены в горячих и плотных условиях рождения самой Вселенной. Рождение, жизнь и смерть звезды описываются в терминах ядерных реакций. Химические элементы, составляющие материю, которую мы наблюдаем во Вселенной, были созданы в результате этих реакций.
Гелий составляет около 25% массы, а все остальное составляет всего 2%. Хотя содержание этих более массивных («тяжелых», A > 4) элементов кажется довольно низким, важно помнить, что большинство атомов в наших телах и на Земле являются частью этой небольшой части материи Земли. вселенная. Элементы с малой массой, водород и гелий, были произведены в горячих и плотных условиях рождения самой Вселенной. Рождение, жизнь и смерть звезды описываются в терминах ядерных реакций. Химические элементы, составляющие материю, которую мы наблюдаем во Вселенной, были созданы в результате этих реакций.
Приблизительно 15 миллиардов лет назад Вселенная началась как чрезвычайно горячая и плотная область лучистой энергии, Большой Взрыв. Сразу после образования он начал расширяться и охлаждаться. Лучистая энергия произвела кварк-антикварки и электрон-позитроны, а также другие пары частица-античастица. Однако когда частицы и античастицы столкнутся в высокоэнергетическом газе, они аннигилируют обратно в электромагнитную энергию. По мере расширения Вселенной средняя энергия излучения становилась меньше. Рождение и аннигиляция частиц продолжались до тех пор, пока температура не снизилась настолько, что создание пар стало энергетически невозможным.
По мере расширения Вселенной средняя энергия излучения становилась меньше. Рождение и аннигиляция частиц продолжались до тех пор, пока температура не снизилась настолько, что создание пар стало энергетически невозможным.
Одним из признаков Большого взрыва, сохранившихся до наших дней, является длинноволновое излучение, заполняющее Вселенную. Это радиация, оставшаяся от первоначального взрыва. Текущая температура этого «фонового» излучения составляет 2,7 К. (Температура Т газа или плазмы и средняя кинетическая энергия частиц Е связаны постоянной Больцмана К = 1,38 х 10 -23 Дж/К, в уравнении E = kT .) На рис. 10.1 показаны температуры на различных этапах временной эволюции Вселенной от кварк-глюонной плазмы до настоящего времени.
Сначала кварки и электроны существовали в виде плазмы лишь мимолетно, потому что аннигиляция удаляла их так же быстро, как и создавала. Когда Вселенная остыла, кварки сконденсировались в нуклоны.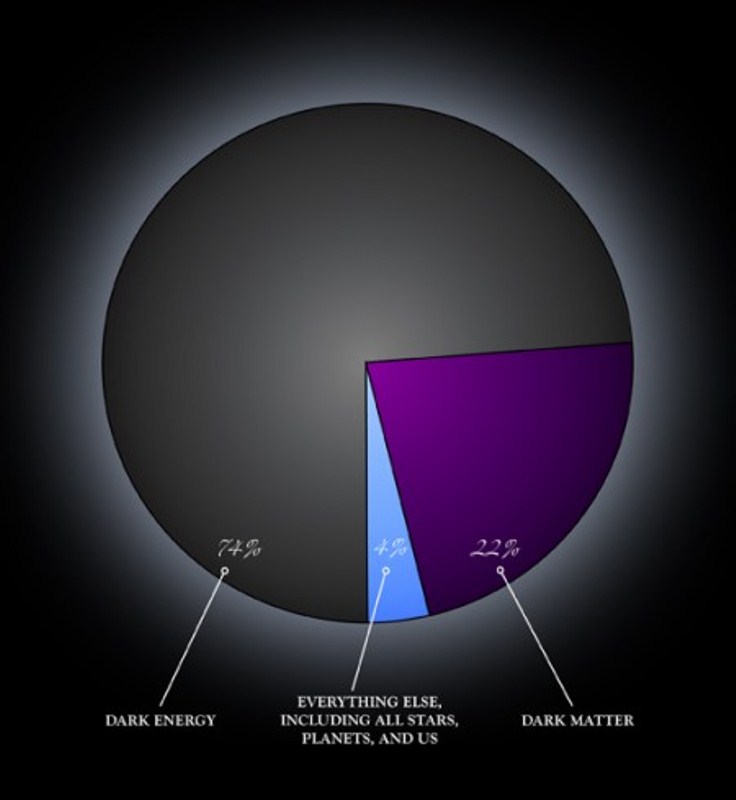 Этот процесс был похож на то, как пар конденсируется в капли жидкости при охлаждении водяного пара. Дальнейшее расширение и охлаждение позволило нейтронам и некоторым протонам слиться с ядрами гелия. Содержание водорода 73% и гелия 25%, существующее сегодня во Вселенной, обусловлено периодом конденсации в течение первых трех минут. 2% ядер, более массивных, чем гелий, присутствующих во Вселенной сегодня, были созданы позже в звездах.
Этот процесс был похож на то, как пар конденсируется в капли жидкости при охлаждении водяного пара. Дальнейшее расширение и охлаждение позволило нейтронам и некоторым протонам слиться с ядрами гелия. Содержание водорода 73% и гелия 25%, существующее сегодня во Вселенной, обусловлено периодом конденсации в течение первых трех минут. 2% ядер, более массивных, чем гелий, присутствующих во Вселенной сегодня, были созданы позже в звездах.
Ядерные реакции, в результате которых из нейтронов и протонов образовался 4 He, были реакциями радиационного захвата. Свободные нейтроны и протоны, слитые с дейтерием (d или 2 H) с избыточной энергией, испускаемой в виде гамма-излучения с энергией 2,2 МэВ,
n + p Æ d + g.
Эти дейтроны могли затем захватить другой нейтрон или свободный протон с образованием трития ( 3 H) или 3 He,
d + n Æ 3 H + g и d + p Æ 3 He + g.
Наконец, 4 Он был получен в результате реакций:
d+ d Æ 4 He + g, 3 He + n Æ 4 He + g и 3 H + p Æ 4 He + g.
Значительное количество ядер более массивных, чем 4 Он не образовался в результате Большого Взрыва, потому что плотности и энергии частиц были недостаточно велики, чтобы инициировать дальнейшие ядерные реакции.
Потребовались сотни тысяч лет дальнейшего охлаждения, пока средние энергии ядер и электронов не стали достаточно низкими для образования стабильных атомов водорода и гелия. Примерно через миллиард лет облака холодного атомарного водорода и газообразного гелия начали стягиваться под действием их взаимных гравитационных сил. Облака нагревались по мере того, как они сжимались до более высокой плотности. Когда температура газообразного водорода достигла нескольких миллионов кельвинов, в ядрах этих протозвезд начались ядерные реакции. Теперь в ядрах очень массивных звезд стали образовываться более массивные элементы.
Содержание главы
- Солнце
- Другие звезды
- Книги и статьи
Какие химические элементы содержатся в организме человека?
Реджинальд ДейвиРецензия на Софию Ковени
Химические элементы являются строительным материалом жизни. Они составляют ошеломляющее разнообразие молекул, которые объединяются в ДНК, клеточные органеллы, клетки, ткани и органы. В этой статье мы обсудим те элементы, которые присутствуют в человеческом теле, их пропорции и различные основные функции, которые они выполняют.
Они составляют ошеломляющее разнообразие молекул, которые объединяются в ДНК, клеточные органеллы, клетки, ткани и органы. В этой статье мы обсудим те элементы, которые присутствуют в человеческом теле, их пропорции и различные основные функции, которые они выполняют.
Изображение предоставлено bestber/Shutterstock.com
Элементы, из которых состоит человеческое тело
Во всех смыслах и целях тело представляет собой чрезвычайно сложный механизм. Для этого требуется множество частей, работающих вместе в сложных отношениях от микро- до макромолекулярного уровня. Строение строительных блоков, составляющих сумму таких частей, как белки и нуклеиновые кислоты, определяется соотношением и взаимодействием химических элементов.
Некоторые элементы встречаются гораздо чаще, чем другие. Человеческое тело примерно на 99% состоит всего из шести элементов: кислорода, водорода, азота, углерода, кальция и фосфора. Еще пять элементов составляют около 0,85% оставшейся массы: сера, калий, натрий, хлор и магний. Все эти 11 элементов являются важными элементами.
Все эти 11 элементов являются важными элементами.
Оставшиеся 0,15% тела человека состоят из микроэлементов. Суммарная масса микроэлементов не соответствует массе магния, который является наименее распространенным из неследовых элементов. Некоторые из микроэлементов (около дюжины или около того) могут быть необходимы для жизни, если верить лабораторным данным.
Функция химических элементов в организме
Большинство химических элементов, присутствующих в организме человека, играют жизненно важную роль. Некоторые микроэлементы, такие как титан и цезий, могут быть загрязнителями. Некоторые, такие как свинец, ртуть, мышьяк и кадмий, являются активными токсинами в зависимости от присутствующего количества.
Основные элементы в организме человека выполняют следующие функции в процентах от массы:
Кислород
Кислород является наиболее распространенным элементом в организме человека, составляющим примерно 65,0% массы тела. Большая часть присутствующего кислорода находится в форме воды. Кислород играет решающую роль в обмене веществ и дыхании, и этот элемент содержится в каждой основной органической молекуле в организме, включая белки, углеводы, жиры и нуклеиновые кислоты.
Кислород играет решающую роль в обмене веществ и дыхании, и этот элемент содержится в каждой основной органической молекуле в организме, включая белки, углеводы, жиры и нуклеиновые кислоты.
Углерод
Углерод является следующим наиболее распространенным элементом в организме человека, составляющим 18% массы тела. Его роль в основном структурная, образуя «костяк» многих органических молекул.
Водород
Водород является самым распространенным элементом во Вселенной (около 75% общей массы) и составляет около 10% массы человеческого тела. Он присутствует в форме воды (наряду с кислородом), а также является важным элементом в органических молекулах.
Азот
Азот составляет 3% массы тела человека. Он содержится во всех организмах в таких молекулах, как аминокислоты (из которых состоят белки), нуклеиновые кислоты (ДНК и РНК) и аденозинтрифосфат (АТФ), важная молекула переноса энергии.
Кальций
Кальций является наиболее распространенным металлом в организме человека, его содержание составляет около 1,4% по массе.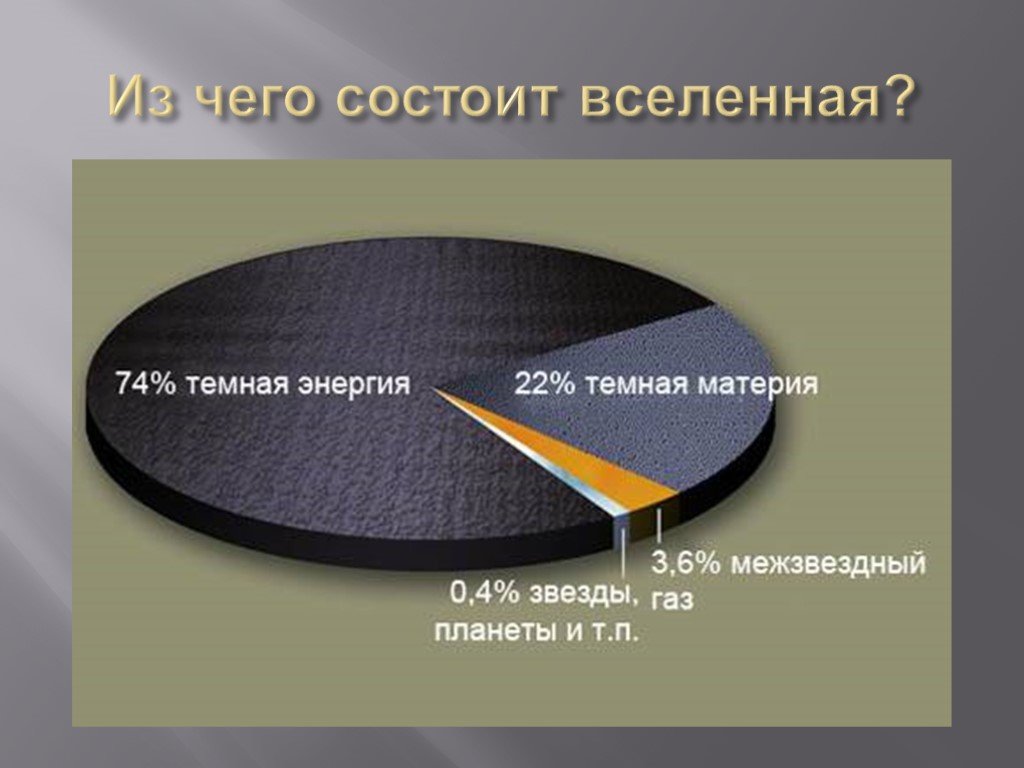 Возможно, его наиболее известная функция заключается в формировании костей и зубов, а недостаток кальция в рационе может привести к различным дегенеративным состояниям. Другие важные роли в организме человека включают синтез белка, поддержание разности потенциалов на клеточных мембранах и действие в качестве вторичных мессенджеров в путях передачи сигнала.
Возможно, его наиболее известная функция заключается в формировании костей и зубов, а недостаток кальция в рационе может привести к различным дегенеративным состояниям. Другие важные роли в организме человека включают синтез белка, поддержание разности потенциалов на клеточных мембранах и действие в качестве вторичных мессенджеров в путях передачи сигнала.
Фосфор
Фосфор обладает высокой реакционной способностью, и из-за этого свойства он никогда не встречается на Земле в виде свободного элемента. Фосфаты необходимы для жизни, и эта связанная форма фосфора является основным компонентом основных органических молекул, таких как фосфолипиды, АТФ и нуклеиновые кислоты. Он составляет 1,1% от общей массы тела человека.
Калий
Калий составляет менее 1% массы тела. Он играет жизненно важную роль в передаче нервных импульсов посредством переноса ионов калия через мембраны нервных клеток.
Сера
Десятый по распространенности элемент во Вселенной и пятый по распространенности на Земле, сера играет важную роль в организме человека. В организме почти всегда находится в виде сульфидов металлов и сероорганических соединений. Сера также является основным структурным элементом белкового кератина, который содержится в коже и волосах.
В организме почти всегда находится в виде сульфидов металлов и сероорганических соединений. Сера также является основным структурным элементом белкового кератина, который содержится в коже и волосах.
Натрий
Натрий, щелочной металл, обычно содержится в соли. Ионы натрия способствуют осмотическому давлению, поскольку они являются основным катионом внеклеточной жидкости (ECF). Натрий также играет ключевую роль в передаче нервных импульсов.
Хлор
Хлор играет важную роль в поддержании кислотно-щелочного баланса крови, а также в формировании сухожилий, зубов и костей. Он обычно содержится в солях и в сочетании с калием и натрием в организме. Он также способствует функции печени и помогает устранять органические отходы.
Магний
Магний является наименее распространенным из основных элементов в организме человека. Около 300 или около того ферментов требуют ионов магния для правильного функционирования, а ионы магния взаимодействуют с такими соединениями, как ДНК, РНК и АТФ.
Микроэлементы
Микроэлементы играют множество ролей, некоторые из них более важны, чем другие, в то время как другие не выполняют никакой заметной функции. Некоторые активно токсичны для человека.
Тремя наиболее распространенными незаменимыми микроэлементами являются железо, фтор и цинк. Железо играет важную роль в здоровье человека как часть гемоглобина, который транспортирует кислород по телу в крови. Фтор важен для зубов. Цинк необходим для более чем 300 ферментов и 1000 факторов транскрипции и жизненно важен для здоровья глаз и роста репродуктивных органов.
Изображение предоставлено: Aldona Griskeviciene/Shutterstock.com
В заключение
Основным источником всех этих элементов является диета. Некоторые элементы более важны, чем другие, и они находятся в ошеломляющем множестве соединений и молекул в организме человека.
Некоторые из них могут даже причинять активный вред организму, а уровни их присутствия в организме могут определять, насколько опасны последствия.


 96
96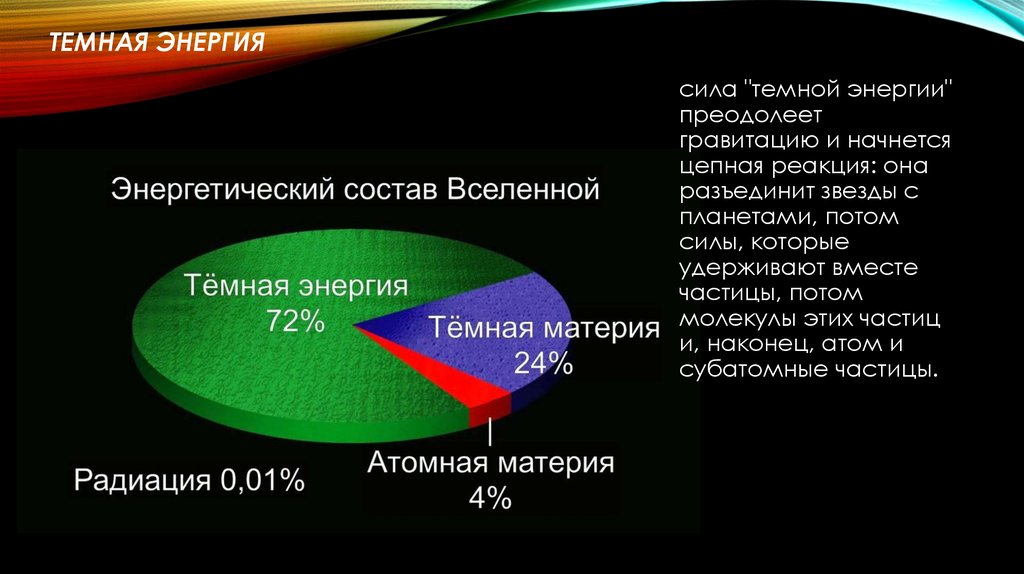 38
38