Содержание
Ученые создали искусственное легкое, которое можно носить в рюкзаке
Поиск по сайту
Кейсы
27 марта 2017
Далее
Александра
Самуилкина
27 марта 2017
Александра
Самуилкина
27 марта 2017
Исследователи из Питтсбургского университета разработали компактное искусственное легкое, которое помещается в рюкзаке и позволяет свободно передвигаться пациентам, ожидающим пересадки этого органа.
Читайте «Хайтек» в
В настоящее время пациентам, легкие которых не могут выполнять свою функцию, приходится пользоваться громоздкими медицинскими установками, которые искусственно насыщают поступающую в них кровь кислородом и поглощают углекислый газ. Такие устройства хорошо справляются со своей задачей, однако пациент не может активно двигаться и вынужден постоянно находиться на больничной койке в период ожидания трансплантации, который может достигать нескольких месяцев, пишет New Scientist.
Такие устройства хорошо справляются со своей задачей, однако пациент не может активно двигаться и вынужден постоянно находиться на больничной койке в период ожидания трансплантации, который может достигать нескольких месяцев, пишет New Scientist.
Малоподвижный образ жизни плохо сказывается на состоянии здоровья пациента, и впоследствии он хуже переносит операцию по пересадке легких. Для того, чтобы решить эту проблему, исследователи из Питтсбургского университета в США разработали искусственное легкое, которое можно уместить в рюкзаке и позволит пациентам поддерживать физическую активность.
«Homo sapiens перестанет существовать через столетие»
Мнения
Устройство объединяет в себе функции легких и сердечной мышцы (у большинства людей с легочной недостаточностью наблюдаются также проблемы с сердцем) и соединяется с организмом пациента через шею. «Мы стремились максимально сократить количество трубок, которые выходят из тела», — говорит ведущий автор исследования Уильям Федершпиль.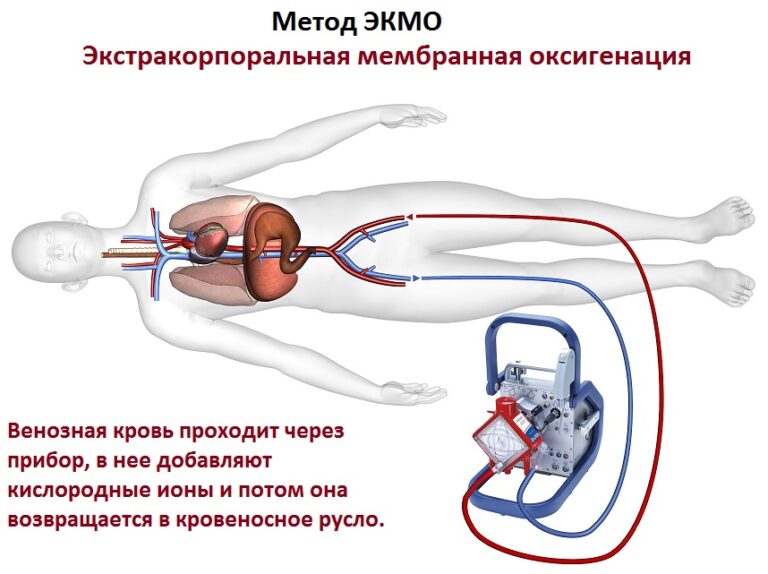
В этом месяце ученые опубликовали результаты тестирования системы на четырех овцах — кровь всех животных успешно насыщалась кислородом с помощью устройства в течение 6 часов подряд. Однако, прежде чем начинать тесты с участием людей, исследователям потребуется провести более длительные эксперименты на животных (продолжительностью не менее месяца).
Ученый создал прототип робомобиля, которому не нужны лидары и радары
Идеи
Нехватка донорских органов — это одно из самых серьезных препятствий, с которыми сталкиваются люди с заболеваниями сердца или легких. В сентябре прошлого года исследователям из Калифорнийского университета в Лос-Анджелесе удалось вырастить миниатюрные модели легких человека на основе стволовых клеток, однако на данном этапе исследований они могут использоваться только для изучения болезней или клинических испытаний лекарственных препаратов.
Читать ещё
Поздравляем, вы оформили подписку на дайджест Хайтека! Проверьте вашу почту
Спасибо, Ваше сообщение успешно отправлено.
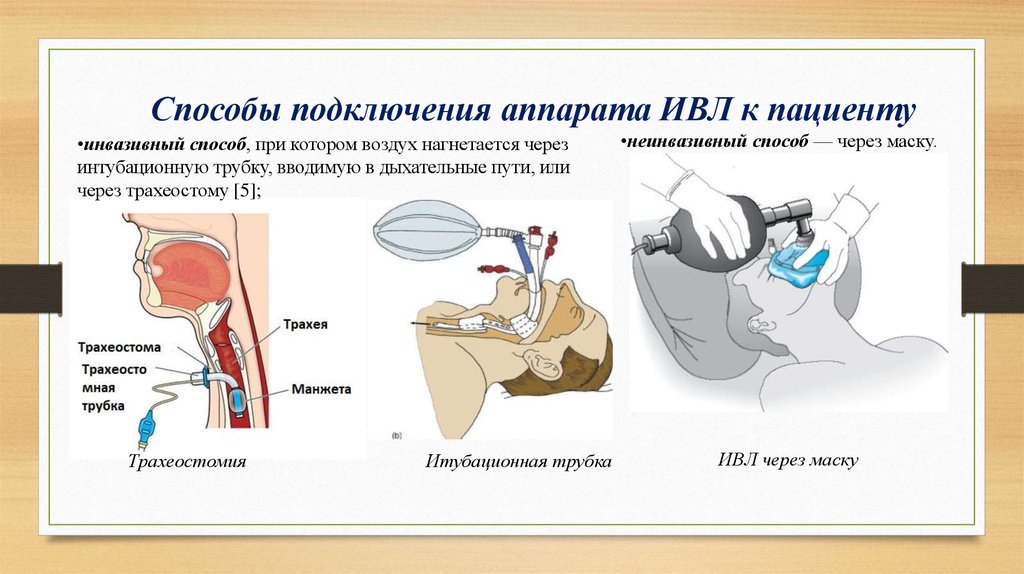
Искусственное легкое
То, что вдувание воздуха в легкие может оживить человека, знали с древнейших времен, но вспомогательные приборы для этого начали производить только в средние века. В 1530 году Парацельс впервые применил ротовой воздуховод с кожаными мехами, предназначенными для раздувания огня в камине. Через 13 лет Везалеус опубликовал труд «О строении человеческого тела», в котором обосновал пользу вентиляции легких через введенную в трахею трубку. А в 2013 году исследователи Университета Кейс Вестерн Резерв создали прототип искусственного легкого. Аппарат использует очищенный атмосферный воздух и не нуждается в концентрированном кислороде. Устройство по структуре напоминает человеческое легкое с силиконовыми капиллярами и альвеолами и работает на механической помпе. Биополимерные трубки имитирую разветвления бронхов на бронхиолы. В будущем запланировано совершенствование аппарата с привязкой к сокращениям миокарда. Мобильное устройство с большой вероятностью может заменить транспортный аппарат ИВЛ.
Размеры искусственного легкого — до 15x15x10 сантиметров, размеры его хотят максимально приблизить к человеческому органу. Огромная площадь газовой диффузионной мембраны дает 3-х — 5-ти кратное повышение эффективность кислородообмена.
Пока прибор тестируется на свиньях, но тесты уже показали его эффективность при дыхательной недостаточности. Внедрение искусственного легкого поможет отказаться от более массивных транспортных аппаратов ИВЛ, работающих со взрывоопасными кислородными баллонами.
Искусственное легкое позволяет активизировать пациента, в противном случае прикованного к постельному реаниматологическому либо транспортному аппарату ИВЛ. А с активизацией возрастают шанс на выздоровление и психологическое состояние.
Пациенты, ожидающие пересадки донорского легкого, обычно вынуждены находиться в больнице довольно долго на аппарате для искусственной оксигенации, пользуясь которым, можно только лежать в койке и наблюдать, как за тебя дышит машина.
Проект искусственного легкого, способного протезировать дыхательную недостаточность, дает этим пациентам шанс на скорейшее выздоровление.
В комплект портативного искусственного легкого входит само легкое и насос для крови. Автономная работа рассчитана на срок до трех месяцев. Малые размеры аппарата позволяют ему заменить транспортный аппарат ИВЛ экстренных медицинских служб.
Работа легкого основана на портативном насосе, обогащающем кровь газами воздуха.
Некоторым людям (особенно новорожденным детям) не требуется длительная подача высококонцентрированного кислорода из-за его окислительных свойств.
Еще один нестандартный аналог ИВЛ, применяемый при высоком повреждении спинного мозга, — чрезкожная электростимуляция диафрагмальных нервов («френикус-стимуляция»). Разработан трансплевральный массаж легких по В. П. Смольникову — создание в плевральных полостях состояния пульсирующего пневмоторакса.
Плюсы классической ИВЛ – в ее универсальности при любой патологии. К минусам относится баротравма, полностью внешнее управление и возможность врачебной ошибки при настраивании техники. Искусственное легкое разрабатывается с целью возврата контроля над дыханием самому пациенту.
Компания ВестМедГрупп имеет в своем ассортименте широкий выбор аппаратуры для жизнеобеспечения пациента (транспортные аппараты ИВЛ, кардиографы, дефибрилляторы, медицинские компрессоры) и оказывает услуги обучения персонала и постпродажного техобслуживания.
Команда Мультицентра стремится создать систему искусственного легкого в домашних условиях | VUMC Reporter
16 февраля 2022 г., 15:21
Мэтт Бэтчелдор
Медицинский центр Университета Вандербильта разделит федеральный грант в размере 8,7 млн долларов на создание системы искусственных легких, которую смогут использовать пациенты с неизлечимыми заболеваниями легких. использовать дома.
Грант Министерства обороны США по Программе медицинских исследований под руководством Конгресса (CDMRP) будет финансировать исследования по созданию и тестированию устройства, которое предназначено для пациентов, которые не могут достаточно долго ждать трансплантации легких или не являются кандидатами на нее.
Мэтью Баккетта, доктор медицины, магистр делового администрирования, магистр медицины
Целью устройства является уход за такими пациентами на неопределенный срок, сказал Мэтью Бакчетта, доктор медицинских наук, магистр делового администрирования, магистр медицины, профессор хирургии и адъюнкт-профессор биомедицинской инженерии, который возглавляет исследовательскую группу Вандербильта, работающую над Устройство. Устройство также может помочь пациентам реабилитироваться после временных опасных для жизни проблем с легкими и послужить мостом к трансплантации.
Более 12 миллионов человек страдают хроническими заболеваниями легких, и у большинства из них они связаны с хронической обструктивной болезнью легких (ХОБЛ).
Вероятность развития ХОБЛ у ветеранов примерно в три раза выше, чем у населения в целом, поэтому исследования финансируются военными, сказал Баккетта.
Между тем, по-настоящему амбулаторных искусственных легких не существует. Экстракорпоральная мембранная оксигенация (ЭКМО) — это поддерживающая жизнь механическая система, которая временно берет на себя функции сердца и легких у пациентов в критическом состоянии, но она проводится в больнице и не может использоваться в домашних условиях. А трансплантаты трудно получить пациентам из-за ограничительных критериев из-за отсутствия органов.
А трансплантаты трудно получить пациентам из-за ограничительных критериев из-за отсутствия органов.
«Необходимость помощи людям с хроническими заболеваниями легких настолько очевидна, потому что это буквально миллионы», — сказал Баккетта. «Очевидно, что трансплантация — единственный выход для таких пациентов. Если вы не можете получить пересадку, вы застряли в жизни с хроническим заболеванием легких. Потребность довольно велика, и мало что может ее удовлетворить».
Исследовательская группа Вандербильта разделит четырехлетний грант с командами из Университета Карнеги-Меллона и Корнельского университета.
Команда Вандербильта сосредоточится на разработке и тестировании режимов сосудистого доступа и эргономики устройства, а также на разработке газообменной части устройства. Баккетта надеется привлечь студентов Университета Вандербильта к участию в Институте хирургии и инженерии Вандербильта (VISE).
Группа Корнелла работает над технологией покрытия, чтобы сделать устройство более биосовместимым, а группа Карнеги-Меллона также будет работать над частью газообмена, создаст программу телемедицины, которая позволит удаленно контролировать устройство, и разработает антикоагулянты, которые позволят пациенты продлили использование системы. Общими усилиями руководит Кит Кук, доктор философии, глава отдела биомедицинской инженерии в Карнеги-Меллон. Он и Баккетта сотрудничают уже несколько лет.
Общими усилиями руководит Кит Кук, доктор философии, глава отдела биомедицинской инженерии в Карнеги-Меллон. Он и Баккетта сотрудничают уже несколько лет.
«Намерение состоит в том, что это потенциально может использоваться в течение многих лет», — сказал Баккетта. «Это совсем другой подход к дизайну, чем у ECMO. Это отличается, потому что ЭКМО является временным и ограничено настройкой отделения интенсивной терапии. Это не входит в наши дизайнерские замыслы. Мы полностью стерли эту чертежную доску и создали новую чертежную доску, которая ориентирована на лечение хронических заболеваний легких в надежной и устойчивой форме, действительно в качестве целевой терапии».
Искусственное легкое — Петрелла — Journal of Thoracic Disease
Обзор статьи
Francesco Petrella 1,2 , Lorenzo Spaggiari 1,2
1 Отделение торакальной хирургии, Европейский институт онкологии, Милан, Италия; 2 Кафедра онкологии и гематоонкологии Миланского университета, Милан, Италия
Пожертвования: (I) Концепция и дизайн: Ф. Петрелла; (II) Административная поддержка: Ф. Петрелла; (III) Предоставление материалов для исследования или пациентов: F Petrella; (IV) Сбор и сбор данных: F Petrella; (V) Анализ и интерпретация данных: F Petrella; (VI) Написание рукописи: все авторы; (VII) Окончательное утверждение рукописи: все авторы.
Петрелла; (II) Административная поддержка: Ф. Петрелла; (III) Предоставление материалов для исследования или пациентов: F Petrella; (IV) Сбор и сбор данных: F Petrella; (V) Анализ и интерпретация данных: F Petrella; (VI) Написание рукописи: все авторы; (VII) Окончательное утверждение рукописи: все авторы.
Адрес для связи: Франческо Петрелла, доктор медицинских наук. Отделение торакальной хирургии, Европейский институт онкологии, Via Ripamonti 435, Милан 20141, Италия. Электронная почта: [email protected]; [email protected].
Abstract: Трансплантация легких остается окончательным методом лечения терминальной стадии заболевания легких. Однако будущее применение тканевой биоинженерии может преодолеть нехватку донорских органов и потребность в иммуносупрессии. Конечной целью инженерии легочной ткани является воссоздание всего спектра специализированных тканей легких и, таким образом, обеспечение физиологических функций посредством биоинженерных проводящих дыхательных путей, сосудистой системы и ткани газообмена.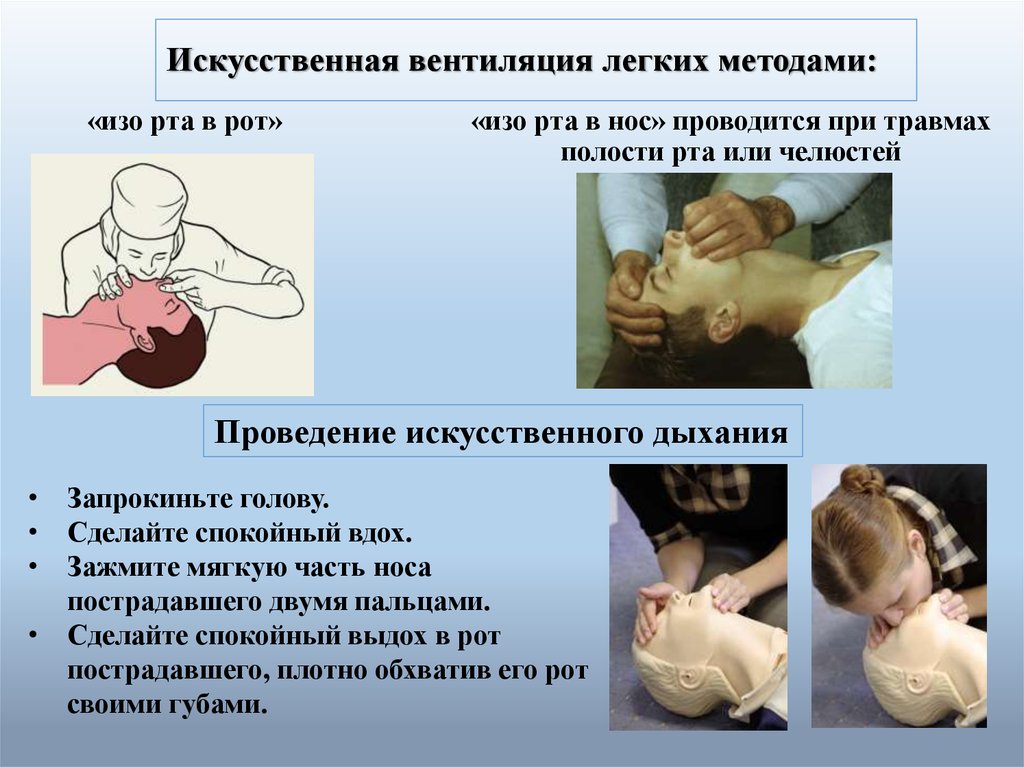 В этом обзоре основное внимание уделяется текущим исследованиям в области разработки искусственных легких, открытым вопросам, достижениям на сегодняшний день и тому, как тканевая инженерия и технология стволовых клеток могут в дальнейшем способствовать клиническому применению биоискусственных легких. Хотя было показано, что экспериментальная трансплантация биоискусственных легких, полученных путем перфузии децеллюляризованных или синтетических каркасов, обеспечивает газообмен in vivo в течение длительного периода, следует четко признать, что разработка трансплантируемого биоискусственного легкого далека от реальности.
В этом обзоре основное внимание уделяется текущим исследованиям в области разработки искусственных легких, открытым вопросам, достижениям на сегодняшний день и тому, как тканевая инженерия и технология стволовых клеток могут в дальнейшем способствовать клиническому применению биоискусственных легких. Хотя было показано, что экспериментальная трансплантация биоискусственных легких, полученных путем перфузии децеллюляризованных или синтетических каркасов, обеспечивает газообмен in vivo в течение длительного периода, следует четко признать, что разработка трансплантируемого биоискусственного легкого далека от реальности.
Ключевые слова: Искусственное легкое; регенеративная медицина; стволовая клетка
Поступила 12 декабря 2017 г. Принята к публикации 14 декабря 2017 г.
Терминальная стадия заболевания легких, а именно хроническая обструктивная болезнь легких (ХОБЛ), является четвертой по значимости причиной смерти во всем мире (1). Растущие показатели курения табака и воздействия загрязнителей воздуха еще больше увеличат число пациентов с ХОБЛ, что создает острую потребность в новых терапевтических стратегиях.
Растущие показатели курения табака и воздействия загрязнителей воздуха еще больше увеличат число пациентов с ХОБЛ, что создает острую потребность в новых терапевтических стратегиях.
Экстракорпоральная мембранная оксигенация (ЭКМО) и искусственная вентиляция легких могут быть временно использованы в этом сценарии в качестве моста к трансплантации легких, которая остается единственным окончательным методом лечения, но необходимость иммуносупрессии и нехватка донорских органов являются основными ограничениями для более широкого клинического воздействия (2 ).
Регенеративная медицина, тканевая инженерия и технологии стволовых клеток, объединяющие области инженерии и биологии, могут обеспечить новые стратегии лечения недостаточности органов-мишеней, тем самым устраняя проблемы нехватки органов, долгосрочной иммуносупрессии и хронического отторжения.
Биология стволовых клеток легких
Легкие обладают значительной репаративной способностью, когда это необходимо, в ответ на выборочные повреждения и раздражители.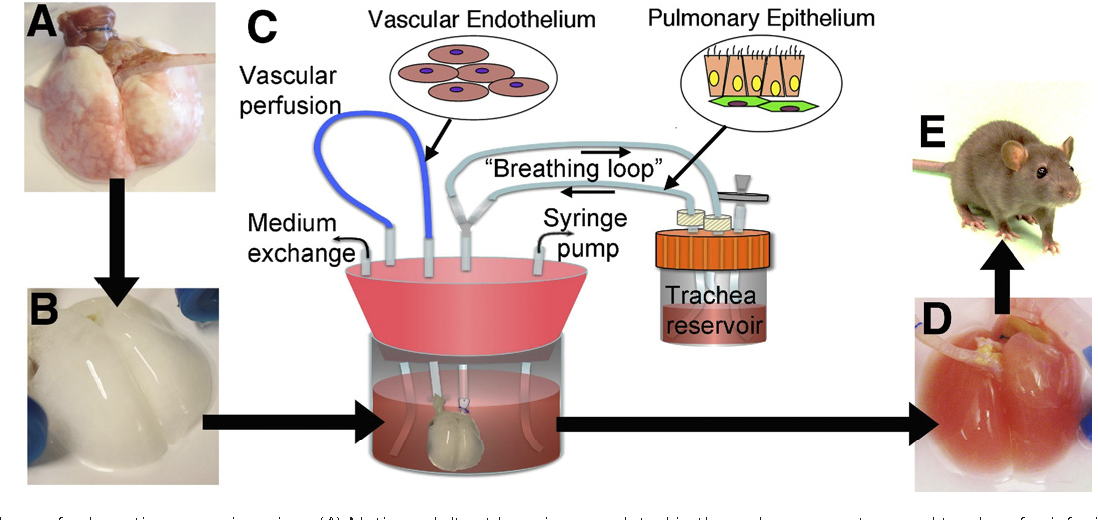 Наиболее вероятные гипотезы, объясняющие это, заключаются в том, что легкие могут реагировать на стресс активацией популяций стволовых клеток или повторным входом в клеточный цикл для повторного заселения поврежденных клеток. Базальные клетки могут функционировать как тканеспецифические стволовые клетки эпителия дыхательных путей в проксимальных дыхательных путях, в то время как в дистальных дыхательных путях бронхиолярный эпителий находится в состоянии покоя до тех пор, пока не произойдет повреждение, когда подмножество секреторных клеток, называемых вариантными клубными клетками, проявляет потенциал пролиферации в ответ. к травме. Альвеолярные эпителиальные клетки II типа считаются идеальными кандидатами на роль клеток-предшественников альвеол легких взрослых, и некоторые из них могут пролиферировать, самообновляться и образовывать альвеолярные эпителиальные клетки I типа. На переходе от бронхиолярного к альвеолярному участку дистального отдела дыхательных путей находится соединение бронхоальвеолярного протока, где некоторые варианты булавовидных клеток обладают регенеративным потенциалом эпителия дыхательных путей после индуцированного повреждения легких.
Наиболее вероятные гипотезы, объясняющие это, заключаются в том, что легкие могут реагировать на стресс активацией популяций стволовых клеток или повторным входом в клеточный цикл для повторного заселения поврежденных клеток. Базальные клетки могут функционировать как тканеспецифические стволовые клетки эпителия дыхательных путей в проксимальных дыхательных путях, в то время как в дистальных дыхательных путях бронхиолярный эпителий находится в состоянии покоя до тех пор, пока не произойдет повреждение, когда подмножество секреторных клеток, называемых вариантными клубными клетками, проявляет потенциал пролиферации в ответ. к травме. Альвеолярные эпителиальные клетки II типа считаются идеальными кандидатами на роль клеток-предшественников альвеол легких взрослых, и некоторые из них могут пролиферировать, самообновляться и образовывать альвеолярные эпителиальные клетки I типа. На переходе от бронхиолярного к альвеолярному участку дистального отдела дыхательных путей находится соединение бронхоальвеолярного протока, где некоторые варианты булавовидных клеток обладают регенеративным потенциалом эпителия дыхательных путей после индуцированного повреждения легких. Эти варианты клеток известны как бронхоальвеолярные стволовые клетки, хотя их существование in vivo оспаривался (3).
Эти варианты клеток известны как бронхоальвеолярные стволовые клетки, хотя их существование in vivo оспаривался (3).
Устройства, имитирующие легкие
Трехмерные (3D) клеточные культуры являются лучшими моделями для воспроизведения основных функций физиологии легких, преодолевая многие ограничения двухмерных систем клеточных культур, которые не могут воссоздать клеточную среду in vivo (4). Культуры поверхности раздела воздух-жидкость получают путем культивирования эпителиальных клеток дыхательных путей пациентов для моделирования патологических состояний, таких как муковисцидоз, астма и вызванное табаком повреждение клеток дыхательных путей, тем самым проливая больше света на лежащую в основе патофизиологию (5).
Органоиды представляют собой эволюцию трехмерных моделей клеточных культур, основанную на свойствах стволовых клеток дифференцироваться в различные специализированные типы клеток и самоорганизовываться в трехмерную модель со специфическими для органов или тканей свойствами и функциями (6).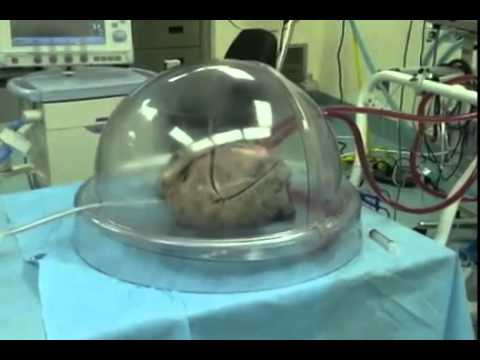 Хотя легочные органоиды, происходящие из одной единственной стволовой клетки, еще не были описаны, в нескольких исследованиях сообщалось о создании легочных органоидов из человеческих плюрипотентных стволовых клеток, первичных респираторных клеток и клеточных линий (7). Недавняя эволюция биоинженерии привела к созданию «органов на чипе», то есть биоинженерных устройств, воспроизводящих свойства и активность тканей и органов в контролируемой среде (8). Впервые описан Huh и др. , модель «легкие на чипе» воспроизводила сосудисто-альвеолярную модель с использованием клеток легочного эпителия, подвергавшихся воздействию газов воздуха, с одной стороны, и клеток эндотелия сосудов легких, подвергавшихся воздействию проточной культуральной среды, с другой стороны проницаемой синтетической мембраны. (9). Эти устройства, вероятно, будут использоваться в ближайшем будущем в качестве систем поддержки дыхания или оксигенаторов.
Хотя легочные органоиды, происходящие из одной единственной стволовой клетки, еще не были описаны, в нескольких исследованиях сообщалось о создании легочных органоидов из человеческих плюрипотентных стволовых клеток, первичных респираторных клеток и клеточных линий (7). Недавняя эволюция биоинженерии привела к созданию «органов на чипе», то есть биоинженерных устройств, воспроизводящих свойства и активность тканей и органов в контролируемой среде (8). Впервые описан Huh и др. , модель «легкие на чипе» воспроизводила сосудисто-альвеолярную модель с использованием клеток легочного эпителия, подвергавшихся воздействию газов воздуха, с одной стороны, и клеток эндотелия сосудов легких, подвергавшихся воздействию проточной культуральной среды, с другой стороны проницаемой синтетической мембраны. (9). Эти устройства, вероятно, будут использоваться в ближайшем будущем в качестве систем поддержки дыхания или оксигенаторов.
Тканевая инженерия — это междисциплинарная область, применяющая принципы инженерии и биологии для восстановления, восстановления или регенерации функций тканей и органов (10).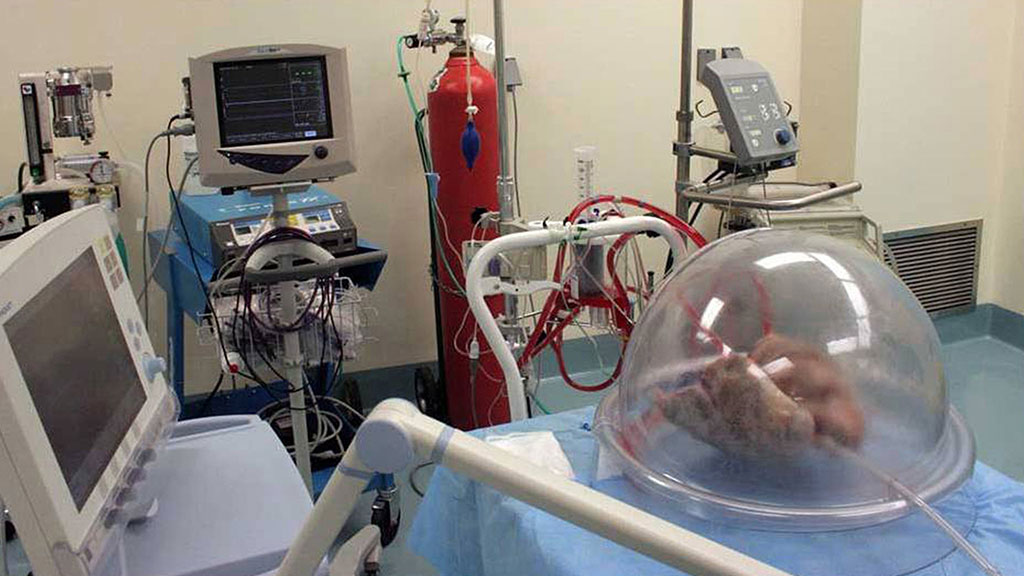 Он основан на источнике и типе клеток, типе каркаса и составе внеклеточного матрикса. В сложной области регенерации дыхательных путей и легких сообщалось о нескольких случаях биоинженерии трахеи (11-14), но привлекательная концепция биоинженерной замены трахеи не дала окончательного и надежного решения (15).
Он основан на источнике и типе клеток, типе каркаса и составе внеклеточного матрикса. В сложной области регенерации дыхательных путей и легких сообщалось о нескольких случаях биоинженерии трахеи (11-14), но привлекательная концепция биоинженерной замены трахеи не дала окончательного и надежного решения (15).
Основные принципы разработки искусственного легкого
Основную роль в процессе создания искусственного легкого играет синтетический интерфейс, через который происходит газообмен между кровью и воздухом. Эта поверхность образована стенками альвеол и сосудов и имеет общую площадь около 100 м 2 в нормальном легком взрослого человека (16). Своеобразным уже существующим искусственным легким является ЭКМО, механическое устройство, обычно используемое с 19 века.50s для респираторной поддержки во время кардиохирургии и интенсивной терапии. Газообмен осуществляется с помощью ЭКМО через пучок пористых полых волокон, которые в настоящее время могут быть чрезвычайно тонкими, что эффективно имитирует альвеолярную мембрану человека (17). Тем не менее, полимеры, используемые в волокнах, являются тромбогенными, что ограничивает активность ЭКМО кратковременными клиническими условиями, но все же с образованием сгустков на поверхности волокна (18).
Тем не менее, полимеры, используемые в волокнах, являются тромбогенными, что ограничивает активность ЭКМО кратковременными клиническими условиями, но все же с образованием сгустков на поверхности волокна (18).
Покрытие мембраны ЭКМО эпителиальными и эндотелиальными клетками человека может дополнительно имитировать нативную легочную сосудистую сеть. Противодействуя тромбогенным эффектам ЭКМО, это может привести к созданию миниатюрных носимых устройств ЭКМО, что потенциально может привести к созданию биоискусственных легких (19).-22).
Инженерия ткани легкого
Конечной целью инженерии легочной ткани является воссоздание всего спектра специализированных тканей легких и, таким образом, обеспечение физиологических функций за счет биоинженерных проводящих дыхательных путей, сосудистой системы и ткани газообмена (2). Одной из самых сложных задач биоинженерии легких является воспроизведение внеклеточного матрикса, белки которого необходимы для защиты хозяина и гомеостаза трансплантата. Синтетические каркасы обеспечивают газообмен, но не содержат белков внеклеточного матрикса и, следовательно, не содержат всех элементов, необходимых для успешного замещения легочной функции.
Синтетические каркасы обеспечивают газообмен, но не содержат белков внеклеточного матрикса и, следовательно, не содержат всех элементов, необходимых для успешного замещения легочной функции.
Еще одна важная проблема, которую необходимо решить, заключается в необходимости создания все более компактных сетей сосудистых потоков, способных к физиологическому кровотоку и газообмену, таким образом воссоздавая архитектурную иерархию легких (2). Одним из способов преодоления этих ограничений является децеллюляризация легких человека-донора, обеспечивающая именно сложную иерархическую структуру архитектуры сосудов и дыхательных путей легких. К сожалению, даже этот вариант имеет ряд недостатков: в случае неполной рецеллюляризации белки внеклеточного матрикса обнажаются и могут инициировать патологические репаративные реакции in vivo ; нарушение внеклеточного матрикса во время децеллюляризации может привести к деградации каркаса; наконец, поскольку для каждого процесса децеллюляризации требуется уже существующее нативное легкое человека, этот подход не решает проблему нехватки человеческих доноров, что делает неизбежным использование ксеногенных каркасов (23).
Легочные каркасы и клетки
Децеллюляризованное легкое свиньи представляет собой наилучшую модель ксеногенного каркаса, поскольку децеллюляризованная ткань свиньи уже широко используется в повседневной клинической практике для изготовления сердечных клапанов и сосудистых стентов. Однако, чтобы избежать риска зоонозной передачи и ксеногенных иммунологических побочных реакций, легкие свиньи нуждаются в обширной децеллюляризации и тщательном предварительном тестировании донора (18).
Искусственные каркасы должны быть неиммуногенными, биосовместимыми, нетоксичными, химически стабильными и хорошо переносимыми хозяином после имплантации во избежание побочных реакций. Синтетические гидрогели, такие как полиэтиленгликоль (ПЭГ) и поливиниловый спирт (ПВС), или синтетические эластомеры, такие как полиглицеринсебацинат (ПГС), могут быть идеальными кандидатами для воспроизведения сложной архитектуры легких (24-26).
Наиболее важными семействами клеток для развития искусственных легких являются эпителиальные клетки, выстилающие просвет дыхательных путей, и эндотелиальные клетки, выстилающие легочные сосуды.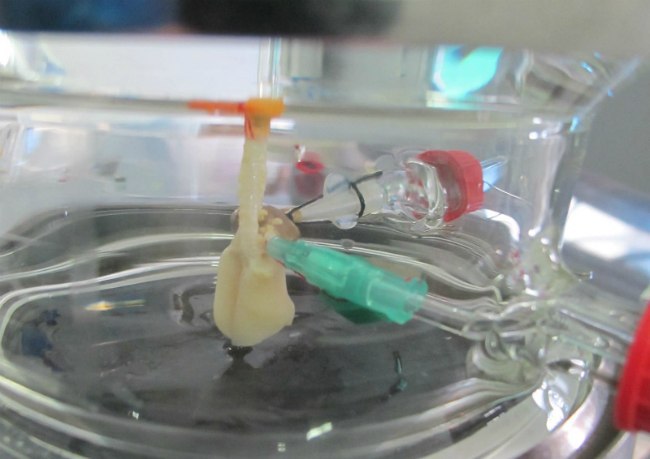 Для полного воспроизведения функций легких необходимы несколько других типов клеток, таких как альвеолярные макрофаги, гладкомышечные клетки и другие. Поскольку в легком есть свои собственные резидентные стволовые клетки, обеспечивающие самообновление в ответ на повреждение (27, 28), возможный подход к рецеллюляризации каркаса может заключаться в стимуляции собственных механизмов репарации реципиента для размещения этих клеток с их правильной пространственной ориентацией внутри децеллюляризированной ткани. или синтетический каркас. И наоборот, прямое повторное заполнение каркаса может быть предложено аутологичными стволовыми клетками, причем взрослые мезенхимальные стромальные клетки являются одними из лучших кандидатов для этой цели (13, 29).,30).
Для полного воспроизведения функций легких необходимы несколько других типов клеток, таких как альвеолярные макрофаги, гладкомышечные клетки и другие. Поскольку в легком есть свои собственные резидентные стволовые клетки, обеспечивающие самообновление в ответ на повреждение (27, 28), возможный подход к рецеллюляризации каркаса может заключаться в стимуляции собственных механизмов репарации реципиента для размещения этих клеток с их правильной пространственной ориентацией внутри децеллюляризированной ткани. или синтетический каркас. И наоборот, прямое повторное заполнение каркаса может быть предложено аутологичными стволовыми клетками, причем взрослые мезенхимальные стромальные клетки являются одними из лучших кандидатов для этой цели (13, 29).,30).
Выводы
Трансплантация легких остается окончательным методом лечения терминальной стадии заболевания легких, но будущие применения тканевой биоинженерии могут преодолеть нехватку донорских органов и потребность в иммуносупрессии. Хотя было показано, что экспериментальная трансплантация биоискусственных легких, полученных путем перфузии децеллюляризованных или синтетических каркасов, обеспечивает газообмен in vivo в течение длительного периода, следует четко признать, что его клиническое применение все еще далеко от реальности. В качестве альтернативы искусственным легким пути и пластичность стволовых клеток легких могут быть нацелены на новые соединения, чтобы стимулировать их вклад в регенерацию легких.
Хотя было показано, что экспериментальная трансплантация биоискусственных легких, полученных путем перфузии децеллюляризованных или синтетических каркасов, обеспечивает газообмен in vivo в течение длительного периода, следует четко признать, что его клиническое применение все еще далеко от реальности. В качестве альтернативы искусственным легким пути и пластичность стволовых клеток легких могут быть нацелены на новые соединения, чтобы стимулировать их вклад в регенерацию легких.
Благодарности
Нет.
Сноска
Конфликт интересов : У авторов нет конфликта интересов, о котором следует заявить.
Каталожные номера
- Rabe KF, Hurd S, Anzueto A, et al. Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких: краткое изложение GOLD. Am J Respir Crit Care Med 2007; 176: 532-55. [Перекрестная ссылка] [PubMed]
- Песня JJ, Ott HC.
 Биоискусственная инженерия легких. Am J Transplant 2012; 12: 283-8. [Перекрестная ссылка] [PubMed]
Биоискусственная инженерия легких. Am J Transplant 2012; 12: 283-8. [Перекрестная ссылка] [PubMed] - Петрелла Ф., Риццо С., Борри А. и др. Современные перспективы терапии мезенхимальными стромальными клетками дефектов тканей дыхательных путей. Стволовые клетки, 2015; 2015. [Перекрестная ссылка] [PubMed]
- Schilders KA, Eenjes E, van Riet S, et al. Регенерация легких: стволовые клетки легких и разработка устройств, имитирующих легкие. Респир Рес 2016;17:44. [Перекрестная ссылка] [PubMed]
- Wark PA, Johnston SL, Bucchieri F, et al. Эпителиальные клетки астматических бронхов имеют недостаточный врожденный иммунный ответ на инфекцию риновирусом. J Exp Med 2005; 201:937-47. [Перекрестная ссылка] [PubMed]
- Инь X, Мид Б.Е., Сафаи Х. и др. Инженерные органоиды стволовых клеток. Стволовая клетка 2016; 18:25-38. [Перекрестная ссылка] [PubMed]
- Надкарни Р.Р., Абед С., Дрейпер Дж.С. Органоиды как модельная система для изучения развития и заболеваний легких человека.
 Biochem Biophys Res Commun 2016;473:675-82. [Перекрестная ссылка] [PubMed]
Biochem Biophys Res Commun 2016;473:675-82. [Перекрестная ссылка] [PubMed] - Гьоревски Н., Ранга А., Лутольф М.П. Биоинженерные подходы к управлению органогенезом на основе стволовых клеток. Разработка 2014; 141:1794-804. [Перекрестная ссылка] [PubMed]
- Хью Д., Мэтьюз Б.Д., Маммото А. и др. Восстановление функций легких на уровне органов на чипе. Наука 2010;328:1662-8. [Перекрестная ссылка] [PubMed]
- Лангер Р., Ваканти Дж.П. Тканевая инженерия. Наука 1993;260:920-6. [Перекрестная ссылка] [PubMed]
- Петрелла Ф., Спаггиари Л. Восстановление больших дефектов дыхательных путей биопротезными материалами. J Thorac Dis 2017; 9: 3674-6. [Перекрестная ссылка] [PubMed]
- Удельсман Б.В., Итон Дж., Муниаппан А. и др. Устранение больших дефектов дыхательных путей биопротезными материалами. J Thorac Cardiovasc Surg 2016;152:1388-97. [Перекрестная ссылка] [PubMed]
- Ахо Дж.М., Дитц А.Б.
 , Радель Д.Дж. и др. Закрытие рецидивирующего бронхоплеврального свища с использованием матрицы, засеянной мезенхимальными стволовыми клетками пациента. Стволовые клетки Transl Med 2016; 5: 1375-9. [Перекрестная ссылка] [PubMed]
, Радель Д.Дж. и др. Закрытие рецидивирующего бронхоплеврального свища с использованием матрицы, засеянной мезенхимальными стволовыми клетками пациента. Стволовые клетки Transl Med 2016; 5: 1375-9. [Перекрестная ссылка] [PubMed] - Маккиарини П., Юнгеблут П., Го Т. и др. Клиническая трансплантация тканеинженерного воздуховода. Ланцет 2008;372:2023-30. [Перекрестная ссылка] [PubMed]
- Sjöqvist S, Jungebluth P, Lim ML, et al. Редакционное выражение озабоченности: Экспериментальная ортотопическая трансплантация тканево-инженерного пищевода у крыс. Нацкоммуна 2016;7:13310. [Перекрестная ссылка] [PubMed]
- Галлетти П.М., Колтон К.К. Искусственные легкие и устройства для газообмена крови. In: Бронзино Д.Д. изд. Справочник по биомедицинской инженерии. Бока-Ратон: CRC, 2000:1-19.
- Бартлетт Р.Х. Экстракорпоральное жизнеобеспечение: история и новые направления. АСАИО Дж. 2005; 51:487-9. [Перекрестная ссылка] [PubMed]
- Лемон Дж.
 , Лим М.Л., Аджаллуэян Ф. и др. Разработка биоискусственных легких. Бр Мед Булл 2014; 110:35-45. [Перекрестная ссылка] [PubMed]
, Лим М.Л., Аджаллуэян Ф. и др. Разработка биоискусственных легких. Бр Мед Булл 2014; 110:35-45. [Перекрестная ссылка] [PubMed] - Fritsche CS, Simsch O, Weinberg EJ, et al. Инженерия легочной ткани с использованием двухкамерных полимерных каркасов с интегрированным сосудистым деревом. Int J Artif Organs 2009;32:701-10. [Перекрестная ссылка] [PubMed]
- Polk AA, Maul TM, McKeel DT, et al. Прототип биогибридного искусственного легкого с активным перемешиванием эндотелизированных микропористых полых волокон. Биотехнология Биоэнг 2010;106:490-500. [ПубМед]
- Ву З.Дж., Чжан Т., Бьянчи Г. и др. Тридцатидневная работа носимого искусственного легкого для амбулаторной респираторной поддержки in vivo. Энн Торак Сург 2012; 93: 274-81. [Перекрестная ссылка] [PubMed]
- Гарсия Дж. П., Яконо А., Кон З. Н. и др. Амбулаторная экстракорпоральная мембранная оксигенация: новый подход к трансплантации моста в легкое. J Thorac Cardiovasc Surg 2010;139:e137-9.
 [Перекрестная ссылка] [PubMed]
[Перекрестная ссылка] [PubMed] - Бадылак С.Ф. Ксеногенный внеклеточный матрикс как каркас для реконструкции тканей. Transpl Immunol 2004;12:367-77. [Перекрестная ссылка] [PubMed]
- Лутольф М.П., Хаббелл Дж.А. Синтетические биоматериалы как инструктивное внеклеточное микроокружение для морфогенеза в тканевой инженерии. Nat Biotechnol 2005; 23:47-55. [Перекрестная ссылка] [PubMed]
- Чен К.З., Лян С.Л., Туас Г.А. Эластомерные биоматериалы для тканевой инженерии. Prog Poly Sci 2013; 38: 584-671. [Перекрестная ссылка]
- Ван Ю., Амир Г.А., Шеппард Б.Дж. и др. Прочный биоразлагаемый эластомер. Nat Biotechnol 2002;20:602-6. [Перекрестная ссылка] [PubMed]
- Рок-младший, Хоган Б.Л. Эпителиальные клетки-предшественники в развитии, поддержании, восстановлении и заболеваниях легких. Annu Rev Cell Dev Biol 2011; 27:493-512. [Перекрестная ссылка] [PubMed]
- Кайстура Дж., Рота М., Холл С.


 Биоискусственная инженерия легких. Am J Transplant 2012; 12: 283-8. [Перекрестная ссылка] [PubMed]
Биоискусственная инженерия легких. Am J Transplant 2012; 12: 283-8. [Перекрестная ссылка] [PubMed] Biochem Biophys Res Commun 2016;473:675-82. [Перекрестная ссылка] [PubMed]
Biochem Biophys Res Commun 2016;473:675-82. [Перекрестная ссылка] [PubMed] , Радель Д.Дж. и др. Закрытие рецидивирующего бронхоплеврального свища с использованием матрицы, засеянной мезенхимальными стволовыми клетками пациента. Стволовые клетки Transl Med 2016; 5: 1375-9. [Перекрестная ссылка] [PubMed]
, Радель Д.Дж. и др. Закрытие рецидивирующего бронхоплеврального свища с использованием матрицы, засеянной мезенхимальными стволовыми клетками пациента. Стволовые клетки Transl Med 2016; 5: 1375-9. [Перекрестная ссылка] [PubMed] , Лим М.Л., Аджаллуэян Ф. и др. Разработка биоискусственных легких. Бр Мед Булл 2014; 110:35-45. [Перекрестная ссылка] [PubMed]
, Лим М.Л., Аджаллуэян Ф. и др. Разработка биоискусственных легких. Бр Мед Булл 2014; 110:35-45. [Перекрестная ссылка] [PubMed] [Перекрестная ссылка] [PubMed]
[Перекрестная ссылка] [PubMed]