Содержание
Искусственный геном из двух генов успешно самовоспроизводится и эволюционирует
Японским ученым удалось создать предельно простую систему, воспроизводящую некоторые базовые свойства клеточной жизни — способность к самовоспроизводству и эволюции на основе дарвиновского механизма отбора. В этой системе присутствует искусственный «геном» (кольцевая ДНК), который размножается посредством репликации и рекомбинации. «Геном» содержит гены, которые кодируют ферменты, обеспечивающие эти два процесса (ДНК полимеразу фага phi29 и рекомбиназу Cre). Транскрипция и трансляция этих генов осуществляется готовым коктейлем ферментов и низкомолекулярных соединений, добавляемым в систему в каждом раунде репликации. Реакции протекают в искусственно формируемых микрокомпартментах — капельках водно-масляной эмульсии, что обеспечивает необходимое условие для конкуренции и адаптивной эволюции «генома». Мутации, накопившиеся в кодирующих и некодирующих участках «генома» за 30 раундов (поколений) самовоспроизводства, повысили эффективность репликации в системе за счет нескольких установленных в ходе исследования механизмов.
Создание искусственной системы, воспроизводящую свойства живой клетки, — одна из амбициозных задач на стыке химии и биологии, которые ставит перед собой современная наука. Эта задача представляет интерес в первую очередь в контексте стремления понять процесс возникновения первых живых клеток из неживой материи. Ведь, как говорил Ричард Фейнман «чего не могу воссоздать, того не понимаю». Во вторую очередь важен потенциал практического использования (а как же!) таких искусственных систем в качестве фабрик по эффективной продукции чего-нибудь полезного человечеству.
«Элементы» уже не раз рассказывали о работах, ведущихся в этом направлении, и об их идейном обосновании: см., например, новости Чтобы спастись от паразитов, первым живым системам достаточно было время от времени разделяться на мелкие капли («Элементы», 19.12.2016) и Создано первое живое существо с синтетическим геномом («Элементы», 25.05.2010), а также статьи Синтетическая биология: конструирование живого и Обыгрывая бога.
Обсуждаемая ниже работа была выполнена в лаборатории Токийского университета, которой руководит Норикадзу Итихаси (Norikazu Ichihashi). Лаборатория специализируется именно на создании искусственных систем, способных к самовоспроизводству и эволюции — то есть систем со свойствами репликатора. На странице лаборатории достаточно подробно и четко изложены разноплановые задачи в контексте этой проблематики, над решением которых сотрудники бьются прямо сейчас.
Но прежде чем говорить о новом результате, необходимо рассказать и о его предыстории.
Репликатор на основе РНК
В 2013 году ученые из лаборатории Норикадзу Итихаси сообщили о создании системы со свойствами репликатора, где роль генома выполняла РНК-молекула (N. Ichihashi et al., 2013. Darwinian evolution in a translation-coupled RNA replication system within a cell-like compartment). Размножение этой молекулы РНК осуществлялось при помощи фермента — РНК-зависимой РНК-полимеразы фага Qβ (bacteriophage Qbeta), причем ген, кодирующий этот фермент, был расположен внутри этой самой молекулы РНК.
Всю смесь разбивали в большом объеме минерального масла на мельчайшие капельки, так что получалась эмульсия. В капельках происходила трансляция гена Qβ полимеразы и размножение (репликация) молекул РНК. Трансляция осуществлялась при помощи искусственно приготовленного коктейля белков и небелковых молекул (см. врезку), который добавлялся порционно на каждом раунде репликации. Всю смесь периодически тщательно перемешивали, разбавляя новыми порциями коктейля для трансляции. В ходе перемешивания одни капельки разделялись, другие сливались вместе. Эта процедура подменяет собой деление клеток, обеспечивая пространственное отделение друг от друга конкурирующих геномов.
Воспроизводство РНК-генома в описанной системе успешно продолжалось на протяжении многих сотен раундов репликации. Но особенно впечатляющим стало то, что эта система в ряду поколений не просто сохранялась, а совершенствовалась! Авторы показали, что к моменту завершения эксперимента репликация и трансляция РНК генома стала проходить быстрее и эффективнее благодаря закреплению разнообразных адаптивных мутаций в молекуле РНК (N.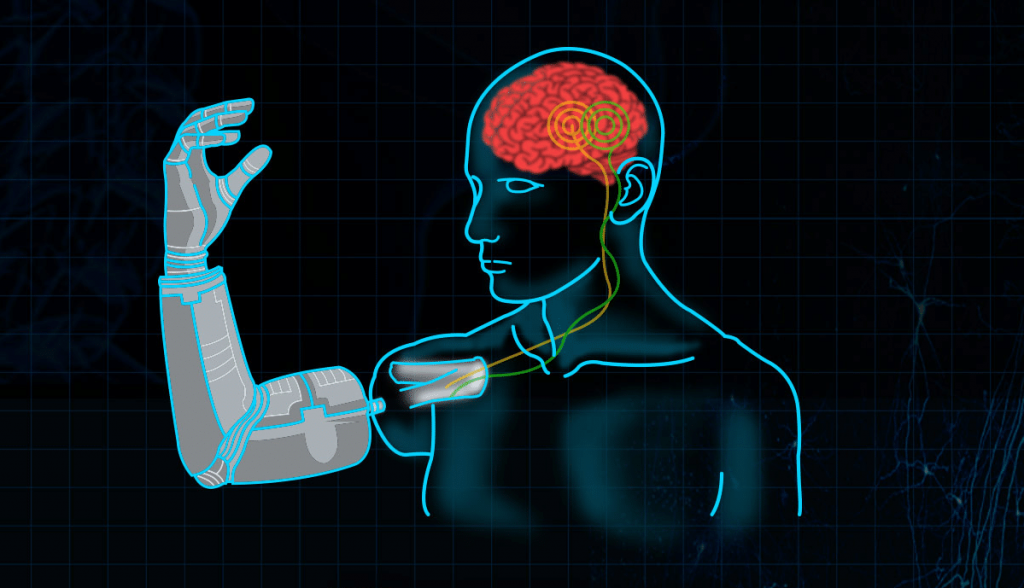 Ichihashi et al., 2013. Darwinian evolution in a translation-coupled RNA replication system within a cell-like compartment, R. Mizuuchi et al., 2015. Adaptive Evolution of an Artificial RNA Genome to a Reduced Ribosome Environment).
Ichihashi et al., 2013. Darwinian evolution in a translation-coupled RNA replication system within a cell-like compartment, R. Mizuuchi et al., 2015. Adaptive Evolution of an Artificial RNA Genome to a Reduced Ribosome Environment).
Эксперименты, представленные в статье японских ученых 2013 года, однозначно свидетельствуют о том, что принципиальным условием, требующимся для осуществления конкуренции и адаптивной эволюции такой самореплицирующейся системы является разделение общей реакционной смеси на компартменты. Капельки водного раствора в масле как раз и выполняли роль таких компартментов. Компартментализация служит и средством защиты системы от засилия бессмысленными укороченными паразитическими геномами (об этом же см. новость Чтобы спастись от паразитов, первым живым системам достаточно было время от времени разделяться на мелкие капли, «Элементы», 19.12.2016). Это важный вывод, подтвердивший экспериментально имевшиеся теоретические ожидания. Во всех дальнейших своих работах, о которых пойдет речь ниже, ученые продолжали использовать опробованный в этом исследовании способ обеспечения компартментализации (эмульсию из водяных капель в масле).
От РНК-генома к ДНК-геному
Следующей целью стало получение автореплицирующейся системы на основе ДНК. Ведь, как ни крути, все известные нам клеточные формы жизни хранят информацию именно в форме ДНК, а не РНК.
Первые успехи были получены к 2015 году (Y. Sakatani et al., 2015. A transcription and translation-coupled DNA replication system using rolling-circle replication). Ученые сконструировали кольцевую ДНК, в которой присутствовал ген, кодирующий полимеразу фага phi29. Их целью было создать систему, в которой бы осуществлялся полный цикл реализации и репликации наследственной информации. То есть с генома должна была считываться копия РНК (это транскрипция), далее на матрице РНК должен был произойти синтез собственно активного белка — полимеразы фага phi29, — которая, в свою очередь, должна была обеспечить размножение генома, содержащего в себе ген этой полимеразы.
Полимераза фага phi29 заметно отличается от большинства других ДНК-полимераз, которые используются обычно в молекулярной биологии (к примеру бактериальная Taq-полимераза). Она гораздо медленнее, но зато для ее работы не требуется циклов смены температур — копирование ДНК происходит при постоянной температуре 30°C. К тому же она способна реплицировать кольцевые ДНК по механизму «катящегося кольца» (rolling circle replication). Чтобы обеспечить автономную репликацию генома с геном полимеразы фага phi29, исследователи создали систему репликации ДНК, сопряженной с транскрипцией и трансляцией (Transcription and Translation coupled DNA Replication, TTcDR). Для этого описанная выше система бесклеточной трансляции была дополнена транскриптазой бактериофага T7. Также в смесь добавили четыре дезоксинуклеотидтрифосфата для синтеза ДНК и короткие цепочки, которые работают в качестве затравок для полимеразы фага phi29. Кроме того, пришлось добавить пирофосфатазу, так как присутствие пирофосфата снижает эффективность работы ДНК-полимеразы. Пришлось потрудиться и над оптимизацией концентрации компонентов системы трансляции, некоторые из которых также подавляли синтез ДНК.
Она гораздо медленнее, но зато для ее работы не требуется циклов смены температур — копирование ДНК происходит при постоянной температуре 30°C. К тому же она способна реплицировать кольцевые ДНК по механизму «катящегося кольца» (rolling circle replication). Чтобы обеспечить автономную репликацию генома с геном полимеразы фага phi29, исследователи создали систему репликации ДНК, сопряженной с транскрипцией и трансляцией (Transcription and Translation coupled DNA Replication, TTcDR). Для этого описанная выше система бесклеточной трансляции была дополнена транскриптазой бактериофага T7. Также в смесь добавили четыре дезоксинуклеотидтрифосфата для синтеза ДНК и короткие цепочки, которые работают в качестве затравок для полимеразы фага phi29. Кроме того, пришлось добавить пирофосфатазу, так как присутствие пирофосфата снижает эффективность работы ДНК-полимеразы. Пришлось потрудиться и над оптимизацией концентрации компонентов системы трансляции, некоторые из которых также подавляли синтез ДНК.
Продуктом работы репликазы фага phi29 является одноцепочечная ДНК, в которой многократно повторена вся последовательность исходной кольцевой матрицы. В свою очередь, на этой одноцепочечной ДНК с помощью все той же полимеразы фага phi29 может начинаться синтез второй, комплементарной, цепочки — уже в противоположном направлении.
Можно заметить, что в описанной системе мы начинаем с кольцевой ДНК, а на выходе получаем линейные молекулы ДНК. Восстановить геном в исходном виде можно, подключив механизм рекомбинации. В публикации 2018 года авторы сообщают о реализации этой идеи (Y. Sakatani et al., 2018. Self-replication of circular DNA by a self-encoded DNA polymerase through rolling-circle replication and recombination). Собственно, в реплицируемый геном была добавлена специальная последовательность — сайт loxP, который узнается рекомбиназой Cre. Саму рекомбиназу Cre добавляли в смесь в виде очищенного белка вместе с системой TTcDR. Поскольку в линейном продукте репликации полимеразой фага phi29 сайт loxP оказывается многократно повторен, рекомбинация, осуществляемая между двумя такими сайтами при участии рекомбиназы Cre, может приводить к образованию одного или нескольких кольцевых геномов. Они отщепляются от линейной молекулы, которая становится при этом короче.
Они отщепляются от линейной молекулы, которая становится при этом короче.
Первоначально у авторов возникло затруднение: рекомбиназа Cre при добавлении в необходимой для ее работы концентрации очень сильно подавляла работу полимеразы фага phi29. Это происходит из-за того, что два фермента фактически конкурируют между собой за связывание с одним и тем же субстратом — молекулой ДНК. Однако после 53 раундов репликации/рекомбинации в системе с компартментами (в виде водно-масляной эмульсии) эффективность репликации за счет изменений в последовательности реплицируемой ДНК повысилась более чем в 40 раз: закрепились некоторые мутации, изменившие сайт loxP, ген полимеразы фага phi29, а также некоторые участки за пределами этих функциональных областей. Таким образом, эта система оказалась способна не только к репликации, но и к адаптивной эволюции!
От одного гена к двум, а там будет видно…
Ну что же — все работает. Но что, если сделать еще один шаг в сторону повышения автономности системы: не добавлять рекомбиназу в виде очищенного белка, а включить ген этого фермента в сам реплицируемый геном? Ответ на этот вопрос как раз и стал основой для обсуждаемой статьи.
Эксперимент состоял в проведении генома (в форме кольцевой ДНК) через большое количество раундов репликации с использованием системы TTcDR. Размножаемая ДНК содержит два гена, один из которых кодирует репликазу, а второй — рекомбиназу Cre. Перед геном репликазы фага phi29 размещена последовательность промотора для транскриптазы фага T7, а за геном рекомбиназы Cre — сайт loxP.
Манипуляции со всей этой молекулярной машинерией начинаются с подготовки водного раствора, содержащего ДНК и полный набор компонентов системы TTcDR. 10 мкл этого раствора соединяется с 1 мл масла. Полученная двухфазная система тщательно перемешивается при помощи гомогенизатора, в результате чего образуется водно-масляная эмульсия: в масле взвешены миллионы мельчайших капелек водного раствора (диаметром несколько мкм), каждая из которых представляет собой автономный компартмент. Количество ДНК, добавленной в раствор рассчитано так, чтобы 1 молекула кольцевой ДНК приходилась примерно на 100 капель. Далее смесь помещают в термостат с температурой 30°C на 16 часов. За это время в системе параллельно протекают процессы транскрипции, трансляции (в результате чего синтезируются белки — полимераза и рекомбиназа), репликации и рекомбинации. Это завершает первый раунд репродукции.
Далее смесь помещают в термостат с температурой 30°C на 16 часов. За это время в системе параллельно протекают процессы транскрипции, трансляции (в результате чего синтезируются белки — полимераза и рекомбиназа), репликации и рекомбинации. Это завершает первый раунд репродукции.
Далее следует 5-кратное разведение смеси: 200 мкл эмульсии из первого раунда переносят в новую пробирку, туда же добавляют 800 мкл масла и 8 мкл TTcDR в водном растворе. Выбранная кратность разведения примерно соответствует средней скорости размножения кольцевого генома в этой системе (то есть за 16 часов из одного исходного генома образуется в среднем 4–5 новых посредством репликации/рекомбинации). Затем смесь снова перемешивается в гомогенизаторе. При этом, с одной стороны, водяные капли дробятся, в результате чего геномы разделяются по отдельным компартментам, а с другой стороны, некоторые капли сливаются, обеспечивая приток новой порции компонентов системы TTcDR для дальнейшего осуществления транскрипции, трансляции и репликации.
Всего было проведено 60 таких раундов в двух параллельных экспериментах. В каждом раунде ученые определяли концентрацию ДНК — она довольно сильно изменялась (рис. 2). Иногда даже приходилось прибегать к дорепликации молекул ДНК посредством обычной ПЦР, чтобы эксперимент не закончился слишком быстро. Возможная причина таких провалов в количестве нарабатываемых молекул ДНК может крыться в «перенаселении» системы быстроразмножающимися дефектными ДНК, которые фактически являются паразитическими. Это предположение в рамках данного исследования не проверялось (но сам факт регулярного появления таких паразитических дефектных молекул в подобных системах с саморепликацией был продемонстрирован учеными этой исследовательской группы в других работах, см., например T. Furubayashi et al., 2020. Emergence and diversification of a host-parasite RNA ecosystem through Darwinian evolution).
На 30-м раунде обоих экспериментов ученые отобрали образцы для углубленного анализа: они выделили, клонировали и секвенировали геномы. Целью этих манипуляций было обнаружение признаков эволюции молекул ДНК — логика эксперимента подразумевала, что эволюция должна иметь место. Точность репликации с участием полимеразы фага phi29 не идеальная. Ошибки репликации при ее работе возникают с частотой примерно 6·10−5 на нуклеотид за один раунд. Преимущество при размножении должны получать те геномы, которые накопили «полезные» мутации — то есть те, которые повышают эффективность воспроизводства.
Целью этих манипуляций было обнаружение признаков эволюции молекул ДНК — логика эксперимента подразумевала, что эволюция должна иметь место. Точность репликации с участием полимеразы фага phi29 не идеальная. Ошибки репликации при ее работе возникают с частотой примерно 6·10−5 на нуклеотид за один раунд. Преимущество при размножении должны получать те геномы, которые накопили «полезные» мутации — то есть те, которые повышают эффективность воспроизводства.
Всего было получено 17 клонированных геномов из первого эксперимента и 18 из второго. Как показало секвенирование, каждый клон содержал множество уникальных мутаций, но некоторые мутации встречались одновременно в двух или более клонах. Именно эти мутации с большей вероятностью являются адаптивными.
Для пяти клонированных геномов из первого эксперимента и для четырех из второго была проведена сравнительная оценка способности к автономной репликации в системе с TTcDR. Анализ провели для тех клонов, которые содержали наибольшее число общих мутаций с другими клонами. Семь из девяти проверенных «эволюционировавших» геномов показали достоверно более высокую эффективность репликации по сравнению с исходным вариантом генома (рис. 3, А). По паре самых активных вариантов из каждого эксперимента (их назвали Evo1, Evo2, Evo 3 и Evo4) использовали в дальнейших функциональных испытаниях, целью которых было выявить конкретные механизмы, обеспечившие повышение эффективности репликации этих версий.
Семь из девяти проверенных «эволюционировавших» геномов показали достоверно более высокую эффективность репликации по сравнению с исходным вариантом генома (рис. 3, А). По паре самых активных вариантов из каждого эксперимента (их назвали Evo1, Evo2, Evo 3 и Evo4) использовали в дальнейших функциональных испытаниях, целью которых было выявить конкретные механизмы, обеспечившие повышение эффективности репликации этих версий.
На рис. 3, Б отражены конкретные мутации, присутствующие в этих «выдающихся» версиях генома. Можно видеть, что в области белок-кодирующих генов наблюдались нуклеотидные замены, часть из которых меняла, а часть не меняла аминокислотную последовательность кодируемых белков. В области перед промотором, взятым от фага T7, во всех четырех клонах присутствовали инсерции, которые, в сущности, представляли собой дупликацию некоторого фрагмента этого же промотора. Авторы предположили, что эти дупликации (по крайней мере при прямой их ориентации, как в клонах Evo1, Evo2 и Evo 3) могли повысить эффективность транскрипции, приводя в итоге к образованию большего количества ДНК полимеразы фага phi29 в единицу времени и, как следствие, — к ускорению репликации.
Далее авторы провели несколько серий опытов, в каждой из которых проверялся один из возможных механизмов повышения эффективности репликации четырьмя сверхэффективными репликаторами. Ниже представлены схемы и результаты этих исследований. Каждый из графиков на рис. 4–7 демонстрирует результат трех повторных экспериментов (усредненные значения по трем измерениям).
Первая серия опытов (рис. 4) проверяла влияние мутаций на свойства репликазы фага phi29. В верхней части рисунка показана схема опыта, в нижней — собственно, результаты. Об эффективности полимеразы судили по тому, как много копий ДНК синтезировалось за один 16-часовой раунд репликации. Версия репликазы из генома Evo1 давала такой же результат, что и исходная версия (что логично, ведь в этом гене не появилось каких-либо мутаций, см. рис. 3). У версии из генома Evo2 эффективность оказалась даже ниже, чем у исходной версии белка. А вот версии из геномов Evo3 и Evo4 показали более высокую эффективность, чем исходный белок (хотя только для гена из Evo3 отличие оказалось достоверным).
Вторая серия опытов была нацелена на проверку предположения о том, что благодаря некоторым мутациям молекула ДНК может становиться либо более, либо менее удачным субстратом в качестве матрицы для репликации полимеразой фага phi29 (рис. 5). Ведь свою роль могут играть, к примеру, вторичные структуры, которые потенциально могут возникать внутри ДНК в ходе репликации и тормозить процесс. Достоверно лучшими субстратами в сравнении с исходной версией генома оказались варианты Evo1 и Evo2. Судя по графику, это отличие имеется и для Evo3, хотя оно не достоверно. Особенно заметна разница для Evo1: репликация этого варианта генома шла в 5 раз быстрее, чем исходного.
Третья серия опытов позволила оценить изменения в свойствах рекомбиназы Cre (рис. 6). Резко сниженной оказалась только рекомбиназная активность белка, кодируемого вариантом Evo3, остальные в своей активности не отличались заметно от исходной версии.
Целью четвертой серии экспериментов было оценить влияние мутаций в гене рекомбиназы на способность белка Cre подавлять эффективность репликации посредством phi29 полимеразы (рис. 7). Все 4 версии белка Cre из разных вариантов генома показали менее выраженный подавляющий эффект в отношении репликации матрицы (роль матрицы в этом эксперименте выполняла обычная кольцевая плазмида pUC19, c добавленным loxP сайтом) в сравнении с исходной версией. Но в любом случае репликация шла еще более эффективно, когда в системе вовсе не было рекомбиназы.
7). Все 4 версии белка Cre из разных вариантов генома показали менее выраженный подавляющий эффект в отношении репликации матрицы (роль матрицы в этом эксперименте выполняла обычная кольцевая плазмида pUC19, c добавленным loxP сайтом) в сравнении с исходной версией. Но в любом случае репликация шла еще более эффективно, когда в системе вовсе не было рекомбиназы.
К сожалению, до экспериментальной оценки влияния дупликаций в промоторной области геномов дело почему-то не дошло. Здесь авторы предлагают только свои теоретические предположения.
Зато ученые решили проверить еще одну идею в качестве задела на будущее. Потенциально ведь можно пытаться еще наращивать степень автономности данной системы, добавляя в самореплицирующийся геном все больше необходимых генов и исключая соответствующие готовые белковые или РНКовые компоненты смеси TTcDR. Но будет ли система при таком наращивании генома все еще сохранять способность к самовоспроизводству?
Чтобы проверить эту идею, в каждый вариант генома был добавлен фрагмент длиной около 2500 пар оснований, внутри которого присутствовал ген, кодирующий белок bla (этот дополнительный фрагмент встраивали в промежутке между сайтом loxP и промотором фага T7).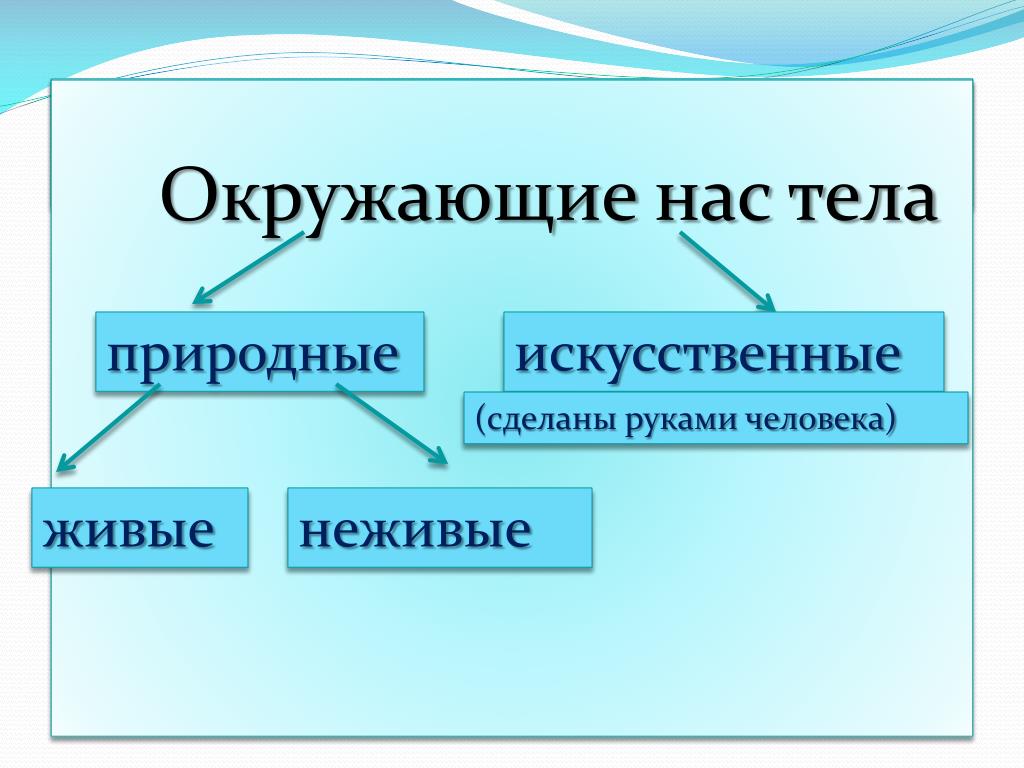 Исходная версия генома и Evo4 оказались неспособны реплицироваться в таком расширенном виде, между тем как эффективность репликации для клонов Evo1, Evo2, Evo3 после добавления лишнего фрагмента осталась примерно на том же уровне, что и без него (рис. 8).
Исходная версия генома и Evo4 оказались неспособны реплицироваться в таком расширенном виде, между тем как эффективность репликации для клонов Evo1, Evo2, Evo3 после добавления лишнего фрагмента осталась примерно на том же уровне, что и без него (рис. 8).
Конечно же, эта система еще сильно не дотягивает до того, чтобы представлять собой действительно некоторую форму «жизни». Помимо того, что для ее автономной работы не хватает большого количества необходимых белков, которые синтезировались бы внутри системы, здесь нет и намека на способность самостоятельно расти и делиться (формировать новые компартменты), осуществлять полноценный метаболизм (подразумевающий, в частности, активное введение определенных веществ внутрь клеток-компартментов и выведение других во внешнюю среду против градиента концентрации) и саморегуляцию. Но каждое из обозначенных выше свойств живого ученые постепенно учатся воссоздавать в искусственных биохимических системах, — эти работы ведутся многими лабораториями в разных странах. И все более реалистичным представляется, в свете последних достижений, сценарий появления в один прекрасный день новой «жизни из пробирки», эволюционно не связанной с LUCA — общим клеточным предком всех нынешних обитателей Земли.
И все более реалистичным представляется, в свете последних достижений, сценарий появления в один прекрасный день новой «жизни из пробирки», эволюционно не связанной с LUCA — общим клеточным предком всех нынешних обитателей Земли.
Источник: Hiroki Okauchi, Norikazu Ichihashi. Continuous Cell-Free Replication and Evolution of Artificial Genomic DNA in a Compartmentalized Gene Expression System // ACS Synthetic Biology. 2021. DOI: 10.1021/acssynbio.1c00430.
Татьяна Романовская
Первая в мире искусственная жизнь создана – Ирина Якутенко – Наука и технологии – Материалы сайта – Сноб
Ученым впервые удалось создать искусственный геном и заставить живую клетку жить с этим генетическим кодом. Команда исследователей под руководством Крейга Вентера химическим путем синтезировала геном бактерии Mycoplasma mycoides и вставила его в клетку другого микроорганизма — Mycoplasma capricolum, из которой перед этим были удалены все гены. Полученный «франкенштейн» ожил, стал размножаться и вообще повел себя как обычная бактерия Mycoplasma mycoides. Описание этой замечательной работы опубликовано в четверг в журнале Science.
Описание этой замечательной работы опубликовано в четверг в журнале Science.
До сих пор ученые умели только «читать» ДНК живых существ, а вот создать геном de novo (заново) еще никому не удавалось. Получение искусственного организма имеет не только научный интерес, но даже философский: создав жизнеспособное существо с использованием искусственной ДНК, ученые наглядно доказали, что жизнь можно получить из десятка баночек с реактивами. Теоретически этот тезис всем очевиден, но на практике никто никогда его напрямую не подтверждал.
Прежде чем рассказать о деталях незаурядного эксперимента Вентера и коллег, стоит напомнить, кто такой Крейг Вентер. Это своего рода медийная звезда, исследователь, известный не только в биологических кругах, но и широкой публике: впервые его имя зазвучало на рубеже нового тысячелетия, когда вовсю осуществлялся проект «Геном человека» — ученые всего мира коллективными усилиями пытались определить последовательность ДНК Homo sapiens. Несмотря на все старания, работа продвигалась медленно — проект стартовал в 1990 году, и за девять лет была целиком расшифрована всего одна маленькая хромосома. Вентер и специалисты созданной им компании Celera Genomics усовершенствовали технологии работы с ДНК и подключились к «Геному человека». В 2001 году черновая расшифровка генома была наконец завершена.
Вентер и специалисты созданной им компании Celera Genomics усовершенствовали технологии работы с ДНК и подключились к «Геному человека». В 2001 году черновая расшифровка генома была наконец завершена.
На расшифровке генома человека основатель Celera Genomics не остановился — его следующим амбициозным проектом (а Вентера интересуют только амбициозные проекты) стало создание организма с синтетическим геномом.
Казалось бы, ничего сложного здесь нет: надо лишь воссоздать уже известную нам последовательность букв генетического кода и вставить ее в подходящую клетку. Но на самом деле на этом пути исследователи сталкиваются со множеством трудностей — не в последнюю очередь потому, что пока ученые доподлинно не знают всех особенностей работы генома как комплексной системы. Это не просто цепочка букв. Нить ДНК каждого организма снабжена навешанными на нее молекулами-«маячками», так называемыми эпигенетическими маркерами, без которых считывание генома будет проходить некорректно. На то, чтобы научиться вносить в искусственный геном Mycoplasma mycoides необходимые маркеры, у исследователей ушел не один год.
На то, чтобы научиться вносить в искусственный геном Mycoplasma mycoides необходимые маркеры, у исследователей ушел не один год.
Эксперимент по созданию жизни был спланирован так: ученые синтезируют геном какой-нибудь бактерии (назовем ее бактерией-донором, так как она дает исследователям последовательность своей ДНК) и вставляют его в клетку бактерии другого вида, из которой предварительно удаляют собственный геном (это будет бактерия-реципиент). Если получившийся организм живет, питается и размножается, а также в точности напоминает донорные бактерии, а не бактерии-реципиенты или что-то промежуточное, то эксперимент удался.
- Фото первых в мире бактериий с синтетическим геномом
В качестве донора ученые выбрали бактерию-паразита Mycoplasma mycoides, отчасти из-за того, что у нее очень маленький геном — всего около миллиона «букв» (для сравнения: в геноме человека их 3 миллиарда). Реципиентом выступала родственная бактерия Mycoplasma capricolum. Самой сложной частью эксперимента был синтез целого бактериального генома: современные технологии не позволяют за раз получать такие длинные цепи. Чтобы преодолеть эту трудность, ученые синтезировали небольшие «кассеты» из ДНК, содержащие только часть генома Mycoplasma mycoides, а затем соединяли их вместе. Пока самым эффективным инструментом для объединения «кассет» являются живые организмы — никакие химические ухищрения не позволяют делать это столь же точно. Исследователи как мозаику складывали геном Mycoplasma mycoides сначала в клетках кишечной палочки, а потом, когда им удалось получить достаточно крупные куски ДНК, в клетках дрожжей.
Самой сложной частью эксперимента был синтез целого бактериального генома: современные технологии не позволяют за раз получать такие длинные цепи. Чтобы преодолеть эту трудность, ученые синтезировали небольшие «кассеты» из ДНК, содержащие только часть генома Mycoplasma mycoides, а затем соединяли их вместе. Пока самым эффективным инструментом для объединения «кассет» являются живые организмы — никакие химические ухищрения не позволяют делать это столь же точно. Исследователи как мозаику складывали геном Mycoplasma mycoides сначала в клетках кишечной палочки, а потом, когда им удалось получить достаточно крупные куски ДНК, в клетках дрожжей.
В итоге им удалось по кусочкам собрать весь геном. «Запихнуть» его в очищенную от ДНК клетку бактерии-реципиента также было нетривиальной задачей.
Полученные бактерии-гибриды выглядели так же, как Mycoplasma mycoides, росли так же, как Mycoplasma mycoides, поглощали питательные вещества так же, как Mycoplasma mycoides, и размножались так же. Чтобы дополнительно убедиться в успехе эксперимента, ученые выделили из гибридных клеток белки, разделили их на фракции и сравнили полученную картину с тем, что получается при выделении белков из обычной Mycoplasma mycoides. Получилось то же самое. Сейчас созданные исследователями бактерии растут в лаборатории и ничем не отличаются от своих соседей из чашки Петри.
Чтобы дополнительно убедиться в успехе эксперимента, ученые выделили из гибридных клеток белки, разделили их на фракции и сравнили полученную картину с тем, что получается при выделении белков из обычной Mycoplasma mycoides. Получилось то же самое. Сейчас созданные исследователями бактерии растут в лаборатории и ничем не отличаются от своих соседей из чашки Петри.
Читатель может спросить, а в чем же глубинный смысл экспериментов Вентера? Что дадут человечеству искусственно созданные бактерии? Авторы статьи объясняют суть своей работы так: отработанная ими технология получения жизнеспособных организмов, геномы которых созданы искусственно, в будущем позволит не только делать копии уже существующих в природе живых существ, как сегодня сделал Вентер, но и создавать абсолютно новые организмы, которые не входили в генеральный план Создателя, или природы, или эволюции — как хотите. И речь не обязательно идет о каких-то неведомых чудищах: имея на руках работающую методику, можно переписывать генетическую программу привычных организмов таким образом, чтобы они сочетали в себе максимальное число полезных признаков. Можно создать абсолютно новый организм, который, например, одновременно давал бы молоко, синтезировал антибиотики и при этом представлял собой всего лишь культуру клеток в пробирке.
Можно создать абсолютно новый организм, который, например, одновременно давал бы молоко, синтезировал антибиотики и при этом представлял собой всего лишь культуру клеток в пробирке.
Искусственная жизнь, созданная в лаборатории, может расти и делиться, как естественные бактерии. созданный путем объединения компонентов бактерий
Mycoplasma с химически синтезированным геномом, может расти и делиться на клетки одинаковой формы и размера, как и большинство естественных бактериальных клеток.
В 2016 году исследователи под руководством Крейга Вентера из Института Дж. Крейга Вентера в Сан-Диего, Калифорния, объявили о создании синтетических «минимальных» клеток. Геном каждой клетки содержал всего 473 ключевых гена, которые считались необходимыми для жизни.
Клетки были названы JCVI-syn3.0 в честь института, и они могли расти и делиться на агаре с образованием кластеров клеток, называемых колониями.
Но при ближайшем рассмотрении делящихся клеток в то время Вентер и его коллеги заметили, что они не делятся равномерно и равномерно, образуя идентичные дочерние клетки, как это делают большинство естественных бактерий. Вместо этого они производили дочерние клетки причудливых форм и размеров.
Вместо этого они производили дочерние клетки причудливых форм и размеров.
«[Создатели JCVI-syn3.0] выбросили все части генома, которые, по их мнению, не были необходимы для роста», — говорит Элизабет Стрихальски из Национального института стандартов и технологий США. Но их определение того, что необходимо для роста, оказалось необходимым для создания красивых колоний, растущих на чашке с агаром, говорит она, а не для производства клеток, которые делятся однородным и реалистичным образом.
Подробнее: Искусственная клетка, созданная в лаборатории, обнаруживает гены, необходимые для жизни
Повторно вводя различные гены в эти синтетические бактериальные клетки и затем наблюдая под микроскопом, как эти добавки влияют на рост клеток, Стрыхальски и ее команда смогли точно определить семь дополнительных генов, необходимых для равномерного деления клеток.
Когда исследователи добавили эти семь генов в JCVI-syn3.0 для получения новой синтетической клетки, они обнаружили, что этого достаточно для восстановления нормального, равномерного деления и роста клеток.
Стрыхальски и ее коллеги обнаружили, что, хотя уже было известно, что два из семи генов участвуют в клеточном делении, пять ранее не имели известной функции. «Это было удивительно, — говорит она.
«Эти пять генов выходили за рамки того, о чем мы знали», — говорит Джеймс Пеллетье из Массачусетского технологического института, соавтор исследования.
«Минимальная клетка имеет много генов с неизвестной функцией, которые, хотя мы понятия не имеем, что они делают, необходимы для жизни клетки — так что это захватывающая область для будущих исследований», — говорит он.
Подробнее: Безупречное творение: рождение первой синтетической клетки
«[Это исследование] невероятно важно для понимания того, как устроена жизнь и какие гены необходимы для надежной работы клеток», — говорит Дрю Энди из Стэнфордского университета в Калифорнии. .
«Фундаментальные исследования минимальных клеток помогают нам понять принципы явлений жизни и эволюционную историю жизни», — говорит Кейт Адамала из Миннесотского университета в Миннеаполисе. Это потому, что минимальная клетка является хорошим аналогом последнего универсального общего предка всего живого на Земле.
Это потому, что минимальная клетка является хорошим аналогом последнего универсального общего предка всего живого на Земле.
Новое открытие также «приближает нас к разработке полностью определенных, понятных и управляемых» живых клеток, говорит она. «Свободные от сложности естественных живых систем, синтетические клетки являются инструментом как для фундаментальных исследований, так и для биотехнологии».
«Потенциальные области применения очень обширны: в сельском хозяйстве, питании, биомедицине и восстановлении окружающей среды», — говорит Джеф Боке из Нью-Йоркского университета. «Возможность исправлять и улучшать биологический код, как это, является важным шагом к тому, чтобы мы туда попали».
Ссылка на журнал: Cell , DOI: 10.1016/j.cell.2021.03.008
Подпишитесь на Wild Wild Life, бесплатный ежемесячный информационный бюллетень, посвященный разнообразию и науке о животных, растениях и других странных и удивительных обитателях Земли.
Статья изменена 30 марта 2021
Мы выяснили, кто занимался исследованием.
Еще по этим темам:
- клеточная биология
Ученые создают синтетические организмы, которые могут воспроизвести
Династия Ксенобот
11. 29. 21 от MJ Banias
Династия Ксенобота
/Скорбная наука
/Hard Science/Harvard/Reproduction/Синтетическая биология 9000
/жесткая наука/Гарвард/репродукция/синтетическая биология.0003
11. 29. 21 MJ Banias
Ученые создали синтетические организмы, способные к самовоспроизведению. Эти крошечные биологические машины миллиметровой ширины, известные как «ксеноботы», теперь обладают способностью воспроизводиться — поразительный скачок вперед в синтетической биологии.
Опубликовано в Proceedings of the National Academy of Sciences , совместная группа из Университета Вермонта, Университета Тафтса и Гарвардского университета использовала Xenopus laevis эмбриональные клетки лягушки для создания ксеноботов.
Их первоначальная работа началась в 2020 году, когда ксеноботы были впервые «построены». Команда разработала алгоритм, который собирал бесчисленное количество клеток вместе для создания различных биологических машин, в конечном итоге остановившись на эмбриональных клетках кожи лягушек.
Корпуса машин собраны с использованием биологического клеточного материала и искусственных электродов. Когда они были активированы, клетки начали работать вместе. Формируя своего рода архитектуру, клетки кожи начали формироваться в «тела», которые могли выполнять определенные задачи, такие как расталкивание микроскопических объектов или самоорганизация и движение в строю.
Выйдя за пределы способности выполнять простые роботизированные задачи, команда подняла планку.
«При правильном дизайне они будут спонтанно самовоспроизводиться», — заявил в заявлении для прессы соруководитель исследования Джошуа Бонгард, ученый-компьютерщик и эксперт по робототехнике из Университета Вермонта.
Как и в любом хорошем сценарии фильма-антиутопии «Убить всех людей», маленькие роботы плавают вокруг и начинают собирать сотни отдельных клеток в свои «рты» в стиле Pac-Man. Через несколько дней появляется совершенно новый ксенобот.
«Это очень неинтуитивно. Это выглядит очень просто», — сказал исследователь Сэм Кригман в пресс-релизе, добавив, что «эти родители создали детей, которые создали внуков, которые создали правнуков, которые создали праправнуков».
Вполне естественно думать, что эти маленькие ксеноботы однажды будут ответственны за восстание роботов и будущий ад франшизы «Терминатор», но биологические машины довольно безобидны. В отличие от современных технологий, таких как ноутбук, ксеноботы можно просто выключить, и примерно через семь дней они биоразложатся, как любая клетка кожи. Более того, команда не собирается выпускать ксеноботов в мир в качестве роботов-помощников. Скорее, идея состоит в том, чтобы изучить, как их создание может привести к созданию более качественных и быстрых алгоритмов, которые могут манипулировать уже живыми и функционирующими клетками.
