Содержание
Этап фотосинтеза приспособили для производства водорода напрямую
Развитие водородной энергетики, которая всё никак не сменит углеводородную, упирается в одну проблему – где брать водород? Австралийцы взяли пример с растений и научились напрямую использовать для его получения солнечный свет, без необходимости сначала производить электричество, а потом использовать его для электролиза воды.
Когда-нибудь автомобили и самолеты перейдут на водород в качестве топлива. Однако если сегодня человечество научилось более или менее эффективно преобразовывать энергию окисления водорода в электричество и даже придумало несколько способов транспортировки и хранения водорода, то каким образом его добывать, непонятно до сих пор.
Основным способом получения водорода в наше время является паровая конверсия метана, когда разогретый до нескольких сот градусов Цельсия водяной пар реагирует с метаном и превращается в смесь угарного газа и водорода. Однако получаемый таким образом водород малопригоден для использования в топливных элементах: даже микропримеси CO являются сильными каталитическими ядами, резко снижающими эффективность катализаторов в топливных элементах. Да и метан сам по себе является невозобновимым ресурсом, и рано или поздно человечество будет вынуждено отказаться от него.
Да и метан сам по себе является невозобновимым ресурсом, и рано или поздно человечество будет вынуждено отказаться от него.
Поэтому уже сейчас понятно, что добывать водород для нужд энергетики придется с помощью старого доброго электролиза воды. Трудностей на пути массового производства водорода из воды достаточно. Начиная с того, что из-за сложности и многообразия химических процессов на электродах затрачивать на электролиз приходится в полтора раза больше энергии, чем теоретически можно получить обратно в реакции каталитического окисления. И заканчивая тем, что электролиз подразумевает использование чистой пресной воды, нехватку которой человечество ощущает уже сейчас. Научиться эффективно опреснять морскую воду нам еще предстоит.
Не пытаясь решить всех проблем сразу, международная группа ученых во главе с Леоном Спиццией, профессором Монашеского университета в австралийском Мельбурне, опубликовала в последнем выпуске международного издания журнала Angewandte Chemie статью, в которой
предложила использовать на одной из стадий разложения воды реакцию фотолиза воды, то есть расщепления её молекул с помощью света.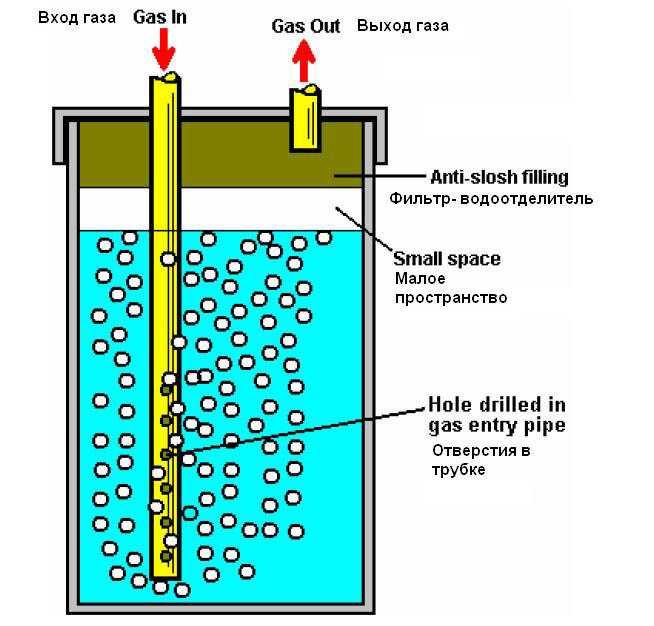
Такая реакция происходит во всех растениях, от одноклеточных водорослей до вековых деревьев, и приводит к поглощению растением углекислого газа и воды с выделением кислорода и усвоением углеводов под действием солнечного света.
Растения обладают специфическим каталитическим центром, в котором окисление воды происходит исключительно под действием света. Структурные исследования прежних лет выявили, что центр этот имеет кубическую геометрию и состав {CaMn3O4} и связан с четвертым атомом марганца через дополнительную оксогруппу (-O-). Химики уже пытались воссоздать подобный каталитический центр in vitro, но до сих пор ни один из этих искаженных или неполных кубических элементов не показал способности к фотоокислению воды.
Предыдущие работы научной группы Спицции были посвящены синтезу целого семейства комплексных соединений, основу которых составил кубический элемент {Mn4O4}n+. В высших степенях окисления этот кубический элемент проявляет очень большую окислительную способность, разрывая даже очень сильные связи кислород-водород и азот-водород.
Кроме того, команда Спицции синтезировала различные комплексные соединения с ядром из кубического марганцево-кислородного элемента [Mn4O4L6], где в качестве лигандов L — используются различные диарилфосфинатные анионы. Эти комплексы на основе марганцево-кислородного кубического ядра уникальны своей способностью высвобождать молекулярный кислород при возбуждении светом.
close
100%
Процесс идет наиболее эффективно при облучении фиолетовым светом с длиной волны 350 нм. Он включает в себя высвобождение двух из четырех атомов кислорода, образующих ядро, а также отсоединение одного из шести лигандов.
Впоследствии комплекс полностью восстанавливается, присоединяя к себе утраченный лиганд и две молекулы воды и высвобождая четыре протона – то есть ядра атомов водорода – в последовательных стадиях депротонирования.
Проблема реализации замкнутого каталитического цикла на основе подобного катализатора заключается в том, что описанные реакции возможны только в газовой фазе. А вот в конденсированном состоянии энергии света оказывается недостаточно для отрыва молекулы кислорода.
А вот в конденсированном состоянии энергии света оказывается недостаточно для отрыва молекулы кислорода.
Кроме того, комплексные соединения на основе кубического ядра из марганца и кислорода нерастворимы в воде и большинстве органических растворителей, что сильно осложняло исследователям жизнь при изучении взаимодействия подобных комплексов с водой при освещении.
close
100%
Преодолеть эту трудность помог замечательный мембранный материал Nafion производства американской корпорации Du Pont. Этот материал представляет собой полимерную мембрану с порами, заполненными молекулами воды. Поры образованы гидрофильными, то есть притягивающими молекулы воды, участками полимерной цепи, а разделены между собой участками гидрофобными, то есть отталкивающими воду.
С помощью реакции ионного обмена ученым удалось поместить комплексные соединения с кубическим ядром в гидрофобные участки мембраны и закрепить их там за счет взаимодействия лигандов с матрицей полимера. При этом активный центр катализатора сохраняет доступ к воде в порах полимера. Поры же в материале Nafion объединены в каналы, по которым и переносятся ионы водорода Н+.
Поры же в материале Nafion объединены в каналы, по которым и переносятся ионы водорода Н+.
Дальнейшие процедуры по созданию установки по окислению воды выглядят следующим образом. Жидкий Nafion с встроенными в него комплексами катализатора выливают на подложку из стеклоуглерода, где тот затвердевает и, таким образом, функционализирует рабочий электрод электролизера. Электрод опускается в емкость с деионизованной водой и между ним и электродом сравнения создается разность потенциалов примерно.
При освещении электрода светом происходит резкое увеличение тока, которое связано с протеканием реакций окисления молекул воды.
Если же освещение выключить, то протекание электрического тока прекращается, что говорит об окончании реакции окисления воды.
close
100%
Nafion
Мембрана Nafion представляет собой сополимер тетрафторэтилена и мономера, имеющего боковые цепи перфторированного винилового эфира, оканчивающиеся сульфогруппами.
В процессе этой реакции кислород высвобождается в молекулярной форме, тогда как ионы водорода через каналы в Nafion’е двигаются к катоду. Достигая поверхности электрода, ионы получают электроны и преобразуются в молекулярный водород.
Достигая поверхности электрода, ионы получают электроны и преобразуются в молекулярный водород.
К достоинству подобного метода получения водорода относится отсутствие необходимости в больших напряжениях – разница потенциалов между электродами составляет примерно 1 В – и энергозатратах, характерных для обычного электролиза. Для расщепления воды на O2 и 4Н+ достаточно осветить электрод видимым светом, а электрическое напряжение прикладывается исключительно для восстановления 2Н+ до молекулы водорода.
Кроме того, кубические анионы на основе марганца и кислорода гораздо дольше сохраняют свою эффективность, будучи закреплены в полимерной матрице, чем если бы они были растворены в составе комплексного соединения в неводном растворителе. Растворенные комплексы при постоянном отщеплении и присоединении одного из лигандов постепенно полимеризуются, и в итоге количество молекул, принимающих участие в фотоокислении воды, снижается. С закреплёнными в матрице такого не происходит.
Сумев воспроизвести в некое подобие природного механизма окисления воды,
ученые могут пока что только развести руками в ответ на вопрос о механизме такого превращения.
Изучению данной реакции воды с искусственными кубическими марганцево-кислородными окислителями будут посвящены их ближайшие работы.
И это лишь первый шаг на пути освоения природного механизма фотоокисления воды, который эволюционировал в течение миллиардов лет. По современным подсчетам, у человечества, чтобы слезть с нефтегазовой иглы, есть лишь несколько десятилетий.
Солнечный водород как спасение — Федеральное министерство иностранных дел Германии
Революционная методика позволит превращать этот элемент в «чистое» топливо и использовать в качестве энергонакопителя в промышленных масштабах.
Водород признан незаменимым для экологичного и стабильного энергообеспечения, поскольку выработка тока и тепла с его помощью представляет собой практически неограниченный ресурс и не генерирует опасные побочные продукты.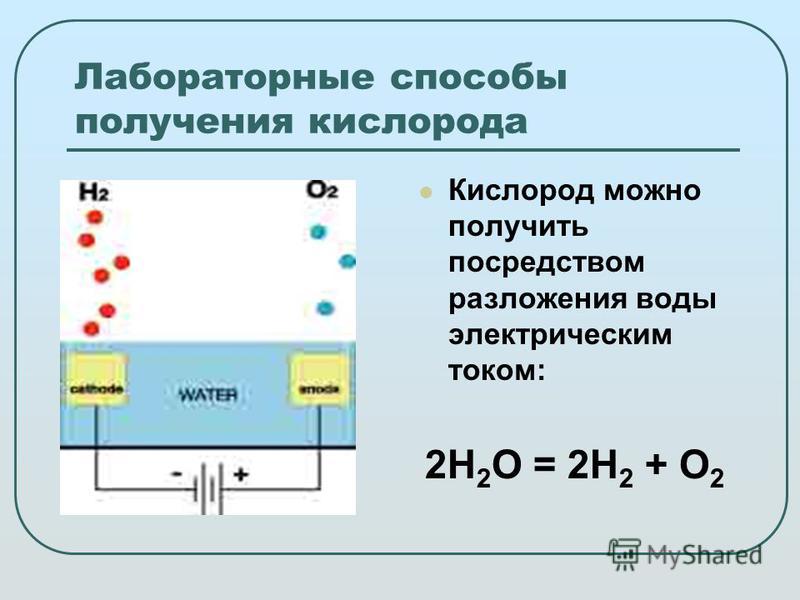 Специалисты давно делают ставку на производство этого элемента путем прямого расщепления воды солнечным светом. Однако из-за малой производительности фотокалитических систем водород до сих пор получают в основном из природного газа или из воды, которую расщепляют электролизом. А используемые в промышленном масштабе агрегаты пока не приспособлены работать исключительно на изменяющейся силе ветра или солнечной энергии.
Специалисты давно делают ставку на производство этого элемента путем прямого расщепления воды солнечным светом. Однако из-за малой производительности фотокалитических систем водород до сих пор получают в основном из природного газа или из воды, которую расщепляют электролизом. А используемые в промышленном масштабе агрегаты пока не приспособлены работать исключительно на изменяющейся силе ветра или солнечной энергии.
Германо-американская команда исследователей совершила прорыв в фотогальванике, увеличив КПД при стопроцентном «солнечном» производстве водорода из воды до рекордных 19 %. Тем самым ученые вплотную приблизились к теоретически допустимому максимуму, составляющему 23 %, при котором вся поглощенная энергия света расходуется на разложение воды. Примечательно, что предыдущий рекорд (12,4 %) продержался целых 17 лет.
Для своей революционной разработки Маттиас Май (Mattias May) из Центра материалов и энергии имени Гельмгольца, Томас Ханнапель (Thomas Hannappel) из Технического университета Ильменау и Ханс-Йоахим Леверенц (Hans-Joachim Lewerenz) из Калифорнийского технологического института использовали высокоэффективную тандемную солнечную батарею, состоящую из двух полупроводников смешанного типа.
Суперпродуктивность инновационной солярной энергосистемы (ISE) обеспечивает разработанный во Фрайбурге в Институте солнечных энергосистем им. Фрауэенгофера фотохимический элемент, который имеет фотоэлектрический КПД 30 процентов. Собственно, он и вырабатывает электроэнергию из солнечного света с тем, чтобы расщепить воду на водород и кислород. Для этого солнечная батарея помещается в заполненную водой электрохимическую ячейку. В процессе эксплуатации в области катода выделяется газообразный водород, тогда как в области анода возникает кислород.
Три года назад Маттиасу Маю и его коллегам этим способом уже удавалось преобразовать 14 процентов падающего солнечного света в водород, что в то время тоже было лучшим в мире результатом. Однако энергопотери, вызванные процессами отражения и поглощения света на поверхности используемой тогда фотохимической ячейки, были слишком велики. К тому же коррозийный эффект, вызванный контактом с водой, сокращал срок службы электрохимических элементов.
Сейчас исследователи устранили слабые звенья конструкции. «Мы заменили антикоррозийный верхний слой кристаллическим слоем диоксида титана, который не только обладает отличными антибликовыми свойствами, но и притягивает наночастицы родия, из которых состоит катализатор нашей установки», – объясняет Ханс-Йоахим Леверенц.
Для получения частиц родия, ускоряющих процесс расщепления воды, исследователи также использовали новый электрохимический процесс. «Эти частицы всего 10 нанометров в диаметре и поэтому оптически почти прозрачны, что делает их идеальными для работы», – поясняют создатели высокопродуктивной новинки.
Кроме этого, на этот раз удалось обеспечить оптимальную транспортировку производимого в солнечной батарее электрического переносчика заряда в направлении катода. Все эти новшества позволили ученым обеспечить в кислотном водном растворе небывалую эффективность 19,3 %, тогда как в нейтральной воде КПД на данный момент составляет 18,5 %. С помощью дальнейших технических инноваций экспериментаторы рассчитывают перешагнуть 20-прецентный показатель производительности для фотокаталитической ячейки этого типа.
Среди ближайших задач – работа над увеличением срока эксплуатации тандемной батареи, который пока остается слабым звеном. Производительность системы падает после ста часов работы, в то время как для практического применения требуется несколько тысяч часов бесперебойной работы без снижения эффективности.
Также в планах – снизить затраты на материалы для прототипа, поскольку используемые в нем особые полупроводники делают конструкцию чересчур дорогой для коммерческого применения. Для этого специалисты Технического университета Ильменау вместе с коллегами из Института Фрауэнгофера работают над созданием фотогальванических элементов, в которых композиционные полупроводники будут скомбинированы с кремнием, который превосходит родий в экономичности.
Если удастся и впредь вести разработки с нынешними темпами, то, по оценкам ученых, уже через пять-десять лет тандемные солнечные батареи поступят на рынок, чтобы превращать энергию солнечного света в водород в промышленных масштабах.
Арина Попова
Составление и разложение материи | manoa.hawaii.edu/ExploringOurFluidEarth
Химические реакции
Соединения состоят из атомов двух или более элементов, соединенных химически. Это химическое соединение называется соединением . Существует много типов химических реакций, в результате которых образуются химические соединения, некоторые из них описаны в таблице 1.4. В химической реакции одно или несколько веществ подвергаются химическому изменению с образованием другого вещества или веществ. Исходными веществами являются реагенты . Новое вещество, полученное в результате химической реакции, называется продуктом . Химическая реакция обычно записывается в следующем формате:
реагент + реагент → продукт + продукт
Стрелка указывает на то, что произошла химическая реакция. Вышеприведенное утверждение следует читать как «реагент плюс реагент дает продукт и продукт».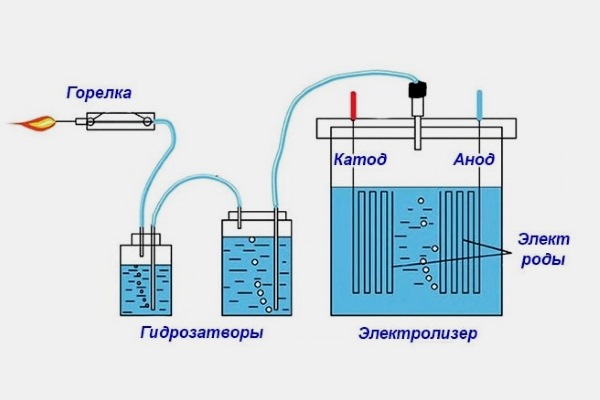
Примером химической реакции является нейтрализация желудочной кислоты антацидом. Химическая формула антацида Ca(OH) 2 . Желудочная кислота представляет собой соляную кислоту (HCl). Когда эти два реагента объединяются, они реагируют с образованием хлорида кальция (CaCl 2 ) и воды (H 2 O). Вода образуется из OH в Ca(OH) 2 и H в HCl, чтобы получить HOH, другой способ записи H 2 O. Химическая реакция записывается в следующем формате:
Ca( OH) 2 + 2 HCl → CaCl 2 + 2 H 2 O
Эта реакция выглядит так: гидроксид кальция плюс соляная кислота дает хлорид кальция плюс вода . Примеры химических реакций приведены в таблице 1.4.
| Тип реакции | Реакция модели | Пример реакции |
|---|---|---|
| Состав | А + В → АВ
Два или более реагента объединяются с образованием продукта | 4 Fe + O 2 → 2 Fe 2 O 3
железо плюс кислород дает оксид железа упрощенная реакция на образование ржавчины |
| Одиночная замена | А + ХУ → АУ + Х
Производится одиночный переход между компонентами двух реагентов | 3 Ag 2 S + 2 Al → 6 Ag + Al 2 S 3
сульфид серебра плюс алюминий дает серебро и сульфид алюминия реакция для полировки потускневшего серебра в ванне с алюминиевой фольгой |
| Двойная замена | AB + XY → AY + XB
Производится двойной переход между компонентами двух реагентов | Ca(OH) 2 + 2 HCl → CaCl 2 + 2 H 2 O
гидроксид кальция плюс соляная кислота дает хлорид кальция плюс вода реакция на нейтрализацию желудочной кислоты антацидом |
| Горение | C i H j +O 2 → CO 2 + H 2 O
Реагент, состоящий из углерода и водорода (углеводород), реагирует с кислородом с образованием двуокиси углерода и воды.
| CH 4 + 2 O 2 → CO 2 + 2 H 2 O
метан плюс кислород дает углекислый газ и воду реакция сжигания метана (основного компонента природного газа) |
| Разложение | АВ → А + В
Реагент распадается на два или более продуктов | 2 Ч 2 О 2 → 2 Н 2 О + О 2
перекись водорода дает воду и газообразный кислород реакция разложения перекиси водорода |
Соединения могут быть разложены на более простые соединения или их элементарные компоненты путем разрыва связей. Некоторые соединения разлагаются при нагревании или под воздействием солнечного света. Например, карбонат кальция (известняк) при нагревании разлагается на оксид кальция (негашеную известь) и углекислый газ. Свет разлагает перекись водорода на воду и кислород (рис. 1.8). Поскольку вода является чрезвычайно стабильным соединением, она не разлагается легко.
Например, карбонат кальция (известняк) при нагревании разлагается на оксид кальция (негашеную известь) и углекислый газ. Свет разлагает перекись водорода на воду и кислород (рис. 1.8). Поскольку вода является чрезвычайно стабильным соединением, она не разлагается легко.
В процессе электролиза используется электричество для разрыва связей, что приводит к разложению материи. Электричество — это поток электронов, отрицательно заряженных частиц в атомах. При электролизе химическое изменение вызывается электричеством, протекающим через химическое соединение.
Задание
Исследование состава воды с помощью электролиза. Чтобы электрический ток протекал, цепь должна быть замкнутой. Цепь может состоять из батареи и двух проводов, соединенных с электродами, которые уходят в раствор.
Аппарат Хоффмана
Аппарат Хоффмана используется для электролиза воды. Это стеклянная U-образная трубка, заполненная трубкой чертополоха (рис. 1.11). В таблице 1.5 поясняются части аппарата Хоффмана.
1.11). В таблице 1.5 поясняются части аппарата Хоффмана.
| Помеченные детали на рис. 1.11 | Имя | Описание |
|---|---|---|
| А | Трубка чертополоха | Средняя трубка имеет наверху воронкообразную секцию, называемую чертополоховой трубкой, которая используется для наполнения аппарата водой для электролиза. |
| Б | U-образная трубка | U-образная трубка состоит из двух вертикальных цилиндров, соединенных горизонтальной трубкой. Маркировка на баллонах позволяет точно измерять объемы газов и жидкостей. |
| С | Платиновые электроды | Платиновые электроды находятся на дне цилиндров. Платиновые электроды проводят электричество и не подвержены коррозии. |
| Д | Запорные краны | Запорные краны можно открывать или закрывать для сбора газов. |
Мероприятие
Наблюдать за демонстрацией испытания пламенем для исследования газообразных продуктов электролиза. Демонстрационные материалы и процедура написаны в этом упражнении.
Электролиз
Электролиз использует электричество для расщепления воды на водород и кислород. На отрицательном полюсе батареи образуются электроны. Эти электроны текут по проводу к электроду в растворе (рис. 1.12). На отрицательном (-) электроде электроны передаются воде и подхватываются атомами водорода в воде. Это позволяет водороду отделяться от остальной части молекулы воды и образовывать молекулы h3. На другом электроде, положительном (+), электроны отдаются кислородом в молекуле воды, что позволяет кислороду отделяться от воды и образовывать молекулы O2. Электроны текут от этого электрода обратно к положительной клемме батареи.
Химическая реакция, которая произошла на положительном электроде:
2 H 2 O → O 2 + 4H + + 4E —
. Химичная реакция, которая произошла в Chemical Recement, которая произошла. Негативная. электрод был:
Химичная реакция, которая произошла в Chemical Recement, которая произошла. Негативная. электрод был:
2 H 2 O + 2e — → H 2 + 2OH —
Физические и химические изменения воды при нагревании
1 9000 Физическое изменение происходит, когда жидкая вода испаряется в газообразный водяной пар. Кипение — это физическое изменение, потому что, хотя вода из жидкого состояния переходит в газообразное, и жидкость, и газ состоят из молекул воды. Молекула воды не распалась.
При электролизе воды (рис. 1.13 Б) из жидкой воды образуются газообразные водород и кислород. Электролиз воды вызывает химическое изменение, при котором молекулы воды расщепляются с образованием водорода и кислорода — двух веществ, которые химически отличаются от воды. Разложение воды затруднено и не может быть достигнуто только путем нагревания. Воду не разбивает даже жар вулканического извержения!
Сохранение материи
Важной характеристикой материи является то, что она никогда не может быть создана или уничтожена, только преобразована. Физическое или химическое изменение превращает материю из одной формы материи в другую. Джон Дальтон был одним из первых ученых, признавших это свойство материи. Эта идея называется законом сохранения материи. При любом физическом или химическом изменении материя не создается из ничего. Например, металлический предмет, который ржавеет, приобретает коричневатый налет, а также увеличивается в массе. Это происходит из-за химического изменения, реакции атомов железа с атомами кислорода в воздухе. Материя тоже не исчезает, хотя может появиться. Например, при электролизе воды, хотя объем жидкой воды уменьшается, вещество, из которого состоит вода, не исчезает. Скорее, атомы водорода и кислорода в жидкой воде превращаются в молекулы газообразного водорода и газообразного кислорода. Закон сохранения материи является частью атомной теории Дальтона, состоящей из пяти основных частей:
Физическое или химическое изменение превращает материю из одной формы материи в другую. Джон Дальтон был одним из первых ученых, признавших это свойство материи. Эта идея называется законом сохранения материи. При любом физическом или химическом изменении материя не создается из ничего. Например, металлический предмет, который ржавеет, приобретает коричневатый налет, а также увеличивается в массе. Это происходит из-за химического изменения, реакции атомов железа с атомами кислорода в воздухе. Материя тоже не исчезает, хотя может появиться. Например, при электролизе воды, хотя объем жидкой воды уменьшается, вещество, из которого состоит вода, не исчезает. Скорее, атомы водорода и кислорода в жидкой воде превращаются в молекулы газообразного водорода и газообразного кислорода. Закон сохранения материи является частью атомной теории Дальтона, состоящей из пяти основных частей:
- Материя состоит из маленьких частиц, называемых атомами.
- Атомы одного и того же элемента одинаковы; атомы разных элементов различны.

- Материя не может быть создана или уничтожена.
- атомов могут соединяться в различных соотношениях, образуя соединения.
- В химических реакциях атомы перестраиваются с образованием новых соединений.
Атомная теория Дальтона составляет основу современной атомной теории.
23,9: Электролиз воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53976
Поскольку ископаемое топливо становится все более дорогим и менее доступным, ученые ищут другие источники энергии. Водород долгое время считался идеальным источником, поскольку при горении он не загрязняет воздух. Проблема заключалась в том, чтобы найти способы экономичного производства водорода. Один из новых подходов, который изучается, — это фотоэлектролиз — производство электричества с использованием фотогальванических элементов для расщепления молекул воды. Этот метод все еще находится на стадии исследований, но, похоже, в будущем он станет очень многообещающим источником энергии.
Проблема заключалась в том, чтобы найти способы экономичного производства водорода. Один из новых подходов, который изучается, — это фотоэлектролиз — производство электричества с использованием фотогальванических элементов для расщепления молекул воды. Этот метод все еще находится на стадии исследований, но, похоже, в будущем он станет очень многообещающим источником энергии.
Электролиз воды
При электролизе воды образуются газообразные водород и кислород. Электролитическая ячейка состоит из пары платиновых электродов, погруженных в воду, к которым добавлено небольшое количество электролита, такого как \(\ce{H_2SO_4}\). Электролит необходим, потому что чистая вода не несет достаточного заряда из-за отсутствия ионов. На аноде вода окисляется до газообразного кислорода и ионов водорода. На катоде вода восстанавливается до газообразного водорода и ионов гидроксида. 90_\text{cell} = -2,06 \: \text{V} \end{array}\nonumber \]
Чтобы получить общую реакцию, полуреакцию восстановления умножили на два, чтобы уравнять электроны.
