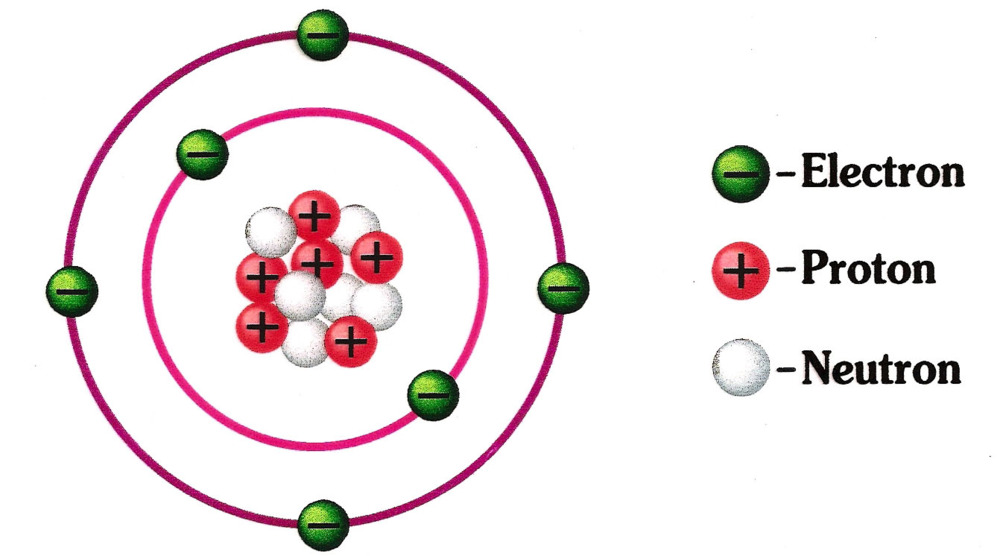
Содержание
Возбужденные атомы: 4. Ридберговские атомы
Масштабы: времена > Возбужденные атомы
Переход из 2P в 1S-состояние в атоме водорода — это один из самых быстрых процессов излучения фотона возбужденным атомом. Для других возбужденных состояний это время может быть намного больше. Есть разные причины, дополнительно затрудняющие излучение. Это может быть слишком маленькая энергия излученного фотона, несогласование пространственных конфигураций начального и конечного электронного облака, или слишком большой вращательный момент, который приходится уносить излученному фотону.
Симпатичной иллюстрацией того, как может задерживаться распад возбужденного состояния, являются ридберговские атомы. Так называют атомы некоторых элементов, у которых самый внешний электрон находится в очень возбужденном энергетическом состоянии: его главное квантовое число n (условно говоря, номер ступеньки в лестнице возбужденных состояний) может достигать тысячи! Такой атом можно представлять себе как компактный остов и далеко простирающееся облако возбужденного электрона. Ридберговский атом может иметь очень большие размеры, вплоть до долей миллиметра. Подумать только — один атом чуть ли не макроскопических размеров!
Ридберговский атом может иметь очень большие размеры, вплоть до долей миллиметра. Подумать только — один атом чуть ли не макроскопических размеров!
ПС
Поскольку возбужденный электрон находится далеко от центра, все связанные с ним явления замедляются. Период движения внешнего электрона — уже не доли фемтосекунды, а во много тысяч раз больше, в пикосекундной или наносекундной области.
На рисунке внизу показано, как может колебаться и деформироваться электронное облако в таком атоме при его движении в пространстве.
МКС
Время жизни таких возбужденных состояний тоже быстро растет с увеличением n и составляет микросекунды и больше. Это намного превышает естественное время жизни возбужденного состояния, про которое мы говорили на предыдущих страницах. А это значит, что есть некоторые препятствия для распада этого возбужденного состояния. И в самом деле, испустить фотон и сразу упасть в основное состояние этот электрон не может — слишком уж непохожи друг на друга электронные конфигурации в начале и в конце. Он может распадаться каскадно, прыгая со ступеньки на ступеньку и каждый раз излучая по фотону. Однако между ступеньками очень маленькая разница энергий — и из-за этого такой процесс тоже очень замедлен.
Он может распадаться каскадно, прыгая со ступеньки на ступеньку и каждый раз излучая по фотону. Однако между ступеньками очень маленькая разница энергий — и из-за этого такой процесс тоже очень замедлен.
Вообще, с ридберговскими атомами можно делать много чего интересного — особенно когда имеется целый набор таких атомов. Но здесь уже начинается передний край атомной физики, на который мы залезать не будем, а ограничимся лишь ссылкой на популярную заметку про ридберговскую материю.
Атомы-долгожители
Миллионы безуспешных попыток
Написать комментарий
Бело-черная пятница американской науки
25.11 • Алексей Левин
Нобелевская премия по физике — 2022
08.10 • Алексей Левин
В данных LHC проступают новые намеки на отклонения от Стандартной модели
30.09 • Игорь Иванов
Климатическая повестка проникает и в физику элементарных частиц
12..jpg) 09 • Игорь Иванов
09 • Игорь Иванов
Все новости физики
Откуда мы знаем об атомах? . Атомы у нас дома. Удивительная наука за повседневными вещами
Если мы не можем видеть атомы, откуда мы знаем об их существовании? Как я могу убедить вас, что под полом вашего дома есть атомы, с большим успехом, чем я могу доказать вам, что на чердаке у вас скребется мышь? В чем атомная физика отличается от транса верующих, убежденных в том, что они могут обнять Господа? В отличие от религии, наука основана на доказательствах. И в том, что именно атомы становятся строительными кирпичиками нашего мира, нас убеждают многочисленные факты, которые человечество собирало на протяжении последних 2500 лет. В атомы верили даже древние греки. Само слово в переводе с древнегреческого означает «неделимый». Оно было изобретено Демокритом – первым человеком, который населил наш мир этими «невидимыми и неделимыми» элементами. Это было замечательное достижение человеческого разума, особенно с учетом того, что в то время очевидных доказательств существования атома не было.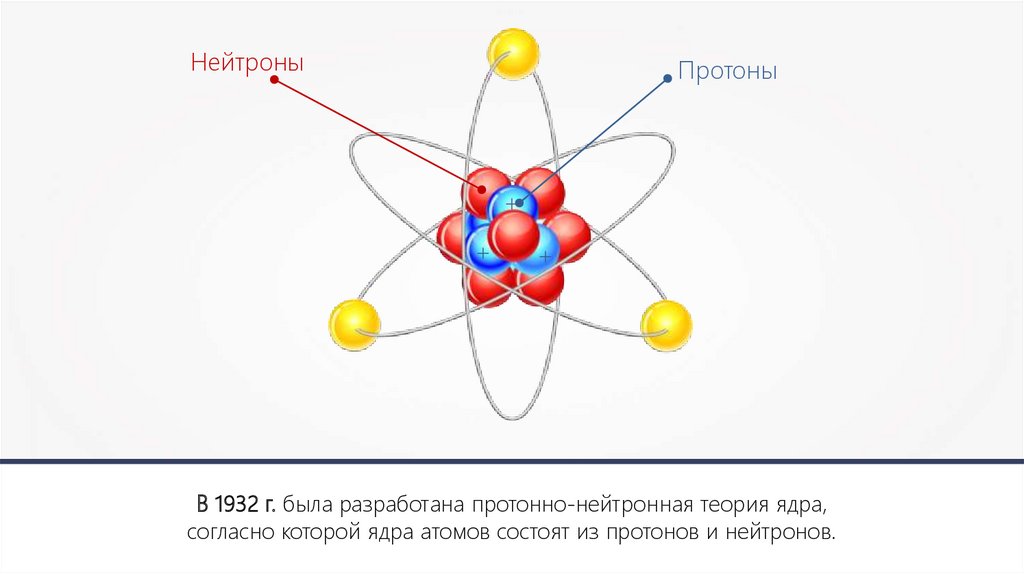
Сегодня такие доказательства получены четырьмя различными способами: химическим, электрическим, явлением радиоактивности и делением атома. Первый способ простой – химия. Если вы знаете, что два разных газа (например, водород и кислород) соединяются и образуют воду всегда в соотношении 2: 1 (2 атома водорода и 1 атом кислорода), то такое же соотношение можно установить и для других химических веществ и атомов, из которых они состоят. Скажем, если вы смешаете мягкий металл натрий с ядовитым газом хлором, то получите хлорид натрия, то есть пищевую соль, которую вы используете при приготовлении еды. В ней один атом натрия приходится на один атом хлора. Если пронаблюдать за сотнями химических реакций, как это сделал известный английский химик Джон Дальтон в 1803 году, то можно установить, что базовые химические элементы всегда находятся в их соединениях в простых соотношениях: один к одному, два к одному, три к одному и т. д. Если эти элементы расставить в систематическом порядке, то вы получите нечто вроде кухонных шкафчиков, в которых вещества организованы в периодическую таблицу. Это полный список химических элементов, которые мы имеем в своем распоряжении.
Это полный список химических элементов, которые мы имеем в своем распоряжении.
Простые химические реакции заставляют нас предположить, что атомы существуют. Но вот вопрос: если вещества вроде воды или соли состоят из атомов, из чего состоят сами атомы? Если следовать логике древних греков, этот вопрос не имеет смысла: ведь атомы и так являются мельчайшими «неделимыми» единицами в природе и не сделаны ни из чего. Такое объяснение вполне удовлетворяло ученых до середины XIX века, когда Андре-Мари Ампер, Алессандро Вольта и Майкл Фарадей начали свои знаменитые опыты по раскрытию тайн электричества. Когда в 1897 году англичанин Джозеф Томсон открыл базовый элемент электрического поля, известный сейчас как электрон, появилось еще одно важное свидетельство в пользу существования атомов. И не только их, но и таинственного субатомного мира внутри них[83]. К счастью, Томсона не обескуражила реакция его кузена, когда в школьные годы последний спросил будущего ученого, чем бы он хотел заняться в будущем. «Проводить научные исследования», – ответил Томсон. «Не будь таким глупцом!» – фыркнул кузен[84]. Что произошло бы, если бы великий ученый оставил свою мечту и стал врачом или бухгалтером? Что произошло бы, если бы электрон не был открыт еще несколько десятилетий? Отложилась бы революция в области высоких технологий и электроники еще лет на пятьдесят? Спорить об этом теперь уже бесполезно – но очень увлекательно.
«Проводить научные исследования», – ответил Томсон. «Не будь таким глупцом!» – фыркнул кузен[84]. Что произошло бы, если бы великий ученый оставил свою мечту и стал врачом или бухгалтером? Что произошло бы, если бы электрон не был открыт еще несколько десятилетий? Отложилась бы революция в области высоких технологий и электроники еще лет на пятьдесят? Спорить об этом теперь уже бесполезно – но очень увлекательно.
Деление атомов
Еще более убедительное доказательство существования сложной жизни внутри атома было получено примерно в то же время во Франции. В 1896 году Анри Беккерель открыл явление радиации и установил, что в ходе ее атомы испускают некие элементарные частицы. Это явление было похоже на рентгеновское излучение (тоже недавно открытое), но гораздо более мощное. Явление радиоактивности, как мы теперь его называем, легко понять, если предположить, что гигантские атомы наполнены несравненно более мелкими элементарными частицами. Некоторые атомы существуют в возбужденных, нестабильных формах, которые известны как изотопы. Те стремятся прийти в более спокойное состояние, отторгая нежелательные или ненужные микрочастицы.
Некоторые атомы существуют в возбужденных, нестабильных формах, которые известны как изотопы. Те стремятся прийти в более спокойное состояние, отторгая нежелательные или ненужные микрочастицы.
Мария Кюри (и ее муж Пьер) развили работы Беккереля. Эти исследования стоили Марии Кюри жизни, но ее жертва стала благородной: со времени ее смерти до настоящего дня открыто множество различных способов лечения с помощью радиоактивного облучения страшных болезней, в том числе рака[85]. Многие годы спустя научные открытия часто кажутся заслуживающими восхищения. Судьба супругов Кюри в 1943 году вдохновила кинодеятелей из Голливуда на создание прекрасного фильма с Гриер Гарсон и Уолтером Пидженом в главных ролях. Однако повседневная научная работа очень далека от романтики. Мы часто вспоминаем рассказы о блестящих озарениях и находках разных ученых, но забываем о рутинной, тяжелой и зачастую скучной работе, которая за этим стоит.
Открытие Марии Кюри потребовало проведения за четыре года 5677 опытов, в ходе которых она нагревала в колбах 8 т растворов урана (в переводе с немецкого – «злосчастного минерала»), чтобы в результате получить всего 1 г радиоактивного радия[86].
Нас пугают рискованные эксперименты Марии Кюри, потому что мы знаем, как закончилась ее жизнь. Она осталась ярким пятном в истории исследования атома и радиоактивности, которая все же заставляет нас с недоверием относиться к ядерной энергии. Грибовидное облако над Хиросимой еще долго будет проходить период полураспада. Катастрофы в Чернобыле и Фукусиме породили глубокие сомнения в ценности ядерной энергии – хотя от естественной радиоактивности люди умирают едва ли не чаще, чем от рака[87]. Однако дух первопроходца, руководивший Марией Кюри, жив и поныне. Журнал Popular Science в 1955 году опубликовал очень занимательную статью о непрофессиональных исследователях урановой проблемы, которые под покровом ночи работали со счетчиком Гейгера, выписанным по каталогу. Мотивировало их обещание некой награды от Комиссии по атомной энергии.
Мать и сын купили коротковолновую ультрафиолетовую лампу, начитались материалов о минералогических изысканиях и с тех пор каждый вечер выходили на окрестные холмы в поисках урана. Эта новость стала известна, и в течение нескольких месяцев Комиссия была завалена заявлениями о присоединении к проекту[88].
Эта новость стала известна, и в течение нескольких месяцев Комиссия была завалена заявлениями о присоединении к проекту[88].
В феврале 2014 года 13-летний английский школьник Джейми Эдвардс стал первым человеком в мире, который добился реакции ядерного синтеза (когда более мелкие атомы соединяются в более крупные). Деньги на счетчик Гейгера Джейми сэкономил из рождественских подарков[89]. Джозеф Томсон гордился бы им.
Нестабильные атомы, например радиоактивного урана, распадаются, создавая более стабильные изотопы. Но это не единственный вид изменений, который могут претерпевать атомы. Четвертый вид научных доказательств их существования дал науке убедительные свидетельства того, что они не только содержат более мелкие частицы – такие как электроны, – но и у них имеется своя сложная внутренняя структура.
Человеком, который «разделил атом», считается новозеландец Эрнест Резерфорд. Но на самом деле честь первооткрывателя принадлежит множеству ученых, которые «возились» с атомной проблемой в первые 20 лет XX столетия.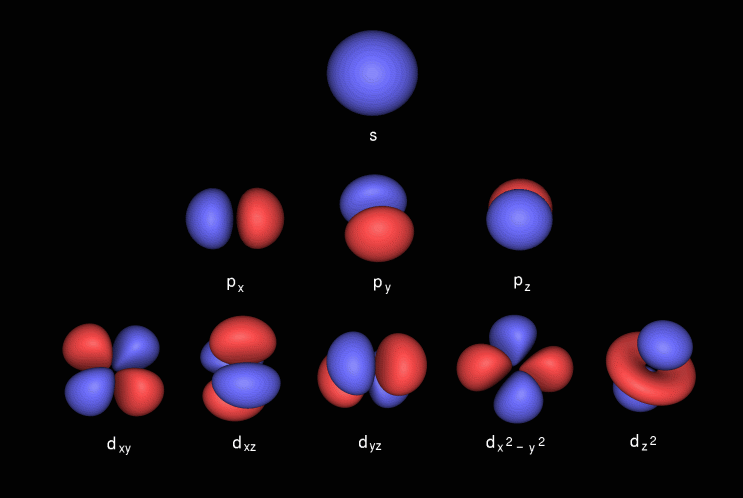
Резерфорд широко известен своим выдающимся экспериментом, который он провел в Манчестере в 1910 году вместе со своими двумя молодыми ассистентами: Гансом Гейгером и Эрнестом Марсденом. Направляя положительно заряженные частицы атомов гелия на золотую фольгу, экспериментаторы увидели, что большинство из них прошло мимо атомов золота без ущерба для себя, некоторые (примерно 1 частица из 8000) отклонялись под невероятными углами, а отдельные вообще отклонились назад в том направлении, из которого исходили. Резерфорд был поражен. Он заявил, что у него создавалось ощущение, «будто он стреляет 300-миллиметровым снарядом по листу бумаги, а снаряд возвращается и попадает в него». Для нас объяснение уже вполне очевидно. Положительно заряженные частицы гелия попадали в положительно заряженное ядро атомов золотой фольги, которое отталкивало их назад (или «рассеивало», как говорят ученые), как это происходит между одноименными полюсами магнита.
? Старый способ разделения атома. Эрнест Резерфорд обстреливал альфа-частицами (атомами гелия) золотую фольгу и наблюдал за результатами. Большинство частиц прошли сквозь фольгу, не претерпев особых изменений. Некоторые отклонились под очень большими углами. Одна или две частицы практически вернулись назад по первоначальной траектории. Из этого Резерфорд сделал вывод, что атомы золота состоят из ядра, окруженного преимущественно пустым пространством, в котором разбросаны электроны. Ученому удалось с высокой точностью вычислить размеры ядра атома золота.
Эрнест Резерфорд обстреливал альфа-частицами (атомами гелия) золотую фольгу и наблюдал за результатами. Большинство частиц прошли сквозь фольгу, не претерпев особых изменений. Некоторые отклонились под очень большими углами. Одна или две частицы практически вернулись назад по первоначальной траектории. Из этого Резерфорд сделал вывод, что атомы золота состоят из ядра, окруженного преимущественно пустым пространством, в котором разбросаны электроны. Ученому удалось с высокой точностью вычислить размеры ядра атома золота.
? Новый способ разделения атома. Когда протоны сталкиваются с большой скоростью в Большом адронном коллайдере, принадлежащем европейской организации ЦЕРН[90], то создается еще более 10 других частиц, которые оставляют свои следы на фотографии[91].
Точные и изящные эксперименты Резерфорда позволили раскрыть потрясающую тайну строения атомов. В основном внутри них находится пустое пространство, а значительная часть их массы заключена в положительно заряженном ядре, вокруг которого вращаются в облаках «пустоты» электроны.
В основном внутри них находится пустое пространство, а значительная часть их массы заключена в положительно заряженном ядре, вокруг которого вращаются в облаках «пустоты» электроны.
Сегодня делением атомов уже никого не удивишь. Современные последователи Резерфорда в искусстве «ускорения» частиц добились деления атомов на частицы, а тех, в свою очередь, на еще более мелкие элементарные частицы. Мы знаем десятки элементарных субатомных частиц, от старых друзей вроде протонов и нейтронов до новых (и очень трудно уловимых) бозонов Хиггса, за которыми ученые охотятся десятилетиями, а человечество тратит на это миллиарды евро, вложенных, в частности, в огромный ускоритель, построенный недавно под Женевой: Большой адронный коллайдер (БАК)[92].
А ведь для того чтобы разделять атомы, не нужно особых затрат времени и денег. Вплоть до недавнего времени большинство из нас занималось этим каждый вечер дома в гостиной. Старые телевизоры с катодными трубками работают на принципе нагревания специальных металлических элементов, которые излучают пучки электронов (исторически за ними закрепилось название «катодные лучи»), которые разгоняются по специальным стеклянным трубкам и с помощью магнитов направляются на покрытый фосфоресцирующим составом экран, высвечивая на нем изображение.
Что служит топливом для топлива?
Чтобы сблизить атомы, нужно приложить действительно большие усилия. И чем сильнее вы их сближаете, тем это труднее. Если с достаточной силой сжать пар, можно получить воду. Если сжимать ее дальше, то можно получить лед. Если точно так же постепенно сжимать необозримое множество атомов углерода, водорода и кислорода, то в конце концов можно получить необходимые нам нефть, каменный или древесный уголь. Заключенная в этом топливе энергия, которую вы высвобождаете, когда сжигаете эти субстанции, является как раз той самой энергией, которая пошла на сближение в них атомов для создания молекул углеводорода. Изготавливать это топливо своими руками бессмысленно: нам вернулось бы ровно столько энергии, сколько мы в него вложили. К счастью, топливо для нас создает природа: энергия Солнца, естественных сжатий и естественного тепла внутри Земли. Так что мы получаем энергию от природы, не прикладывая усилий к ее производству.
То, что верно для молекул, верно и для атомов. Теоретически вы можете создать атом, объединив в пространстве его составляющие (протоны, нейтроны и электроны). Для этого потребуется гигантское количество энергии, но вы сможете получить ее обратно. Этот процесс мы называем ядерным синтезом (здесь атомы создаются из своих составных частей). Аналогичным образом, только разделив атомы, вы можете добиться высвобождения колоссального объема энергии. Никто не подозревал ни о чем подобном до начала XX века. Первый ключ к разгадке этой великой тайны природы подобрал Альберт Эйнштейн, когда в 1905 году сформулировал свое бессмертное уравнение Е = mc?. Скорость света – это огромное число (300 000 000, а точнее 299 792 458 м/с), а скорость света в квадрате и вовсе невообразима (90 000 000 000 000 000 м?/c?). Так что даже небольшая масса (m) создаст гигантское количество энергии (Е). Всё это звучит достаточно сухо и абстрактно до тех пор, пока вы не вспомните эффект, произведенный первым высвобождением ядерной энергии. Две относительно небольшие (около 3 м в длину) атомные бомбы в 1945 году стерли с лица земли города Хиросиму и Нагасаки. Такой вариант высвобождения атомной энергии называется расщеплением ядра (при этом происходит деление атома). Через 50 лет после тех трагических событий многие из нас используют электроэнергию, которую вырабатывают электростанции путем разделения атомов. Разве это не удивительно!
Две относительно небольшие (около 3 м в длину) атомные бомбы в 1945 году стерли с лица земли города Хиросиму и Нагасаки. Такой вариант высвобождения атомной энергии называется расщеплением ядра (при этом происходит деление атома). Через 50 лет после тех трагических событий многие из нас используют электроэнергию, которую вырабатывают электростанции путем разделения атомов. Разве это не удивительно!
Сколько нужно атомов, чтобы зажечь электрическую лампочку?
Представьте себе, что мы берем 1 г урана (сверхтяжелый элемент, который используется в качестве топлива в АЭС) и разделяем все его атомы, чтобы получить энергию. Если бы мы делали это каждую секунду, то в результате ежесекундно получали бы 100 ГВт мощности. Сегодня крупная АЭС имеет мощность порядка 2 ГВт. Таким образом, 1 г урана дает нам мощность примерно 50 АЭС[93].
Причина в том, что на практике атомные электростанции используют немного уранового топлива, причем медленно. С другой стороны, чтобы зажечь 10-ваттную лампочку, необходимо ежесекундно разделять 300 млрд атомов урана.
С другой стороны, чтобы зажечь 10-ваттную лампочку, необходимо ежесекундно разделять 300 млрд атомов урана.
Огромные числа. Но ничего удивительного. Атомы, как мы всегда знали, представляют собой исключительно микроскопические объекты природы.
Как выглядят атомы?
спросил
Изменено
6 лет, 4 месяца назад
Просмотрено
2к раз
$\begingroup$
Мой профессор заметил, что, когда он учился в школе, микроскопы были недостаточно мощными, чтобы разрешать некоторые вещи (я забыл, что это было). Но современные микроскопы достаточно мощные.
Экстраполируя эту тенденцию, он предположил, что к тому времени, когда мы достигнем его возраста, мы сможем видеть атомы.
Подождите. Видишь атомы? Ожидаем ли мы увидеть дискретные маленькие точки для электронов (я так не думаю)? Что именно мы можем ожидать «увидеть», если вообще что-нибудь?
$\endgroup$
2
$\begingroup$
Да, мы определенно можем видеть атомы в современных микроскопах. Я постараюсь не углубляться в тему «видения», но отмечу, что большинство людей говорят, что видят, когда используют глаза для наблюдения за объектами. То есть они используют оптическую систему (глаз), состоящую из линзы и детектора (сетчатки), и некоторую обработку изображения, осуществляемую компьютером (мозг). Таким образом, любой инструмент, использующий какой-либо детектор и компьютер для преобразования сигналов этого детектора в изображение, на которое нам удобно смотреть, я квалифицирую как «видение в микроскоп». Если вас это устраивает, читайте дальше.
Если вас это устраивает, читайте дальше.
Мой любимый микроскоп, способный видеть атомы, — это просвечивающий электронный микроскоп (ПЭМ). Используя высококачественный ПЭМ, мы можем легко различать объекты размером около ангстрема, то есть расстояния между атомами. Чтобы получить изображение одного атома, вам также необходимо иметь образец толщиной всего в один атом в какой-то момент. Это сложно выполнить, но можно сделать. Сегодня изображения графена, пожалуй, являются лучшими изображениями ПЭМ «одного атома». Основная статья находится здесь (платный доступ). Вы также можете поискать в Интернете графеновые изображения, подобные этому.
В приведенных выше ссылках изображения показывают форму атомов в виде маленьких пятен, и в значительной степени пятна являются скорее описанием способности микроскопа фокусироваться, чем формой самого атома. Однако атомно-силовой микроскоп (АСМ) превосходно видит электроны на поверхности атома. С помощью АСМ исследователи могут даже визуализировать химические связи молекул, находящихся на подложке. В этом случае на изображении связи показаны как стержни, а центры атомов на самом деле не видны. Учебники по химии часто показывают «формы» атомов, рисуя орбитали электронов, так что в некотором смысле эти стержни также являются формами этих атомов.
В этом случае на изображении связи показаны как стержни, а центры атомов на самом деле не видны. Учебники по химии часто показывают «формы» атомов, рисуя орбитали электронов, так что в некотором смысле эти стержни также являются формами этих атомов.
Это просто указывает на то, что «форма» атомов — нетривиальная тема, которая очень зависит от того, как вы на них смотрите.
$\endgroup$
$\begingroup$
Мы не можем «увидеть» отдельные атомы с помощью света. Длина волны видимого света слишком велика, чтобы можно было разделить отдельные атомы, но это не значит, что мы не можем обнаружить отдельных атомов, используя различные методы.
Рентгеновские лучи и пучки электронов имеют длину волны, подходящую для обнаружения атомов, и некоторые микроскопы, основанные на том и другом, могут создавать изображения, разрешающие показывать положение атомов. Трансмиссионные электронные микроскопы могут при определенных обстоятельствах «видеть» отдельные атомы.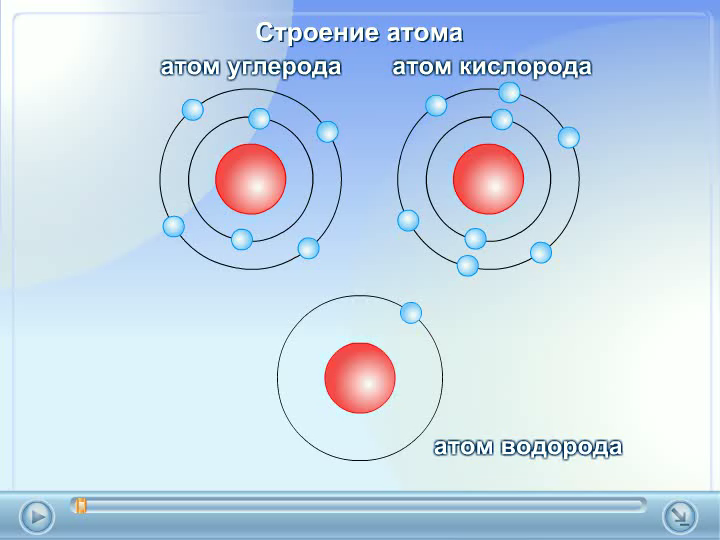 Что еще более важно, структура кристаллов может быть решена путем интерпретации дифракции рентгеновских лучей от кристаллической решетки, что обеспечивает подробный анализ трехмерной структуры кристаллов. Это почти рутинный способ определения структуры таких сложных молекул, как белки. В некотором смысле это «видение» атомов (точнее, определение плотности электронов). Но это очень косвенный способ «видеть», и, строго говоря, вы обнаруживаете, используя большое количество атомов, а не по одному за раз.
Что еще более важно, структура кристаллов может быть решена путем интерпретации дифракции рентгеновских лучей от кристаллической решетки, что обеспечивает подробный анализ трехмерной структуры кристаллов. Это почти рутинный способ определения структуры таких сложных молекул, как белки. В некотором смысле это «видение» атомов (точнее, определение плотности электронов). Но это очень косвенный способ «видеть», и, строго говоря, вы обнаруживаете, используя большое количество атомов, а не по одному за раз.
Существуют современные методы, позволяющие обнаруживать отдельных атомов и даже манипулировать ими. Они основаны на использовании очень маленьких игл с наконечниками размером с атом. Атомно-силовая микроскопия или сканирующая туннельная микроскопия и другие варианты могут использовать контролируемое движение этих тонких игл для измерения силы взаимодействия между атомами на кончике иглы и молекулами или атомами на поверхности. Итак, то, что вы «видите», — это атомные силы, создаваемые электронными облаками в отдельных атомах, когда они взаимодействуют с чем-то еще, что также имеет размер атома.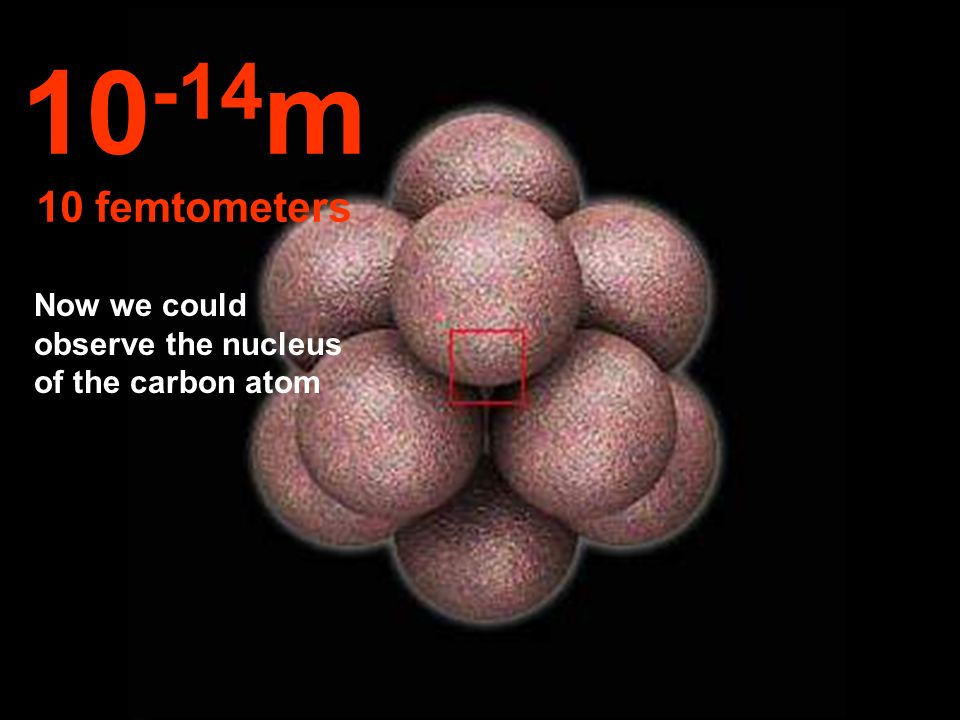
Например, на этом изображении показан лист графена:
И это изображение показывает одну молекулу пентацена (с моделью структуры, показанной под реальным изображением):
Существует даже забавный анимационный видеоролик от IBM (который изобрел метод атомно-силовой микроскопии), показывающий историю сказал, манипулируя положением молекул монооксида углерода на поверхности.
Эти методы даже использовались для понимания механизмов реакции путем наблюдения за тем, что происходит с отдельными молекулами.
Итак, мы можем «видеть» молекулы на атомах, используя устройства, которые могут очень точно измерять атомные силы. В этом смысле мы можем увидеть, как они «выглядят», по крайней мере, с точки зрения других взаимодействующих с ними атомов.
$\endgroup$
$\begingroup$
Поскольку ядро скрыто внутри гораздо большего электронного облака, форма атома — это форма его орбиталей; трехмерный образец связей в кристаллах и т. д. Итак, если бы мы могли каким-то образом увидеть атом без использования света, атом «выглядел бы» как его электронная волновая функция, окружающая его стоячая волна вероятности.
д. Итак, если бы мы могли каким-то образом увидеть атом без использования света, атом «выглядел бы» как его электронная волновая функция, окружающая его стоячая волна вероятности.
Волновая функция H-орбиталей: двумерный график вероятностей
Галерея орбиталей: трехмерная, твердая и блестящая версия!
Если я правильно понимаю, оси волновой функции отдельного атома в пространстве имеют неопределенное направление. Поэтому, если мы каким-то образом не прощупаем атом и не «схлопнем» его ориентацию, приведенные выше волновые функции должны рассматриваться как размытые сферически.
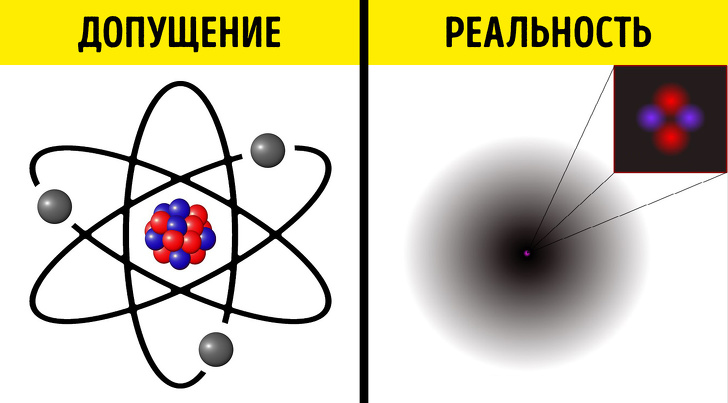
С другой стороны, все в 1950-х годах знали, что атомы выглядят вот так.
Распространенный образ «солнечной системы с тремя планетами» глубоко укоренился в американской поп-культуре. Это неправильно и должно быть заменено различными графиками двумерных волновых функций, но попробуйте убедить публику! Хех, а еще радиоволны не исходят из оконечностей радиовышек. И у падающих капель дождя нет острых концов. Вместо этого они сферы!
И у падающих капель дождя нет острых концов. Вместо этого они сферы!
🙂
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Можем ли мы увидеть атомы? — Как работают атомы
Атомы настолько малы, что мы не можем видеть их глазами (т.е. микроскопическими). Чтобы дать вам представление о некоторых размерах, вот приблизительные диаметры различных атомов и частиц:
- Atom = 1 x 10 -10 метров
- ядро = 1 x 10 -15 до 1 x 10 -14 метры
- нейтронный или протон = 1 x 10 -15
666666666666666666666666666666666666666666666666666 3
. — точно не известно, но считается, что порядка 1 x 10 -18 метров
Вы не можете увидеть атом в световой микроскоп. Однако в 1981 году был разработан тип микроскопа, названный сканирующим туннельным микроскопом (СТМ) . СТМ состоит из следующего:
Реклама
- Очень маленький острый наконечник, проводящий электричество ( зонд )
- Быстрое пьезоэлектрическое сканирующее устройство, к которому прикреплен наконечник
- Электронные компоненты для подачи тока на наконечник, управления сканером и приема сигналы от датчика движения
- Компьютер для управления системой и анализа данных (сбор данных, обработка, отображение)
СТМ работает следующим образом: перемещает иглу по поверхности проводящего образца.
Процесс очень похож на старый фонограф, где игла — это кончик, а канавки на виниловой пластинке — это атомы. Игла СТМ перемещается по атомарному контуру поверхности, используя туннельный ток как чувствительный детектор положения атома.
СТМ и новые модификации этого микроскопа позволяют нам видеть атомы. Кроме того, СТМ можно использовать для манипулирования атомами, как показано здесь:
«»
Атомы можно размещать на поверхности с помощью наконечника СТМ, создавая на поверхности пользовательский узор.
Фото предоставлено NIST Источник фото: IBM Almaden Research Labs
Атомы можно перемещать и формовать для создания различных устройств, таких как молекулярные двигатели (подробности см. в разделе «Как будут работать нанотехнологии»).
в разделе «Как будут работать нанотехнологии»).
Таким образом, наука 20-го века раскрыла структуру атома. В настоящее время ученые проводят эксперименты, чтобы выявить детали структуры ядра и сил, удерживающих его вместе.
Статьи по теме HowStuffWorks
Другие полезные ссылки
- Семейство атомов: портретный салон Призрака – занятия об атомах для 6–12 классов
- Выставка Американского института физики: Взгляд внутрь атома
- Все об атомах
- Анатомия атома
- Путешествие в атом — узнайте о физике атома и элементарных частиц
- Выставка Американского института физики: открытие электрона
- Физическая структура: структура атома
- Физическая структура: главное меню
Химия
- Биологический проект: Учебное пособие по химии: основы химии для понимания биологии
Периодическая таблица
- Chemical Elements.com: онлайн, интерактивная Периодическая таблица элементов
- Периодическая таблица в картинках
Орбитали
- Учебное пособие по орбитам — мультимедиа ударно-волновая анимация
Модели атомов
- Physics 2000: Quantum Atom Tutorial — отличные демонстрации апплетов Java; используйте оглавление, чтобы увидеть элементы в виде атомов и Периодической таблицы
Квантовая теория
- Квантовая теория
- Общая химия в Интернете: Квантовая теория
Сканирующая туннельная микроскопия
- Атомно-силовая микроскопия
- IBM: Сканирующая туннельная микроскопия
- Изображения сканирующего туннельного микроскопа
- Сканирующий туннельный микроскоп – что это такое и как он работает
Процитируйте это!
Пожалуйста, скопируйте/вставьте следующий текст, чтобы правильно цитировать эту статью HowStuffWorks.