Содержание
Прехирургическое картирование речевых зон коры головного мозга с помощью фМРТ: актуальное состояние и тенденции | Печенкова
1. Fedorenko E., Kanwisher N. Neuroimaging of Language: Why Hasn’t a Clearer Picture Emerged? Language and Linguistics Compass. 2009; 3 (4): 839–865. https://doi.org/10.1111/j.1749-818X.2009.00143.x
2. Ojemann G. A. Individual variability in cortical localization of language. J. Neurosurg. 1979; 50 (2): 164–169. https://doi.org/10.3171/jns.1979.50.2.0164
3. Ding J. R., Zhu F., Hua B. et al. Presurgical localization and spatial shift of resting state networks in patients with brain metastases. Brain Imaging Behav. 2019; 13 (2): 408–420. https://doi.org/10.1007/s11682-018-9864-6
4. Szelenyi A., Bello L., Duffau H. et al. Intraoperative electrical stimulation in awake craniotomy: methodological aspects of current practice. Neurosurg. Focus. 2010; 28 (2): E7. https://doi.org/10.3171/2009.12.FOCUS09237
5. Dragoy O., Chrabaszcz A., Tolkacheva V. , Buklina S. Russian Intraoperative Naming Test: a Standardized Tool to Map Noun and Verb Production during Awake Neurosurgeries. The Russian Journal of Cognitive Science. 2016; 3 (4): 4–25
, Buklina S. Russian Intraoperative Naming Test: a Standardized Tool to Map Noun and Verb Production during Awake Neurosurgeries. The Russian Journal of Cognitive Science. 2016; 3 (4): 4–25
6. Ritaccio A. L., Brunner P., Schalk G. Electrical Stimulation Mapping of the Brain: Basic Principles and Emerging Alternatives. J. Clin. Neurophysiol. 2018; 35 (2): 86–97. https://doi.org/10.1097/WNP.0000000000000440
7. Szelenyi A., Senft C., Jardan M. et al. Intra-operative subcortical electrical stimulation: a comparison of two methods. Clin. Neurophysiol. 2011; 122 (7): 1470–1475. https://doi.org/10.1016/j.clinph.2010.12.055
8. Tate M.C., Guo L., McEvoy J., Chang E.F. Safety and efficacy of motor mapping utilizing short pulse train direct cortical stimulation. Stereotact Funct. Neurosurg. 2013; 91 (6): 379–385. https://doi.org/10.1159/000350020
9. Riva M., Fava E., Gallucci M. et al. Monopolar highfrequency language mapping: can it help in the surgical management of gliomas? A comparative clinical study. J. Neurosurg. 2016; 124 (5): 1479–1489. https://doi.org/10.3171/2015.4.JNS14333
J. Neurosurg. 2016; 124 (5): 1479–1489. https://doi.org/10.3171/2015.4.JNS14333
10. Verst S.M., de Aguiar P.H.P., Joaquim M.A.S. et al. Monopolar 250-500Hz language mapping: Results of 41 patients. Clin. Neurophysiol. Pract. 2019; 4: 1–8. https://doi.org/10.1016/j.cnp.2018.11.002
11. Kim P.E., Singh M. Functional magnetic resonance imaging for brain mapping in neurosurgery. Neurosurg. Focus. 2003; 15 (1): E1. https://doi.org/10.3171/foc.2003.15.1.1
12. Papanicolaou A.C., Wheless J.W., Babajani-Feremi A. et al. Letter re: Practice guideline summary: Use of fMRI in the presurgical evaluation of patients with epilepsy: Report of the Guideline Development, Dissemination, and Implemen tation Subcommittee of the American Academy of Neurology. Neurology. 2017; 89 (6): 640. https://doi.org/10.1212/WNL.0000000000004204
13. Бакулин И.С., Пойдашева А.Г., Медынцев А.А., Супонева Н.А., Пирадов М.А. Транскраниальная магнитная стимуляция в когнитивной нейронауке: методологические основы и безопасность. Российский журнал когнитивной науки. 2020; 7 (3): 25–44. https://doi.org/10.47010/20.3.2
Российский журнал когнитивной науки. 2020; 7 (3): 25–44. https://doi.org/10.47010/20.3.2
14. Bowyer S.M., Zillgitt A., Greenwald M., Lajiness-O’Neill R. Language Mapping With Magnetoencephalography: An Update on the Current State of Clinical Research and Practice With Considerations for Clinical Practice Guidelines. J. Clin. Neurophysiol. 2020; 37 (6): 554–563. https://doi.org/10.1097/WNP.0000000000000489
15. Grummich P., Nimsky C., Pauli E. et al. Combining fMRI and MEG increases the reliability of presurgical language localization: a clinical study on the difference between and congruence of both modalities. Neuroimage. 2006; 32 (4): 1793–803. https://doi.org/10.1016/j.neuroimage.2006.05.034
16. Najib U., Bashir S., Edwards D., Rotenberg A., PascualLeone A. Transcranial brain stimulation: clinical applications and future directions. Neurosurg. Clin. N. Am. 2011; 22 (2): 233–251, ix. https://doi.org/10.1016/j.nec.2011.01.002
17. Papanicolaou A.C., Rezaie R., Narayana S. et al. Is it time to replace the Wada test and put awake craniotomy to sleep? Epilepsia. 2014; 55 (5): 629–632. https://doi.org/10.1111/epi.12569
et al. Is it time to replace the Wada test and put awake craniotomy to sleep? Epilepsia. 2014; 55 (5): 629–632. https://doi.org/10.1111/epi.12569
18. Benjamin C.F.A., Li A.X., Blumenfeld H. et al. Presurgical language fMRI: Clinical practices and patient outcomes in epilepsy surgical planning. Hum. Brain Mapp. 2018; 39 (7): 2777–2785. https://doi.org/10.1002/hbm.24039
19. Кремнева Е.И., Коновалов Р.Н., Кротенкова М.В. Функциональная магнитно-резонансная томография. Анналы клинической и экспериментальной неврологии. 2011; 5 (1): 30–34
20. Терновой С.К., Синицын В.Е., Морозов С.П. Применение функциональной магнитно-резонансной томографии в нейрохирургии опухолей головного мозга. Медицинская визуализация. 2002; (2): 5–10
21. Власова Р.М., Печенкова Е.В., Синицын В.Е., Степанян М.А. Сочетание функциональной магнитнорезонансной томографии и нейропсихологического обследования при предоперационной диагностике в нейрохирургии опухолей головного мозга. Кубанский научный медицинский вестник. 2010; (6): 38–43
2010; (6): 38–43
22. Токарев А.С., Степанов В.Н., Шатохина Ю.И., Чувилин С.А., Шалумов А.З. Применение функциональной магнитно-резонансной томографии головного мозга в нейрохирургии. Нейрохирургия. 2017; 2: 3–10.
23. Дмитриев А. Ю., Дашьян В. Г. Флуоресцеин натрия и индоцианин зеленый в нейроонкологии и хирургии артериовенозных мальформаций головного мозга. Обзор литературы. Вестник неврологии, психиатрии и нейрохирургии. 2021; (8): 614–627. https://doi.org/10.33920/med-01-2108-04
24. Geschwind N. Language and the brain. Sci. Am. 1972; 226 (4): 76–83. https://doi.org/10.1038scientificamerican0472-76
25. Anderson J.M., Gilmore R., Roper S. et al. Conduction aphasia and the arcuate fasciculus: A reexamination of the Wernicke-Geschwind model. Brain Lang. 1999; 70 (1): 1–12. https://doi.org/10.1006/brln.1999.2135
26. Catani M., Jones D.K., Ffytche D.H. Perisylvian language networks of the human brain. Ann Neurol. 2005; 57 (1): 8–16. https://doi.org/10.1002/ana. 20319
20319
27. Tremblay P., Dick A.S. Broca and Wernicke are dead, or moving past the classic model of language neurobiology. Brain Lang. 2016; 162: 60–71. https://doi.org/10.1016/j.bandl.2016.08.004
28. Mazoyer B., Zago L., Jobard G. et al. Gaussian mixture modeling of hemispheric lateralization for language in a large sample of healthy individuals balanced for handedness. PLoS One. 2014; 9 (6): e101165. https://doi.org/10.1371/journal.pone.0101165
29. Kundu B., Rolston J.D., Grandhi R. Mapping language dominance through the lens of the Wada test. Neurosurg. Focus. 2019; 47 (3): E5. https://doi.org/10.3171/2019.6.FOCUS19346
30. Partovi S., Jacobi B., Rapps N. et al. Clinical standardized fMRI reveals altered language lateralization in patients with brain tumor. Am. J. Neuroradiol. 2012; 33 (11): 2151–2157. https://doi.org/10.3174/ajnr.A3137
31. Li Q., Dong J.W., Del Ferraro G. et al. Functional Translocation of Broca’s Area in a Low-Grade Left Frontal Glioma: Graph Theory Reveals the Novel, Adaptive Network Connectivity. Front Neurol. 2019; 10: 702. https://doi.org/10.3389/fneur.2019.00702
Front Neurol. 2019; 10: 702. https://doi.org/10.3389/fneur.2019.00702
32. Kuchukhidze G., Siedentopf C., Unterberger I. et al. Language Dominance in Patients With Malformations of Cortical Development and Epilepsy. Front Neurol. 2019; 10: 1209. https://doi.org/10.3389/fneur.2019.01209
33. Hickok G., Poeppel D. The cortical organization of speech processing. Nat. Rev. Neurosci. 2007; 8 (5): 393–402. https://doi.org/10.1038/nrn2113
34. Yuan D., Luo D., Kwok V.P.Y. et al. Myeloarchitectonic Asymmetries of Language Regions in the Human Brain. Cereb. Cortex. 2021; 31 (9): 4169–4179. https://doi.org/10.1093/cercor/bhab076
35. Bradshaw A.R., Bishop D.V.M., Woodhead Z.V.J. Methodological considerations in assessment of language lateralisation with fMRI: a systematic review. Peer J. 2017; 5: e3557. https://doi.org/10.7717/peerj.3557
36. Tailby C., Abbott D.F., Jackson G.D. The diminishing dominance of the dominant hemisphere: Language fMRI in focal epilepsy. Neuroimage Clin. 2017; 14: 141–150. https://doi.org/10.1016/j.nicl.2017.01.011
2017; 14: 141–150. https://doi.org/10.1016/j.nicl.2017.01.011
37. Polczynska M., Japardi K., Curtiss S. et al. Improving language mapping in clinical fMRI through assessment of grammar. Neuroimage Clin. 2017; 15: 415–427. https://doi.org/10.1016/j.nicl.2017.05.021
38. Walenski M., Europa E., Caplan D., Thompson C.K. Neural networks for sentence comprehension and production: An ALE-based meta-analysis of neuroimaging studies. Hum. Brain Mapp. 2019; 40 (8): 2275–2304. https://doi.org/10.1002/hbm.24523
39. Middlebrooks E.H., Yagmurlu K., Szaflarski J.P. et al. A contemporary framework of language processing in the human brain in the context of preoperative and intraoperative language mapping. Neuroradiology. 2017; 59 (1): 69–87. https://doi.org/10.1007/s00234-016-1772-0
40. Benjamin C.F., Walshaw P.D., Hale K. et al. Presurgical language fMRI: Mapping of six critical regions. Hum. Brain Mapp. 2017; 38 (8): 4239–4255. https://doi.org/10.1002/hbm.23661
41. Lopez-Barroso D. , Catani M., Ripolles P. et al. Word learning is mediated by the left arcuate fasciculus. Proc. Natl. Acad. Sci U S A. 2013; 110 (32): 13168–13173. https://doi.org/10.1073/pnas.1301696110
, Catani M., Ripolles P. et al. Word learning is mediated by the left arcuate fasciculus. Proc. Natl. Acad. Sci U S A. 2013; 110 (32): 13168–13173. https://doi.org/10.1073/pnas.1301696110
42. Hickok G., Poeppel D. Neural Basis of Speech Perception. In: Neurobiology of Language / G. Hickok, S.L. Small (eds). Elsevier, 2016: 299–310.
43. Hickok G. The cortical organization of speech processing: feedback control and predictive coding the context of a dual-stream model. J. Commun. Disord. 2012; 45 (6): 393–402. https://doi.org/10.1016/j.jcomdis.2012.06.004
44. Duffau H., Moritz-Gasser S., Mandonnet E. A re-examination of neural basis of language processing: proposal of a dynamic hodotopical model from data provided by brain stimulation mapping during picture naming. Brain Lang. 2014; 131: 1–10. https://doi.org/10.1016/j.bandl.2013.05.011
45. Ахутина Т.В. Модель порождения речи Леонтьева– Рябовой: 1967–2005. В кн.: Психология, лингвистика и междисциплинарные связи / Под ред. Т.В. Ахутиной, Д.А. Леонтьева. М.: Смысл, 2008: 79–104.
Т.В. Ахутиной, Д.А. Леонтьева. М.: Смысл, 2008: 79–104.
46. Alemi R., Batouli S.A.H., Behzad E. et al. Not single brain areas but a network is involved in language: Applications in presurgical planning. Clin. Neurol. Neurosurg. 2018; 165: 116–128. https://doi.org/10.1016/j.clineuro.2018.01.009
47. Unadkat P., Fumagalli L., Rigolo L. et al. Functional MRI Task Comparison for Language Mapping in Neurosurgical Patients. J. Neuroimaging. 2019; 29 (3): 348–356. https://doi.org/10.1111/jon.12597
48. Barnett A., Marty-Dugas J., McAndrews M.P. Advantages of sentence-level fMRI language tasks in presurgical language mapping for temporal lobe epilepsy. Epilepsy Behav. 2014; 32: 114–120. https://doi.org/10.1016/j.yebeh.2014.01.010
49. Genetti M., Tyrand R., Grouiller F. et al. Comparison of high gamma electro corticography and fMRI with electrocortical stimulation for localization of somatosensory and language cortex. Clin. Neurophysiol. 2015; 126 (1): 121–130. https://doi. org/10.1016/j.clinph.2014.04.007
org/10.1016/j.clinph.2014.04.007
50. Babajani-Feremi A., Narayana S., Rezaie R. et al. Language mapping using high gamma electro corticography, fMRI, and TMS versus electrocortical stimulation. Clin. Neurophysiol. 2016; 127 (3): 1822–1836. https://doi.org/10.1016/j.clinph.2015.11.017
51. Weng H.H., Noll K.R., Johnson J.M. et al. Accuracy of Presurgical Functional MR Imaging for Language Mapping of Brain Tumors: A Systematic Review and Meta-Analysis. Radiology. 2018; 286 (2): 512–523. https://doi.org/10.1148/radiol.2017162971
52. Kundu B., Penwarden A., Wood J.M. et al. Association of functional magnetic resonance imaging indices with postoperative language outcomes in patients with primary brain tumors. Neurosurg. Focus. 2013; 34 (4): E6. https://doi.org/10.3171/2013.2.FOCUS12413
53. Mellerio C., Charron S., Lion S. et al. Perioperative functional neuroimaging of gliomas in eloquent brain areas. Neurochirurgie. 2017; 63 (3): 129–134. https://doi.org/10.1016/j.neuchi. 2016.10.012
2016.10.012
54. Polczynska M.M. Organizing Variables Affecting fMRI Estimates of Language Dominance in Patients with Brain Tumors. Brain Sci. 2021; 11 (6). https://doi.org/10.3390/brainsci11060694
55. FitzGerald D.B., Cosgrove G.R., Ronner S. et al. Location of Language in the Cortex: A Comparison between Functional MR Imaging and Electrocortical Stimulation. Am. J. Neuroradiol. 1997; 18 (8): 1529–1539.
56. Roux F.E., Boulanouar K., Lotterie J.A. et al. Language functional magnetic resonance imaging in preoperative assessment of language areas: correlation with direct cortical stimulation. Neurosurgery. 2003; 52 (6): 1335– 1345; discussion 1345–1347. https://doi.org/10.1227/01.neu.0000064803.05077.40
57. Austermuehle A., Cocjin J., Reynolds R. et al. Language functional MRI and direct cortical stimulation in epilepsy preoperative planning. Ann. Neurol. 2017; 81 (4): 526– 537. https://doi.org/10.1002/ana.24899
58. Bizzi A., Blasi V., Falini A. et al. Presurgical functional MR imaging of language and motor functions: validation with intraoperative electrocortical mapping. Radiology. 2008; 248 (2): 579–589. https://doi.org/10.1148/radiol.2482071214
Radiology. 2008; 248 (2): 579–589. https://doi.org/10.1148/radiol.2482071214
59. Lu J.F., Zhang H., Wu J.S. et al. “Awake” intraoperative functional MRI (ai-fMRI) for mapping the eloquent cortex: Is it possible in awake craniotomy? Neuroimage Clin. 2012; 2: 132–142. https://doi.org/10.1016/j.nicl.2012.12.002
60. Nadkarni T.N., Andreoli M.J., Nair V.A. et al. Usage of fMRI for pre-surgical planning in brain tumor and vascular lesion patients: task and statistical threshold effects on language lateralization. Neuroimage Clin. 2015; 7: 415–423. https://doi.org/10.1016/j.nicl.2014.12.014
61. Auer T., Schweizer R., Frahm J. An iterative two-threshold analysis for single-subject functional MRI of the human brain. Eur. Radiol. 2011; 21 (11): 2369–2387. https://doi.org/10.1007/s00330-011-2184-5
62. Mendez Orellana C., Visch-Brink E., Vernooij M. et al. Crossed cerebrocerebellar language lateralization: an additional diagnostic feature for assessing atypical language representation in presurgical functional MR imaging. Am. J. Neuroradiol. 2015; 36 (3): 518–524. https://doi.org/10.3174/ajnr.A4147
Am. J. Neuroradiol. 2015; 36 (3): 518–524. https://doi.org/10.3174/ajnr.A4147
63. Loddenkemper T., Morris H.H., Moddel G. Complications during the Wada test. Epilepsy Behav. 2008; 13 (3): 551–553. https://doi.org/10.1016/j.yebeh.2008.05.014
64. Dym R.J., Burns J., Freeman K., Lipton M.L. Is functional MR imaging assessment of hemispheric language dominance as good as the Wada test?: a meta-analysis. Radiology. 2011; 261 (2): 446–455. https://doi.org/10.1148/radiol.11101344
65. Wang A., Peters T.M., de Ribaupierre S., Mirsattari S.M. Functional magnetic resonance imaging for language mapping in temporal lobe epilepsy. Epilepsy Res. Treat. 2012; 2012: 198183. https://doi.org/10.1155/2012/198183
66. Bauer P.R., Reitsma J.B., Houweling B.M. et al. Can fMRI safely replace the Wada test for preoperative assessment of language lateralisation? A meta-analysis and systematic review. J. Neurol. Neurosurg. Psychiatry. 2014; 85 (5): 581–588. https://doi.org/10.1136/jnnp-2013-305659
67. Janecek J.K., Swanson S.J., Sabsevitz D.S. et al. Language lateralization by fMRI and Wada testing in 229 patients with epilepsy: rates and predictors of discordance. Epilepsia. 2013; 54 (2): 314–322. https://doi.org/10.1111/epi.12068
Janecek J.K., Swanson S.J., Sabsevitz D.S. et al. Language lateralization by fMRI and Wada testing in 229 patients with epilepsy: rates and predictors of discordance. Epilepsia. 2013; 54 (2): 314–322. https://doi.org/10.1111/epi.12068
68. Szaflarski J.P., Gloss D., Binder J.R. et al. Practice guideline summary: Use of fMRI in the presurgical evaluation of patients with epilepsy: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology. 2017; 88 (4): 395–402. https://doi.org/10.1212/WNL.0000000000003532
69. Sanjuan A., Forn C., Ventura-Campos N. et al. The sentence verification task: a reliable fMRI protocol for mapping receptive language in individual subjects. Eur. Radiol. 2010; 20 (10): 2432–2438. https://doi.org/10.1007/s00330-010-1814-7
70. Sanjuan A., Bustamante J.C., Forn C. et al. Comparison of two fMRI tasks for the evaluation of the expressive language function. Neuroradiology. 2010; 52 (5): 407– 415. https://doi.org/10.1007/s00234-010-0667-8
https://doi.org/10.1007/s00234-010-0667-8
71. de Guibert C., Maumet C., Ferre J.C. et al. FMRI language mapping in children: a panel of language tasks using visual and auditory stimulation without reading or metalinguistic requirements. Neuroimage. 2010; 51 (2): 897–909. https://doi.org/10.1016/j.neuroimage.2010.02.054
72. Mahdavi A., Houshmand S., Oghabian M.A. et al. Developing optimized fMRI protocol for clinical use: comparison of different language paradigms. J. Magn. Reson. Imaging. 2011; 34 (2): 413–419. https://doi.org/10.1002/jmri.22604
73. Zaca D., Nickerson J.P., Deib G., Pillai J.J. Effectiveness of four different clinical fMRI paradigms for preoperative regional determination of language lateralization in patients with brain tumors. Neuroradiology. 2012; 54 (9): 1015–1025. https://doi.org/10.1007/s00234-012-1056-2
74. Chang Y.A., Javadi S.S., Bahrami N. et al. Mapping lexicalsemantic networks and determining hemispheric language dominance: Do task design, sex, age, and language performance make a difference? Brain Lang. 2018; 179: 42–50. https://doi.org/10.1016/j.bandl.2018.02.005
2018; 179: 42–50. https://doi.org/10.1016/j.bandl.2018.02.005
75. Mohtasib R.S., Alghamdi J.S., Baz S.M. et al. Developing fMRI protocol for clinical use. Comparison of 6 Arabic paradigms for brain language mapping in native Arabic speakers. Neurosciences (Riyadh). 2021; 26 (1): 45–55. https://doi.org/10.17712/nsj.2021.1.20200012
76. Black D.F., Vachha B., Mian A. et al. American Society of Functional Neuroradiology-Recommended fMRI Paradigm Algorithms for Presurgical Language Assessment. Am. J. Neuroradiol. 2017; 38 (10): E65–E73. https://doi.org/10.3174/ajnr.A5345
77. Omisade A., O’Grady C.B., Schmidt M.H., Fisk J.D. Visual and Auditory fMRI Paradigms for Presurgical Language Mapping: Convergent Validity and Relationship to Individual Variables. Neurol. Res. Int. 2019; 2019: 6728120. https://doi.org/10.1155/2019/6728120
78. Ramsey N.F., Sommer I.E., Rutten G.J., Kahn R.S. Combined analysis of language tasks in fMRI improves assessment of hemispheric dominance for language functions in individual subjects. Neuroimage. 2001; 13 (4): 719–733. https://doi.org/10.1006/nimg.2000.0722
Neuroimage. 2001; 13 (4): 719–733. https://doi.org/10.1006/nimg.2000.0722
79. Литвинова Л.Д., Печенкова Е.В., Власова Р.М., Березуцкая Ю.Н., Синицын В.Е. Локализация зон, связанных с восприятием речи: сопоставление трех проб для фМРТ на материале русского языка. Международный симпозиум по нейроимиджингу: фундаментальные исследования и клиническая практика. М.: МГППУ, 2012: 76–79.
80. Rumshiskaya A.D., Vlasova R., Litvinova L. et al. Combined analysis of two tasks improves localization of Wernicke’s area in patients with primary brain tumors. European Congress of Radiology (ECR). Vienna, Austria, 2014. https://doi.org/10.1594/ecr2014/C-1232
81. Bradshaw A.R., Thompson P.A., Wilson A.C. et al. Measuring language lateralisation with different language tasks: a systematic review. PeerJ. 2017; 5: e3929. https://doi.org/10.7717/peerj.3929
82. Partovi S., Konrad F., Karimi S. et al. Effects of covert and overt paradigms in clinical language fMRI. Acad. Radiol. 2012; 19 (5): 518–525. https://doi.org/10.1016/j.acra.2011.12.017
https://doi.org/10.1016/j.acra.2011.12.017
83. Croft L.J., Rankin P.M., Liegeois F. et al. To speak, or not to speak? The feasibility of imaging overt speech in children with epilepsy. Epilepsy Res. 2013; 107 (1–2): 195–199. https://doi.org/10.1016/j.eplepsyres.2013.08.008
84. Wilson S.M., Bautista A., Yen M. et al. Validity and reliability of four language mapping paradigms. Neuroimage Clin. 2017; 16: 399–408. https://doi.org/10.1016/j.nicl.2016.03.015
85. Berro D.H., Lemee J.M., Leiber L.M. et al. Overt speech feasibility using continuous functional magnetic resonance imaging: Isolation of areas involved in phonology and prosody. J. Neurosci Res. 2020; 98 (12): 2554–2565. https://doi.org/10.1002/jnr.24723
86. Игнатьев Г.А., Власова Р.М., Акинина Ю.С., Завьялова В.В., Ушаков В.Л., Иванова М.В., Драгой О.В. фМРТ-исследование чтения предложений: эффект контрольного условия. Когнитивная наука в Москве: новые исследования. Материалы конференции 16 июня 2015 / Под ред. Е.В. Печенковой, М.В. Фаликман. М.: Буки Веди, ИППиП, 2015: 158–164.
Е.В. Печенковой, М.В. Фаликман. М.: Буки Веди, ИППиП, 2015: 158–164.
87. Price C.J., Devlin J.T., Moore C.J. et al. Meta-analyses of object naming: effect of baseline. Hum. Brain. Mapp. 2005; 25 (1): 7082. https://doi.org/10.1002/hbm.20132
88. Власова Р.М. Мозговые механизмы номинативной функции речи: нейропсихологический и нейровизуализационный подход: Дис. … канд. психол. наук. Московский государственный университет имени М.В. Ломоносова. М., 2013.
89. Karakas S., Baran Z., Ceylan A.O. et al. A comprehen sive neuropsychological mapping battery for functional magnetic resonance imaging. Int. J. Psychophysiol. 2013; 90 (2): 215–234. https://doi.org/10.1016/j.ijpsycho.2013.07.007
90. Thakkar I., Arrano-Carrasco L., Cortes-Rivera B. et al. Alternative language paradigms for functional magnetic resonance imaging as presurgical tools for inducing crossed cerebro-cerebellar language activations in brain tumor patients. Eur. Radiol. 2021. https://doi.org/10.1007/s00330-021-08137-9
91. Mahdavi A., Azar R., Shoar M.H. et al. Functional MRI in clinical practice: Assessment of language and motor for pre-surgical planning. Neuroradiol J. 2015; 28 (5): 468– 473. https://doi.org/10.1177/1971400915609343
Mahdavi A., Azar R., Shoar M.H. et al. Functional MRI in clinical practice: Assessment of language and motor for pre-surgical planning. Neuroradiol J. 2015; 28 (5): 468– 473. https://doi.org/10.1177/1971400915609343
92. Gould L., Mickleborough M.J., Wu A. et al. Presurgical language mapping in epilepsy: Using fMRI of reading to identify functional reorganization in a patient with longstanding temporal lobe epilepsy. Epilepsy Behav. Case Rep. 2016; 5: 6–10. https://doi.org/10.1016/j.ebcr.2015.10.003
93. Tie Y., Rigolo L., Ozdemir Ovalioglu A. et al. New Paradigm for Individual Subject Language Mapping: MovieWatching fMRI. J. Neuroimaging. 2015; 25 (5): 710–720. https://doi.org/10.1111/jon.12251
94. Буклина C.Б., Подопригора А.Е., Пронин И.Н., Болдырева Г.Н., Бондаренко А.А., Пяшина Д.В., Фадеева Л.М., Корниенко В.Н. фМРТ-исследования доминантности полушария по речи у больных с опухолями головного мозга. Международный симпозиум по нейроимиджингу: фундаментальные исследования и клиническая практика. М.: МГППУ, 2012: 52–55.
М.: МГППУ, 2012: 52–55.
95. Vlasova R.M., Sinitsyn V.E., Pechenkova E.V. The Effect of Word Frequency on the Brain Correlates of Object Naming in Russian. The Russian Journal of Cognitive Science. 2015; 2 (1): 24–40
96. Кремнева Е.И., Коновалов Р.Н., Кротенкова М.В., Кадыков А.С., Боголепова И.Н., Белопасова А.В. Картирование речевых структур головного мозга у здоровых людей с помощью функциональной магнитно-резонансной томографии. Лучевая диагностика и терапия. 2012; 2 (3): 65–72
97. Коробкова Л.А., Власова Р.М., Синицын В.Е., Печенкова Е.В. Номинация или артикуляция: фМРТисследование. Когнитивная наука в Москве: новые исследования. Материалы конференции 16 июня 2015 г. / Под ред. Е.В. Печенковой, М.В. Фаликман. М.: Буки Веди, ИППиП, 2015: 190–196.
98. Драгой О.В., Власова Р.М., Козинцева Е.Г., С.А., Акинина Ю.С., Петрушевский А.Г., Федина О.Н., Гутырчик Е.Ф., Иванова М. В. фМРТ-исследование называния действий при афазии. Когнитивная наука в Москве: новые исследования. Материалы конференции 16 июня 2015 г. / Под ред. Е.В. Печенковой, М.В. Фаликман. М.: Буки Веди, ИППиП, 2015: 119–124.
Материалы конференции 16 июня 2015 г. / Под ред. Е.В. Печенковой, М.В. Фаликман. М.: Буки Веди, ИППиП, 2015: 119–124.
99. Власова Р.М., Печенкова Е.В., Ахутина Т.В., Синицын В.Е., Ситников А.Р. Называние действий по картинкам: фМРТ-исследование. Международный симпозиум по нейроимиджингу: фундаментальные исследования и клиническая практика. М.: МГППУ, 2012: 58–60.
100. Печенкова Е.В., Власова Р.М., Новикова М.В., Фаликман М.В., Синицын В.Е. Чтение предложений как активирующее задание для функциональной МРТ головного мозга. Российский электронный журнал лучевой диагностики. 2012; 2 (2): 406–407
101. Белопасова А.В., Кадыков А.С., Коновалов Р.Н., Кремнева Е.И. Организация нейрональной речевой системы у здоровых лиц и ее реорганизация у пациентов с постинсультной афазией. Анналы клинической и экспериментальной неврологии. 2013; 7 (1): 25–30
102. Власова Р.М., Печенкова Е.В., Ахутина Т.В., Синицын В.Е. Структурно-функциональная организация использования глаголов и существительных в зависимости от стратегии их актуализации. Вопросы психологии. 2012; 4: 128–138.
Вопросы психологии. 2012; 4: 128–138.
103. Больгина Т.А., Малютина С.А., Завьялова В.В., Игнатьев Г.А., Власова Р.М., Ушаков В.Л., Иванова М.В., Драгой О.В. Русскоязычная фМРТ-парадигма для локали зации речевых зон в мозге. Седьмая международная конференция по когнитивной науке / Под ред. Ю.И. Александрова, К.В. Анохина. Светлогорск: Институт психологии РАН, 2016: 163–164.
104. Купцова С.В., Власова Р.М., Драгой О.В., Иванова М.В., Малютина С.А., Петрушевский А.Г., Федина О.Н., Гутыр чик Е.Ф. Особенности реорганизации речевых зон мозга у больных с разными формами афазии. Вестник Воронежского государственного университета. Серия: лингвистика и межкультурная коммуникация. 2015; 4: 74–81.
105. Tie Y., Rigolo L., Norton I.H. et al. Defining language networks from resting-state fMRI for surgical planning – a feasibility study. Hum. Brain Mapp. 2014; 35 (3): 1018– 1030. https://doi.org/10.1002/hbm.22231
106. Sair H.I., Agarwal S., Pillai J.J. Application of Resting State Functional MR Imaging to Presurgical Mapping: Language Mapping. Neuroimaging Clin. N. Am. 2017; 27 (4): 635–644. https://doi.org/10.1016/j.nic.2017.06.003
Neuroimaging Clin. N. Am. 2017; 27 (4): 635–644. https://doi.org/10.1016/j.nic.2017.06.003
107. Rosazza C., Zaca D., Bruzzone M.G. Pre-surgical Brain Mapping: To Rest or Not to Rest? Front. Neurol. 2018; 9: 520. https://doi.org/10.3389/fneur.2018.00520
108. Shirer W.R., Ryali S., Rykhlevskaia E. et al. Decoding subject-driven cognitive states with whole-brain connectivity patterns. Cereb. Cortex. 2012; 22 (1): 158–165. https://doi.org/10.1093/cercor/bhr099
109. Tanaka N., Stufflebeam S.M. Presurgical Mapping of the Language Network Using Resting-state Functional Connectivity. Top. Magn. Reson. Imaging. 2016; 25 (1): 19–24. https://doi.org/10.1097/RMR.0000000000000073
110. Branco P., Seixas D., Deprez S. et al. Resting-State Functional Magnetic Resonance Imaging for Language Preoperative Planning. Front. Hum. Neurosci. 2016; 10: 11. https://doi.org/10.3389/fnhum.2016.00011
111. Sair H.I., Yahyavi-Firouz-Abadi N., Calhoun V.D. et al. Presurgical brain mapping of the language network in patients with brain tumors using resting-state fMRI: Comparison with task fMRI. Hum. Brain Mapp. 2016; 37 (3): 913–923. https://doi.org/10.1002/hbm.23075
Hum. Brain Mapp. 2016; 37 (3): 913–923. https://doi.org/10.1002/hbm.23075
112. Branco P., Seixas D., Castro S.L. Mapping language with resting-state functional magnetic resonance imaging: A study on the functional profile of the language network. Hum. Brain Mapp. 2020; 41 (2): 545–560. https://doi.org/10.1002/hbm.24821
113. Румшиская А.Д., Паникратова Я.Р., Маковская Л.А., Власова Р.М., Мершина Е.А., Синицын В.Е., Печенкова Е.В. Целесообразность использования фМРТ покоя для индивидуального картирования зон головного мозга, связанных с моторными, речевыми и регуляторными функциями. Когнитивная наука в Москве: новые исследования. Материалы конференции 15 июня 2017 г. / Под ред. Е. В. Печенковой, М. В. Фаликман. М.: Буки Веди, ИППиП, 2017: 311–316.
114. Hsu A.L., Chen H.S., Hou P. et al. Presurgical resting-state functional MRI language mapping with seed selection guided by regional homogeneity. Magn. Reson. Med. 2020; 84 (1): 375–383. https://doi.org/10.1002/mrm.28107
115. Lemee J.M., Berro D.H., Bernard F. et al. Resting-state functional magnetic resonance imaging versus taskbased activity for language mapping and correlation with perioperative cortical mapping. Brain Behav. 2019; 9 (10): e01362. https://doi.org/10.1002/brb3.1362
Lemee J.M., Berro D.H., Bernard F. et al. Resting-state functional magnetic resonance imaging versus taskbased activity for language mapping and correlation with perioperative cortical mapping. Brain Behav. 2019; 9 (10): e01362. https://doi.org/10.1002/brb3.1362
116. Park K.Y., Lee J.J., Dierker D. et al. Mapping language function with task-based vs. resting-state functional MRI. PLoS One. 2020; 15 (7): e0236423. https://doi.org/10.1371/journal.pone.0236423
117. Liu H., Stufflebeam S.M., Sepulcre J. et al. Evidence from intrinsic activity that asymmetry of the human brain is controlled by multiple factors. Proc. Natl. Acad. Sci. U.S.A. 2009; 106 (48): 20499–20503. https://doi.org/10.1073/pnas.0908073106
118. Wang D., Buckner R.L., Liu H. Functional specialization in the human brain estimated by intrinsic hemispheric interaction. J. Neurosci. 2014; 34 (37): 12341–12352. https://doi.org/10.1523/JNEUROSCI.0787-14.2014
119. Rolinski R., You X., Gonzalez-Castillo J. et al. Language lateralization from task-based and resting state functional MRI in patients with epilepsy. Hum. Brain Mapp. 2020; 41 (11): 3133–3146. https://doi.org/10.1002/hbm.25003
Language lateralization from task-based and resting state functional MRI in patients with epilepsy. Hum. Brain Mapp. 2020; 41 (11): 3133–3146. https://doi.org/10.1002/hbm.25003
120. Mbwana J.S., You X., Ailion A. et al. Functional connectivity hemi spheric contrast (FC-HC): A new metric for language mapping. Neuroimage Clin. 2021; 30): 102598. https://doi.org/10.1016/j.nicl.2021.102598
121. Gohel S., Laino M.E., Rajeev-Kumar G. et al. RestingState Functional Connectivity of the Middle Frontal Gyrus Can Predict Language Lateralization in Patients with Brain Tumors. Am. J. Neuroradiol. 2019; 40 (2): 319–325. https://doi.org/10.3174/ajnr.A5932
122. Phillips N.L., Shatil A.S., Go C. et al. Resting-State Functional MRI for Determining Language Lateralization in Children with Drug-Resistant Epilepsy. Am. J. Neuroradiol. 2021; 42 (7): 1299–1304. https://doi.org/10.3174/ajnr.A7110
123. DeSalvo M.N., Tanaka N., Douw L. et al. Resting-State Functional MR Imaging for Determining Language Laterality in Intractable Epilepsy. Radiology. 2016; 281 (1): 264–269. https://doi.org/10.1148/radiol.2016141010
Radiology. 2016; 281 (1): 264–269. https://doi.org/10.1148/radiol.2016141010
124. Tuncer M.S., Salvati L.F., Grittner U. et al. Towards a tractography-based risk stratification model for language area associated gliomas. Neuroimage Clin. 2021; 29: 102541. https://doi.org/10.1016/j.nicl.2020.102541
125. Ivanova M.V., Isaev D.Y., Dragoy O.V. et al. Diffusiontensor imaging of major white matter tracts and their role in language processing in aphasia. Cortex. 2016; 85: 165–181. https://doi.org/10.1016/j.cortex.2016.04.019
126. Baboyan V., Basilakos A., Yourganov G. et al. Isolating the white matter circuitry of the dorsal language stream: Connectome-Symptom Mapping in stroke induced aphasia. Hum. Brain Mapp. 2021. https://doi.org/10.1002/hbm.25647
127. Duffau H., Herbet G., Moritz-Gasser S. Toward a pluricomponent, multimodal, and dynamic organization of the ventral semantic stream in humans: lessons from stimulation mapping in awake patients. Front. Syst. Neurosci. 2013; 7: 44. https://doi.org/10.3389/fnsys.2013.00044
2013; 7: 44. https://doi.org/10.3389/fnsys.2013.00044
128. Di Cristofori A., Basso G., de Laurentis C. et al. Perspectives on (A)symmetry of Arcuate Fasciculus. A Short Review About Anatomy, Tractography and TMS for Arcuate Fasciculus Reconstruction in Planning Surgery for Gliomas in Language Areas. Front. Neurol. 2021; 12: 639822. https://doi.org/10.3389/fneur.2021.639822
129. Leclercq D., Duffau H., Delmaire C. et al. Comparison of diffusion tensor imaging tractography of language tracts and intraoperative subcortical stimulations. J. Neurosurg. 2010; 112 (3): 503–511. https://doi.org/10.3171/2009.8.JNS09558
130. Caverzasi E., Hervey-Jumper S.L., Jordan K.M. et al. Identifying preoperative language tracts and predicting postoperative functional recovery using HARDI q-ball fiber tractography in patients with gliomas. J. Neurosurg. 2016; 125 (1): 33–45. https://doi.org/10.3171/2015.6.JNS142203
131. Castellano A., Bello L., Michelozzi C. et al. Role of diffusion tensor magnetic resonance tractography in predicting the extent of resection in glioma surgery. Neuro Oncol. 2012; 14 (2): 192–202. https://doi.org/10.1093/neuonc/nor188
Neuro Oncol. 2012; 14 (2): 192–202. https://doi.org/10.1093/neuonc/nor188
132. Klein A.P., Ulmer J.L., Mueller W.M. et al. DTI for Presurgical Mapping In: Functional Brain Tumor Imaging / Pillai J. – New York: Springer, 2014: 95–109.
133. Farshidfar Z., Faeghi F., Mohseni M. et al. Diffusion tensor tractography in the presurgical assessment of cerebral gliomas. Neuroradiol. J. 2014; 27 (1): 75–84. https://doi.org/10.15274/NRJ-2014-10008
как ученые визуализируют строение головного мозга — T&P
Понятие brain mapping в русском медицинском словаре переводится как «картирование головного мозга». Этот процесс кардинально изменился с начала XX века, когда немецкий невролог Корбиниан Бродман использовал химические красители для наблюдения движения нейронов через микроскоп. Результатом нескольких лет изучения тканей мозга стала карта, на которой разные области коры состояли из разных групп клеток. Так ученый понял, что это может быть связано с функциями каждого участка, которые, вероятно, отличаются друг от друга.
 T&P публикуют сокращенный перевод статьи The Atlantic о том, как ученые и врачи создают карты головного мозга в наше время.
T&P публикуют сокращенный перевод статьи The Atlantic о том, как ученые и врачи создают карты головного мозга в наше время.
Бродман, мягко говоря, был бы удивлен современным аналогам его работы. Один из них — это карта, недавно созданная сотрудниками американского Института Аллена по изучению мозга. Она показывает активность более чем 18 тысяч нервных клеток той зоны коры головного мозга мыши, которая связана с визуальным восприятием. В ходе эксперимента мышам показывали как простые изображения вроде черно-белых полос, так и видео. По мнению ученых, это должно приблизить их к пониманию, как взаимодействуют тысячи нейронов, каждый из которых отвечает за разные функции, формируя визуальное восприятие животного.
Эта карта — результат внушительного технологического прорыва. На протяжении столетия до работы Бродмана и после него многие ученые приписывали различные функции разным участкам мозга, пытаясь выяснить, как все это функционирует в целом. Одной из первых попыток этого достичь можно считать схему, созданную последователями френологии, которая была в большей степени построена на догадках, чем на научных фактах. Они считали, что «воинственность» находится у нас за ухом, а «родительская любовь» — в области задней части головы, которая, как теперь известно, на самом деле является первичной зрительной корой. Здесь можно провести интересную параллель с историей картографии. Так же как и френологи, ранние картографы просто не оставляли на картах белых пятен, несмотря на отсутствие информации о соответствующих территориях. Они могли обозначить Антарктику как terra incognita, а потом украсить этот неизведанный огромный континент горными хребтами и разнообразными обитателями. Во времена Великих географических открытий качество карт значительно улучшилось, поскольку теперь они основывались на непосредственных наблюдениях и показаниях приборов.
Они считали, что «воинственность» находится у нас за ухом, а «родительская любовь» — в области задней части головы, которая, как теперь известно, на самом деле является первичной зрительной корой. Здесь можно провести интересную параллель с историей картографии. Так же как и френологи, ранние картографы просто не оставляли на картах белых пятен, несмотря на отсутствие информации о соответствующих территориях. Они могли обозначить Антарктику как terra incognita, а потом украсить этот неизведанный огромный континент горными хребтами и разнообразными обитателями. Во времена Великих географических открытий качество карт значительно улучшилось, поскольку теперь они основывались на непосредственных наблюдениях и показаниях приборов.
Так и френология в прогрессивном XIX веке перестала существовать, а на ее место пришли ученые вроде Бродмана. Врачи заметили, что повреждения разных участков головного мозга влияют на разные функции, например речь или память, и стали создавать карты, основанные на реальных исследованиях. Сегодня картирование — очень сложный процесс, возможный благодаря датчикам, способным собирать данные, и компьютерам, которые их обрабатывают (все чаще — в режиме реального времени) и хранят. Карта Института Аллена — пример, основанный на достижениях в робототехнике, генетике и оптической визуализации.
Сегодня картирование — очень сложный процесс, возможный благодаря датчикам, способным собирать данные, и компьютерам, которые их обрабатывают (все чаще — в режиме реального времени) и хранят. Карта Института Аллена — пример, основанный на достижениях в робототехнике, генетике и оптической визуализации.
О работе сотрудников Института Аллена
Совершенно другой портрет мозга недавно создали художники Грег Данн и Брайан Эдвардс, PhD в области нейробиологии и физики соответственно. Их инсталляция «Self Reflected» находится в Институте Франклина в Филадельфии и представляет собой динамическое изображение того, как более 500 тысяч нервных клеток сплетаются между собой, то появляясь, то исчезая в зависимости от положения смотрящего. Изображение транслируется на поверхности размером 2,4 на 3,6 метра: нейронные сети вырезаны из полимера и покрыты сусальным золотом, которое переливается под разными углами. Свет от расположенной сверху светодиодной лампы попадает и формирует изображение подобно воздействию электрических импульсов на клетки мозга.
Свет от расположенной сверху светодиодной лампы попадает и формирует изображение подобно воздействию электрических импульсов на клетки мозга.
Хоть инсталляция и представляет собой визуализацию работы мозга, это, по мнению Данна, абсолютная противоположность карты Института Аллена. Ее корни уходят в науку, которая впоследствии была искусно адаптирована, чтобы излишне не загружать зрителя. Во-первых, полмиллиона нейронов — это незначительная часть от общего количества, которое на самом деле содержится в участке мозга такого размера. Во-вторых, сами клетки здесь гораздо больше. Данн не отслеживал траекторию их движения, глядя в микроскоп, а создал их, дуя на капли чернил (этот метод воссоздает естественный процесс разветвления нейронов). В итоге он перенес все это в компьютер и запрограммировал их движения так, чтобы они имитировали случайные изменения, естественным образом происходящие в природе.
Alena Aniukhina
Теги
#мозг
#картография
#нейронауки
2 732
Интраоперационное картирование длинных ассоциативных трактов в хирургии глиом доминантной по речи лобной доли
Список сокращений
SLF — верхний продольный пучок
AF — дугообразный пучок
FAT — лобный косой пучок
Первые операции в сознании на головном мозге были выполнены в первой половине ХХ века выдающимся канадским нейрохирургом W. Penfield у пациентов с эпилепсией. Во время операций он стимулировал поверхность коры мозга электрическими разрядами и записывал свои наблюдения. После накопления опыта и выполнения более 750 операций в сознании W. Penfield предложил современное описание топографии корковых представительств моторных и сенсорных функций. Позднее G. Ojemann во время операций в сознании картировал проводящие пути белого вещества, связанные с корковыми речевыми зонами. В частности, он описал номинативную (амнестическую) афазию при субкортикальной стимуляции теменной доли и развитие внезапного неврологического дефицита при выполнении заданий на память во время стимуляции таламических структур [1].
В частности, он описал номинативную (амнестическую) афазию при субкортикальной стимуляции теменной доли и развитие внезапного неврологического дефицита при выполнении заданий на память во время стимуляции таламических структур [1].
Прямая стимуляция корковых зон и проводящих путей в настоящее время является стандартом при удалении внутримозговых опухолей головного мозга. Согласно Европейским рекомендациям [1], увеличение объема резекции опухоли значительно продлевает общую выживаемость пациентов c глиомами как с низкой, так и с высокой степенью злокачественности. С другой стороны, мозговые функции должны быть картированы для сохранения качества жизни пациентов. Поэтому при диффузных опухолях, таких как глиомы, основная задача состоит в удалении части головного мозга, пораженной опухолевыми клетками, исходя из индивидуальных функциональных границ, а не из «онкологических» границ, которых по сути нет при глиомах, всегда имеющих инвазивный рост [1].
Другими словами, крайне важно картировать кору и проводящие пути белого вещества, ответственные за сенсомоторную, зрительно-пространственную и языковую функции. Чтобы подтвердить эту новую концепцию, в недавнем метаанализе, в котором были представлены результаты хирургического лечения 8091 пациента с глиомами головного мозга, было показано, что использование интраоперационного картирования позволило добиться статистически значимого снижения постоянного неврологического дефицита, несмотря на увеличение частоты резекций в функционально важных областях; кроме того, степень резекций была расширена [1].
Чтобы подтвердить эту новую концепцию, в недавнем метаанализе, в котором были представлены результаты хирургического лечения 8091 пациента с глиомами головного мозга, было показано, что использование интраоперационного картирования позволило добиться статистически значимого снижения постоянного неврологического дефицита, несмотря на увеличение частоты резекций в функционально важных областях; кроме того, степень резекций была расширена [1].
Глиомы являются распространенными опухолями ЦНС и чаще всего (40% случаев) локализуются в лобных долях [2], где расположены различные функционально важные зоны, в том числе отвечающие за двигательные функции и речь.
Хирургическое лечение глиом функционально значимых зон головного мозга — весьма сложная задача. Помимо детального знания нейрохирургом функциональной анатомии коры головного мозга, в процессе операции должна учитываться и анатомия проводящих путей. Исторически основное внимание нейрохирургов и нейрофизиологов было сосредоточено на функциональной анатомии коры головного мозга и в меньшей степени — проводящих путей, из которых наиболее часто во время операций картируется пирамидный тракт [3]. Менее изучены в хирургии внутримозговых опухолей длинные ассоциативные пути, участвующие в обеспечении функции речи.
Менее изучены в хирургии внутримозговых опухолей длинные ассоциативные пути, участвующие в обеспечении функции речи.
Несмотря на значительный прогресс в понимании строения длинных ассоциативных проводящих путей головного мозга, достигнутый за последние 30 лет благодаря изобретению диффузионно-тензорной трактографии (DTI) и совершенствованию математических моделей получения и обработки сигнала — HARDI, HARDI Q-ball, HARDI-CSD, их точность остается недостаточной, чтобы окончательно ответить на вопрос об анатомическом строении ассоциативных трактов [4, 5]. Тем не менее современные возможности HARDI-трактографии позволяют выявлять терминали трактов, пересечение различных пучков, ход трактов в зоне опухолевой инфильтрации и отека [6]. На основании этих данных возможно предоперационное представление топографо-анатомических взаимоотношений между трактом и опухолью (варианты смещения, инфильтрации, деструкции, интактного пучка).
Важным для понимания микрохирургической анатомии трактов представляется изучение хода их волокон с помощью диссекции по Клинглеру на трупных препаратах мозга [7].
В настоящее время для интраоперационного картирования функциональных речевых зон стандартом является краниотомия в сознании [8, 9].
В литературе описаны многочисленные случаи транзиторной послеоперационной афазии при хирургической резекции глиом с пробуждением, когда глиомы расположены в доминантном по речи полушарии. По данным H. Duffau и соавт. [8], почти у 80% пациентов сразу после операций с пробуждением на доминантном полушарии возникают речевые нарушения. По прошествии 3 мес до 95% больных не имеют неврологического дефицита. По результатам других авторов [10], постоянные речевые нарушения могут оставаться почти у 10% пациентов. Для снижения вероятности появления послеоперационного речевого дефицита используется интраоперационное картирование не только корковых речевых зон, но и длинных ассоциативных путей.
Цель исследования — сопоставить результаты интраоперационного картирования и послеоперационного состояния речевой функции у пациентов с глиомами премоторной зоны доминантной по речевым функциям лобной доли, вовлекающими верхний продольный, дугообразный и лобный косой пучки, оперированных с использованием методики краниотомии в сознании.
1. Топография SLF/AF и FAT
Топография и сегментация длинных ассоциативных трактов (SLF, AF, FAT) и их функциональное значение [11—13] представлены в табл. 1 (более подробно они были опубликованы в наших предшествующих работах [6, 14]).
Таблица 1. Основные сведения о верхнем продольном и аркуатном трактах.
Примечание. S — сегменты трактов, PreCu — предклинье, Cing — поясная извилина, AG — ангулярная извилина, MFG — средняя лобная извилина, SMG — супрамаргинальная извилина, IFG — нижняя лобная извилина, MTG — средняя височная извилина, ITG — нижняя височная извилина, PCG — прецентральная извилина, SMA — дополнительная моторная область.
Верхний продольный пучок (SLF) представляет собой сложный тракт, состоящий из трех сегментов: SLF I, SLF II, SLF III. Данные о строении, функциях и симптомах, выявляемых при повреждении этих трактов, представлены в табл. 1. Эта сегментация может показаться условной, особенно SLF I, анатомически отделенного от остальных сегментов. Такой подход объясняется данными авторадиографии на приматах и общей функцией всех сегментов — связью между лобной, теменной долей и височными долями.
Такой подход объясняется данными авторадиографии на приматах и общей функцией всех сегментов — связью между лобной, теменной долей и височными долями.
В аркуатном пучке (AF) в настоящее время выделяют два сегмента: дорсальный и вентральный. Дорсальный сегмент соединяет среднюю и нижнюю височные извилины с нижней лобной, при его повреждении обнаруживаются нарушение лексической и семантической сторон речи, транскортикальная моторная афазия. Вентральный сегмент соединяет верхнюю и среднюю височные извилины с нижней лобной (pars triangularis). Поражение данного сегмента вызывает фонемические (литеральные) парафазии, что было описано Карлом Вернике в XIX веке. Ряд авторов [11] описывают AF как часть SLF.
Волокна SLF и AF идут параллельно, однако AF в отличие от SLF не переключается в теменной доле. Более подробно анатомия, сегментации и симптомы поражения основных длинных ассоциативных трактов были описаны ранее в отечественных и зарубежных работах [11—13, 15, 16].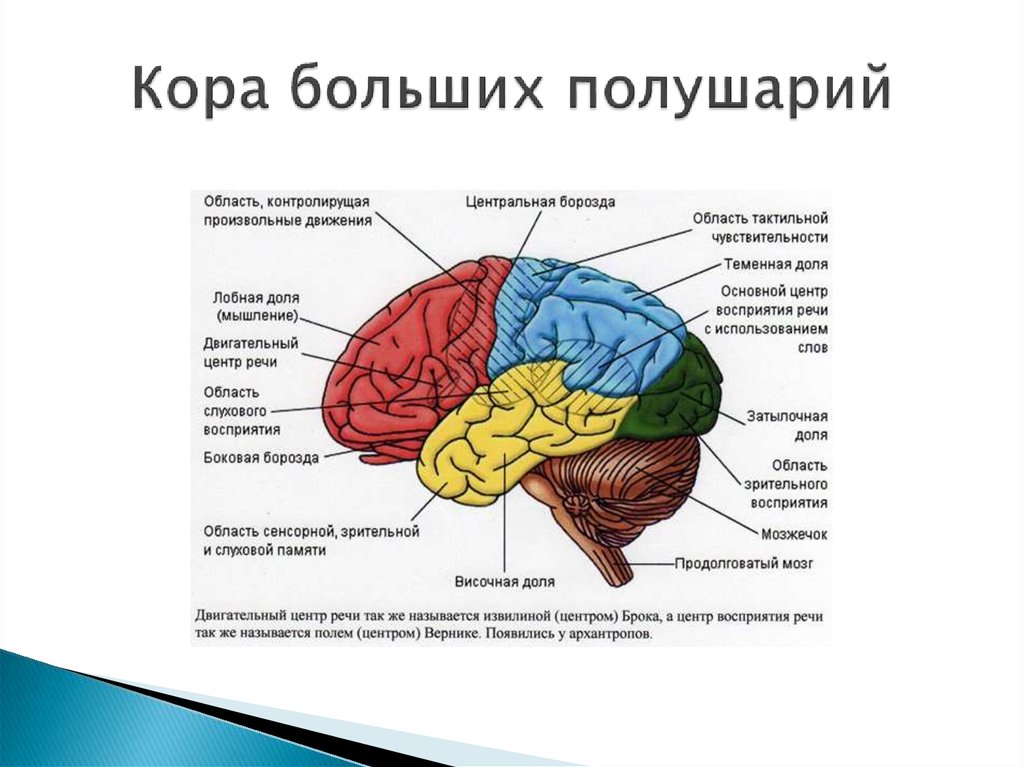
Лобный косой пучок (FAT) открыт позднее всех остальных проводящих путей с помощью МР-трактографии. Он проходит косо от нижней лобной извилины (pars opercularis) к медиальной поверхности дополнительной моторной коры. В норме через лобный косой пучок подавляется излишняя моторная речевая активность и инициируется артикуляция. Частичное повреждение или интраоперационная стимуляция данного пучка вызывает заикание или остановку речи (speech arrest), а полное повреждение приводит к развитию специфического синдрома Фокс—Шавани—Мари (парез лица, гортани и челюсти). Предполагается, что FAT играет важную роль в инициировании спонтанной речи, связывая площадь Брока и SFG [17].
Точное строение вышеописанных пучков остается невыясненным, также до конца не известна их сегментация, которая в основном строится на разнице неврологических дефицитов, наблюдаемых при интраоперационном картировании этих пучков, что само по себе является довольно спорным решением, поскольку ассоциативные проводящие пути проявляют наибольшую вариабельность. Подробно их строение и сегментация описаны в нашей предыдущей работе [16].
Подробно их строение и сегментация описаны в нашей предыдущей работе [16].
Топографически в лобной доле SLF II, SLF III и оба сегмента AF идут параллельно, плотно прилегая друг к другу, а FAT пересекает их под прямым углом, вследствие чего в большинстве клинических случаев затрагиваются все вышеописанные пучки, и интраоперационная дифференциальная диагностика поражения проводящих путей бывает затруднена. Еще сильнее она затрудняется при наличии предоперационной или присоединении интраоперационной афазии, которая смазывает картину мониторинга речи и затрудняет контроль неврологического статуса пациента. Схема хода основных ассоциативных трактов представлена на рис. 1.
Рис. 1. Анатомия волокон длинных ассоциативных трактов. а — схематичные проекции длинных ассоциативных трактов на латеральной поверхности полушария; б — МР-трактография здорового добровольца, построение волокон длинных ассоциативных трактов; в — латеральная диссекция по технике Клинглера, выделение волокон длинных ассоциативных трактов: SLF — верхний продольный пучок, IFOF — нижний лобно-затылочный тракт, UF — крючковидный тракт, I — островок; г — глубокая диссекция латеральной поверхности полушария, выделение нижнего лобно-затылочного тракта на всем протяжении от полюса лобной до полюса затылочной доли; д — схематическое изображение хода кортико-таламических волокон и stratum sagittale (параллельный ход зрительной лучистости и нижнего лобно-затылочного тракта).
2. Материал и методы исследования
2.1. Серия пациентов
Критериями включения пациентов в данное исследование являлись возраст старше 18 лет, наличие супратенториальной глиомы в доминантном полушарии (по речи), хирургия с пробуждением, обязательное обнаружение функционально значимых проводящих путей во время операции (SLF, AF, FAT). В данной статье нами описана серия из 12 (6 мужчин и 6 женщин, средний возраст пациентов 45 лет (29—67)) клинических наблюдений пациентов с глиомами, расположенными в левой лобной доле вблизи речевых зон, из них 6 пациентов с диффузными астроцитомами (Grade II), 1 — с анапластической астроцитомой (Grade III), 1 — с глиобластомой (Grade IV), 1 — с олигодендроглиомой (Grade II) и 3 — с анапластической олигодендроглиомой (Grade III). Клиническая картина у 6 пациентов была представлена структурной эпилепсией с фокальными приступами, у 2 — речевыми нарушениями, возникшими до операции, у 4 — общемозговой симптоматикой (головная боль).
2.
 2. Пред- и послеоперационная МРТ с контрастным усилением и МР-трактография
2. Пред- и послеоперационная МРТ с контрастным усилением и МР-трактография
Всем 12 пациентам выполнена МРТ с контрастным усилением и построением длинных ассоциативных трактов по методике HARDI (High angular resolution diffusion-weighted imaging — диффузионно взвешенные изображения с высоким угловым разрешением) с определением топографоанатомических взаимоотношений трактов и опухоли до операции и в первые 72 ч после ее завершения.
2.3. Нейрофизиологический контроль и методика краниотомии в сознании
У всех пациентов оперативные вмешательства выполнены с пробуждением по протоколу asleep-awake-asleep с использованием кортикальной и субкортикальной стимуляции с целью локализации функционально значимых структур и уточнения допустимого объема резекции. Средняя сила тока при прямой электрической стимуляции коры и ассоциативных трактов составила 3 мА (1,9—6,5 мА). Прямая электростимуляция осуществлялась с помощью биполярного электрода трейнами. Во всех случаях при операциях для контроля эпилептической активности коры мозга использовалась электрокортикография. Для интраоперационной идентификации границ опухоли в 6 наблюдениях использовались интраоперационный ультразвук и флуоресцентная навигация с 5-аминолевулиновой кислотой (5-АЛК, Аласенс).
Для интраоперационной идентификации границ опухоли в 6 наблюдениях использовались интраоперационный ультразвук и флуоресцентная навигация с 5-аминолевулиновой кислотой (5-АЛК, Аласенс).
2.4. Пред-, интра- и послеоперационная оценка речи
Состояние речевых функций оценивалось до, во время и после операции нейропсихологом.
До операции и перед выпиской проводилось комплексное нейропсихологическое исследование по методу А.Р. Лурия [18]. Данный метод позволяет проводить детальный качественный анализ выявляемых расстройств, а также устанавливать топическую принадлежность выявленных симптомов. Исследовались разные виды праксиса, качественные особенности речевых функций (в том числе письма и счета), пространственных функций, слуховой и зрительный гнозис, а также мышление. Особый акцент делался на исследовании речевой функции. При этом оценивались спонтанная речь, называние, понимание, повторение, письмо под диктовку. Для оценки словарного запаса и инертности речевых функций проводился тест на беглость речи с называнием в течение 1 мин слов с заданным признаком («красные» или «зеленые» предметы, «существительные на букву К или С»).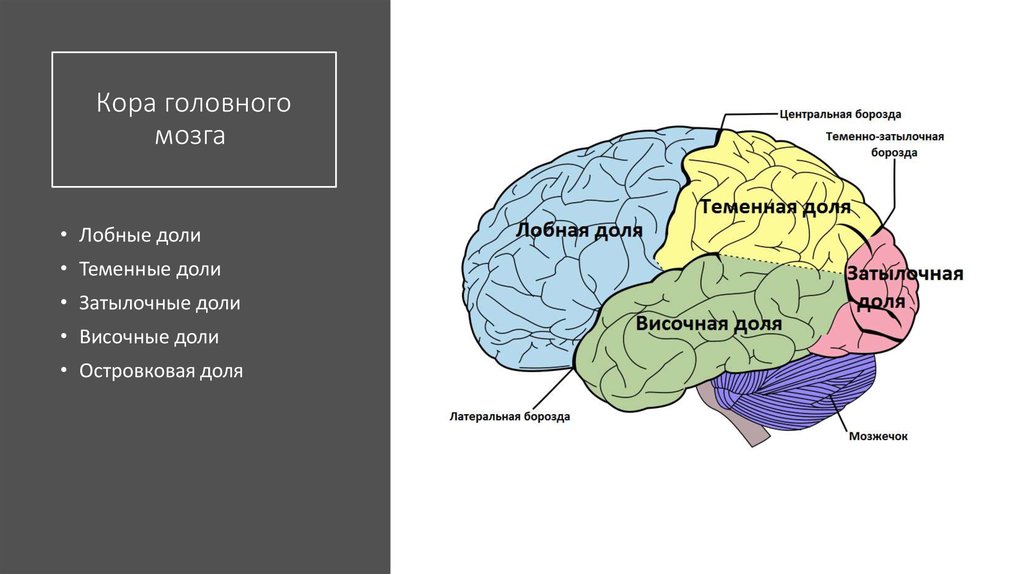 Кроме этого, всем больным до и после операции проводился компьютеризированный тест с называнием предметов (naming-тест), который использовался при интраоперационном тестировании.
Кроме этого, всем больным до и после операции проводился компьютеризированный тест с называнием предметов (naming-тест), который использовался при интраоперационном тестировании.
Ведущая рука определялась по опроснику M. Annett [19], согласно которому 11 пациентов были правшами, 1 — переученным в раннем возрасте левшой, полностью перешедшим на правую руку. Доминантность полушария по речи определялась с помощью дихотического прослушивания с определением соответствующего коэффициента.
Для интраоперационного мониторинга речи использовался компьютеризированный naming-тест [20] с называнием существительных или глаголов по представленным простым черно-белым картинкам (всего по 30 картинок, изображающих действия или предметы), а также оценивались автоматизированные ряды (счет от 1 до 10, перечисление месяцев, дней недели). На протяжении всего пробуждения при отсутствии электростимуляции во время удаления опухоли осуществлялся свободный диалог с больным.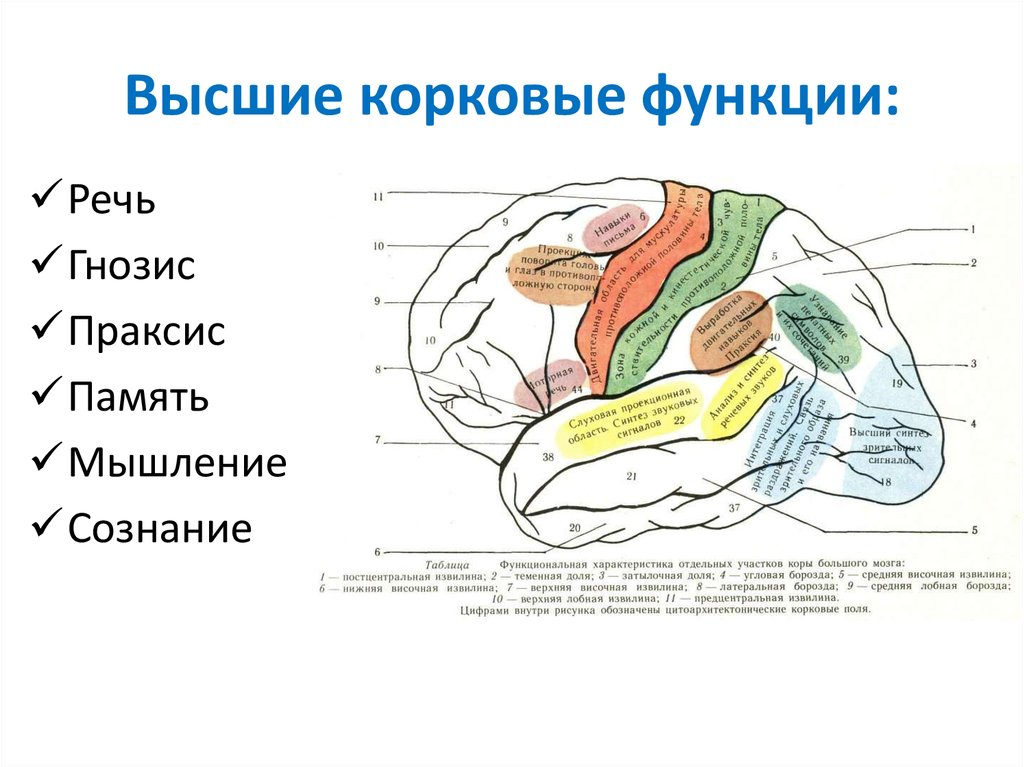
3. Результаты
3.1. Дооперационное нейропсихологическое исследование больных
До операции у 10 из 12 больных речь была в норме. У 1 пациентки (№ 3) имелись легкие явления эфферентной моторной афазии (по А.Р. Лурия) или афазии Брока, что проявлялось отдельными персеверациями в спонтанной речи и при письме. У другого пациента (№ 11) речь была в норме, однако при письме отмечались отдельные персеверации букв и слогов. У всех пациентов обнаруживались в разной степени выраженные нарушения слухоречевой памяти и динамического праксиса.
3.2. Интраоперационное картирование функциональных речевых зон коры
У 4 из 12 пациентов интраоперационно была определена корковая зона моторной речи. Ее обнаружение при электростимуляции сопровождалось остановкой речи или персеверациями предыдущих слов, что было характерно для эфферентной моторной афазии по А.Р. Лурия (афазия Брока). В 2 случаях корковая моторная зона речи располагалась в задних отделах нижней лобной извилины, что совпадало с общепринятыми анатомическими границами зоны Брока; в 2 других случаях она локализовалась в средних и задних отделах средней лобной извилины соответственно.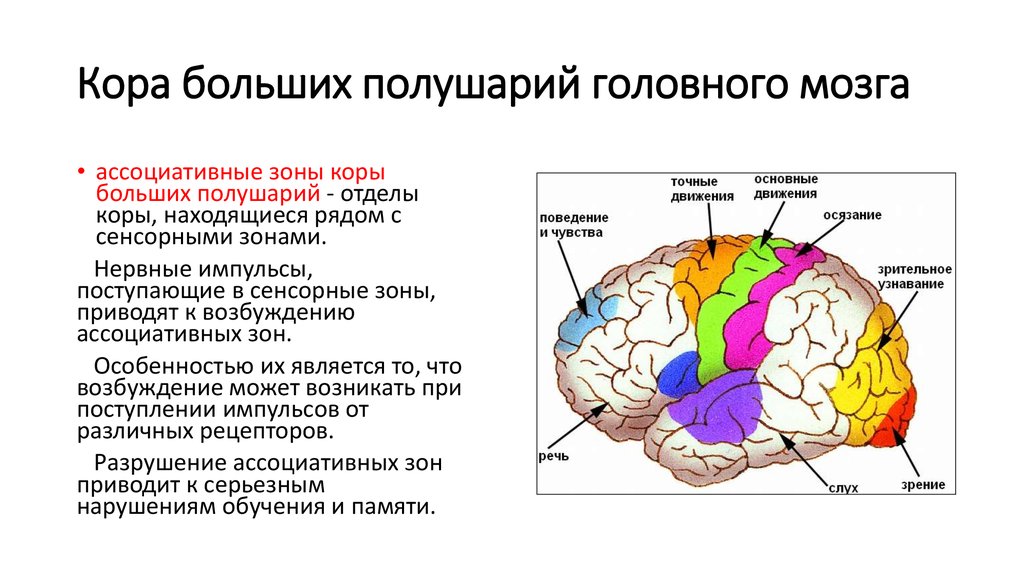 В остальных 8 наблюдениях во время операции корковых речевых зон не выявлено.
В остальных 8 наблюдениях во время операции корковых речевых зон не выявлено.
3.3. Интраоперационная флуоресцентная диагностика
Из 6 пациентов, оперированных с применением 5-АЛК, видимая флуоресценция отмечалась в 3 случаях: в 1 наблюдении имела яркий характер (пациент с глиобластомой) и в 2 случаях была умеренной (пациенты с глиомами Grade III). В 1 случае флуоресценция опухоли отмечалась на коре мозга. Флуоресценция отсутствовала у 3 пациентов с диффузными астроцитомами. В 6 наблюдениях флуоресценция не использовалась.
3.4. Интраоперационное картирование длинных ассоциативных трактов
При интраоперационном картировании речевых зон выявляемые речевые нарушения были схожи с таковыми при эфферентной моторной афазии (Брока), например персеверации, остановка речи, а также акустико-мнестической афазией (номинативной) — забывание слов. Реже имели место нарушения речи в рамках подкоркового поражения — дизартрия, замедление. Вне стимуляции во время свободного диалога по мере удаления опухоли впервые речевые нарушения появились в 6 из 12 наблюдений (парафазии разного характера, персеверации, проговаривание слов по слогам, дизартрия и замедление речи, забывания слов). Из этих 6 наблюдений только в 2 случаях затем проведена прямая электростимуляция, при которой речевые нарушения возникли повторно. В остальных 6 из 12 наблюдений впервые нарушения речи возникли непосредственно при прямой электрической стимуляции. Таким образом, при прямой электростимуляции речевые нарушения отмечались всего в 8 из 12 наблюдений: остановка речи, вербальные и литеральные парафазии при назывании картинок, персеверации предыдущих слов, забывание слов, замедление и нарушение артикуляции речи (табл. 2). В 11 случаях в ложе удаляемой опухоли локализован комплекс верхнего продольного и дугообразного пучков (SLF/AF), у одного пациента — лобный косой пучок (FAT). Мы рассматривали комплекс SLF и AF без разделения этих трактов и сегментации SLF на отдельные пучки. Подробные данные о речевых нарушениях до операции, во время операции и после нее в различные сроки представлены в табл. 2. Не предъявляя картинок, мы не улавливали нарушения называния (височный компонент), после операции именно он мог выступать на первый план.
Из этих 6 наблюдений только в 2 случаях затем проведена прямая электростимуляция, при которой речевые нарушения возникли повторно. В остальных 6 из 12 наблюдений впервые нарушения речи возникли непосредственно при прямой электрической стимуляции. Таким образом, при прямой электростимуляции речевые нарушения отмечались всего в 8 из 12 наблюдений: остановка речи, вербальные и литеральные парафазии при назывании картинок, персеверации предыдущих слов, забывание слов, замедление и нарушение артикуляции речи (табл. 2). В 11 случаях в ложе удаляемой опухоли локализован комплекс верхнего продольного и дугообразного пучков (SLF/AF), у одного пациента — лобный косой пучок (FAT). Мы рассматривали комплекс SLF и AF без разделения этих трактов и сегментации SLF на отдельные пучки. Подробные данные о речевых нарушениях до операции, во время операции и после нее в различные сроки представлены в табл. 2. Не предъявляя картинок, мы не улавливали нарушения называния (височный компонент), после операции именно он мог выступать на первый план.
Таблица 2. Локализация опухоли и динамика речевых нарушений у обследованных пациентов Таблица 2. (окончание) Локализация опухоли и динамика речевых нарушений у обследованных пациентов
Как видно из табл. 2, после операции у 11 из 12 пациентов были выявлены те или иные речевые нарушения. При этом у 1 из них речевые нарушения появились через 1 сут после операции, что можно связать с нарастанием послеоперационного отека мозгового вещества. У 1 пациента после операции выявлялся умеренный правосторонний гемипарез, преимущественно в руке.
Из табл. 2 также видно, что у 10 человек из исследованной серии афазия, выявленная после удаления опухоли лобной доли левого полушария, имела сложный характер. Только 2 пациента после операции не имели афазии. У 1 из них (№ 1) выявлялись подкорковые нарушения речи (замедление, негрубая дизартрия) и письма (письмо «разорванное», неплавное, микрография). Опухоль у него была небольшого размера, располагалась преимущественно в дорсомедиальной префронтальной области, во время тестирования имелись нарушения речи, сходные с послеоперационными. Еще у 1 пациентки (№ 7) речь оставалась нормальной в течение периода наблюдения. Опухоль у нее была небольших размеров, располагалась вблизи зоны Брока (по данным функциональной МРТ). Во время интраоперационного тестирования выявлялись персеверации и парафазии при назывании действий, что и позволило идентифицировать зону Брока.
Еще у 1 пациентки (№ 7) речь оставалась нормальной в течение периода наблюдения. Опухоль у нее была небольших размеров, располагалась вблизи зоны Брока (по данным функциональной МРТ). Во время интраоперационного тестирования выявлялись персеверации и парафазии при назывании действий, что и позволило идентифицировать зону Брока.
Особый интерес представляет анализ сложного речевого синдрома у 10 пациентов. У 8 из них отмечались, кроме типичного для поражения левой лобной доли персевераторного синдрома разной степени выраженности (эфферентная моторная афазия по Лурия, афазия Брока), еще и нарушения, характерные для поражения височной доли. Прежде всего, это были нарушения называния, очень схожие с таковыми при акустико-мнестической афазии (по Лурия). Причем почти у всех 8 человек они были выраженные, сопровождались описанием функционального назначения предъявляемого объекта. Весьма характерными были и вербальные парафазии, которыми больные заменяли настоящие названия объектов, причем парафазии часто были весьма далеки по смыслу от настоящего названия.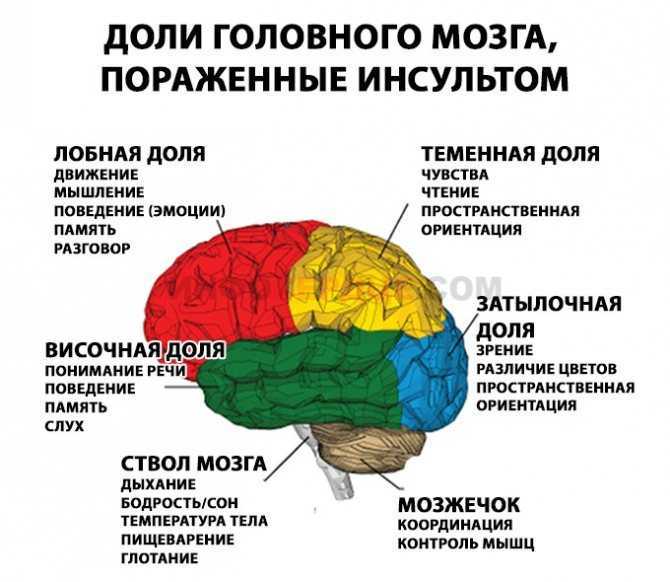 В 1 случае подобные парафазии отмечались уже при интраоперационном картировании (предъявлении картинок с действиями). Еще у 4 из этих 7 больных наблюдалось отчуждение смысла слов, причем иногда в выраженной форме (уже при просьбе показать части лица, предметы в комнате, картинки в альбоме и т. д.). Подобная характеристика речевых нарушений заставляла думать о возникновении у больных проводниковой афазии вследствие разобщения связей между речевыми зонами височной и лобной долей левого полушария из-за повреждения длинных ассоциативных трактов (комплекса SLF/AF).
В 1 случае подобные парафазии отмечались уже при интраоперационном картировании (предъявлении картинок с действиями). Еще у 4 из этих 7 больных наблюдалось отчуждение смысла слов, причем иногда в выраженной форме (уже при просьбе показать части лица, предметы в комнате, картинки в альбоме и т. д.). Подобная характеристика речевых нарушений заставляла думать о возникновении у больных проводниковой афазии вследствие разобщения связей между речевыми зонами височной и лобной долей левого полушария из-за повреждения длинных ассоциативных трактов (комплекса SLF/AF).
У пациентки № 2 после операции выявилась четкая транскортикальная моторная афазия (динамическая). Во время тестирования трактов SLF/AF были отмечены остановка речи и персеверации. Однако постоперационная картина больше соответствовала заинтересованности FAT, что можно связать с близким пространственным расположением трактов SLF/AF и FAT в области средней лобной извилины. Еще у 1 пациента (№ 5) после операции отмечена сложная моторная афазия (эфферентная моторная — афазия Брока) и афферентная моторная, сопровождающаяся нарушением орального праксиса и смазанностью речи.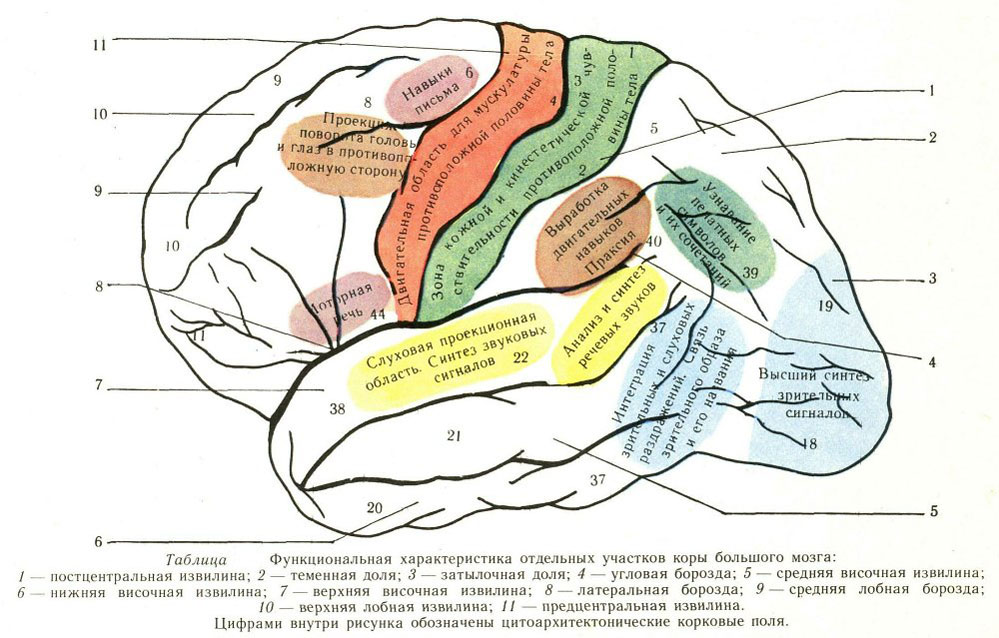 Этот компонент характерен для теменного поражения. У больного была опухоль преимущественно средней лобной извилины, в меньшей степени нижней лобной извилины. Во время интраоперационного тестирования также были получены персеверации и смазанность речи. Появление теменного компонента в афазии мы могли связать с заинтересованностью теменного компонента верхнего продольного пучка.
Этот компонент характерен для теменного поражения. У больного была опухоль преимущественно средней лобной извилины, в меньшей степени нижней лобной извилины. Во время интраоперационного тестирования также были получены персеверации и смазанность речи. Появление теменного компонента в афазии мы могли связать с заинтересованностью теменного компонента верхнего продольного пучка.
Средний индекс Карновского до операции составлял 90 баллов, к моменту выписки — 70 баллов.
3.5. Магнитно-резонансное томографическое обследование
Проведенная всем пациентам в первые 48—72 ч после операции МРТ показала, что тотальная резекция выполнена в 7 (более 90% опухоли) наблюдениях, субтотальная — в 2, парциальная — в 2, открытая биопсия — в 1 наблюдении. По данным послеоперационной МР-трактографии, ложе удаленной опухоли непосредственно граничило с комплексом SLF/AF в 7 наблюдениях, располагалось вблизи от комплекса SLF/AF в 3 наблюдениях, непосредственно граничило с FAT в 2.
3.6. Клинические примеры
Клинический пример 1
Пациентка А., 29 лет (наблюдение № 7). Заболевание манифестировало в виде приступов нарушения речи с последующей кратковременной потерей сознания. При МРТ головного мозга выявлена опухоль левой лобной доли (задние отделы нижней лобной извилины — вблизи зоны Брока) (см. рис. 2).
Рис. 2. Магнитно-резонансная томография головного мозга пациентки А. а, б, в — МРТ до операции в Т1-, Т2- (аксиальные срезы) и FLAIR- (сагиттальный срез) режимах; г — фМРТ — оранжевым цветом обозначена зона Брока; д — предоперационная МР-трактография (латеральный срез): обозначены желтым цветом AF, фиолетовым — FAT, зеленым цветом выделена опухоль. AF расположен по внутренней границе опухоли и тесно прилежит к ней; е — интраоперационное фото: 3 — зона Брока; 0 — дугообразный пучок; ж, з — МРТ после операции в первые 72 ч в T2- и DWI-режимах (аксиальные срезы). Стрелкой обозначена гемостатическая метка (оставленный в полости ложа по внутреннему контуру опухоли фрагмент гемостатической марли в зоне найденных при электрической стимуляции речевых нарушений — область дугообразного пучка; и — послеоперационная МР-трактография (аксиальный срез): желтым цветом обозначен AF, фиолетовым — FAT, зеленым цветом выделена послеоперационная полость.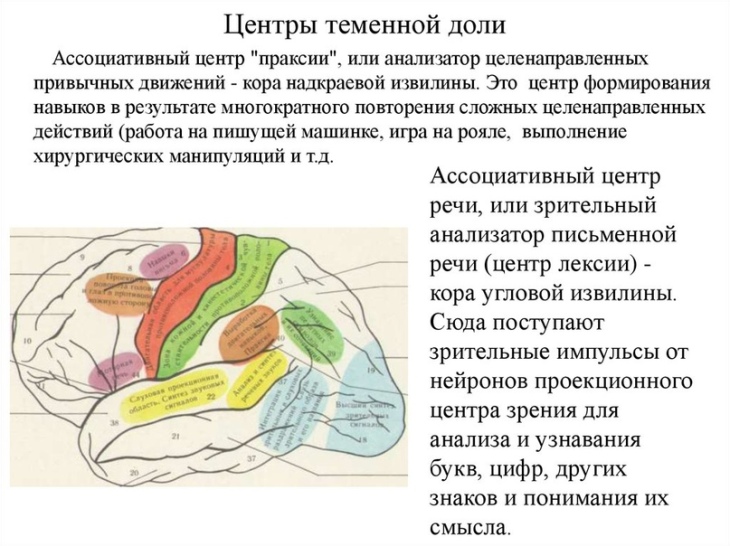
Осмотр нейропсихологом до операции: речевые функции в норме; слухоречевая и зрительная память — нижняя граница нормы. Произведено удаление опухоли левой лобной доли с электрофизиологическим мониторингом и пробуждением. Во время операции проведено картирование коры мозга: кверху от опухоли выявлена зона Брока (отмечалась остановка речи). Непосредственно к концу резекции опухоли при электростимуляции в области нижнелатеральной поверхности операционного ложа на глубине около 3,5 см от коры появились речевые нарушения в виде неправильного называния действий, отдельных персевераций; видимых остатков опухоли в этой области не было. Топографически эта зона в ложе удаленной опухоли соответствовала ходу комплекса SLF/AF (что также соответствовало как до, так и послеоперационной МР-трактографии). После операции на МРТ с контрастированием опухоль удалена тотально; при обследовании нейропсихологом речевых нарушений не выявлено. Гистологический диагноз: анапластическая олигодендроглиома.
Клинический пример 2
Пациентка М., 60 лет (наблюдение № 4). Поступила в клинику с общемозговой симптоматикой. При МРТ до операции выявлена глиома задних отделов нижней лобной извилины слева. При нейропсихологическом исследовании до операции речь и письмо в норме, отмечены только четкие дефекты слухоречевой памяти с нарушением избирательности следов и расстройства динамического праксиса. Синдром соответствовал поражению задних отделов левой лобной доли.
Во время операции выявлена корковая моторная зона руки (рис. 3).
Рис. 3. Магнитно-резонансная томография головного мозга пациентки М. а, б — МРТ с контрастным усилением до операции в Т1- и Т2-режимах, аксиальные срезы; в — позитронно-эмиссионная томография головного мозга с метионином: индекс накопления РФП 1,3; г — функциональная МРТ: оранжевым цветом обозначена зона Брока; д, е — предоперационная МР-трактография: зеленым цветом обозначен пирамидный тракт, голубым — аркуатный пучок; ж — интраоперационное фото: 0 — двигательная зона правой руки; з — интраоперационное фото: видимая флуоресценция опухоли; и — интраоперационное фото: выявленный при электростимуляции в глубине опухолевого ложа дугообразный пучок; к — МРТ с контрастным усилением в первые 72 ч после операции, аксиальный срез; л, м — послеоперационная МР-трактография: зеленым цветом обозначен пирамидный тракт, голубым — аркуатный пучок.
При субкортикальной электростимуляции на глубине около 4 см от коры выявлены специфические ошибки в назывании действий, изображенных на картинках. Специфичность состояла в том, что больная использовала для обозначения действий, предъявленных на картинках, глаголы, очень далекие по семантике от правильных. Например, больная при показе картинки, где девочка гладит кошку, говорила: «Чешет землю», при показе картинки, где девочка чистит зубы, говорила: «Гладит песок».
После операции на 2-е сутки отмечались эфферентная моторная афазия с вербальными персеверациями, нарушение называния со специфическими для комплекса SLF/AF и вербальными парафазиями схожего характера. Нарушения речи имели четкие признаки поражения как лобной, так и височной доли, что можно было связать с поражением комплекса SLF/AF. При контрольной МРТ с контрастированием после операции отмечается субтотальное удаление опухоли.
Окончательный гистологический диагноз: диффузная астроцитома Grade II.
Клинический пример 3
Пациентка К., 48 лет (наблюдение № 9). Диагноз опухоли левой лобной доли установлен 9 лет назад после единичного судорожного приступа, который в дальнейшем не повторялся. Пациентка все это время воздерживалась от операции и находилась под динамическим наблюдением. При очередном МРТ-контроле головного мозга выявлено значительное увеличение размеров опухоли. Опухоль имела следующую локализацию: префронтальные отделы и полюс левой лобной доли — средние и передние отделы средней лобной и частично верхней лобной извилин. Осмотр нейропсихологом до операции: речь в норме, другие когнитивные функции сохранны. Произведено удаление опухоли левой лобной доли с электрофизиологическим мониторингом и пробуждением. Во время операции, ближе к концу резекции опухоли, в области задней поверхности операционного ложа на глубине около 3 см от коры появились спонтанные речевые нарушения в виде единичных литеральных парафазий.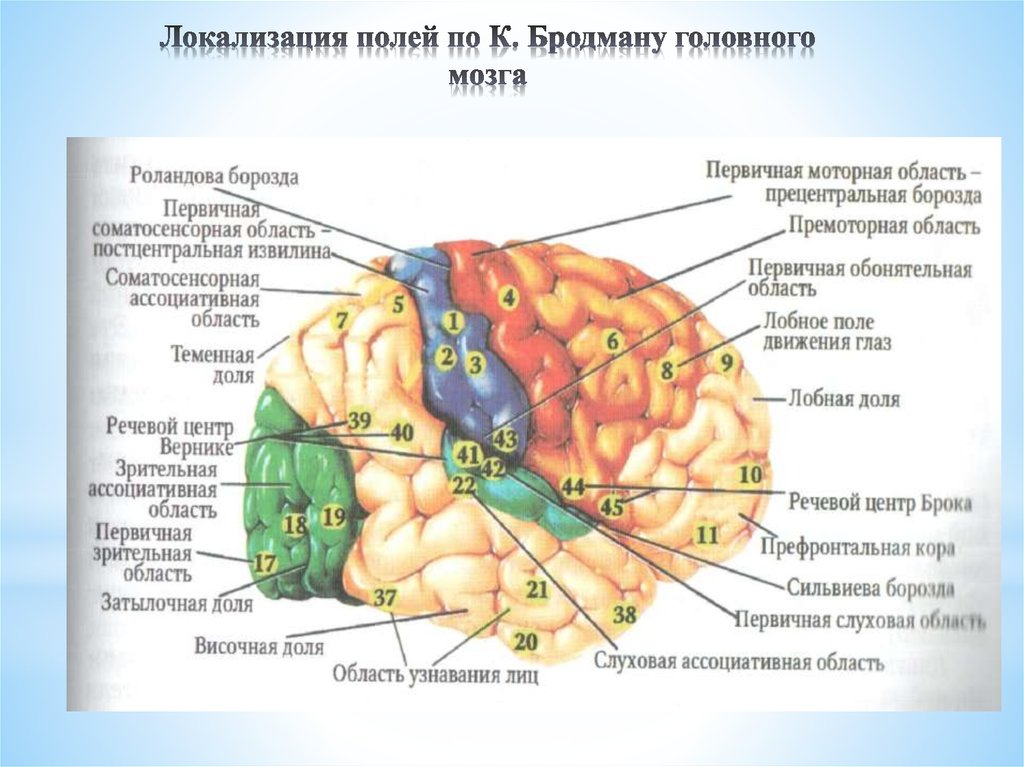 Сразу в этой зоне проведена электрическая стимуляция, во время которой отмечались речевые нарушения в виде множественных персевераций и парафазий, в связи с чем в этой области был оставлен фрагмент опухоли. Выявленная зона топографически могла соответствовать ходу лобного косого пучка (FAT), связывающего кору медиальной поверхности лобной доли и зону Брока. Об этом свидетельствуют и данные как до, так и послеоперационной МР-трактографии. Однако в 1-е сутки у больной отмечался более сложный синдром речевых нарушений, состоящий из эфферентной моторной и акустико-мнестической (номинативной) афазии, особенно проявляющийся на произвольном уровне (при проведении проб). Больная плохо называла как объекты, так и действия, при этом постоянно персеверировала. Характерно, что при персеверациях называла те же глаголы, что и при стимуляции во время операции. Височный компонент афазии при проведении операции в области средней и верхней лобной извилин корково-подкоркового уровня левой лобной доли говорит о разобщении лобной и височной долей за счет повреждения комплекса SLF/AF.
Сразу в этой зоне проведена электрическая стимуляция, во время которой отмечались речевые нарушения в виде множественных персевераций и парафазий, в связи с чем в этой области был оставлен фрагмент опухоли. Выявленная зона топографически могла соответствовать ходу лобного косого пучка (FAT), связывающего кору медиальной поверхности лобной доли и зону Брока. Об этом свидетельствуют и данные как до, так и послеоперационной МР-трактографии. Однако в 1-е сутки у больной отмечался более сложный синдром речевых нарушений, состоящий из эфферентной моторной и акустико-мнестической (номинативной) афазии, особенно проявляющийся на произвольном уровне (при проведении проб). Больная плохо называла как объекты, так и действия, при этом постоянно персеверировала. Характерно, что при персеверациях называла те же глаголы, что и при стимуляции во время операции. Височный компонент афазии при проведении операции в области средней и верхней лобной извилин корково-подкоркового уровня левой лобной доли говорит о разобщении лобной и височной долей за счет повреждения комплекса SLF/AF. Это может быть обусловлено большими размерами опухоли и развитием послеоперационного отека в зоне расположения также SLF/AF, а не только FAT. Результаты обследования и выявленные нарушения даны на рис. 4.
Это может быть обусловлено большими размерами опухоли и развитием послеоперационного отека в зоне расположения также SLF/AF, а не только FAT. Результаты обследования и выявленные нарушения даны на рис. 4.
Рис. 4. Магнитно-резонансная томография головного мозга пациентки К. а, б — МРТ до операции в Т1- и Т2-режимах, аксиальные срезы; в — фМРТ — оранжевым цветом обозначена зона Брока; г — предоперационная МР-трактография: желтым цветом обозначен AF, синим — FAT, опухоль выделена зеленым цветом. FAT расположен по задней границе опухоли и тесно прилежит к ней; д — интраоперационное фото: 0, 2, 3, 41 — зоны нарушений речи в ложе раны, полученные при прямой электрической стимуляции; обращает на себя внимание топография выявленных зон, соответствующая ходу волокон FAT; е — МРТ после операции в первые 72 ч. Стрелкой обозначена гемостатическая метка (оставленный в полости ложа по заднему контуру опухоли фрагмент гемостатической марли в зоне найденных при электрической стимуляции речевых нарушений), ж — послеоперационная МР-трактография: желтым цветом обозначен AF, синим — FAT, зеленым цветом выделены остатки опухоли.
В данном клиническом примере интересным представляется картирование FAT. Интраоперационно у пациентки отмечено развитие персевераций и парафазий, данные речевые нарушения могли быть вызваны вследствие электрической стимуляции FAT, который связывает дополнительную моторную кору и зону Брока. И выявленный ход волокон тракта во время операции анатомически соответствовал ходу FAT по заднему контуру опухоли, полученному при МР-трактографии. Однако в послеоперационном периоде за счет больших размеров опухоли и развития перифокального отека отмечалось появление клиники поражения комплекса SLF/AF с выходом на первый план афазии височного типа.
Обсуждение
Современное понимание нейроанатомической основы языковых функций было установлено через модели, включающие много областей коры головного мозга, функционирующих как часть большой сети, и в том числе состоящие из верхней лобной извилины, нижней теменной дольки, средней височной извилины, нижней области височной доли и других трактов белого вещества, таких как SLFs, IFOFs, и волокон в глубинных отделах лобной доли [21].
Следует отметить, что в целом функция проводящих путей белого вещества изучена не так хорошо, как корковых структур мозга. Одна из причин этого связана с ограничениями исследований, в которых обычно трудно найти пациента с избирательным поражением определенного тракта. Кроме того, хотя кора может быть картирована с помощью поверхностных электродов, например как метод дооперационного исследования у больных с эпилепсией или опухолями головного мозга, подкорковые волокна таким способом оценить нелегко [22].
Зона стимуляции считается функционально значимой, когда отмечаются речевые нарушения три раза подряд после последующих стимулов, при этом после окончания стимуляции отмечается восстановление речевой функции. Тип речевых нарушений верифицируется нейропсихологом, а характер и степень выраженности речевых нарушений оцениваются исходя из применяемых тестов. Следующим этапом выполняется резекция опухоли с учетом данных картирования, при этом проводится периодическая субкортикальная стимуляция для поиска функционально значимых проводящих путей белого вещества.
Таким образом, использование интраоперационного картирования и электрофизиологического мониторинга позволяет хирургам максимально удалить объем патологического очага с сохранением неврологических функций и достижением минимального процента послеоперационных осложнений [23—25].
Лобная доля является самой большой долей мозга человека, ее объем составляет до 40% от объема всего мозга, а по локализации глиом она занимает первое место относительно других долей мозга [10]. Основные ассоциативные тракты лобной доли включают верхний продольный пучок (SLF), разделяющийся на три сегмента (SLF I, II, III), лобный косой пучок (FAT) и нижний лобно-затылочной тракт (IFOF), поражение которого в данной работе мы не рассматривали. В ранее выполненных работах была показана вариативная анатомия данных пучков [14, 16].
В нашей серии из 12 пациентов все опухоли были локализованы в левой лобной доле. В группу входили 7 пациентов с глиомами низкой степени злокачественности (Grade II) и 5 — с глиомами высокой степени злокачественности (Grade III—IV).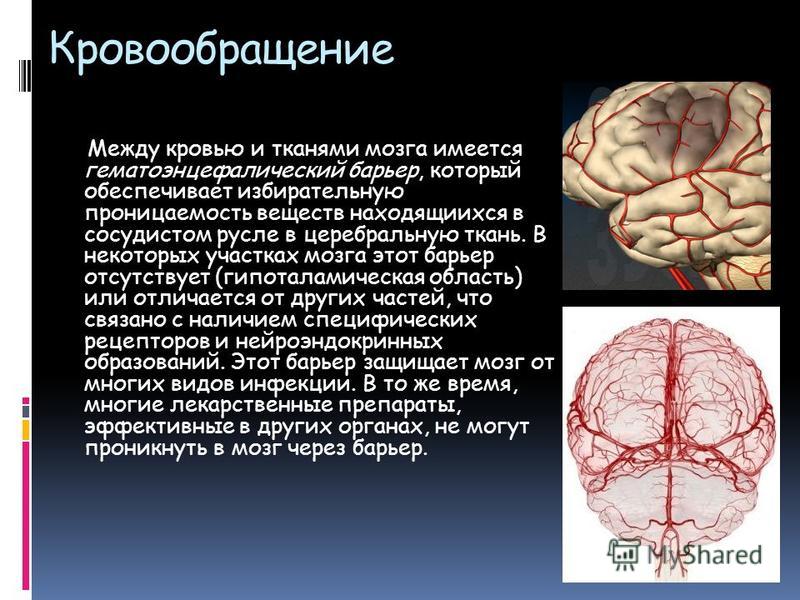 В 6 наблюдениях при удалении опухоли в субкортикальных отделах возникли речевые нарушения без проведения прямой электрической стимуляции. У 8 пациентов речевые нарушения возникали во время электростимуляции. Характер речевых нарушений был разным. У 1 пациентки нарушение речи носило отсроченный (на 2-е сутки) и обратимый характер. На наш взгляд, это может быть связано с транзиторным перифокальным отеком ввиду близкого расположения волокон SLF/AF. Симптоматика полностью регрессировала на фоне противоотечной терапии.
В 6 наблюдениях при удалении опухоли в субкортикальных отделах возникли речевые нарушения без проведения прямой электрической стимуляции. У 8 пациентов речевые нарушения возникали во время электростимуляции. Характер речевых нарушений был разным. У 1 пациентки нарушение речи носило отсроченный (на 2-е сутки) и обратимый характер. На наш взгляд, это может быть связано с транзиторным перифокальным отеком ввиду близкого расположения волокон SLF/AF. Симптоматика полностью регрессировала на фоне противоотечной терапии.
В этом исследовании мы наблюдали воспроизводимые речевые симптомы у 8 пациентов во время электрической стимуляции белого вещества лобной доли. Наши результаты показали, что у 11 пациентов возникли речевые нарушения без моторных нарушений со стороны конечностей или языка (кроме 1 наблюдения с развитием в послеоперационном периоде правостороннего гемипареза). Это означает, что афатические нарушения не были связаны с поражением двигательного компонента (коры и пирамидного тракта).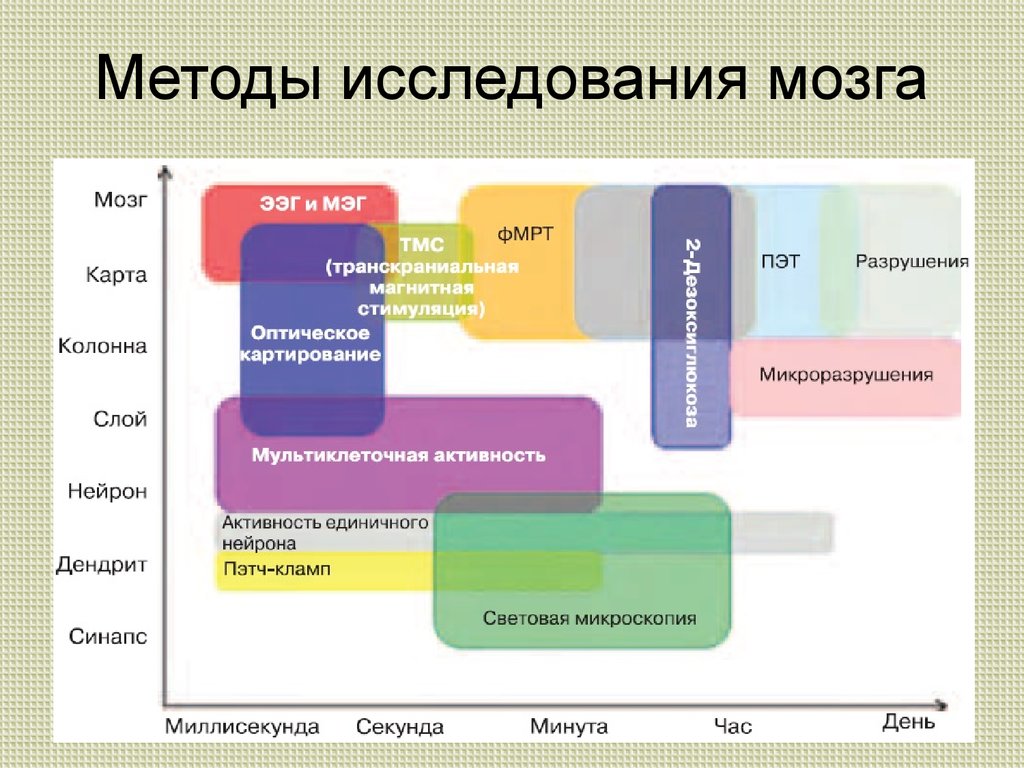
У всех пациентов (кроме 1 пациентки, наблюдение № 7) после операции отмечалось нарастание речевых нарушений. Примечательно, что в большинстве случаев афазия носила комплексный характер и сочетала очаговую симптоматику поражения как лобной, так и височной доли, а у 1 пациента (наблюдение № 5) — лобной и теменной долей. Это указывает на частичное повреждение длинных ассоциативных трактов, приводящее к симптомам разобщения указанных долей мозга. Описанные нами речевые нарушения полностью соответствуют представленным в литературе описаниям проводниковой афазии [26—28].
Как правило, если интраоперационное повреждение негрубое и неполное, речевые нарушения имеют преходящий характер и регрессируют в период от нескольких дней до нескольких недель. Особое значение в этих ситуациях имеет работа логопеда в послеоперационном периоде.
Таким образом, у 11 из 12 пациентов в послеоперационном периоде отмечались различные варианты речевых нарушений, несмотря на то что во время операции с пробуждением исследуемые тракты были идентифицированы и это служило основанием для прекращения резекции опухоли. Наши результаты соответствуют данным мировой литературы, согласно которым у пациентов с частотой до 95% наблюдаются речевые нарушения после операций с пробуждением. (Такие операции в принципе выполняются при близости речевых корковых зон или речевых трактов.) При методично выполненной резекции с картированием тракта речевые нарушения регрессируют в течение 3 мес после операции и остаются перманентными только у 5% пациентов.
Наши результаты соответствуют данным мировой литературы, согласно которым у пациентов с частотой до 95% наблюдаются речевые нарушения после операций с пробуждением. (Такие операции в принципе выполняются при близости речевых корковых зон или речевых трактов.) При методично выполненной резекции с картированием тракта речевые нарушения регрессируют в течение 3 мес после операции и остаются перманентными только у 5% пациентов.
В одном из наблюдений отмечалась невозможность построения c помощью МР-трактографии части волокон комплекса SLF/AF в самой опухоли. При измерении расстояния от поверхности коры до волокон тракта на дооперационных снимках мы видим несоответствие с расстоянием от тракта до коры, измеренным во время операции. Тракт был выявлен на более близком расстоянии к коре, что указывает на невозможность построения волокон длинных ассоциативных трактов в самой опухоли. Любая предоперационная трактография является условной (это математическая модель), поскольку имеет существенные ограничения в построении волокон, проходящих внутри опухоли.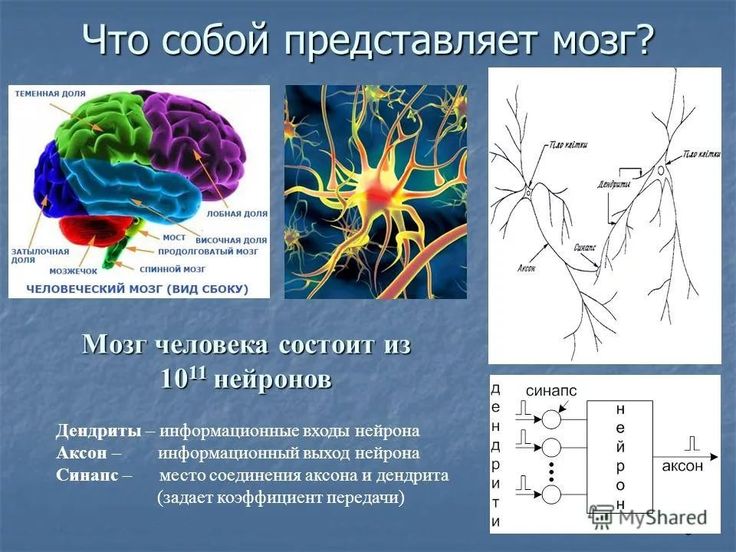
Ряд исследователей при интраоперационной стимуляции используют различную силу тока (от 2 до 10 мА) и различную амплитуду импульсов. K. Seidel и соавт. [29] предлагают остановить резекцию опухоли при ответе на стимуляцию с силой тока 2 мА. H. Duffau и соавт. [30] также используют силу тока 2 мА и считают метод прямой электростимуляции безопасным, точным и надежным для идентификации проводящих путей. Как известно, сила тока имеет прямую взаимозависимость с расстоянием, на которое он распространяется; с примерным соотношением 1 мм — 1 мА («золотое правило» нейрофизиологии) [31]. Большое значение имеют параметры и сила тока при стимуляции ассоциативных трактов. В нашей серии наблюдений сила тока составила 2—5 мА, что соответствует данным зарубежных авторов.
У пациентов со злокачественными глиомами достоверно чаще до операции присутствует очаговая неврологическая симптоматика. В случае наличия вблизи опухоли длинных ассоциативных трактов или функциональной корковой речевой зоны — это, как правило, афазия.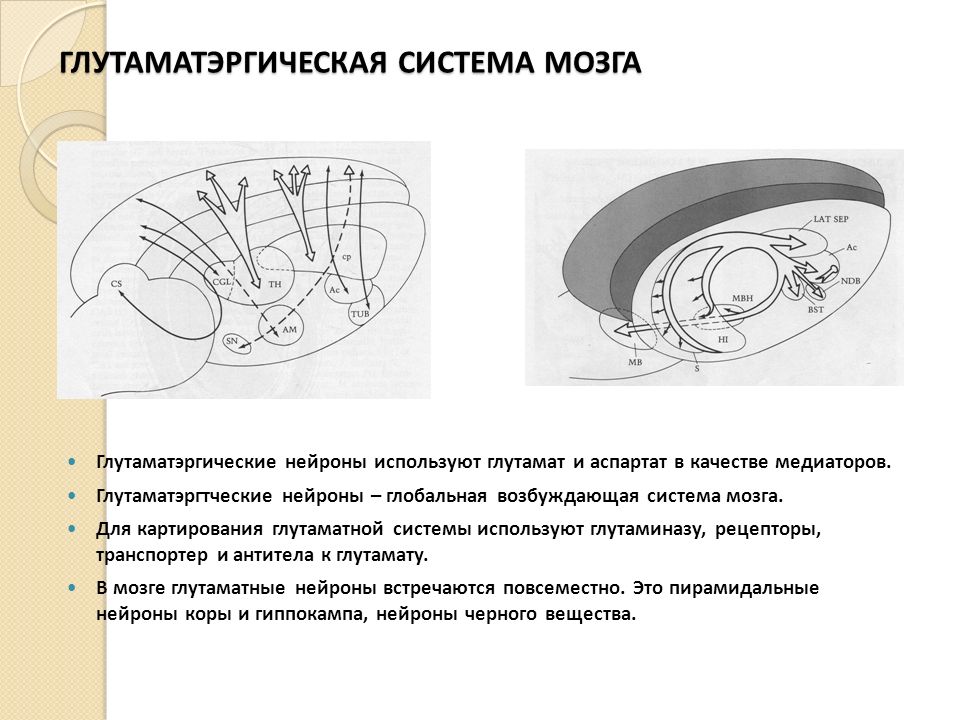 При грубой афазии до операции краниотомия в сознании противопоказана. В то же время при инфильтративном характере роста опухоли в ее структуру могут вовлекаться длинные ассоциативные тракты, функция которых может быть сохранена, особенно при доброкачественных глиомах [32]. При злокачественных глиомах в белом веществе имеется зона деструкции с уже сформированным очаговым неврологическим дефицитом. При глиомах низкой степени злокачественности основным симптомом до операции являются фокальные эпилептические приступы, афатические нарушения встречаются крайне редко, что увеличивает сложность операции и требует обязательного картирования не только корковых зон, но и длинных ассоциативных трактов.
При грубой афазии до операции краниотомия в сознании противопоказана. В то же время при инфильтративном характере роста опухоли в ее структуру могут вовлекаться длинные ассоциативные тракты, функция которых может быть сохранена, особенно при доброкачественных глиомах [32]. При злокачественных глиомах в белом веществе имеется зона деструкции с уже сформированным очаговым неврологическим дефицитом. При глиомах низкой степени злокачественности основным симптомом до операции являются фокальные эпилептические приступы, афатические нарушения встречаются крайне редко, что увеличивает сложность операции и требует обязательного картирования не только корковых зон, но и длинных ассоциативных трактов.
В нашей серии у 9 из 12 пациентов во время операций был найден комплекс SLF/AF. Мы считаем необоснованным дифференцировать эти тракты во время операции ввиду близкого их топографоанатомического расположения и параллельного хода волокон. Отличие этих путей состоит в том, что волокна SLF переключаются в теменной зоне Гешвинда, в то время как волокна AF идут напрямую из лобной доли в височную. Кроме того, во время операции сложно идентифицировать сегменты SLF ввиду их близкого расположения друг к другу и схожести неврологических симптомов поражения. Однако в ряде работ [33] показаны анатомическое разделение волокон SLF и AF и возможность отличия отдельных сегментов SLF. На наш взгляд, изучение хода волокон на анатомических препаратах является необходимым для нейрохирурга-нейроонколога, однако в реальной операционной ситуации идентификация отдельных близко расположенных трактов друг от друга, а тем более их сегментов вряд ли возможна. В связи с этим мы можем согласиться с мнением ряда коллег о целесообразности интраоперационной идентификации волокон SLF и AF в комплексе. Это обусловлено не только близостью и контурами их хода, но и схожей симптоматикой их поражения [32].
Кроме того, во время операции сложно идентифицировать сегменты SLF ввиду их близкого расположения друг к другу и схожести неврологических симптомов поражения. Однако в ряде работ [33] показаны анатомическое разделение волокон SLF и AF и возможность отличия отдельных сегментов SLF. На наш взгляд, изучение хода волокон на анатомических препаратах является необходимым для нейрохирурга-нейроонколога, однако в реальной операционной ситуации идентификация отдельных близко расположенных трактов друг от друга, а тем более их сегментов вряд ли возможна. В связи с этим мы можем согласиться с мнением ряда коллег о целесообразности интраоперационной идентификации волокон SLF и AF в комплексе. Это обусловлено не только близостью и контурами их хода, но и схожей симптоматикой их поражения [32].
Таким образом, спорной остается сама клиническая значимость такой глубокой интраоперационной дифференциальной диагностики поражения конкретных сегментов ассоциативных проводящих путей, поскольку поражение любого из вышеописанных пучков является показанием к остановке резекции опухоли вне зависимости от конкретно затронутого сегмента. Несмотря на это, понимание топографии вышеуказанных пучков и их функции может дать ценные интраоперационные сведения о степени вовлечения каждого конкретного сегмента и повлиять на решение о продолжении резекции опухоли.
Несмотря на это, понимание топографии вышеуказанных пучков и их функции может дать ценные интраоперационные сведения о степени вовлечения каждого конкретного сегмента и повлиять на решение о продолжении резекции опухоли.
Выводы
1. При внутримозговых опухолях лобной доли доминантного по речи полушария целесообразно выполнять МР-трактографию с построением длинных ассоциативных трактов (комплекса SLF/AF и FAT) для оценки их взаимоотношений с опухолью и их электрофизиологическую идентификацию в условиях краниотомии в сознании.
2. В хирургии опухолей лобной доли доминантного полушария в условиях сознания после идентификации функционально значимых корковых структур на всех этапах удаления опухоли целесообразно осуществлять непрерывный речевой контакт с пациентом, дополняя его электрической стимуляцией, поскольку высока вероятность развития речевых нарушений в результате повреждения проводящих путей. Сегментация волокон SLF и разделение волокон SLF от AF в условиях реальной операционной ситуации затруднительны.
3. В большинстве наблюдений в раннем послеоперационном периоде у пациентов наблюдается нарастание речевых нарушений (у 11 из 12 пациентов). Указанные речевые нарушения в дальнейшем регрессируют у подавляющего большинства пациентов.
4. При повреждении длинных ассоциативных трактов доминантного полушария во время операции может наблюдаться синдром разобщения лобной, височной и реже теменной долей с развитием сложных комплексных видов афазий, которые могут нарастать в раннем послеоперационном периоде.
Благодарности: авторы выражают благодарность за помощь в подготовке публикации студентам В.А. Тюрину и С.Н. Беляеву (ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва) и ординатору А.В. Кондрашову (ФГАОУ ВО «Первый московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва).
Статья выполнена при поддержке грантов РФФИ № 16−04−01419 «Динамические исследования микроструктуры и пластичности кортикоспинальных трактов на модели травматического и опухолевого поражения мозга человека с использованием методов диффузионно-куртозисной магнитно-резонансной томографии, диффузии с высоким угловым разрешением и бесконтрастной магнитно-резонансной перфузии», гранта РФФИ № 18−29−01−032 «Исследование индивидуальной вариабельности функциональной интеграции областей мозга при глиальных опухолях для предоперационного неинвазивного картирования» и гранта РФФИ № 17−00−00158 КОМФИ «Исследование клинических и молекулярно-генетических паттернов глиом головного мозга человека с длительным периодом общей выживаемости».
Ограничения:
Промежуток follow-up оказался недостаточным у пациентов, оперированных в 2017 г. (меньше 12 мес). В исследование не входят левши. Мы не рассматривали пациентов с билатеральным речевым представительством при опухолях субдоминантного полушария и перекрестные афазии.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
*e-mail: [email protected]
Комментарий
Одной из важных проблем в нейроонкологии является хирургическая тактика при лечении глиом функционально значимых зон головного мозга. Основное внимание в нейрохирургии уделяется картированию коры мозга. В меньшей степени изучены и внедрены в практику методы картирования проводящих путей, особенно длинных ассоциативных трактов мозга. Данные проводники обеспечивают важнейшие функции мозга человека, что было подтверждено рядом работ (H. Duffau и соавт., M. Berger и соавт., S. Sarubbo и соавт., 2015).
Статья авторов обобщает опыт картирования комплекса верхнего продольного и аркуатного трактов у 12 пациентов с глиомами левой лобной доли. Авторы логично продолжают обобщать клинические наблюдения после 2 предыдущих публикаций, посвященных анатомии длинных ассоциативных трактов (С.А. Горяйнов, В.Ю. Жуков, А.А. Потапов, 2014 и 2017 гг.).
Авторы логично продолжают обобщать клинические наблюдения после 2 предыдущих публикаций, посвященных анатомии длинных ассоциативных трактов (С.А. Горяйнов, В.Ю. Жуков, А.А. Потапов, 2014 и 2017 гг.).
Приводят обзор литературы и клинические примеры, обращая внимание на детали картирования длинных ассоциативных трактов, особенности нейропсихологических тестов и послеоперационных нарушений речи. Работа иллюстрирована клиническими примерами пациентов с глиомами левой лобной доли с интраоперационной идентификацией комплекса верхнего продольного и аркуатного трактов.
Материал авторов пока что невелик, следует продолжить это значимое исследование; из рекомендаций — следует включить больных с глиомами головного мозга, вовлекающими другие длинные ассоциативные тракты.
Данная работа является первой в отечественной литературе по представленной теме и будет полезна практикующим нейрохирургам, занимающимся лечением пациентов с внутримозговыми опухолями головного мозга, что позволит повысить безопасность и эффективность оперативных вмешательств.
В.Л. Пучков (Москва)
Объяснение картирования мозга | Типы МРТ
Объяснение картирования мозга
Как нейровизуализация влияет на терапию и лечение
Лица, нуждающиеся в лечении зависимости, когнитивных расстройств или других заболеваний, могут получить пользу от процедур картирования мозга в таких клиниках, как Институт здоровья Дж. Флауэрса. С помощью картирования мозга психологи и врачи могут лучше понять, как работает мозг их клиентов, и разработать персонализированные, эффективные планы лечения, которые приводят к долгосрочным результатам и облегчению.
Что такое картирование мозга?
Картирование мозга включает в себя множество методов и технологий, используемых для изучения, сканирования и картирования электрической активности в мозге. Инструменты картирования мозга могут либо изучать структуру или функции мозга, исследуя физическое расположение мозга, либо измеряя, где и как происходит электрическая активность в его тканях. 1
1
История картирования мозга
Картирование мозга как отдельный метод лечения и область технологии началось в конце 1970-х годов, когда были созданы как методы МРТ или магнитно-резонансной томографии, так и КТ или компьютерной томографии.
Эти технологии были намного менее вредными и инвазивными, чем другие типы методов картирования мозга того времени, такие как процессы, которые включали дренаж спинномозговой жидкости и замену ее воздухом для картирования структуры мозга с помощью рентгеновских лучей.
Прогресс в области картирования мозга продолжался только в последующие десятилетия. Теперь есть несколько различных методов лечения и технологий, которые врачи могут использовать для точного картирования внутренней части мозга, измерения электрической активности и получения большего уровня детализации, чем когда-либо прежде.
Типы сканирования мозга
Врачи могут использовать различные методы сканирования мозга, включая МРТ. МРТ — не единственный вид сканирования головного мозга, но один из самых распространенных. Они неинвазивны и предоставляют массу информации для медицинских работников.
МРТ — не единственный вид сканирования головного мозга, но один из самых распространенных. Они неинвазивны и предоставляют массу информации для медицинских работников.
Медицинские работники также могут использовать электроэнцефалографию или сканирование ЭЭГ, при которых используются металлические датчики и шапочка на голове для измерения электрической активности головного мозга. Кроме того, при лечении QEEG берутся измерения, полученные при типичном сканировании ЭЭГ, и обрабатываются эти электрические паттерны с помощью программного обеспечения и формул для количественного анализа.
При правильном выполнении ЭЭГ и/или квЭЭГ могут быть очень полезны для врачей и психологов, стремящихся лучше понять, как мозг их клиентов функционирует на наносекундном уровне. Эта информация, в свою очередь, позволяет разрабатывать персонализированные и эффективные планы лечения зависимостей, неврологических расстройств и многого другого.
Основы картирования мозга
Что в мозгу можно картировать?
При проведении теста в мозгу клиента могут быть отображены различные условия или факторы.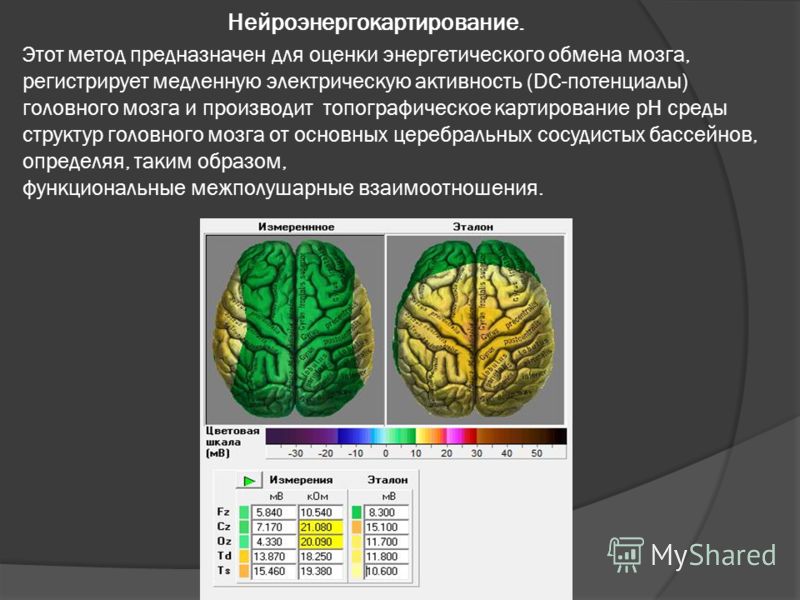 К ним относятся:
К ним относятся:
Память:
Воспоминания могут быть отображены или обнаружены с помощью электрического сканирования, такого как сканирование ЭЭГ. С помощью этих методов можно изучить мозг клиента, чтобы определить, где хранятся определенные воспоминания, как мозг вспоминает разные воспоминания и какое влияние эти воспоминания оказывают на другие неврологические процессы.
Обучение:
Психологи и врачи могут использовать картирование мозга, чтобы определить, как клиент учится и где хранится информация. Его также можно использовать для выявления препятствий к обучению из-за неврологических состояний, таких как зависимости, когнитивная негибкость и т. д.
Старение:
Картирование мозга можно использовать для обнаружения эффектов старения в сознании, как структурных, так и функциональных, а также для определения того, как лекарства или другие вещества могут вызывать преждевременное старение и ткани головного мозга.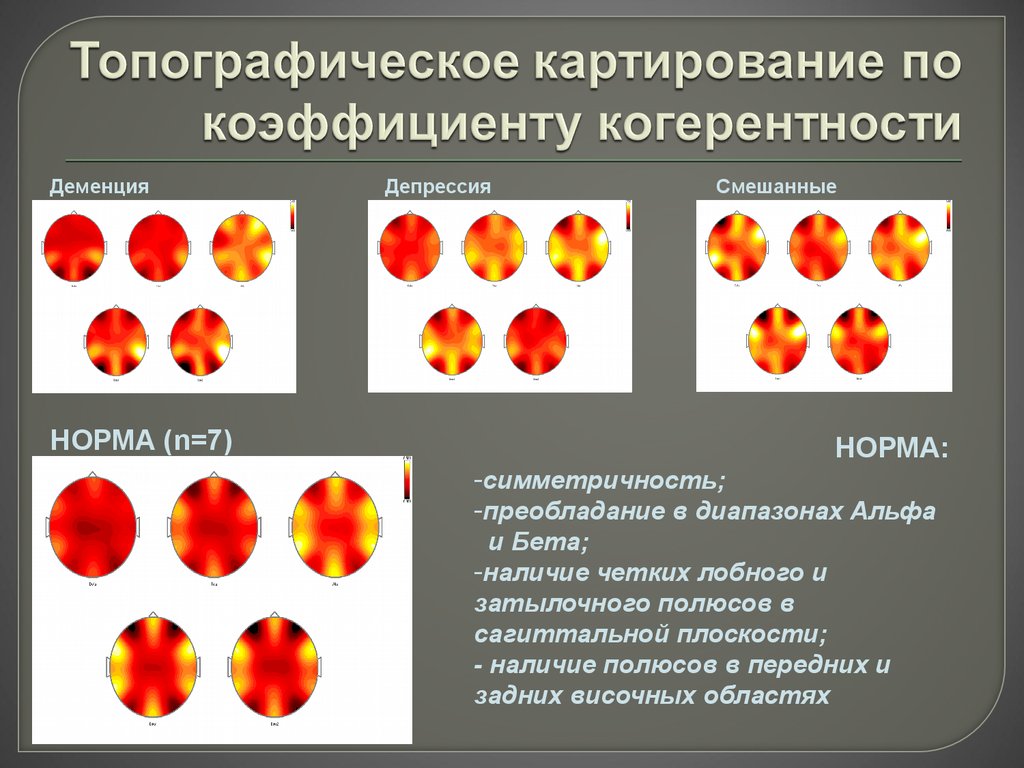
Воздействие лекарств:
Картирование мозга можно использовать для выявления эффектов старения в сознании, как структурных, так и функциональных, а также для выявления того, как лекарства или другие вещества могут вызывать преждевременное старение и ткани головного мозга.
В общем и целом, картирование мозга — это очень важный метод, который могут и должны использовать специалисты по здоровому образу жизни и психологи, чтобы оказывать наилучшую возможную помощь своим клиентам.
Как работает МРТ?
Типы МРТ
Существует пять основных типов МРТ, которые могут проводить врачи. К ним относятся:
ФМРТ или функциональная магнитно-резонансная томография:
Этот метод включает использование магнитных полей для создания радиосигналов, которые отражаются от различных атомных ядер внутри мозга пациента. Измеряя радиосигналы, врачи могут создать подробную карту структуры мозга.
Сканирование груди:
Как следует из названия, МРТ-сканирование груди используется для выявления рака молочной железы у клиентов с помощью тех же методов, которые описаны выше.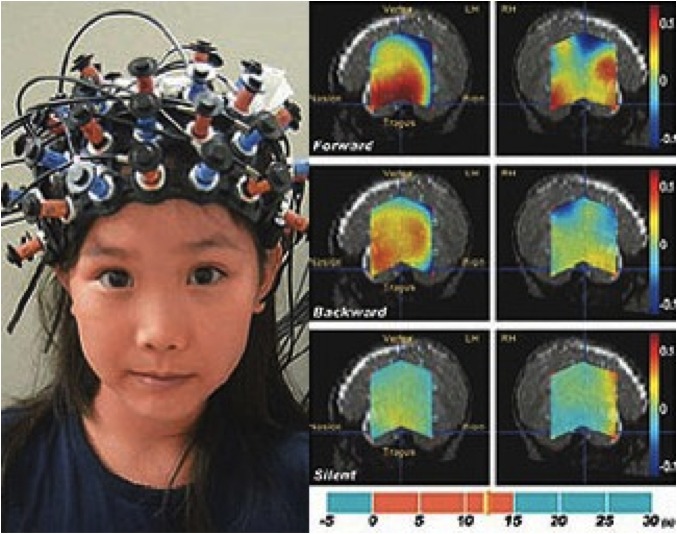
МРА или магнитно-резонансная ангиография:
В этой неинвазивной процедуре используется МРТ и внутривенное введение контрастных красителей для визуализации кровеносных сосудов. Эта процедура приводит к тому, что некоторые кровеносные сосуды выглядят непрозрачными, а МРТ-изображения помогают врачам в их анализах и диагностике.
MRV или магнитно-резонансная венография
В методах MRV используются большие магниты и радиочастоты для получения подробных изображений структур и органов по всему телу. Они также могут использовать внутривенный контрастный краситель для визуализации вен клиентов.
МРТ сердца
МРТ сердца использует радиочастоты и магниты для получения подробных изображений структур сердца, что полезно для диагностики рака сердца, сердечно-сосудистых заболеваний и т. д.
5 типов мозговых волн
Наряду с использованием МРТ методы картирования мозга или методы лечения могут включать анализ пяти основных типов мозговых волн.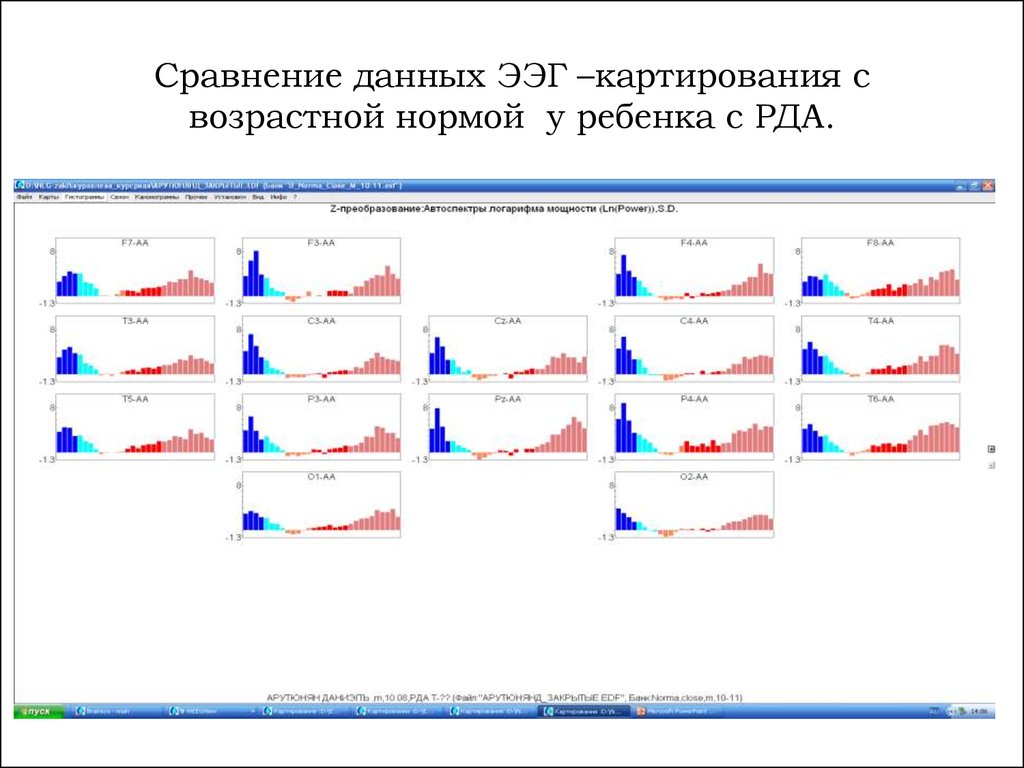 Мозговые волны могут быть проанализированы для лучшего понимания потребностей клиентов или моделей мышления, а также для разработки эффективных планов лечения. Пять основных типов мозговых волн: 2
Мозговые волны могут быть проанализированы для лучшего понимания потребностей клиентов или моделей мышления, а также для разработки эффективных планов лечения. Пять основных типов мозговых волн: 2
Дельта-волны
, которые имеют самую высокую амплитуду и самую медленную и которые в основном возникают в глубоком сне.
Тета-волны
, возникающие во время циклов быстрого сна или во время интенсивного расслабления, например, во время мечтаний или медитации.
Альфа-волны
, которые возникают, когда ум бодр и сознателен, но все еще относительно расслаблен.
Бета-волны
, которые возникают, когда мозг бодрствует и бодрствует, а также когда люди взволнованы или возбуждены.
Гамма-волны
, которые имеют самую низкую амплитуду, но самые быстрые из мозговых волн. Они создаются, когда человек пытается решить проблему или вынужден интенсивно концентрироваться на конкретной задаче.
Важность картирования мозга для выявления заболеваний
Картирование мозга имеет решающее значение для выявления причин и методов лечения различных расстройств, в том числе:
Физические расстройства:
С помощью методов структурной визуализации мозга картирование мозга может помочь врачам обнаружить наличие опухолей или других повреждений головного мозга, пока не стало слишком поздно.
Эмоциональные расстройства:
Некоторые методы картирования мозга, особенно те, которые измеряют электрическую активность, могут определить происхождение или модели мышления, лежащие в основе эмоциональных состояний, включая зависимость.
Когнитивные расстройства:
Картирование мозга может помочь психологам и врачам найти основные причины когнитивных расстройств, таких как депрессия, тревога, потеря памяти и т. д.
Какие расстройства можно картировать с помощью нейровизуализации?
С помощью нейровизуализации нейробиологи и другие медицинские работники могут диагностировать широкий спектр заболеваний.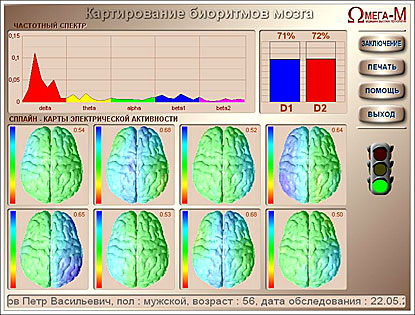 К ним относятся такие расстройства, как шизофрения или клиническая депрессия. Однако сканирование мозга используется только для предоставления информации клиентам и медицинским работникам. Информация должна быть использована правильно для разработки хорошей методики лечения, дающей долгосрочные результаты.
К ним относятся такие расстройства, как шизофрения или клиническая депрессия. Однако сканирование мозга используется только для предоставления информации клиентам и медицинским работникам. Информация должна быть использована правильно для разработки хорошей методики лечения, дающей долгосрочные результаты.
Как подготовиться к сеансу qEEG
Несмотря на то, что сеансы qEEG не являются надежными, каждый клиент должен убедиться, что сеанс прошел успешно. Клиент может подготовиться к сеансам QEEG, следуя приведенному ниже списку правил и запретов.
- Хорошо выспитесь и позавтракайте перед визитом, чтобы отвлекающие факторы или недостаток сна не влияли на активность мозга.
- Запланируйте сеанс квЭЭГ, когда вы, скорее всего, будете бодрствовать, например, утром перед рабочим днем.

- Вымойте волосы, не добавляя гель для укладки или другие средства для волос, чтобы предотвратить помехи при сканировании ЭЭГ.
- Приходите заранее, чтобы не беспокоиться о другой встрече или других обязанностях.
- Снимите контактные линзы перед сеансами квЭЭГ.
- Старайтесь сохранять спокойствие и бдительность на протяжении всего сеанса картографирования, чтобы получать наиболее точную и полезную информацию.
НЕ ДЕЛАЙТЕ:
- Попытаться поторопиться с картированием QEEG.

- Чрезмерное движение.
- Опоздать или не явиться на прием.
Чего ожидать от сеанса ЭЭГ
Преимущества картирования мозга
Картирование мозга может быть невероятно полезным как для клиентов, так и для врачей, особенно когда речь идет о лечении когнитивных расстройств или лечении зависимостей.
Например, картирование мозга можно использовать в сочетании с нейробиоуправлением. Благодаря этой революционной терапии пациенты знакомятся с результатами сканирования QEEG и работают со своими психологами или поставщиками медицинских услуг, чтобы отучить свой мозг от вредных привычек или нездоровых моделей мышления. Картирование мозга обеспечивает прямой путь к пониманию своего разума на более глубоком уровне, чем когда-либо прежде. 3
3
ABC13 Функциональный IQ Чонси Гловера подскочил на 21 балл после картирования мозга
Чонси Гловер прошел картирование мозга, чтобы увидеть, как это может помочь в решении проблем, с которыми он сталкивается с тех пор, как два года назад заразился COVID-19. Вот как это было.
ЧИТАТЬ ДАЛЕЕ
Покрывает ли страховка картирование мозга?
Страховка иногда может покрывать картирование мозга. Различные поставщики страховых услуг покрывают сеансы картирования мозга или встречи на основе:
- Их общая политика покрытия
- Для чего предназначен сеанс картирования мозга
- На какой тип сеанса картирования мозга записывается клиент
Клиенты, рассматривающие возможность картирования мозга для лечения одного или нескольких заболеваний, должны говорить своему страховому провайдеру, чтобы определить, будет ли их план частично или полностью покрывать встречу.
Почему стоит выбрать J. Flowers для картирования мозга?
Институт здоровья Дж. Флауэрса — лучший выбор для борьбы с зависимостью или поиска эффективных планов лечения различных когнитивных расстройств, включая депрессию и тревогу. В Институте здоровья Дж. Флауэрса мы стремимся к максимальной конфиденциальности наших клиентов и знаем, что индивидуальное медицинское обслуживание часто является наиболее успешным.
С этой целью мы работаем с каждым из наших клиентов, чтобы разработать индивидуальный и уникальный подход к их оздоровительным потребностям. Наряду с другими методами у нас есть возможности и опыт, необходимые для максимально эффективного использования методов картирования/нейровизуализации мозга.
Свяжитесь с Институтом здоровья J. Flowers для получения дополнительной информации о методах картирования мозга и о том, как мы можем помочь в лечении зависимости, диагностике когнитивных расстройств и многом другом.
Ресурсы
- https://www.
 uclahealth.org/neurology/brain-mapping
uclahealth.org/neurology/brain-mapping - https://www.ncbi.nlm.nih.gov/books/NBK539805/#:~:text=Однако%2C%20%20наиболее%20часто%20используется, бета%20 (от 13%20 до%2030 Гц).
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4892319/
QEEG Картирование мозга при СДВГ, аутизме и др.
Институт Дрейка использует qEEG (количественную электроэнцефалограмму) картирование мозга в течение 23 лет в качестве важного диагностического теста при обследовании пациентов с СДВ/СДВГ, расстройствами аутистического спектра, расстройствами обучения, тревогой, Депрессия и посттравматическое стрессовое расстройство.
Как медицинская клиника, Институт Дрейка разработал одну из крупнейших клинических баз данных, использующих картирование мозга qEEG для нейробиоуправления в Соединенных Штатах. По сути, процесс картирования мозга qEEG обеспечивает «неинвазивное окно в функционирование мозга», позволяя клиницистам определить источник симптомов или нарушения регуляции в мозге. В Институте Дрейка наши клиницисты используют эту информацию для создания максимально эффективных протоколов лечения нейробиоуправления, чтобы помочь нашим пациентам улучшить качество своей жизни, не полагаясь на использование лекарств.
В Институте Дрейка наши клиницисты используют эту информацию для создания максимально эффективных протоколов лечения нейробиоуправления, чтобы помочь нашим пациентам улучшить качество своей жизни, не полагаясь на использование лекарств.
Картирование мозга QEEG аналогично тому, как врач делает бактериальную культуру у пациента с инфекцией, чтобы определить, какой антибиотик лучше всего подходит для лечения этой инфекции. Кроме того, карта мозга сообщает нам, связаны ли симптомы с неврологическими причинами. Когда симптомы неврологически связаны, существует высокая вероятность успеха лечения с использованием нейробиоуправления и комплексной программы FullCare Института Дрейка.
Как работает картирование мозга?
19 датчиков размещаются на поверхности головы, и активность мозговых волн регистрируется над этими 19 датчиками.области. Картирование мозга является неинвазивным (в отличие от сканирования ОФЭКТ или ПЭТ) и безболезненным. Подобно термометру, который только регистрирует вашу температуру, но не влияет на нее, карта мозга записывает только электрическую активность мозга для анализа; на самом деле он ничего не делает с самим мозгом. Записи карты мозга обрабатываются в одобренной FDA нормативной базе данных для сравнения с «нормальными» результатами, что позволяет нам идентифицировать любые аномальные области, которые потребуют особого внимания во время нейробиоуправления.
Записи карты мозга обрабатываются в одобренной FDA нормативной базе данных для сравнения с «нормальными» результатами, что позволяет нам идентифицировать любые аномальные области, которые потребуют особого внимания во время нейробиоуправления.
Подобно другим лабораторным тестам в клинической медицине, карта мозга qEEG выполняется для сравнения карты мозга пациента с нормальной активностью мозга для людей их возрастной группы. Подобно анализу крови на функцию щитовидной железы, который покажет, находится ли уровень гормонов щитовидной железы в пределах нормы, низкий (гипотиреоз) или аномально повышенный (гипертиреоз) по сравнению с группой пациентов с нормальным функционированием щитовидной железы, процесс карты мозга покажет, находится ли ваш уровень гормонов щитовидной железы в нормальном диапазоне. активность мозга находится в пределах нормы или каким-то образом нарушена регуляция.
Картирование мозга также можно сравнить с выполнением врачом ЭКГ (электрокардиограммы) у взрослого пациента, страдающего от боли в груди и одышки, чтобы определить причину этих симптомов.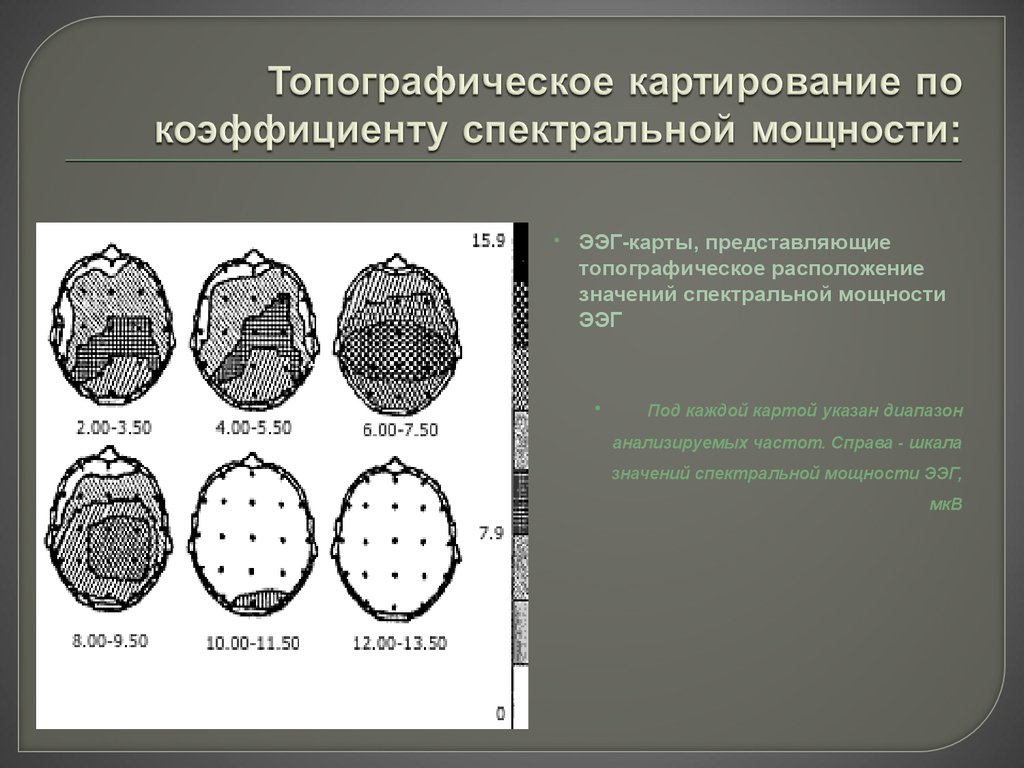 В Институте Дрейка мы используем карту мозга qEEG для пациентов с симптомами СДВГ или расстройства аутистического спектра, происходящими из головного мозга, чтобы мы могли определить основную причину этих симптомов. Когда у пациента появляются симптомы, связанные с проблемой сердца, врач оценивает сердце (поскольку оно является источником симптомов). Когда в Институт Дрейка приходят пациенты с симптомами, связанными с СДВГ или расстройством аутистического спектра, мы проводим оценку аналогичного типа, но мы будем оценивать мозг (источник симптомов СДВГ или расстройства аутистического спектра).
В Институте Дрейка мы используем карту мозга qEEG для пациентов с симптомами СДВГ или расстройства аутистического спектра, происходящими из головного мозга, чтобы мы могли определить основную причину этих симптомов. Когда у пациента появляются симптомы, связанные с проблемой сердца, врач оценивает сердце (поскольку оно является источником симптомов). Когда в Институт Дрейка приходят пациенты с симптомами, связанными с СДВГ или расстройством аутистического спектра, мы проводим оценку аналогичного типа, но мы будем оценивать мозг (источник симптомов СДВГ или расстройства аутистического спектра).
Процесс картирования мозга обнаружит, если какая-либо область мозга дисфункциональна или нарушена регуляция. Иногда симптомы вызваны областью или областями мозга, которые недостаточно активны, проявляя чрезмерно медленные мозговые волны, которые вызывают нарушение функционирования и симптомы. И наоборот, у меньшего процента пациентов будут проявляться симптомы из-за области или областей его / ее мозга, которые чрезмерно стимулированы, показывая слишком много быстрых мозговых волн. Любая аномалия нарушает нормальное или оптимальное функционирование и может вызывать клинические симптомы.
Любая аномалия нарушает нормальное или оптимальное функционирование и может вызывать клинические симптомы.
Мозг состоит из множества «функциональных сетей», состоящих из нейронов или клеток мозга, работающих вместе синхронно для выполнения специализированной функции. Благодаря достижениям в области неврологии, которые интегрированы в наш анализ карты мозга, мы также можем видеть, функционируют ли различные функциональные сети в мозге в пределах нормы. На сегодняшний день эта технология является передовой в науке и клинической практике как для картирования мозга при СДВГ, так и для картирования мозга при расстройствах аутистического спектра.
Например, существуют мозговые сети для регулирования внимания, исполнительных функций (организация, расстановка приоритетов, управление временем и т. д.), рабочей памяти, настроения, обработки речи (выразительной и рецептивной) и понимания невербальных социальных сигналов (важные у пациентов с расстройствами аутистического спектра).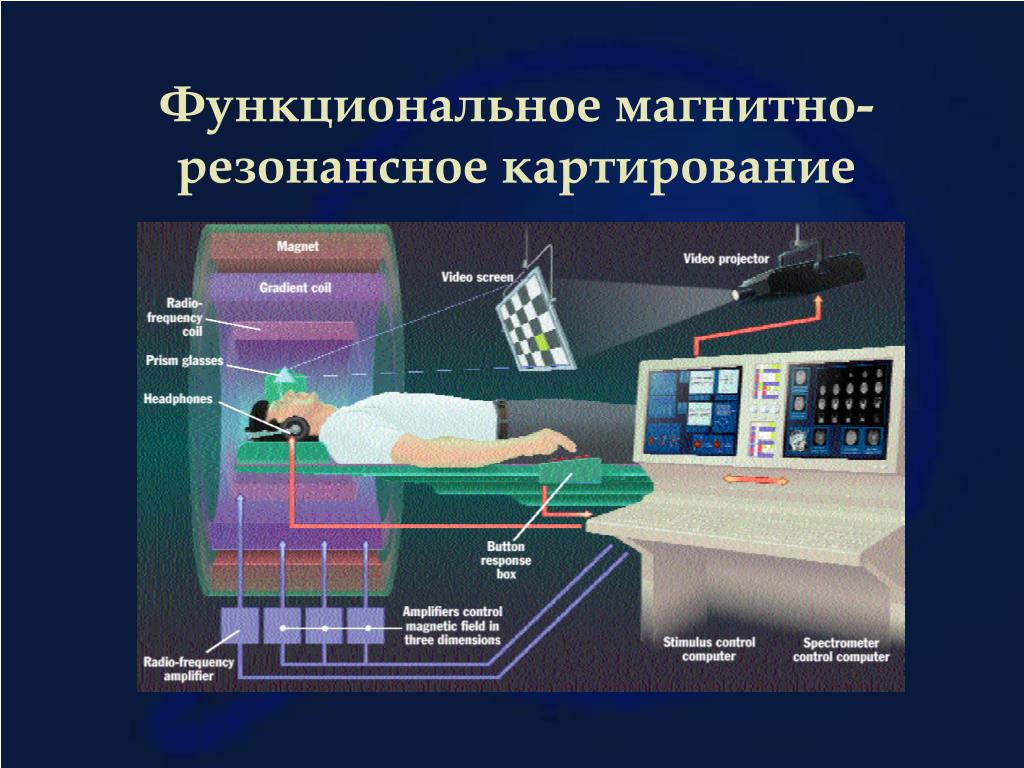 Эти разные сети взаимодействуют друг с другом для обмена информацией, чтобы мозг мог оптимально выполнять сложные задачи. Этот процесс можно представить как аналог компании с 19различные менеджеры, которым всем необходимо общаться и координировать друг с другом, чтобы поддерживать оптимальную и эффективную работу компании. Мозг ничем не отличается.
Эти разные сети взаимодействуют друг с другом для обмена информацией, чтобы мозг мог оптимально выполнять сложные задачи. Этот процесс можно представить как аналог компании с 19различные менеджеры, которым всем необходимо общаться и координировать друг с другом, чтобы поддерживать оптимальную и эффективную работу компании. Мозг ничем не отличается.
Исследования в области неврологии показали, что функциональные связи между областями мозга являются ключевыми для оптимального функционирования мозга. Анализ карты мозга qEEG измеряет «когерентность» между различными областями, что указывает на здоровье или нормальность функциональных связей между этими областями мозга; другими словами, он измеряет, насколько хорошо различные области мозга взаимодействуют друг с другом для выполнения сложных задач. Например, должна быть адекватная «когерентная» связь между сетями внимания, слуховой и визуальной обработки в мозгу, чтобы быть хорошим читателем с правильным пониманием.
Картирование мозга при СДВГ и расстройствах аутистического спектра
При СДВГ и расстройствах аутистического спектра симптомы часто являются результатом неправильного подключения или нарушения регуляции в определенной сети мозга, но они также могут быть результатом отказа некоторых сетей. работать вместе для осуществления сложного умственного функционирования или поведенческого/эмоционального контроля. Хотя неправильное подключение/нарушение регуляции может быть значительным при СДВГ, оно, как правило, еще более выражено при расстройствах аутистического спектра. Мозг буквально функционирует в хаосе, ему не хватает эффективной связи между различными областями или сетями, что приводит к тому, что ребенок перегружается даже обычными требованиями.
работать вместе для осуществления сложного умственного функционирования или поведенческого/эмоционального контроля. Хотя неправильное подключение/нарушение регуляции может быть значительным при СДВГ, оно, как правило, еще более выражено при расстройствах аутистического спектра. Мозг буквально функционирует в хаосе, ему не хватает эффективной связи между различными областями или сетями, что приводит к тому, что ребенок перегружается даже обычными требованиями.
Как картирование мозга используется в лечении?
На основе анализа карты мозга разрабатываются протоколы нейробиоуправления, направленные на определенные симптомы, связанные с функциональными сетями в мозге, которые, как было показано, являются аномальными или нерегулируемыми. Например, если у ребенка с СДВГ есть проблемы с поддержанием концентрации на нежелательных задачах, а «сеть внимания» на анализе карты мозга qEEG показывает значительные отклонения, то лечение с помощью нейробиоуправления будет направлено на улучшение функционирования и связей в областях «сети внимания». которые слабы или нарушены. Кроме того, мы также направим нейробиоуправление на работу по улучшению связей между сетью внимания и другими соответствующими сетями, необходимыми для обеспечения оптимального функционирования мозга для концентрации.
которые слабы или нарушены. Кроме того, мы также направим нейробиоуправление на работу по улучшению связей между сетью внимания и другими соответствующими сетями, необходимыми для обеспечения оптимального функционирования мозга для концентрации.
Если в лобной области мозга наблюдаются чрезмерно медленные мозговые волны и у пациента есть трудности с концентрацией внимания, то у нас есть «соответствие», чтобы помочь ему/ей с помощью нейробиоуправления, обучая лобную долю более нормальному регулированию для устойчивой концентрации.
Другой пример: правая височная область участвует в эмоциональной регуляции, поэтому, если она неисправна, мы ожидаем, что у ребенка будут трудности с эмоциональной регуляцией или низкая устойчивость к фрустрации. Опять же, здесь мы можем помочь ребенку с нейробиоуправлением укрепить эту область, чтобы улучшить эмоциональную регуляцию.
У пациентов с СДВГ с похожими симптомами затруднений с устойчивой концентрацией внимания, выполнением задач и/или нарушением импульсивного контроля будут проявляться различные дисбалансы или аномалии на их индивидуальных картах мозга, которые являются уникальными для нарушения регуляции их мозга. Карта мозга подобна отпечатку пальца мозга. Следовательно, протоколы нейробиоуправления для каждого пациента будут разными и индивидуальными, чтобы улучшить их специфическую дисрегуляцию, связанную с симптомами.
Карта мозга подобна отпечатку пальца мозга. Следовательно, протоколы нейробиоуправления для каждого пациента будут разными и индивидуальными, чтобы улучшить их специфическую дисрегуляцию, связанную с симптомами.
Ограничения для медикаментозного лечения
Это то, что дает пациентам Института Дрейка наилучшие возможности для долгосрочного улучшения или устранения симптомов, чего не может дать медикаментозное лечение. Лекарства не обладают таким уровнем лечебной специфичности. Кроме того, хотя лекарства могут и часто обеспечивают временное подавление симптомов, они не помогают переобучить мозг самостоятельно генерировать стабильные, более здоровые паттерны мозговых волн, которые уменьшат симптомы в долгосрочной перспективе. Лечение на основе нейробиоуправления делает именно это, поэтому наши методы лечения могут привести к долгосрочному положительному улучшению.
Как нейробиоуправление с картой мозга улучшает качество жизни?
Родителям важно понимать, что ребенок или подросток с СДВГ или расстройством аутистического спектра не обладает нейрофизическими способностями адекватно удовлетворять некоторые нормальные потребности, с которыми они сталкиваются в повседневной жизни. Это помогает объяснить, почему они могут быть эмоционально перегружены легче, чем дети с нормальной функцией мозга, а также почему ребенок/подросток с СДВГ теряет мотивацию для выполнения нежелательных задач. Это очень расстраивает пациента, и сторонний наблюдатель часто не понимает и не ценит того, что нарушенная нейрофизическая способность ребенка ограничивает его способность к саморегуляции.
Это помогает объяснить, почему они могут быть эмоционально перегружены легче, чем дети с нормальной функцией мозга, а также почему ребенок/подросток с СДВГ теряет мотивацию для выполнения нежелательных задач. Это очень расстраивает пациента, и сторонний наблюдатель часто не понимает и не ценит того, что нарушенная нейрофизическая способность ребенка ограничивает его способность к саморегуляции.
Протоколы нейробиоуправления Института Дрейка, основанные на картах мозга, позволяют пациентам укреплять связи в своем мозгу, что приводит к повышению эффективности и скорости обработки информации как внутри, так и между сетями или областями мозга. Обычно это приводит к уменьшению негативных симптомов. Программа нейробиоуправления Института Дрейка на основе карты мозга основана на принципе «безопасности и эффективности» клинической медицины и соблюдает его.
Картирование мозга при аутизме показало аномальную когерентность или паттерны связности в языковых областях мозга. Таким образом, у аутичных детей можно было бы ожидать сниженного речевого развития, что обычно является основным дефицитом при аутизме. Мы также часто обнаруживаем аномальные паттерны мозговых волн и связность в правой задней области мозга у детей/подростков с расстройством аутистического спектра. Это неудивительно, так как эта область мозга участвует в понимании невербальных социальных сигналов и выражений лица или чувств других людей. У детей с диагнозом «расстройство аутистического спектра» эта часть мозга является первоочередной для анализа, а затем для укрепления с помощью лечения, если на карте мозга обнаруживаются дисбалансы.
Мы также часто обнаруживаем аномальные паттерны мозговых волн и связность в правой задней области мозга у детей/подростков с расстройством аутистического спектра. Это неудивительно, так как эта область мозга участвует в понимании невербальных социальных сигналов и выражений лица или чувств других людей. У детей с диагнозом «расстройство аутистического спектра» эта часть мозга является первоочередной для анализа, а затем для укрепления с помощью лечения, если на карте мозга обнаруживаются дисбалансы.
Жизненный опыт пациента отличается, когда его мозг работает нормально, а не когда он работает нерегулируемым образом.
Без картирования мозга клиницист не может точно знать, являются ли симптомы неврологическими или просто психологическими/поведенческими. Если это неврология, то карта мозга точно определяет, какие паттерны мозговых волн и функциональные связи являются ненормальными, а также где эта аномалия существует. Проанализировав карты мозга тысяч пациентов в Институте Дрейка, нам повезло, что у нас есть обширная уникальная база данных клинического лечения, из которой мы можем извлечь информацию для более успешного лечения пациентов.
Наш медицинский директор, Дэвид Велкофф, доктор медицинских наук, магистр искусств, разрабатывает индивидуальные протоколы нейробиоуправления Института Дрейка для каждого конкретного пациента, и обычно мы можем добиться значительного клинического улучшения у 80% людей, которые обращаются к нам за помощью.
Чтобы получить помощь, которая нужна вам или близкому вам человеку, позвоните сейчас, чтобы записаться на бесплатную консультацию по скринингу — позвоните по номеру 800-700-4233.
Научные исследования QEEG картирования мозга и СДВ/СДВГ.
- Общество биологической психиатрии: Торможение у детей с синдромом дефицита внимания/гиперактивности: психофизиологическое исследование задачи «Стоп»
- Клиническая нейрофизиология: данные ЭЭГ в пользу новой концепции синдрома дефицита внимания и гиперактивности
- Международный журнал психофизиологии: одновременные измерения ЭЭГ и ЭДА при синдроме дефицита внимания и гиперактивности у подростков
- Психиатрические исследования: Избыточная бета-активность у детей с синдромом дефицита внимания/гиперактивности: атипичная электрофизиологическая группа (PDF)
«Дэвид Ф. Велкофф, доктор медицинских наук, наш медицинский директор и соучредитель, курирует все процедуры оценки и программы лечения. Он признан врачом-первопроходцем в использовании биологической обратной связи, картирования мозга qEEG, нейробиоуправления и нейромодуляции в лечении СДВГ, расстройств аутистического спектра и заболеваний, связанных со стрессом, включая тревогу, депрессию, бессонницу и высокое кровяное давление.
Велкофф, доктор медицинских наук, наш медицинский директор и соучредитель, курирует все процедуры оценки и программы лечения. Он признан врачом-первопроходцем в использовании биологической обратной связи, картирования мозга qEEG, нейробиоуправления и нейромодуляции в лечении СДВГ, расстройств аутистического спектра и заболеваний, связанных со стрессом, включая тревогу, депрессию, бессонницу и высокое кровяное давление.
Доктор Дэвид Велкофф получил степень магистра психологии в Калифорнийском государственном университете в Лос-Анджелесе в 1975 лет и степень доктора медицины в Медицинской школе Университета Эмори в Атланте в 1976 году. Затем доктор Велкофф завершил интернатуру по акушерству и гинекологии с факультативом по неврологии в Медицинском центре Калифорнийского университета в Ирвине. Затем он переключил свою специализацию на нейрофизическую медицину и прошел начальную подготовку в области биологической обратной связи/нейрофидбэка в нейрофизической медицине у ведущих врачей мира в области биологической обратной связи в известной клинике Меннингера в Топике, штат Канзас. В 19В 80 лет он стал соучредителем Института нейрофизической медицины Дрейка.
В 19В 80 лет он стал соучредителем Института нейрофизической медицины Дрейка.
Стремясь лучше понять связь между болезнью и сознанием, д-р Велькофф работал клиническим руководителем международного исследования психонейроиммунологии в Медицинской школе Калифорнийского университета в Лос-Анджелесе, Отделении микробиологии и иммунологии и Институте Пастера в Париже. Это было продолжением более раннего клинического сотрудничества с Медицинской школой Калифорнийского университета в Лос-Анджелесе, которое продемонстрировало, как лечение стресса в Институте Дрейка привело к улучшению иммунного функционирования активности естественных клеток-киллеров.
Доктор Велькофф был одним из основателей и помощников редактора научного издания Journal of Neurotherapy. Он был приглашенным лектором в Детской больнице Лос-Анджелеса, Калифорнийском университете в Лос-Анджелесе, Медицинском центре Cedars Sinai, Центре психического здоровья Thalias, больнице Св. Иоанна в Санта-Монике,
Калифорния и ЧАДД. Он был медицинским консультантом по нейрофизической медицине для CNN, National Geographic Channel, Discovery Channel, Univision и PBS».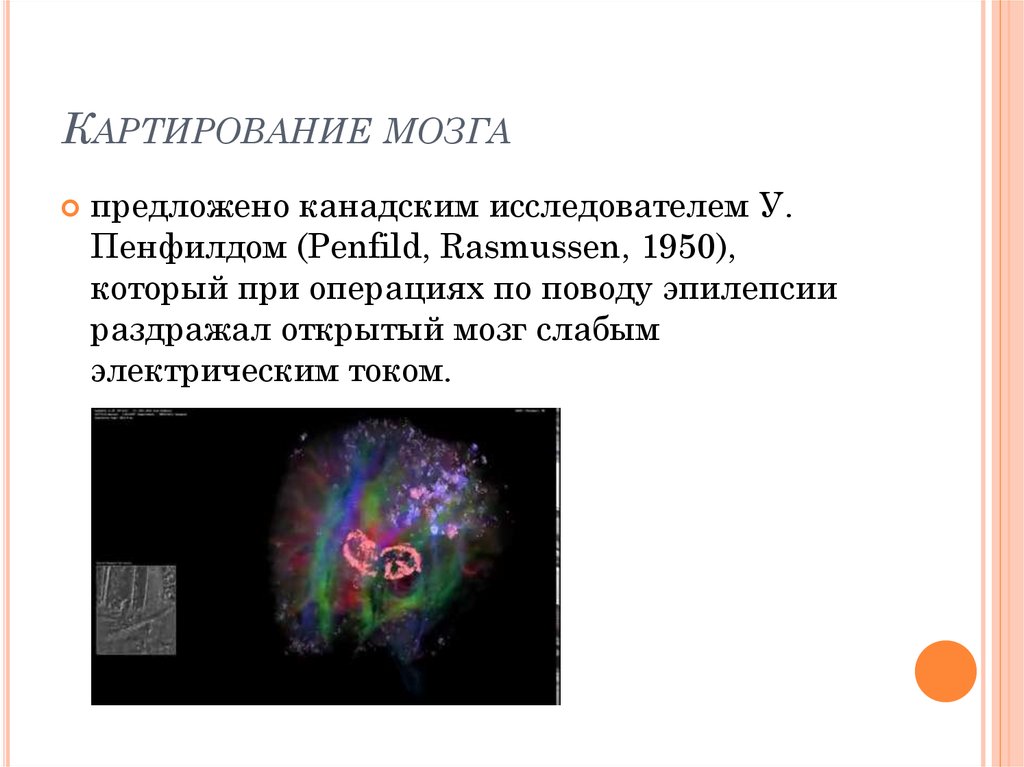
Подробнее о том, что делает Институт Дрейка уникальным
Как картирование мозга помогает бороться с тревогой, депрессией и СДВГ с помощью нейробиоуправления
Загрузите и поделитесь версией в формате PDF
Пятьдесят лет назад, когда нейробиоуправление было в зачаточном состоянии, картирования мозга еще не существовало. Серьезные практики довольно хорошо определили, какие области играют роль в таких состояниях, как СДВГ, сон, тревога и проблемы с обучением. Однако, когда появилось картирование ЭЭГ мозга (известное как кЭЭГ), стало возможным более точно проводить обучение нейробиоуправлению.
Сегодня с помощью карт мозга специалисты по нейробиоуправлению могут видеть, какие области мозга работают не так, как должны. Эта информация помогает создать более целенаправленное обучение для решения проблем с мозгом, которые могут получить пользу от нейробиоуправления.
В двух словах, сложное картирование мозга с помощью qEEG помогает выявить, что происходит внутри вашего мозга.
Что такое нейробиоуправление? Нейробиоуправление — это биологическая обратная связь для мозга. Он использует современные компьютерные технологии для регулирования и стабилизации работы мозга, чтобы улучшить когнитивные функции, внимание, настроение, тревогу, сон и поведение. Это достигается без использования
лекарств.
Я использую технологию картирования мозга в Центре мозга для создания целевых протоколов тренировки мозга с 2001 года. С годами технология нашего центра развивалась вместе с наукой на благо наших клиентов.
Карта мозга может помочь вам понять это, поэтому вот два примера:
Первый показывает мозг 23-летнего мужчины, у которого были проблемы со слушанием и концентрацией внимания. Он также не любил читать. Красный цвет в середине указывает на то, что у него чрезмерная медленная активность (6-9Гц). Чрезмерная медленная активность мешает вниманию и является обычным паттерном для СДВГ. Это также часто связано с людьми, которые не любят читать, потому что им трудно обращать внимание на содержание. Мы научили этого клиента уменьшать чрезмерное количество медленной активности, и его внимание и способность к чтению улучшились.
Мы научили этого клиента уменьшать чрезмерное количество медленной активности, и его внимание и способность к чтению улучшились.
Изображения ниже сделаны двумя людьми. На карте слева показан мозг человека с длительной историей депрессии. Оранжевые и желтые области указывают на избыточную активность медленных мозговых волн, типичную для человека с депрессией. На картинке справа показан нормальный мозг.
Эти примеры позволяют легко увидеть, как этот тип очень специфической информации может быть мощным инструментом для разработки более точного протокола обучения нейробиоуправлению.
Зачем обращаться в Центр мозга за картой мозга?
Несмотря на важность картирования мозга, не каждая практика нейробиоуправления предлагает его. Для проведения карты мозга требуется специальное оборудование, а также технические знания и навыки. Кроме того, требуется большой опыт, чтобы интерпретировать результаты и иметь возможность разрабатывать индивидуальные протоколы для каждого клиента с использованием этих результатов.
Также важно отметить, что не все сервисы qEEG одинаковы. Для менее опытных практиков доступны менее сложные карты. Они не предоставляют обширную информацию, которую предоставляют четыре типа кЭЭГ Центра мозга.
И, наконец, не все, кто предлагает услуги qEEG, обладают глубоким опытом и пониманием qEEG, которые предлагает Center for Brain.
Важно изучить уровень опыта практикующего, прежде чем составлять карту мозга.
Всем ли мы рекомендуем карту мозга?
Нет. Ситуация некоторых людей не оправдывает стоимость карты, которая может составлять от 295 до 695 долларов. Некоторые распространенные проблемы, такие как бессонница, могут так быстро реагировать на нейробиоуправление без гиперцелевых протоколов, что делать карту не имеет смысла.
При этом мы проводим карты примерно 80% наших клиентов, потому что информация, которую мы получаем от нее, может значительно повысить скорость и эффективность их обучения.
Однако обычно нам не требуется ни у кого карта для получения наших услуг.
Вы задаетесь вопросом, почему ваш лечащий врач не составил карту мозга и не порекомендовал ее вам?
Большинство психиатров и специалистов в области психического здоровья не используют картирование мозга, потому что оно не является частью их обычных инструментов. Проведение КЭЭГ требует огромного обучения и очень технично. Они также могут недостаточно знать о картировании мозга, чтобы чувствовать себя комфортно, рекомендуя его.
Запись на консультацию
Если вам интересно узнать, подходит ли вам карта мозга qEEG, свяжитесь с нами сегодня, чтобы записаться на консультацию.
«Мозг обладает огромной способностью к самовосстановлению. Мы можем помочь этому случиться. Картирование мозга — один из наших ключевых инструментов». – Майк Коэн
Личные истории
Вот две истории наших клиентов, иллюстрирующие ценность карты мозга: Мальчик, у которого все-таки не было синдрома дефицита внимания. Родители нашего 11-летнего клиента.
пять лет пытались выяснить, что не так с их сыном. Он испытывал как академические, так и социальные проблемы. За эти годы его трижды обследовали несколько специалистов и докторов медицины, в результате чего диагнозы были неопределенны, а вариант лечения был только один: стимулирующие препараты.
Как только мы составили карту мозга и добавили результаты к другим данным тестирования, диагноз синдрома Аспергера стал ясен. Его карта также указывала на то, что стимулирующие лекарства не следует использовать, несмотря на то, что все врачи прописали ему.
Итог: Как только мы узнали, в чем проблема, мы смогли правильно ее решить, и он стал намного лучше учиться и социально.
Тревожный мужчина, у которого не было тревожного расстройства Мужчина, которого мы лечили, большую часть своей жизни страдал от беспокойства. Противотревожные препараты не помогли, и качество его жизни сильно ухудшилось.
Карта мозга показала, что в его мозгу есть проблемы с сенсорной интеграцией.

 uclahealth.org/neurology/brain-mapping
uclahealth.org/neurology/brain-mapping пять лет пытались выяснить, что не так с их сыном. Он испытывал как академические, так и социальные проблемы. За эти годы его трижды обследовали несколько специалистов и докторов медицины, в результате чего диагнозы были неопределенны, а вариант лечения был только один: стимулирующие препараты.
пять лет пытались выяснить, что не так с их сыном. Он испытывал как академические, так и социальные проблемы. За эти годы его трижды обследовали несколько специалистов и докторов медицины, в результате чего диагнозы были неопределенны, а вариант лечения был только один: стимулирующие препараты.