Содержание
Что такое ДНК, полезная информация
Главная
Генетические исследования
ДНК
ДНК (сокращение от дезоксирибонуклеиновая кислота) – это одна из важнейших для живых существ молекула, в которой содержится вся генетическая информация о них. Если представить, что живое существо – это какой-нибудь сложный прибор, например, магнитофон, то понять, что такое ДНК, можно сравнив его с пленкой, на которой записаны инструкции по созданию магнитофона и его функционированию.
Молекулы ДНК есть в каждой клетке нашего организма, и они хранятся в ядре (существует еще одна внеядерная разновидность ДНК –митохондриальная, она кратко описана в словаре). Если достать ДНК всего лишь из одной клетки и вытянуть, то длина полученной нити составит около двух метров. При этом размеры клеточного ядра не превышают шести микрометров (микрометр – это одна миллионная часть метра). ДНК помещается в ядро за счет того, что она многократно свернута и уложена в компактные тельца – хромосомы. У человека в ядре каждой клетки хранятся 23 пары хромосом – один набор приходит от отца, второй – от матери. Исключением являются половые клетки – яйцеклетка и сперматозоид, которые несут только половину всех хромосом. Такое «сокращение» необходимо, чтобы при слиянии сперматозоида и яйцеклетки образовался бы организм с нормальным набором хромосом.
У человека в ядре каждой клетки хранятся 23 пары хромосом – один набор приходит от отца, второй – от матери. Исключением являются половые клетки – яйцеклетка и сперматозоид, которые несут только половину всех хромосом. Такое «сокращение» необходимо, чтобы при слиянии сперматозоида и яйцеклетки образовался бы организм с нормальным набором хромосом.
В каждой клетке есть специальные системы, которые считывают заложенную в ДНК информацию и на ее основе создают новые белки (белки выполняют в клетке огромное число функций – от строительства до регуляции прочтения заложенных в ДНК инструкций). Хранящиеся в ДНК «послания» особым образом закодированы. Код ДНК состоит из четырех «символов», или нуклеотидов. Эти четыре разновидности нуклеотидов обозначаются буквами А (аденин), Т (тимин), Г (гуанин) и Ц (цитозин).
В нитях ДНК нуклеотиды соединены один за другим в длинные цепочки. В итоге закодированная информация выглядит примерно так: ААТГЦГТААГЦЦ… и так далее. Для непосвященного человека подобный набор букв кажется бессмысленным, однако клеточные «шифровальщики» точно знают, как на основе заложенной в ДНК информации синтезировать нужные клетке белки. «Шифровальщики» узнают определенные последовательности нуклеотидов, называемые генами. Каждый ген кодирует один белок. Именно поэтому гены называют элементарными единицами наследственности.
«Шифровальщики» узнают определенные последовательности нуклеотидов, называемые генами. Каждый ген кодирует один белок. Именно поэтому гены называют элементарными единицами наследственности.
Если спросить человека на улице, что приходит ему в голову, когда он слышит слово «ДНК», то, скорее всего, ответом будет «двойная спираль». У нас пока о двойной спирали не было ни слова. Что же это такое, и почему за ее открытие американские ученые Джеймс Уотсон и Френсис Крик получили Нобелевскую премию по физиологии и медицине?
Двойная спираль – это пространственная структура, в форме которой существует ДНК. Дело в том, что нити ДНК «не любят» быть поодиночке. У каждой нити есть напарница, с которой они переплетаются на всем своем протяжении. В итоге как раз и образуется двойная спираль. Нити ДНК объединяются в пары не просто так. Во-первых, двойная спираль значительно более стабильна, чем одиночная нить. Во-вторых, сдвоенные цепочки ДНК не путаются, поэтому считывание информации проходит без проблем. В-третьих, вторая цепь необходима в качестве гарантии сохранности информации. Нити ДНК соединяются в пары случайным образом, а, как говорят ученые, по принципу комплементарности. Это означает, что напротив каждого нуклеотида в одной нити всегда находится строго определенный нуклеотид из второй нити. Парой для А всегда выступает Т, а напарником Г является Ц.
В-третьих, вторая цепь необходима в качестве гарантии сохранности информации. Нити ДНК соединяются в пары случайным образом, а, как говорят ученые, по принципу комплементарности. Это означает, что напротив каждого нуклеотида в одной нити всегда находится строго определенный нуклеотид из второй нити. Парой для А всегда выступает Т, а напарником Г является Ц.
Эта особенность ДНК позволяет однозначно восстановить последовательность нити, имея на руках ее комплементарную копию. Если ДНК каким-либо образом повреждается и теряются кусочки одной из нитей, специальные белки заполняют возникшие бреши, используя в качестве матрицы для синтеза новой нити ее напарницу.
Существует еще один критически важный для клетки процесс, который требует существования двойной спирали. Это деление клеток. Перед тем как удвоиться, клетка синтезирует вторую копию всей своей ДНК. Это происходит так: двойные спирали расплетаются, и специальные белки создают новые комплементарные копии к каждой из оставшихся поодиночке нитей. В итоге снова образуются двойные спирали, но их уже вдвое больше, чем было исходно. Когда клетка разделяется надвое, каждая половинка получает по одному полному комплекту ДНК.
В итоге снова образуются двойные спирали, но их уже вдвое больше, чем было исходно. Когда клетка разделяется надвое, каждая половинка получает по одному полному комплекту ДНК.
Механизмы синтеза новых цепей работают очень точно, однако иногда происходят сбои, и на месте, скажем, нуклеотида А появляется нуклеотид Г. Причем ошибка может произойти не только в одном нуклеотиде: из цепи ДНК могут выпасть (или появиться) сразу несколько «букв». Ошибки размером в один нуклеотид получили название однонуклеотидных полиморфизмов, ошибки большего размера специального названия не имеют и объединяются под термином «мутации» (сюда входят и однонуклеотидные полиморфизмы).
Мутации могут никак не сказываться на работе клетки (например, если они произошли между генами), могут улучшить ее работу, а могут вызвать серьезный сбой. Последнее часто происходит в том случае, если из-за мутаций нарушается синтез того или иного белка. Именно мутации являются причиной многих наследственных заболеваний.
ДНК • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Молекула ДНК имеет форму двойной спирали, и ее воспроизведение основано на том, что каждая цепь двойной спирали служит матрицей для сборки новых молекул.
Сегодня мы знаем, что молекула ДНК является носителем кода, который управляет химизмом всего живого (см. Центральная догма молекулярной биологии), а двойная спираль молекулы ДНК стала одним из самых известных научных символов. Открытие ДНК, как и практически все великие открытия, не было результатом работы одинокого гения, а увенчало собой длинную цепь экспериментальных работ. Так, эксперимент Херши—Чейз продемонстрировал, что носителем генетической информации в клетках является именно ДНК, а не белки. Еще в 1920-е годы американский биохимик родом из России Фибус Левин (Phoebus Levene, 1869–1940) установил, что основные кирпичики, из которых построена ДНК, — это пятиатомный сахар дезоксирибоза (она обозначена буквой Д в слове ДНК), фосфатная группа и четыре азотистых основания — тимин, гуанин, цитозин и аденин (их обычно обозначают буквами Т, Г, Ц и А). В конце 1940-х годов американский биохимик австрийского происхождения Эрвин Чаргафф (Erwin Chargaff, р. 1905) выяснил, что во всех ДНК содержится равное количество оснований Т и А и, аналогично, равное количество оснований Г и Ц. Однако относительное содержание Т/А и Г/Ц в молекуле ДНК специфично для каждого вида.
В конце 1940-х годов американский биохимик австрийского происхождения Эрвин Чаргафф (Erwin Chargaff, р. 1905) выяснил, что во всех ДНК содержится равное количество оснований Т и А и, аналогично, равное количество оснований Г и Ц. Однако относительное содержание Т/А и Г/Ц в молекуле ДНК специфично для каждого вида.
В начале 1950-х годов стали известны два новых факта, пролившие свет на природу ДНК: американский химик Лайнус Полинг (Linus Pauling, 1901–94) показал, что в длинных молекулах, например белках, могут образовываться связи, закручивающие молекулу в спираль, а в лондонской лаборатории Морис Уилкинс и Розалинда Франклин получили данные рентгеноструктурного анализа (основанные на усовершенствованном применении закона Брэгга), позволившие предположить, что ДНК имеет спиральную структуру.
Как раз в это время молодой американский биохимик Джеймс Уотсон отправился на год в Кембриджский университет для работы с молодым английским физиком-теоретиком Фрэнсисом Криком. («Обо мне тогда практически никто не знал, — вспоминал впоследствии Крик, — а идеи Уотсона считали. .. слишком заумными».) Экспериментируя с металлическими моделями, Крик и Уотсон пытались объединить различные компоненты молекулы в трехмерную модель ДНК.
.. слишком заумными».) Экспериментируя с металлическими моделями, Крик и Уотсон пытались объединить различные компоненты молекулы в трехмерную модель ДНК.
Чтобы лучше представить себе полученные ими результаты, вообразите длинную лестницу. Вертикальные стойки этой лестницы состоят из молекул сахара, кислорода и фосфора. Важную функциональную информацию в молекуле несут ступеньки лестницы. Они состоят из двух молекул, каждая из которых крепится к одной из вертикальных стоек. Эти молекулы — четыре азотистых основания — представляют собой одиночные или двойные кольца, содержащие атомы углерода, азота и кислорода и способные образовывать две или три водородные связи (см. Химические связи) с другими основаниями. Форма этих молекул позволяет им образовывать связи — законченные ступеньки — лишь определенного типа: между А и Т и между Г и Ц. Другие связи возникнуть не могут. Следовательно, каждая ступенька представлена либо А—Т либо Г—Ц. Теперь вообразите, что вы берете собранную таким образом лестницу за два конца и скручиваете — вы получите знакомую двойную спираль ДНК.
Считывая ступеньки по одной цепи молекулы ДНК, вы получите последовательность оснований. Представьте, что это сообщение, написанное с помощью алфавита всего из четырех букв. Именно это сообщение определяет химические превращения, происходящие в клетке, и, следовательно, характеристики живого организма, частью которого является эта клетка. На другой цепи спирали никакой новой информации не содержится, ведь если вам известно основание, которое находится на одной цепи, вы знаете и то, какой должна быть вторая половина ступеньки. В некотором смысле две цепи двойной спирали относятся друг другу так же, как фотография и негатив.
Открыв двуспиральную структуру ДНК, Уотсон и Крик поняли и тот простой способ, которым осуществляется воспроизведение молекулы ДНК — как и должно происходить при делении клетки. По их собственным словам, «от нашего внимания не ускользнул тот факт, что постулированная нами специфичная парность азотистых оснований непосредственно указывает на возможный механизм копирования генетического материала».
Такой «возможный механизм копирования» определен структурой ДНК. Когда клетка приступает к делению и необходима дополнительная ДНК для дочерних клеток, ферменты (см. Катализаторы и ферменты) начинают «расстегивать» лестницу ДНК, как застежку-«молнию», обнажая индивидуальные основания. Другие ферменты присоединяют соответствующие основания, находящиеся в окружающей жидкой среде, к парным «обнажившимся» основаниям — А к Т, Г к Ц и т. д. В результате на каждой из двух разошедшихся цепей ДНК достраивается соответствующая ей цепь из компонентов окружающей среды, и исходная молекула дает начало двум двойным спиралям.
Точно так же, как каждое великое открытие основано на работе предшественников, оно дает начало новым плодотворным исследованиям, поскольку ученые используют полученную информацию для движения вперед. Можно сказать, что открытие двойной спирали дало толчок последующему полувековому развитию молекулярной биологии, завершившемуся успешным осуществлением проекта «Геном человека».
Как происходит «починка» поврежденных молекул ДНК
Как происходит «починка» поврежденных молекул ДНК — Газета.Ru
МВД ЛНР ожидает, что ВСУ попытаются занять высоту севернее Сватово
16:55
Глава Минстроя Якутии заявил, что не проходил опрос о размере члена
16:51
Shot: хакеры потребовали от племянницы режиссера Тарковского $600 за нюдсы
16:50
Идову считает, что Карпин может создать сборную, которой будет гордиться вся страна
16:50
Тайвань заявил о решении считать действия вторгающихся истребителей и БПЛА Китая…
16:49
Анджелина Джоли появилась на публике с дочерью после обвинений Брэда Питта…
16:45
Клишас: Россия добивается переработки универсальных норм международного права уже четверть…
16:45
Рогов заявил, что наемники из 30 стран находятся в подконтрольном Киеву городе…
16:42
Рада уволила главу Нацбанка Украины
16:41
Теннисный турнир «Кубок Кремля — 2022» отменен
16:38
Наука
close
100%
Как ДНК «чинит» сама себя и как связаны разрывы ДНК с генетическими заболеваниями, уточнили докторант химфака МГУ Светлана Хороненкова и ее коллеги.
Белки починят ДНК
Российские ученые показали клеточный механизм восстановления ДНК, утерявшей одно из кодирующих оснований…
30 ноября 12:56
Молекула ДНК в клетках человека химически нестабильна, что вызывает ее повреждения различной природы. Существует целый механизм, обеспечивающий ответ на повреждение ДНК, который включает в себя процессы обнаружения повреждения ДНК, генерацию сигнала о повреждении и «починку» молекулы ДНК — так называемую репарацию.
Ответ на повреждение ДНК чрезвычайно важен, например, для того, чтобы обеспечить как можно более высокого качества ДНК перед репликацией — дупликацией предыдущей ДНК на клеточном уровне. Если поврежденная ДНК была реплицирована, то риск рака и других заболеваний значительно увеличится в результате мутаций. Все это может привести к смерти клетки.
Система репарации включает в себя ферменты, которые отвечают за то, чтобы поврежденную ДНК каким-то образом проверить на качество и спасти до того, как она перейдет в дочернюю клетку.
Метаболизм всему голова
Нарушить классическую догму молекулярной биологии и приблизиться к пониманию фундаментальных механизмов…
24 февраля 15:09
В этой системе существует масса различных ферментов, и один из путей проверки и спасения клетки — распознавание поврежденных оснований и сигнализация другим ферментам, которые и будут их «чинить» — репарировать.
Среди этих ферментов — киназа ATM, которая передает сигнал от поврежденной ДНК клеточной системе репарации. Ученые предполагали, что исключительно ATM распознает так называемые двойные разрывы ДНК. Эти разрывы очень опасны, потому что они могут привести к потере генетической информации.
Докторант химического факультета МГУ Светлана Хороненкова, также имеющая аффилиацию Оксфордского университета, вошла в состав международной группы ученых, которая смогла открыть новую роль молекулы ATM. Ее роль заключалась в дизайне проекта, его экспериментальном исполнении и оформлении результатов для публикации.
Результаты изысканий опубликованы в престижном научном журнале PNAS.
Варианты взрывают мозг
Найти взаимосвязь между размером отдельных областей человеческого мозга и генетическими вариантами удалось…
22 января 08:39
«Эндогенные (внутренние) двойные разрывы ДНК в клетках в обычных условиях не возникают в больших количествах, — рассказала Светлана Хороненкова. — Сама идея функционирования клетки заключается в том, чтобы не допустить образования двойных разрывов ДНК. А мы выяснили, что ATM активируется и начинает выполнять свою функцию не только в случае двойных разрывов, но и в ответ на однонитевые разрывы».
Светлана Хороненкова пояснила, что однонитевые разрывы появляются в клетке с безумной частотой: по 10–20 тыс. в день. В отличие от них, двойные разрывы возникают с частотой 10–20 штук в день. Это подчеркивает важность сигнализации присутствия неисправленных однонитевых разрывов ДНК для репарации системы.
В ответ на однонитевые разрывы АТМ сама себя активирует и передает сигнал о повреждении. Это дает паузу в репликации ДНК, и у клетки будет больше времени для репарации.
Это дает паузу в репликации ДНК, и у клетки будет больше времени для репарации.
Если своевременной репарации не произошло, то образуется двойной разрыв ДНК, что гораздо страшнее, так как повышается риск заболевания раком и другими болезнями.
В частности, мутация в гене АТМ связана с генетическим заболеванием атаксия-телеангиэктазия (синдром Луи-Бар) — это редкая передающаяся по наследству болезнь, которая проявляется в основном у детей: у них может наблюдаться иммунодефицит, нейродегенерация, предрасположенность к раку, и умирают они в возрасте 14–15 лет. Кроме того, у таких детей могут быть задержки в развитии. Заболеваемость этим синдромом разная: в США он проявляется чуть чаще, чем в Европе.
Научный журнал вместо школьного
Даже школьник может опубликовать научную публикацию в международном журнале. И это при том, что некоторые…
10 декабря 12:18
В целом, по статистике, наблюдается примерно один зарегистрированный случай на 40–100 тыс. рождений, то есть мутация в гене есть у 1% населения. При этом высока вероятность того, что медики диагностируют только небольшой процент заболевания, что и приводит к разнице в цифрах.
При этом высока вероятность того, что медики диагностируют только небольшой процент заболевания, что и приводит к разнице в цифрах.
«Теперь мы хотим понять механизм того, как происходит активация АТМ в ответ на однонитевые разрывы. Будущая работа должна в конце концов помочь улучшить уровень жизни страдающих от подобных заболеваний пациентов», — резюмировала Светлана Хороненкова.
Подписывайтесь на «Газету.Ru» в Новостях, Дзен и Telegram.
Чтобы сообщить об ошибке, выделите текст и нажмите Ctrl+Enter
Новости
Дзен
Telegram
Картина дня
Военная операция на Украине. День 225-й
Онлайн-трансляция военной спецоперации РФ на Украине — 225-й день
Криптокошельки, уголь и сигареты. Что попало под новые санкции ЕС
ЕС утвердил восьмой пакет антироссийских санкций
«Где деньги?» В Госдуме заинтересовались, куда делись средства на обеспечение тыла
Комитет Госдумы по обороне обсудит с Минобороны проблемы обеспечения тыла 17 октября
Рада уволила главу Нацбанка Украины
Депутат Гурулев призвал бить по критической инфраструктуре для завершения спецоперации
ЛДПР внесла в Госдуму законопроект, уточняющий критерии мобилизации
Врио губернатора Херсонской области Сальдо заявил, что ВСУ точно не смогут взять Херсон
Новости и материалы
МВФ ухудшит прогноз роста мировой экономики в 2022 и 2023 годах
У школы в Новокуйбышевске задержали мужчину с предметом, похожим на пистолет
«Яндекс. Карты» отказались от любых границ
Карты» отказались от любых границ
В Санкт-Петербурге задержали мужчину, стрелявшего из пистолета по автобусу
Милохин покрутил Медведеву вниз головой и заставил зрителей закричать от ужаса в первом выпуске «Ледникового периода»
МВД ЛНР ожидает, что ВСУ попытаются занять высоту севернее Сватово
Глава Минстроя Якутии заявил, что не проходил опрос о размере члена
Shot: хакеры потребовали от племянницы режиссера Тарковского $600 за нюдсы
Идову считает, что Карпин может создать сборную, которой будет гордиться вся страна
Тайвань заявил о решении считать действия вторгающихся истребителей и БПЛА Китая «первым ударом»
Анджелина Джоли появилась на публике с дочерью после обвинений Брэда Питта в насилии
Клишас: Россия добивается переработки универсальных норм международного права уже четверть века
Рогов заявил, что наемники из 30 стран находятся в подконтрольном Киеву городе Запорожье
Теннисный турнир «Кубок Кремля — 2022» отменен
Артистов Большого театра отстранили из-за отъезда на гастроли в выходной
В Гонконге выпустили рекламный туристический ролик, снятый до пандемии
Операторы связи ожидают нехватки технических специалистов из-за мобилизации
Премьер Эстонии Каллас указала на снижение числа инструментов для новых санкций против РФ
Все новости
Капрал расстрелял 36 человек в детском саду в Таиланде. Затем он поехал домой и убил свою семью
Затем он поехал домой и убил свою семью
Thai PBS: в Таиланде более 30 человек погибли после стрельбы в детском саду
«Из подъездного наркомана стал известным певцом»: интервью со Стасом Пьехой — о жизни, семье и творчестве
Стас Пьеха объяснил, почему редко видится с сыном
Публициста Кара-Мурзу обвинили в госизмене. Это его третье уголовное дело за полгода
СМИ: против публициста Кара-Мурзы-младшего возбуждено дело о госизмене
От Кобейна до Башлачева: существует ли «Клуб 27» на самом деле
Правда и мифы о «Клубе 27»
Массаж, кино и VR-шлемы: как военные летчики расслабляются после вылетов
В Западный военный округ поступили новые средства психологической разгрузки военных
Дуров призвал всех срочно удалить WhatsApp. Дело в CVE-2022-36934
Дело в CVE-2022-36934
Дуров объяснил, почему пользователям стоит «держаться подальше» от WhatsApp
Ноги в грязи, руки в презервативах: чем запомнились Недели моды в Милане и Париже
По какой причине ребенок спит с приоткрытыми глазами
Невролог Некрасова назвала нормальным явлением сон ребенка с приоткрытыми глазами
«Муж плакал, когда узнал, что я беременна». Интервью с актрисой «Сердца пармы» Еленой Ербаковой
Актриса Елена Ербакова рассказала о роли ведьмы-ламии в «Сердце пармы», Сергее Пускепалисе и беременности
«Народу не хотят говорить даже часть правды об СВО»
Глава комитета ГД по обороне Картаполов призвал «перестать врать» о спецоперации
NYT: разведка США считает, что к убийству Дугиной причастна Украина
По словам источников, США не знали о готовящемся покушении
«ОПЕК+ встала на сторону России»
Страны ОПЕК+ сократят добычу нефти на 2 млн баррелей в сутки с ноября
Кадыров попал в Книгу рекордов России в день рождения
Кадырова включили в Книгу рекордов РФ из-за числа введенных санкций
Анастасия Миронова
Готовы нa фронт, но от пирогов нa ночь откaзaться не могут
О том, почему у нac столько добровольцев с ожирением, диaбетом и гипертонией
Марина Ярдаева
К станку, не отходя от колыбели
О том, что такое самореализация в декрете
Юлия Меламед
И желает вам приятного полета
О последней волне отъезда из РФ
Георгий Бовт
Невыученный урок истории
О том, как октябрьские события 1993 года «замели под ковер»
Мария Дегтерева
Паникеры паникуют
О том, как спастись от истерики в соцсетях
—>
Читайте также
Найдена ошибка?
Закрыть
Спасибо за ваше сообщение, мы скоро все поправим.
Продолжить чтение
| Секрет фото 51 домашняя страница | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рик Гроло — главный редактор NOVA online. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cell Free Dna — Bilder und Stockfotos
180Bilder
- Bilder
- Fotos
- Grafiken
- Vektoren
- Videos
AlleEssentials
Niedrigster Preis
Signature
Beste Qualität
Durchstöbern Sie 180
ДНК без клеток Stock-Photografie und Bilder. Oder starten Sie eine neuesuche, um noch mehr Stock-Photografie und Bilder zu entdecken.
днк-шаден. — Бесклеточная ДНК, графика, клипарт, мультфильмы и символы
DNA-Schäden.
ДНК-Шеден. ДНК может подвергаться УФ-излучению, ионизирующему излучению, генотоксичному химическому анализу, свободным радикалам и репликациям. Alterungsprozess, Zellapoptose и Krebsentwicklung
asiatische wissenschaftler oder ärzte verwenden microskope, um das Coronavirus (covid 19) zu testen. oder ein neues гриппевирус, um menschenleben im Labor oder krankenhaus zu retten. erfolgreich bei der erforschung der behandlung von civilen — ДНК без клеток стоковые фотографии и изображения
Азиатское научное общество или исследовательский микроскоп Mikroskope, um…
wissenschaftlerin im Labor — ДНК без клеток стоковые фотографии и изображения
Juntinge91
Wissenschaftlerin im Labor
Wissenschaftlerin im2 Форшт им Труда
Диаграмма окислительного стресса — бесклеточная ДНК, стоковые графики, клипарты, мультфильмы и символы
Диаграмма окислительного стресса
Диаграмма окислительного стресса. Vektorillustration flaches Design
Vektorillustration flaches Design
nahaufnahme des humanen biotechnologen, der neue chemische substanzen im Labor testet — stockfoto — cell free dna stock-fotos und bilder
nahaufnahme des humanen biotechnologen, der neue chemische…
menschliche krebszelle — cell free und dna stock-fotos фотография
Menschliche Krebszelle
weiße kn95 ffp2 maske auf grünem grund, противовирусная медицинская маска, защищающая от коронавируса. хирургическая маска.
Weiße KN95 Ffp2 Maske auf grünem Grund, antivirale medizinische… vorbereitung von prüfungen einsetzt, frau mit vitiligo, die sich auf der terrasse entspannt — ДНК без клеток, стоковые фотографии и изображения
Молоденькая женщина, умирает из дома, афроамериканская студентка,…
Молоденькая женщина-любительница, селфи с генетическим витилиго, умирает в камере, блестит, мужская и положительная концепция — без клеток ДНК фотографии и фотографии
Молодая женщина, селфи в фотографиях…
wissenschaftler forscht в химической лаборатории. Wissenschaftler arbeitet im Labor — ДНК без клеток, фото и фотографии
Wissenschaftler arbeitet im Labor — ДНК без клеток, фото и фотографии
Wissenschaftler forscht im Chemical Lab. Виссенсшафтлер…
blutreagenzgläser, untersuchung von blutreagenzgläsern bei ihren трудовые днк-тесты. medizinische reagenzgläser mit blutvektordesign und illustration. — Cell free ДНК Stock-grafiken, -clipart, -cartoons und -symbole
Blutreagenzgläser, Untersuchung von Blutreagenzgläsern bei ihren…
impf- und virenschutz — набор иконок в стиле линейного дизайна — cell free dna stock-grafiken, -clipart, — Cartoons und -symbole
Impf- und Virenschutz — Line Design Style Icons Set
funktionsweise von anti-antidian freie radikale schaden — cell free dna stock-grafiken, -clipart, -cartoons und -symbole
Funktionsweise von Antioxidantien freie Radikale Schaden
Wie Antioxidantien auf Schäden durch freie Radikale wirken. Vektor-Illustration
mädchen lachen laut und schalten Lieder ihrem smartphone ein — Cell Free ДНК Stock-fotos und Bilder
Mädchen Lachen Laut und Schalten Lieder ihrem Смартфон ein
wissenschaftlerin im Labor — Cell Free ДНК Stock-fotos und bilder
Wissenschaftlerin im Labor
liniensymbole gesetzt liniensymbole gesetzt alzheimer-krankheit — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Alzheimer-Krankheit Liniensymbole gesetzt
генетические дефекты, связанные с адаптацией к мобильному приложению-seitenbildschirm mit konzepten — cell free dna stock-grafiken, -clipart, -cartoons und -symbole
генетические дефекты, связанные с адаптацией к мобильному приложению1 9030 App-26 9030 Genetische Defekte führen zu einem roten Onboarding-Bildschirm der Mobilen App-Seite mit Konzepten. Erbkrankheit Прохождение 3 Графические описания. UI, UX, GUI-Vektorvorlage mit linearen Farbabbildungen
Erbkrankheit Прохождение 3 Графические описания. UI, UX, GUI-Vektorvorlage mit linearen Farbabbildungen
Генетический дефект морского онбординга мобильное приложение-seitenbildschirm mit konzepten — Cell Free ДНК Stock-grafiken, -clipart, -cartoons und -symbole
Генетический дефект ergebnisse Marine Onboarding mobile App-Seitenb
Menschliche Krebszelle
Диаграмма окислительного стресса — бесклеточная ДНК, графика, -клипарт, -мультфильмы и -символ
Диаграмма окислительного стресса
Диаграмма окислительного стресса. Freie Radikale, die die Zelle angreifen. Векторные флаши Дизайн
Молоденькая фрау zeigt ein handy zu einer alten frau und ein mädchensuchen zu — cell free dna stock-fotos und bilder
Молоденькая фрау zeigt ein Handy zu einer alten Frau und ein Mädchen…
vektor aqua blau монохромный handgezeichnete corona-virus- keime nahtloses muster 03. geeignet für geschenkverpackung, textil und tapete. — Cell Free ДНК стоковые графики, -клипарты, -мультфильмы и -символы
Вектор Аква синий монохромный handgezeichnete Corona-Virus-Keime. ..
..
einen schritt voraus krankheit mit medizinischen forschung — Cell Free ДНК стоковые фотографии и изображения
Einen Schritt voraus Krankheit mit medizinischen Forschung
Nahaufnahme-Porträt eines jungen Wissenschaftlers mit konischem Schlauch mit blauer flüssiger Lösung, Laborexperimenten, isoliertem Laborhintergrund. Судебная экспертиза, генетика, микробиология, биохимия. Фото фон Ärztin oder Forscherin oder Ärztin, die ein Reagenzglas mit klarer Lösung in einem Labor oder Labor mit ihrem College im Hintergrund betrachtet.
injektionsspritze in rohen hähnchenstücken, konzept der injection von gvo in das fleisch. nahaufnahme — стоковые фотографии и изображения ДНК без клеток
Injektionsspritze in rohen Hähnchenstücken, Konzept der…
Injektionsspritze in rohe Hähnchenstücke, Konzept der Injektion von GVO in das Fleisch. Нахауфнаме.
satz von modernen geschenkgutschein-vorlagen. dna-molekül struktur auf — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
dna-molekül struktur auf — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Satz von modernen Geschenkgutschein-Vorlagen. DNA-Molekül…
Set moderner Geschenkgutscheinvorlagen. DNA-Molekülstruktur auf dunkelgrünem Hintergrund. Hintergrund des Wissenschaftsvektors.
Wissenschaftlerin im Labor — днк без клеток, стоковые фотографии и фотографии
Wissenschaftlerin im Labor
Молодежный работник в труде
satz von modernen geschenkgutschein-vorlagen. dna-molekül struktur auf — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Satz von modernen Geschenkgutschein-Vorlagen. DNA-Molekül…
Set moderner Geschenkgutscheinvorlagen. DNA-Molekülstruktur auf dunkelblauem Hintergrund. Hintergrund des Wissenschaftsvektors.
satz von modernen geschenkgutschein-vorlagen. dna-molekül struktur auf — ДНК без клеток, стоковые графики, -клипарты, -мультфильмы и -символы
Satz von modernen Geschenkgutschein-Vorlagen. DNA-Molekül…
DNA-Molekül…
Set moderner Geschenkgutscheinvorlagen. DNA-Molekülstruktur auf dunkelblauem Hintergrund. Hintergrund des Wissenschaftsvektors.
satz von modernen geschenkgutschein-vorlagen. dna-molekül struktur auf — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Satz von modernen Geschenkgutschein-Vorlagen. DNA-Molekül…
wissenschaftler forscht в химической лаборатории. wissenschaftler arbeitet im Labor — ДНК без клеток, фото и фотографии
Wissenschaftler forscht im Chemical Lab. Wissenschaftler…
satz von modernen geschenkgutschein vorlagen. abstraktes polygonales low poly — бесклеточная ДНК, графика, клипарт, мультфильмы и символы
Satz von modernen Geschenkgutschein Vorlagen. Abstraktes…
satz von modernen geschenkgutschein vorlagen. abstraktes polygonales low poly — бесклеточная ДНК, графика, клипарт, мультфильмы и символы
Satz von modernen Geschenkgutschein Vorlagen. Аннотация. ..
..
Установить современный Geschenkgutscheinvorlagen. Abstrakter polygonaler Low-Poly-Hintergrund mit verbindenden Punkten und Linien, Goldenem Hintergrund, Verbindungsstruktur. Цифровой или wissenschaftlicher вектор.
satz von modernen geschenkgutschein-vorlagen. dna-molekül struktur auf — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Satz von modernen Geschenkgutschein-Vorlagen. DNA-Molekül…
Set moderner Geschenkgutscheinvorlagen. DNA-Molekülstruktur auf dunkelgrünem Hintergrund. Hintergrund des Wissenschaftsvektors.
вектор-графика иллюстрации дер Starken манна с ДНК странные fortsetzung унд мит vogel флюгель geschaffen. mensch als gegenstand von forschung der biochemie. — Cell free ДНК стоковые графики, -клипарты, -мультфильмы и -символы
Векторные графические иллюстрации к значкам Mann wie DNA Stränge…
zwei Laborassistenten Untersuchen zellen mit krebsstatus — cell free dna stock-fotos und bilder
Zwei Laborassistenten untersuchen Zellen mit Krebsstatus
Zwei Bachelor-Laborstudenten erforschen Zellen mit Krebsstatus im Labor der Universität.
kostenloses wi-fi — сотовая бесплатная ДНК фондовая графика, -клипарт, -мультфильмы и -символ -символ. vektor — cell free dna stock-grafiken, -clipart, -cartoons und -symbole
Setzen Sie isometrischeGVO, DNA-Forschung,suche und Petrischale…
Stellen Sie isometrische GVO, DNA-Forschung,suche und Petrischale mit Bakteriensymbol ein. Вектор.
satz von modernen geschenkgutschein-vorlagen. dna-molekül struktur auf — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Satz von modernen Geschenkgutschein-Vorlagen. DNA-Molekül…
Set moderner Geschenkgutscheinvorlagen. DNA-Molekülstruktur auf dunkelblauem Hintergrund. Hintergrund des Wissenschaftsvektors.
Wissenschaftlerin im Labor auf dersuche nach Heilung — ДНК без клеток, фото и фотографии
Wissenschaftlerin im Labor auf dersuche nach Heilung
blutreageröhrchen в центрифуге. Plasmapräparat im medizinischen hematologie-laborkonzept — stockfoto — Cell free dna stock-fotos und bilder
Blutreageröhrchen in Zentrifuge. Plasmapräparat im medizinischen…
Plasmapräparat im medizinischen…
Индийский с удобным и портативным компьютером, — фото со стока бесплатно ДНК и изображения
Индийский с портативным и портативным,
satz von modernen geschenkgutschein-vorlagen. dna-molekül struktur auf — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Satz von modernen Geschenkgutschein-Vorlagen. ДНК-молекул…
Laborstudent untersucht zellen mit krebsstatus. — Cell Free ДНК фото и фотографии
Laborstudent untersucht Zellen mit Krebsstatus.
Der Laborant untersucht Zellen mit Krebsstatus im Labor einer medizinischen Universität.
satz von modernen geschenkgutschein-vorlagen. dna-molekül struktur auf — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Satz von modernen Geschenkgutschein-Vorlagen. DNA-Molekül…
набор линий, содержащих бактерии и символы. вектор — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Set Line GVO, Petrischale mit Bakterien und Symbol. Vektor
Vektor
Set-Line GVO, Petrischale mit Bakterien und Ikone. Вектор.
junge in einem business-anzug mit einer barcode-tasche auf dem kopf. — Cell Free ДНК фото и фотографии
Юнги в бизнес-Анзуг мит Эйнер штрих-код-Tasche Auf dem…
набор линий ГМО для проверки huhn, gvo и petri schale с бактериальным символом. вектор — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Set Line Gmo Forschung Huhn, GVO и Petri Schale mit Bakterien-S
Setzen Sie die Linee GMO-Forschung Huhn, GVO und Petrischale mit Bakteriensymbol. Вектор.
набор изометрических генетических veränderte оранжевый, гво и petrischale мит бактериальный символ. вектор — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Набор Изометрический Генетический veränderte Orange, GVO и Petrischale…
satz von modernen geschenkgutschein-vorlagen. dna-molekül struktur auf — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Satz von modernen Geschenkgutschein-Vorlagen. ДНК-молекул…
ДНК-молекул…
Современный набор Geschenkgutscheinvorlagen. DNA-Molekülstruktur auf dunkelgrünem Hintergrund. Hintergrund des Wissenschaftsvektors.
satz von modernen geschenkgutschein-vorlagen. dna-molekül struktur auf — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Satz von modernen Geschenkgutschein-Vorlagen. DNA-Molekül…
set dna-symbol, gmo forschung huhn, petrischale mit bakterien und gvo-symbol mit langem schatten. вектор — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Set DNA-Symbol, Gmo Forschung Huhn, Petrischale mit Bakterien…
satz von modernen geschenkgutschein-vorlagen. dna-molekül struktur auf — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Satz von modernen Geschenkgutschein-Vorlagen. DNA-Molekül…
Set moderner Geschenkgutscheinvorlagen. DNA-Molekülstruktur auf dunkelgrünem Hintergrund. Hintergrund des Wissenschaftsvektors.
Hintergrund des Wissenschaftsvektors.
kostenloser wifi-café-aufkleber mit braune farbe. — ДНК без клеток — графика, -клипарт, -мультфильмы и -символ
Kostenloser wifi-Café-Aufkleber mit Braune Farbe.
satz von modernen geschenkgutschein-vorlagen. dna-molekül struktur auf — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Satz von modernen Geschenkgutschein-Vorlagen. DNA-Molekül…
Set moderner Geschenkgutscheinvorlagen. DNA-Molekülstruktur auf dunkelblauem Hintergrund. Hintergrund des Wissenschaftsvektors.
векторная иллюстрация Старкена Манна, а также ДНК-символа fortsetzung dargestellt und mit vogel flugel geschaffen. молекулярная генетика. — ДНК без клеток — графика, -клипарт, -мультфильмы и -символ
Векторная иллюстрация Старкена Манна и ДНК-символа Fortsetzung…
векторных графических иллюстраций Старкена Манна и ДНК-символа fortsetzung dargestellt und mit drahtgitter verbindungen und vogel flügel geschaffen. биомедицинская техника-концепт. -cell free dna stock-grafiken, -clipart, -cartoons und -symbole
биомедицинская техника-концепт. -cell free dna stock-grafiken, -clipart, -cartoons und -symbole
Vector-Grafik Illustration der starken Mann als DNA-Symbol…
vector-grafik illustration der starken mann als dna-symbol fortsetzung dargestellt und mit drahtgitter verbindungen und vogel flügel geschaffen. биомедицинская техника-концепт. — ДНК без клеток — графика, -клипарт, -мультфильмы и -символ
Векторная графическая иллюстрация Старкена Манна как ДНК-символа…
векторная иллюстрация Старкена Манна как ДНК-символа fortsetzung und mit vogel flugel geschaffen. биотехнологии и молекулярной генетики. — клеточная свободная ДНК сток-графика, -клипарт, -мультфильмы и -символ
Вектор-иллюстрация дер Старкен Манналс ДНК-символ Fortsetzung…
вектор-иллюстрация дер Старкен Манн альс днк-символ fortsetzung унд мит vogel Flugel geschaffen. биотехнологии и молекулярной генетики. — ДНК без клеток — графика, -клипарт, -мультфильмы и -символ
Vektor-Illustration der starken Mann als DNA-Symbol Fortsetzung. ..
..
set gentechnisch verändertes huhn, gvo und petrischale mit bakterien. бизнес-инфографикворлаге. vektor — cell free dna stock-grafiken, -clipart, -cartoons und -symbole
Set Gentechnisch verändertes Huhn, GVO und Petrischale mit…
Gentechnisch veränderte Hühner-, GVO- и Petrischale mit Bakterien ansetzen. Vorlage für Business-Infografiken. Вектор.
фон 3
Датчик оптической силы на основе ДНК для приложений с живыми клетками
Новые результаты
Кристина Джаячандран, Посмотреть профиль ORCID Ариндам Гош, Минакши Прабхун, Джонатан Бат, Эндрю Дж. Терберфилд, Лара Хауке, Йорг Эндерляйн, Флориан Рефельдт, Кристоф Ф. Шмидт
doi: https://doi.org/10.1101/2021.12. 21.473677
- Резюме
- Полный текст
- Информация/История
- Показатели
- Дополнительные материалы
- Предварительный просмотр PDF
- 1.↵
Hayakawa, K., Tatsumi, H. & Sokabe, M. Актиновые филаменты функционируют как датчик натяжения за счет зависимого от натяжения связывания кофилина с филаментом. J. Cell Biol . 195, 721–727 (2011).
- 2.↵
Hotulainen, P.
 & Lappalainen, P. Стрессовые волокна генерируются двумя различными механизмами сборки актина в подвижных клетках. J. Cell Biol . 173, 383–394 (2006).
& Lappalainen, P. Стрессовые волокна генерируются двумя различными механизмами сборки актина в подвижных клетках. J. Cell Biol . 173, 383–394 (2006). - 3.↵
Дасанаяке Н.Л., Михальский П.Дж. и Карлссон А.Е. Общий механизм сократимости актомиозина. Физ. Преподобный Письмо . 107, 118101 (2011).
- 4.↵
de Silva, M. S. et al. Активное многоступенчатое огрубение актиновых сетей, управляемое миозиновыми моторами. Проц. Нац. акад. науч. США 108, 9408–9413 (2011).
- 5.↵
Шоли, Дж. М., Браст-Машер, И. и Могилнер, А. Деление клеток. Природа 422, 746–752 (2003).
- 6.↵
McBeath, R., Pirone, D.M., Nelson, C.M., Bhadriraju, K. & Chen, C.S. Форма клеток, натяжение цитоскелета и роа регулируют коммитацию линии стволовых клеток. Дев. Cell 6, 483–495 (2004).
- 7.↵
Cojoc, D.
 et al. Свойства силы, оказываемой филоподиями и ламеллоподиями, и участие компонентов цитоскелета. PloS one 2, e1072 (2007 г.).
et al. Свойства силы, оказываемой филоподиями и ламеллоподиями, и участие компонентов цитоскелета. PloS one 2, e1072 (2007 г.). - 8.↵
Ridley, A. J. et al. Миграция клеток: интеграция сигналов спереди назад. Наука 302, 1704–1709 (2003).
- 9.
Welch, M.D. & Mullins, R.D. Клеточный контроль нуклеации актина. год. Преподобный Cell Dev. Биол . 18, 247–288 (2002).
- 10.↵
Поллард, Т. Д. и Бориси, Г. Г. Подвижность клеток, обусловленная сборкой и разборкой актиновых филаментов. Cell 112, 453–465 (2003).
- 11.↵
Engler, A.J., Sen, S., Sweeney, H.L. & Discher, D.E. Эластичность матрикса определяет спецификацию стволовых клеток. Cell 126, 677–689 (2006).
- 12.↵
Земель, А., Рефельдт, Ф., Браун, А., Дишер, Д. и Сафран, С. Оптимальная жесткость матрицы для поляризации стрессовых волокон в стволовых клетках.
 Нац. Физика 6, 468–473 (2010).
Нац. Физика 6, 468–473 (2010). - 13.↵
Рефельдт, Ф., Энглер, А. Дж., Экхардт, А., Ахмед, Ф. и Дишер, Д. Э. Реакция клеток на механохимическую микросреду — значение для регенеративной медицины и доставки лекарств. Доп. Наркотик Делив. Версия . 59, 1329–1339 (2007).
- 14.
Калиман, С., Джаячандран, К., Рефельдт, Ф. и Смит, А.-С. Новый режим роста модельных тканей mdck ii на мягких подложках. Биофиз. Дж . 106, Л25–Л28 (2014).
- 15.↵
Гейгер Б., Спатц Дж. П. и Бершадский А. Д. Зондирование окружающей среды с помощью фокальных спаек. Нац. Преподобный Мол. Сотовый Био . 10, 21–33 (2009).
- 16.↵
Polacheck, WJ & Chen, C.S. Измерение сил, создаваемых клетками: руководство по доступным инструментам. Нац. Методы 13, 415–423 (2016).
- 17.↵
Rief, M., Gautel, M., Oesterhelt, F.
 , Fernandez, J.M. & Gaub, H.E. Обратимое развертывание отдельных доменов титина иммуноглобулина с помощью afm. Наука 276, 1109–1112 (1997).
, Fernandez, J.M. & Gaub, H.E. Обратимое развертывание отдельных доменов титина иммуноглобулина с помощью afm. Наука 276, 1109–1112 (1997). - 18.↵
Фишер, Т. Е., Оберхаузер, А. Ф., Каррион-Васкес, М., Марсалек, П. Э. и Фернандес, Дж. М. Изучение механики белков с помощью атомно-силового микроскопа. Тренды Биохим. Наука . 24, 379–384 (1999).
- 19.↵
Ашкин А. и Дзидзич Дж. М. Оптический захват и манипулирование вирусами и бактериями. Наука 235, 1517–1520 (1987).
- 20.↵
Шлоссер Ф., Рефельдт Ф. и Шмидт С. Ф. Колебания силы в трехмерных подвешенных фибробластах. Филос. Транс. Р. Соц. Lond., B, Biol. Наука . 370, 20140028 (2015).
- 21.↵
Smith, S.B., Finzi, L. & Bustamante, C. Прямые механические измерения эластичности отдельных молекул ДНК с использованием магнитных шариков. Наука 258, 1122–1126 (1992).

- 22.↵
Förster, T. Zwischenmolekulare energiewanderung und fluoreszenz. Энн. Физ . 437, 55–75 (1948).
- 23.↵
Лю, Ю., Галиор, К., Ма, В.П.-Ю. и Салайта, К. Датчики молекулярного натяжения для визуализации сил на поверхности клетки. Согл. хим. Рез . 50, 2915–2924 (2017).
- 24.↵
Мэн, Ф., Сухина, Т. М. и Сакс, Ф. Сенсор механического стресса на основе переноса энергии флуоресценции для специфических белков in situ. ФЕБС J . 275, 3072–3087 (2008).
- 25.↵
Grashoff, C. et al. Измерение механического натяжения винкулина выявляет регуляцию динамики фокальной адгезии. Природа 466, 263–266 (2010).
- 26.↵
Стейбли Д. Р., Юрченко К., Маршалл С. С. и Салаита К. С. Визуализация механического напряжения мембранных рецепторов с помощью флуоресцентного датчика. Нац. Методы 9, 64–67 (2012).

- 27.↵
Юрченко С., Чанг Ю., Наруи Ю., Чжан Ю. и Салаита К. С. Силы, генерируемые интегрином, приводят к расщеплению стрептавидин-биотина в клеточных адгезиях. Биофиз. Дж . 106, 1436–1446 (2014).
- 28.↵
Wang, X. & Ha, T. Определение отдельных молекулярных сил, необходимых для активации интегрина и передачи сигналов Notch. Наука 340, 991–994 (2013).
- 29.↵
Шрофф, Х. и др. Биосовместимый датчик силы с оптическим считыванием и размерами 6 нм3. Нано письмо . 5, 1509–1514 (2005).
- 30.↵
Dutta, P.K. et al. Программируемые мультивалентные датчики натяжения ДНК-оригами для регистрации клеточных сил тяги. Нано письмо . 18, 4803–4811 (2018).
- 31.↵
Саркар, А. и др. Датчик тандемного натяжения выявляет зависимость молекулярного напряжения интегрина от жесткости субстрата в живых клетках.
 bioRxiv (2020).
bioRxiv (2020). - 32.↵
Прабхун, М., Рефельдт, Ф. и Шмидт, К.Ф. Датчики молекулярной силы для измерения стресса в клетках. J. Phys. Д заявл. Физ . 50, 233001 (2017).
- 33.↵
Liphardt, J., Onoa, B., Smith, S.B., Tinoco, I. & Bustamante, C. Обратимое развертывание отдельных молекул РНК под действием механической силы. Наука 292, 733–737 (2001).
- 34.↵
Woodside, M. T. et al. Прямое измерение полного, зависящего от последовательности складчатого ландшафта нуклеиновой кислоты. Наука 314, 1001–1004 (2006).
- 35.↵
Woodside, M. T. et al. Наномеханические измерения складчатых ландшафтов, зависящих от последовательности, одиночных шпилек нуклеиновых кислот. Проц. Нац. акад. науч. США 103, 6190–6195 (2006).
- 36.↵
Zhang, Y., Ge, C., Zhu, C. & Salaita, K. Цифровые зонды натяжения на основе ДНК выявляют силы интегрина во время ранней клеточной адгезии.
 Нац. Коммуна . 5, 1–10 (2014).
Нац. Коммуна . 5, 1–10 (2014). - 37.↵
Лос Г.В. и др. Halotag: новая технология мечения белков для визуализации клеток и анализа белков. АКС Хим. Биол . 3, 373–382 (2008).
- 38.↵
Riedl, J. et al. Lifeact: универсальный маркер для визуализации f-актина. Нац. Методы 5, 605–607 (2008).
- 39.↵
Benda, A. et al. Модернизация Tcspc конфокального микроскопа fcs. Rev.Sci. Инструм . 76, 033106 (2005).
- 40.↵
Seidel, C.A., Schulz, A. & Sauer, MH. Специфическое для нуклеотидов тушение флуоресцентных красителей. 1. Одноэлектронные окислительно-восстановительные потенциалы азотистых оснований и их корреляция со статической и динамической эффективностью тушения. J. Phys. Химия . 100, 5541–5553 (1996).
- 41.↵
Маррас, С.А., Крамер, Ф.Р. и Тьяги, С. Эффективность резонансной передачи энергии флуоресценции и контактно-опосредованного тушения в олигонуклеотидных зондах.
 Рез. нуклеиновых кислот . 30, e122–e122 (2002).
Рез. нуклеиновых кислот . 30, e122–e122 (2002). - 42.↵
Koenderink, G., Atakhorrami, M., MacKintosh, F. & Schmidt, C.F. Высокочастотная релаксация напряжений в полугибких полимерных растворах и сетях. физ. Преподобный Письмо . 96, 138307 (2006).
- 43.↵
Гиттес, Ф., Шнурр, Б., Олмстед, П., Маккинтош, Ф. К. и Шмидт, К. Ф. Микроскопическая вязкоупругость: модули сдвига мягких материалов, определенные по тепловым колебаниям. Физ. Преподобный Письмо . 79, 3286 (1997).
- 44.↵
Атахоррами, М. и др. Коррелированные колебания микрочастиц в вязкоупругих растворах: количественное измерение свойств материала с помощью микрореологии в присутствии оптических ловушек. физ. Ред. E 73, 061501 (2006).
- 45.↵
Lorenz, J.S. et al. Синтетические переходные сшивки программируют механику мягких материалов на основе биополимеров.
 Доп. Мать . 30, 1706092 (2018).
Доп. Мать . 30, 1706092 (2018). - 46.↵
Зриби, О.В., Кьюнг, Х., Голестанян, Р., Ливерпуль, Т.Б. и Вонг, Г.К. Конденсация смесей полиэлектролитов днаактина, управляемая ионами различной валентности. Физ. Ред. E 73, 031911 (2006).
- 47.↵
Фитцпатрик Р. и др. Синергические взаимодействия между ДНК и актином запускают возникающее вязкоупругое поведение. Физ. Преподобный Письмо . 121, 257801 (2018).
- 48.↵
Мелак, М., Плесснер, М. и Гроссе, Р. Визуализация актина с первого взгляда. J. Cell Sci . 130, 525–530 (2017).
- 49.↵
Уорд, С. М. В., Вайнс, А., Поллак, М. Р. и Вейц, Д. А. Динамическая вязкоупругость актина, сшитого с мутантным α-актинином-4 дикого типа и вызывающим заболевание. Биофиз. Дж . 95, 4915–4923 (2008).
- 50.↵
Weins, A. et al. Мутантный α-актинин-4, ассоциированный с заболеванием, обнаруживает механизм регуляции его сродства к связыванию с f-актином.

26
26
260365
Механические силы имеют значение для многих биологических процессов, от заживления ран или образования опухолей до миграции и дифференцировки клеток. Цитоскелетный актин в значительной степени отвечает за реагирование на силы и их передачу в клетки, а также за поддержание формы и целостности клеток. Здесь мы описываем новый подход к использованию датчика силы ДНК на основе FRET in vitro и in cellulo для неинвазивного оптического мониторинга внутриклеточных механических сил. Мы используем визуализацию времени жизни флуоресценции для определения эффективности FRET датчика, что делает измерение устойчивым к колебаниям интенсивности. Мы демонстрируем применимость сенсора, отслеживая активность сшивания в in vitro актиновые сети по объемной реологии и конфокальной микроскопии. Мы также демонстрируем, что датчик легко прикрепляется к стрессовым волокнам в живых клетках, что открывает возможность измерения силы живых клеток.
Цитоскелетный актин в значительной степени отвечает за реагирование на силы и их передачу в клетки, а также за поддержание формы и целостности клеток. Здесь мы описываем новый подход к использованию датчика силы ДНК на основе FRET in vitro и in cellulo для неинвазивного оптического мониторинга внутриклеточных механических сил. Мы используем визуализацию времени жизни флуоресценции для определения эффективности FRET датчика, что делает измерение устойчивым к колебаниям интенсивности. Мы демонстрируем применимость сенсора, отслеживая активность сшивания в in vitro актиновые сети по объемной реологии и конфокальной микроскопии. Мы также демонстрируем, что датчик легко прикрепляется к стрессовым волокнам в живых клетках, что открывает возможность измерения силы живых клеток.
Актиновый цитоскелет 1 является основным компонентом основного механизма генерации силы в большинстве клеток. Например, стрессовые волокна 2 производят сократительные силы 3, 4 , которые помогают в передвижении клеток, делении 5 и дифференцировке 6 . Движущая сила ок. 20 пН образуются в результате полимеризации актина 7 стимулирования миграции клеток 8–10 . В сочетании с миозиновыми моторами актин также служит ключевым элементом в механоощущении 11, 12 . Передающие силу и чувствительные структуры и их движения можно легко визуализировать с помощью флуоресцентной микроскопии. Напр., на жестких эластичных субстратах клетки образуют заметные актиновые стрессовые волокна 13-15 . Силы и стрессы, однако, не видны напрямую, и количественная оценка сил, воздействующих на структуру актина в клетках, остается сложной из-за отсутствия соответствующих датчиков силы.
Движущая сила ок. 20 пН образуются в результате полимеризации актина 7 стимулирования миграции клеток 8–10 . В сочетании с миозиновыми моторами актин также служит ключевым элементом в механоощущении 11, 12 . Передающие силу и чувствительные структуры и их движения можно легко визуализировать с помощью флуоресцентной микроскопии. Напр., на жестких эластичных субстратах клетки образуют заметные актиновые стрессовые волокна 13-15 . Силы и стрессы, однако, не видны напрямую, и количественная оценка сил, воздействующих на структуру актина в клетках, остается сложной из-за отсутствия соответствующих датчиков силы.
Для измерения клеточных сил, передающихся на окружающую среду, применялось несколько методов, включая микроскопию силы растяжения 16 , атомно-силовую микроскопию 17, 18 и оптический 19, 20 и магнитный пинцет 21 . Эти методы нечувствительны к внутренне уравновешенным силам в клетках и, таким образом, не могут полностью охарактеризовать клеточные стрессы. Недавними дополнениями к этому набору методов являются генетически выраженные датчики молекулярной силы (MFS), которые основаны на переносе энергии резонанса Фёрстера (FRET). MFS на основе FRET позволяет измерять стрессы путем измерения эффективности передачи энергии между донорным и акцепторным флуорофором (пара FRET), которые связаны через молекулярную пружину 22 . Эти MFS предлагают пиконьютоновскую (pN) чувствительность и высокое пространственное (∼20 нм) и временное разрешение (∼ мс) при минимальном воздействии на клетки 23 . Однако генетически экспрессированные сенсоры обычно используют флуоресцентные белки 24, 25 , которые могут раскрываться при приложении силы и обладают фотофизическими свойствами, уступающими свойствам органических красителей. При использовании полимерных цепей в качестве молекулярных пружин между донором и акцептором 26, 27 трудно точно отрегулировать жесткость пружины. Оба эти ограничения могут быть преодолены с помощью MFS на основе ДНК, которую можно настроить на широкий диапазон физиологически значимых сил 28 из-за простоты проектирования структур ДНК 29–31 , как указано в Prabhune et al .
Недавними дополнениями к этому набору методов являются генетически выраженные датчики молекулярной силы (MFS), которые основаны на переносе энергии резонанса Фёрстера (FRET). MFS на основе FRET позволяет измерять стрессы путем измерения эффективности передачи энергии между донорным и акцепторным флуорофором (пара FRET), которые связаны через молекулярную пружину 22 . Эти MFS предлагают пиконьютоновскую (pN) чувствительность и высокое пространственное (∼20 нм) и временное разрешение (∼ мс) при минимальном воздействии на клетки 23 . Однако генетически экспрессированные сенсоры обычно используют флуоресцентные белки 24, 25 , которые могут раскрываться при приложении силы и обладают фотофизическими свойствами, уступающими свойствам органических красителей. При использовании полимерных цепей в качестве молекулярных пружин между донором и акцептором 26, 27 трудно точно отрегулировать жесткость пружины. Оба эти ограничения могут быть преодолены с помощью MFS на основе ДНК, которую можно настроить на широкий диапазон физиологически значимых сил 28 из-за простоты проектирования структур ДНК 29–31 , как указано в Prabhune et al . 32 . MFS на основе ДНК, привитые к поверхностям, использовались для исследования межфазных сил между клетками и лигандами. 30, 31
32 . MFS на основе ДНК, привитые к поверхностям, использовались для исследования межфазных сил между клетками и лигандами. 30, 31
Здесь мы представляем новую MFS на основе ДНК для in cellulo и in vitro . Структура этого сенсора представляет собой шпильку ДНК, способную переключаться между двумя конформационными состояниями 33, 34 . Пара FRET, состоящая из органического красителя (донора) и гасителя (акцептора), обеспечивает считывание флуоресценции за счет изменения эффективности FRET, когда внешняя сила разрывает шпильку на части. Шпилька обратимо переключается между двумя состояниями: она открывается при определенной пороговой силе и складывается обратно, когда сила снимается. Пороговое усилие открытия наших датчиков оценивается в ≈ 10 пН 35, 36 . В следующих разделах мы представляем конструкцию и изготовление этого сенсора, подробно описываем его с помощью спектроскопии времени жизни флуоресценции, изучаем новые стратегии прикрепления, проверяем его работу в реконструированных актиновых сетях и показываем, что сенсоры могут быть вставлены в актиновые сети и нацелены на них. цитоскелета живых клеток.
цитоскелета живых клеток.
Результаты и обсуждение
Конструкция датчика ДНК
Наш датчик силы ДНК состоит из шпильки (рис. 1А), со стержнем (8 пар оснований (п.н.)), петлей (16 п.н.) и двумя плечами (каждое 20 пар оснований (п.н.)). нт). Две другие нити, а именно нити F и Q, гибридизуются с плечами шпильки. Пара FRET образована флуорофором Alexa488, присоединенным к F-цепи, и молекулой гасителя (Iowa black FQ), присоединенной к Q-цепи. При гибридизации со шпильками краситель и гаситель попадают в диапазон FRET. Сенсор подключается к актину через LifeAct 38 , временный актин-связывающий белок (ABP) с
следующим образом. 5′- и 3′-концы шпилечного сенсора модифицированы для включения лиганда HaloTag®, который ковалентно связывается с белком HaloTag® 37 , который экспрессируется в виде генетического слияния с красным флуоресцентным белком (RFP) и LifeAct (рис. 1B). ) (подробности см. в разделе «Методы»). Конструкцию LifeAct можно использовать для измерений in cellulo посредством трансфекции тремя слитыми генами, и ее можно рекомбинантно экспрессировать и очищать для in vitro измерения. Когда на этот датчик действует внешняя сила, превышающая определенный порог, шпилька датчика претерпевает конформационный переключатель, разворачиваясь из закрытого (высокий FRET) в открытый (низкий FRET) состояние (рис. 1А).
Конструкцию LifeAct можно использовать для измерений in cellulo посредством трансфекции тремя слитыми генами, и ее можно рекомбинантно экспрессировать и очищать для in vitro измерения. Когда на этот датчик действует внешняя сила, превышающая определенный порог, шпилька датчика претерпевает конформационный переключатель, разворачиваясь из закрытого (высокий FRET) в открытый (низкий FRET) состояние (рис. 1А).
Рис. 1:
Конструкция и крепление датчика силы ДНК. A: Датчик силы ДНК состоит из шпильки (красного цвета) со стержнем (8 п.н.), петлей (16 п.н.) и двумя плечами (каждое по 20 нт). Плечи гибридизуются с двумя цепями, каждая длиной 20 нуклеотидов, несущими флуорофор Alexa 488 (цепь F, синяя) и гаситель Iowa black FQ (цепь Q, черная), которые образуют пару FRET. Пороговое усилие, приложенное к концам датчика, открывает его, переключая из погашенного состояния (высокий FRET) в флуоресцентное состояние (низкий FRET). B: Внешние концы нитей F и Q модифицированы лигандом HaloTag®. Лиганды HaloTag® ковалентно связываются с HaloTag® посредством слияния HaloTag® 37 . HaloTag® были генетически экспрессированы в клетках в виде слияния с RFP и LifeAct, актин-связывающим пептидом 38 . C: Для характеризации сенсорные шпильки были открыты с помощью дополнительной нити (оранжевой). Контрольный зонд был разработан без гасителя.
B: Внешние концы нитей F и Q модифицированы лигандом HaloTag®. Лиганды HaloTag® ковалентно связываются с HaloTag® посредством слияния HaloTag® 37 . HaloTag® были генетически экспрессированы в клетках в виде слияния с RFP и LifeAct, актин-связывающим пептидом 38 . C: Для характеризации сенсорные шпильки были открыты с помощью дополнительной нити (оранжевой). Контрольный зонд был разработан без гасителя.
Валидация на основе интенсивности флуоресценции
Сначала мы охарактеризовали датчик с помощью измерений интенсивности объемной флуоресценции (детали эксперимента см. в разделе «Методы»). Интенсивность флуоресценции сенсоров контролировали с помощью стандартного флуоресцентного спектрометра (люминесцентный спектрометр AMINCO-Bowman Series 2). Контроль только для донора (рис. 1C), используемый в качестве эталона для оценки эффективности FRET полного сенсора, и конструкции, для которой петля шпильки может быть открыта путем гибридизации с комплементарной нитью ДНК (цепь C) (рис. 1C) , использовался как имитатор открытого состояния датчика. В оставшейся части этой рукописи мы будем использовать следующую номенклатуру для различных конструкций: «закрытые датчики» — датчики в их собранной геометрии, содержащие как молекулы красителя, так и молекулы тушителя, «только донорский контроль» — собранные датчики, не содержащие гасителей, и «открытые сенсоры» — сенсоры, содержащие как флуорофор, так и гаситель, которые открываются С-цепью. Закрытые датчики демонстрируют интенсивность флуоресценции, которая составляет ок. в 15 раз слабее, чем у открытых датчиков (см. рис. 2А), что подтверждает сильное гашение на основе FRET. Мы проверили флуоресценцию сенсоров закрытых и открытых сенсоров при поперечном связывании с in vitro реконструировали актиновую сеть (см. рис. 2B). В этом случае мы наблюдали уменьшенное тушение для закрытых сенсоров по сравнению с неприкрепленными сенсорами в растворе (рис. 2А): интенсивность флуоресценции закрытых сенсоров составляла 50% от таковой открытых сенсоров при поперечном сшивании с актином (рис.
1C) , использовался как имитатор открытого состояния датчика. В оставшейся части этой рукописи мы будем использовать следующую номенклатуру для различных конструкций: «закрытые датчики» — датчики в их собранной геометрии, содержащие как молекулы красителя, так и молекулы тушителя, «только донорский контроль» — собранные датчики, не содержащие гасителей, и «открытые сенсоры» — сенсоры, содержащие как флуорофор, так и гаситель, которые открываются С-цепью. Закрытые датчики демонстрируют интенсивность флуоресценции, которая составляет ок. в 15 раз слабее, чем у открытых датчиков (см. рис. 2А), что подтверждает сильное гашение на основе FRET. Мы проверили флуоресценцию сенсоров закрытых и открытых сенсоров при поперечном связывании с in vitro реконструировали актиновую сеть (см. рис. 2B). В этом случае мы наблюдали уменьшенное тушение для закрытых сенсоров по сравнению с неприкрепленными сенсорами в растворе (рис. 2А): интенсивность флуоресценции закрытых сенсоров составляла 50% от таковой открытых сенсоров при поперечном сшивании с актином (рис. 2Б).
2Б).
Рис. 2:
Массовый флуоресцентный анализ сенсоров ДНК. Измерения проводились на коммерческом спектрометре, регистрирующем спектры излучения при длине волны возбуждения 488 нм. A: Открытые датчики (с цепью C) в растворе показывают более сильный сигнал флуоресценции (зеленая кривая), чем закрытые датчики (черная кривая). B: При прикреплении к актиновой сети интенсивность флуоресценции закрытых сенсоров (черная кривая) гасится менее сильно. C: Измерение времени жизни флуоресценции сенсорных молекул в водном буфере. Репрезентативные гистограммы TCSPC и подгонки, полученные для закрытых (красный) и контрольных только доноров (зеленый) датчиков соответственно. Д: Эффективность FRET рассчитана с использованием измеренных значений времени жизни флуоресценции закрытых и контрольных датчиков только донора. Стехиометрия сенсорной нити составляет 0,5:1:1 (F:H:Q)
In vitro характеристика ДНК-сенсоров по времени жизни флуоресценции
τ ) и использовали его для определения эффективности FRET датчика в растворе.
Эффективность FRET определяется количественно по соотношению
где E — эффективность FRET, а τ DA и τ D — время жизни флуоресценции донора в присутствии (закрытый сенсор) и в отсутствие (только донор, соответственно) . Высокая эффективность FRET свидетельствует о правильной сборке закрытого датчика (рис. 1). Все измерения времени жизни флуоресценции проводились с помощью коррелированного по времени счета одиночных фотонов (TCSPC) с помощью конфокального микроскопа 9.0571 39 .
Мы провели дальнейшие измерения в буфере, подходящем для актиновых сетей in vitro (состав буфера см. в таблице 3, вспомогательная информация). Мы также оптимизировали стехиометрию нитей F, H и Q, чтобы получить максимальное гашение флуоресцентного излучения. На рис. 2C представлены гистограммы TCSPC, измеренные для закрытых датчиков и контролей только для доноров. Подогнанные значения времени жизни флуоресценции 0,5 ± 0,1 нс для закрытых датчиков указывают на сильное гашение флуоресценции по сравнению со значениями времени жизни 3,7 ± 0,1 нс для донорских контролей. Исходя из измеренного срока службы закрытого датчика, мы делаем вывод, что эффективность FRET составляет 86,0 ± 3,2 %, что подтверждает правильную сборку датчиков. Долгоживущая компонента флуоресценции для закрытых сенсоров (3,7 ± 0,1 нс) указывает на существование непогашенной субпопуляции сенсоров. Вероятными объяснениями являются отсутствие нитей гасителя в некоторых собранных конструкциях или неправильное свертывание самих конструкций. Измеренные значения времени жизни флуоресценции открытых сенсоров в буфере ДНК-гибридизации составили 3,81 ± 0,03 нс. Это немного больше, чем время жизни флуоресценции донорских контролей, скорее всего, из-за внутрипетлевого тушения флуоресценции гуанозином посредством переноса электрона в контроле 40, 41 . Также представлены дополнительные измерения времени жизни флуоресценции для открытых сенсоров, а также для закрытых сенсоров, содержащих цепи F, H и Q в различных молярных соотношениях (таблица 4, вспомогательная информация).
Подогнанные значения времени жизни флуоресценции 0,5 ± 0,1 нс для закрытых датчиков указывают на сильное гашение флуоресценции по сравнению со значениями времени жизни 3,7 ± 0,1 нс для донорских контролей. Исходя из измеренного срока службы закрытого датчика, мы делаем вывод, что эффективность FRET составляет 86,0 ± 3,2 %, что подтверждает правильную сборку датчиков. Долгоживущая компонента флуоресценции для закрытых сенсоров (3,7 ± 0,1 нс) указывает на существование непогашенной субпопуляции сенсоров. Вероятными объяснениями являются отсутствие нитей гасителя в некоторых собранных конструкциях или неправильное свертывание самих конструкций. Измеренные значения времени жизни флуоресценции открытых сенсоров в буфере ДНК-гибридизации составили 3,81 ± 0,03 нс. Это немного больше, чем время жизни флуоресценции донорских контролей, скорее всего, из-за внутрипетлевого тушения флуоресценции гуанозином посредством переноса электрона в контроле 40, 41 . Также представлены дополнительные измерения времени жизни флуоресценции для открытых сенсоров, а также для закрытых сенсоров, содержащих цепи F, H и Q в различных молярных соотношениях (таблица 4, вспомогательная информация). Эти измерения помогли нам оптимизировать работу датчика.
Эти измерения помогли нам оптимизировать работу датчика.
Флуоресцентная визуализирующая микроскопия (FLIM) сенсоров, встроенных в актиновые сети
Затем мы проверили, насколько хорошо сохраняется функциональность сенсоров, когда они связаны с актиновыми филаментами в сеть. Сенсорную функцию снова измеряли с помощью микроскопии для визуализации времени жизни флуоресценции (FLIM). Мы восстановили два вида актиновых сетей in vitro , сшитые закрытыми сенсорами и открытыми сенсорами (С-цепь) соответственно, с концентрацией актина 24 мкМ и молярным отношением сшивающего агента к концентрации актин-мономера R = 0,1. FLIM-изображения были записаны для областей размером ~ 40 мкм × 40 мкм из шести соседних плоскостей z с интервалом 1 мкм м. Рисунок 3А иллюстрирует экспериментальную схему FLIM на актиновых сетях, сшитых с сенсорными конструкциями. Кривые TCSPC для сенсоров, помеченных Alexa488, внутри актиновых сетей показаны на рис. 3B. Закрытые сенсоры в актиновых сетях демонстрировали гораздо более быстрое затухание флуоресценции, чем сенсоры, содержащие открытые сенсоры. Короткая (погашенная) составляющая времени жизни оказалась равной 1,2 ± 0,1 нс и оставалась примерно постоянной для всех z -самолеты. Однако мы также наблюдали и долговременную (негашеную) составляющую 3,7 ± 0,1 нс. Поскольку результаты согласуются с измерениями времени жизни флуоресценции в «актиновом буфере», существование непогашенной субпопуляции сенсоров, вероятно, связано со связыванием актина. На рис. 3С показаны распределения значений времени жизни флуоресценции для закрытых и открытых сенсоров внутри актиновых сетей.
Закрытые сенсоры в актиновых сетях демонстрировали гораздо более быстрое затухание флуоресценции, чем сенсоры, содержащие открытые сенсоры. Короткая (погашенная) составляющая времени жизни оказалась равной 1,2 ± 0,1 нс и оставалась примерно постоянной для всех z -самолеты. Однако мы также наблюдали и долговременную (негашеную) составляющую 3,7 ± 0,1 нс. Поскольку результаты согласуются с измерениями времени жизни флуоресценции в «актиновом буфере», существование непогашенной субпопуляции сенсоров, вероятно, связано со связыванием актина. На рис. 3С показаны распределения значений времени жизни флуоресценции для закрытых и открытых сенсоров внутри актиновых сетей.
Рисунок 3:
Микроскопия флуоресцентной визуализации (FLIM) in vitro актиновые сети, сшитые сенсорами ДНК. A: Экспериментальная схема z -stack FLIM в актиновых сетях. FLIM-сканы записывались в разных фокальных плоскостях, отстоящих друг от друга на 1 мкм, но не более чем на 5 мкм над поверхностью стекла. Справа показана увеличенная схема сенсоров ДНК, прикрепленных к актиновым филаментам. B: гистограмм TCSPC, полученных из актиновой сети, сшитой с закрытыми и открытыми сенсорами ( R = 0,1). C: Распределение времени жизни флуоресценции для закрытых и открытых сенсоров, прикрепленных к актиновым сетям. Из двухкомпонентной подгонки к распаду бимодальное распределение времени жизни (синее), соответствующее короткой и длинной компонентам жизни, было получено для закрытых датчиков (1,16 ± 0,08 нс и 3,67 ± 0,06 нс), в то время как открытые датчики демонстрируют время жизни 3,84 ± 0,06 нс (красный) при поперечном сшивании с актиновой сетью. R = c сшивающий агент /c актин .
Справа показана увеличенная схема сенсоров ДНК, прикрепленных к актиновым филаментам. B: гистограмм TCSPC, полученных из актиновой сети, сшитой с закрытыми и открытыми сенсорами ( R = 0,1). C: Распределение времени жизни флуоресценции для закрытых и открытых сенсоров, прикрепленных к актиновым сетям. Из двухкомпонентной подгонки к распаду бимодальное распределение времени жизни (синее), соответствующее короткой и длинной компонентам жизни, было получено для закрытых датчиков (1,16 ± 0,08 нс и 3,67 ± 0,06 нс), в то время как открытые датчики демонстрируют время жизни 3,84 ± 0,06 нс (красный) при поперечном сшивании с актиновой сетью. R = c сшивающий агент /c актин .
Вязкоупругие свойства актиновых сетей, сшитых ДНК-сенсорами
Ожидается, что сшивка запутанных актиновых сетей сенсорными конструкциями сильно повлияет на вязкоупругие свойства сетей и, таким образом, может служить тестом на эффективность сенсора в связывание разных филаментов, а не связывание с одним и тем же филаментом. Для количественной оценки вязкоупругих свойств сенсорно-сшитых актиновых сетей мы измерили комплексные модули сдвига G ( ω ) таких сетей в экспериментах по частотной развертке между 0,01 и 1 Гц при амплитуде деформации 1% в реометре (MCR 501, Антон Паар). В этом диапазоне частот мы ожидаем поведение упругого плато с действительной частью G ( ω ), модулем накопления G ′, преобладающим над мнимой частью, модулем вязкости G ” (рис. 4 B и рис. С1 Б, С). В целом сенсорно-сшитые сети были значительно более жесткими, чем запутанный актин при той же концентрации 24 мк М актин. Запутанные актиновые сети показали эластичное плато на низких частотах с модулем накопления G ‘ = 0,4 Па, что согласуется с опубликованными исследованиями 42, 43,44 . Сети, сшитые сенсором, показали плато с G ′ в диапазоне от 0,5 до 1,2 Па (рис. 4A и рис. S1 A), в зависимости от концентрации сенсора (данной как R = концентрация сшивающего агента (сенсоры ДНК) / концентрация актина в таблице).
Для количественной оценки вязкоупругих свойств сенсорно-сшитых актиновых сетей мы измерили комплексные модули сдвига G ( ω ) таких сетей в экспериментах по частотной развертке между 0,01 и 1 Гц при амплитуде деформации 1% в реометре (MCR 501, Антон Паар). В этом диапазоне частот мы ожидаем поведение упругого плато с действительной частью G ( ω ), модулем накопления G ′, преобладающим над мнимой частью, модулем вязкости G ” (рис. 4 B и рис. С1 Б, С). В целом сенсорно-сшитые сети были значительно более жесткими, чем запутанный актин при той же концентрации 24 мк М актин. Запутанные актиновые сети показали эластичное плато на низких частотах с модулем накопления G ‘ = 0,4 Па, что согласуется с опубликованными исследованиями 42, 43,44 . Сети, сшитые сенсором, показали плато с G ′ в диапазоне от 0,5 до 1,2 Па (рис. 4A и рис. S1 A), в зависимости от концентрации сенсора (данной как R = концентрация сшивающего агента (сенсоры ДНК) / концентрация актина в таблице). 2, вспомогательная информация). При самой высокой концентрации сенсора, которую мы тестировали ( R = 0,2), мы нашли G ′ = 1,8 Па для сетей 1:1:1 (F:H:Q) (данные не показаны) и G ′ = 1,5 Па для 0,5:1:1 ( F:H:Q) сети (рис. S1 A). При высоких концентрациях сенсора ( R = 0,1 и R = 0,2) эластичность сети медленно увеличивалась со временем и не достигала стационарного модуля сдвига после > 1 ч (см. рис. 4A для R = 0,1 и рис. S1 A для R = 0,2). Сети с меньшей концентрацией датчиков ( R = 0,005, R = 0,01 и R = 0,02) стабилизировались через ~2000 с (рис. 4A и рис. S1 A). Как значительное увеличение модуля плато, так и медленное созревание сшитых актиновых сетей по направлению к стационарному состоянию согласуются с описанным поведением актиновых сетей, сшитых простыми двухцепочечными связями ДНК без сенсорных функций -45-.
2, вспомогательная информация). При самой высокой концентрации сенсора, которую мы тестировали ( R = 0,2), мы нашли G ′ = 1,8 Па для сетей 1:1:1 (F:H:Q) (данные не показаны) и G ′ = 1,5 Па для 0,5:1:1 ( F:H:Q) сети (рис. S1 A). При высоких концентрациях сенсора ( R = 0,1 и R = 0,2) эластичность сети медленно увеличивалась со временем и не достигала стационарного модуля сдвига после > 1 ч (см. рис. 4A для R = 0,1 и рис. S1 A для R = 0,2). Сети с меньшей концентрацией датчиков ( R = 0,005, R = 0,01 и R = 0,02) стабилизировались через ~2000 с (рис. 4A и рис. S1 A). Как значительное увеличение модуля плато, так и медленное созревание сшитых актиновых сетей по направлению к стационарному состоянию согласуются с описанным поведением актиновых сетей, сшитых простыми двухцепочечными связями ДНК без сенсорных функций -45-.
Рисунок 4:
Реология сенсорных сетей актин-ДНК. A: Эффект перекрестного связывания ДНК-сенсоров с актиновыми филаментами наблюдается по увеличению модуля упругости сдвига (G’, синяя и красная кривые). При высоких концентрациях сенсора ( R = 0,1), сеть становится более жесткой (увеличение G’), что свидетельствует о формировании хорошо сшитой сети. B: Частотная характеристика сетей в пределе линейной деформации при деформации 1%. Сети с перекрестными связями не демонстрируют какого-либо специфического частотно-зависимого поведения на исследуемых частотах. R = 0,01 указывает на сеть с низкой концентрацией сенсоров, R = 0,1 — сеть с высокой концентрацией сенсоров, а R = 0 указывает на запутанную актиновую сеть (без сенсоров). R = c сшивающий агент /c актин . Сплошные линии представляют собой средние значения, а заштрихованные области представляют собой стандартную ошибку среднего значения.
A: Эффект перекрестного связывания ДНК-сенсоров с актиновыми филаментами наблюдается по увеличению модуля упругости сдвига (G’, синяя и красная кривые). При высоких концентрациях сенсора ( R = 0,1), сеть становится более жесткой (увеличение G’), что свидетельствует о формировании хорошо сшитой сети. B: Частотная характеристика сетей в пределе линейной деформации при деформации 1%. Сети с перекрестными связями не демонстрируют какого-либо специфического частотно-зависимого поведения на исследуемых частотах. R = 0,01 указывает на сеть с низкой концентрацией сенсоров, R = 0,1 — сеть с высокой концентрацией сенсоров, а R = 0 указывает на запутанную актиновую сеть (без сенсоров). R = c сшивающий агент /c актин . Сплошные линии представляют собой средние значения, а заштрихованные области представляют собой стандартную ошибку среднего значения.
Изменения в структуре сенсорно-сшитых актиновых сетей, которые мы наблюдали в конфокальном микроскопе, соответствовали изменениям измеренной эластичности. При низких концентрациях сенсора ( R = 0,005, R = 0,01, R = 0,02) сети оказались изотропно сшитыми (рис. 5 A, B, C, D). При более высоких концентрациях сенсора R = 0,1 и R = 0,2 (рис. 5 E, F) сети стали неоднородными, с более плотными пучками актина, сосуществующими с гомогенным фоном сети. Эти пучки всегда наблюдались во всех образцах (рис. S2), что доказывает, что они не были поверхностными артефактами. Такие составные сети, включающие изолированные пучки, также наблюдали Лоренц и др. . 45 в своем исследовании сетей двухцепочечной ДНК-актина. Медленное приближение к механическому устойчивому состоянию (рис. 4А, 9).0563 R = 0,1), наблюдаемое в экспериментах по реологии, вероятно, отражает продолжающееся образование пучков, которые в конечном итоге будут просачиваться. Пучки в наших сетях наблюдаются только при высоких концентрациях сенсоров и, таким образом, не могут быть результатом разделения фаз, вызванного условиями растворителя, то есть изменениями концентрации ионов 46 .
При низких концентрациях сенсора ( R = 0,005, R = 0,01, R = 0,02) сети оказались изотропно сшитыми (рис. 5 A, B, C, D). При более высоких концентрациях сенсора R = 0,1 и R = 0,2 (рис. 5 E, F) сети стали неоднородными, с более плотными пучками актина, сосуществующими с гомогенным фоном сети. Эти пучки всегда наблюдались во всех образцах (рис. S2), что доказывает, что они не были поверхностными артефактами. Такие составные сети, включающие изолированные пучки, также наблюдали Лоренц и др. . 45 в своем исследовании сетей двухцепочечной ДНК-актина. Медленное приближение к механическому устойчивому состоянию (рис. 4А, 9).0563 R = 0,1), наблюдаемое в экспериментах по реологии, вероятно, отражает продолжающееся образование пучков, которые в конечном итоге будут просачиваться. Пучки в наших сетях наблюдаются только при высоких концентрациях сенсоров и, таким образом, не могут быть результатом разделения фаз, вызванного условиями растворителя, то есть изменениями концентрации ионов 46 . Связки также вряд ли будут управляться силами истощения из-за ДНК. Формирование пучков, управляемое энтропией, должно приводить к потере связности/запутанности в актине 9.0571 47 . Это не относится к нашим сенсорно-сшитым актиновым сетям, поскольку их эластичность остается высокой, что указывает на хорошую связь между сенсорами и актином.
Связки также вряд ли будут управляться силами истощения из-за ДНК. Формирование пучков, управляемое энтропией, должно приводить к потере связности/запутанности в актине 9.0571 47 . Это не относится к нашим сенсорно-сшитым актиновым сетям, поскольку их эластичность остается высокой, что указывает на хорошую связь между сенсорами и актином.
Рисунок 5:
Морфология актиновых сетей, сшитых ДНК-сенсором. Изображения конфокального лазерного сканирования A: запутанного актина ( R = 0) и B-F: сшитых ДНК-сенсор сетей (от R = 0,01 до R = 0,2). Изотропно сшитая сетка наблюдается для всех нижних R -значения ( R = 0,005, R = 0,01, R = 0,02), которые визуально не отличаются от запутанной актиновой сети ( R = 0). При более высоких концентрациях сенсора ( R = 0,1, R = 0,2) возникают сложные сетчатые структуры, имеющие вид пучков, встроенных в сшитую сеть. R = c сшиватель /c актин . Масштабная линейка: 30 мкм. Врезная шкала: 10 мкм. Вставки A, B, C, D представляют собой увеличенные изображения. Врезки E и F представляют собой увеличенные изображения для указанного комплекта. Актин флуоресцентно помечен Atto 647N-фаллоидином.
R = c сшиватель /c актин . Масштабная линейка: 30 мкм. Врезная шкала: 10 мкм. Вставки A, B, C, D представляют собой увеличенные изображения. Врезки E и F представляют собой увеличенные изображения для указанного комплекта. Актин флуоресцентно помечен Atto 647N-фаллоидином.
Определение характеристик датчиков внутри живых клеток
Наконец, мы исследовали пригодность наших датчиков для измерений в живых клетках. С этой целью клетки HeLa трансфицировали HaloTag®-RFP-LifeAct с последующей микроинъекцией 50 нМ раствора закрытых сенсоров ДНК (подробности см. на рис. S3). На рис. 6А показаны конфокальные микрофотографии клетки HeLa как в сенсорном (слева), так и в спектральном канале RFP (актин, средняя панель). Изображения показывают отличную совместную локализацию сенсоров и актиновых стрессовых волокон (рис. 6А, правая панель, рис. S4). Мы наблюдали среднее время жизни флуоресценции 2,2 ± 0,5 нс для сенсоров ДНК с красителем внутри живых клеток, как показано на рис. 6B, рис. 6C и рис. S5. Эти результаты подтверждают, что представленная здесь MFS применима для визуализации FLIM внутри живых клеток, что открывает возможности прямого количественного определения клеточных сил.
6B, рис. 6C и рис. S5. Эти результаты подтверждают, что представленная здесь MFS применима для визуализации FLIM внутри живых клеток, что открывает возможности прямого количественного определения клеточных сил.
Рисунок 6:
Клетки HeLa с микроинъекцией закрытых сенсоров ДНК. A: Конфокальные микрофотографии клетки с ложным окрашиванием по интенсивности флуоресценции. Изображения, соответствующие закрытому датчику ДНК с меткой Alexa 488, записанные в спектральном канале датчика силы ДНК (слева), той же ячейке в спектральном канале RFP (в центре) и наложение между обоими каналами (справа), подтверждают совместную локализацию между датчиками ДНК и актин. B: FLIM-изображение той же ячейки, что и в A проиллюстрирован для спектрального канала датчика силы ДНК. C: Столбчатая гистограмма, показывающая подогнанные времена жизни флуоресценции, полученные для B . Среднее время жизни флуоресценции 2,2 ± 0,5 нс было рассчитано для сенсоров силы ДНК.
Среднее время жизни флуоресценции 2,2 ± 0,5 нс было рассчитано для сенсоров силы ДНК.
В этом технико-экономическом обосновании мы сконструировали и протестировали датчик молекулярной силы на основе ДНК, предназначенный для прикрепления и сшивания актиновых филаментов в цитоскелете клеток. Наши датчики предназначены для измерения внутренних напряжений клетки, которые не обязательно будут передаваться в окружающую среду клетки. Датчики используют FRET между синтетическим органическим красителем и гасителем, который можно считывать с помощью визуализации интенсивности флуоресценции или времени жизни флуоресценции. Датчики можно использовать в в экспериментах in vitro или в клетках. Они могут быть напрямую присоединены к любому клеточному компоненту (здесь мы нацелились на актин) гибким образом с помощью связывания белков или их фрагментов с использованием системы HaloTag®. Мы протестировали характеристики связывания сенсоров с актиновыми сетями, основным компонентом цитоскелета клеток. Эффективность гашения составила 86,0 ± 3,2 %, что сравнимо с другими зарегистрированными датчиками силы ДНК, которые, в отличие от нашего, были разработаны для прикрепления к поверхности 29, 36 . Наши ДНК-сенсоры в виде шпилек размером 8 п.н. можно легко модифицировать, изменив длину шпильки и содержание GC для измерения силы в различных диапазонах 32–36 . В нашем случае сенсоров сшивания актина можно использовать различные инструменты связывания 48 или мутантные ABP. Связывающие белки или фрагменты имеют сильно различающиеся скорости диссоциации 49, 50 , что наделяет сенсоры функцией временного фильтра верхних частот: будут обнаружены только изменения силы, которые происходят быстрее, чем обратная скорость диссоциации. Дизайн нашего датчика — это первый шаг к изучению передачи силы через клеточные биополимерные сети. Следующей серьезной задачей будет изучение эффектов геометрии прикрепления. В отличие от сенсоров, которые располагались между клетками и подложками или были встроены в более или менее одномерные структуры, несущие нагрузку, такие как фокальные спайки, сетевые сенсоры, скорее всего, будут связываться в очень неоднородных направлениях и конфигурациях, испытывая сильно различающееся воздействие на молекулярные молекулы.
Эффективность гашения составила 86,0 ± 3,2 %, что сравнимо с другими зарегистрированными датчиками силы ДНК, которые, в отличие от нашего, были разработаны для прикрепления к поверхности 29, 36 . Наши ДНК-сенсоры в виде шпилек размером 8 п.н. можно легко модифицировать, изменив длину шпильки и содержание GC для измерения силы в различных диапазонах 32–36 . В нашем случае сенсоров сшивания актина можно использовать различные инструменты связывания 48 или мутантные ABP. Связывающие белки или фрагменты имеют сильно различающиеся скорости диссоциации 49, 50 , что наделяет сенсоры функцией временного фильтра верхних частот: будут обнаружены только изменения силы, которые происходят быстрее, чем обратная скорость диссоциации. Дизайн нашего датчика — это первый шаг к изучению передачи силы через клеточные биополимерные сети. Следующей серьезной задачей будет изучение эффектов геометрии прикрепления. В отличие от сенсоров, которые располагались между клетками и подложками или были встроены в более или менее одномерные структуры, несущие нагрузку, такие как фокальные спайки, сетевые сенсоры, скорее всего, будут связываться в очень неоднородных направлениях и конфигурациях, испытывая сильно различающееся воздействие на молекулярные молекулы. масштаб в деформирующих сетях. Технология, которую мы представили здесь, откроет дверь для полностью оптического и неинвазивного измерения этих сил в сложных средах, таких как клетки и ткани.
масштаб в деформирующих сетях. Технология, которую мы представили здесь, откроет дверь для полностью оптического и неинвазивного измерения этих сил в сложных средах, таких как клетки и ткани.
Методы
Дизайн сенсорной последовательности и химические модификации
Сенсорные последовательности (см. вспомогательную таблицу 1) были разработаны на веб-сайте NUPACK 51 , а олигомеры ДНК были приобретены у Integrated DNA Technologies (Левен, Бельгия). Лиофилизированные порошки восстанавливали до исходных концентраций 100 или 500 мкМ путем добавления соответствующего объема буфера для гибридизации ДНК (см. вспомогательную таблицу 3). Сенсоры были дополнительно химически модифицированы на 3’-конце F-цепи и 5’-конце Q-цепи (см. Таблицу 1, вспомогательную информацию). Эти нити были приобретены с включенными тиоловыми группами на соответствующих концах (см. вспомогательную информацию в таблице 1). Обе нити были модифицированы по отдельности. От 50 мкл до 100 мкл 30 мкМ растворов этих цепей готовили путем разбавления в буферах для гибридизации ДНК и восстанавливали 2 мМ TCEP (трис(2-карбоксиэтил)фосфингидрохлорид, Sigma-Aldrich, Германия) путем инкубации при комнатной температуре в течение 60 минут. Затем йодацетамид (O 4 ) Лиганд HaloTag® (Promega, Мэдисон, США) добавляли к указанному выше раствору до конечной концентрации 20 мкМ и инкубировали в течение 90 мин.
Затем йодацетамид (O 4 ) Лиганд HaloTag® (Promega, Мэдисон, США) добавляли к указанному выше раствору до конечной концентрации 20 мкМ и инкубировали в течение 90 мин.
Сборка сенсоров ДНК
Объем 50 мкл раствора закрытых сенсоров или донорских контролей готовили путем добавления модифицированной цепи F (до 5 мкМ), модифицированной нити Q или Q ™ (до 10 мкМ) и Н-цепь (до конечной концентрации 10 мкМ) в ДНК-буфер. Таким же образом были собраны открытые датчики с последующим добавлением С-цепи (комплементарной нити к петле шпильки). Молярная концентрация С-цепи была в 10 раз больше, чем концентрация Н-цепи. Конечные концентрации сенсоров и донорских контролей варьировали в зависимости от эксперимента (см. Таблицу 2), в то время как соотношения сохранялись постоянными на уровне 0,5:1:1 (F:H:Q) во всех экспериментах.
Препарат сенсорной сети актин и актин-ДНК
G-актин получали из скелетных мышц кролика в соответствии с опубликованными протоколами 52–54 . Очищенный актин хранили небольшими аликвотами при -80°С. Аликвоты размораживали перед экспериментами. К соответствующему объему воды добавляли концентрированный 10-кратный полимеризационный буфер (композицию актинового буфера см. во вспомогательной таблице 3, Polymix 10X, Hypermol). Добавляли G-актин до достижения конечной концентрации 24 мкМ (1 мг/мл). Концентрация актина оставалась неизменной на протяжении всего эксперимента. Для построения сенсорных сетей актин-ДНК добавляли белок Lifeact-RFP-HaloTag® до конечной концентрации 30 мкМ. Затем добавляли модифицированные и собранные датчики или контроли только для доноров, приготовленные, как описано выше. Концентрации сенсора варьировали от 0 мкМ до 4,7 мкМ ( R -соотношение, см. вспомогательную таблицу 2). Для экспериментов по визуализации в конце добавляли 10% объема исходного раствора Atto 647N, фаллоидин (Atto-TEC GmbH, Siegen) с концентрацией 10 нмоль. Растворы осторожно пипетировали для распределения компонентов, а затем заливали в камеру микроскопа.
Очищенный актин хранили небольшими аликвотами при -80°С. Аликвоты размораживали перед экспериментами. К соответствующему объему воды добавляли концентрированный 10-кратный полимеризационный буфер (композицию актинового буфера см. во вспомогательной таблице 3, Polymix 10X, Hypermol). Добавляли G-актин до достижения конечной концентрации 24 мкМ (1 мг/мл). Концентрация актина оставалась неизменной на протяжении всего эксперимента. Для построения сенсорных сетей актин-ДНК добавляли белок Lifeact-RFP-HaloTag® до конечной концентрации 30 мкМ. Затем добавляли модифицированные и собранные датчики или контроли только для доноров, приготовленные, как описано выше. Концентрации сенсора варьировали от 0 мкМ до 4,7 мкМ ( R -соотношение, см. вспомогательную таблицу 2). Для экспериментов по визуализации в конце добавляли 10% объема исходного раствора Atto 647N, фаллоидин (Atto-TEC GmbH, Siegen) с концентрацией 10 нмоль. Растворы осторожно пипетировали для распределения компонентов, а затем заливали в камеру микроскопа.
Белки LifeAct-RFP-HaloTag®, используемые для прикрепления сенсоров к актиновым сетям in vitro , были бактериально экспрессированы и очищены в соответствии со стандартными процедурами и добавлены к описанным выше растворам модифицированных F- и Q-цепей. LifeAct-RFP-HaloTag® ковалентно связывается с йодацетамидом (O 4 ) Лиганд HaloTag® на цепях F и Q.
Измерения интенсивности флуоресценции
Измерения интенсивности флуоресценции проводили с помощью люминесцентного спектрометра AMINCO-Bowman Series 2 (Thermo Electron Scientific Instruments Corporation, Madison, WI 53711, USA). Спектры излучения измеряли при следующих настройках прибора: длина волны возбуждения — 488 нм, длина волны излучения — 520 нм, полоса пропускания — 1, диапазон сканирования излучения 490 — 600 нм.
Реологические измерения
Реологические измерения проводились с помощью коммерческого реометра (MCR 501 Anton Paar, Австрия) в геометрии конус-пластина (CP-25, 2°). Полимеризацию сеток контролировали в измерениях развертки во времени с колебательным сдвигом при амплитуде деформации 1%, частоте 1 Гц и температуре 23°С. Чтобы предотвратить испарение во время измерений, гидратацию образца поддерживали, помещая влажную папиросную бумагу вокруг измерительных пластин. Получены модули накопления и потерь сетей. Вязкоупругие свойства сети определялись из измерений частотной развертки, выполненных после временной развертки для всех сетей. Диапазон частот составлял от 0,01 Гц до 10 Гц при деформации 1% (см. рис. S1 и рис. S2). В сетки, используемые для реологических экспериментов, фаллоидин не добавляли.
Полимеризацию сеток контролировали в измерениях развертки во времени с колебательным сдвигом при амплитуде деформации 1%, частоте 1 Гц и температуре 23°С. Чтобы предотвратить испарение во время измерений, гидратацию образца поддерживали, помещая влажную папиросную бумагу вокруг измерительных пластин. Получены модули накопления и потерь сетей. Вязкоупругие свойства сети определялись из измерений частотной развертки, выполненных после временной развертки для всех сетей. Диапазон частот составлял от 0,01 Гц до 10 Гц при деформации 1% (см. рис. S1 и рис. S2). В сетки, используемые для реологических экспериментов, фаллоидин не добавляли.
Конфокальная визуализация сетей
Камеры микроскопа были сконструированы из очищенных КОН предметных стекол (631-1550, VWR, Германия) и покровных стекол (№ 1,5, 24×24 мм, VWR, Германия) с использованием двух полосок (3 мм) оптически прозрачного двустороннего скотча (толщина 50 мкм, 3M™, #8212, США). 50 мкл раствора сенсора актина или актин-ДНК осторожно помещали в середину камеры перед ее закрытием. Растворы распространяются при аккуратном размещении покровного стекла сверху. Следили за тем, чтобы в камере не было пузырьков воздуха. Затем камеры немедленно запечатывали VALAP (смесь вазелина, ланолина и парафина) и обертывали алюминиевой фольгой для предотвращения фотообесцвечивания во время полимеризации. Визуализацию проводили после завершения полимеризации (1 час). Сети визуализировали с помощью конфокального микроскопа Leica TCS SP5 (Leica Microsystems CMS GmbH, Мангейм, Германия) для исследования морфологии полученных сетей. Мы записывали конфокальные сканы по всей глубине сетей ( z — сканы). Лазер белого света (спецификация) использовался для освещения с максимальной интенсивностью 20 % для сенсорного канала (длина волны возбуждения — 488 нм) и максимальной интенсивностью 22 % для канала визуализации актиновой сети (длина волны возбуждения — 647 нм). Получение изображения xyz (1024 × 1024 пикселей) было выполнено с двунаправленным сканированием, при этом каждая строка сканировалась 16 раз (среднее значение строки = 16) со скоростью 700 Гц.
Растворы распространяются при аккуратном размещении покровного стекла сверху. Следили за тем, чтобы в камере не было пузырьков воздуха. Затем камеры немедленно запечатывали VALAP (смесь вазелина, ланолина и парафина) и обертывали алюминиевой фольгой для предотвращения фотообесцвечивания во время полимеризации. Визуализацию проводили после завершения полимеризации (1 час). Сети визуализировали с помощью конфокального микроскопа Leica TCS SP5 (Leica Microsystems CMS GmbH, Мангейм, Германия) для исследования морфологии полученных сетей. Мы записывали конфокальные сканы по всей глубине сетей ( z — сканы). Лазер белого света (спецификация) использовался для освещения с максимальной интенсивностью 20 % для сенсорного канала (длина волны возбуждения — 488 нм) и максимальной интенсивностью 22 % для канала визуализации актиновой сети (длина волны возбуждения — 647 нм). Получение изображения xyz (1024 × 1024 пикселей) было выполнено с двунаправленным сканированием, при этом каждая строка сканировалась 16 раз (среднее значение строки = 16) со скоростью 700 Гц. Результирующее поле зрения составляло 100 мкм x 100 мкм. Был использован коэффициент масштабирования 2,5. Размер пинхола 1 единица Эйри (95,4 мкм), и были получены стопки z с шагом 3 мкм.
Результирующее поле зрения составляло 100 мкм x 100 мкм. Был использован коэффициент масштабирования 2,5. Размер пинхола 1 единица Эйри (95,4 мкм), и были получены стопки z с шагом 3 мкм.
Измерение времени жизни флуоресценции в водном буфере
Использовался самодельный конфокальный микроскоп, способный измерять время жизни флуоресценции. Возбуждение осуществлялось импульсным диодным лазером с линейной поляризацией ( λ = 485 нм, длительность импульса 50 пс на полувысоте, LDH-P-C-485B, PicoQuant), оснащенным очищающим фильтром (Brightline FF01-480/17, Semrock). Свет этого лазера был импульсным с частотой повторения 40 МГц с многоканальным драйвером пикосекундного лазера (PDL 828, «Sepia II», PicoQuant). Лазерный луч вводится в одномодовое волокно с сохранением поляризации (PMC-400-4.2-NA010-3-APC-250V, Schäfter and Kirchhoff GmbH). На выходе волокна свет коллимируется и отражается дихроичным зеркалом (технология FITC/TRITC Chroma) в линзу объектива микроскопа (UPLSAPO 60x water, 1,2 NA, Olympus). Тот же водно-иммерсионный объектив используется для регистрации флуоресценции образца. Фильтр длинного пропускания (BLP01-488R-25, Semrock) используется для блокировки обратного рассеяния света от лазера. Испускаемый свет фокусируется в отверстие диаметром 100 мкм, снова коллимируется, перефокусируется на однофотонный лавинный фотодиод (SPCM — CD 3516 H, Excelitas Technologies GmbH & Co. KG). Многоканальный пикосекундный таймер событий (HydraHarp 400, PicoQuant) регистрирует зарегистрированные фотоны от детектора с абсолютным временным разрешением 16 пс. Для измерений продолжительности жизни каплю 30 мкл ДНК-сенсоров, растворенных в буфере для гибридизации ДНК (состав буфера см. в таблице 3), помещали на покровное стекло (24 мм × 24 мм, толщина 170 мкм). Лазерный луч был сфокусирован на 30 мкм внутри капли, после чего был начат сбор данных. Гистограммы TCSPC рассчитывали по зарегистрированным фотонам, и моноэкспоненциальные (открытые сенсоры и контрольные только доноры) и биэкспоненциальные (для закрытых сенсоров) функции затухания подгоняли к хвостам гистограмм (0,5 нс после максимума) с использованием максимума.
Тот же водно-иммерсионный объектив используется для регистрации флуоресценции образца. Фильтр длинного пропускания (BLP01-488R-25, Semrock) используется для блокировки обратного рассеяния света от лазера. Испускаемый свет фокусируется в отверстие диаметром 100 мкм, снова коллимируется, перефокусируется на однофотонный лавинный фотодиод (SPCM — CD 3516 H, Excelitas Technologies GmbH & Co. KG). Многоканальный пикосекундный таймер событий (HydraHarp 400, PicoQuant) регистрирует зарегистрированные фотоны от детектора с абсолютным временным разрешением 16 пс. Для измерений продолжительности жизни каплю 30 мкл ДНК-сенсоров, растворенных в буфере для гибридизации ДНК (состав буфера см. в таблице 3), помещали на покровное стекло (24 мм × 24 мм, толщина 170 мкм). Лазерный луч был сфокусирован на 30 мкм внутри капли, после чего был начат сбор данных. Гистограммы TCSPC рассчитывали по зарегистрированным фотонам, и моноэкспоненциальные (открытые сенсоры и контрольные только доноры) и биэкспоненциальные (для закрытых сенсоров) функции затухания подгоняли к хвостам гистограмм (0,5 нс после максимума) с использованием максимума. процедура правдоподобия, как описано в другом месте 55 . Мы также выполнили измерения времени жизни флуоресценции на сенсорах ДНК, растворенных в водном буфере, подходящем для актиновых сетей. Еще одной целью измерений времени жизни флуоресценции in vitro был поиск оптимального молярного соотношения между отдельными нитями, чтобы присутствовало достаточное количество F-цепей для перекрестного связывания актиновых филаментов. Не менее важно было получить молярное соотношение, обеспечивающее максимальное гашение времени жизни флуоресценции. Для соответствия обоим критериям мы варьировали молярную концентрацию F-цепи в закрытом сенсоре и определяли время жизни флуоресценции для четырех различных молярных соотношений: 2:2:2, 1:2:2, 0,5:2:2 и 0,25:2: 2 (Ф:Ч:К). В таблице 4 (вспомогательная информация) перечислены значения времени жизни флуоресценции, полученные из TCSPC для всех различных конструкций. Эти значения предполагают, что молярное соотношение 0,5:2:2 содержит достаточное количество F-цепей для удовлетворения обоим критериям.
процедура правдоподобия, как описано в другом месте 55 . Мы также выполнили измерения времени жизни флуоресценции на сенсорах ДНК, растворенных в водном буфере, подходящем для актиновых сетей. Еще одной целью измерений времени жизни флуоресценции in vitro был поиск оптимального молярного соотношения между отдельными нитями, чтобы присутствовало достаточное количество F-цепей для перекрестного связывания актиновых филаментов. Не менее важно было получить молярное соотношение, обеспечивающее максимальное гашение времени жизни флуоресценции. Для соответствия обоим критериям мы варьировали молярную концентрацию F-цепи в закрытом сенсоре и определяли время жизни флуоресценции для четырех различных молярных соотношений: 2:2:2, 1:2:2, 0,5:2:2 и 0,25:2: 2 (Ф:Ч:К). В таблице 4 (вспомогательная информация) перечислены значения времени жизни флуоресценции, полученные из TCSPC для всех различных конструкций. Эти значения предполагают, что молярное соотношение 0,5:2:2 содержит достаточное количество F-цепей для удовлетворения обоим критериям.
Введение сенсоров в живые клетки
Введение сенсоров в живые клетки проводили в два этапа (см. рис. S3). Клетки HeLa (ACC 173, Институт Лейбница, DMSZ, Брауншвейг, Германия) культивировали до слияния в колбах T75 и пассировали следующим образом. Их промывали 10 мл PBS (физиологический раствор с фосфатным буфером), обрабатывали трипсином в течение 3 минут с 5 мл раствора ЭДТА/трипсина (0,05%, 59417C, Gibco, Thermo Fisher) и разбавляли DMEM с низким содержанием глюкозы (среда Игла, модифицированная Дульбекко). , SigmaAldrich, Сент-Луис, Миссури, США), содержащий 10 % эмбриональной телячьей сыворотки (FBS) (# F0244, Sigma-Aldrich, инактивированная нагреванием (30 мин, 56 °C) и 1 % пенициллин-стрептомицин (# 17-602E). , Lonza, Базель, Швейцария). Затем клеточный раствор центрифугировали в течение 5 мин при 1000 об/мин, и полученный осадок ресуспендировали в 1000 мкл DMEM. 40 000 клеток высевали на µ-чашки ibidi (#81166, ibidi, Германия). Через 48 ч после посева клеток в чашки для ибидо клетки трансфицировали плазмидой lifeact-RFP-HaloTag® с использованием реагента липофектамин 3000 (L3000001, Thermo Fisher Scientific, Германия). После ∼24 ч экспрессии небольшие объемы сенсора ДНК 50 нМ раствор в среде без фенолового красного микроинъецировали в клетки с помощью Transjector 5246 (Eppendorf, Hamburg, Ger, 5246 01 084) в сочетании с Femtotips (Eppendorf, Hamburg, Ger, 930000035). Инъекцию осуществляли близко к ядру импульсами длительностью 3 с.
После ∼24 ч экспрессии небольшие объемы сенсора ДНК 50 нМ раствор в среде без фенолового красного микроинъецировали в клетки с помощью Transjector 5246 (Eppendorf, Hamburg, Ger, 5246 01 084) в сочетании с Femtotips (Eppendorf, Hamburg, Ger, 930000035). Инъекцию осуществляли близко к ядру импульсами длительностью 3 с.
Измерения FLIM в живых клетках
Измерения продолжительности жизни проводили в течение 1 часа после микроинъекции сенсорной конструкции в клетки HeLa. Среда для визуализации состояла из: среды без фенола (DMEM, Gibco, 1X, 11880-028, Life Technologies, Великобритания) с 10 % фетальной бычьей сыворотки (FBS), инактивированной нагреванием (30 мин, 56 °C), (# F0244, Sigma-Aldrich) и 1 % пенициллинстрептомицина (№ 17-602E, Lonza, Базель, Швейцария). Измерения FLIM проводились с использованием того же конфокального микроскопа, изготовленного по индивидуальному заказу, описанного выше. Вкратце, лазерный луч был сфокусирован на отдельных клетках, и сканирование FLIM было записано с нескольких областей интереса. Гистограммы TCSPC для каждого пикселя были рассчитаны, а затем подобраны с использованием биэкспоненциальной функции затухания. Среднее значение времени жизни было рассчитано для каждого пикселя, взвешивая компоненты времени жизни с соответствующими фотонами флуоресценции (как используется для подбора TCSPC). Полученные значения средних значений времени жизни, взвешенных по интенсивности, выделены цветом на изображениях FLIM на рис. S4 вспомогательной информации и рис. 6 в основном тексте.
Гистограммы TCSPC для каждого пикселя были рассчитаны, а затем подобраны с использованием биэкспоненциальной функции затухания. Среднее значение времени жизни было рассчитано для каждого пикселя, взвешивая компоненты времени жизни с соответствующими фотонами флуоресценции (как используется для подбора TCSPC). Полученные значения средних значений времени жизни, взвешенных по интенсивности, выделены цветом на изображениях FLIM на рис. S4 вспомогательной информации и рис. 6 в основном тексте.
Доступность данных
Все данные, подтверждающие результаты, описанные в этом исследовании, доступны в рукописи и соответствующей вспомогательной информации, а также от соответствующих авторов по запросу.
Вклад авторов
Ф.Р. и К.Ф.С. задумал исследование; Ф.Р. и К.Ф.С., А.Т. и М.П. разработал конструкции ДНК, М.П. провел предварительные эксперименты. CJ (подготовка сенсора, объемная флуоресценция, визуализация сетей, реология, культура клеток) и AG (визуализация FLIM) выполнили описанные здесь эксперименты с помощью LH для клеточных экспериментов (микроинъекция). J.E. руководил экспериментами FLIM, F.R. и C.F.S контролировали все остальные эксперименты, C.J., A.G., J.E., F.R. и К.Ф.С. написал рукопись.
J.E. руководил экспериментами FLIM, F.R. и C.F.S контролировали все остальные эксперименты, C.J., A.G., J.E., F.R. и К.Ф.С. написал рукопись.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Авторы благодарят Fred Wouters за содержательные обсуждения. Эта работа была финансово поддержана Deutsche Forschungsgemeinschaft (DFG, Немецкий исследовательский фонд) через проект A03 (FR и CFS) Совместного исследовательского центра 755 (SFB 755). Компания J.E. также получила поддержку Deutsche Forschungsgemeinschaft (DFG, Немецкий исследовательский фонд) в рамках Стратегии совершенства Германии — EXC 2067/1-39.0729940.

 & Lappalainen, P. Стрессовые волокна генерируются двумя различными механизмами сборки актина в подвижных клетках. J. Cell Biol . 173, 383–394 (2006).
& Lappalainen, P. Стрессовые волокна генерируются двумя различными механизмами сборки актина в подвижных клетках. J. Cell Biol . 173, 383–394 (2006).  et al. Свойства силы, оказываемой филоподиями и ламеллоподиями, и участие компонентов цитоскелета. PloS one 2, e1072 (2007 г.).
et al. Свойства силы, оказываемой филоподиями и ламеллоподиями, и участие компонентов цитоскелета. PloS one 2, e1072 (2007 г.). 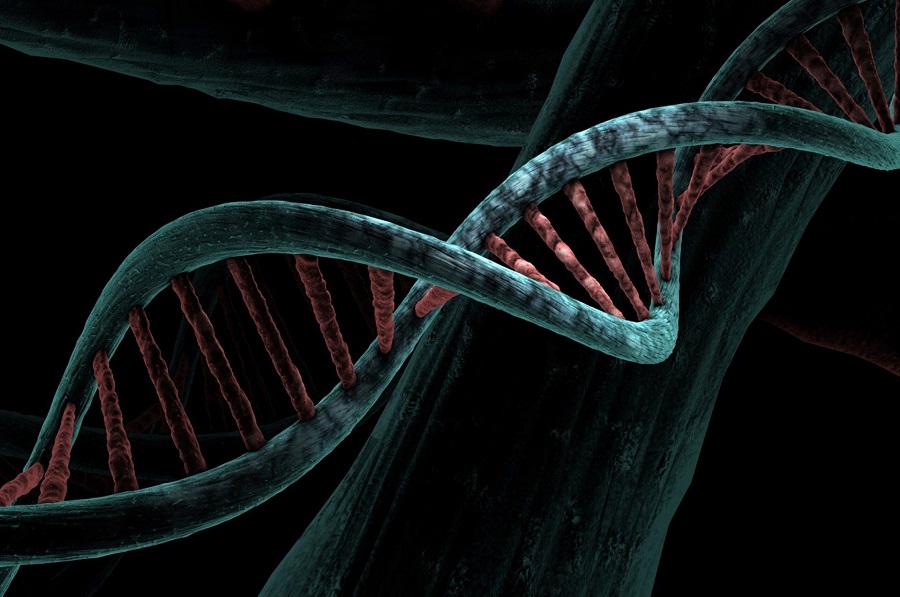 Нац. Физика 6, 468–473 (2010).
Нац. Физика 6, 468–473 (2010).  , Fernandez, J.M. & Gaub, H.E. Обратимое развертывание отдельных доменов титина иммуноглобулина с помощью afm. Наука 276, 1109–1112 (1997).
, Fernandez, J.M. & Gaub, H.E. Обратимое развертывание отдельных доменов титина иммуноглобулина с помощью afm. Наука 276, 1109–1112 (1997). 

 bioRxiv (2020).
bioRxiv (2020).  Нац. Коммуна . 5, 1–10 (2014).
Нац. Коммуна . 5, 1–10 (2014).  Рез. нуклеиновых кислот . 30, e122–e122 (2002).
Рез. нуклеиновых кислот . 30, e122–e122 (2002).  Доп. Мать . 30, 1706092 (2018).
Доп. Мать . 30, 1706092 (2018). 