Содержание
Человеческий мини-мозг прижился в мозге крысы и среагировал на прикосновение к усам
Модели органа, сделанные из клеток человека, прижились и развились в мозге крыс, после чего повлияли на поведение грызунов
Ученые из США придумали, как улучшить создание моделей человеческого мозга. В исследовании, опубликованном в Nature, утверждается, что пересадка мозгового органоида новорожденным крысам позволяет добиться того, что не получалось раньше: искусственный мини-мозг приживается и взаимодействует с другими клетками в организме крысы, в том числе реагирует на внешние раздражители — например, на прикосновение к усам.
Поскольку изучать головной мозг и его патологии на человеке сложно, ученые вынуждены использовать для этой цели лабораторных животных — грызунов или даже собак. Проблема в том, что такие модели не отражают все характеристики человеческого мозга и процессы в нем. Поэтому ученые стараются сделать мини-модели головного мозга из стволовых клеток человека — мозговые органоиды.
Чтобы сделать структуру, похожую на человеческий мозг, ученые выращивают стволовые клетки в окружении, которое заставляет их становиться клетками мозга. После этого органоид переносят животным, чтобы проверить, как он работает. И вот тут начинаются проблемы. Из-за своего искусственного происхождения мини-мозги не могут нормально развиваться в организме, а значит и функционировать должным образом, взаимодействуя с другими частями мозга грызунов. Ученые стараются решить проблему, создавая новые подходы к созданию и пересадке органоидов.
Команда исследователей из Стэнфордского университета под руководством Серджиу Пашка (Sergiu P. Pașca) продвинулась в этом деле. Они перенесли мозговой органоид новорожденным крысам, а не взрослым, как делали их коллеги. В этот период мозг еще не завершил свое развитие, что позволило органоиду прижиться и встроиться в его структуру. Кроме того, у крыс не было тимуса, а значит их адаптивный иммунитет не смог атаковать трансплантат.
Мозговые органоиды не только прижились в мозгу крыс: ученые отметили девятикратное увеличение объема трансплантата через три месяца после операции.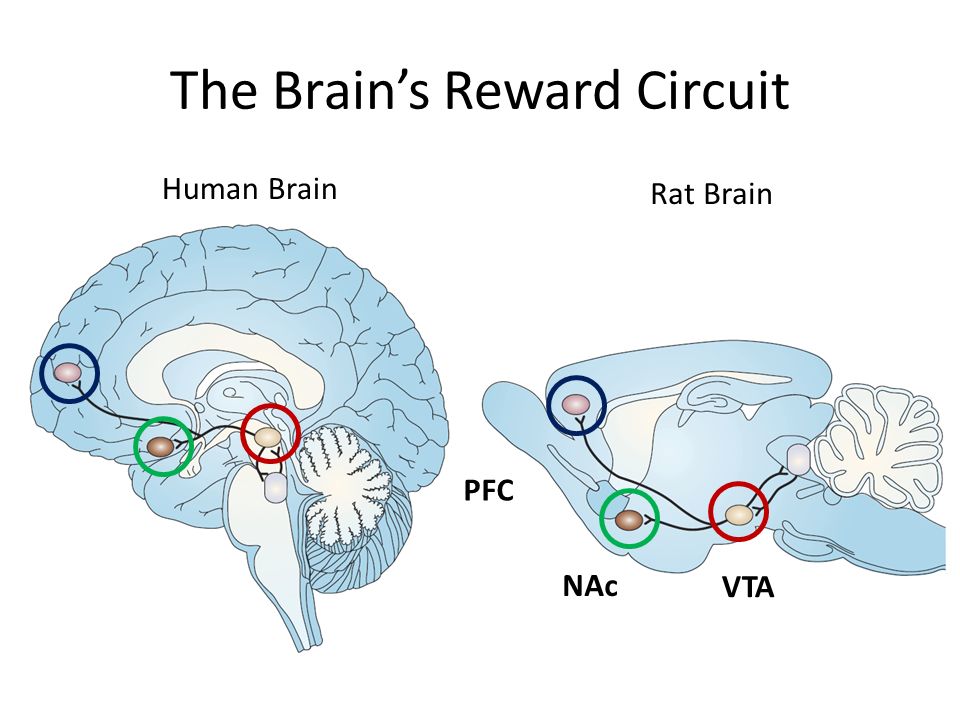 Более того, внутри него появились сосуды и клетки микроглии — макрофаги нервной системы.
Более того, внутри него появились сосуды и клетки микроглии — макрофаги нервной системы.
Клетки мозгового органоида, который встроили в организм грызунов, стали отличаться от тех, что выращивали in vitro. Они больше и экспрессируют гены, связанные с созреванием нейронов, а значит — ученые добились развития органоида в живом организме.
Кроме того, ученые выяснили, что с помощью мозгового органоида можно влиять на поведение крыс, для чего использовали методы оптогенетики. Сначала исследователи сделали органоид, который экспрессировал светочувствительный канал. Это белок, который открывается под действием света и меняет активность клеток. Затем мозговой органоид перенесли крысам, а через три месяца в трансплантат добавили оптическое волокно, которое генерировало красный или синий свет. Животные получали награду, если пили во время действия синего света. Через пятнадцать дней те крысы, которым вживили мозговой органоид со светочувствительным белком, поняли этот принцип. Ученые сделали вывод, что клетки органоида интегрировались в мозг и стали активировать нейроны, чтобы получать награду. Еще одно доказательство интеграции трансплантата смогли обнаружить, потрогав крыс за усы. В ответ на такой внешний стимул ученые заметили активацию части клеток в мозговом органоиде.
Ученые сделали вывод, что клетки органоида интегрировались в мозг и стали активировать нейроны, чтобы получать награду. Еще одно доказательство интеграции трансплантата смогли обнаружить, потрогав крыс за усы. В ответ на такой внешний стимул ученые заметили активацию части клеток в мозговом органоиде.
С помощью пересадки органоида новорожденным крысам с иммунодефицитом, ученые смогли решить сразу несколько проблем: их мини-мозг прижился, начал развиваться внутри живого организма и активно с ним взаимодействовать.
Исследователи предлагают использовать свою модель не только для изучения нормы. Им удалось сделать мозговые органоиды из клеток людей с синдромом Тимоти. Это генетическое заболевание, при котором нарушается работа сердца. Нейроны в таком органоиде отличались от тех, которые были сделаны из клеток здоровых людей, а значит модель воспроизводит особенности патологических состояний и может быть полезна при изучении патологий и тестировании лекарств.
Ученые давно пытаются воспроизвести органы человека в лабораторных условиях. Кроме мозга, они создают мини-желудки, кожу и даже сердце. Исследовательский интерес — не единственное, что движет исследователями. В будущем, такие органоиды можно будет использовать для пересадки людям, в случае необходимости.
Кроме мозга, они создают мини-желудки, кожу и даже сердце. Исследовательский интерес — не единственное, что движет исследователями. В будущем, такие органоиды можно будет использовать для пересадки людям, в случае необходимости.
На мышах
Нейронауки
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
В крысиный мозг добавили человеческого
Нейроны человека после пересадки в крысу лучше растут и больше похожи на нейроны настоящего мозга.
Чтобы изучать клетки живьём, их выращивают в клеточной культуре: множество клеток растут и делятся на дне специальной ёмкости, погружённые в питательную среду. Но всё-таки клетки, растущие монотонным слоем, не то же самое, что клетки в настоящем органе. Более полную картину дают органоиды — микроскопические подобия настоящих органов.
Человеческий мозговой органоид в мозге крысы. (Фото: Stanford University)
(Фото: Stanford University)
Открыть в полном размере
‹
›
Они выглядят как объёмные клеточные конгломераты, в которых каждая клетка окружена со всех сторон своими коллегами, принимает от них сигналы и посылает свои сигналы им. Есть органоиды кишечные, почечные и даже органоиды мозга. Разумеется, они имитируют даже не весь орган целиком, а только некоторую его часть (например, в мозговых органоидах пытаются воспроизвести фрагмент коры с её слоями нейронов).
Объёмный органоид больше похож на орган, чем плоский клеточный слой, но всё-таки он растёт опять же не в организме, а в питательной среде. И в случае особенно сложных органов, например мозга, вполне очевидно, что нейроны в органоиде не приобретают каких-то свойств, которые есть у них в настоящем мозге. И вот чтобы ещё сильнее приблизить мозговой органоид к мозгу, сотрудники Стэнфордского университета пересадили человеческий органоид в мозг новорождённых крысят.
Органоид начал расти. За три месяца, как пишут исследователи в Nature, он вырос примерно в девять раз и занимал примерно треть коры одного из полушарий. Причём рос он как одно целое, крысиные нейроны объёма ему не добавляли — их он держал в стороне. Очевидно, что в настоящем мозге нейроны органоида, грубо говоря, лучше питались, и заодно получали сигналы от соседних клеток, которые управляли их развитием. Сами человеческие нейроны в пересаженном органоиде вырастали примерно в шесть раз более крупными, чем нейроны в органоиде, который развивался сам по себе, в лабораторной посуде и в питательной среде, на их отростках появлялось больше ответвлений и синапсов — межклеточных контактов с другими нейронами. Клетки в пересаженном органоиде выглядели более зрелыми и вели себя в смысле электрофизиологических свойств более похоже на нейроны в обычном мозге.
За три месяца, как пишут исследователи в Nature, он вырос примерно в девять раз и занимал примерно треть коры одного из полушарий. Причём рос он как одно целое, крысиные нейроны объёма ему не добавляли — их он держал в стороне. Очевидно, что в настоящем мозге нейроны органоида, грубо говоря, лучше питались, и заодно получали сигналы от соседних клеток, которые управляли их развитием. Сами человеческие нейроны в пересаженном органоиде вырастали примерно в шесть раз более крупными, чем нейроны в органоиде, который развивался сам по себе, в лабораторной посуде и в питательной среде, на их отростках появлялось больше ответвлений и синапсов — межклеточных контактов с другими нейронами. Клетки в пересаженном органоиде выглядели более зрелыми и вели себя в смысле электрофизиологических свойств более похоже на нейроны в обычном мозге.
При этом они устанавливали связи не только между собой, но и с крысиными нейронами. Органоид внедряли в соматосенсорную область коры, в тот её участок, который принимает сигналы от вибриссов. Когда вибриссы чувствовали дуновение воздуха, человеческие нейроны отзывались на это импульсами. Более того, человеческие нейроны могли влиять на поведение крыс. Органоид модифицировали так, чтобы его нейроны реагировали на световые вспышки. В крысином мозге их стимулировали светом, и одновременно крыса получала порцию воды. И потом крыса уже сама искала воду, когда человеческие нейроны у неё начинали активничать.
Когда вибриссы чувствовали дуновение воздуха, человеческие нейроны отзывались на это импульсами. Более того, человеческие нейроны могли влиять на поведение крыс. Органоид модифицировали так, чтобы его нейроны реагировали на световые вспышки. В крысином мозге их стимулировали светом, и одновременно крыса получала порцию воды. И потом крыса уже сама искала воду, когда человеческие нейроны у неё начинали активничать.
Однако притом нельзя было сказать, что грызуны становились умнее — поведенческие тесты они выполняли так же, как и обычные крысы. В то же время ни электроэнцефалограмма, ни магнитно-резонансная томография не показали каких-то серьёзных отклонений в работе мозга, хотя отклонений ждать стоило, всё-таки органоид для мозга был чужой.
Крысам также пересаживали органоид из нейронов с синдромом Тимоти — так называют сложное генетическое заболевание, которое проявляется в том числе аномальным развитием мозга. Нейроны в органоиде действительно получились с аномалиями; например, их отростки-дендриты были устроены проще, чем нейроны в органоиде без синдрома. Очевидно, пересадку человеческого органоида-цереброида в крысиный мозг можно использовать, чтобы подробнее изучить различные психоневрологические болезни и те генетические мутации, которые делают их более вероятными.
Очевидно, пересадку человеческого органоида-цереброида в крысиный мозг можно использовать, чтобы подробнее изучить различные психоневрологические болезни и те генетические мутации, которые делают их более вероятными.
Пересаживать человеческие нейроны в мозг грызунов пробовали и раньше, и мы писали про некоторые из таких экспериментов. Но в тех исследованиях пересаживали именно как нейроны, выросшие в обычной клеточной культуре. На сей раз они появились в крысином мозге, будучи сами уже объединены в «микромозг» — скорее всего, в этом случае после пересадки они должны вести себя более естественно.
Человеческие нейроны, имплантированные в мозг крысы, влияют на ее поведение
Трансплантированный человеческий органоид, помеченный флуоресцентным белком, в срезе мозга крысы.
Adobe
Ученый включил лазер, наполнив мозг крысы голубым светом. Грызун, верный своим двухнедельным тренировкам, пробежал через свою стеклянную коробку к крошечному носику, где был должным образом вознагражден глотком воды. Со стороны это могло показаться довольно заурядным нейробиологическим экспериментом, за исключением того факта, что нейроны, направляющие крысу к утолению жажды, не содержали крысиной ДНК. Вместо этого они были получены из человеческого «мини-мозга» — шарика человеческой ткани, называемого органоидом, — который исследователи из Медицинской школы Стэнфордского университета вырастили в лаборатории и имплантировали в кору грызунов за несколько месяцев до этого.
Со стороны это могло показаться довольно заурядным нейробиологическим экспериментом, за исключением того факта, что нейроны, направляющие крысу к утолению жажды, не содержали крысиной ДНК. Вместо этого они были получены из человеческого «мини-мозга» — шарика человеческой ткани, называемого органоидом, — который исследователи из Медицинской школы Стэнфордского университета вырастили в лаборатории и имплантировали в кору грызунов за несколько месяцев до этого.
Эксперимент — часть исследования, опубликованного в среду в журнале Nature, — является первым описанием влияния нейронов человека на поведение другого вида. Исследование также показало, что сигналы могут идти в обратном направлении; усики человеческих нейронов смешивались с клетками мозга грызунов и возбуждались в ответ на шелест воздуха усиками крыс.
Прогресс открывает двери для использования таких химер человек-грызун, чтобы лучше понять, как развивается человеческий мозг и что идет не так при неврологических и психиатрических состояниях, таких как шизофрения, аутизм и эпилепсия. Когда ученые из Стэнфорда имплантировали органоиды, выращенные из клеток пациентов с тяжелым генетическим заболеванием мозга, они могли с беспрецедентной четкостью наблюдать за аномальным развитием нейронов.
Когда ученые из Стэнфорда имплантировали органоиды, выращенные из клеток пациентов с тяжелым генетическим заболеванием мозга, они могли с беспрецедентной четкостью наблюдать за аномальным развитием нейронов.
реклама
«Эта статья действительно выходит за рамки возможного», — сказал нейробиолог Томаш Новаковски из Калифорнийского университета в Сан-Франциско, который использует органоиды мозга в своих исследованиях нарушений развития нервной системы, но не участвовал в новой работе. «Поле отчаянно нуждается в большем количестве экспериментальных моделей. И что действительно важно в этом исследовании, так это то, что оно демонстрирует, что органоиды мозга могут завершить траекторию своего созревания при трансплантации. Так что это действительно расширяет наш инструментарий для постановки более тонких вопросов о том, как генетические мутации приводят к поведенческим расстройствам».
В биологии, пожалуй, нет ничего более безумно трудного для изучения, чем раннее развитие человеческого мозга. Получение образцов тканей в этот период времени практически невозможно. И поэтому на протяжении десятилетий ученым приходилось полагаться на косвенные подсказки, полученные в результате экспериментов на животных, таких как мыши и обезьяны. Но человеческий мозг настолько эволюционно отличается, что эти открытия не принесли многого в плане эффективного лечения многих поведенческих расстройств, которые, по мнению ученых, вероятно, связаны с особенностями, уникальными для человеческого мозга.
Получение образцов тканей в этот период времени практически невозможно. И поэтому на протяжении десятилетий ученым приходилось полагаться на косвенные подсказки, полученные в результате экспериментов на животных, таких как мыши и обезьяны. Но человеческий мозг настолько эволюционно отличается, что эти открытия не принесли многого в плане эффективного лечения многих поведенческих расстройств, которые, по мнению ученых, вероятно, связаны с особенностями, уникальными для человеческого мозга.
реклама
Однако за последние 10 лет новые методы уговоров стволовых клеток дифференцироваться в нейроны и выращивания этих клеток в трехмерные структуры размером с чечевицу произвели революцию в способности ученых изучать процессы развития нервной системы.
Мини-мозги, мозговые шарики, церебральные органоиды, человеческие сферические кортикоиды — как бы вы их ни называли — могут проследить свою короткую взрывную историю до 2013 года, когда нейробиолог Мадлен Ланкастер, тогда работавшая в Австрийской академии наук, обнаружила, что путем выращивания ствола клетки в солоновато-сладком поддерживающем геле, клетки самоорганизуются в маленькие сферические массы функционирующей мозговой ткани. Вскоре после этого лаборатории по всему миру начали выращивать свои собственные колонии мозговых шаров и применять различные химические стимулы и толчки, чтобы заставить их развиваться дальше.
Вскоре после этого лаборатории по всему миру начали выращивать свои собственные колонии мозговых шаров и применять различные химические стимулы и толчки, чтобы заставить их развиваться дальше.
В 2015 году Сергуи Паска из Стэнфорда создал сфероиды, способные искрить электричеством, что сделало их первыми, которые нейробиологи смогли изучать функционально. Несколько лет спустя группа из Медицинского центра Калифорнийского университета в Дэвисе опубликовала первые результаты исследования мозговых шаров, способных кровоточить, что открыло возможности для изучения инсультов и других заболеваний сосудов головного мозга. И чем больше они становились похожими на настоящие органы, тем полезнее становились эти капли для изучения сложной внутренней работы мозга.
Но ученые мало что могут узнать в пробирке или гелевой матрице. В этих условиях клетки в центре сфероидов перестают получать кислород и питательные вещества, как только их диаметр превышает несколько миллиметров. Это ограничивает их способность развивать функциональные нейронные сети — связи и клеточные перекрестные помехи, необходимые для получения и обработки информации — и, следовательно, их полезность в качестве модели сложного поведения и неврологических заболеваний.
Даже Паска, чья лаборатория сообщила о некоторых из самых долгоживущих культур органоидов мозга с возрастом более 800 дней, заметил, что нейроны в чашке не вырастают такими большими, как их реальные аналоги. Вот почему он и его коллеги начали искать более дружелюбное окружение, где температура в самый раз и всегда есть свежий поток соли, сахара и кислорода, как, скажем, внутри черепа теплокровного лабораторного животного.
Для этого последнего исследования группа Паски выбрала двух-трехдневных детенышей крысы, развитие которых эквивалентно человеческому младенцу — время, когда мозг быстро растет, а нейроны тянутся, чтобы сформировать новые связи. Этим животным они пересадили человеческие органоиды, напоминающие кору головного мозга. Около 80 процентов имплантатов прижились.
В течение нескольких недель клетки крыс начали перемещаться в органоиды, строя кровеносные сосуды, которые поддерживали их рост наряду с собственными животными. Из этих органоидов выросли миллионы новых нейронов, посылая аксоны и проводку в цепочки по всему мозгу крыс, в том числе глубоко в таламус, область, отвечающую за передачу сенсорных сигналов, таких как прикосновение и температура. Шесть месяцев спустя примерно треть полушария мозга, получившего трансплантат, состояла из клеток человека.
Шесть месяцев спустя примерно треть полушария мозга, получившего трансплантат, состояла из клеток человека.
Группа
Паски не первая, кто пытается осуществить межрасовое слияние разумов. В 2018 году ученые из Института Солка сообщили о первой успешной имплантации церебральных органоидов человека в мозг взрослых лабораторных мышей, где они выживали до трех месяцев и даже подключались к нейронным схемам животных. Более поздние попытки группы из Киотского университета повторили этот подвиг на обезьянах. Но, проводя свои эксперименты на очень молодых крысах, чья кора еще не насыщена синапсами, Паска и его коллеги обнаружили, что человеческие нейроны легко интегрируются в быстро расширяющиеся схемы животных, что обеспечивает им стимуляцию, необходимую им для того, чтобы превзойти предшествующие этапы развития. барьеры.
Анализ электрических свойств нейронов человека показал, что «они гораздо более зрелые, чем то, что мы делали раньше в пробирке», — сказал Паскаль на брифинге для журналистов в понедельник. «Они также намного больше — они вырастают примерно в шесть раз больше, чем эквивалентный нейрон, растущий в чашке».
«Они также намного больше — они вырастают примерно в шесть раз больше, чем эквивалентный нейрон, растущий в чашке».
Это открытие позволило им более подробно увидеть, что не так в развивающемся мозге детей, у которых развивается тяжелая форма эпилепсии и аутизма из-за разрушительного генетического расстройства, называемого синдромом Тимоти. Лаборатория Паски ранее делала мини-мозги с синдромом Тимоти из клеток пациентов и в лабораторной посуде увидела, что их нейроны беспорядочно прыгают, не зная, куда мигрировать.
После выращивания в течение пяти-шести месяцев в мозгу крыс эти различия стали еще более значительными. Нейроны Тимоти были меньше и чахлые — они не посылали столько дендритов, которые укрепляли связи с соседними нейронами. В результате сторона мозга крыс с трансплантатом Тимоти имела гораздо меньшую и гораздо менее организованную электрическую активность.
«Когда вы смотрите в естественных условиях, вы видите очень четкую разницу между клетками пациентов и контрольными клетками, которую вы можете буквально увидеть на глаз», — сказал Паска.
Его группа сейчас работает над применением этого метода для изучения органоидов, созданных из пациентов с другими неврологическими заболеваниями, и надеется однажды использовать его в качестве платформы для тестирования на наркотики. Также в списке дел: внедрение еще более сложных протомозгов внутрь черепов молодых грызунов, где их развитие может пойти еще дальше.
В статье, опубликованной в 2020 году, группа Паски показала, что объединение органоидов, представляющих три разные ткани — скелетные мышцы, кору головного мозга и спинной мозг — создает нечто, имитирующее произвольный контроль движений. Удар по мозговому концу этого мега-сгустка, который Паска назвал «ассемблоидом», заставил мышечный конец подергиваться. Он и его коллеги создали органоиды, представляющие дюжину различных областей мозга, включая глубокие области центральной нервной системы, где рождаются тормозные нейроны.
Теперь группа Паски начала создавать ассамблоиды с различным соотношением возбуждающих и тормозных нейронов. Выращивая их в мозгу молодых мышей, они надеются ответить на вопросы о причинах развития эпилепсии, шизофрении и других психических состояний, которые, как считается, вызваны дисбалансом между возбуждающими и тормозными нейронами.
Выращивая их в мозгу молодых мышей, они надеются ответить на вопросы о причинах развития эпилепсии, шизофрении и других психических состояний, которые, как считается, вызваны дисбалансом между возбуждающими и тормозными нейронами.
Ин-Хьюн Пак, биолог стволовых клеток из Йельской школы медицины, в течение многих лет занимается слиянием органоидов головного мозга, чтобы изучить, как тормозные нейроны мигрируют в процессе развития мозга. В чашке его органоиды производят как живую смесь возбуждающих, тормозных и опорных клеток, но они не развивают функциональные связи, необходимые для понимания того, ведут ли себя клетки должным образом. Он выглядит как мозг, но говорит ли он как мозг?
В ответ на это он сказал, что его команда думала о пересадке своих органоидов лабораторным мышам, но они сопротивлялись, опасаясь, что захват такой большой части мозга хозяина вызовет проблемы у животного. Но работа Стэнфордской группы развеяла эти опасения. «Они продемонстрировали действительно убедительное доказательство того, что нейроны человека могут функционально соединяться с мозгом хозяина», — сказал Парк. «Это действительно важное открытие для отрасли».
«Это действительно важное открытие для отрасли».
Нейрохирурги, такие как Бен Вальдау из Калифорнийского университета в Дэвисе, согласились с тем, что это ценное достижение, которое, несомненно, привлечет больше исследователей к работе с органоидами, и назвали исследование «впечатляющим». Но как человек, заинтересованный в том, чтобы когда-нибудь использовать органоиды не только в качестве инструмента исследования, но и для лечения людей, которые потеряли функцию мозга из-за инсульта, он отметил, что есть еще много возможностей для улучшения.
Органоиды
Паски не сформировали ни одного из шести слоев, которые есть в нормальной коре головного мозга человека. И их интеграция в крысиный мозг не была идеальной; вместо того, чтобы строиться вокруг других структур мозга, таких как боковые желудочки, которые транспортируют жидкость, человеческая ткань оттеснила их в сторону. Если это как-то задело крыс, они этого не показали. Все они совершенно нормально справились с рядом физических и когнитивных тестов.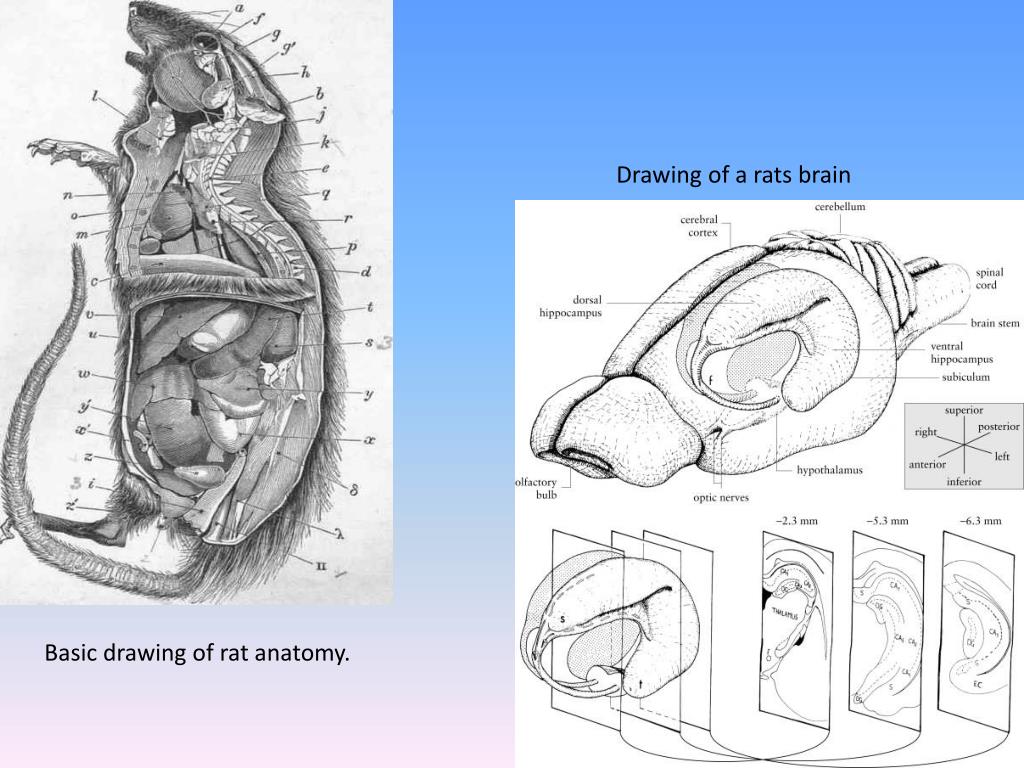 Но это то, что может беспокоить регуляторов, планирующих первые клинические испытания органоидов.
Но это то, что может беспокоить регуляторов, планирующих первые клинические испытания органоидов.
«В конце концов, было бы здорово, если бы мы могли создать слоистые органоиды, которые можно было бы использовать для трансплантации пациентам с инсультом, у которых отсутствуют части мозга», — сказал Вальдау. «И это то, над чем еще предстоит работать».
Об авторе
Репринты
Создайте отображаемое имя для комментария
Это имя будет отображаться вместе с вашим комментарием
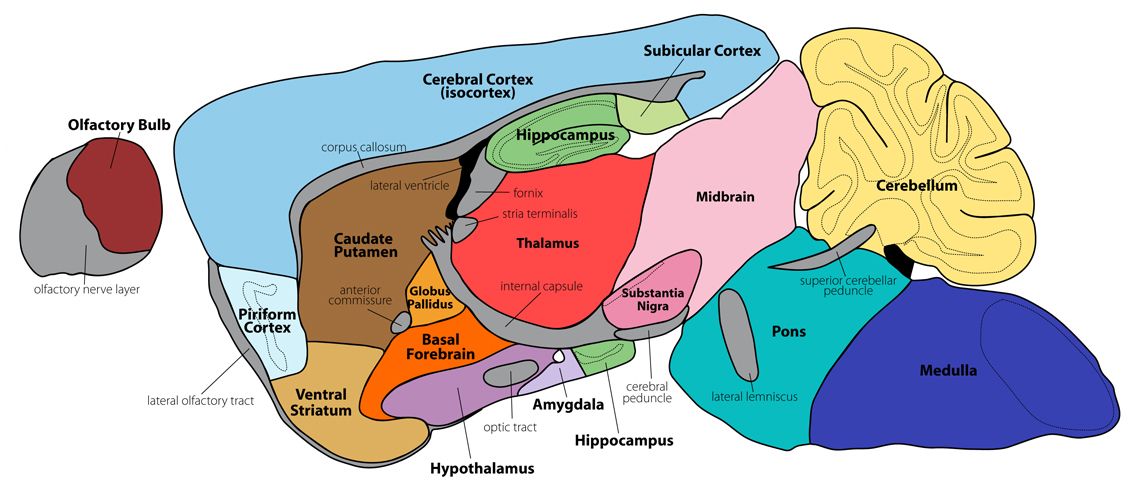
Атлас мозга крысы — EBRAINS
Атласы
Изучите трехмерный анатомический атлас мозга крысы в открытом доступе
- Изучите или загрузите атлас мозга космической крысы Waxholm
- Связанные инструменты EBRAINS
- Наше сообщество
Прокрутите вниз, чтобы узнать больше об Атласе мозга крыс в EBRAINS
Исследуйте Атлас мозга крысы в siibra-explorer — интерактивной программе просмотра атласов EBRAINS
Крысы — одна из наиболее широко используемых животных-моделей в неврологии. Атласы мозга крыс широко используются в качестве справочного материала для ориентации, планирования экспериментов, а также в качестве инструментов для определения местоположения экспериментальных данных, а также для объединения и сравнения данных разных экспериментов. EBRAINS предлагает атлас мозга крыс Waxholm Space (WHS). Вы можете просматривать атлас из любого браузера с помощью нашего интерактивного средства просмотра атласа и находить интересующие области с помощью текстового поиска или с помощью соответствующей иерархии областей мозга. WHS Rat Brain Atlas является основой пространственно-ориентированных рабочих процессов и нескольких других инструментов EBRAINS для анализа данных из мозга крыс.
Атласы мозга крыс широко используются в качестве справочного материала для ориентации, планирования экспериментов, а также в качестве инструментов для определения местоположения экспериментальных данных, а также для объединения и сравнения данных разных экспериментов. EBRAINS предлагает атлас мозга крыс Waxholm Space (WHS). Вы можете просматривать атлас из любого браузера с помощью нашего интерактивного средства просмотра атласа и находить интересующие области с помощью текстового поиска или с помощью соответствующей иерархии областей мозга. WHS Rat Brain Atlas является основой пространственно-ориентированных рабочих процессов и нескольких других инструментов EBRAINS для анализа данных из мозга крыс.
- Исследуйте подробные 3D-очертания областей мозга в интуитивно понятной веб-программе просмотра атласов.
- Атлас построен на высококачественном шаблоне объемного изображения с высоким разрешением.
- Легко находите интересующую вас область мозга с помощью связанной иерархии областей мозга
- Находите и получайте доступ к данным, переданным через EBRAINS и зарегистрированным в Waxholm Space Rat Brain Atlas.

- Используйте атлас, встроенный в другие инструменты EBRAINS, что позволяет интегрировать данные и автоматически анализировать изображения с пространственной привязкой.
Атлас мозга крыс Waxholm Space (WHS) содержит исчерпывающие анатомические очертания областей мозга и волоконных путей мозга взрослой крысы. Атлас был получен от 80-дневного самца крысы Sprague Dawley с использованием ex vivo магнитно-резонансной и диффузионно-тензорной визуализации (MRI/DTI) в Центре микроскопии in vivo Дьюка (Дарем, Северная Каролина, США). Он включает пространственные координаты и положение брегмы и лямбды, облегчая преобразование в стереотаксические координаты.
Атлас, тома МРТ/ДТИ и данные тензора диффузии доступны вместе с метками и файлами конфигурации для ITK-SNAP, набора инструментов атласирования Mouse BIRN и PMOD. Атлас предоставляется в стандартном объемном формате (NIfTI), содержащем очертания 222 областей мозга, сопровождаемый файлом метки с названием и идентификатором каждой области.
Изучите атлас мозга космической крысы Waxholm в интерактивном средстве просмотра атласов EBRAINS
Загрузите атлас мозга космической крысы Waxholm из NITRC
Доступ к файлам атласа через EBRAINS Knowledge Graph
Осен К.К., Имад Дж., Веннберг А.Е., Папп Э.А., Лергард Т.Б. (2019) Ваксхольм Космический атлас слуховой системы мозга крысы: трехмерные очертания на основе структурной и диффузионно-тензорной магнитно-резонансной томографии. НейроИзображение 199, 38-56. https://doi.org/10.1016/j.neuroimage.2019.05.016
Папп Э.А., Лергаард Т.Б., Калабрезе Э., Джонсон Г.А., Бьяали Дж.Г. (2014) Waxholm Космический атлас мозга крыс Sprague Dawley . НейроИзображение 97, 374-386.
https://doi.org/10.1016/j.neuroimage.2014.04.001
Papp EA, Leergaard TB, Calabrese E, Johnson GA, Bjaalie JG (2015) Приложение к «Космическому атласу Waxholm мозга крыс Sprague Dawley» [НейроИзображение 97 (2014) 374-386].