Содержание
Генная терапия буллезного эпидермолиза прошла фазу 3 КИ — PCR News
Подготовила
Юлия Панченко
В США завершилась фаза 3 клинических испытаний генной терапии дистрофического буллезного эпидермолиза. Герпесвирусный вектор B-VEC доставляет в клетки кожи рабочую копию COL7A1 при многократном местном нанесении. Через шесть месяцев после начала терапии полностью зажили 67% ран, на которые наносили вектор, и 22% ран, на которые наносили плацебо. Нежелательные явления в основном были легкими или умеренными.
Подготовила
Юлия Панченко
При буллезных эпидермолизах на теле людей постоянно образуются раны, волдыри и рубцы. Дистрофический подтип этого заболевания ассоциирован с мутациями в гене COL7A1, кодирующем коллаген VII типа (C7). Мутантный белок не образует фибриллы, или те не заякориваются, что нарушает адгезию эпидермиса к дерме. Постоянные повреждения кожи со временем могут приводить к развитию плоскоклеточной карциномы, угрожающих жизни инфекций и деформации конечностей. На настоящий момент одобренной терапии этого заболевания нет.
Мутантный белок не образует фибриллы, или те не заякориваются, что нарушает адгезию эпидермиса к дерме. Постоянные повреждения кожи со временем могут приводить к развитию плоскоклеточной карциномы, угрожающих жизни инфекций и деформации конечностей. На настоящий момент одобренной терапии этого заболевания нет.
Ученые из США разработали генную терапию дистрофического буллезного эпидермолиза. Герпесвирусный вектор B-VEC доставляет рабочую копию гена COL7A1
в клетки при нанесении на кожу. Это вектор не встраивается в ДНК хозяина, несет большой груз, обладает тропизмом к коже и избегает действия иммунной системы, что позволяет использовать его повторно. В фазе 1–2 клинических испытаний на девяти пациентах ученые показали, что в клетках кожи образуется белок C7, а фибриллы нормально заякориваются. Раны у пациентов, получивших терапию, заживали лучше, чем в группе плацебо, в течение трех месяцев испытаний.
В новой работе описаны результаты фазы 3 клинических испытаний генной терапии, которые длились шесть месяцев.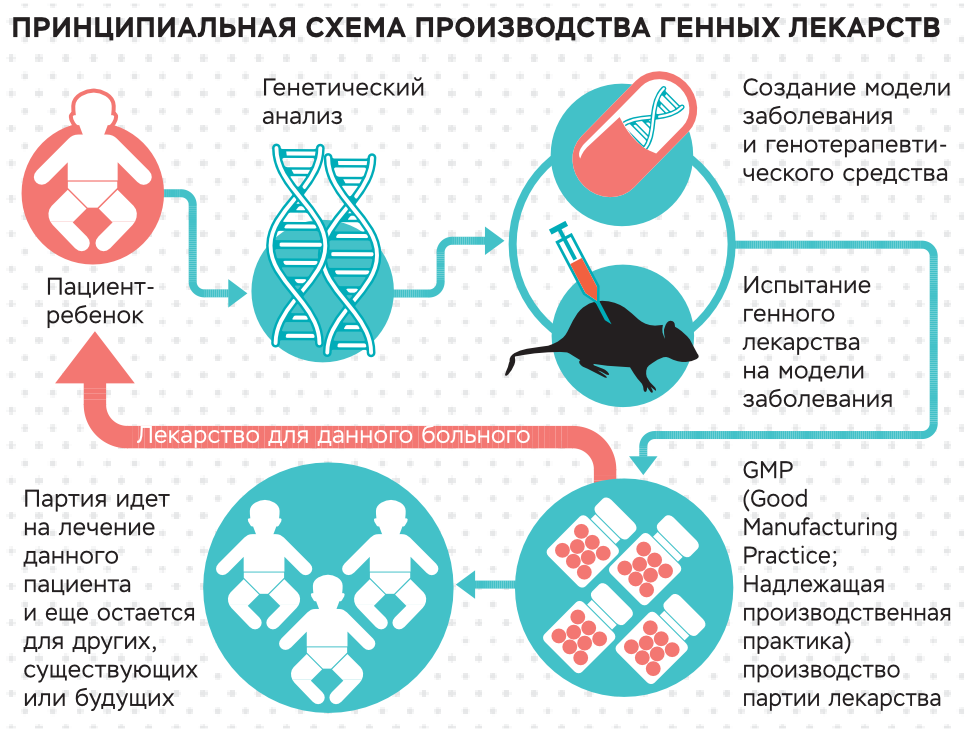 Оценивались эффективность и безопасность терапии для взрослых и детей с дистрофическим буллезным эпидермолизом. Для этого у каждого пациента выбирали две раны примерно одинакового размера, расположения и вида. На одну рану наносили B-VEC, на другую — плацебо. B-VEC наносили также на дополнительные раны без контроля плацебо. Заживание отслеживали с помощью системы визуализации. Прогресс проверяли каждую неделю, если рана закрывалась, то нанесение препарата пропускали, если открывалась — возобновляли.
Оценивались эффективность и безопасность терапии для взрослых и детей с дистрофическим буллезным эпидермолизом. Для этого у каждого пациента выбирали две раны примерно одинакового размера, расположения и вида. На одну рану наносили B-VEC, на другую — плацебо. B-VEC наносили также на дополнительные раны без контроля плацебо. Заживание отслеживали с помощью системы визуализации. Прогресс проверяли каждую неделю, если рана закрывалась, то нанесение препарата пропускали, если открывалась — возобновляли.
Испытание длилось 26 недель, в него вошел 31 пациент, завершили 28, три человека покинули испытание по причинам, не связанным с терапией. Пять человек перешли в фазу 3 из предыдущей фазы.
Через шесть месяцев полностью зажили 67% ран, на которые наносили B-VEC, и 22% ран, на которые наносили плацебо. Через три месяца наблюдалось полное заживление 71% ран в группе B-VEC и 20% ран в группе плацебо. Рана считалась полностью зажившей, если она оставалась зажившей в течение двух недель. Боль при перевязке снижалась сильнее в группе B-VEC. Также в этой группе раны заживали на более долгий срок.
Боль при перевязке снижалась сильнее в группе B-VEC. Также в этой группе раны заживали на более долгий срок.
У 18 пациентов было по крайней мере одно нежелательное явление, однако большая часть была слабой или умеренной. Пять серьезных нежелательных явлений были зарегистрированы у трех пациентов, но они не были связаны с терапией. Никто не покинул испытание из-за побочных явлений. Иммунологических реакций выявлено не было.
Таким образом, многократное нанесение B-VEC на раны повышало шансы полного их заживления через шесть месяцев терапии по сравнению с плацебо. Однако раны были сравнительно невелики, пациентов в испытании было немного. Все участники получали и препарат, и плацебо, что мешало оценить системные побочные явления. Авторы говорят о необходимости более крупных и продолжительных клинических испытаний.
Предложена новая генная терапия для «людей-бабочек»
Источник:
Shireen V. Guide, et al. Trial of Beremagene Geperpavec (B-VEC) for Dystrophic Epidermolysis Bullosa // MEJM (2022) 387:2211-2219, published December 15, 2022, DOI:
Guide, et al. Trial of Beremagene Geperpavec (B-VEC) for Dystrophic Epidermolysis Bullosa // MEJM (2022) 387:2211-2219, published December 15, 2022, DOI:
10.1056/NEJMoa2206663
Генная терапия Клинические исследования Наследственные заболевания
PCR.news
Генная терапияx
COVID-19 Et сetera Вирусология Секвенирование Диагностика Эпидемиология Молбиология Клинические исследования Онкология Молекулярная диагностика Вакцины Экспрессия генов Иммунная система Бактериология Биоинформатика Технологии Неврология Новые препараты Терапия Геномика Государственное регулирование Генетика Клеточная биология Рынок и регулирование PCR Биомаркеры Российские компании Фарма Обзоры периодики CRISPR Иммунологические методы Мероприятия Метаболизм Образование Иммунотерапия Редактирование генома Наследственные заболевания Организация науки Новые концепции Инвестиции Новые инструменты и оборудование Финансирование исследований Сердечно-сосудистые заболевания Тест-системы в клинике Протеомика Эпигенетика Бизнес-среда Репродуктивное здоровье Подготовка образцов Методология эксперимента Рынок клинической диагностики Микрочипы и мультиплексный анализ Интервью Персонализированная медицина Гастроэнтерология Паразитология Масс-спектрометрия Вебинары Микология Сопроводительная диагностика МД-2021 Избранное Работа в биотехе Поможем друг другу! ИФА Рейтинги Вопросы и ответы Подготовка об Направления Курсы Государственное регулиров Все
16. 12.2022
12.2022
Генная терапия буллезного эпидермолиза прошла фазу 3 КИ
16.12.2022
Энхансерные элементы рыбки данио улучшили состояние сердца у мышей
08.12.2022
На конференции Clinical Trials on Alzheimer’s Disease , которая проходила 29 ноября — 2 декабря 2022 года, американская компания Lexeo Therapeutics представила результаты клинического исследования генной терапии болезни Альцгеймера. В основу терапии легло знание о генетических предпосылках к заболеванию, обусловленных полиморфизмами гена аполипопротеина E (APOE). Аллель APOE4 считается фактором риска БА с поздним началом, тогда как APOE2, наоборот, снижает риск. Специалисты Lexeo проверили, можно…
24.11.2022
Новые вирусные векторы для доставки генов успешно проникают в мозг макак
24. 11.2022
11.2022
FDA одобрило использование препарата HEMGENIX от компании uniQure для генной терапии гемофилии B. Препарат использует аденоассоциированный вирусный вектор AAV5, который несет ген, кодирующий фактор IX, с вариантом Padua (заменой R338L, которая делает фактор более активным), и таргетирует клетки печени. Для получения эффекта нужна всего одна доза, но есть подвох — эта доза стоит 3,5 млн долларов, что делает HEMGENIX самым дорогим препаратом в мире. Лекарство одобрено для взрослых пациентов, которые…
23.11.2022
Компания PerkinElmer
объявила
о выпуске семи наборов для обнаружения векторов на основе аденоассоциированных вирусов (AAV). Комплекты предназначены для разработчиков генной и клеточной терапии. Они позволяют охарактеризовать создаваемые векторные частицы, что должно упростить рабочий процесса переноса генов в клетки.
Новые наборы, созданные на запатентованной платформе
AlphaLISA,
сокращают время на обнаружение вирусов по сравнению со стандартным иммуноферментным анализом. Каждый из семи наборов…
Каждый из семи наборов…
22.11.2022
В четверг, 17 ноября 2022 г., компания Editas Medicine обнародовала результаты фазы 1/2 КИ CRISPR-терапии врожденного амавроза Лебера типа 10 (LCA10). Это дегенеративное заболевание сетчатки, связанное с мутацией в гене CEP290 , который кодирует белок, необходимый фоторецепторным клеткам для восприятия света. Специалисты Editas разработали CRISPR-препарат, нацеленный на мутацию в интроне 26 гена CEP290 . Конструкт, кодирующий систему CRISPR-Cas9, размещается на вирусном векторе и вводится в организм…
16.11.2022
Thermo Fisher ликвидирует юридическое лицо в России
02.11.2022
Pfizer, J&J и Merck инвестировали в исследования «темного генома»
12.10.2022
Новые большие сериновые рекомбиназы намного эффективнее ранее известных
12. 10.2022
10.2022
Вектор на основе AAV9 проникает в мозг мышей и приматов при внутривенном введении
05.10.2022
Малые интерферирующие РНК облегчили симптомы язвенного колита у мышей
21.09.2022
FDA одобрило генную терапию стоимостью 3 миллиона долларов
20.09.2022
CRISPR-редактирование в организме человека лечит наследственный ангионевротический отек
22.08.2022
В четверг, 18 августа, компания Bluebird Bio
сообщила
об одобрении препарата Zyntenglo регулятором США. Zyntenglo (betibeglogene autotemcel, или beti-cel) предназначен для пациентов с бета-талассемией, которым необходимы регулярные переливания крови. Препарат изготавливается из гемопоэтических стволовых клеток пациента, трансформированных
ex
vivo
лентивирусным вектором, который кодирует функциональный ген бета-глобина. Курс лечения состоит из одной инфузии препарата.
Ранее Zyntenglo получил
условное…
Курс лечения состоит из одной инфузии препарата.
Ранее Zyntenglo получил
условное…
20.06.2022
На конгрессе Европейской гематологической ассоциации (EHA-2022), проходившем в Вене с 15 по 17 июня, компании CRISPR Therapeutics (Швейцария) и Vertex Pharmaceuticals (США) объявили о расширении клинических исследований терапии под названием exa-cel (от exagamglogene autotemcel). В него будут включены дети до 12 лет, страдающие серповидноклеточной анемией (severe sickle cell disease, SCD) или бета-талассемией (transfusion-dependent beta thalassemia, TDT). Об этом сообщается в NewScientist . В текущем…
06.06.2022
Рак поджелудочной железы трудно поддается лечению, при этом его пятилетняя выживаемость составляет всего 10%. Сотрудники Института рака Провиденса (штат Орегон)
генетически модифицировали
Т-клетки пациента с прогрессирующим метастатическим раком поджелудочной железы, нацелив их на мутантный онкоген KRAS G12D. Однократное введение перепрограммированных Т-клеток вызвало у больного регрессию 72% висцеральных метастазов спустя шесть месяцев, причем эти клетки продолжали циркулировать в периферической…
Однократное введение перепрограммированных Т-клеток вызвало у больного регрессию 72% висцеральных метастазов спустя шесть месяцев, причем эти клетки продолжали циркулировать в периферической…
30.05.2022
Генная терапия уменьшает повреждения мозга у мышей при черепно-мозговой травме
30.05.2022
Отечественный «геном в бутылке» и эксперимент на студентах
12.05.2022
Жизнь мышам продлили с помощью генной терапии
26.04.2022
Нанокапсулы доставят систему CRISPR-Cas9 для терапии глиобластомы в мозг
12.04.2022
Генная терапия гемофилии A не вызвала повреждений печени у участников
31.03.2022
Эффективность генной терапии буллезного эпидермолиза показали в фазе 1 и 2 КИ
21. 03.2022
03.2022
Вектор для генной терапии доставляется в клетки внутреннего уха хирургическим путем
14.02.2022
Эффективность генной терапии синдрома Вискотта–Олдрича сохраняется несколько лет
09.02.2022
Ученые отредактировали митохондриальные гены у взрослых мышей
02.02.2022
Таблетку, которая вводит мРНК в стенку желудка, создали в МТИ
25.01.2022
Редактирование генома использовали для терапии гемофилии у мышей
1
2
3
4
Предыдущая
Следующая
Лекарства для генной терапии в 2018 году
Новый метод лечения слепоты привнес генную терапию в реальный мир, но стоит она дорого.
Генная терапия наконец-то вышла из области научной фантастики… и на этот раз она, возможно, останется здесь.
Но с ценниками, приближающимися к отметке в миллион долларов, сможет ли кто-нибудь, кроме сверхбогатых, позволить себе эти новые методы лечения?
В прошлом месяце Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило новый метод генной терапии для лечения редкой наследственной формы слепоты.
Стоимость? 850 000 долларов — меньше, чем 1 миллион долларов, на который рассчитывали многие аналитики.
Тем не менее, это 425 000 долларов за глаз. Для препарата, который не полностью восстанавливает зрение. И известно, что это работает только у некоторых пациентов до четырех лет.
Только от 1000 до 2000 человек в Соединенных Штатах могут получить пользу от этого одноразового лечения. Как и другие сверхдорогие методы лечения редких заболеваний, редкость этого заболевания частично объясняет его высокую стоимость.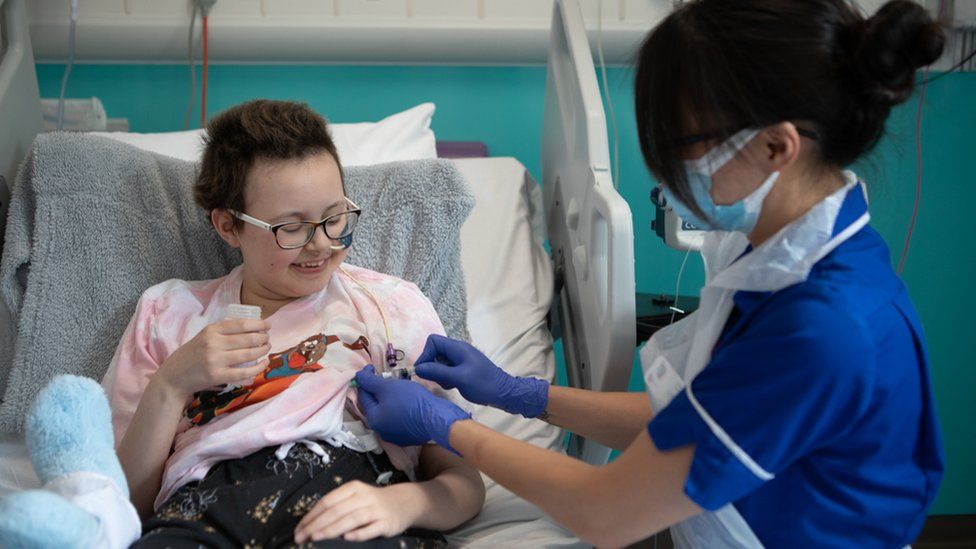
Люди с этим заболеванием имеют особый ген, известный как RPE65, который вызывает ухудшение зрения. У некоторых людей это может привести к полной слепоте.
Препарат под названием Luxturna был разработан компанией Spark Therapeutics из Филадельфии.
В то время как производители и страховые компании бьются над тем, как сделать это лекарство доступным и при этом позволить компании получать прибыль, область генной терапии продолжает развиваться.
То, что произойдет в 2018 году в области генной терапии, будет основываться на достижениях ученых и фармацевтических компаний в прошлом году.
«Некоторые из наиболее интересных событий прошлого года касались успешной разработки продуктов и ценообразования на коммерческой арене. Я ожидаю, что это продвинется еще дальше», — сказал доктор Санджив Гупта, профессор медицины и патологии в Медицинском колледже Альберта Эйнштейна и системе здравоохранения Монтефиоре.
В области рака FDA одобрило терапию Т-клетками CAR для некоторых детей и молодых людей с одним типом острого лимфобластного лейкоза (ОЛЛ).
Этот тип иммунотерапии включает генетическую модификацию иммунных клеток человека — Т-клеток — для повышения их способности бороться с раком.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов также одобрило терапию CAR Т-клетками для лечения В-клеточной лимфомы, встречающейся у взрослых.
Благодаря тому, что ученые достигли такого «значительного прогресса в лечении рака [возникающего в крови]», — сказал Гупта, — «мы надеемся увидеть больше таких успехов в лечении солидных опухолей».
Еще одна область, в которой будет продолжать развиваться, — это редактирование генов, позволяющее вносить точные изменения в последовательность ДНК клетки.
«Редактирование генов с помощью технологий CRISPR становится все более и более захватывающим», — сказал Гупта Healthline. «Несколько компаний конкурируют в редактировании генов — одним из первых примеров было испытание Sangamo для синдрома Хантера, — но мы увидим больше испытаний редактирования генов».
CRISPR-Cas9 — это инструмент редактирования генома, который позволяет ученым добавлять, удалять или изменять определенные участки ДНК не только у людей, но и у других организмов.
Ученые Гарвардского университета недавно использовали этот метод для замедления прогрессирующей формы глухоты у мышей.
Генетическая мутация, вызывающая это состояние, также встречается у людей, хотя и только в небольшом числе семей, поэтому вскоре ученые опробуют это лечение на людях.
Еще одна область, в которой Гупта ожидает развития в ближайшем будущем, — регуляция экспрессии генов. Возможность контролировать, какие гены активны, может дать ученым возможность лечить болезни без необходимости изменять ДНК.
Хотя любое заболевание является потенциальной мишенью для генной терапии, некоторые виды лечения легче осуществить в клинике.
Неслучайно одним из первых одобренных FDA методов генной терапии является лечение слепоты.
«Заболевания глаз поддаются генной терапии по разным причинам, — сказал Гупта, — включая легкий доступ к глазу и результаты лечения, которые легче оценить, чем в некоторых других случаях».
Более сложные генетические заболевания, такие как синдром Хантера, затрагивают несколько систем органов, и повреждение происходит глубже внутри тела, чем глаз.
Болезни крови также являются более легкой мишенью, поскольку клетки крови можно удалить, генетически модифицировать, а затем вернуть в организм человека.
Сюда входит лейкемия, которую лечат с помощью недавно одобренной терапии CAR T-клетками. Но есть и другие потенциальные методы лечения.
«Гемофилия А и В — основные цели, которые активно преследуют многие компании, — сказал Гупта.
Гемофилия — это генетическое заболевание, при котором нарушается способность крови к свертыванию.
«Кроме того, мы должны увидеть развитие серповидно-клеточной анемии или бета-талассемии, — добавил Гупта, — где отдельные мутации могут быть отредактированы для коррекции аномальной выработки гемоглобина, которая вызывает быстрое разрушение эритроцитов и анемию».
Гупта считает, что мышечная дистрофия может стать еще одной важной целью генной терапии в ближайшем будущем.
Даже генная терапия, которая помогла бы лишь паре тысяч человек, была бы выдающимся достижением.
Но что делать, если слепой, страдающий нарушением свертываемости крови или больной раком не может позволить себе лечение?
Методы генной терапии все еще довольно новы, поэтому мы можем увидеть падение цен, как только исследования и разработки этих препаратов станут более распространенным явлением.
«В краткосрочной перспективе затраты, вероятно, будут высокими, — сказал Гупта. «В конце концов, с эффектом масштаба цены должны снизиться, как это обычно бывает».
Частью высокой стоимости генной терапии является одноразовое лечение. Фармацевтические компании должны компенсировать затраты на разработку одним платежом.
Сравните это с таблеткой, принимаемой человеком каждый день на протяжении всей оставшейся жизни — высокие затраты, растянувшиеся на этот более длительный период, гораздо менее круты.
Вопрос, однако, насколько упадет цена?
Фармацевтические компании по-прежнему берут десятки тысяч долларов за лекарства, которые нужно принимать каждый день. И давайте не будем забывать о лечении гепатита стоимостью 100 000 долларов, дебютировавшем в прошлом году.
И давайте не будем забывать о лечении гепатита стоимостью 100 000 долларов, дебютировавшем в прошлом году.
Дэвид Митчелл, основатель и президент правозащитной группы «Пациенты за доступные лекарства», заявил MIT Technology Review, что фармацевтические компании будут взимать «такую сумму, которую, по их мнению, им сойдет с рук».
Spark Therapeutics ведет переговоры со страховыми компаниями, чтобы убедить их покрыть расходы на лечение слепоты. Это включает в себя частичное возмещение, если терапия не работает в течение первых трех месяцев.
Одна страховая компания, Harvard Pilgrim Health Care, уже согласилась оплатить терапию Luxturna.
Таким образом, даже с ценником в 850 000 долларов многие люди со страховкой никогда не заплатят эту сумму из своего кармана.
Но, как и большая часть здравоохранения в Соединенных Штатах, это не поможет тем, кто не застрахован, застрахован недостаточно или чья страховка не подписала соглашение о покрытии яркого нового генно-терапевтического лечения.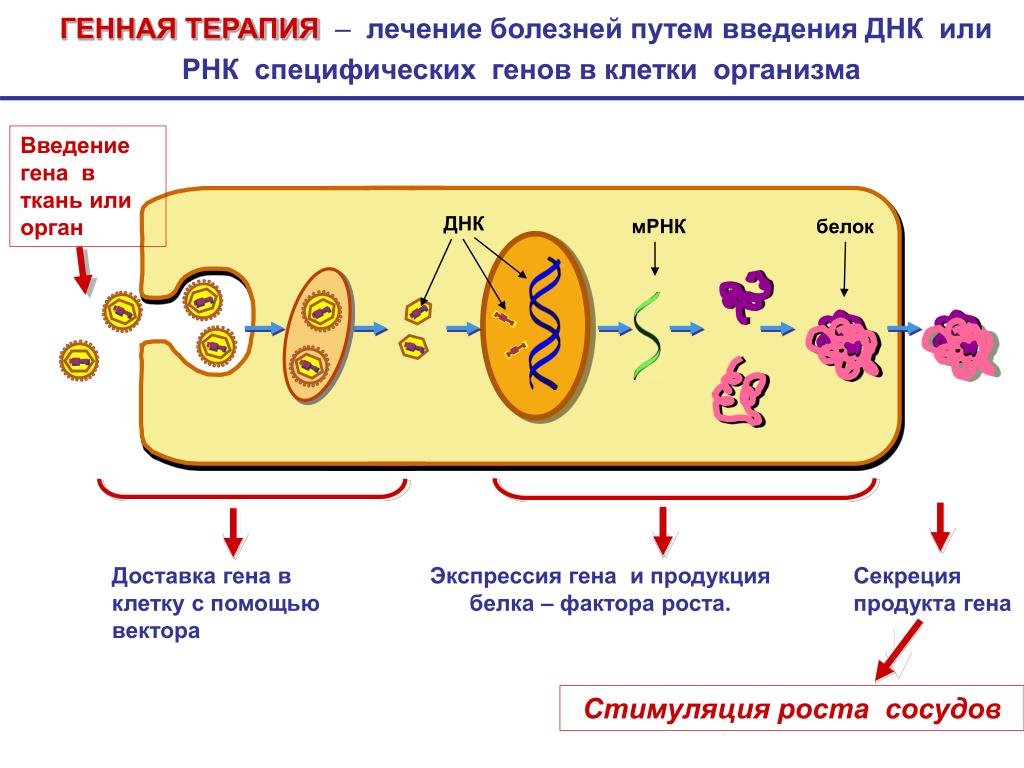
За последнее десятилетие задача генной терапии состояла в том, чтобы заставить ее работать в клинике. Следующим на очереди является обеспечение того, чтобы все больные получали необходимую им помощь.
«Мы должны сохранять бдительность, чтобы сделать лечение доступным», — сказал Гупта. «Эти замечательные достижения науки являются результатом работы, поддерживаемой средствами налогоплательщиков в течение длительного периода времени. У генной терапии светлое будущее, но мы должны сделать его ярче, сделав его доступным для каждого человека».
Этот метод на основе РНК может сделать генную терапию более эффективной | MIT News
Доставка функциональных генов в клетки для замены мутировавших генов, подход, известный как генная терапия, обладает потенциалом для лечения многих типов заболеваний. Самые ранние попытки доставки генов в больные клетки были сосредоточены на ДНК, но сейчас многие ученые изучают возможность использования вместо нее РНК, которая могла бы обеспечить повышенную безопасность и более легкую доставку.
Инженеры-биологи Массачусетского технологического института разработали способ регулирования экспрессии РНК после ее попадания в клетки, что дает им точный контроль над дозой белка, которую получает пациент. Эта технология может позволить врачам более точно подбирать лечение для отдельных пациентов, а также предлагает способ быстро отключить гены, если это необходимо.
«Мы можем очень дискретно контролировать, как экспрессируются разные гены», — говорит Джейкоб Бекрафт, аспирант Массачусетского технологического института и один из ведущих авторов исследования, опубликованного в выпуске журнала 9 от 16 октября.0103 Природа Химическая Биология . «Исторически генная терапия сталкивалась с проблемами безопасности, но с новыми достижениями в области синтетической биологии мы можем создать совершенно новые парадигмы «умной терапии», которые активно взаимодействуют с собственными клетками пациента для повышения эффективности и безопасности».
Бекрафт и его коллеги из Массачусетского технологического института основали компанию для дальнейшего развития этого подхода с первоначальным упором на лечение рака. Тайлер Вагнер, недавно получивший докторскую степень в Бостонском университете, также является ведущим автором статьи. Тасуку Китада, бывший постдоктор Массачусетского технологического института, и Рон Вайс, профессор биологической инженерии Массачусетского технологического института и член Института Коха, являются старшими авторами.
Тайлер Вагнер, недавно получивший докторскую степень в Бостонском университете, также является ведущим автором статьи. Тасуку Китада, бывший постдоктор Массачусетского технологического института, и Рон Вайс, профессор биологической инженерии Массачусетского технологического института и член Института Коха, являются старшими авторами.
Цепи РНК
На данный момент только несколько методов генной терапии одобрены для использования человеком, но ученые работают над новыми методами генной терапии и тестируют их для лечения таких заболеваний, как серповидноклеточная анемия, гемофилия и врожденные заболевания глаз, среди многих другие.
В качестве инструмента генной терапии с ДНК может быть сложно работать. При переносе синтетическими наночастицами частицы должны быть доставлены в ядро, что может быть неэффективно. Вирусы намного эффективнее доставляют ДНК; однако они могут быть иммуногенными, сложными и дорогими в производстве и часто интегрируют свою ДНК в собственный геном клетки, что ограничивает их применимость в генетической терапии.
Мессенджерная РНК, или мРНК, предлагает более прямой и непостоянный способ изменения экспрессии клеточных генов. Во всех живых клетках мРНК переносит копии информации, содержащейся в ДНК, в клеточные органеллы, называемые рибосомами, которые собирают белки, кодируемые генами. Следовательно, доставляя мРНК, кодирующую определенный ген, ученые могут индуцировать производство желаемого белка без необходимости вводить генетический материал в ядро клетки или интегрировать его в геном.
Чтобы сделать основанную на РНК генную терапию более эффективной, команда Массачусетского технологического института решила точно контролировать производство терапевтических белков, когда РНК попадает внутрь клеток. Для этого они решили адаптировать принципы синтетической биологии, позволяющие точно программировать цепи синтетической ДНК, к РНК.
Новые схемы исследователей состоят из одной нити РНК, которая включает гены нужных терапевтических белков, а также гены РНК-связывающих белков, которые контролируют экспрессию терапевтических белков.
«Благодаря динамическому характеру репликации производительность цепей можно настроить таким образом, чтобы разные белки экспрессировались в разное время из одной и той же нити РНК», — говорит Бекрафт.
Это позволяет исследователям включать цепи в нужное время с помощью «маломолекулярных» препаратов, которые взаимодействуют с РНК-связывающими белками. Когда к клеткам добавляют такой препарат, как доксициклин, уже одобренный FDA, он может стабилизировать или дестабилизировать взаимодействие между РНК и РНК-связывающими белками, в зависимости от того, как устроена схема. Это взаимодействие определяет, блокируют ли белки экспрессию генов РНК или нет.
В предыдущем исследовании исследователи также показали, что они могут встраивать клеточную специфичность в свои цепи, так что РНК становится активной только в клетках-мишенях.
Борьба с раком
Компания Strand Therapeutics, основанная исследователями, в настоящее время работает над адаптацией этого подхода к иммунотерапии рака — новой стратегии лечения, которая включает стимуляцию собственной иммунной системы пациента для борьбы с опухолями.
Используя РНК, исследователи планируют разработать цепи, которые могут избирательно стимулировать иммунные клетки к атаке опухолей, что позволит воздействовать на опухолевые клетки, метастазировавшие в труднодоступные части тела. Например, оказалось трудно воздействовать на раковые клетки, такие как поражения легких, с помощью мРНК из-за риска воспаления легочной ткани. Используя цепи РНК, исследователи сначала доставляют свою терапию к целевым типам раковых клеток в легких, а через свои генетические схемы РНК активирует Т-клетки, которые могут лечить метастазы рака в других частях тела.
«Надежда состоит в том, чтобы вызвать иммунный ответ, который сможет выявлять и лечить остальные метастазы по всему телу», — говорит Бекрафт. «Если вы можете вылечить один участок рака, то ваша иммунная система позаботится обо всем остальном, потому что теперь вы выработали иммунный ответ против него».
Используя такие схемы РНК, врачи смогут корректировать дозировку в зависимости от реакции пациента, говорят исследователи.
