Почему в качестве доноров органов используют свиней, а не шимпанзе? Пересадка генома человека
Пересадка генов - Генетика
Большинство методов пересадки генов заключаются во введении ДНК в ткани-мишени с целью создания условий для экспрессии экзогенного гена, кодирующего белок, который отсутствует у пациента в результате мутации гена, или с целью обеспечить синтез нового белка с желаемым фармакологическим эффектом.
В этой ситуации экзогенный ген, называемый трансгеном, не занимает своего нормального положения на хромосоме в геноме человека. Но при введении соответствующих промоторов или регуляторных элементов трансген может экспрессироваться в клетках-мишенях. В процессе развития пересадки генов возникает ряд проблем, в том числе достижение терапевтического уровня экспрессии гена в соответствующих клетках, контроль экспрессии гена, возможность иммунных реакций с вектором или продуктом гена и риск мутагенеза. При некоторых приобретенных заболеваниях (например, рак или инфекции) желательна кратковременная экспрессия трансгена, а для большинства наследственных заболеваний необходима пожизненная генетическая модуляция.
Пересадка генов включает введение нуклеиновой кислоты в лекарственной форме, которая вместо случайного распространения включается в ДНК клеток, что приводит к коррекции мутации хромосомной ДНК, превращая неактивный ген в активный или нормализуя активность аномально функционирующего гена. Несмотря на видимые преимущества генной коррекции (устранения мутации) по сравнению с введением экзогенной ДНК, что теоретически может привести к возникновению нежелательных побочных эффектов, применение технологий генной коррекции может быть очень сложно в случае заболеваний, обусловленных сотней различных мутаций. Поэтому этот вид пересадки генов ограничен лечением моногенных заболеваний.
В связи с клинической эффективностью заместительной ферментной терапии при таких заболеваниях, как болезнь Гоше, вызывают сомнения преимущества активации синтеза белка в организме пациента по сравнению с экзогенным введением данного белка. В некоторых случаях невозможно направить экзогенный белок в ткань-мишень или обеспечить его внутриклеточную локализацию, что необходимо для его функционирования. При синтезе белка в тканях больного с терапевтической целью может быть достигнута его значительно более высокая местная концентрация, что помогает избежать системной токсичности при парентеральном введении экзогенного белка. Поддержание постоянного терапевтического уровня для большинства экзогенно вводимых белков достаточно сложно.
Трансферные гены могут обеспечить постоянную равновесную концентрацию требуемого белка.
Пересадка генов может осуществляться ex vivo или in vivo. В случае генной терапии ex vivo проводится забор клеток-мишеней, их генетическая коррекция в лаборатории и повторное введение пациенту. Этот метод подобен пересадке органов (например, печени при гиперлипидемии) или клеток (например, пересадка костного мозга при лизосомных заболеваниях), за тем исключением, что в данном случае вводятся аутологичные клетки, что снижает вероятность иммунных реакций и гибели клеток в результате отторжения. Хотя такой подход легко применим к некоторым видам клеток, включая клетки костного мозга и фибробласты, его значительно сложнее осуществить по отношению к большинству других тканей. Целью пересадки генов in vivo служит введение вектора и гена внутривенно, перорально или через верхние дыхательные пути. Вектор должен направить ген в соответствующие органы-мишени с минимальным его рассеиванием в другие ткани. Дальнейшие защитные механизмы включают использование регуляторных последовательностей, присоединенных к гену, которые обеспечивают транскрипцию трансгена в тканях-мишенях.
Важно иметь в виду риск гуморального иммунного ответа, направленного против соответствующего продукта трансгена, или клеточного иммунного ответа, направленного против клеток, модифицированных данным геном. Эта проблема пересадки генов особенно значима у пациентов с наследственными заболеваниями, в организме которых никогда не вырабатывался данный нормальный белок (в результате делеции гена). Полиморфизм генетических вариаций у людей позволяет предположить, что ответ на попытку генной терапии будет варьировать у людей значительно шире, чем в экспериментах на линейных животных. Перед проведением исследований с участием людей необходимы доклинические испытания на животных, однако важно учитывать ограниченное значение этих исследований.
Полезно:
Геном свиней «очистили» от вирусов для пересадки их органов людям
При помощи технологии CRISPR-Cas9 исследователи из США, Китая и Дании вырастили свиные эмбрионы и поросят с «выключенными» копиями ретровируса, потенциально опасного для человека.
Межвидовая трансплантация подразумевает пересадку органов или тканей от организмов одного биологического вида другому. Ученые и врачи особенно заинтересованы в пересадке органов животных человеку и большие надежды в этой области возлагают на свиней, поскольку их органы близки к человеческим по размеру и функциям, а выращивать этих животных проще, чем, к примеру, приматов.
Однако существуют две принципиальные проблемы, связанные с трансплантацией свиных органов человеку: это иммунологическая несовместимость и риск заражения реципиентов свиным эндогенным ретровирусом (сокращенно PERV — porcine endogenous retrovirus). Будучи ретровирусом (как, к примеру, вирус иммунодефицита человека), PERV способен встраиваться в ДНК свиньи, а затем распространяться, заражая новые клетки.
Хотя до сих пор не было зафиксировано случаев заражения человека PERV напрямую от свиньи, авторы новой работы подтвердили опасения, показав возможность инфицирования на клеточном уровне. Таким образом, PERV представляет реальное препятствие в использовании свиных органов для межвидовой трансплантации. Однако исследователи предложили методику, позволяющую вырастить генетически модифицированных животных-доноров с инактивированными копиями PERV в геноме.
Для этого ученые обратились к системе редактирования генома CRISPR-Cas9, позволяющей вносить направленные изменения в последовательность ДНК. С ее помощью им удалось добиться эффективности «выключения» генов PERV выше 90% на свиных эмбриональных стволовых клетках свиньи. А с использованием коктейля из веществ, препятствующих апоптозу (клеточной смерти) генетически отредактированных клеток, — довести эффективность до 100%.
Затем при помощи технологии пересадки ядер соматических клеток из отредактированных клеток исследователи получили здоровые зародыши, которые затем подсадили суррогатным матерям.
В общей сложности ученые вырастили 15 поросят с полностью инактивированными PERV. Сейчас старшему поколению животных около четырех месяцев, и исследователи продолжают наблюдение за ними, чтобы изучить влияние инактивации PERV и геномного редактирования на взрослых животных.
Статья с описанием результатов исследования опубликована в журнале Science.
Одна из возможных альтернатив межвидовой трансплантации — использование химерных животных в качестве «инкубаторов» для выращивания органов из человеческих стволовых клеток. Эта технология поможет решить вторую проблему ксенотрансплантации — иммунологическую несовместимость. Как это работает, читайте на «Чердаке».
chrdk.ru
Наука: Наука и техника: Lenta.ru
Подводя итоги уходящего года, «Лента.ру» составила список лучших публикаций 2016-го года. Этот текст — один из них. Технология CRISPR-Cas9 привлекает большое внимание как ученых, так и всех тех, кто интересуется биотехнологиями. Многие считают, что новый метод точного редактирования генов позволит создать в будущем совершенного человека. «Лента.ру» рассказывает о том, что представляет собой система CRISPR и следует ли ждать от нее чудес.
В начале февраля 2016 года стало известно, что правительство Великобритании разрешило ученым изменять ДНК человеческих эмбрионов в исследовательских целях с помощью системы CRISPR. Речь не идет о создании ГМО-людей, поскольку все модифицированные эмбрионы, полученные через экстракорпоральное оплодотворение, через 14 дней будут уничтожаться. Однако общественность сильно обеспокоилась. Например, директор национальной разведки США Джеймс Клэппер заявил, что потенциально технологии редактирования генома — это оружие массового поражения. Его пессимистический прогноз воплотили в новом сезоне сериала «Секретные материалы», где систему CRISPR использовали для глобального геноцида. Что же такое технология CRISPR, почему она вызывает столько ажиотажа среди ученых, опасений у общественности и что в действительности может дать человечеству?
Рисунок художника системы CRISPR-Cas
Изображение: Steve Dixon / Feng Zhang / MIT
CRISPR — это иммунная система бактерий и архей, спасающая микроорганизмы от вирусов. Впервые она была обнаружена японскими учеными в конце 1980-х годов у бактерии Escherichia coli (кишечная палочка). Они заметили, что в геноме бактерии присутствуют повторяющиеся последовательности, разделенные спейсерами — уникальными участками. Однако какую роль все это выполняет, тогда выяснить не смогли. Схожую генетическую структуру-кассету нашли позднее у другого микроорганизма — археи Haloferax mediterranei, а затем и у многих других прокариот. Такие участки стали называть акронимом CRISPR, то есть Clustered Regularly Interspaced Short Palindromic Repeats. По-русски — «короткие палиндромные повторы, регулярно расположенные группами».
Материалы по теме
00:06 — 4 марта 2016
Спустя более десяти лет генетики установили, что рядом с CRISPR-кассетами располагаются гены, которые кодируют белки, названные Cas. Известные спейсеры сравнили с последовательностями ДНК из обширных баз геномных данных. Оказалось, что спейсеры очень похожи на участки геномов вирусов-бактериофагов, а также плазмид — кольцевых молекул ДНК, обычно встречающихся у бактерий.
Группа биоинформатиков под руководством Евгения Кунина из Национального центра биотехнологической информации предложила механизм работы CRISPR-кассет и ассоциированных с ними белков Cas. Вирус, проникший в клетку бактерии, обнаруживается комплексом белков Cas, несущих с собой последовательность спейсера. Если последняя совпадает с участком ДНК вируса (протоспейсером), то белки Cas разрезают чужеродную ДНК, предотвращая инфекцию. Позже ученые сумели внести в CRISPR-кассету бактерии спейсер с фрагментом генома бактериофага и наблюдали, как микроорганизм успешно справился с вирусом. Это послужило одним из доказательств предложенной гипотезы.
Спейсеры в CRISPR-кассетах — это шаблон для производства crРНК, которая и отправляется вместе с Cas-белками в атаку на вирус. Откуда же спейсеры берутся? Когда бактерия сталкивается с неизвестным вирусом, она начинает вырезать различные участки ДНК из своего и чужого генома и вставлять их в кассету. Конечно, большинство таких кусков оказываются бесполезными и даже вредными, однако тот, что помогает организму побороть инфекцию, остается в CRISPR и передается потомкам бактерии.
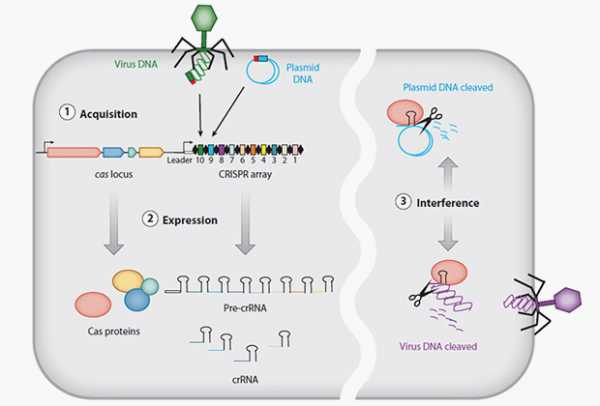
Схема работы кассеты CRISPR в защите бактерии от вирусов
Изображение: Annual Review of Genetics
Выяснилось, что существует несколько разновидностей системы CRISPR-Cas. Одна из них кодирует не комплекс белков Cas, а всего лишь один — Cas9. Это универсальная молекула, выполняющая сразу несколько функций: она связывает чужеродную ДНК и разрезает ее. Именно в системе с белком Cas9 ученые увидели точный инструмент редактирования генома. В статье, опубликованной в журнале Science в 2012 году, Эммануэль Шарпентье и Дженнифер Дудна предложили в качестве crРНК искусственные последовательности, которые узнавали бы определенные участки ДНК. Тогда Cas9 вносил бы разрезы туда, куда это нужно ученым. Другая исследовательская группа примерно в это же время показала, что система CRISPR-Cas9 может работать с геномами не только в бактериях, но и в клетках других организмов, включая человека.
И до CRISPR-системы были известны способы редактирования генома. Например, с помощью нуклеаз, содержащих цинковые пальцы. Это искусственные ферменты, не существующие в природе и способные расщеплять цепочку ДНК. Цинковый палец — особый белковый модуль, включающий в себя один или несколько ионов цинка. Именно с помощью подобных структур ферменты взаимодействуют с ДНК, РНК и другими молекулами. Ученые соединили цинковый палец с другим модулем, разрезающим цепочку ДНК. Такие нуклеазы могут быть нацелены на определенные участки генома, где и производят разрезы. Проблема в том, что для каждого участка, куда нужно внести разрыв, необходимо синтезировать, выделить и проверить специфичный белок. Кроме того, применение нуклеаз сопряжено с большой вероятностью ошибок: часто разрывы происходили не в тех местах, что были нужны.
Система CRISPR-Cas гораздо удобнее. Функцию разреза на себя берет белок Cas9, одинаковый для любых локусов-мишеней. Все, что нужно сделать, это синтезировать crРНК, которая укажет белку, где именно внести двуцепочечный разрыв. После того как разрыв внесен, включаются системы восстановления ДНК. Во-первых, это механизм негомологичного соединения концов (non-homologous end joining, NHEJ ), в результате чего возникают различные мутации, нарушающие функции генов. Если сделать множество таких разрывов, то можно добиться перестройки крупного участка ДНК.
Во-вторых — гомологичная рекомбинация (homologous recombination, HR), когда похожие или идентичные участки ДНК обмениваются между собой нуклеотидными последовательностями. Такой механизм используется для восстановления повреждений двойной цепи, называемых двунитевыми разрывами.
Что касается управляемого редактирования ДНК, то ученым больше подходит гомологичная рекомбинация. С помощью системы CRISPR-Cas можно внести разрывы так, чтобы убрать из ДНК целый участок. При этом генетики подсовывают созданную ими последовательность, которая встраивается на место удаленной. Таким образом можно «ремонтировать» мутации, вызывающие тяжелые заболевания. Ученые убирают дефектный участок гена и заменяют его на нормальный. Более того, можно вносить новые мутации, создавать различные варианты одного и того же гена, добавлять к нему специфические последовательности, что отражается на функциях кодируемого им белка.
Можно исправлять сразу множество дефектных генов. Для этого нужно лишь синтезировать соответствующие crРНК, чьи последовательности совпадают с нужными участками ДНК. Белки Cas9 связываются с crРНК и устремляются «чинить» гены. Следует уточнить, что когда мы говорим о совпадении, то имеем в виду комплементарное соответствие. Принцип комплементарности показывает, в каком случае между различными цепочками ДНК или РНК будут образовываться связи. Нуклеотид А связывается с нуклеотидом Т, а нуклеотид С — с G. Поэтому, например, фрагмент ACTG совпадает с TGAC.
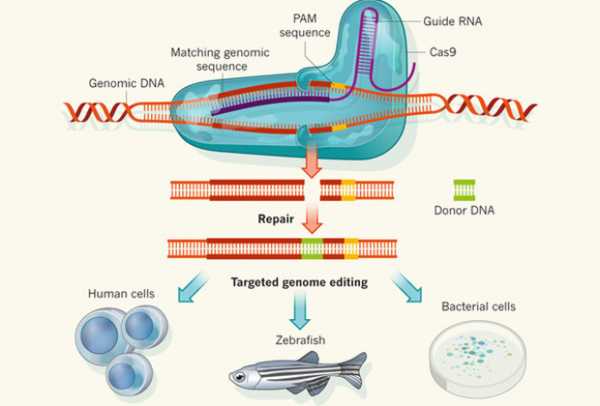
Схема редактирования ДНК с помощью CRISPR
Изображение: Nature
Когда стало понятно, что CRISPR-систему можно использовать для редактирования генома человека, множество лабораторий по всему свету занялись активными исследованиями. Например, используют технологию для создания генно-модифицированных организмов. Одно из направлений — создание кисломолочных бактерий, которые могли бы сопротивляться атаке бактериофагов, уничтожающих культуры полезных микроорганизмов. Но пожалуй, одно из самых интересных применений CRISPR — борьба с ретровирусными инфекциями.
Ретровирусы — к ним относится ВИЧ — вставляют свой геном прямо в ДНК зараженной клетки. В журнале Scientific Reports опубликована работа, демонстрирующая, как с помощью CRISPR-Cas9 можно очистить пораженные ВИЧ Т-лимфоциты и даже воспрепятствовать повторному встраиванию вируса. Генетики просто-напросто внесли в культуру T-клеток гены, кодирующие crРНК и Cas9, которые, в свою очередь, успешно вырезали ДНК вируса из генома лимфоцитов.
Китайские ученые проводили эксперименты на эмбрионах человека еще до того, как подобные исследования разрешили в Великобритании. В апреле 2016 года генетики сообщили, что они изменили гены зародышей, чтобы сделать их неуязвимыми к ВИЧ. С помощью CRISPR они внесли ген, который встречается у людей, невосприимчивых к инфекции.
Пригодилась система CRISPR и в борьбе с раком. Например, в работе, опубликованной в Nature Biotechnology, показано, что с помощью модифицированного белка Cas9 можно отключать определенные гены и тем самым определять их роль в перерождении нормальных клеток в злокачественные. Если выяснится, что мутация в определенном гене способствует развитию рака, то следующий шаг — исправление дефекта с помощью генетических манипуляций.
CRISPR способен помочь в лечении рака крови — лейкемии. Вместо того чтобы искать донора костного мозга, можно взять образцы тканей кроветворного органа самого пациента, исправить дефективные стволовые клетки, избавив их от роковой мутации, а затем пересадить обратно. Если злокачественные клетки, оставшиеся в больном организме, уничтожить облучением, исправленные клетки получат возможность размножаться и производить здоровые клетки крови.
Опасна ли система CRISPR? На нынешнем уровне развития нет. Опасения в большей степени связаны с тем, что редактировать геном человека с целью лечения наследственных заболеваний пока еще рано. Технология пока еще сырая. Так, работы китайских ученых были раскритикованы за большое количество разрывов ДНК, возникших не в том месте. Кроме того, только в нескольких из полусотни эмбрионов была произведена правильная замена участка гена.
Если технология редактирования генома и избавит человечество от наследственных заболеваний, рака, вирусов, то это дело будущего, которое, возможно, гораздо дальше, чем думают оптимисты. Что же касается создания улучшенных людей и связанных с этим этических проблем, то это вообще за пределами того, на что способна система CRISPR.
lenta.ru
как взломать код жизни — National Geographic Россия
Окинув беглым взглядом офис Энтони Джеймса, нетрудно догадаться, чем он занимается, — все стены завешаны изображениями комаров, а полки уставлены книгами об этих насекомых.
Над рабочим столом красуется плакат, на котором наглядно представлены все стадии развития комара Aedes aegypti: вылупление личинки из яйца, ее последующее окукливание и превращение во взрослую особь. Масштаб изображения заставит содрогнуться даже заядлых любителей триллеров о кровожадных насекомых-гигантах. На номерном знаке машины Энтони тоже гордо отштамповано непонятное непосвященным сочетание букв — AEDES.
«Три десятка лет я буквально помешан на комарах», — рассказывает Энтони Джеймс, молекулярный генетик из Калифорнийского университета (Ирвайн). В природе встречается около 3,5 тысячи видов настоящих комаров, но Энтони интересуют лишь самые смертоносные из них. Один из ярких примеров — малярийный комар Anopheles gambiae — переносчик болезни, ежегодно уносящей жизни сотен тысяч человек.
Биогеографы полагают, что эти комары попали в Америку из Африки на кораблях работорговцев в XVII веке и принесли с собой желтую лихорадку, от которой в те времена в Новом Свете погибли миллионы людей. В наши дни эти насекомые стали переносчиками еще и лихорадки денге, которой ежегодно заражаются около 400 миллионов человек, вирусов чикунгунья, Западного Нила и Зика. (Последний разбушевался в прошлом году в Бразилии и Пуэрто-Рико, что привело к вспышке целого ряда заболеваний нервной системы. В их числе и довольно редкий недуг — микроцефалия: дети рождаются с непропорционально маленькой головой и недоразвитым мозгом.)
Основная цель, которую ставит перед собой группа Энтони, — подобрать ключ к геному комаров и сделать так, чтобы те не смогли распространять опасные болезни. До недавних пор его команда продвигалась по тернистому пути теоретических исследований практически одна. Все изменилось с появлением новой революционной технологии — CRISPR/Cas9: изыскания Энтони наконец обрели практическую основу.
CRISPR/Cas9 — две составляющие генной системы бактерий, отвечающие за иммунитет этих мельчайших существ. Первая представляет собой расположенные регулярными группами короткие палиндромные повторы ДНК (по-английски, cluster regularly interspaced short palindromic repits, или сокращенно CRISPR), между которыми сидят спейсеры (буквально: «разделители»).
Спейсеры, по сути, представляют собой участки генов вирусов и выполняют роль своего рода картотеки генетических «отпечатков пальцев» этих главных врагов бактерий. А Cas9 — белок, который с помощью направляющей РНК — копии того или иного спейсера — сверяет фрагменты вирусной ДНК, уже имеющиеся в «картотеке», с инородными молекулами, оказавшимися в клетке. И, если совпадение обнаружено, разрезает ДНК пытавшегося внедриться в клетку вируса, лишая его возможности размножаться.
Оказалось, что Cas9 можно приспособить для работы с любой направляющей РНК, а значит, этот белок можно нацелить на разрезание любой последовательности ДНК, являющейся аналогом этой РНК. Когда разрез в заданной части ДНК произведен, остается лишь вставить в зазор нужный ген (а можно ничего нового не вставлять, достаточно удалить ненужное старое). Дальше все делает сама клетка (причем не только бактериальная!): для нее устранение подобных разрывов — рутинная работа.
Овладев оружием бактерий против вирусов, генетики научились быстро и точно изменять ДНК любого живого организма на планете, и человек не стал исключением. По сути, CRISPR-технология — это скальпель в руках генетика, более острый и более безопасный, чем стальной скальпель хирурга. С помощью нового метода генной инженерии специалисты могут исправить некоторые генетические недуги — отредактировать мутации, приводящие к дистрофии мышц, кистозному фиброзу, даже победить одну из форм гепатита. Недавно несколько групп ученых попробовали использовать новый метод, чтобы «вырезать» гены вируса иммунодефицита (ВИЧ), встроившиеся в хромосомы человеческих клеток — лимфоцитов. Пока рано говорить о новом чудо-средстве от СПИДа, но, по убеждению многих специалистов, оно будет найдено именно благодаря CRISPR-технологии.
Еще одно направление активных поисков — борьба с вирусами свиней, из-за которых до сих пор не удается поставить на поток пересадку органов от животных к человеку. Пытаются найти применение CRISPR-технологии и для защиты видов, находящихся под угрозой исчезновения. Начали проводить эксперименты и по удалению генов из ДНК культурных растений, чтобы отвадить от них насекомых-вредителей. Если этого удастся добиться, человечество перестанет всецело полагаться на ядовитые пестициды.
Ни одно из научных открытий прошлого века не сулило стольких благ — но и не поднимало такого множества этических проблем. К примеру, можно ли редактировать половые клетки? Ведь они содержат генетический материал, передающийся следующим поколениям — детям, внукам и правнукам генетически модифицированных особей — и так до бесконечности. Неважно, какими намерениями при этом будут руководствоваться генетики — желанием ли исправить врожденный недуг, стремлением ли усилить какое-то полезное свойство, — но кто возьмет на себя смелость предсказать все последствия от вмешательства в сами основы жизни?
«Если кто-то вдруг отважится на преобразование половых клеток, он должен трижды подумать, — размышляет Эрик Ландер, директор Кембриджского института имени Броуда, возглавлявший нашумевший не так давно проект «Геном человека». — И пока этот смельчак не докажет широкой общественности, что для подобного вмешательства в природу человека есть веские основания, а общество не примет его доказательства, ни о каком глубоком изменении генома и речи быть не может. Однако ученым еще не удалось найти ответы на многие этические вопросы. И я не знаю, кто и когда сможет их дать».
А промедление в данном случае смерти подобно в самом прямом смысле слова. Так, по прогнозам центров по контролю и профилактике заболеваний США, к моменту, когда бушующая в Пуэрто-Рико эпидемия лихорадки Зика пойдет на спад, более четверти из 3,5-миллионного населения острова станут носителями этого заболевания (расчет основан на моделях распространения других патогенов, переносчиками которых являются комары). Это значит, что тысячи беременных женщин рискуют родить неизлечимо больного или нежизнеспособного ребенка.
По-настоящему эффективное решение проблемы на данный момент одно — залить весь остров инсектицидами, которые уничтожат насекомых-переносчиков. [Так в свое время поступили в СССР при строительстве Братской ГЭС. — Примечание российской редакции (ПРР).] Однако Энтони Джеймс предлагает иной способ искоренить болезнь раз и навсегда. Для этого потребуется всего лишь отредактировать геном комаров по технологии CRISPR.
Направленное редактирование генома позволяет обойти «незыблемые» законы наследственности. В природе заведено так, что при размножении половым путем родители передают потомкам по одной копии генов каждый. Однако некоторые гены-счастливчики получили «подарок» от эволюции: их шансы быть унаследованными превышают 50 процентов. Правда, обладатели таких генов вряд ли будут рады подобному дару судьбы: как правило, это гены — носители тяжелых заболеваний. Теперь же — хотя бы теоретически — ученые могут использовать CRISPR-технологию для вырезания из цепочки ДНК дефектных генов. Дальше измененный генотип будет распространяться в популяции естественным (половым) путем.
-

Лон Хайбинь, сотрудник Института фармацевтических исследований в Гуанчжоу, гладит бигля Тяньгу — одну из двух собак, выращенных из эмбрионов, чей геном был отредактирован для увеличения мышечной массы животного вдвое. Подобные эксперименты позволяют ученым лучше понять механизмы возникновения мышечной дистрофии у человека.
-

Сотрудник Международного центра регенеративной медицины в Шэньчжэне перед входом в стерильное помещение, где клетки роговицы свиного глаза модифицируют для последующей пересадки людям.
В прошлом году в журнале Proceedings of the National Academy of Sciences была опубликована статья Энтони Джеймса, в которой он описал применение CRISPR-метода для генетической модификации малярийного комара. «Благодаря вставке определенных генов комары не смогут распространять возбудителей смертоносной болезни, — объясняет Джеймс. — Но при этом больше ничего в их жизни не изменится».
«Я работал в тишине и покое десятилетиями, никто обо мне не знал. Теперь мой телефон разрывается от звонков», — добавляет он, кивком головы указывая на стопку писем, скопившихся на его рабочем столе. Но Энтони прекрасно понимает, что запуск искусственно созданной мутации, спроектированной для быстрого распространения в популяции диких животных, может привести к непредсказуемым последствиям и, возможно, к необратимым изменениям природы. «Распространение насекомых с отредактированным в лаборатории геномом в естественной среде, безусловно, сопряжено с определенным риском, — рассуждает ученый. — Однако, на мой взгляд, бездействие еще опаснее».
Генетики более 40 лет назад научились удалять определенные последовательности нуклеотидов из генома одних организмов и переносить их в другие для изменения природы новых обладателей. Молекулярные биологи предвкушали, какие огромные возможности сулит им метод рекомбинантных ДНК — так назвали новую технологию. Однако энтузиазма поубавилось, когда они осознали, что перенос ДНК между различными видами может привести к неконтролируемому распространению вирусов и других патогенов, а впоследствии — к возникновению заболеваний, от которых не существует природных механизмов защиты. А значит, от этих болезней не будет готовых вакцин.
Непредсказуемое будущее напугало прежде всего самих ученых. В 1975 году на проходившей в Калифорнии Асиломарской конференции молекулярные биологи со всего мира обсудили риски, которые несла генная инженерия, и создали рабочую группу, выработавшую ряд мер по усилению безопасности в экспериментах с геномом.
Вскоре стало ясно, что безопасность приемлемого уровня достижима, а возможности новой прикладной науки превосходят самые смелые ожидания. Генная инженерия начала постепенно изменять к лучшему жизни миллионов людей. Страдающие диабетом получили стабильный источник инсулина: ученые передали бактериям гены, отвечающие за синтез инсулина в человеческом организме, и гигантские колонии генетически модифицированных бактерий превратились в настоящие инсулиновые фабрики.
Благодаря генетической модификации растений появились новые высокоурожайные культуры, устойчивые к гербицидам и насекомым, — начался новый виток зеленой революции.
-

Оба родителя 16-месячного Джека — носители одного и того же дефектного гена, а значит, с вероятностью 25 процентов их дети унаследуют муковисцидоз. К счастью, сам Джек не подвержен этому недугу, но он со временем тоже может передать заболевание по наследству.
-
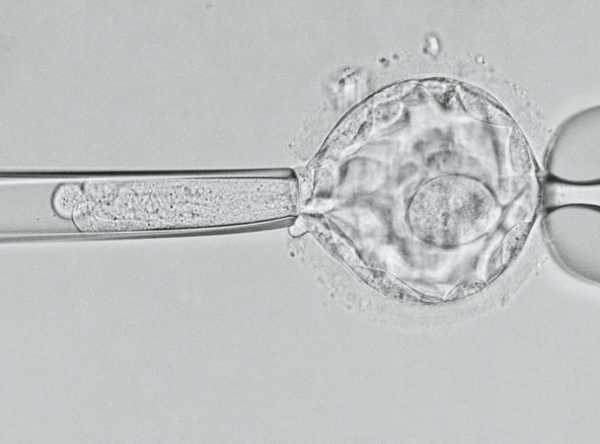
Прежде чем эмбрионы попали в матку, была проведена тщательная преимплантационная генетическая диагностика (ПГД) — проверка, позволяющая отобрать лишь здоровых зародышей. По подсчетам Илана Тур-Каспа, доктора из Института репродуктивной генетики и репродукции человека (Огайо), проводившего операцию, ПГД поможет сократить расходы на лечение муковисцидоза на 2,2 миллиарда долларов в год.
Получило широкое распространение и лечение при помощи генной инженерии. Лишь пищевая промышленность столкнулась с неприятием обществом тех же самых научных методов. Не помогли и многочисленные исследования, демонстрирующие, что употребление в пищу продуктов, полученных с помощью генетически модифицированных организмов (ГМО), ничуть не опаснее традиционной пищи. Истерия вокруг ГМО подтверждает: люди готовы отказаться даже от тех продуктов питания, которые были признаны безопасными научным сообществом. [И это при том, что несчастные случаи, связанные с употреблением «здоровых» органических продуктов зафиксированы были, а от употребления генетически модифицированных продуктов еще никто не пострадал! Однако благодаря малообразованным политикам, чьи высказывания моментально подхватываются и распространяются в СМИ, у обывателей складывается обратное впечатление. — ПРР.]
На заре применения метода рекомбинантных ДНК термины «трансгенный» и «генетически модифицированный» относились к организмам, созданным при комбинировании ДНК модифицируемого организма с фрагментами ДНК, взятыми у других видов. Возможно, CRISPR-технология поможет ученым переубедить обывателя: генная инженерия в ряде случаев не просто нужна — она необходима. Ведь эта технология позволяет менять геном определенного вида без участия инородного ДНК.
Яркий тому пример — золотой рис. Единственное отличие этого генетически модифицированного сорта риса от исходного вида заключается в том, что его зерна, как раз благодаря модификации, богаты витамином А. Ежегодно в развивающихся странах до полумиллиона детей теряет зрение из-за недостатка витамина А, но активисты, выступающие против ГМО, все равно заблокировали как исследования ученых, так и коммерческое производство золотого риса. Теперь же генетики поменяли тактику и начали работы по изменению свойств обыкновенного риса с помощью CRISPR, чтобы добиться того же результата за счет редактирования генов самого растения. А группе ученых во главе с Кайся Гао из Китайской академии наук удалось, удалив все три копии одного из генов пшеницы, вывести сорт растения, устойчивый к опасному грибковому заболеванию — мучнистой росе.
На протяжении тысячелетий агрономы перебирали — конечно, неосознанно — гены представителей того или иного вида, скрещивая разные сорта. CRISPR-технология, по сути, является более экономным методом селекции — высокоточным и ускоренным. В некоторых странах различия между ГМО-сортами и сортами, полученными благодаря CRISPR-технологии, уже официально подтверждены регулирующими органами — так поступили правительства Германии, Швеции и Аргентины.
Помимо грядущих изменений в пищевой промышленности трудно переоценить возможности CRISPR-метода в медицине. Технология уже существенно упростила исследования в онкологии — теперь ученым гораздо проще создавать экспериментальные клоны раковых клеток в лаборатории и тестировать на них различные лекарства, чтобы выявить наиболее эффективное в борьбе с развивающейся опухолью.
Очень скоро доктора опробуют метод CRISPR для непосредственного лечения некоторых заболеваний. Например, стволовые клетки людей, страдающих от гемофилии, можно будет отредактировать вне организма пациента, чтобы исправить мутантные гены, вызывающие данное заболевание.
Затем новые работоспособные клетки нужно будет ввести обратно в кровоток пациента.
В ближайшие несколько лет нас ждут еще более удивительные научные прорывы. К примеру, в США около 120 тысяч человек записаны на трансплантацию органов, и очередь эта только растет. Тысячи людей умирают, так и не дождавшись спасительной операции. (И это без учета тех сотен тысяч людей, которые по разным медицинским показаниям не могут даже попасть в список на пересадку органов!) Долгие годы ученые пытаются решить проблему — в том числе и за счет использования органов животных. В числе кандидатов на донорство — свиньи, однако их ДНК содержит эндогенные свиные ретровирусы (PERV), похожие на ВИЧ и потенциально способные поражать клетки человека. Никакой государственный регулятор ни при каких условиях не разрешит пересадку зараженных органов, а до недавнего времени никому не удавалось полностью исключить ретровирусы из клеток свиньи. [Органы свиней используются в качестве потенциальных трансплантатов, поскольку они сопоставимы по размеру с человеческими и выращивать этих животных проще, чем шимпанзе и горилл (не говоря уже про этические проблемы), а отнюдь не потому, что они генетически ближе к людям, чем обезьяны. — ПРР.] Можно надеяться, что редактирование свиного генома с помощью CRISPR позволит генетикам обеспечить людей трансплантатами.
Группе под руководством Джорджа Черча, профессора Гарвардской медицинской школы и Массачусетского технологического института, уже удалось вырезать все 62 гена вирусов PERV из ДНК клетки свиной почки — сложнейшая операция с единовременным редактированием сразу нескольких участков генома проведена впервые. Когда модифицированные клетки смешали с человеческими в лаборатории, ни одна из клеток человека ничем не заразилась. Те же специалисты смогли успешно отредактировать и другие типы свиных клеток, удалив из них 20 генов, вызывающих отторжение чужеродных тканей иммунной системой человека. Это еще одна важная составляющая успешной трансплантации органов животных человеку.
Сейчас Джордж занимается клонированием модифицированных клеток, чтобы вырастить из них полноценные свиные эмбрионы. Через год-два он рассчитывает начать опыты на приматах, и, если после тестовых трансплантаций органы станут функционировать без сбоев, а отторжение не произойдет, то на следующем этапе можно будет ставить эксперименты с привлечением добровольцев. По оптимистичным прогнозам Черча подобные операции на людях станут реальны уже через полтора года, учитывая, что альтернатива риска для многих пациентов — неминуемая смерть.
На протяжении всей своей научной карьеры Джордж искал способ помочь людям, которым врачи отказали в трансплантации из-за низкой вероятности успеха. «Решение о пересадке органов для врачей одно из труднейших, — объясняет он. — Нужно учитывать множество факторов: наличие инфекционных заболеваний, злоупотребление алкоголем и вообще все, что «не так» с потенциальным реципиентом. Отказ принято подкреплять словами, что пересадка не принесет пациенту существенной пользы. Но это в корне неверно: безусловно, трансплантация дает второй шанс любому человеку! Просто нужно обеспечить достаточное количество донорских органов! »
Еще одно непаханое поле деятельности для CRISPR-технологии — восстановление популяций исчезающих видов. Скажем, популяции птиц на Гавайских островах стремительно сокращаются — всему виной особый вид малярийного плазмодия, поражающего пернатых. До того как в начале XIX века суда китобоев завезли на острова комаров, здешние птицы никогда не сталкивались c болезнями, переносчиками которых являются двукрылые, и не успели выработать к ним иммунитет. До наших дней дожили лишь 42 эндемичных гавайских вида, и три четверти из них уже находятся под угрозой исчезновения. Американская организация по сохранению птиц успела присвоить Гавайям статус «мировой столицы вымирающих видов пернатых». Если не остановить птичью малярию с помощью редактирования комариного генома, острова, скорее всего, лишатся всех собственных видов.
-
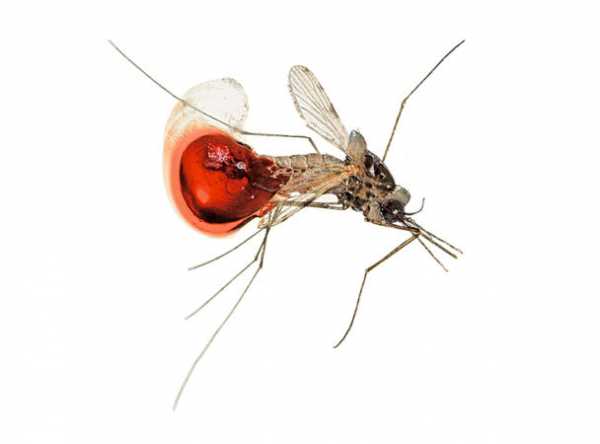
Кишечник этого комара из лаборатории Энтони Джеймса заполнен кровью коровы. Подобные насекомые способны переносить вирус Зика и лихорадку денге, но можно модифицировать их геном по CRISPR-технологии так, что потомство измененных особей окажется стерильным. Фото: Дэвид Лииттшвагер
Джек Ньюман, в прошлом главный научный сотрудник компании Amyris, первой наладившей выпуск синтетического артемизинина — единственного эффективного лекарства для лечения малярии у человека, теперь сосредоточился на борьбе с птичьими болезнями, переносчиками которых являются комары. Единственный на сегодня относительно эффективный метод защиты птиц — полное устранение переносчиков, для чего требуется распылить отравляющие вещества на огромной площади. Относительный — потому что даже при таком подходе успех вовсе не гарантирован. «Чтобы комар погиб, инсектицид должен попасть прямо на него», — объясняет Ньюман. Но кровососы проводят большую часть жизни, скрываясь в кронах деревьев и прячась в углублениях скал или между камнями. Чтобы отравить основную часть популяции комаров, придется залить химикатами все Гавайские острова. Если же пойти по пути изменения генома и стерилизовать комаров, то птиц можно будет спасти и без уничтожения привычной им среды обитания. «Использование генной инженерии — невероятно точное решение сразу нескольких проблем Гавайев, — убежден Джек. — Птичья малярия неуклонно уничтожает экосистему островов, но у нас есть возможность остановить ее. Неужели мы просто будем сидеть сложа руки и смотреть, как природа гибнет на наших глазах? »
Правда, не все рады стремительному прогрессу. Так, в феврале 2016 года директор Национальной разведки США Джеймс Клеппер в ежегодном выступлении в Сенате предостерег: технологии генной инженерии вроде CRISPR могут использоваться для создания оружия массового поражения. Впрочем, научное сообщество тут же указало на безосновательность подобных заявлений, признав их чересчур радикальными. У террористов есть гораздо более легкие и дешевые способы для нападения на мирных граждан, чем заражение фермерских полей новой болезнью или разработка смертельно опасного вируса.
Не стоит, конечно, полностью исключать возможный вред от использования новых генных технологий. «Какие могут быть последствия опрометчивого обращения с геномом? » — задается вопросом Дженифер Даудна, профессор химии и молекулярной биологии Калифорнийского университета (Беркли).
В 2012 году Дженифер, совместно с коллегой Эммануэль Шарпентье из Института инфекционной биологии в Берлине (один из сети исследовательских институтов Макса Планка) впервые применившая CRISPR-технологию для редактирования ДНК, так отвечает на свой вопрос: «Я не думаю, что мы знаем достаточно о геноме человека, да и о геноме других животных, но люди все равно будут использовать эту технологию — и неважно, насколько хорошо она изучена».
Читайте также
 Чем быстрее развивается наука, тем страшнее кажутся технологические угрозы, с которыми сталкивается человечество. Биология становится проще и доступнее, и в скором времени эксперименты с домашним набором CRISPR сможет проводить любой желающий — подобно радиолюбителям, собирающим у себя дома всевозможные приемники и передатчики. Так что обеспокоенность тем, что могут натворить любители в домашних лабораториях, если получат в руки инструмент для изменения фундаментальных основ генетики животных и растений, вполне оправдана.
Чем быстрее развивается наука, тем страшнее кажутся технологические угрозы, с которыми сталкивается человечество. Биология становится проще и доступнее, и в скором времени эксперименты с домашним набором CRISPR сможет проводить любой желающий — подобно радиолюбителям, собирающим у себя дома всевозможные приемники и передатчики. Так что обеспокоенность тем, что могут натворить любители в домашних лабораториях, если получат в руки инструмент для изменения фундаментальных основ генетики животных и растений, вполне оправдана. И все же не следует упускать удивительные возможности генной инженерии. Ведь если, например, удастся навсегда избавить человечество от малярии и других заболеваний, переносимых кровососами, это, безусловно, станет одним из величайших достижений современной науки. И хотя пока еще рано говорить о применении CRISPR-технологии для редактирования человеческих эмбрионов, есть другие способы преобразования генома половых клеток, позволяющие излечивать болезни, при этом не затрагивая ДНК будущих поколений.
Скажем, у детей с болезнью Тея-Сакса отсутствуют ферменты, необходимые для расщепления ганглиозид — жирных кислот, накапливающихся в нервных клетках головного мозга, что ведет к отмиранию этих клеток и, как следствие, к торможению умственного и физического развития, а затем и к ранней смерти ребенка. Заболевание встречается крайне редко и только в тех случаях, когда оба родителя передают своим детям дефектную копию одного и того же гена (что характерно для замкнутых людских групп с близкородственным скрещиванием). С помощью CRISPR-технологии можно скорректировать генетический материал одного из родителей — например, сперматозоиды отца — и ребенок наверняка не унаследует сразу обе дефектные копии.
В будущем подобная генная терапия сможет спасать жизни и снижать вероятность заболевания. Схожего эффекта уже можно добиться — при искусственном оплодотворении: выбор эмбриона без дефектной копии гена гарантирует, что новорожденный не передаст заболевание по наследству своим потомкам.
«Технологии переноса генов и метод CRISPR предоставляют нам широчайшие возможности, о которых раньше никто не мог и мечтать, — подытоживает Хэнк Грили, директор Центра права и биологических наук при Стэнфордской медицинской школе. — С их помощью мы способны сделать много хорошего. Но важно осознавать: мы обрели власть совершенно иного порядка, и необходимо убедиться, что мы распорядимся ею разумно. Пока мы не готовы взять на себя такую ответственность, но нельзя терять ни дня — предстоит очень много сделать, чтобы гарантировать себе спокойную жизнь в будущем».
www.nat-geo.ru
Первая в мире операция по пересадке генома позволила превратить один вид бактерий в другой
Американские ученые провели первую в мире успешную операцию по пересадке целого генома от одного вида бактерий к другому. В результате микробы приобрели все свойства того вида, чей геном был им пересажен. Успех этого эксперимента — важный шаг на пути к созданию искусственных живых организмов.
Ученые из Института Крейга Вентера (J. Craig Venter Institute) в течение последних 10 лет уверенно идут к великой цели — созданию искусственных микроорганизмов с заданными свойствами. Практическое значение этих работ может оказаться огромным. Например, планируется создание микробов, которые будут в больших количествах производить дешевое топливо. Генеральная идея состоит в том, чтобы установить минимальный набор генов, необходимый для жизнеобеспечения бактерии, добавить туда гены, кодирующие полезные функции (например, синтез водорода), искусственно синтезировать спроектированный геном и внедрить его в живую бактерию, собственный геном которой должен быть каким-то образом удален.
Работы ведутся в основном с бактериями рода Mycoplasma. Это довольно обширная (около 180 видов) группа паразитических бактерий, вызывающих всевозможные болезни у растений, животных и человека. Микоплазмы обладают рядом уникальных свойств, которые делают их весьма удобным объектом для подобных исследований. Геномы микоплазм очень малы (от 600 до 1400 тыс. пар оснований) и хорошо изучены — на сегодняшний день полностью прочтены геномы 14 видов. В отличие от подавляющего большинства других бактерий с маленькими геномами, микоплазмы не являются облигатными внутриклеточными паразитами — они могут жить вне хозяйских клеток, поэтому их можно выращивать обычным образом на питательной среде. Правда, среда должна быть весьма богатой — микоплазмы очень требовательны в этом отношении, поскольку у них отсутствуют гены, необходимые для синтеза многих жизненно важных веществ. Наконец, у микоплазм нет жесткой клеточной стенки, характерной для подавляющего большинства бактерий. Клетки микоплазм окружены лишь тонкой и эластичной плазматической мембраной. Это сильно облегчает обмен наследственным материалом между клетками.

Изучая геномы микоплазм, Крейг Вентер и его коллеги уже очень близко подошли к пониманию того, что должен представлять собой «минимальный геном» будущих искусственных микробов. Синтез искусственных фрагментов генома уже налажен, синтез целого бактериального генома — дело недалекого будущего. Однако до сих пор никому не удавалось пересадить целый геном в живую бактериальную клетку. Отдельные фрагменты геномов пересаживают давно, и в этом ученым большую помощь оказывают имеющиеся у бактерий естественные механизмы для обмена генетическим материалом. Такой обмен в мире бактерий осуществляется тремя основными путями:
- конъюгация: две бактерии соединяются при помощи специальных белковых трубочек — пилей, и бактерия-донор передает бактерии-реципиенту часть своего генома;
- вирусная трансдукция: вирусы, переходя из одной клетки в другую, могут прихватывать с собой куски бактериального генома;
- естественная трансформация: иногда бактерия просто «всасывает» фрагменты ДНК из окружающей среды и, при определенных условиях, встраивает их в свой геном.
Однако во всех этих случаях речь идет о передаче лишь сравнительно небольших кусочков генома.
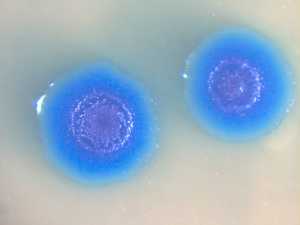
В статье, опубликованной 28 июня на сайте журнала Science, Крейг Вентер (Craig Venter) и его сотрудники сообщили о первой успешной трансплантации целого генома от одного вида бактерий другому. Правда, ученые пока сами не до конца понимают, как им это удалось, и пройдет ли этот номер с другими видами бактерий. Сделано было следующее. Ученые выделили геном из бактерии Mycoplasma mycoides, которая вызывает тяжелую пневмонию у коров и может заражать других парнокопытных. Геном этого микроба, как и у большинства бактерий, представляет собой одну кольцевую молекулу ДНК. Геном был тщательно очищен от посторонних примесей, в том числе от белков, и добавлен в культуру бактерий Mycoplasma capricolum, возбудителей козьего полиартрита, которые поражают также коров и овец. Предварительно в геном M. mycoides были внесены особые метки — в том числе гены устойчивости к антибиотикам — чтобы легче было потом определить, успешно ли прошла трансплантация.
Спустя недолгое время среди клеток Mycoplasma capricolum появились бактерии с признаками Mycoplasma mycoides. Обработав культуру бактерий антибиотиком, ученые уничтожили тех микробов, которые не вобрали в себя чужую ДНК, а оставшихся подвергли тщательному изучению. По всем признакам это были самые настоящие M. mycoides. Ни генов, ни белков, характерных для исходного вида Mycoplasma capricolum, у них обнаружить не удалось. Антитела, избирательно реагирующие на поверхностные белки Mycoplasma capricolum, не прикреплялись к этим микробам, в отличие от антител, распознающих поверхностные белки Mycoplasma mycoides (синяя окраска колоний на снимке сигнализирует об успехе одного из таких иммунологических тестов).
Всё это свидетельствует о том, что пересадка генома полностью удалась. Авторы не знают точно, как это произошло, но предполагают, что бактерии «проглатывали» чужую молекулу ДНК, и в первый момент в них, вероятно, содержались оба генома вместе. Когда такая клетка делилась, одна из дочерних клеток получала геном Mycoplasma capricolum, а другая — геном Mycoplasma mycoides. Последующая обработка антибиотиком уничтожила клетки первого типа.
Дальнейшие исследования покажут, можно ли проделывать подобную манипуляцию с другими бактериями-реципиентами и другими геномами. Не исключено, что вобрать в себя целый чужой геном способны только микробы, не имеющие клеточной стенки — в этом случае микоплазмы, скорее всего, и впредь останутся единственными объектами для таких экспериментов. Так или иначе, проделанная работа сильно приблизила Крейга Вентера к его заветной цели — созданию искусственного микроба. По-видимому, эта цель может быть достигнута уже через несколько лет. Кстати сказать, в США сейчас активно дискутируются этические и юридические проблемы, связанные с близящимся созданием искусственных организмов. Самые горячие споры идут по вопросу о том, можно ли будет эти организмы патентовать.
Источник: Carole Lartigue, John I. Glass, Nina Alperovich, Rembert Pieper, Prashanth P. Parmar, Clyde A. Hutchison, Hamilton O. Smith, J. Craig Venter. Genome Transplantation in Bacteria: Changing One Species to Another // Science. Published Online June 28, 2007.
Александр Марков
elementy.ru
Человек произошел от свиньи или всё-таки от обезьяны?
...неуклонно растущая потребность в органах и тканях для трансплантации породила глобальную проблему. Одним из перспективных путей ее решения сегодня считают использование для пересадки человеку органов и тканей животных – ксенотрансплантацию. Но до последнего времени она рассматривалась только теоретически – казалось невозможным предотвратить отторжение таких органов.
Трансгенные поросята, светящиеся зеленоватым светом в темноте. В ДНК поросят был введен позаимствованный у медузы ген, синтезирующий флуоресцентный белок.Источник: http://news.bbc.co.uk/2/hi/asia-pacific/4605202.stm
Действительно, если даже у хорошо подобранной человеческой пары донор–больной существует реальная угроза отторжения (кроме близнецов) пересаженного органа, и пациенту приходится всю оставшуюся жизнь принимать подавляющие иммунитет иммуносупрессивные препараты, то в случае животного и человека несовместимость много больше. В сущности, пока еще никто не знает, как в течение длительного времени будет функционировать в организме человека пересаженный чужеродный орган животного, даже если он приживется.
Правда, единичные относительно успешные попытки пересадки органов животных предпринимались. Так, в 1963 году К.Римстма пересадил человеку почку шимпанзе, которая функционировала в течение девяти месяцев. Позднее пробовали пересадить человеку сердце и печень приматов. Но результаты таких экспериментов не слишком обнадеживали. Дело в том, что при пересадке органа животного иммунологический конфликт начинается немедленно после операции и протекает от несколько минут до нескольких часов. В пересаженном органе происходят сложные морфо-физиологические изменения, в результате которых развивается отек, кровоизлияния, закупорка мелких сосудов и орган очень быстро погибает. [...]
Чем эволюционно ближе животное-донор к человеку, тем вероятнее успешная пересадка органа. Однако множество причин сдерживает использование человекообразных обезьян для целей трансплантации. Это и ограниченное количество животных этого вида, и трудности выведения их в неволе в больших количествах, и невозможность обезопасить больного от инфекционных заболеваний донора, не говоря уже об этических проблемах, связанных с убийством обезьян.
Как ни удивительно, но нашлось животное, обладающее существенными преимуществами по сравнению с приматами. Свиньи широко распространены, их легко выращивать и содержать, их органы сходны с человеческими по размерам и физиологии, многие люди принимают факт изъятия свиных донорских органов, поскольку свиней выращивают как источник пищи для человека. По статистическим данным, в мире около 700 млн. домашних свиней, большая часть которых ежегодно перерабатывается в пищу и обновляется за счет высокой продуктивности свиноматок.
Открывшаяся возможность использовать свиней в качестве доноров органов для человека активизировала иммунологические, вирусологические, молекулярно-биологические, в том числе и генно-инженерные, исследования этих животных. Был выявлен механизм отторжения пересаженного органа свиньи, намечены пути его преодоления. Следующим этапом стало создание особых – трансгенных животных, клетки которых содержат, кроме собственных, еще и не свойственные данному виду гены. В организме таких животных вырабатываются белки, предотвращающие поражение пересаженного органа иммунной системой человека. Как это осуществляется на деле? Генно-инженерным (трансгенным) способом вызывают изменения в генетическом аппарате зародыша свиньи. Затем эмбрион внедряют в матку суррогатной матери, где и протекает беременность. У родившегося поросенка ткани по многим параметрам оказываются совместимыми с человеческими и не подвергаются острому отторжению.
Судя по всему, трансгенным технологиям в ксенотрансплантации обеспечено большое будущее. Становится возможным приживление и сохранение ксенотранстплантата без постоянного лечения в течение всей последующей жизни. Таким образом, благодаря раскрытию механизмов тканевой несовместимости и достижениям генной инженерии появилась реальная перспектива осуществления ксенотрансплантации. Возможно, генно-инженерная свинья и есть путь к окончательному решению проблемы. Британские эксперты предсказывают, что в ближайшие годы в мире будет более 300 свиноферм, работающих по программе пересадки органа.
Хотя главные трудности еще впереди, есть все основания утверждать, что проблема сверхострого отторжения ксенооргана может быть решена достаточно скоро и что мы сможем использовать свинью или другое млекопитающее в качестве неограниченного источника органов для человека.
В. Шумаков, А. Тоневицкий. Ксенотрансплантация: научные и этические проблемы. Журнал «Человек», 1999 г., №6.
antropogenez.ru
учёные впервые отредактировали геном в теле человека — РТ на русском
Учёные калифорнийской детской больницы впервые отредактировали геном в теле человека. Операция была сделана 44-летнему Брайану Мэддоксу, страдающему неизлечимым генетическим заболеванием — синдромом Хантера. Сейчас пациент ожидает результатов эксперимента. По мнению экспертов, в случае успеха применённого метода генную терапию ждёт настоящий прорыв — врачи смогут лечить многие тяжелейшие заболевания. RT разбирался в технологии и перспективах редактирования генома в организме человека.
«Я ждал этого 15 лет»
44-летний Брайан Мэддокс перенёс первую в мире операцию по редактированию генома непосредственно в организме. Этот эксперимент провела исследовательская группа калифорнийской детской больницы UCSF Benioff Children’s Hospital Oakland, уже несколько лет изучающая возможности технологии генного редактирования. Наблюдавшийся у них пациент страдал от редкого генетического заболевания, связанного с X-хромосомой.
Также по теме
 Полтора часа жизни: как начиналось создание искусственного сердца
Полтора часа жизни: как начиналось создание искусственного сердца В марте 1952 года врачам одной из американских клиник удалось поддерживать жизнь пациента при помощи искусственного сердца в течение...
Болезнь наследуется рецессивно, то есть дефектный ген был у обоих родителей Мэддокса. В клетках печени пациента не синтезировался один из ферментов (идуронат-2-сульфатаза), из-за чего нарушилось расщепление гликозаминогликанов — веществ, связывающих клетки в тканях. В результате эти вещества накапливались в организме в большом количестве, и от этого страдали различные органы и ткани.
Признаки болезни проявились у Мэддокса уже на втором году жизни: искажённые черты лица, укрупнённая голова. Болезнь поразила нервную систему и дыхательные пути. Синдром Хантера считается неизлечимой болезнью. Медики борются с симптомами, облегчают страдания пациентов при помощи регулярного вливания искусственного аналога необходимого фермента или трансплантации костного мозга. Лечение с помощью искусственного фермента облегчает далеко не все симптомы и к тому же обходится довольно дорого (около $100 тыс. в год).
Мэддоксу пришлось перенести 26 операций по удалению грыж, прорастаний кости в спинной мозг, а также хирургических вмешательств на глазах, ушах и желчном пузыре.
Генная терапия стала для Мэддокса единственной возможностью вернуться к нормальной жизни.
Брайан согласился стать первым пациентом в мире, редактирование генов которого проводили непосредственно в теле, а не в клетках, выращенных отдельно или просто предварительно извлечённых из организма.
«Я ждал появления возможности редактирования генома последние 15 лет, и теперь мне выпала большая честь — поучаствовать в подобном беспрецедентном эксперименте. Меня несколько смутило, что я стал первым пациентом, на котором провели такую операцию. Но я решил, что готов пойти на риск, чтобы помочь людям справиться с болезнями, которые всегда считались неизлечимыми», — заявил Брайан Мэддокс.
Технология процесса
«Мы разрезали его ДНК, вставили туда ген и сшили обратно. Теперь этот ген стал частью ДНК на всю оставшуюся жизнь», — в двух словах пояснил суть операции доктор Сэнди Макрай.
С помощью специальных вирусов учёные доставили в организм больного миллиарды «правильных» копий гена. Эта технология редактирования отличается большой точностью. В основе метода лежат белки нуклеазы (то есть режущие ДНК) с «цинковыми пальцами». Участок, называемый «цинковым пальцем», может быть спроектирован так, чтобы узнавать определённую последовательность в ДНК, а нуклеаза, как ножницы, аккуратно делает разрез в нужном месте.

Учёные и раньше обращались к этому методу. Так, несколько лет назад медики использовали «цинковые пальцы», чтоб вылечить людей, страдающих ВИЧ. Исследователи собрали клетки крови у двенадцати ВИЧ-инфицированных пациентов. Затем использовали «цинковые пальцы», чтобы редактировать мутированный ген в этих клетках. В процессе терапии специалисты разрушили ген в 25% культивированных клеток каждого участника. Затем вернули культивированные клетки крови в организм пациентов. После такой «трансплантации» у всех пациентов повысились в крови уровни Т-клеток, играющих важную роль в иммунном ответе. ВИЧ-клетки стали расти гораздо медленнее, чем раньше.
Также по теме
 «Сухая кровь»: революционное открытие российских учёных
«Сухая кровь»: революционное открытие российских учёных Учёные из Обнинска разработали препарат ПАМ-3 — сухой кровезаменитель. Он может применяться при большой кровопотере. ПАМ-3 заменяет...
В новом исследовании учёные впервые обратились к «цинковым пальцам», чтобы отредактировать геном непосредственно в организме человека. Учёные вставили правильную копию гена и два «цинковых пальца» в безобидный вирус, у которого предварительно вырезали его опасную для организма часть. Миллиарды таких копий ввели в вену пациента, чтобы они достигли печени. Чтобы вылечить больного, достаточно исправить геном хотя бы 1% клеток печени.
Технология, которую использовали авторы исследования, отличается от ставшего популярным в последнее время метода редактирования генома с помощью системы CRISPR/Cas9 — комплекса из белков и РНК. В основе CRISPR/Cas9 — система иммунитета бактерий, которую те используют для борьбы с вирусами. Так, в августе 2017 года с помощью CRISPR американские учёные впервые редактировали геном человеческого эмбриона. По заявлению медиков, им удалось исправить мутацию в геноме плода. Однако родится ли ребёнок здоровым, пока неизвестно.
В ожидании прорыва
Эксперты отмечают, что проведение генной терапии может быть небезопасно. Один из первых пациентов «генных инженеров», 18-летний Джесси Джелсинджер, умер в 1999 году через четыре дня с начала клинического испытания из-за масштабного иммунного ответа на вирусы, которые доставляли гены в его клетки.

- Результаты анализа ДНК
- globallookpress.com
- © David Oxberry/moodboard
«Конечно, с тех пор медицина сильно шагнула вперед, — отметила в беседе с RT кандидат медицинских наук, врач-генетик Наталья Ветрова. — Учёные используют другие вирусы, доказавшие в ходе испытаний на животных свою безопасность».
Однако, по словам эксперта, проблема внесения в ДНК поправок остаётся актуальной до сих пор. Дело в том, что, встроившись в неправильное место, даже «правильный» ген может навредить.
«У пациентов, перенёсших генную терапию, уже известно несколько случаев лейкемии, — подчеркнула Ветрова. — К сожалению, исправлять подобные ошибки учёные пока не умеют. Но в новой операции исследователи смогли довольно точно задать место редактирования. Думаю, в случае успеха этого метода генную терапию ждёт прорыв, и, вероятно, белки с «цинковыми пальцами» в перспективе помогут вылечить и другие тяжёлые заболевания. Например, исправить дефективные клетки больного раком, избавив их от мутации».
Несчастье помогло
Прижился ли новый ген у Мэддокса, можно будет сказать не раньше, чем через месяц. Сам пациент понимает, что терапия может не сработать. Более того, в его возрасте многие произошедшие в организме изменения уже необратимы. Однако и он, и лечащие его врачи надеются, что такой опыт будет полезен другим больным. При положительных результатах операции Мэддоксу не нужно будет каждую неделю получать инъекции дорогостоящего искусственного фермента и опасаться за свою жизнь в случае обычной простуды. Кроме того, вероятно, одно из главных событий в жизни Мэддокса уже произошло: во время терапии он познакомился с медсестрой, которая стала его невестой.
В случае успеха операции учёные планируют испытать метод ещё на 30 взрослых пациентах и перейти к редактированию геномов детей, чтобы успеть помочь им до того, как болезнь навредит организму.
russian.rt.com
















