Содержание
Строение атома кратко и понятно (химия, 8 класс), электронно-графическая формула
4.4
Средняя оценка: 4.4
Всего получено оценок: 3716.
4.4
Средняя оценка: 4.4
Всего получено оценок: 3716.
Атом – наименьшая частица вещества. Его изучение началось еще в Древней Греции, когда к строению атома было приковано внимание не только ученых, но и философов. Каково же электронное строение атома, и какие основные сведения известны об этой частице?
Строение атома
Уже древнегреческие ученые догадывались о существовании мельчайших химически частиц, из которых состоит любой предмет и организм. И если в XVII-XVIII вв. химики были уверены, что атом неделимая элементарная частица, то на рубеже XIX-XX вв., опытным путем удалось доказать, что атом не является неделимым.
Атом, будучи микроскопической частицей вещества, состоит из ядра и электронов. Ядро в 10000 раз меньше атома, однако практически вся его масса сосредоточена именно в ядре. Главной характеристикой атомного ядра, является то, что он имеет положительный заряд и состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны не имеют заряда (они нейтральны).
Главной характеристикой атомного ядра, является то, что он имеет положительный заряд и состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны не имеют заряда (они нейтральны).
Связаны они друг с другом с помощью сильного ядерного взаимодействия. Масса протона примерно равна массе нейтрона, но при этом в 1840 раз больше массы электрона. Протоны и нейтроны имеют в химии общее название – нуклоны. Сам атом является электронейтральным.
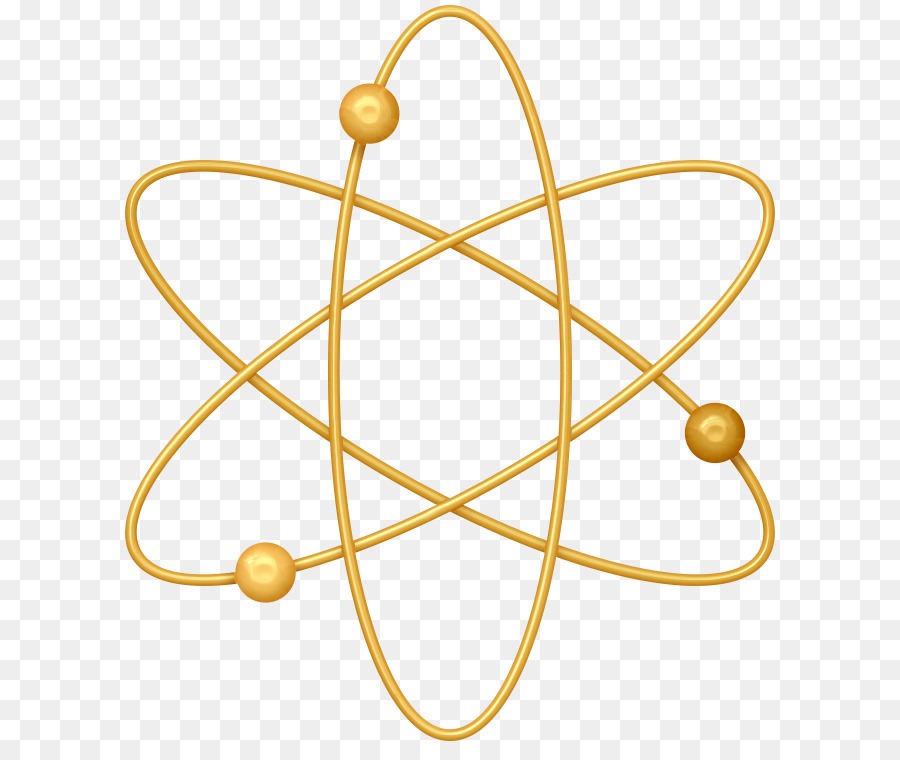
Атом любого элемента можно обозначить электронной формулой и электронно графической формулой:
Рис. 1. Электронно-графическая формула атома.
Единственным химическим элементом из периодической системы, в ядре которого не содержатся нейтроны, является легкий водород (протий).
Электрон является отрицательно заряженной частицей. Электронная оболочка состоит из движущихся вокруг ядра электронов. Электроны имеют свойства притягиваться к ядру, а между друг друг на них оказывает влияние кулоновское взаимодействие. Чтобы преодолеть притяжения ядра, электроны должны получать энергию от внешнего источника. Чем дальше электрон находится от ядра, тем меньше энергии для этого необходимо.
Чем дальше электрон находится от ядра, тем меньше энергии для этого необходимо.
Модели атомов
На протяжении долго времени ученые стремились познать природу атома. На раннем этапе большой вклад внес древнегреческий философ Демокрит. Хотя сейчас его теория и кажется нам банальной и слишком простой, в тот период, когда представления об элементарных частицах только начинало зарождаться, его теория о кусочках материи воспринималась совершенно серьезно. Демокрит считал, что свойства любого вещества зависят от формы, массы и других характеристик атомов. Так, например, у огня, полагал он, острые атомы – поэтому огонь обжигает; у воды атомы гладкие, поэтому она способна течь; у твердых предметов, по его представлению, атомы были шереховатые.
Демокрит считал, что из атомов состоит абсолютно все, даже душа человека.
В 1904 году Дж. Дж. Томсон предложил свою модель атома. Основные положения теории сводились к тому, что атом представлялся положительно заряженным телом, внутри которого находились электроны с отрицательным зарядом. Позже эта теория была опровергнута Э. Резерфордом.
Позже эта теория была опровергнута Э. Резерфордом.
Рис. 2. Модель атома Томсона.
Также в 1904 году японским физиком Х. Нагаока была предложена ранняя планетарная модель атома по аналогии с планетой Сатурн. Электроны по этой теории объединены в кольца и вращаются вокруг положительно заряженного ядра. Эта теория оказалась ошибочной.
В 1911 году Э. Резерфорд, проделав ряд опытов, сделал выводы, что атом по своему строению похож на планетную систему. Ведь электроны, словно планеты, движутся по орбитам вокруг тяжелого положительно заряженного ядра. Однако это описание противоречило классической электродинамике. Тогда датский физик Нильс Бор в 1913 году ввел постулаты, суть которых заключалась в том, что электрон, находясь в некоторых специальных состояниях, не излучает энергию. Таким образом, постулаты бора показали, что для атомов классическая механика неприменима. Планетарная модель, описанная Резерфордом и дополненная Бором, получила название – планетарная модель Бора-Резерфорда.
Рис. 3. Планетарная модель Бора-Резерфорда.
Дальнейшее изучение атома привело к созданию такого раздела, как квантовая механика, с помощью которого объяснялись многие научные факты. Современные представления об атоме развились из планетарной модели Бора-Резерфорда.
Что мы узнали?
В данной статье по химии (8 класс) рассказывается кратко и понятно о строении атома. На протяжении многих веков ученые разных стран изучали мельчайшие частицы вещества. Появлялись разные теории, модели и разные формулы строения атома. Современные представления об атоме основываются на модели Бора-Резерфорда, по которой атом состоит из ядра и электронного облака, в котором электроны движутся вокруг ядра.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Саша Николаев
10/10
Александр Котков
10/10
Павел Сафаров
6/10
Мир Грин
10/10
Юрий Филиппов
7/10
Александр Котков
10/10
Даниил Суханкин
10/10
Виктория Гудимова
10/10
Виктор Миронов
9/10
Сергей Ефремов
9/10
Оценка доклада
4. 4
4
Средняя оценка: 4.4
Всего получено оценок: 3716.
А какая ваша оценка?
Строение атома. Модель томпсона. Опыты Резерфорда. Планетарная модель
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: планетарная модель атома.
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Модель Томсона
Первую модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный Нобелевской премии за открытие электрона). В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. Физики называли модель Томсона «пудинг с изюмом».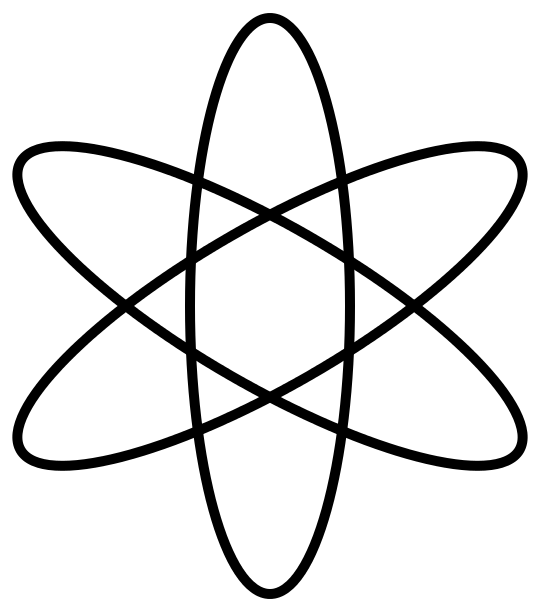
Согласно Томсону атом представляет собой шар размером порядка см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1).
Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Опыты Резерфорда
Верна ли модель Томсона? Как в действительности распределены положительные и отрицательные заряды внутри атома? Чтобы ответить на эти вопросы, нужен был эксперимент, позволяющий проникнуть внутрь атома. Ученик Томсона, знаменитый английский физик Эрнест Резерфорд предложил с этой целью бомбардировать атом высокоэнергетичными ?-частицами и смотреть, как они будут отклоняться положительным зарядом атома.
Ученик Томсона, знаменитый английский физик Эрнест Резерфорд предложил с этой целью бомбардировать атом высокоэнергетичными ?-частицами и смотреть, как они будут отклоняться положительным зарядом атома.
Что такое -частицы? Потоки этих частиц — так называемые «альфа-лучи» — были обнаружены при радиоактивном распаде некоторых элементов (например, радия). В результате тщательных исследований, проведённых опять-таки Резерфордом, было установлено, что каждая -частица имеет положительный заряд, равный по модулю удвоенному заряду электрона, и массу, превышающую массу электрона примерно в раз. То есть, -частица оказалась полностью ионизованным (лишённым электронов) атомом гелия.
Резерфорд говорил об -частицах как об ионах гелия; сейчас мы знаем, что это ядра гелия.
Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов!
Энергия -частиц очень велика — достаточно сказать, что скорость их вылета из радиоактивного образца составляет примерно скорости света.![]() Поэтому интересно было выяснить, на какие углы будут отклоняться столь мощные «снаряды» при рассеянии на отдельных атомах, а точнее — на их положительных зарядах.
Поэтому интересно было выяснить, на какие углы будут отклоняться столь мощные «снаряды» при рассеянии на отдельных атомах, а точнее — на их положительных зарядах.
Пучок -частиц направлялся на тончайшую золотую фольгу. Как гласит история, Резерфорд не сомневался в том, что углы отклонения должны быть весьма малы: имея столь огромную энергию, -частицы должны проходить сквозь фольгу как нож сквозь масло. Только «для очистки совести», на всякий случай, он попросил учеников посмотреть, не возникает ли рассеяния -частиц на большие углы.
Каково же было всеобщее удивление, когда такие частицы обнаружились! Да, как и следовало ожидать, подавляющая доля -частиц отклонялась несущественно. Но совсем небольшая их часть (примерно одна частица из нескольких тысяч) отклонялась на угол, больший (рис. 2).
Рис. 2. Рассеяние -частиц на атомах
Эти отклонения казались совершенно невероятными. По словам Резерфорда, дело выглядело так, словно артиллерийский снаряд налетел на кусок бумаги и от удара повернул назад.
А «бумагой» в образном сравнении Резерфорда служил атом, устроенный согласно модели Томсона. Действительно, допустим, что положительный заряд атома «размазан» по всему атому, то есть шару радиусом см. Этот положительный заряд создаёт электрическое поле, тормозящее и отклоняющее -частицы. Вблизи атома потенциал данного поля:
Расчёты, однако, показывают, что такое поле оказывается слишком слабым — его тормозящего действия никак не хватит для того, чтобы остановить -частицу и отбросить её назад!
Таким образом, наличие -частиц, отброшенных фольгой, опровергло модель Томсона. Что же было предложено взамен?
Планетарная модель атома
Чтобы отбросить -частицу, положительный заряд атома должен создавать куда более сильное электрическое поле, чем то, которое получается в модели Томсона. А чтобы создать такое поле, положительный заряд должен быть сосредоточен в области, гораздо меньшей размера атома.
Размер этой области можно вычислить. Если положительный заряд занимает область размером , то вблизи заряда создаётся электрическое поле с потенциалом
Если положительный заряд занимает область размером , то вблизи заряда создаётся электрическое поле с потенциалом
Зная кинетическую энергию -частицы, можно найти величину тормозящего потенциала , а затем и размер положительно заряженной области. Вычисления, проведённые Резерфордом, дали следующий результат:
см.
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 3).
Рис. 3. Планетарная модель атома
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню ( м). Тогда ядро окажется горошиной размером мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!
Вот таким удивительным объектом оказался атом. Однако планетарная модель атома, объяснив результаты опытов Резерфорда по рассеянию -частиц, оказалась лишь первым шагом на пути к пониманию внутриатомных процессов. А именно, планетарная модель приводила к одному серьёзному противоречию, и преодоление этого противоречия Нильсом Бором положило начало физике атома. Читаем следующий листок!
Читаем следующий листок!
Урок 1. Схема строения атомов – HIMI4KA
Архив уроков › Основные законы химии
В уроке 1 «Схема строения атомов» из курса «Химия для чайников» рассмотрим основы строение атома и состав атомного ядра; выясним, что такое атомная единица массы, порядковый номер атома и атомная масса элемента. Обязательно просмотрите основные понятия и определения к разделу «Атомы, молекулы и ионы», чтобы лучше воспринимать суть изложенного материала в данной главе.
Содержание
- Основы строения атома
- Состав ядра атома
- Атомная единица массы
- Порядковый номер атома и атомная масса элемента
Основы строения атома
Пока не будем говорить, кто и когда узнал о существовании атома, а сразу перейдем к основам его строения: Атом — это мельчайшая частица вещества, которая состоит из ядра (заряд «+»), окруженного электронами (заряд «–»).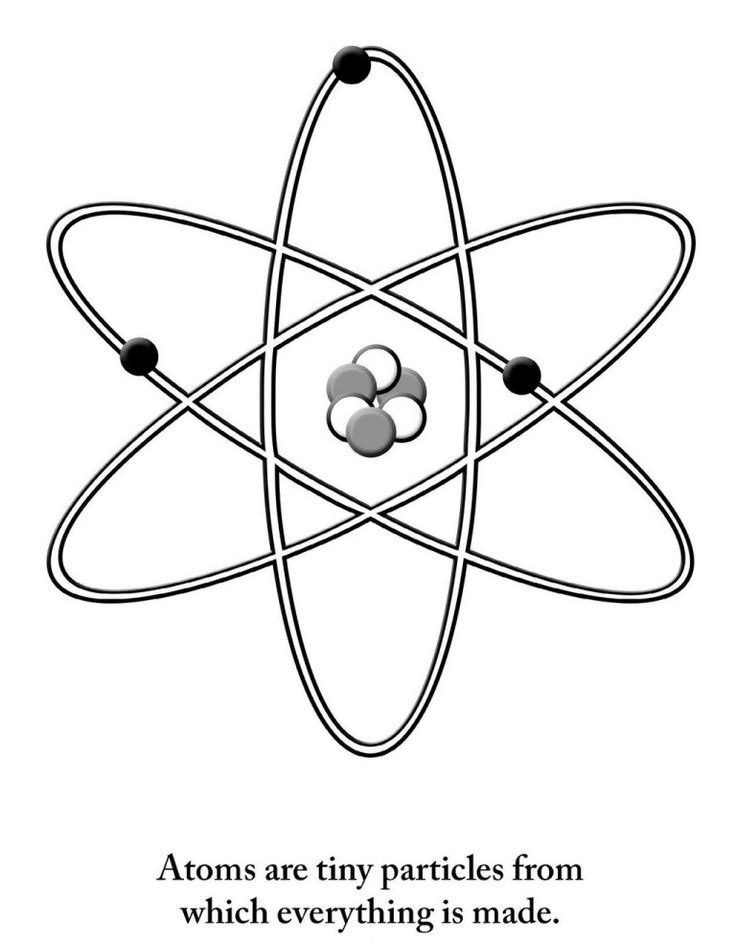
Электроны расположены на электронных оболочках атома: чем больше заряд ядра, тем больше электронов и электронных оболочек. Сам атом заряда не имеет, так как он является электрически нейтральным: заряд ядра (+) равен сумме зарядов электронов (-), вращающихся вокруг ядра.
Состав ядра атома
Ядро атома состоит из нуклонов. Нуклоны в ядре — это протоны и нейтроны. Массы протона и нейтрона почти одинаковые. Заряд ядра атома обозначается знаком «+» и зависит исключительно от количества протонов, ведь протоны — это носители положительного заряда, а нейтроны заряда не имеют никогда. Почти вся масса атома сконцентрирована в ядре, поэтому оно супер-тяжелое по отношению к остальному содержимому атома, однако, очень маленькое по сравнению с общим размером атома.
Чтобы вы понимали насколько оно мало, приведу пример: если атом увеличить до размеров Земли, то ядро атома будет в диаметре всего 60 метров. Надеюсь, что теперь у вас возникло некоторое представление об основах строения атома и составе атомного ядра.
Надеюсь, что теперь у вас возникло некоторое представление об основах строения атома и составе атомного ядра.
Атомная единица массы
Весы, которые могли бы взвесить атом, электрон или нуклон, пока еще не изобрели. Поэтому химики выражают массу частиц не в граммах, а в атомных единицах массы (а.е.м.). 1 атомная единица массы равна 1/12 массы атома углерода, ядро которого состоит из 6 протонов и 6 нейтронов. Получается, что масса 1 протона ~ 1 нейтрона ~ 1 а.е.м. Возникает вопрос, почему мы не считали 6 электронов, однако ответ будет простым: масса электрона ничтожно мала, поэтому в данном случае с ней даже не считаются.
Перевод граммов в атомные единицы массы выглядит так: 1 гр = 6,022×1023 а.е.м и наоборот 1 а.е.м. = 1,66×10-24 г. Число 6,022×1023 носит название — число Авогадро N (позже мы рассмотрим способ ее вычисления). Ниже изображена сравнительная таблица зарядов и масс элементарных частиц:
| Название | Заряд, Кл | Масса, гр | Масса, а. е.м. е.м. |
| Протон | +1,6·10-19 | 1,67·10-24 | 1,00728 |
| Нейтрон | 0 | 1,67·10-24 | 1,00866 |
| Электрон | -1,6·10-19 | 9,10·10-28 | 0,00055 |
Порядковый номер атома и атомная масса элемента
Переходим к двум фундаментальным понятиям. Порядковый (атомный) номер Z — это число протонов в ядре и оно же обозначает число электронов, потому как атом должен быть электрически нейтральным. Атомная масса элемента (относительная атомная масса, атомный вес) — это масса всех субатомных частиц (протонов, нейтронов, электронов) в атоме, выражается в а.е.м. Относительная атомная масса элемента один в один то же самое, что и атомная, но является безразмерной величиной и показывает, во сколько раз масса рассматриваемого атома превышает массу 1/12 части атома углерода. Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.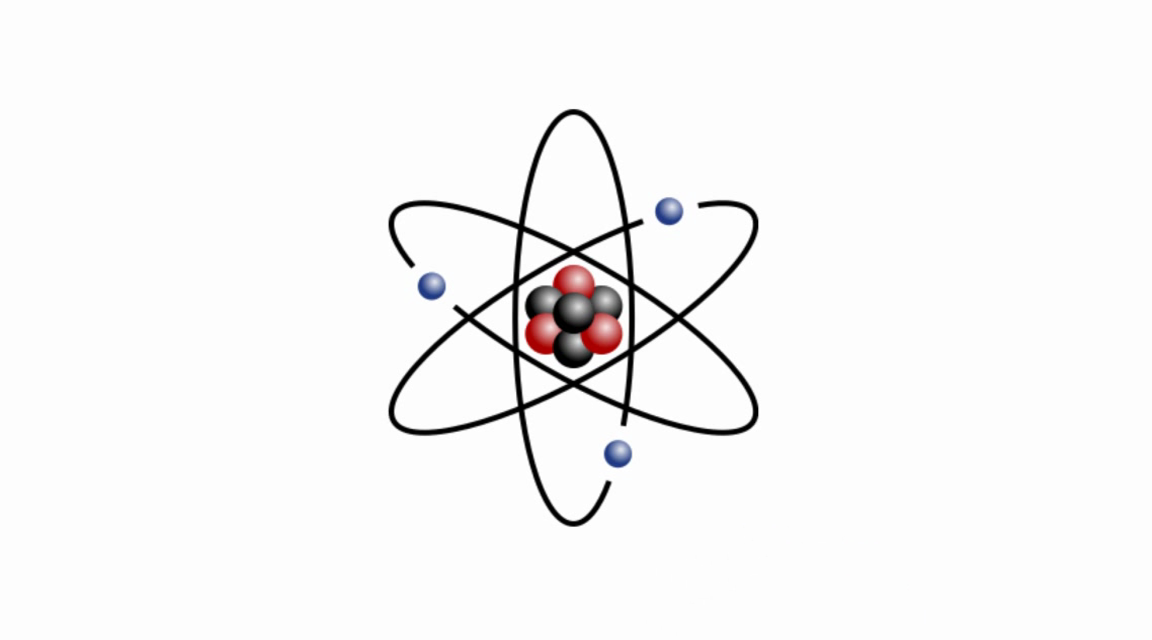
Все атомы в природе с одинаковым порядковым номером в химическом отношении ведут себя практически одинаково и, поэтому их можно считать как атом одного и того же химического элемента. Каждый элемент обозначается одно- или двухбуквенным символом, заимствованный в большинстве случаев из греческого или латинского названия. Например, символ углерода — C, натрия — Na, азота — N и т.д. В качестве символа натрия Na, взяты две первые буквы его латинского названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице Менделеева приведен алфавитный перечень элементов и их символов, их порядковый номер и атомные массы.
Надеюсь урок 1 «Схема строения атомов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 2. Изотопы элементов →
← Глоссарий к главе «Атомы, молекулы и ионы»
Рисунок атома — Как нарисовать атом шаг за шагом
Возможно, мы не сможем увидеть атомы невооруженным глазом, но технически вы видите их везде, куда бы вы ни посмотрели!
Атомы составляют всю окружающую нас материю, и удивительно думать, что на микроскопическом уровне эти крошечные клетки составляют все, что мы видим и с чем взаимодействуем. Атомы очень важны, но также может быть интересно научиться рисовать атом!
Атомы очень важны, но также может быть интересно научиться рисовать атом!
С помощью этого руководства вы будете точно знать, как это сделать.
Мы надеемся, что вам понравится это пошаговое руководство о том, как нарисовать атом за 6 шагов!
О чем эта запись в блоге
- Как нарисовать атом — приступим!
- Шаг 1
- Шаг 2 – Нарисуйте следующий овал для вашего атома
- Шаг 3 – Затем нарисуйте еще один овал для вашего атома
- Шаг 4 – Теперь начните рисовать некоторые детали вашего атома Добавьте ядро атома
- Шаг 6. Завершите рисунок атома цветом
- 3 Еще несколько советов, которые облегчат рисование атомов!
- Ваш атомный рисунок готов!
Шаг 1
В этом первом шаге нашего руководства по рисованию атома мы начнем с очень простой формы. На самом деле мы будем строить атом, используя несколько экземпляров одной и той же формы.
Эта форма будет длинным овалом, а первая будет вертикальной. В идеале вы хотели бы, чтобы все последующие овалы, которые вы будете рисовать, были одного размера.
В идеале вы хотели бы, чтобы все последующие овалы, которые вы будете рисовать, были одного размера.
Вы можете убедиться в этом, используя трафарет или обведя что-то плоское и овальное.
В противном случае вы можете измерить длину и ширину этого овала и попытаться воспроизвести его в следующих шагах. Как только вы нарисуете этот овал, вы будете готовы к следующему шагу!
Шаг 2 – Нарисуйте следующий овал для вашего атома
Вы сделали первый овал вашего атома, и теперь вы можете добавить еще один на этом шаге. Как мы упоминали в предыдущем шаге, вы должны изо всех сил стараться, чтобы этот овал был идентичен по размеру и форме первому.
Вот почему использование чего-то вроде трафарета для обводки было бы идеальным для такого рода рисунков! Как бы вы ни нарисовали его, этот овал будет проходить по диагонали над другим овалом.
Шаг 3 – Затем нарисуйте еще один овал для вашего атома
Теперь вы действительно освоились! Прежде чем мы добавим некоторые детали частиц к атому, у нас есть еще один овал, который нужно добавить на этом этапе нашего руководства по рисованию атома.
Этот также будет проходить по диагонали над первым овалом, за исключением того, что этот будет идти в направлении, противоположном тому, что на предыдущем шаге.
Нарисовав все овалы, мы перейдем к окончательным деталям частиц в следующих нескольких шагах, так что давайте двигаться дальше!
Шаг 4 – Теперь начните рисовать некоторые детали вашего атома.
На этом этапе рисования мы добавим на атом несколько мелких деталей. Они будут маленькими и простыми, но с их помощью ваш атом будет выглядеть как настоящий!
Для этого просто нарисуйте несколько маленьких кругов на линиях атома, которые вы рисовали до сих пор.
Для этого руководства мы нарисовали три, но вы можете нарисовать больше или меньше, если хотите, а также изменить их положение на атоме.
Тогда нам нужно добавить еще один важный элемент, прежде чем вы начнете раскрашивать свой атомный рисунок!
Шаг 5 – Добавьте ядро атома
Центр атома называется ядром, и это самая важная часть атома! К счастью, хотя это может быть очень важно, на этом этапе нашего руководства по рисованию атома будет очень легко рисовать.
Все, что вам нужно сделать, это нарисовать круг в центре атома. Если вы хотите нарисовать идеальный круг для центра, вы можете использовать чертежный циркуль или обвести что-то круглое и плоское, чтобы сделать это.
Прежде чем двигаться дальше, вы также можете добавить некоторые детали и элементы самостоятельно! Мы упоминали о том, чтобы добавить больше частиц к атому или изменить их положение, но вы также можете придумать еще больше творческих идей.
Возможно, вы могли бы нарисовать еще несколько атомов, плавающих на заднем плане! Что вы можете придумать, чтобы закончить этот рисунок атома, прежде чем перейти к последнему шагу?
Шаг 6 – Завершите рисунок атома цветом
Это подводит вас к последнему этапу рисования атома, и это шаг, на котором вы получите массу удовольствия, добавляя цвет к своему рисунку!
Мы сделали его простым и чистым для нашего изображения, и мы использовали красный, синий и желтый цвета для различных частиц атома. Однако это всего лишь предложение, и у вас есть много вариантов того, как вы можете раскрасить это изображение!
Однако это всего лишь предложение, и у вас есть много вариантов того, как вы можете раскрасить это изображение!
Вам также не нужно ограничиваться раскрашиванием только частиц атома, вы также можете раскрасить промежутки между овалами, которые вы нарисовали.
У вас также есть безграничные варианты цветов, которые вы можете использовать, так что это прекрасная возможность использовать все ваши любимые цвета!
Вы можете весело провести время, выбирая цвета, но вы также можете отлично провести время, играя с вашими любимыми художественными средствами, чтобы воплотить их в жизнь.
Независимо от того, хотите ли вы сохранить цвета яркими и яркими или более холодными и приглушенными, мы знаем, что вы сделаете этот атомный рисунок еще лучше!
3 Еще несколько советов, которые облегчат рисование атомов!
Создайте этот рисунок, пока мы покажем вам, как сделать легко рисуемый атом еще проще!
Один из самых простых способов облегчить восприятие этого рисунка атома — нарисовать его как можно больше.
Структура атома может быть довольно сложной и запутанной, поэтому чем меньше вы сделаете ее, тем сложнее она будет.
Если вы сделаете его красивым и большим, вы также можете начать использовать инструменты для рисования, такие как циркуль, чтобы упростить рисование кругов.
Вы также можете использовать более толстые инструменты для рисования, такие как маркеры или ручки, чтобы сделать линии более гладкими.
Увеличение размера рисунка сделает его более впечатляющим!
Подготовка является ключом к облегчению любого рисунка, и это относится к этому рисунку атома. В предыдущем шаге мы упомянули, что может помочь рисование большого изображения, но вы также можете использовать карандаш для подготовки.
Работать карандашом очень удобно, так как вы можете стереть любые ошибки. Таким образом, вы можете сосредоточиться на самом рисунке, не отвлекаясь.
Затем, когда вы довольны тем, как выглядят линии карандаша, вы можете переключиться на более стойкие средства, чтобы тщательно пройтись по линиям. Как только вы стерли карандаш, никто никогда не узнает, что вы его использовали!
Как только вы стерли карандаш, никто никогда не узнает, что вы его использовали!
Иногда хороший способ преодолеть трудности в рисовании — отвлечь внимание от проблемных областей. Допустим, вы сделали одну часть своего наброска атома слишком длинной, и уже слишком поздно ее исправлять.
Как художник, легко зациклиться на такой ошибке, но большинство людей даже не заметят ее! Один из способов убедиться, что это так, — добавить несколько меток.
Вы можете сделать это, посмотрев на схему атома, чтобы увидеть, как называются различные части. Затем нарисуйте несколько линий, отходящих от вашего атома с этими метками.
Таким образом, люди будут обращать внимание на это, а не на мелкие ошибки!
Ваш атомный рисунок готов!
Это подводит вас к концу этого руководства как нарисовать атом . Мы надеемся, что это руководство показало вам, что рисование атома не обязательно должно быть сложной задачей!
Кроме того, мы надеемся, что это руководство показало вам, что рисование атома может быть увлекательным и увлекательным занятием.
Завершение этого руководства — лишь часть веселья! Вы также можете продолжить этот рисунок, добавляя свои собственные детали и элементы.
Мы упомянули несколько идей, таких как рисование большего количества атомов на заднем плане или изменение дизайна, но что еще вы можете придумать?
Если вы готовы к большему, на нашем сайте есть еще много замечательных руководств по рисованию. Они охватывают огромное разнообразие тем, так что каждый найдет что-то для себя! Обязательно заходите почаще, так как мы часто загружаем новые.
Как только ваш рисунок атома будет готов, мы надеемся, что вы поделитесь им, чтобы мы могли его увидеть на наших страницах в Facebook и Pinterest. Нам не терпится увидеть ваши работы!
Рисование атомов – путаница Монтессори
В этом году я основывал свое введение в основы химии для своих учеников средней школы на периодической таблице элементов. Однако первый шаг — научить их рисовать базовые модели атомов.
Я начал с того, что во время зимних каникул учащиеся запомнили первые 20 элементов (от H до Ca) в правильном порядке — по атомному номеру.
Схема атома кислорода.
Чтобы было немного контекста, я пробежался по основным частям атома (протоны, нейтроны и электроны) и дал понять, что название элемента определяется исключительно количеством протонов. Я даже попросил их нарисовать несколько атомов с протонами и нейтронами в центре и электронами в оболочках. Поскольку я вывалил на них все это за один урок, это, вероятно, было слишком, но, поскольку это было просто для того, чтобы дать им некоторый контекст, я не ожидал, что семиклассники, которые не видели этого раньше, запомнят. все это; для восьмиклассников это должен был быть просто обзор.
Большинство учащихся хорошо справились с запоминанием. Некоторые нашли в Интернете песни, которые помогли, а другие просто пробились. Две недели зимних каникул, чтобы поработать над этим, вероятно, тоже помогли.
Когда мы вернулись в школу, я первым делом дал им схему верхней части периодической таблицы и попросил заполнить ее названиями элементов.
Шаблон для первых 20 элементов таблицы Менделеева. (pdf)
(pdf)
После того, как они заполнили свой шаблон таблицы Менделеева, я более подробно изучил части атомов и попросил их попрактиковаться. Ключевые моменты, которые я хотел, чтобы они запомнили, были следующими:
- Атомный номер записывается в виде нижнего индекса слева от символа элемента.
Атомный номер — это число протонов. Поскольку они запомнили элементы по порядку, они должны быть в состоянии понять это самостоятельно, но они также могли бы быстро найти это в периодической таблице или посмотреть на символ элемента, где атомный номер иногда пишется в нижней части. оставил.
- Атомы имеют такое же количество электронов, как и протоны. Протоны заряжены положительно, а электроны отрицательно заряжены, поэтому атом должен иметь одинаковое количество и того, и другого, чтобы его заряд был сбалансирован. Мы не будем говорить об ионах, в которых больше или меньше электронов, пока позже.
- Атомная масса (4) записывается в виде надстрочного индекса слева от символа элемента.
 Атомная масса представляет собой сумму числа протонов (2) и числа нейтронов (2).
Атомная масса представляет собой сумму числа протонов (2) и числа нейтронов (2).Маленькие атомы, которые мы рассматриваем под номером , как правило, имеют в то же количество нейтронов, что и протоны, но это не обязательно так. Так как же узнать, сколько нейтронов? Вы должны спросить, или посмотреть на число атомной массы, которое обычно пишется слева вверху от атома. С атомная масса это сумма количества протонов и нейтронов, если вы знаете атомную массу и количество протонов, вы можете легко вычислить количество нейтронов. (Обратите внимание, что электроны не вносят вклад в массу атома, потому что их массы намного меньше, чем массы нейтронов и протонов.
- Этот атом кислорода имеет 8 электронов на двух оболочках.
Электронные оболочки : Электроны вращаются вокруг ядра в виде ряда оболочек. Каждая оболочка может содержать определенное максимальное количество электронов (2 для первой оболочки, 8 для второй оболочки и 8 для третьей).
 И чтобы нарисовать атомы, вы сначала заполняете внутренние оболочки, а затем переходите к внешним оболочкам.
И чтобы нарисовать атомы, вы сначала заполняете внутренние оболочки, а затем переходите к внешним оболочкам.
Итак, если я напишу на доске только символ элемента и его атомную массу, ученики смогут вычислить количество частиц.
Пример: Углерод-12
Например, наиболее распространенная форма (изотоп) углерода-12 записывается как:
- Протоны = 6 : Поскольку мы знаем атомный номер 6 (потому что мы запомнили его ), атом имеет 6 протонов.
- Нейтронов = 6 : Поскольку атомная масса равна 12 (вверху слева от символа элемента), чтобы найти количество нейтронов, мы вычитаем количество протонов (12 – 6 = 6).
- Электронов = 6 : Этот атом сбалансирован по заряду, поэтому ему нужно шесть электронов с их отрицательными зарядами, чтобы компенсировать шесть положительных зарядов шести протонов. (Примечание: мы еще не говорили о несбалансированных заряженных атомах, но заряд будет отображаться в виде верхнего индекса справа от символа.
 )
) - Электронные оболочки (2-4) : У нас есть шесть электронов, поэтому первые два идут на заполнение первой электронной оболочки, а остальные могут идти на вторую оболочку, которая может содержать до 8 электронов. Это дает электронную конфигурацию 2-4.
Схема атома углерода-12.
Пример: Углерод-14
Углерод-14 — это радиоактивный изотоп углерода, который часто используется для радиоуглеродного датирования исторических артефактов. Это записывается как:
- Протонов = 6 : Пока это углерод, у него шесть протонов.
- Электронов = 6 : Этот атом также сбалансирован по заряду, поэтому ему также нужно шесть электронов.
- Нейтронов = 8 : При атомной массе 14, когда мы вычитаем шесть протонов, количество нейтронов должно быть 8 (14 – 6 = 8).
Единственная разница между углеродом-12 и углеродом-14 заключается в том, что у последнего на два нейтрона больше. Следовательно, это два изотопа углерода.
Следовательно, это два изотопа углерода.
Схема атома углерода-14.
Пример: гелий-4
Схема атома гелия-4.
Пример: Натрий-23
Схема атома натрия-23.
Примечание. Изображение атома водорода можно найти здесь. Обновление
: я создал интерактивное приложение, которое будет рисовать атомы (первых 20 элементов) для использования с рабочим листом для студенческой практики.
Автор Lensyl UrbanoОпубликовано Рубрики Химия, Мир природыМетки атомы, атомы и молекулы, изотопы, субатомные частицы
Как нарисовать атом
255 акций
Узнайте, как нарисовать великолепный рисунок с пошаговыми инструкциями Атом и простым учебником. Теперь вы можете легко создать красивый рисунок атома.
Полный чертеж атома
Перейти к пошаговым инструкциям.
Атом — это «мельчайшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц». Атомы считаются строительными блоками химии.
Знаете ли вы? Атомы в основном пустое пространство. Подобно тому, как планеты вращаются вокруг Солнца на большом расстоянии друг от друга, крошечные протоны и нейтроны ядра далеки от крошечных электронов.
Электроны одного атома могут взаимодействовать с электронами другого, образуя химические связи и строя молекулы.
Каждый тип атома может быть идентифицирован как определенный элемент в периодической таблице. В нашем руководстве по рисованию изображен литий, третий элемент, потому что у него три электрона.
Прокрутите вниз, чтобы загрузить PDF-файл этого руководства.
Атом в нашем руководстве по рисованию — это упрощенная версия атома. Такие диаграммы часто используются на уроках естествознания, в мультфильмах и на вывесках, указывающих на радиацию.
Это диаграмма в старом стиле; теперь известно, что точное местоположение электронов обнаружить невозможно. Поэтому электроны теперь изображаются как «облако», а не как единый объект с фиксированным вращением.
Поэтому электроны теперь изображаются как «облако», а не как единый объект с фиксированным вращением.
У многих мультипликационных персонажей атом является эмблемой. К ним относятся Atom Ant, Atom и Captain Atom.
Хотите нарисовать мультяшный атом? Это простое пошаговое руководство по рисованию мультфильмов поможет вам научиться этому.
Все, что вам нужно, это карандаш, ластик и лист бумаги.
Если вам понравился этот урок, см. также следующие руководства по рисованию: Cartoon Scientist, Microscope и Rick из Rick and Morty.
Пошаговые инструкции по рисованию атома
Как нарисовать красивый атом для детей, начинающих и взрослых. Шаг 1
1. Начните с рисования круга. Это сформирует ядро атома.
Easy Atom Drawing – Шаг 2
2. Нарисуйте круг меньшего размера на некотором расстоянии от первого круга. Это формирует первый электрон.
Easy Atom Drawing – Step 3
3. Нарисуйте неполный овал вокруг ядра.![]() Электрон должен находиться в центре, как если бы линия проходила через него. Этот овал указывает путь вращения электрона вокруг ядра.
Электрон должен находиться в центре, как если бы линия проходила через него. Этот овал указывает путь вращения электрона вокруг ядра.
Easy Atom Drawing — Шаг 4
4. Нарисуйте еще одну изогнутую линию примерно параллельно первой. Начните с электрона и подведите линию к открытому концу незавершенного овала в острой точке.
Easy Atom Drawing — шаг 5
5. Нарисуйте еще один маленький кружок за пределами овала, образуя еще один электрон.
Easy Atom Drawing — Шаг 6
6. Нарисуйте еще один путь вращения, как если бы он проходил позади первого. Нарисуйте пару изогнутых линий между электроном и предыдущим путем. На другой стороне пути нарисуйте еще один набор изогнутых линий, стирая при необходимости. Наконец, нарисуйте две короткие линии, которые встречаются в одной точке.
Easy Atom Drawing – Step 7
7. Нарисуйте третий электрон в виде маленького круга сразу за пределами рисунка.
Добавьте больше деталей к вашему изображению атома – Шаг 8
8. Нарисуйте траекторию вращения этого электрона, проходящую позади двух других. Сначала нарисуйте пару изогнутых линий между электроном и почти горизонтальным вращением. Затем нарисуйте изогнутые линии между вертикальным и горизонтальным поворотами, стирая при необходимости. Нарисуйте две линии в форме буквы «С», выгибающиеся наружу от этого пути вращения и возвращающиеся к нему. Нарисуйте еще одну пару изогнутых линий между двумя поворотами и последнюю пару, которая встречается в острой точке.
Нарисуйте траекторию вращения этого электрона, проходящую позади двух других. Сначала нарисуйте пару изогнутых линий между электроном и почти горизонтальным вращением. Затем нарисуйте изогнутые линии между вертикальным и горизонтальным поворотами, стирая при необходимости. Нарисуйте две линии в форме буквы «С», выгибающиеся наружу от этого пути вращения и возвращающиеся к нему. Нарисуйте еще одну пару изогнутых линий между двумя поворотами и последнюю пару, которая встречается в острой точке.
Завершите набросок вашего рисунка атома – шаг 9
9. Нарисуйте одинарные или двойные кривые линии сразу за крайними точками траекторий вращения. Это помогает создать ощущение движения, когда электроны вращаются вокруг ядра.
Раскрась свой рисунок атома
Раскрась свой мультяшный атом. На схемах атомов протоны, нейтроны и электроны часто окрашиваются в разные цвета. Вы можете создать знак «Осторожно: радиация», покрасив свой атом в черный цвет и придав ему желтый фон.

 Атомная масса представляет собой сумму числа протонов (2) и числа нейтронов (2).
Атомная масса представляет собой сумму числа протонов (2) и числа нейтронов (2). И чтобы нарисовать атомы, вы сначала заполняете внутренние оболочки, а затем переходите к внешним оболочкам.
И чтобы нарисовать атомы, вы сначала заполняете внутренние оболочки, а затем переходите к внешним оболочкам. )
)