Самые твердые материалы на Земле ТОП 10. Самые твердые материалы
Самые твердые материалы на Земле ТОП 10
Каждый из вас знает, что эталоном твердости на сегодня так и остается алмаз. При определении механической твердости существующих на земле материалов твердость алмаза берется как эталон: при измерениях методом Мооса – в виде поверхностного образца, методами Виккерса или Роквелла – в качестве индентора (как более твердое тело при исследовании тела с меньшей твердостью). На сегодняшний день можно отметить несколько материалов, твердость которых приближается к характеристикам алмаза.
Сравниваются в данном случае оригинальные материалы, исходя из их микротвердости по методу Виккерса, когда материал считается сверхтвердым при показателях в более 40 ГПа. Твердость материалов может изменяться, в зависимости от характеристик синтеза образца или направления приложенной к нему нагрузки.
Колебания показателей твердости от 70 до 150 ГПа – общеустановленное понятие для твердых материалов, хотя эталонной величиной принято считать 115 ГПа. Давайте рассмотрим 10 самых твердых материалов, кроме алмаза, которые существуют в природе.

10. Субоксид бора (B6O) — твердость до 45 ГПа
Субоксид бора обладает способностями создавать зерна, имеющие форму икосаэдров. Образованные зерна при этом не являются обособленными кристаллами или разновидностями квазикристаллов, представляя собой своеобразные кристаллы-двойники, состоящие из двух десятков спаренных кристаллов-тетраэдров.
Содержание недостаточного количества атомов кислорода в субоксиде бора обеспечивает материалу характеристики, свойственные керамическим материалам. Данное вещество имеет качества химической инертности, повышенной прочности, устойчивости к истиранию при невысоких показателях плотности, а его монокристаллы обладают твердостью в 45 ГПа.
10. Диборид рения (ReB2) — твердость 48 ГПа
Многие исследователи ставят под сомнение вопрос, может ли этот материал причисляться к материалам сверхтвердого типа. Это вызвано весьма необычными механическими свойствами соединения.

Послойное чередование разных атомов делает этот материал анизотропным. Поэтому измерение показателей твердости получаются разными при наличии разнотипных кристаллографических плоскостей. Таким образом, испытаниями диборида рения при малых нагрузках обеспечивается твердость в 48 ГПа, а при увеличении нагрузки твердость становится намного меньше и составляет приблизительно 22 ГПа.
8. Борид магния-алюминия (AlMgB14) — твердость до 51 ГПа
Состав представляет собой смесь алюминия, магния, бора с невысокими показателями трения скольжения, а также высокой твердостью. Эти качества могли бы стать находкой для производства современных машин и механизмов, работающих без смазки. Но использование материала в такой вариации пока что считается непомерно дорогим.
AlMgB14 — специальные тоненькие пленки, создающиеся при помощи лазерного напыления импульсного типа, имеют способность обладать микротвердостью до 51 ГПа.
7. Бор-углерод-кремний — твердость до 70 ГПа
Основа такого соединения обеспечивает сплаву качества, подразумевающие оптимальную устойчивость к химическим воздействиям негативного типа и высокой температуре. Такой материал обеспечивается микротвердостью до 70 ГПа.
6. Карбид бора B4C (B12C3) — твердость до 72 ГПа
Еще один материал – карбид бора. Вещество достаточно активно стало использоваться в разных сферах промышленности практически сразу же после его изобретения в 18 веке.

Микротвердость материала достигает 49 ГПа, но доказано, что и этот показатель можно увеличить посредством добавления ионов аргона в строение кристаллической решетки – до 72 ГПа.
5. Нитрид углерода-бора — твердость до 76 ГПа
Исследователи и ученые со всего мира давно пытаются синтезировать многосложные сверхтвердые материалы, в чем уже были достигнуты ощутимые результаты. Компонентами соединения являются атомы бора, углерода и азота – близкие по размерам. Качественная твердость материала доходит до 76 ГПа.
4. Наноструктурированный кубонит — твердость до 108 ГПа
Материал еще называется кингсонгитом, боразоном или эльбором, а также обладает уникальными качествами, успешно используемыми в современной промышленности. При показателях твердости кубонита в 80-90 ГПа, близких к алмазному эталону, сила закона Холла-Петча способна обусловить их значительный рост.

Это означает, что при уменьшении размеров кристаллических зерен увеличивается твердость материала – существуют определенные возможности увеличения до 108 ГПа.
3. Вюртцитный нитрид бора — твердость до 114 ГПа
Вюрцитная кристаллическая структура обеспечивает высокие показатели твердости данному материалу. При локальных структурных модификациях, во время приложения нагрузки конкретного типа, связи между атомами в решетке вещества перераспределяются. В этот момент качественная твердость материала становится больше на 78 %.
2. Лонсдейлит — твердость до 152 ГПа
Лонсдейлит является аллотропной модификацией углерода и отличается явной схожестью с алмазом. Обнаружен твердый природный материал был в метеоритном кратере, образовавшись из графита – одного из компонентов метеорита, однако рекордной степенью прочности он не обладал.
Учеными было доказано еще в 2009 году, что отсутствие примесей способно обеспечить твердость, превышающую твердость алмаза. Высокие показатели твердости способны обеспечиваться в этом случае, как и в случае с вюртцитным нитридом бора.
1. Фуллерит — твердость до 310 ГПа
Полимеризованный фуллерит считается в наше время самым твердым материалом, известным науке. Это структурированный молекулярный кристалл, узлы которого состоят из целых молекул, а не из отдельных атомов.

Твердость фуллерита составляет до 310 ГПа, и он способен поцарапать алмазную поверхность, как обычный пластик. Как видите, алмаз это больше не самый твёрдый природный материал в мире, науке доступны более твердые соединения.
Пока это самые твердые материалы на Земле, известные науке. Вполне возможно, в скором времени нас ждут новые открытия и прорыв в области химии/физики, что позволит добиться более высокой твердости.
www.sciencedebate2008.com
Самые твердые материалы в мире
Всем известно, что на настоящий момент алмаз является эталоном твёрдости, т.е. при определении твёрдости материала за основу берется показатель твёрдости алмаза. В нашей статье мы рассмотрим десять самых твёрдых материалов в мире и посмотрим насколько они тверды относительно алмаза. Материал считается сверхтвёрдым если его показатели находятся выше 40 ГПа. Нужно учесть, что твёрдость материала может колебаться в зависимости от внешних факторов, в частности от приложенной к нему нагрузки. Итак, представляем десять самых твёрдых материалов в мире.
10. Субоксид бора
Субоксид бора состоит из зёрен имеющих форму выпуклых двадцатигранников. Эти зёрна состоят, в свою очередь, из двадцати кристаллов-многогранников, гранями которого являются четыре треугольника. Субоксид бора имеет повышенную прочность в 45 ГПа.
9. Диборид рения
Диборид рения очень интересный материал. При малых нагрузках он ведет себя как сверхтвёрдый, имея прочность в 48 ГПа, а при нагрузке его твердость снижается до 22 ГПа. Этот факт вызывает бурные дискуссии у ученых всего мира относительно того стоит ли считать диборид рения сверхтвёрдым материалом.
8. Борид магния-алюминия
Борид магния-алюминия составляет собой сплав алюминия, магния и бора. Этот материал имеет невероятно низкие показатели трения скольжения. Это уникальное свойство могло бы стать настоящей находкой в производстве разнообразных механизмов, ведь детали из борида магния-алюминия способны работать без смазки. К сожалению, сплав невероятно дорог, что на данный момент закрывает ему дорогу к широкому применению. Твердость борид магния-алюминия — 51 ГПа.
7. Бор-углерод-кремний
Соединение Бор-углерод-кремний обладает невероятной устойчивостью к высочайшим температурам и химическому воздействию. Твердость Бор-углерод-кремния — 70 ГПа.
6. Карбид бора
Карбид бора был открыт еще в 18 веке и начал использоваться почти сразу во многих отраслях промышленности. Его используют при обработке металлов и сплавов, при изготовлении химической посуды, а также в энергетике и электронике. Используется как основное вещество для пластин бронежилетов. Твердость карбида бора составляет 49 ГПа, а добавляя в него аргон в виде ионов, можно увеличить этот показатель до 72 ГПа.
5. Нитрид углерода-бора
Нитрид углерода-бора является одним из представителей достижений современной химии, он был синтезирован сравнительно недавно Твердость нитрид углерода-бора — 76 ГПа.
4. Наноструктурированный кубонит
Наноструктурированный кубонит имеет и другие названия: кингсонгит, боразон или эльбор. Материал обладает показателями твёрдости близкими к алмазу и успешно применяется в промышленности при обработке различных металлов и сплавов. Твердость наноструктурированного кубонита — 108 ГПа.
3. Вюртцитный нитрид бора
Структура кристаллов этого вещества имеет особую вюрцитную форму, она то и позволяет быть ему одним из лидеров по твёрдости. При приложении нагрузки связи между атомами в кристаллической решётке перераспределяются и твёрдость материала повышается почти на 75%! Твердость вюрцитного нитрида бора — 114 ГПа.
2. Лонсдейлит
Лонсдейлит по своей структуре очень похож на алмаз, ведь они оба являются аллотропными модификациями углерода. Лонсдейлит был обнаружен в воронке метеорита, одним из компонентов которого являлся графит. По всей видимости от нагрузок, вызванных взрывом метеорите, графит превратился в лонсдейлит. При обнаружении лонсдейлит не продемонстрировал особых чемпионских показателей твёрдости, однако было доказано, что при отсутствии в нём примесей, он будет твёрже алмаза! Доказанный показатель твердости лонсдейлита — до 152 ГПа
1. Фуллерит
Пришло время рассмотреть самое твёрдое вещество в мире — фуллерит. Фуллерит — это кристалл, который состоит из молекул, а не из отдельных атомов. Благодаря этому фуллерит обладает феноменальной твердостью, он способен легко царапать алмаз, также как сталь царапает пластик! Твердость фуллерита — 310 ГПа.
 Фуллерит
ФуллеритМы привели список самых твёрдых материалов в мире на данный момент. Как видим, среди них достаточно веществ твёрже алмаза и ,возможно, нас ждут впереди ещё новые открытия, которые позволят получить материалы с ещё более высокими показателями твёрдости!
www.alto-lab.ru
Топ 10 Самых твердых веществ в мире
Все еще думаете, что алмаз – самое твердое вещество на нашей планете? Прошлый век! В нашем ТОП 10 – самые твердые вещества на планете, и алмаз в них только на четвертом месте.
1 Ульратвердый фуллерит
 Поцарапать алмаз? Запросто. Для этого подходит ультратвердый фуллерит. В гранях этого кристалла – целые молекулы фуллерона, что делает его необычайно крепким, примерно в три раза крепче алмаза.
Поцарапать алмаз? Запросто. Для этого подходит ультратвердый фуллерит. В гранях этого кристалла – целые молекулы фуллерона, что делает его необычайно крепким, примерно в три раза крепче алмаза.
2 Лонсдейлит
 В отличие от полностью искусственного фуллерита лонсдейлит можно найти в местах столкновения астероидов с земной поверхностью. Особенностью этого вещества является способность к модифицированию под давлением. Если нагрузка извне возрастает, лонсдейлит перестраивает свою структуру так, чтобы стать еще крепче.
В отличие от полностью искусственного фуллерита лонсдейлит можно найти в местах столкновения астероидов с земной поверхностью. Особенностью этого вещества является способность к модифицированию под давлением. Если нагрузка извне возрастает, лонсдейлит перестраивает свою структуру так, чтобы стать еще крепче.
3 Вюртцитный нитрид бора
 Аналогичный механизм запускается у бронзового медалиста нашей Десятки самых твердых веществ на земле. Это вюртцитный нитрид бора. При увеличении давления на этот материал, он становится тверже своего обычного состояния почти в два раза.
Аналогичный механизм запускается у бронзового медалиста нашей Десятки самых твердых веществ на земле. Это вюртцитный нитрид бора. При увеличении давления на этот материал, он становится тверже своего обычного состояния почти в два раза.
4 Алмаз
 Натуральный алмаз все еще цепляется за свои позиции, однако… мало кто знает, что алмазы по твердости тоже бывают разными. В зависимости от качества камня его твердость колеблется от 70 до 150 гигапаскалей. Но, все же, твердую четверку он заслуживает.
Натуральный алмаз все еще цепляется за свои позиции, однако… мало кто знает, что алмазы по твердости тоже бывают разными. В зависимости от качества камня его твердость колеблется от 70 до 150 гигапаскалей. Но, все же, твердую четверку он заслуживает.
 Все это названия одного и того же вещества – кубического нитрида бора, открытого еще в 1985 году. Интересно узнать, что боразон кое в чем алмаз превосходит – его температура горения почти в два раза превышает температуру горения алмаза.
Все это названия одного и того же вещества – кубического нитрида бора, открытого еще в 1985 году. Интересно узнать, что боразон кое в чем алмаз превосходит – его температура горения почти в два раза превышает температуру горения алмаза.
6 Нитрид углерода-бора
 А вот это вещество существует только потенциально и до сих пор доказано лишь теоретически. Тем не менее, когда оно будет создано, Нитрид углерода бора (c-BC2N) будет в некоторых аспектах тверже алмаза.
А вот это вещество существует только потенциально и до сих пор доказано лишь теоретически. Тем не менее, когда оно будет создано, Нитрид углерода бора (c-BC2N) будет в некоторых аспектах тверже алмаза.
7 Карбид бора
 Карбид бора – один из старожилов нашей десятки самых твердых веществ на планете. В 2016 исполняется 123 года с момента его открытия. И, тем не менее, он до сих пор держит марку – это одно из самых тугоплавких и химически стойких веществ, не растворяющееся даже в кипящих кислотах.
Карбид бора – один из старожилов нашей десятки самых твердых веществ на планете. В 2016 исполняется 123 года с момента его открытия. И, тем не менее, он до сих пор держит марку – это одно из самых тугоплавких и химически стойких веществ, не растворяющееся даже в кипящих кислотах.
8 Диборид осмия
 Диборид осмия отличается исключительной прочностью в одном из направлений своей кристаллической решетки. Чтобы получить это вещество, диборид магния смешивают с хлоридом осмия и выдерживают при температуре +1000С три дня. И то и другое вещество растворяются даже водой, но получившиеся кристаллы – гораздо тверже.
Диборид осмия отличается исключительной прочностью в одном из направлений своей кристаллической решетки. Чтобы получить это вещество, диборид магния смешивают с хлоридом осмия и выдерживают при температуре +1000С три дня. И то и другое вещество растворяются даже водой, но получившиеся кристаллы – гораздо тверже.
9 Диборид рения
 Еще один кристалл, который наступает на пятки алмазу. Его кристаллическая решетка в отдельных направлениях даже тверже этого природного минерала. В то же время, по другим – в пять-шесть раз мягче. Так что 9 место он получает заслужено.
Еще один кристалл, который наступает на пятки алмазу. Его кристаллическая решетка в отдельных направлениях даже тверже этого природного минерала. В то же время, по другим – в пять-шесть раз мягче. Так что 9 место он получает заслужено.
10 Борид магния-алюминия
 Трехкомпонентное вещество, которое обладает идеальным скольжением и отменной твердостью. Материал существует в виде тончайшего напыления.
Трехкомпонентное вещество, которое обладает идеальным скольжением и отменной твердостью. Материал существует в виде тончайшего напыления.
dekatop.com
виды, классификация, характеристики, интересные факты и особенности, химические и физические свойства
В своей деятельности человек использует различные качества веществ и материалов. И совсем не маловажным является их крепость и надежность. О самых твердых материалах в природе и созданных искусственно пойдет речь в этой статье.

Общепринятый эталон
Для определения прочности материала используется шкала Мооса – шкала оценки твердости материала по его реакции на царапание. Для обывателя самый твердый материал – это алмаз. Вы удивитесь, но этот минерал всего лишь где-то на 10-м месте среди самых твердых. В среднем материал считают сверхтвердым, если его показатели выше 40 ГПа. Кроме того, при выявлении самого твердого материала в мире следует учитывать и природу его происхождения. При этом крепость и прочность часто зависят от воздействия внешних факторов на него.
Самый твердый материал на Земле
В данном разделе обратим внимание на химические соединения с необычной кристаллической структурой, которые намного прочнее алмазов и вполне могут его поцарапать. Приведем топ-6 самых твердых материалов созданных человеком, начиная с наименее твердого.
- Нитрид углерода – бора. Это достижение современной химии имеет показатель прочности 76 ГПа.
- Графеновый аэрогель (аэрографен) – материал в 7 раз легче воздуха, восстанавливающий форму после 90 % сжатия. Удивительно прочный материал, способный к тому же впитать количество жидкости или даже масла в 900 раз больше собственного веса. Этот материал планируется использовать при разливах нефти.
- Графен – уникальное изобретение и самый прочный материал во Вселенной. О нем ниже чуть подробнее.
- Карбин – линейный полимер аллотропного углерода, из которого делают супертонкие (в 1 атом) и суперпрочные трубки. Долгое время никому не удавалось построить такую трубку длиною более чем 100 атомов. Но австрийским ученым из Венского Университета удалось преодолеть этот барьер. Кроме того, если раньше карбин синтезировался в малых количествах и был очень дорогой, то сегодня появилась возможность синтезировать его тоннами. Это открывает новые горизонты для космотехники и не только.
- Эльбор (кингсонгит, кубонит, боразон) – это наноконструированное соединение, которое сегодня широко применяется в обработке металлов. Твердость – 108 ГПа.

- Фуллерит – вот какой самый твердый материал на Земле, известный человеку сегодня. Его прочность в 310 ГПа обеспечивается тем, что он состоит не из отдельных атомов, а из молекул. Эти кристаллы с легкостью поцарапают алмаз, как нож масло.

Чудо рук человеческих
Графен – еще одно изобретение человечества на основе аллотропных модификаций углерода. С виду – тонкая пленка толщиной в один атом, но в 200 раз прочнее стали, обладающая исключительной гибкостью.
Именно о графене говорят, что, чтобы его проткнуть, на кончике карандаша должен стоять слон. При этом его электропроводность выше кремния компьютерных чипов в 100 раз. Очень скоро он покинет лаборатории и войдет в повседневную жизнь в виде солнечных панелей, сотовых телефонов и чипов современных компьютеров.
Два очень редких результата аномалий в природе
В природе встречаются очень редкие соединения, которые обладают невероятной прочностью.
- Нитрид бора – вещество, кристаллы которого имеют специфическую вюрцитную форму. С приложением нагрузок соединения между атомами в кристаллической решетке перераспределяются, повышая прочность на 75 %. Показатель твердости – 114 ГПа. Образуется это вещество при вулканических извержениях, в природе его очень мало.
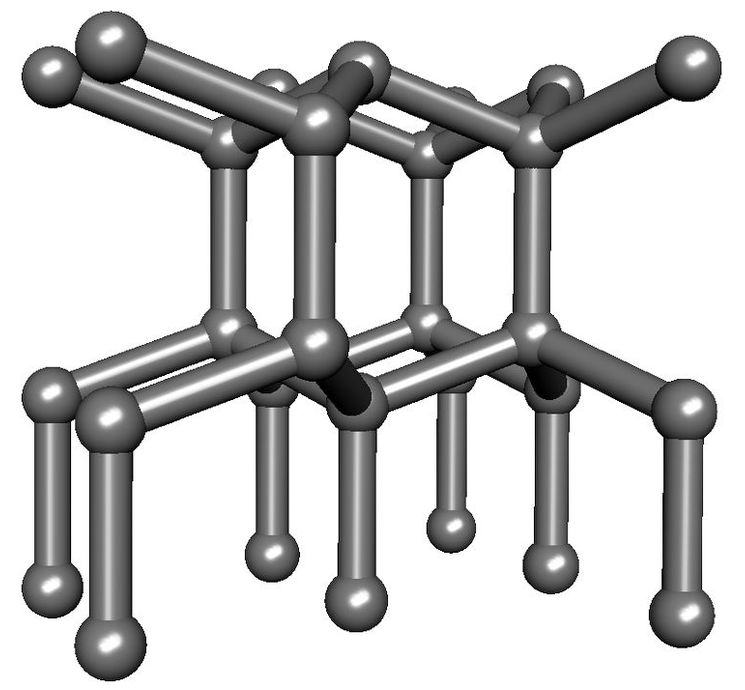
- Лонсдейлит (на главном фото) – соединение аллотропного углерода. Материал был обнаружен в воронке метеорита, считается, что он образовался из графита под воздействием условий взрыва. Показатель твердости – 152 ГПа. В природе встречается редко.

Чудеса живой природы
Среди живых существ на нашей планете есть такие, у которых имеется что-то совершенно особенное.
- Паутина Caerostris darwini. Нить, которую выделяет паук Дарвина, прочнее стали и тверже кевлара. Именно эта паутина была взята учеными НАСА на вооружение при разработке космических защитных костюмов.
- Зубы моллюска Морское блюдечко – их волокнистая структура сегодня изучается бионикой. Они настолько прочные, что позволяют моллюску отодрать водоросли, вросшие в камень.
Железная береза
Еще одно чудо природы – береза Шмидта. Ее древесина – самый твердый природный материал биологического происхождения. Растет она на Дальнем Востоке в заповеднике Кедровая Падь и внесена в Красную Книгу. Прочность сравнима с железом и чугуном. Но при этом не подвержена коррозии и гниению.
Повсеместному использованию древесины березы Шмидта, которую не пробивают даже пули, препятствует ее исключительная редкость.

Самый твердый из металлов
Это металл бело-голубого цвета - хром. Но его прочность зависит от его чистоты. В природе его содержится 0,02 %, что совсем не так мало. Добывают его из силикатных горных пород. Много хрома содержат и падающие на Землю метеориты.
Он коррозионностойкий, жаропрочный и тугоплавкий. Хром входит в состав многих сплавов (хромистая сталь, нихром), которые широко используются в промышленности и в антикоррозийных декоративных покрытиях.
Вместе прочнее
Один металл – это хорошо, но в некоторых сочетаниях возможно придание сплаву удивительных свойств.
Сверхпрочный сплав титана и золота – единственный крепкий материал, который оказался биосовместимым с живыми тканями. Сплав beta-Ti3Au настолько прочный, что его невозможно измельчить в ступке. Уже сегодня ясно, что это будущее различных имплантатов, искусственных суставов и костей. Кроме того, он может быть применен в буровом производстве, изготовлении спортивного снаряжения и во многих других областях нашей жизни.
Подобными свойствами может обладать и сплав палладия, серебра и некоторых металлоидов. Над этим проектом сегодня работают ученые института Калтека.

Будущее по 20 долларов за моток
Какой самый твердый материал уже сегодня может купить любой обыватель? Всего за 20 долларов можно купить 6 метров ленты Braeön. С 2017 года она поступила в продажу от производителя Дастина Маквильямса. Химический состав и способ производства хранятся в строгом секрете, но качества ее поражают.
Лентой можно скрепить абсолютно все. Для этого ее необходимо обмотать вокруг скрепляемых деталей, разогреть обычной зажигалкой, придать пластичному составу нужную форму и все. После остывания стык выдержит нагрузку в 1 тонну.
И твердый, и мягкий
В 2017 году появилась информация о создании удивительного материала – самого твердого и самого мягкого одновременно. Этот метаматериал изобрели ученые из Университета Мичиган. Им удалось научиться управлять структурой материала и заставлять его проявлять различные свойства.
Например, при использовании его для создания автомобилей при движении кузов будет обладать жесткостью, а при столкновении – мягкостью. Кузов абсорбирует энергию соприкосновения и защитит пассажира.
fb.ru
Самое твёрдое вещество в мире: избавляемся от ложных истин
- Подписаться
- Лента публикаций
- Последние публикации
- Лучшие публикации
- за все время
- за полгода
- за месяц
- Категории
- Города и страны
- Здоровье
- Изобретения
- Интересные факты
- История
- Космос
- Наука
- Природа
- Рекорды
- Технологии
- Человек
vseonauke.com
Самый твердый материал на земле
 Давно «известно», что ни один из материалов, ни одно вещество не способно сравниться по твёрдости с алмазом. (На самом деле это не так). Но всё-таки, какие материалы приближаются к нему по этому параметру, и как именно определяется твёрдость?
Давно «известно», что ни один из материалов, ни одно вещество не способно сравниться по твёрдости с алмазом. (На самом деле это не так). Но всё-таки, какие материалы приближаются к нему по этому параметру, и как именно определяется твёрдость?
Если измерение идёт по шкале Мооса, то оценивают свойства поверхности того или иного тела. Методы Роквелла и Виккерса помогают изучить параметры тела как единого целого. Сверхтвёрдым на микроуровне считается вещество (материал), чей показатель от сорока гигапаскалей и выше. Эта величина может изменяться, смотря по особенностям синтеза вещества или разных направлений приложения силы.
Субоксид бора, например, может выдерживать нагрузку в сорок пять гигапаскалей. Зёрна данного вещества по форме икосаэдры. Благодаря пониженному содержанию кислорода, субоксид бора химически инертен.
Борид магния-алюминия отличается твёрдостью в пятьдесят один гигапаскаль, плюс – малой интенсивностью трения. Однако использовать данный материал в машиностроении было бы чрезвычайно дорого.
Карбид бора, синтезированный более двухсот лет назад, имеет микротвёрдость до семидесяти двух гигапаскалей. Недаром его начали применять в практических целях, как только это свойство его стало известно. Сегодня карбид бора используется в бронежилетах.
Наноструктурированный кубонит – твёрдость около ста восьми гигапаскалей. Другое название этого вещества боразон, или эльбор. Он сопоставим по прочности с алмазом.
На шесть гигапаскалей твёрже вюртцитный нитрид бора, который подвергли локальным модификациям структуры.
Сто пятидесяти двух Гпа достигает Лонсдейлит – аллотропная модификация углерода, имеющая некоторое сходство с алмазом. Природный лонсдейлит был обнаружен сначала в кратере метеорита. Заметим всё же, что по сравнению с лабораторными образцами он не является предельно прочным.
Но что там лонсдейлит! Полимеризованный фуллерит полирует алмаз так легко, словно речь идёт о банальной пластмассе. Неудивительно – твёрдость его достигает трёхсот десяти гигапаскалей. Кристаллические узлы минерала образованы не атомами, а молекулами.
Особо прочные текстильные волокна применяются в бронежилетах, спортивном снаряжении, двигателях. Сверхтвёрдость им придают нанотрубки. Среди металлов высочайшую твёрдость имеет хром, среди древесины – берёза Шмидта.
Понравилась статья? Поделитесь!
interesnie-fakti.net
Самое твердое вещество • Наука
Самое твердое вещество
Твердые материалы сегодня

Наиболее твёрдым из существующих на сегодняшний день материалов является ультратвёрдый фуллерит (примерно в 1,17—1,52 твёрже алмаза). Однако этот материал доступен только в микроскопических количествах. Самым же твёрдым из распространённых веществ является алмаз. Кроме того, существует информация, что группе американских и китайских ученых удалось доказать, что специально обработанный лонсдейлит на 58% тверже алмаза.
Лонсдейлит представляет собой одну из аллотропных модификаций углерода. Структура его кристаллической решетки напоминает структуру решетки алмаза. За это данный материал получил второе имя - гексагональный алмаз. Отличие заключается в том, что элементарная ячейка лонсдейлита содержит четыре атома, а ячейка алмаза - восемь. Однако, по словам исследователей, маловероятно, что новый материал найдет практическое применение, потому рассматривать его теоретические свойства на данный момент не имеет никакого смысла.
Фуллери́т — это молекулярный кристалл, в узлах решётки которого находятся молекулы фуллерена.
Алма́з — минерал, одна из аллотропных форм углерода.
Твёрдость — свойство материала сопротивляться проникновению в него другого, более твёрдого тела.
ФУЛЛЕРИТ - НОВАЯ ФОРМА УГЛЕРОДА
Новый материал для исследования
И. В. ЗОЛОТУХИН, Воронежский технический университет
ВВЕДЕНИЕ
В 1990 году среди физиков и химиков возник бум исследовательских работ, вызванный сообщением о получении нового вещества - фуллерита, состоящего из молекул углерода - фуллеренов. Структура фуллерита, его свойства, методы получения - все эти вопросы оказались в фокусе внимания исследователей. Открылись богатейшие возможности для создания на основе нового вещества различного рода соединений и структур с необычными физико-химическими свойствами.
Фуллерит является аллотропной модификацией углерода. Поэтому, прежде чем перейти к рассмотрению его структуры, свойств и возможных областей применения, вспомним ближайших "родственников" нового вещества - графит и алмаз.
Одной из кристаллических модификаций углерода является графит. Этот чудесный материал находит широчайшее применение в самых разнообразных сферах человеческой деятельности - от изготовления карандашных грифелей до блоков замедления нейтронов в ядерных реакторах.
Расположение атомов углерода в кристаллической структуре графита весьма необычно. Отдельные атомы, соединяясь между собой, формируют шестиугольные кольца, образующие сетку, похожую на пчелиные соты [1]. Множество таких сеток располагаются друг над другом слоями. Расстояние между атомами, расположенными в вершинах правильных шестиугольников, равно 0,142 нм. Соседние атомы внутри каждого слоя связаны весьма прочными ковалентными связями, поэтому слой атомов, образующих гексагональную сетку, достаточно прочен и стабилен. А вот слои в графите находятся на довольно почтительном расстоянии друг от друга: оно равно 0,335 нм, что более чем в два раза превышает расстояние между углеродными атомами в гексагональной сетке. Большое расстояние между слоями определяет слабость сил, связывающих слои. Такая структура - прочные слои, слабо связанные между собой - определяет специфические свойства графита: низкую твердость и способность легко расслаиваться на мельчайшие чешуйки.
Алмаз уникален
Другой кристаллической модификацией углерода является алмаз - вещество совершенно уникальное. Каждый атом углерода в структуре алмаза расположен в центре тетраэдра, вершинами которого служат четыре ближайших атома. Соседние атомы связаны между собой ковалентными связями. Такая структура определяет свойства алмаза - самого твердого вещества, известного на Земле.
Изучение этих двух форм чистого углерода имеет давнюю историю. В разное время выдающиеся химики и материаловеды открыли и другие формы углерода, такие, как аморфный углерод, карбин, белый углерод и т. д. Однако все эти формы являются композитами, то есть смесью малых фрагментов графита и алмаза. До последнего времени считалось, что существуют только два способа расположения атомов углерода в пространстве, позволяющих получить кристаллическую форму углерода. Такое положение следует считать весьма удивительным. В самом деле, в настоящее время известно свыше миллиона соединений углерода с другими элементами. Их изучение составляет предмет огромного раздела науки - органической химии. В то же время исследования в области химии чистого углерода начались сравнительно недавно. В последние 10 лет фундаментальные исследования ознаменовались выдающимися успехами в получении принципиально новой третьей формы чистого углерода, о которой пойдет речь ниже.
ФУЛЛЕРЕНЫ - МОЛЕКУЛЯРНАЯ ФОРМА УГЛЕРОДА

Новая форма углерода является новой по существу [2]. В противоположность первым двум, графиту и алмазу, структура которых представляет собой периодическую решетку атомов, третья форма чистого углерода является молекулярной. Это означает, что минимальным элементом ее структуры является не атом, а молекула углерода. Да какая молекула! Оказывается, молекулы чистого углерода представляют собой замкнутую поверхность, имеющую форму сферы или сфероида. Такие молекулы назвали фуллеренами в честь американского изобретателя и архитектора Ричарда Бакминстера Фуллера, получившего в 1954 году патент на строительные конструкции в виде шестиугольников и пятиугольников, составляющих полусферу или полусфероид, которые можно использовать в качестве крыш больших зданий (цирки, выставочные павильоны и др.).
Большой интерес к молекулярному углероду возник в 1985 году, когда была открыта 60-атомная молекула C60 . Кроме того, были обнаружены молекулы C70 , C76 , C84 и т. д. Все они имеют форму замкнутой поверхности, на которой располагаются атомы углерода.
Структура фуллеренов
Основным элементом структуры фуллеренов является шестиугольник, в вершинах которого расположены атомы углерода. Как мы видели ранее, подобные шестиугольники также характерны для структуры графита. Исходя из этого, логично предположить, что графит должен использоваться как исходное сырье для синтеза фуллеренов. Так и происходит на самом деле. В настоящее время твердо установлено, что наиболее эффективным способом получения фуллеренов является термическое разложение слоистой структуры графита на малые фрагменты, из которых затем происходит формирование C60 и других замкнутых молекул углерода.
Если считать, что молекула C60 составлена только из шестиугольных фрагментов графита, то ее радиус должен быть равен 0,37 нм. На самом же деле точное значение радиуса C60 , установленное рентгеноструктурным анализом, составляет 0,357 нм. Эта величина всего на 2% отличается от рассчитанной. Различие в радиусах связано с тем, что атомы углерода располагаются на сферической поверхности в вершинах 20 правильных шестиугольников, унаследованных от графита, и 12 правильных пятиугольников, возникших в процессе формирования C60 . Можно показать, что из правильных шестиугольников легко выкладывается плоская поверхность, однако ими не может быть выложена поверхность замкнутая: часть шестиугольных колец необходимо разрезать, чтобы из разрезанных частей сформировались пятиугольники. Точно таким же образом шьется футбольный мяч. Его покрышка также состоит (и в этом легко убедиться) из пяти- и шестиугольных лоскутков кожи, образующих сферическую поверхность.Таким образом, структурные элементы фуллеренов подобны структурным элементам графита. Плоская сетка шестиугольников (в случае графита) свернута и сшита в замкнутую сферу или сфероид. При этом часть шестиугольников преобразуется в пятиугольники.
ПОЛУЧЕНИЕ ФУЛЛЕРЕНОВ И ФУЛЛЕРИТА
Установка для получения фуллеренов путем термического испарения графита. Этот способ был разработан в 1990 году [3]. В качестве сырья используют цилиндрические стержни спектрально чистого графита, имеющие диаметр от 1 до 6 мм. Заточенные концы стержней соединяют, и через них пропускают ток 150 - 200 А. Можно использовать как постоянный, так и переменный ток. При пропускании тока в месте контакта возникает электрическая дуга и начинается испарение графита. Нагрев должен быть умеренным, чтобы от стержней отделялись не отдельные атомы углерода, а целые фрагменты слоев графита, состоящие из углеродных шестиугольников. Испаренный графит осаждается на стенках камеры в виде сажи.
Описанный процесс осуществляется в камере, в которой предварительно создается вакуум порядка 10- 6 Торр. Затем камеру заполняют газом гелием. Считается, что атомы гелия способны эффективно отнимать избыточную энергию у фрагментов графита, покинувших зону электрической дуги. Кроме того, гелий уносит энергию, выделяющуюся при объединении фрагментов в молекулы фуллеренов. Оптимальное давление гелия в камере при испарении графита находится в пределах 50 - 100 Торр. Шестиугольные фрагменты графита, охлажденные в газообразном гелии, служат "кирпичиками" для построения молекул C60 и C70 .
Чтобы выделить чистые фуллерены, осевшую на стенках испарительной камеры сажу растворяют в метилбензоле (толуоле). При этом фуллерены переходят в раствор, а непрореагировавшие фрагменты графита выпадают в осадок. Отделение осадка может быть произведено одним из трех путей: фильтрацией, вращением раствора в центрифуге, экстракцией при помощи прибора Сокслета. В результате получают жидкость цвета красного вина, которая затем помещается в испаритель. Толуол испаряется, а фуллерены выпадают на дно и стенки сосуда в виде черной пудры, масса которой составляет около 10% от массы исходной графитовой сажи. В состав пудры входят молекулы C60 и C70 в соотношении 85 : 15. Для разделения этих фуллеренов используется жидкостная колоночная хроматография, требующая большого количества растворителей. Цвет чистого C60 в растворе - красный анилиновый, тогда как цвет раствора C70 - оранжевый.
При выпаривании раствора чистого C60 образуется новое кристаллическое вещество, которое получило название "фуллерит". Впервые твердый фуллерит наблюдали Кречмер и Хуффман в мае 1990 года в одной из лабораторий Института ядерной физики в г. Гейдельберге (Германия). Фуллерит является третьей формой чистого углерода, принципиально отличающейся как от алмаза, так и от графита.
КРИСТАЛЛЫ ФУЛЛЕРИТА
Установлено, что фуллерит имеет высокую степень кристаллического порядка [4]. Молекулы C60 при комнатной температуре конденсируются в структуру с плотной упаковкой, где каждая молекула имеет 12 ближайших соседей. Можно доказать, что существуют две плотноупакованные структуры. В кристаллографии (науке о строении кристаллов) они получили названия гранецентрированной кубической (ГЦК) и гексагональной решеток. В кристаллическом фуллерите молекулы фуллеренов образуют ГЦК-решетку. Поскольку 60-атомная молекула имеет диаметр 0,71 нм, размеры элементарной ячейки ГЦК-решетки весьма внушительны: каждая сторона куба равна 1,42 нм, а расстояние между ближайшими соседями составляет около 1 нм. В кристаллах, состоящих из атомов и имеющих ГЦК-решетку, сторона куба обычно не превышает 0,4 нм, а расстояние между ближайшими соседями - 0,3 нм.
Методом ядерного магнитного резонанса доказано, что молекулы C60 , занимая определенные места в гранецентрированной решетке, при комнатной температуре постоянно вращаются вокруг положения равновесия с частотой 1012 с- 1. Такое вращение является значительной помехой, когда требуется определить положение атомов углерода в самой молекуле C60 . К счастью, по мере понижения температуры вращение молекул замедляется и при очень низкой температуре полностью прекращается.
Интересно отметить, что при понижении температуры до 249 К фуллерит испытывает фазовое превращение первого рода, при котором ГЦК-решетка перестраивается в простую кубическую. При этом объем фуллерита увеличивается на 1%.
СВОЙСТВА ФУЛЛЕРЕНОВ И ФУЛЛЕРИТА

Логично предположить, что вещество, состоящее из столь удивительных молекул, будет обладать необычными свойствами. Кристалл фуллерита имеет плотность 1,7 г/см3, что значительно меньше плотности графита (2,3 г/см3) и тем более алмаза (3,5 г/см3). Да это и понятно - ведь молекулы фуллеренов полые.
Фуллерит не отличается высокой химической активностью [5]. Молекула C60 сохраняет стабильность в инертной атмосфере аргона вплоть до температур порядка 1200 К. Однако в присутствии кислорода уже при 500 К наблюдается значительное окисление с образованием CO и CO2 . Процесс, продолжающийся несколько часов, приводит к разрушению ГЦК-решетки фуллерита и образованию неупорядоченной структуры, в которой на исходную молекулу C60 приходится 12 атомов кислорода. При этом фуллерены полностью теряют свою форму. При комнатной температуре окисление происходит только при облучении фотонами с энергией 0,5 - 5 эВ. Вспомнив, что энергия фотонов видимого света находится в диапазоне 1,5 - 4 эВ, приходим к выводу: чистый фуллерит необходимо хранить в темноте.
Фуллериты достаточно легко растворяются в неполярных растворителях. Наиболее известные растворители образуют следующий ряд в порядке уменьшения растворимости фуллеритов: сероуглерод (CS2), толуол (C7H8), бензол (C6H6), тетрахлорметан (CCl4), декан (C10h32), гексан (C6h24), пентан (C5h22) [6].
Проводимость и сверхпроводимость фуллеренов
Твердый фуллерит является полупроводником с шириной запрещенной зоны 1,5 эВ. Это означает, что при облучении обычным видимым светом электрическое сопротивление кристалла фуллерита уменьшается. Оказывается, фотопроводимостью обладают не только чистый фуллерит, но и его различные смеси с другими веществами. Одна из первых успешных попыток в этом направлении состоит в следующем: полимер поливинилкарбазол в количестве 1,5 и 0,04 г фуллерита растворяли в 12 мл толуола. Приготовленным раствором покрывалась алюминиевая пластина. Толщина слоев изменялась от 1 до 30 мкм. Как оказалось, спектр фотопоглощения полученной смеси полностью охватывает видимый диапазон (длины волн от 280 до 680 нм). При этом квантовый выход по отношению к образованию электронно-дырочных пар составляет 0,9. Иначе говоря, каждый падающий фотон (квант света) рождает в полученном материале в среднем 0,9 электрона. С этой точки зрения рассматриваемый материал является лучшим в ряду органических фотопроводящих материалов.
Очень интересные результаты были получены при добавлении калия или натрия в кристаллические пленки C60 . Оказалось, что добавка щелочного металла приводит к повышению электрической проводимости таких пленок на несколько порядков. При этом состоянию с металлической проводимостью отвечает структура M3C60 , где M - атом щелочного металла.
В начале 1991 года было установлено, что добавление атомов калия в пленки C60 приводит к тому, что они становятся сверхпроводящими при 19 К, т.е. электрическое сопротивление таких пленок становится равным нулю. Структура RbCs2C60 становится сверхпроводящей уже при 33 К, а сплав RbTlC60 - при 42,5 К. Вероятно, в ближайшем будущем могут быть достигнуты температуры порядка 100 К.
Соединения фуллеренов с другими элементами
В настоящее время установлено, что фуллерены могут являться основой для создания с другими элементами очень многих соединений. Одна из наиболее интересных и заманчивых проблем в этом направлении - внедрение внутрь молекулы C60 атомов различных элементов [6]. В настоящее время известно, что более трети элементов периодической таблицы могут быть помещены внутрь молекулы C60 . Уже имеются сообщения о внедрении атомов лантана, никеля, натрия, калия, рубидия, цезия. С этой точки зрения очень привлекательны атомы редкоземельных элементов, таких как тербий, гадолиний и диспрозий, обладающих ярко выраженными магнитными свойствами. Фуллерен, внутри которого расположен такой атом, должен обладать свойствами магнитного диполя, ориентацией которого можно управлять внешним магнитным полем.
Возникает перспектива использования фуллеренов в качестве основы для создания запоминающей среды со сверхвысокой плотностью информации. Как известно, в настоящее время в качестве накопителей информации широко используются магнитные диски. При этом информационная среда представляет собой тонкую пленку ферромагнитного металла, что дает возможность получить поверхностную плотность записи порядка 107 бит/см2. Оптические диски, действие которых опирается на лазерную технологию, позволяют достичь несколько большей информационной плотности, порядка 108 бит/см2. Если же в качестве носителей информации использовать фуллереновые магнитные диполи, расположенные на поверхности жесткого диска на расстоянии 5 нм друг от друга, то плотность записи достигнет фантастического значения 4 " 1012 бит/см2. Реализация подобных устройств даст человечеству невиданное информационное могущество. Например, станет возможным записать содержание всех книг, изданных в мире с момента появления книгопечатания, всего на одну дискету современного формата.
Очень интересные результаты достигнуты в направлении синтеза полимеров на основе фуллеренов [5]. При этом фуллерен C60 служил основой полимерной цепи, а связь между молекулами осуществлялась с помощью бензольных колец. Такая структура получила образное название "нить жемчуга". Так были синтезированы металлоорганические полимеры типа (C60Pd)n , (C60Pd2)n .
Фуллерит, как исходный материал для получения алмаза
Совсем недавно было показано, что поликристаллический фуллерит можно превратить в алмаз при давлении всего лишь 2 " 105 атм и при комнатной температуре. Пока же, как известно, для превращения поликристаллического графита в алмаз необходимо давление (3 - 5) " 106 атм и температура 1200╟С. Таким образом, фуллериты являются наиболее перспективным сырьем для синтеза самого твердого и дорогого материала - алмаза.
ИСПОЛЬЗОВАНИЕ ФУЛЛЕРЕНОВ
В мае 1994 года на Всемирной конференции в Сан-Франциско широко обсуждались вопросы практического использования фуллеренов в электронике. Крупнейшая международная промышленная корпорация "Мицубиси" решила использовать фуллерены в качестве основы для производства аккумуляторных батарей, принцип действия которых основан на реакции присоединения водорода, подобно тому как это происходит в широко распространенных металлогидридных никелевых аккумуляторах. Отличие заключается в том, что аккумуляторы на основе фуллеренов способны запасать примерно в пять раз большее количество водорода и, следовательно, емкость их в пять раз больше. Кроме того, батареи на фуллеренах характеризуются малым весом, а также высокой экологической и санитарной безопасностью. Планируется широкое использование таких аккумуляторов для питания персональных компьютеров и слуховых аппаратов.
Обсуждаются вопросы использования фуллеренов для создания фотоприемников и оптоэлектронных устройств, алмазных и алмазоподобных пленок, лекарственных препаратов, сверхпроводящих материалов, а также в качестве красителей для копировальных машин.
Много внимания уделяется проблеме использования фуллеренов в медицине и фармакологии. Одна из трудностей - создание водорастворимых нетоксичных соединений фуллеренов, которые могли бы вводиться в организм человека и доставляться кровью в орган, подлежащий терапевтическому воздействию. В решении этой проблемы уже имеются успехи. Одно из первых соединений такого рода синтезировано на основе дифенэтиламиносакцинита и активно используется в медико-биологических экспериментах с фуллеренами. Широко обсуждается идея создания противораковых медицинских препаратов на основе водорастворимых эндоэдральных соединений фуллеренов с радиоактивными изотопами (эндоэдральные соединения - это молекулы фуллеренов, внутри которых помещен один или более атомов какого-либо элемента).
Себестоимость фуллерена
ЗАКЛЮЧЕНИЕ
В начале 1995 года 1 грамм фуллерита стоил около 100 долларов США. Столь высокая стоимость обусловлена тем, что имеющиеся способы получения и очистки фуллеренов весьма несовершенны и малопроизводительны (около 1 грамма в час). Поэтому актуальнейшей задачей является разработка новых эффективных методов их получения. Впрочем, не исключено, что дешевле всего получать фуллерены в готовом виде из земных недр. Не так давно стало известно, что природный углеродсодержащий минерал шунгит, запасы которого в Карелии составляют сотни миллионов тонн, содержит 0,1% фуллеренов. Таким образом, из каждой тонны минерала можно получить до килограмма фуллерита, поэтому на очереди - разработка промышленного метода извлечения фуллеренов из шунгита.
Необходимо дальнейшее развитие работ, связанных с получением эндоэдральных молекул C60 . В результате могут быть получены фуллериты с особыми, практически ценными, физико-химическими свойствами. Приоритетными являются исследования биологически активных соединений фуллеренов. Одна из важнейших задач - выяснение закономерностей накопления фуллереновых соединений в органах и тканях. Решение этой проблемы может привести к синтезу новых высокоэффективных лекарственных препаратов.
Таким образом, фуллерены, открытые в результате чисто физических исследований, в настоящее время привлекают внимание не только физиков, но и химиков, энергетиков, материаловедов, медиков и биологов. Не исключено, что исследования в этой области приведут к качественно новым результатам глобального масштаба, так же как это было в начале пятидесятых годов, когда началось широкое использование полупроводников, ставших основой развития информационных технологий.
ЛИТЕРАТУРА
1. Жариков О.В. // Природа. 1992. ╧ 3. С. 68.
2. Smalley R.E. // Nav. Res. Rev. 1991. V. 43. P. 3.
3. Huffman D.R. // Physics Today. 1991. ╧ 11. P. 26.
* * *Иван Васильевич Золотухин - доктор технических наук, профессор Воронежского технического университета. Область научных интересов - физика неупорядоченных конденсированных сред. Основные исследования связаны с решением физико-химических проблем создания новых аморфных металлических материалов с необычными физическими свойствами. И.В. Золотухин - автор двух монографий и более 230 статей. В последние годы научные усилия направлены на разработку методов получения и изучения физических свойств нанокристаллических сплавов, фрактальных структур и фуллеренов.
АЛМАЗ - МОДИФИКАЦИЯ УГЛЕРОДА

Алмаз — абсолютно незаменимый материал в самых разных областях человеческой деятельности, начиная от ювелирной и обрабатывающей промышленности и заканчивая электронной и космической. И все это — благодаря его уникальным свойствам: твердости и износостойкости, большой теплопроводности и оптической прозрачности, высокому показателю преломления и сильной дисперсии, химической и радиационной стойкости, а также возможности его легирования электрически и оптически активными примесями. Крупные и особо чистые природные алмазы — большая редкость, поэтому неудивительно, что успешные попытки их производства вызывают огромный интерес.
Высокая цена на эти камни объясняется не только их особыми характеристиками, но и уровнем монополизации в торговле: Международная корпорация «Де Бирс», контролирующая 70—80% поставляемых на рынок природных алмазов, уже более столетия удерживает на них известные цены. Освоение во второй половине XX века промышленного производства технических и ювелирных аналогов, казалось бы, должно было снизить стоимость самых твердых и красивых камней на Земле, однако этого не случилось. Стоит сразу уточнить, что тоннами сегодня выращивают только мелкие камни диаметром до 0,6 мм, используемые в качестве сырья для изготовления абразивного инструмента. И цены на них действительно несколько упали после освоения данной технологии и составляют около 10 центов за карат. Однако никакого обвала цен на ювелирные алмазы пока не предвидится, поскольку их выращивание обходится довольно дорого.
Вместе с тем природные алмазы не могут полностью удовлетворить потребности науки, техники и промышленности. Скажем, инструментальной, металло- и камнеобрабатывающей отраслям нужно примерно в 4 раза больше алмазов, чем их добывается из земли. А в ряде высокотехнологичных областей — при изготовлении оптических окон, элементов пассивной и активной электроники, датчиков ультрафиолетового и ионизирующего излучения природное сырье зачастую использовать нельзя.
В первую очередь это связано с тем, что разброс физических свойств природных кристаллов алмаза очень широк — и это во многом исключает возможность их применения в серийных изделиях и приборах, чувствительных к свойствам используемого материала. Другой проблемой является то, что подавляющее большинство природных кристаллов алмаза (примерно 98%) содержит в качестве примеси азот (1 атом азота на 1 000— 100 000 атомов углерода), наличие которого сказывается на свойствах алмаза. Еще одна незадача возникает из-за несовершенства кристаллической структуры добываемых кристаллов и неравномерного распределения примесей.Всего лишь углерод
Алмаз и алхимия
С давних пор алмаз считали чудодейственным камнем и могущественным талисманом. Полагали, что человек, носящий его, сохраняет память и веселое расположение духа, не знает болезней желудка, на него не действует яд, он храбр и верен.Трудно представить, что самый твердый из известных природных материалов является одной из полиморфных (отличающихся расположением атомов в кристаллической решетке) модификаций углерода, другая модификация которого — графит, мягкое вещество, использующееся в качестве смазки и грифелей для карандашей.
В алмазе, имеющем кубическую структуру, каждый атом углерода окружен четырьмя такими же атомами, которые образуют правильную четырехгранную пирамиду. Графит же имеет слоистую структуру, в которой прочные связи между атомами углерода существуют только внутри слоя, где атомы образуют гексагональную сетку. Связь же между отдельными слоями очень слабая, поэтому они могут легко скользить относительно друг друга и остаются на бумаге в виде микрочешуек, когда мы пишем карандашом.Физика роста
Люди всегда хотели сделать алмаз более доступным: то есть не добывать его в копях, а получать лабораторным способом, причем желательно — дешевым.
Опыты над алмазами
Первые документально зафиксированные опыты над алмазами относятся к 1694 году. Именно тогда флорентийские ученые Аверани и Тарджиони продемонстрировали с помощью зажигательного стекла, что алмаз горит, если его нагреть до достаточно высокой температуры. На протяжении последующих веков велись непрерывные эксперименты по исследованию самого прочного в мире минерала (И. Ньютон, А. Лавуазье, С. Теннант, Х. Дэви, М. Фарадей, Г. Розе), после которых стало ясно, что «величайшая драгоценность» в химическом отношении полностью аналогична графиту, углю и саже. Экспериментаторы, разумеется, пытались получить эту «драгоценность» из указанных веществ (В. Каразин, Б. Хэнней, К. Хрущов, А. Муассан). Однако по причине почти полного отсутствия информации о физико-химических свойствах алмаза и графита и несовершенства техники того времени цель так и не была достигнута.
Лишь в 1939 году молодой сотрудник Института химической физики АН СССР Овсей Лейпунский выполнил расчет линии равновесия графит-алмаз. Эта работа впервые обозначила возможные способы промышленного получения камня. Лейпунский рассчитал оценочные значения давления и температуры, необходимые для осуществления превращения графита в алмаз. Впоследствии его расчеты были несколько уточнены и подтверждены экспериментально.
Следующим этапом на пути к решению проблемы получения алмаза явилась разработка аппаратуры, обеспечивающей создание и поддержание в течение длительного интервала времени необходимых высоких давлений и температур. Большой вклад в развитие техники высоких давлений был внесен Нобелевским лауреатом Перси Бриджменом, разработавшим принципы действия аппаратов высокого давления.
Оценка качества алмазов
Бриллианты (ограненные алмазы) оцениваются по четырем главным CCCC критериям (так называемая система 4'C): цвет (color), качество (clarity), огранка и пропорции (cut), вес в каратах (carat weight). Наиболее ценны те, что имеют так называемый «высокий» цвет, а в действительности являются бесцветными.Наличие даже едва заметного и незначительного, на взгляд неспециалиста, оттенка желтого, коричневого или зеленого цвета (называемого ювелирами «нацветом») может серьезно понизить стоимость камня. У бесцветных алмазов выше всего ценится круглая огранка (бриллиант в этом случае имеет 57 граней), позволяющая максимально выявить блеск и игру камня (так называемый «огонь»). Максимальная стоимость бриллианта весом 1 карат сегодня составляет $18 000.
Наиболее часто камни такого же веса имеют менее высокий цвет и качество, и их стоимость — $5 000— $8 000. Чемпионами по стоимости в мире бриллиантов являются окрашенные в красный, голубой, розовый, зеленый и оранжевый цвета камни. Цена на розовые и голубые может превосходить стоимость бесцветных аналогичного веса и качества в 10 и более раз, а самым дорогим (за карат) за всю историю бриллиантом является камень красного цвета весом 0,95 карата, проданный в 1987 году на аукционе Christie's за 880 000 долларов США. Единого прейскуранта цен для цветных камней не существует, и, как правило, они формируются на аукционных торгах.
Многолетние усилия ученых и конструкторов завершились в 1953— 1954 годах успешными опытами по выращиванию алмаза. Успеха добились исследовательские группы компаний ASEA (Швеция) и General Electric (США). Полученные образцы были очень далеки от совершенства и имели размер менее 1 мм.
Шведы и американцы использовали схожие технологии — графит в смеси с металлом (растворителем углерода) помещался в твердую сжимаемую среду. Необходимое давление (70 000—80 000 атмосфер) создавалось мощным гидравлическим оборудованием. Нагрев осуществлялся до температур 1 600—2 500°С в течение двух минут.
Кристаллизация алмазов происходила за счет того, что расплав металла (железо) при высоком давлении и температуре оказывается ненасыщенным углеродом по отношению к графиту и пересыщенным по отношению к алмазу. При таких условиях термодинамически выгоднее оказывается образование алмаза и растворение графита. Получаемое в настоящее время по данной технологии сырье — это преимущественно алмазные порошки с размером зерна 0,001—0,6 мм (максимально 2 мм) и концентрацией азота более 1019 атомов/см3.
Способы получения алмазов
В начале 60-х годов советские ученые Б. Дерягин и Б. Спицын и независимо от них американец В. Эверсол предложили принципиально иной CVD-способ получения алмаза, не требующий использования больших давлений. Суть его состоит в том, что углеродсодержащий газ (например, метан) в смеси с водородом и кислородом разлагают при атмосферном или пониженном давлении, и атомы углерода осаждаются на поверхности затравочных кристаллов алмаза, что приводит к их росту. Однако получаемые кристаллы имели ограничения по качеству.
Несмотря на определенные успехи в деле выращивания алмазов, оставалась одна нерешенная задача — получение крупных монокристаллов ювелирного качества. Лишь в 1967 году Роберт Венторф запатентовал способ («метод температурного градиента»), позволивший решить данную проблему.
Движущей силой кристаллизации алмаза в этом методе является перепад концентрации растворенного в металле углерода, обусловленный разностью температур в реакционном объеме. Источник углерода располагают в наиболее горячей зоне, а алмазную затравку (кристалл алмаза размером около 0,5 мм) в области с более низкой температурой. Металлрастворитель плавится и насыщается углеродом. Однако степень насыщения из-за разницы температур будет неравномерной. Равновесная концентрация углерода в расплаве на границе раздела расплав — источник углерода будет выше, чем на границе раздела расплав — алмазная затравка.
Возникающий градиент концентрации приводит к диффузии углерода от источника к затравочным кристаллам, у которых расплав оказывается перенасыщенным — из него происходит осаждение углерода, вызывающее рост алмазного кристалла-затравки. Это очень остроумный метод, основанный на хорошем понимании того множества процессов, которые происходят в термодинамически неравновесных средах, — в данном случае перепад температур одновременно обеспечивает доставку нужного для роста алмаза углерода и гарантирует его осаждение на затравку.Пирамиды-иголочки из полупроводникового алмаза стоят больше, чем бриллианты такого же размера (0,01 карата)
Обработка алмазов
При огранке и полировке алмазов используют абразивные порошки из того же самого алмаза. Одинаковая твердость абразива и обрабатываемого материала создает определенные проблемы при таких работах. У алмаза, как и у большинства кристаллов, разные грани имеют неодинаковую твердость. Труднее всего поцарапать так называемую грань (111), на которой атомы углерода расположены наиболее плотно.Именно при обработке поверхностей, параллельных данной кристаллографической грани, у ювелиров и технологов возникают особые трудности. Технологи ищут пути повышения твердости выращиваемых алмазов путем целенаправленного их легирования различными примесями, а также пытаются синтезировать вещества покрепче самого минерала. Уже более 10 лет в научных кругах обсуждаются углеродные материалы, получаемые при высоких давлениях и температурах из молекул фуллерена С60.Плоскопараллельные пластинки из особо чистого и легированного бором алмаза (2,5х2,5х0,5 мм) Среди синтезируемых кристаллических и аморфных структур особо интересна модификация фуллерита с большой долей «алмазоподобных» межатомных связей — до 80%. Остальная часть химических связей в этом веществе более прочная, чем алмазная, и подобна той, что соединяет атомы в плоскостях графита, в молекуле С60 и стенках углеродных нанотрубок. Структура расположения атомов углерода в этом состоянии обеспечивает изотропность его механических свойств и отсутствие так называемых «легких» плоскостей скалывания, имеющихся у кристаллов алмаза. Как полагают, именно такая «рваная» и сильно напряженная кристаллическая структура и обеспечивает данному материалу твердость выше, чем у знаменитой грани (111) алмаза.Этот материал, названный «тиснумит», уже нашел применение в сверхпрочных наконечниках зондовых сканирующих микроскопов NanoSkan («Вокруг света» № 6, 2005). Недавно ученые из Германии открыли новый вариант алмазоподобной структуры: агрегированные алмазные наностержни (Aggregated Carbon NanoRods), с плотностью и твердостью на несколько процентов большими, чем у обычного кристаллического алмаза. Ожидается, что такой материал ACNR найдет применение в различных нанотехнологиях.
Блеск алмаза
Первоначально людей в алмазе привлекала только его необычайная твердость, и ценился он ниже некоторых других минералов. Лишь в середине XV века придворный ювелир герцога Бургундии Карла Смелого знаменитый Луи ван Беркем придумал первый вариант так называемой бриллиантовой огранки, позволившей достаточно полно выявить блеск и игру цветов алмаза. Яркий блеск ограненного алмаза обусловлен его высоким показателем преломления (2,42), а разноцветная игра — сильной дисперсией (с
samogoo.net
















