Содержание
что это такое, какие болезни вызывают
Инфекционные болезни могут развиваться не только из-за бактерий, вирусов и других хорошо известных врачам микроорганизмов - это ошеломляющее заявление в медицинской среде было сделано после того, как в 1982 году профессор неврологии и биохимии Стэнли Прузинер (США) обнаружил белковые соединения, способные вызывать заболевания. Открытие белков-прионов было настоящим прорывом в медицине, доказательством чему стало получение учёным Нобелевской премии в 1997 году.
Прионы: биологическая сущность, свойства, среда обитания таинственных молекул
До недавнего времени исследователи считали, что в составе любой «живой» субстанции должны быть молекулы ДНК или РНК — нуклеиновых кислот, обусловливающих способность вирусов, бактерий, грибов и прочих организмов размножаться. Однако открытие прионов полностью трансформировало это представление. Устойчивость к высоким температурам, к различным видам излучений, действию нуклеаз (ферментов, способных расщеплять нуклеиновые кислоты), отсутствие роста на питательных средах – такими необычными свойствами обладал ранее не известный возбудитель.
Белковые соединения с определённой конфигурацией, способные трансформироваться в патогенные и вызывать нейродегенеративные процессы в организме, были названы прионами. Термин «прион» (prion) предложил Стэнли Прузинер. Термин происходит от фрагментов английских слов protein (белок) и infection (инфекция). Прионы способны размножаться. Этот процесс более продолжителен по времени, чем размножение патогенных микроорганизмов, поэтому от момента попадания прионов в организм до клинических проявлений болезни может пройти несколько месяцев или лет.
Молекула приона в «нормальной» форме имеется на поверхности нервных клеток у каждого человека. Обычные молекулы белка, вступая в контакт с патологическими, сами превращаются в них, изменяя при этом собственную пространственную структуру. Что является пусковым механизмом подобной трансформации, до конца не известно. Из этого следует, что прион, выступая в роли инфекционного агента, заражает нормальные молекулы, вызывая «молекулярную эпидемию».
Токсичные белковые бляшки на клетке приводят к её гибели, а на месте погибшей клетки образуется пустота, которая заполняется жидкостью. Количество пустот в головном мозге с течением времени будет увеличиваться, пока он не превратится в «губку».
Как можно заразиться прионами?
На сегодняшний день выделяют следующие основные пути заражения инфекционным белком-прионом:
1. Трансмиссивный. В этом случае молекулы белка передаются от одного вида млекопитающего к другому — например, от инфицированной коровы или овцы человеку. Заражение происходит при употреблении в пищу мяса или молока заражённого животного, либо использовании его тканей (роговицы, препаратов крови и т.п.), применении во время оперативных вмешательств биологического шовного материала.
2. Наследственный. Заболевание развивается на фоне генетической мутации, затрагивающей область 20-й хромосомы. Несмотря на слабую изученность функционирования этого участка генома, достоверно известно его участие в синтезе нормального прионного белка.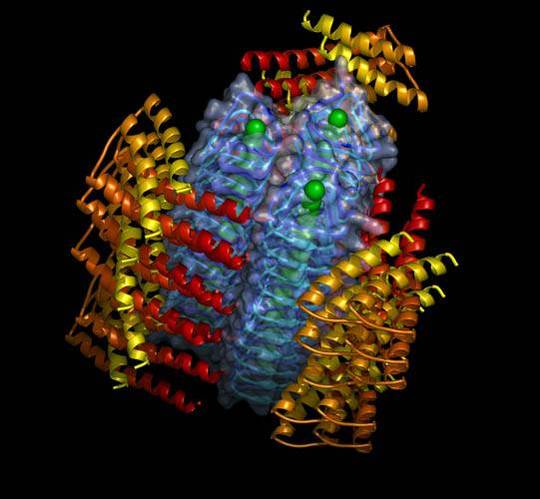 В случае генных мутаций вместо здорового приона образуется патологический, а это приводит к развитию болезней.
В случае генных мутаций вместо здорового приона образуется патологический, а это приводит к развитию болезней.
3. Спорадический. При этом аномальный белок появляется в организме спонтанно, без видимых причин.
Вне зависимости от способа появления аномальный белок может стать причиной заражения других людей.
Прионные заболевания: особенности течения, лечения, прогноз
Отличительной особенностью болезней, вызываемых прионами, является длительный инкубационный период - от 2-3 месяцев до нескольких десятилетий. Подавляющее большинство прионных заболеваний человека являются спорадическими и имеют семейный характер наследования.
Куру, синдром Герстманна-Штреусслера-Шейнкера, болезнь Крейтцфельдта-Якоба, скрэпи – прионы вызывают заболевания, сопровождаемые поражением центральной нервной системы. Для них характерны такие признаки как деменция (слабоумие), зрительные и мозжечковые нарушения. При этом у больного могут отмечаться двигательные расстройства, бессонница, галлюцинации, нарушение речи.
К сожалению, эффективных методов лечения прионных болезней на сегодняшний день нет, хотя учёные пытаются предотвращать переход нормального белка в аномальный. Пациентам назначается симптоматическая терапия с использованием противосудорожных средств для облегчения страданий. Прогноз пока неутешителен, так как все вышеперечисленные заболевания завершаются летальным исходом.
Перспективы
Недостаточная изученность проблемы прионов и прионных болезней способствует углублению исследований в этой области — учёные занимаются активным поиском средств борьбы с патогенными белками. Актуальность этого вопроса растёт в связи с возможностью возникновения «прионной эпидемии», например, из-за приёма лекарственных средств животного происхождения.
Раскрытие загадочных явлений, которыми окутаны прионы, возможно, поможет в понимании ряда серьёзных биомедицинских проблем человечества.
Севиля Ибраимова
Редакция рекомендует:
Не антибиотиком единым: «киллеры» бактерий – бактериофаги
Риск на грани. Как открыли хеликобактер пилори?
Как открыли хеликобактер пилори?
идеальные убийцы и возможный ключ к бессмертию – Москва 24, 17.06.2015
Фото: M24.ru/Евгения Смолянская
За свою историю человечество сталкивалось с огромным количеством войн, эпидемий, стихийных бедствий и других катаклизмов. В XXI веке, когда с эпидемиями, казалось, было покончено, у человечества появился новый вызов – прионы. Что это такое, чем они грозят людям и почему прионами так интересуются ученые всего мира – в материале M24.ru.
Ты помнишь, как все начиналось
В двадцатые годы прошлого столетия врачи столкнулись с новым и неизведанным доселе заболеванием. Немецкий невропатолог Ганс Герхард Крейтцфельдт наблюдал в своей клинике одну пациентку – 20-летнюю девушку. На начальной стадии болезни у нее была нарушена чувствительность в руках и ногах, быстро прогрессировали расстройства памяти, нервной деятельности, больная все чаще впадала в бессознательное состояние. Через несколько месяцев девушка умерла от расстройств дыхания и сердечной деятельности. Невропатолог, который в будущем станет видным нацистским врачом и будет принимать участие в программе «Эвтаназия», задокументировал ход болезни.
Невропатолог, который в будущем станет видным нацистским врачом и будет принимать участие в программе «Эвтаназия», задокументировал ход болезни.
Спустя несколько месяцев доктор Альфонс Мария Якоб из Гамбурга столкнулся с тремя аналогичными пациентами. Молодые люди страдали от расстройств нервной деятельности, глотания, практически не осознавали происходящее вокруг и вскоре умерли. При вскрытии Якоб увидел интересное явление, которое раньше врачам наблюдать не приходилось, – поражен у больных был только мозг. Была зафиксирована массовая гибель клеток серого вещества головного мозга, а сохранившиеся нейроны отличались необычным набуханием. Ни в одном другом органе не было зафиксировано никаких патологических изменений. В память о двух первооткрывателях заболевание получило название болезни Крейтцфельдта – Якоба.
В те далекие годы вирусология как наука находилась еще в зачаточной стадии. Поэтому заболеванию было суждено долгое время оставаться в забвении. Этому поспособствовали Великая депрессия и Вторая мировая война.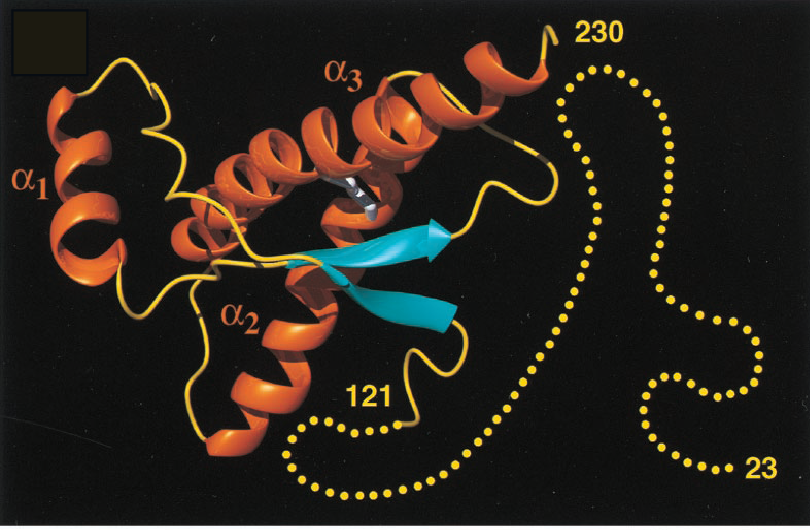 И лишь в пятидесятые годы прошлого века ученые начали активно интересоваться, что же все-таки происходит с людьми, которым не посчастливилось подхватить болезнь Крейтцфельдта – Якоба.
И лишь в пятидесятые годы прошлого века ученые начали активно интересоваться, что же все-таки происходит с людьми, которым не посчастливилось подхватить болезнь Крейтцфельдта – Якоба.
В то же время ученые открывают еще два заболевания, которые по своим симптомам и течению весьма и весьма напоминают описанный выше страшный недуг – куру и скрейпи. Первая болезнь была распространена среди народности форе на острове Папуа – Новая Гвинея, а вторым страдали овцы по всему миру. Но важным оказалось другое: симптомы болезней несколько отличались от болезни Крейтцфельдта – Якоба, но характер поражений был практически идентичен – образование пустот в тканях головного мозга и массовая гибель нервных клеток.
Казалось бы, все ясно. Имеется болезнь, ее вызывает какой-то вирус или бактерия, давайте разберемся, кто является возбудителем и устраним причину. Но не тут-то было! Все оказалось не так просто…
«Познавательные фильмы»: Вакцины
Исследования
Ученым удалось достаточно быстро установить, почему болеют папуасы. Выяснилось, что заболевают только те из них, кто участвовал в ритуальном поедании тел погибших от куру родственников. Согласно местным верованиям того времени, дети должны были обязательно отведать мозга умершего, считалось, что от этого у них прибавится ума. Неизвестно, прибавлялось ли у детей от этого ума, но все малолетние, участвовавшие в таких трапезах, обязательно оказывались зараженными куру.
Выяснилось, что заболевают только те из них, кто участвовал в ритуальном поедании тел погибших от куру родственников. Согласно местным верованиям того времени, дети должны были обязательно отведать мозга умершего, считалось, что от этого у них прибавится ума. Неизвестно, прибавлялось ли у детей от этого ума, но все малолетние, участвовавшие в таких трапезах, обязательно оказывались зараженными куру.
Особенно масштабные исследования развернулись с агентом скрейпи. Для начала определили его размеры, они оказались стандартными для вирусов – 17–27 нанометров. После этого вирусологи всего мира стали разбираться в свойствах неизвестного возбудителя заболевания, и тут их ждали сюрпризы. Оказалось, что инфекционный агент совершенно невосприимчив к формалину, пепсину и трипсину, не реагирует на ферменты, разрушающие ДНК и РНК, устойчив к кипячению, ультрафиолетовому излучению и… проникающей радиации! С такими вирусами ученым сталкиваться еще не приходилось.
Фото: M24.ru/Александр Авилов
Больше того, возбудителя заболевания никак не удавалось увидеть в электронный микроскоп, что было уж совсем странно.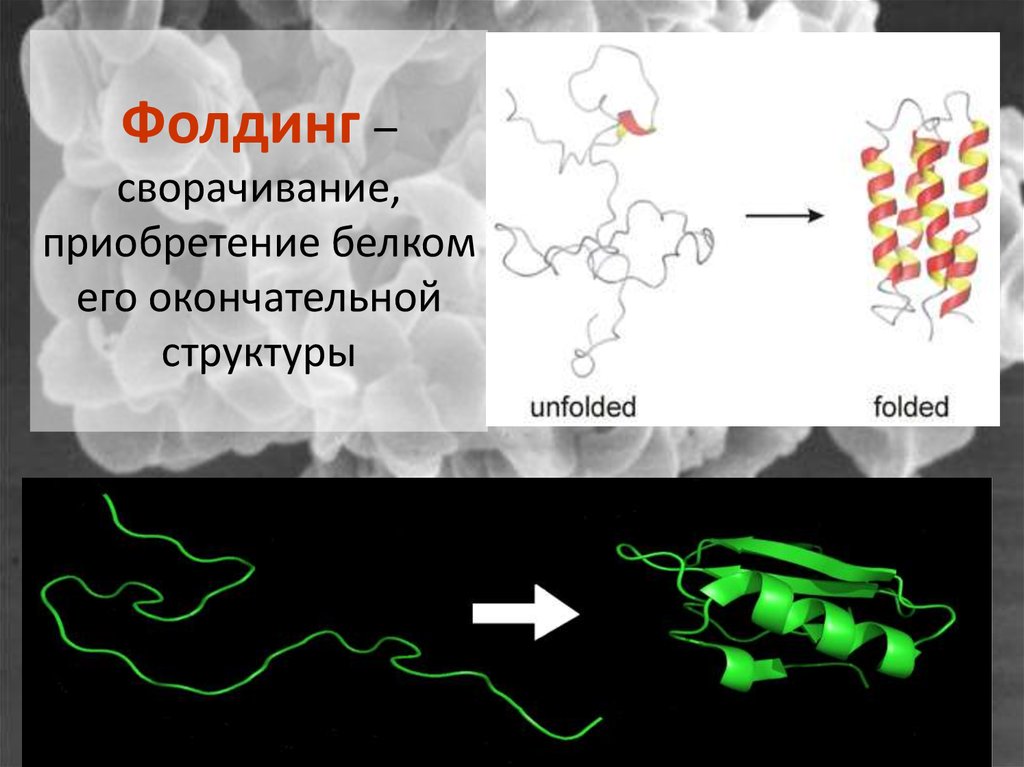 В то время ученые уже умели распознавать вирусные частицы намного мельче, чем 17 нанометров, но вирус скрейпи (почесуха) так никто и не увидел – наблюдали лишь фрагменты клеточных мембран.
В то время ученые уже умели распознавать вирусные частицы намного мельче, чем 17 нанометров, но вирус скрейпи (почесуха) так никто и не увидел – наблюдали лишь фрагменты клеточных мембран.
Еще одной интересной загадкой оказалось всякое отсутствие иммунного ответа организма больных. Организм людей, больных куру, и овец, страдавших от скрейпи, никак не реагировал на течение заболевания. При обычных болезнях, вроде гриппа и простуды, в организме увеличивается синтез интерферона (отвечает за иммунитет), что ведет к быстрому выпуску антител, которые соединяются с вирусными частицами и растворяют их. Ученые пытались обнаружить признаки хоть каких-либо антител, но потерпели неудачу.
Отчаявшиеся исследователи начали выдвигать гипотезы, что возбудителем является не вирус, а молекула полисахарида или же белка, но подтверждения эта версия так и не нашла. Ученые топтались на месте, пока в 1982 году американский невролог Стэнли Прузинер не заявил об открытии нового класса инфекционных агентов – прионах.
Что такое прион
До открытия прионов считалось, что болезни человека и животных могут вызываться исключительно живыми организмами или хотя бы вирусами, содержащими нуклеиновую кислоту. Однако все оказалось не так просто. Прион – это особый вид белка, который присутствует в любом человеческом организме.
Выяснилось, что либо под воздействием непонятных факторов, либо из-за мутаций в организме некоторых людей нормальный прионный белок, входящий в состав клеточных мембран, заменяется «неправильным». Второй вид прионного белка имеет другую структуру, вызывает гибель клеток, но самое интересное – способен самостоятельно размножаться (без каких-либо ДНК и РНК!) и менять нормальные прионы в соседних клетках на дефектные.
«Познавательный фильм»: Вирусы и защита от эпидемий
Таким образом, прионы оказались единственным видом инфекционных агентов, которых никак нельзя причислить к живым существам. Ведь, по своей сути, они не содержат никакой генетической информации и самостоятельно синтезируются организмом.
Естественно, исследователей заинтересовал самый главный вопрос – а зачем вообще в человеческом организме нужны прионы? В настоящее время известно уже достаточно много прионных болезней. Все они являются экстремально редкими, самая распространенная – болезнь Крейтцфельдта – Якоба – наблюдается у одного из миллиона человек. Также известно о синдроме Герстманна – Штраусслера – Шайнкера, фатальной семейной бессонице и куру. Некоторые исследователи включают в группу прионных заболеваний человека также болезнь Альперса у детей, амиотрофический лейкоспонгиоз (описан белорусскими учеными в конце прошлого века, болели работники одной из ферм) и спонгиоформный миозит (мышечное истощение).
Все эти заболевания являются смертельными, и лекарств от них пока не предложено. Но все же зачем организм синтезирует прионы? Какую он отводит роль для них?
Зачем нужны прионы?
В 70-е годы прошлого века два английских исследователя – Паттисон и Джебет – изучали на мышах действие вещества под названием купризон.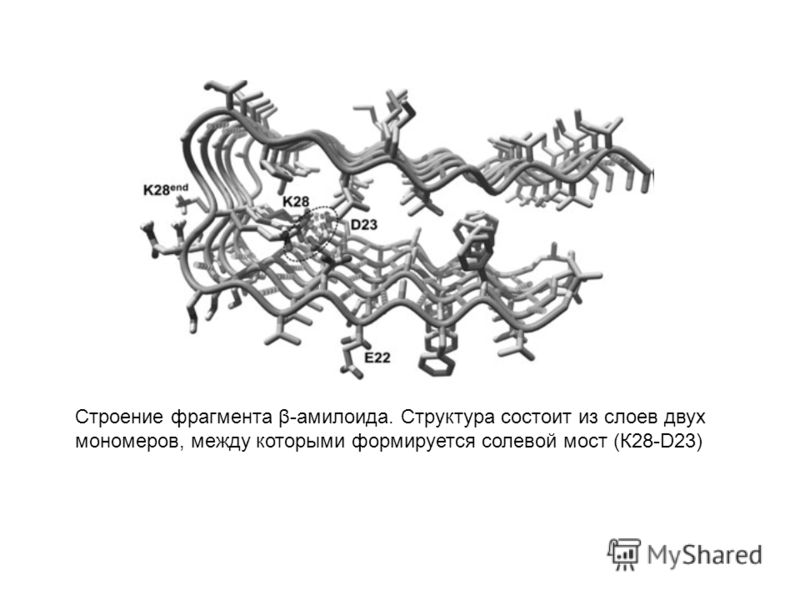 В нормальных условиях оно связывает в организме ионы меди. Животным включили купризон в обязательную диету с целью посмотреть, какое действие он произведет на грызунов. И поразились! После 30 с лишним дней купризоновой диеты совершенно здоровые до этого мыши превратились в тяжелобольных. Причем все признаки заболевания полностью отвечали симптомами скрепи. Часть мышей, участвовавших в эксперименте, вскрыли и посмотрели – оказалось, что в головном мозгу животных произошли абсолютно те же изменения, что и при прионных болезнях.
В нормальных условиях оно связывает в организме ионы меди. Животным включили купризон в обязательную диету с целью посмотреть, какое действие он произведет на грызунов. И поразились! После 30 с лишним дней купризоновой диеты совершенно здоровые до этого мыши превратились в тяжелобольных. Причем все признаки заболевания полностью отвечали симптомами скрепи. Часть мышей, участвовавших в эксперименте, вскрыли и посмотрели – оказалось, что в головном мозгу животных произошли абсолютно те же изменения, что и при прионных болезнях.
Возник вопрос: а что если купризон мышам больше не давать? Попробовали – и через несколько дней грызуны выздоровели. Уже через 30 дней у них исчезли и вызванные купризоном изменения в мозговой ткани.
Спустя много лет было выяснено, что прионы весьма и весьма похожи на положительно заряженные частицы двухвалентной меди. И изменения, которые они вызывают в организме, практически идентичны. Таким образом, исследователи сделали вывод о том, что в нормальном состоянии прионы отвечают за оборот металлов, в частности меди.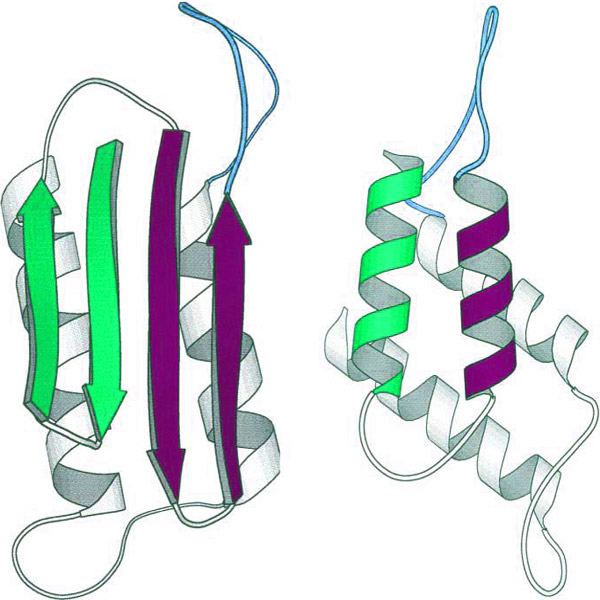 Но эти данные пока остаются лишь гипотезой.
Но эти данные пока остаются лишь гипотезой.
Фото: ТАСС/Станислав Красильников
Еще одна группа американских исследователей принялась копать в другом направлении. Им удалось получить данные, что прионы помогают клеткам мозга прикрепляться друг к другу и участвуют в передаче сигналов внутри клетки. Это означает, что отсутствие прионов или их дефекты не позволяют клеткам мозга получать сигнал о других клеток, что ведет к развитию тяжелых нарушений в работе нервной и других систем организма.
Но самым интересным является предположение о том, что прионы участвуют в механизмах клеточного старения. Не секрет, что долгое время прионные болезни относили к группе старческих болезней, потому что вызываемые ими изменения весьма сходны с другими заболеваниями (вроде болезни Пика, Альцгеймера и других неврологических недугов). Наличие прионной инфекции как бы подталкивает организм к ускоренному старению. Естественно, это ставит очень важный вопрос: если лекарство от таких болезней будет найдено, не станет ли оно своеобразным ключом к долголетию или даже бессмертию организма? Но ответ на этот вопрос пока дать невозможно, поскольку функции прионов изучены еще недостаточно хорошо.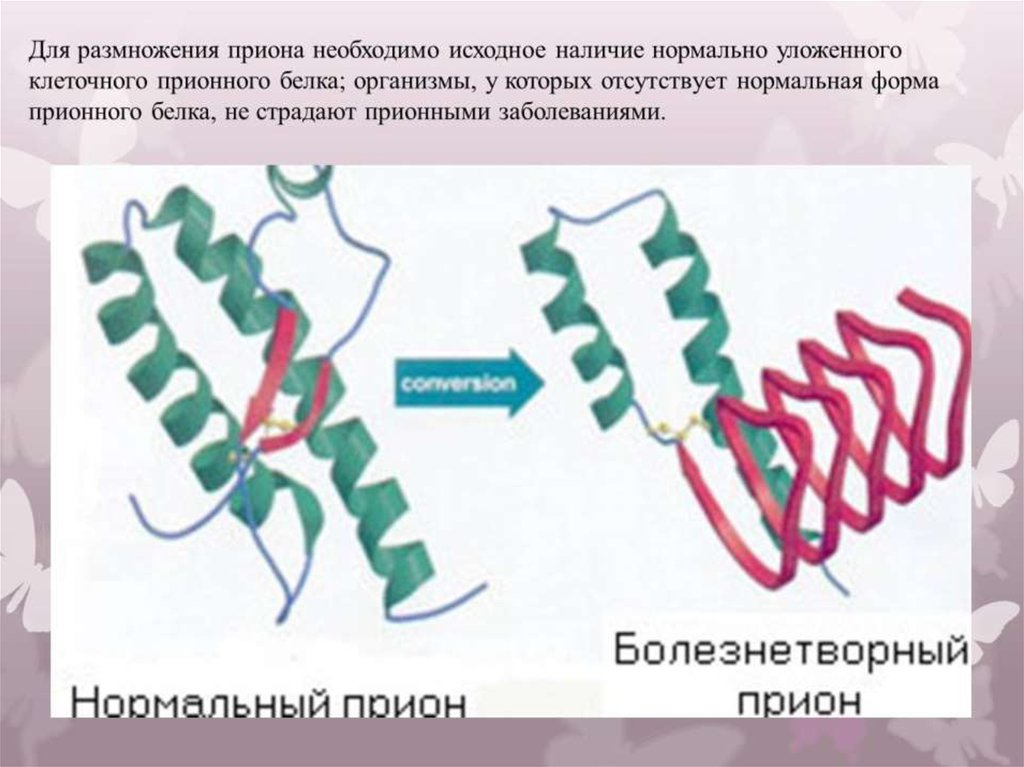
Способы заражения
В заключение поговорим о способах заражения. Их четыре. В первом и самом распространенном случае заболевание возникает как бы из ниоткуда. То есть жил себе человек, да вдруг взял и заболел. Этот путь возникновения болезни называется спорадическим и, кстати сказать, является наиболее распространенным. По нынешним представлениям, это происходит спонтанно под действием каких-то пока не установленных факторов.
Второй способ – наследственный. Некоторые виды болезней являются семейными и возникают из-за мутаций. В свою очередь, гены передаются потомству. Известно около 40 семей, страдающих фатальной бессоницей. Каждый десятый страдающий болезнью Крейтцфельдта – Якоба – страдает семейной формой этого заболевания.
Фото: M24.ru/Михаил Сипко
Третий способ – ятрогенный. Это означает, что заражение прионами произошло по вине медицинских работников при проведении каких-либо оперативных вмешательств. Однако описаны лишь несколько таких случаев, и все они произошло в 70-е годы прошлого века, когда о свойствах прионов еще никто не знал. Так, одна женщина заболела после того, как ей пересадили роговицу глаза от страдавшего болезнью Крейтцфельдта – Якоба мужчины.
Так, одна женщина заболела после того, как ей пересадили роговицу глаза от страдавшего болезнью Крейтцфельдта – Якоба мужчины.
А вот последний способ наиболее коварен и опасен. Дело в том, что человек восприимчив к прионам, которые поражают крупный рогатый скот. И при употреблении в пищу мяса больных животных заболевают и люди – у них развивается болезнь Крейтцфельдта – Якоба. В девяностые годы прошлого века настоящая эпидемия этого страдания разразилась в Англии.
Лечения пока нет. Однако ученые уже выяснили, что некоторые виды прионов разлагаются лишайниками, другим удалось описать особые антиприонные антитела (к инфекционным прионам).
Иными словами, перед исследователями стоит весьма непростая задача, которая не только поможет найти лекарство от тяжелых заболеваний, но и, возможно, поможет открыть секрет долголетия. Для этого нужно только одно – понять прионы.
наука болезни исследования заболевания прионы
30-летний проект NIAID раскрывает структуру инфекционных прионов
Изучение инфекционных заболеваний в исследовательской лаборатории может быть похоже на то, как семья собирает дома пазл, хотя и с бесконечным количеством частей. Десятки людей будут входить и выходить из исследовательской группы на протяжении многих лет, внося важный вклад в решение головоломки, но так и не найдя окончательной части.
Десятки людей будут входить и выходить из исследовательской группы на протяжении многих лет, внося важный вклад в решение головоломки, но так и не найдя окончательной части.
В январе 2021 года Эллисон Краус, доктор философии, нашла последний фрагмент в изучении молекулярной структуры инфекционного приона — головоломки, которую ее наставник Байрон Коги, доктор философии, начал 30 лет назад. Вместе они и большая группа ученых из Лабораторий Роки-Маунтин (RML) NIAID в Монтане и Университета Кейс Вестерн Резерв (CWRU) в Огайо решили первую трехмерную структуру приона с высоким разрешением. Они также получили беспрецедентные изображения другого прионного штамма, но с более низким разрешением. Определение структуры прионов и их разнообразия имеет основополагающее значение для того, чтобы помочь исследователям понять, как развиваются прионные заболевания, какие методы лечения могут быть нацелены на замедление и предотвращение болезни, а также как прионы соотносятся с белками, вызывающими родственные заболевания, такие как болезни Альцгеймера и Паркинсона.
Основа для разработки терапии
Прионные заболевания вызываются прионами, которые представляют собой поврежденные формы белка млекопитающих, называемого прионовым белком, или PrP. Коги считает, что их исследование «Сравнение структуры и штаммов инфекционных прионов млекопитающих с высоким разрешением», опубликованное 23 августа в Molecular Cell , предоставит коллегам первоначальный пример того, как нормальные молекулы PrP могут рефолдироваться и накапливаться, вызывая заболевание.
«Основываясь на структуре с высоким разрешением, которую мы видим, мы думаем, что патогенные стержневидные фибриллы PrP имеют липкие концы, которые захватывают нормальные молекулы PrP и распутывают их, как будто они прикрепляются к узкой змеевидной полоске липучки», — он сказал.
Этот 37-секундный анимационный видеоролик, созданный на основе тысяч точек данных образца, собранных с помощью электронного микроскопа, показывает трехмерную структуру инфекционного прионного белка, вращающегося и вращающегося под разными углами.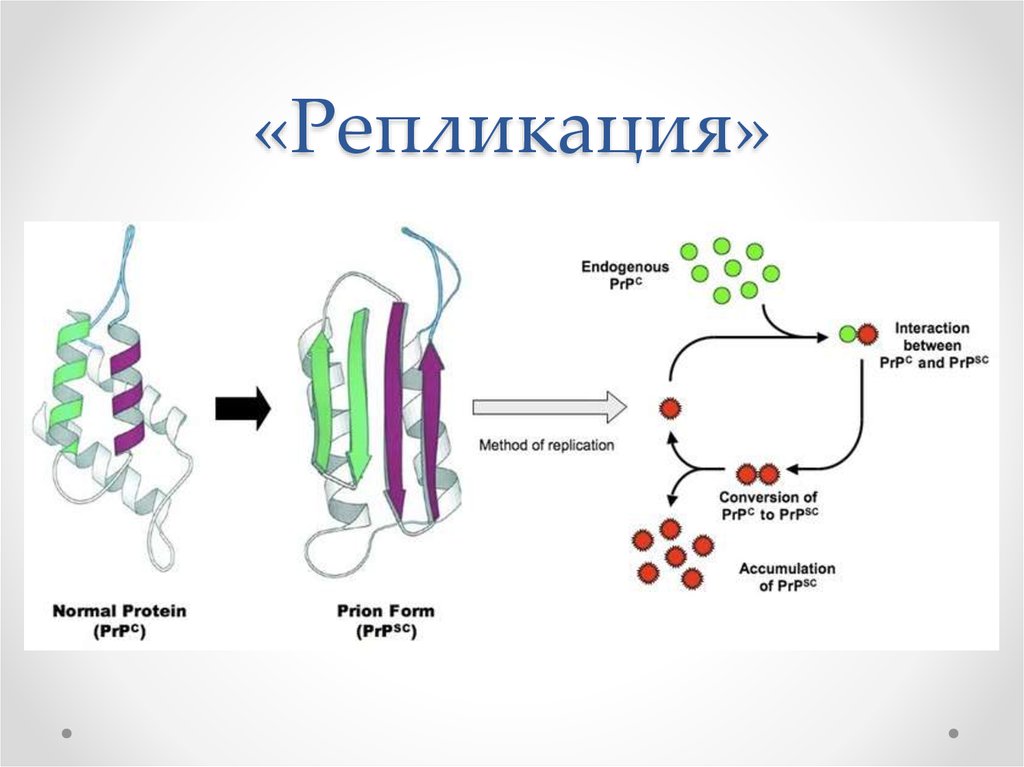 Обратите внимание, что наложенные друг на друга слои идентичных поврежденных белков образуют ступени инфекционной прионной фибриллы.
Обратите внимание, что наложенные друг на друга слои идентичных поврежденных белков образуют ступени инфекционной прионной фибриллы.
Предоставлено: NIAID
Раньше у ученых были только обоснованные предположения о структуре прионов, которыми они руководствовались в своей работе. Две ведущие теории были сосредоточены на структуре, представляющей собой либо ряд сложенных друг на друга штопорообразных молекул — модель бета-соленоида, либо то, что группа Коги предложила в 2014 году и теперь подтвердила свою правильность: модель PIRIBS. PIRIBS, что означает «параллельный межмолекулярный бета-лист», показывает блинообразные слои молекул PrP, образующих прионные фибриллы. Бета-слои представляют собой ключевую лестничную субструктуру таких фибрилл.
Сравнивая новые изображения двух штаммов прионов грызунов, Краус и Коги смогли увидеть, что они заметно различаются по структуре, что должно частично объяснять различные нейродегенеративные заболевания, которые они вызывают. Они признают, что эти первоначальные структуры не объяснят все штаммы прионов, и что им необходимо, как говорит Коги, «очеловечить понимание прионных структур».
Их структура с высоким разрешением представляет собой специфический адаптированный к хомякам штамм скрепи, прионного заболевания, которое естественным образом встречается у овец и коз. Второй штамм, который они проанализировали, представляет собой адаптированную для мышей форму скрепи. Теперь они анализируют, в какой степени прионные структуры различаются среди других прионных заболеваний. Определив первую детальную структуру высокоинфекционного приона, их работа также наводит на размышления о факторах, которые контролируют степень передачи различных патологических белковых агрегатов, таких как агрегаты болезни Альцгеймера и Паркинсона.
Обладая почти атомарной структурой приона, они могут начать оценивать изменения, происходящие при превращении нормального PrP в инфекционную форму приона. По их мнению, это позволит ученым определить этапы, на которых лечение может быть эффективным для замедления или предотвращения распространения болезни.
«Мы и другие группы ищем препараты для стабилизации нормальных молекул PrP и предотвращения их аномального повторного фолдинга», — говорит Коги.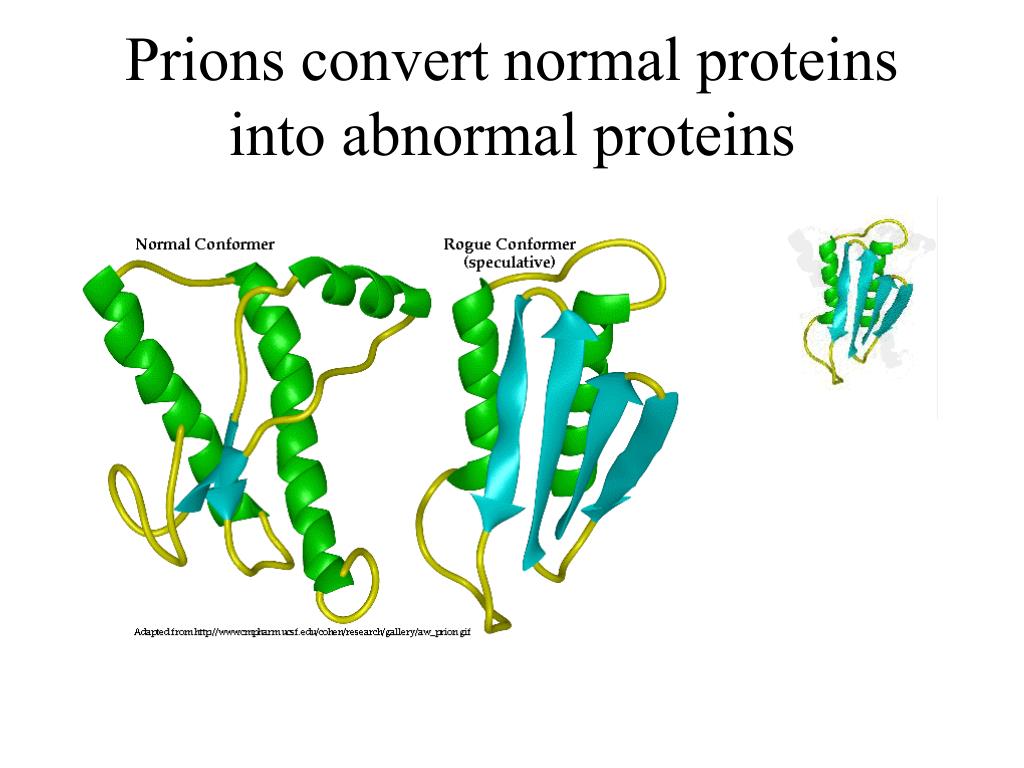 «Другие пытаются разработать вакцины, которые могли бы распознавать прионы и либо блокировать репликацию, либо помогать организму их устранять. Дальнейшая работа в этом направлении должна быть значительно облегчена точным знанием структуры прионов».
«Другие пытаются разработать вакцины, которые могли бы распознавать прионы и либо блокировать репликацию, либо помогать организму их устранять. Дальнейшая работа в этом направлении должна быть значительно облегчена точным знанием структуры прионов».
На этой графической анимации показано поперечное сечение и вид сбоку того, что ученые определили как физическую структуру инфекционного прионного белка. Они проверили слоистое образование, нанеся тысячи точек данных из образцов, просмотренных под микроскопом с высоким разрешением.
Кредит
CWRU и NIAID
На этой графической анимации показано поперечное сечение и вид сбоку того, что ученые определили как физическую структуру инфекционного прионного белка. Они проверили слоистое образование, нанеся тысячи точек данных из образцов, просмотренных под микроскопом с высоким разрешением.
Кредит:
CWRU и НИАИД
Прионные болезни
Прионные болезни — это заразные, неизлечимые и смертельные заболевания головного мозга. Их обсуждение может привести к путанице: у всех млекопитающих есть молекулы PrP, которые предположительно выполняют нормальные физиологические функции как отдельные единицы. По неизвестным причинам молекулы PrP могут рефолдироваться и организовываться в высокоструктурированные сборки, вызывающие инфекционные заболевания. Их называют прионами — инфекционной формой молекул PrP.
Их обсуждение может привести к путанице: у всех млекопитающих есть молекулы PrP, которые предположительно выполняют нормальные физиологические функции как отдельные единицы. По неизвестным причинам молекулы PrP могут рефолдироваться и организовываться в высокоструктурированные сборки, вызывающие инфекционные заболевания. Их называют прионами — инфекционной формой молекул PrP.
Во время заражения прионы могут размножаться в организме хозяина миллиард раз и более. Примечательно, что они делают это, не имея собственных генов, специфичных для инфекции, потому что все молекулы PrP, как нормальные, так и патогенные, кодируются одним и тем же геном-хозяином. Разница между этими формами PrP заключается, прежде всего, в фолдинге, а не в аминокислотной последовательности. Это означает, что ученые не могут легко отслеживать прионы, как вирусы и бактерии. Все прионные болезни смертельны: Коги говорит, что 1 микрограмм — одна миллионная часть грамма — может содержать 100 миллионов смертельных доз.
В 1990 году Коуи впервые увидел свидетельство бета-листов, которые в конечном итоге привели к их моделям структуры прионов PIRIBS. Он и его коллеги, используя очищенный образец скрепи, взятый у хомяков, были первыми учеными, получившими представление об этой аберрантной структуре. Но это был инфракрасный спектрометр, который измеряет поглощение инфракрасного света и не дает структурных подробностей.
Ученые часто используют адаптированные к грызунам штаммы скрепи в качестве прототипов родственных прионных заболеваний человека (болезнь Крейтцфельдта-Якоба), крупного рогатого скота (коровье бешенство), оленей и лосей (хроническое истощение). Исследователи опубликовали свое исследование бета-листов в прионах в 1991, и с тех пор Коги и многие молодые ученые, которых он наставлял, работали над улучшением этой работы. Штамм скрепи для хомяков 263K, использованный тогда, такой же, как тот, который использовался в их недавнем исследовании.
Криогенный EM
Краус прибыл в RML в 2011 году из Университета Альберты, чтобы начать постдокторскую стажировку, работая на Коги.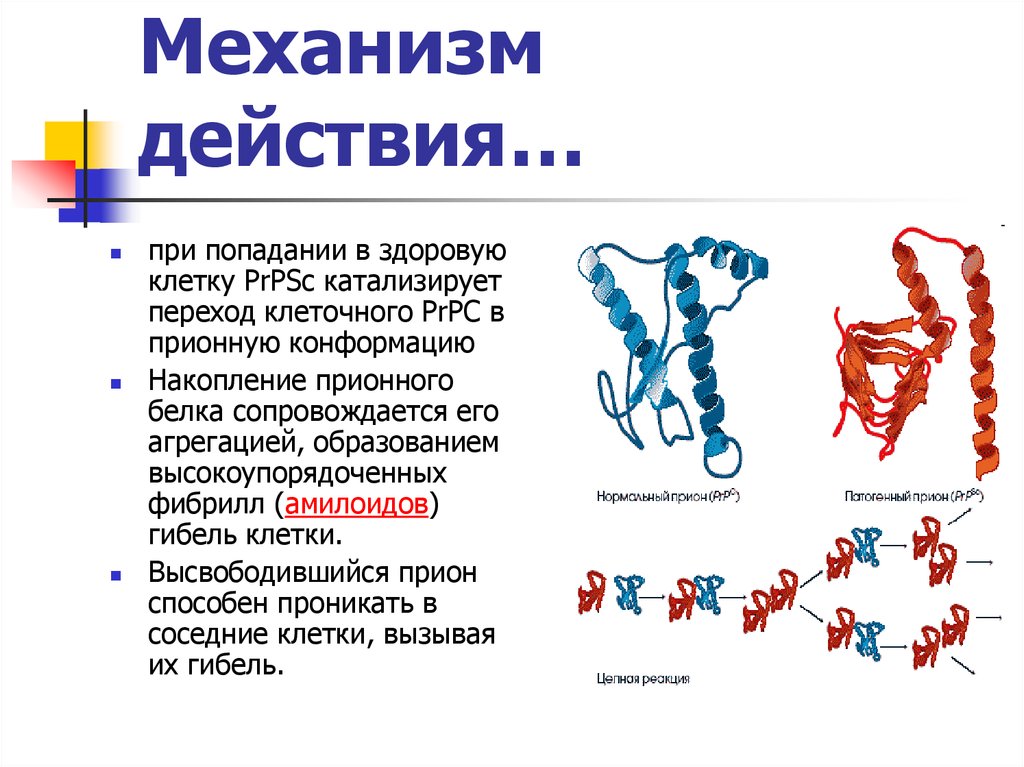 Она хотела узнать больше о том, как и почему прионные белки сворачиваются и могут вызывать заболевания. В начале стажировки он обсудил с Краусом проект прионной структуры. Работа будет основываться на использовании метода, известного как криогенная электронная микроскопия или крио-ЭМ, для создания изображений, показывающих структуру прионов. RML является центральным центром микроскопии NIAID, и в 2009 г.его группа получила титан Krios EM, который мог создавать изображения сверхвысокого разрешения: представьте, что вы видите атомы, из которых состоит золотая частица. В то время Titan Krios компании RML был одним из четырех таких микроскопов в Соединенных Штатах.
Она хотела узнать больше о том, как и почему прионные белки сворачиваются и могут вызывать заболевания. В начале стажировки он обсудил с Краусом проект прионной структуры. Работа будет основываться на использовании метода, известного как криогенная электронная микроскопия или крио-ЭМ, для создания изображений, показывающих структуру прионов. RML является центральным центром микроскопии NIAID, и в 2009 г.его группа получила титан Krios EM, который мог создавать изображения сверхвысокого разрешения: представьте, что вы видите атомы, из которых состоит золотая частица. В то время Titan Krios компании RML был одним из четырех таких микроскопов в Соединенных Штатах.
Вскоре после прибытия Титана Криоса Коги и руководитель ЭМ Бет Фишер начали обсуждать, как применить новую технологию в проекте прионной структуры. Они были уверены, что микроскоп может помочь ученым понять и смоделировать, как деформированные молекулы PrP, вызывающие скрепи, структурированы, размножаются и вызывают заболевание.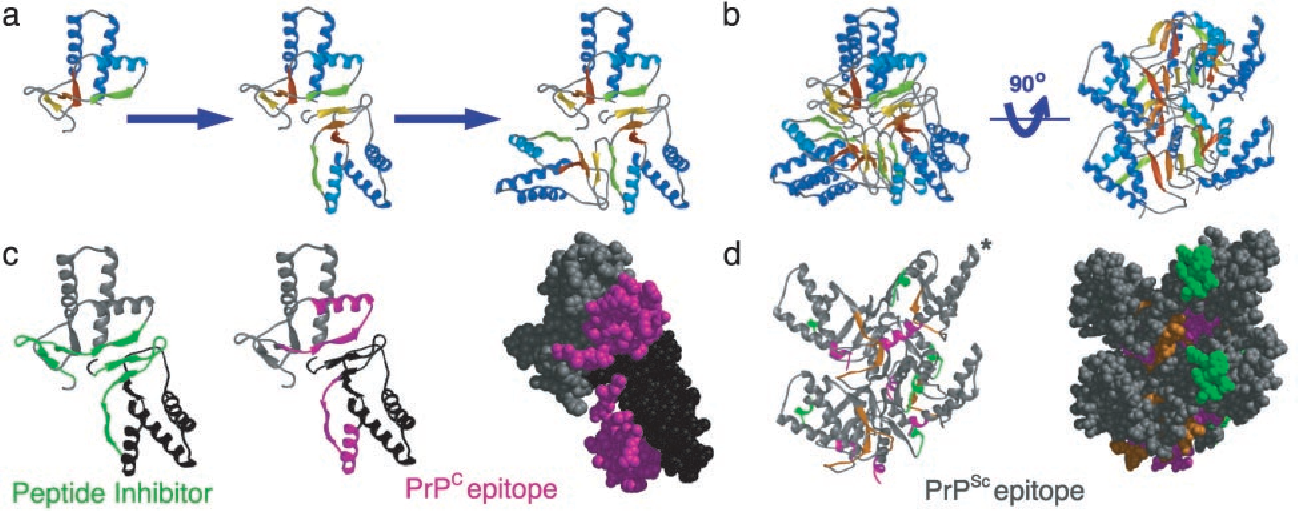
Они с радостью добавили Крауса. В течение следующих восьми лет она и другие члены команды RML EM — Синди Шварц, Форрест Хойт и Брайан Хансен — провели вместе бессчетное количество часов, выдвигая гипотезы, проверяя их, терпя неудачи, читая, выдвигая новые гипотезы, повторно проверяя, улучшая… снова и снова. Хотя целью было исследование структуры прионов с высоким разрешением, попутная работа выявила много важных новых открытий в отношении структурных особенностей прионов.
«Этот процесс был поистине эмпирической наукой, в ее самом жестком, с трудом заработанном виде», — вспоминает Краус.
День 2018 года выделяется среди многих ключевых моментов. «Впервые мы смогли увидеть математические доказательства повторяющихся единиц, которые образуют строительные блоки прионной фибриллы», — сказал Краус. «Никто никогда не визуализировал их… это было первое убедительное доказательство того, что, используя крио-ЭМ, мы действительно можем достичь разрешения, необходимого для изучения структуры».
«Resolution Revolution»
В 2019 году Краус открыла свою собственную независимую лабораторию в качестве доцента в CWRU, но, что важно, сотрудничество с лабораторией Коги в RML продолжалось, и теперь у Краус был доступ к более новому, улучшенному крио-ЭМ-прибору. Используя протоколы и конвейер, разработанные с командой в течение многих лет, Шварц готовил образцы для отправки Краусу для визуализации в CWRU, а Краус отправлял RML терабайт за терабайтом данных Хойту и Хансену для анализа и включения в разрабатываемую модель.
К осени 2020 года — во время пандемии — группы создали изображения прионов скрепи, которые были беспрецедентными по разрешению, и с использованием недавно разработанных вычислительных методов показали огромные перспективы для получения первой модели атомного уровня. Зная, что они были близки, Краус вспоминает, как работал день и ночь на протяжении большей части ноября и декабря 2020 года и вплоть до 2021 года. . «Это исследование и члены команды охватили очень много различных аспектов науки, от биологии прионов до биохимии прионов, технологии микроскопии, достижений в области программного обеспечения, математики, компьютерной графики, чтобы объединить все это».
Затем, в начале января 2021 года, последняя часть: «Когда были проанализированы массивные наборы данных, мы впервые поняли, что можем визуализировать в высоком разрешении структуру приона. Это был такой забавный звонок в Zoom. Мы провели день, исследуя, что мы предположили правильно, что у нас не было и о чем мы даже не думали».
«Наконец-то мы получили четкое представление о его подлом фото», — добавил Коги.
И теперь они знают, что еще не закончили головоломку. Краус и Коги говорят, что их первая полностью инфекционная прионная структура — одна из многих, которые понадобятся для понимания всего спектра этих смертоносных, необычных белковых патогенов.
Или, как выразился Краус, «последняя часть этой 30-летней головоломки — всего лишь первая часть нового проекта, нацеленного на эти аберрантные белковые структуры».
Артикул: A Kraus et al. Сравнение структуры и штаммов инфекционных прионов млекопитающих с высоким разрешением. Молекулярная ячейка . DOI: 10.1016/j.molcel.2021.08.011. (2021).
Молекулярная ячейка . DOI: 10.1016/j.molcel.2021.08.011. (2021).
Структура инфекционного приона
Винсент Раканьелло
Прионы — это не вирусы, это инфекционные белки, в которых отсутствуют нуклеиновые кислоты. Тем не менее, вирусологи всегда были очарованы прионами — они фигурируют в учебниках по вирусологии (куда еще их поместить?) и преподаются на уроках вирусологии. Я писал о прионах в этом блоге (пять статей, если быть точным — смотрите под P в оглавлении), и я очарован их биологией и передачей. Вот почему недавно решенная структура инфекционного прионного белка стала темой шестой статьи о прионах в вирусологическом блоге.
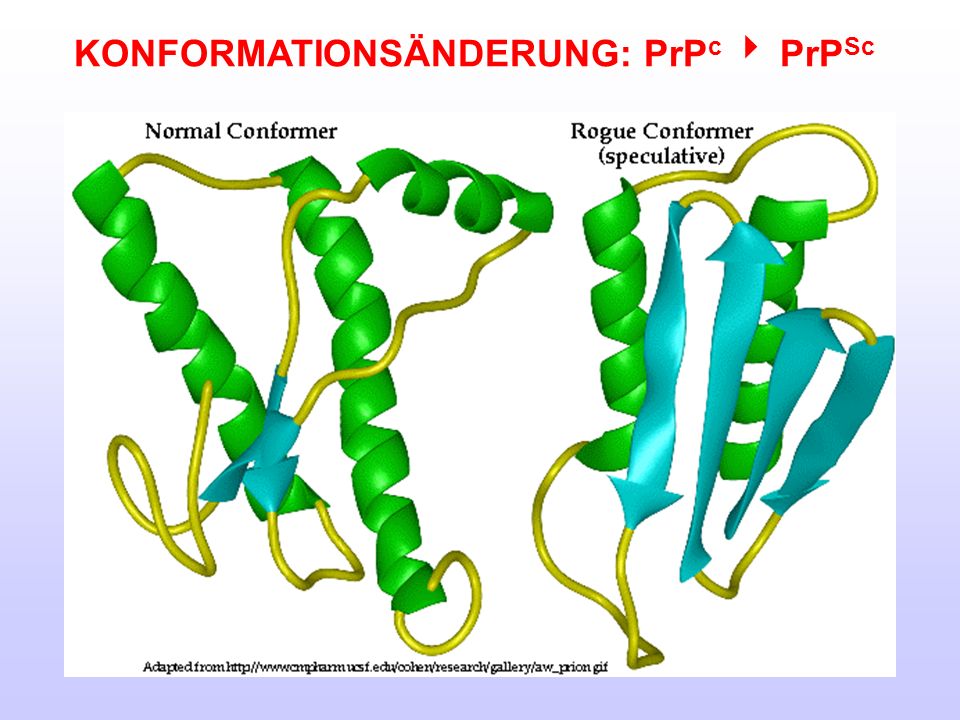
Губчатые энцефалопатии — это нейродегенеративные заболевания, вызванные неправильным сворачиванием нормальных клеточных прионных белков. Губчатые энцефалопатии человека можно разделить на три группы: инфекционные, семейные или генетические и спорадические, отличающиеся тем, как заболевание изначально приобретается. Во всех случаях патогенный белок представляет собой  кодируемый хозяином белок PrP C  с измененной конформацией, называемый PrP sc . В простейшем случае PrP Sc  преобразует обычный PrP C  белок в несколько копий патогенной формы (на иллюстрации).
Во всех случаях патогенный белок представляет собой  кодируемый хозяином белок PrP C  с измененной конформацией, называемый PrP sc . В простейшем случае PrP Sc  преобразует обычный PrP C  белок в несколько копий патогенной формы (на иллюстрации).
Структура нормального белка PrP C , решенная некоторое время назад, показала, что он в значительной степени является альфа-спиральным с небольшим содержанием бета-цепи. Структура белка PrP Sc неизвестна, поскольку он образует агрегаты и амилоидные фибриллы. Было высказано предположение, что белок PrP Sc имеет большее содержание бета-цепи, чем нормальный белок, но как это свойство может привести к репликации приона, было неизвестно. Чтобы полностью понять биологию этого необычного патогена, необходимо было четко определить структуру прионного белка.
Структура белка PrP Sc теперь определена с помощью криоэлектронной микроскопии и реконструкции изображения (ссылка на статью). Белок был очищен от трансгенных мышей, запрограммированных на продукцию формы белка PrP Sc , который не закреплен на клеточной мембране, а также является недостаточно гликозилированным. Белок вызывает заболевание у мышей, но он более гомогенен и образует фибриллярные бляшки, что позволяет использовать более щадящие методы очистки.
Белок был очищен от трансгенных мышей, запрограммированных на продукцию формы белка PrP Sc , который не закреплен на клеточной мембране, а также является недостаточно гликозилированным. Белок вызывает заболевание у мышей, но он более гомогенен и образует фибриллярные бляшки, что позволяет использовать более щадящие методы очистки.
Структура этой формы PrP 9Белок 0099 Sc показывает, что он состоит из двух переплетенных фибрилл (красные на изображении), которые, скорее всего, состоят из серии повторяющихся бета-цепей или ступенек, называемых бета-соленоидами. Структура дает представление о том, как патогенный прионный белок превращает нормальный PrP C в PrP Sc . Верхние и нижние ступени бета-соленоидов, вероятно, являются точками инициации водородных связей с новыми молекулами PrP C  — во многих белках с бета-соленоидами они заблокированы, чтобы предотвратить распространение бета-листов. После добавления к фибриллам концы будут служить для привлечения дополнительных белков, и цепь удлинится.