Содержание
Препарат от старения стволовых клеток успешно протестировали на мышах
Небольшие молекулы восстановили работу теломеразы и удлинили теломеры в культуре стволовых клеток пациентов с наследственным теломерным заболеванием. Вещества добавляли в воду мышей, которым пересадили стволовые клетки с аналогичными мутациями. В результате в этих клетках теломеразы стали работать нормально, а теломеры удлинились. Статья опубликована в журнале Cell Stem Cell.
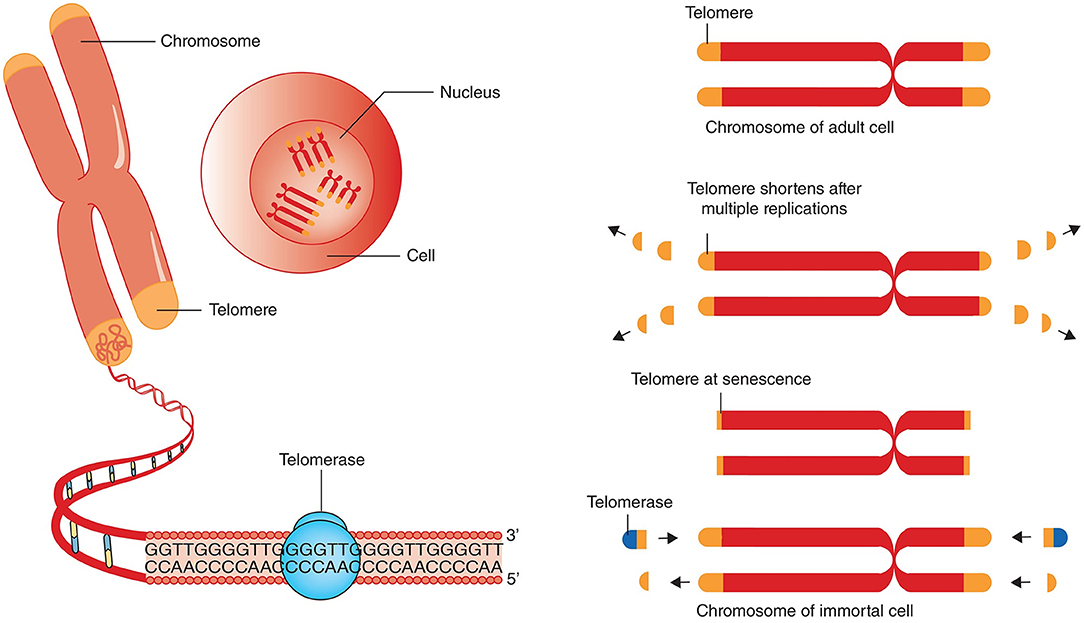
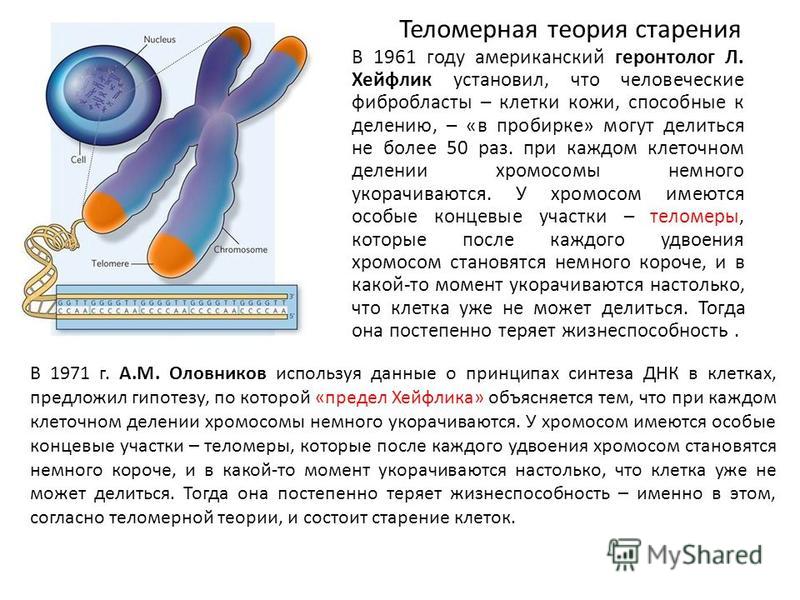
ДНК-полимеразы (ферменты, которые реплицируют ДНК) не умеют копировать концы молекул, и с каждым клеточным делением хромосомы становятся немного короче. Чтобы при этом не терялась важная информация, на концах хромосом находятся теломеры — некодирующие участки ДНК. У них есть еще и защитная функция — теломеры не дают разным хромосомам склеиваться между собой.
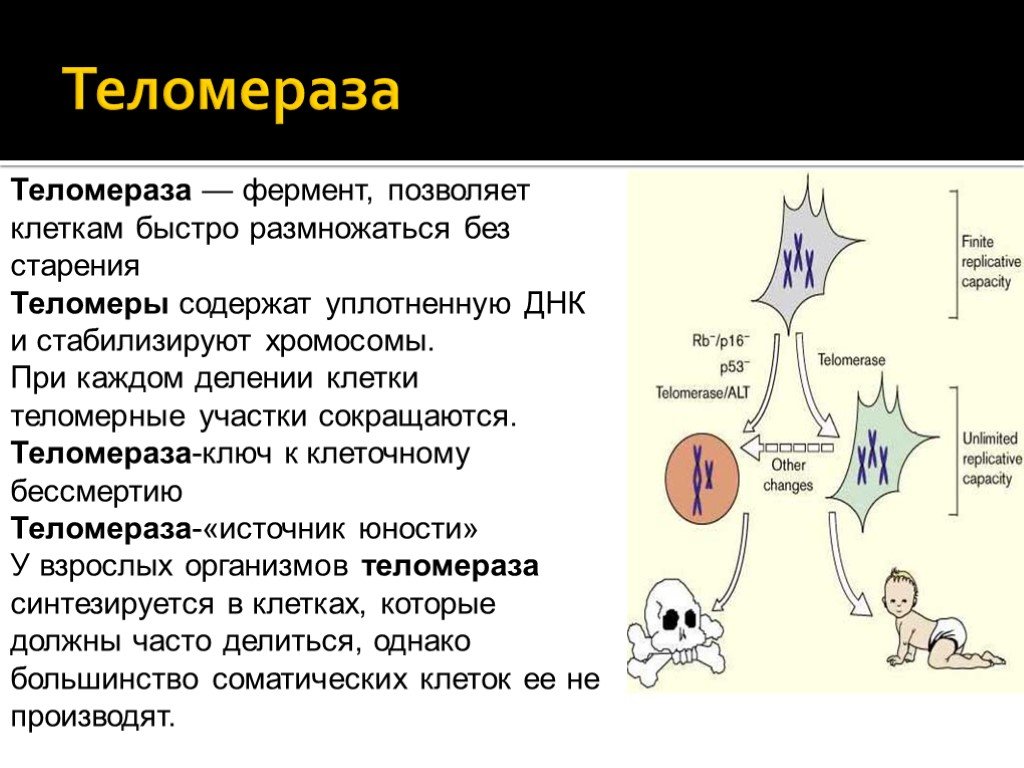
Длина теломер связана с клеточным старением: когда они становятся слишком короткими, клетка запускает механизм старения и гибели, чтобы избежать склеивания хромосом и повреждения генетического материала. Стволовые клетки делятся много (ведь это их основная функция), и у них есть фермент теломераза, который удлиняет теломеры и позволяет клеткам быть бессмертными.
Стволовые клетки делятся много (ведь это их основная функция), и у них есть фермент теломераза, который удлиняет теломеры и позволяет клеткам быть бессмертными.
Мутации, которые нарушают работу теломераз, вызывают ряд наследственных заболеваний. Один из механизмов таких болезней — мутации в гене рибонуклеазы, которая регулирует образование теломеразной РНК — шаблона, по которому фермент достраивает теломеры. Если выключить испорченный ген рибонуклеазы (PAPD5), образуются нормальные теломеразные РНК и теломеры удлиняются.
Ученые из США под руководством Сунита Агарвала (Suneet Agarwal) из Бостонской детской больницы нашли небольшую молекулу BCH001, которая специфически ингибировала мутантную рибонуклеазу. Действие вещества проверили на культуре стволовых клеток пациентов с врожденным дискератозом, наследственным теломерным заболеванием.
Кроме того, исследователи проверили действие на PAPD5 дигидрохинолизинонов — веществ, которые блокируют вирусы гепатита B. В недавнем исследовании обнаружили, что та же рибонуклеаза участвует в патогенезе гепатита B, и авторы работы предоложили, что дигидрохинолизиноны могут действовать на нее.
Затем вещества протестировали in vivo. Для этого в стволовых клетках костного мозга человека нарушили ген рибонуклеазы с помощью CRISPR/Cas9. Эти клетки пересадили мышам, а потом добавляли в их питьевую воду дигидрохинолизинон.
В культуре стволовых клеток, в которую добавляли BCH001, образовывалась нормальная теломеразная РНК, а теломеры удлинялись. При этом другие клеточные ферменты работали нормально. Дигидрохинолизиноны тоже восстанавливали производство теломеразной РНК в культуре стволовых клеток.
У мышей, которым были пересажены стволовые клетки костного мозга человека с испорченной рибонуклеазой, в результате орального приема дигидрохинолизинона в трансплантированных тканях увеличилось количество теломеразной РНК и удлинились теломеры. Препарат не вызвал побочных эффектов даже после месяцев приема.
В 2018 году ученые выяснили детальную структуру теломеразы. Понять строение фермента удалось с помощью криоэлектронной микроскопии.
Алиса Бахарева
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.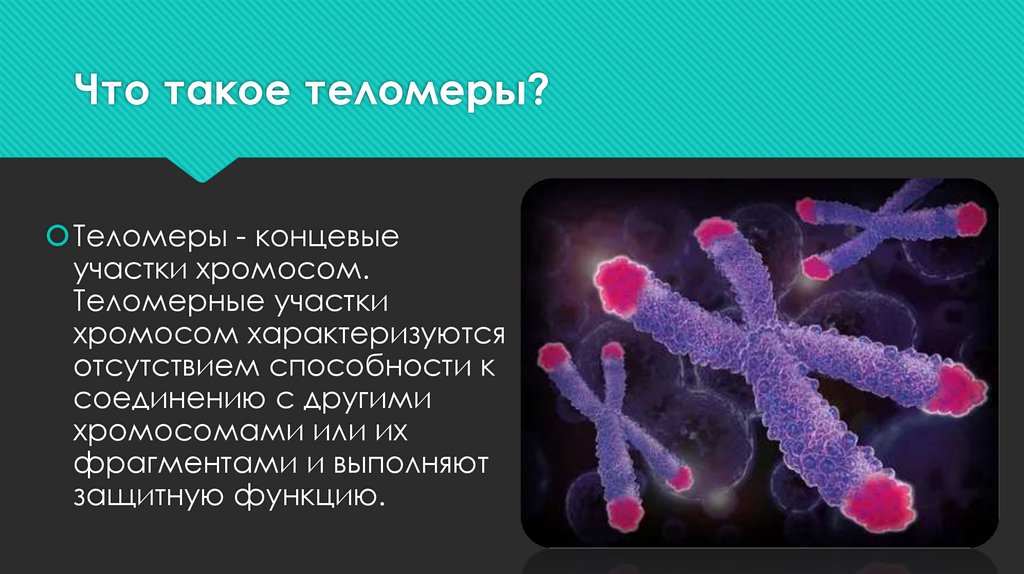
Фармкомпания из России создает лекарство, которое «затормозит» старение
Регистрация пройдена успешно!
Пожалуйста, перейдите по ссылке из письма, отправленного на
https://ria.ru/20161107/1480812008.html
Фармкомпания из России создает лекарство, которое «затормозит» старение
Фармкомпания из России создает лекарство, которое «затормозит» старение — РИА Новости, 07.11.2016
Фармкомпания из России создает лекарство, которое «затормозит» старение
Петр Белый, директор фармацевтической компании NCPharm, рассказал РИА Новости о том, как его корпорация создает препараты, которые могли бы замедлить или даже остановить процессы старения, и о том, какие проблемы они могут вызвать в обществе и в медицине.
2016-11-07T20:00
2016-11-07T20:00
2016-11-07T20:32
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/sharing/article/1480812008.jpg?14808323821478539957
москва
РИА Новости
1
5
4. 7
7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2016
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
открытия — риа наука, москва, старение
Открытия — РИА Наука, Москва, Наука, Старение
МОСКВА, 7 ноя – РИА Новости. Петр Белый, директор фармацевтической компании NCPharm, рассказал РИА Новости о том, как его корпорация создает препараты, которые могли бы замедлить или даже остановить процессы старения, и о том, какие проблемы они могут вызвать в обществе и в медицине.
7 ноября 2016, 19:21
Ученые выяснили, почему оксиданты сокращают жизньОксиданты ускоряют старение клеток нашего тела по той причине, что они повреждают «стройблоки», из которых собираются концевые участки хромосом при следующем делении клетки или при починке мутаций.
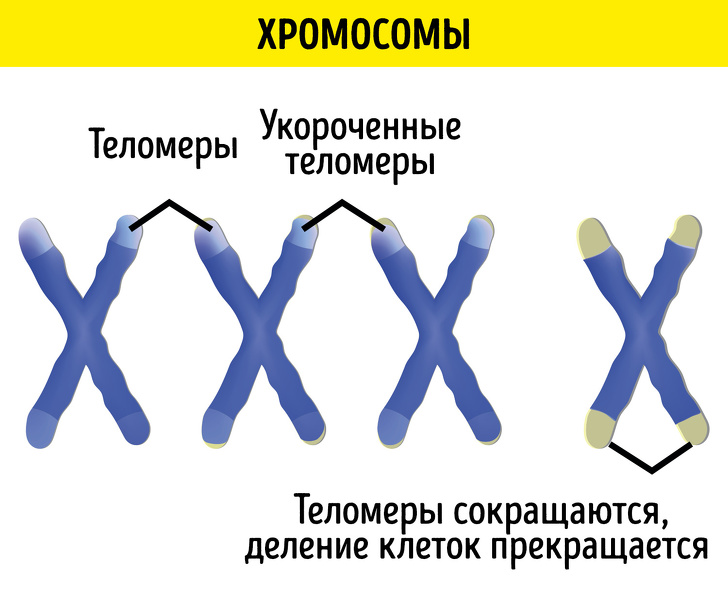
Разработка этих лекарств, по словам Белого, напрямую связана с теломерами — концевыми участками хромосом, которые имеются в ядре каждой клетки. Теломеры защищают ДНК от повреждений, и при каждом делении клетки они становятся короче. Когда их длины оказывается недостаточно для нового деления, клетка погибает или перестает делиться, переходя в особый «режим старости».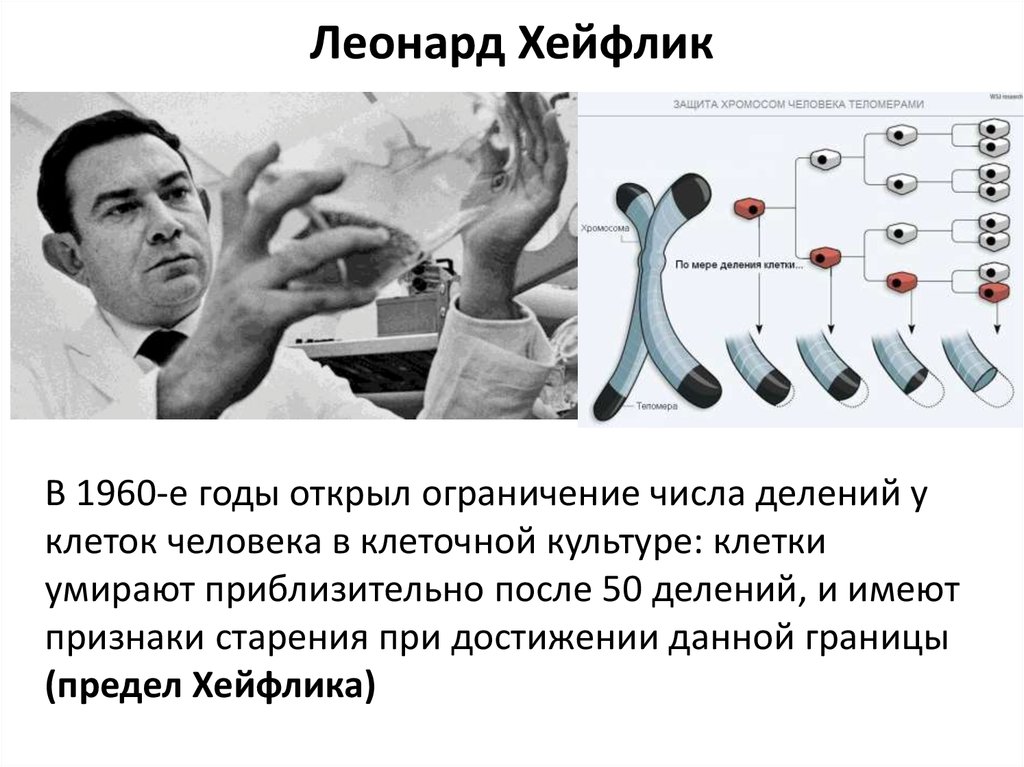
Подобный процесс происходит только во «взрослых» клетках тела – теломеры у стволовых клеток и в клетках зародышей постоянно обновляются особыми ферментами теломеразами, что позволяет им делиться неограниченное число раз и фактически быть бессмертными. В последние годы ученые активно ищут способы включения этих ферментов и «рычаги» управления их активностью для того, чтобы затормозить или даже остановить процесс старения и массовой гибели и дряхления клеток из-за потери ими способности делиться.
5 сентября 2016, 13:16
Ученые, возможно, раскрыли секрет самых долгоживущих людей на планетеИтальянские биологи обнаружили, что люди, дожившие до ста и более лет, обладают необычной сетью капилляров и других мелких сосудов, стареющей заметно медленнее, чем у остальных жителей Земли.
К примеру, в январе прошлого года биологи из Стэнфордского университета смогли «включить» теломеразы в культуре клеток в пробирке, используя специальные РНК-молекулы, удлинив теломеры примерно на тысячу «букв»-нуклеотидов.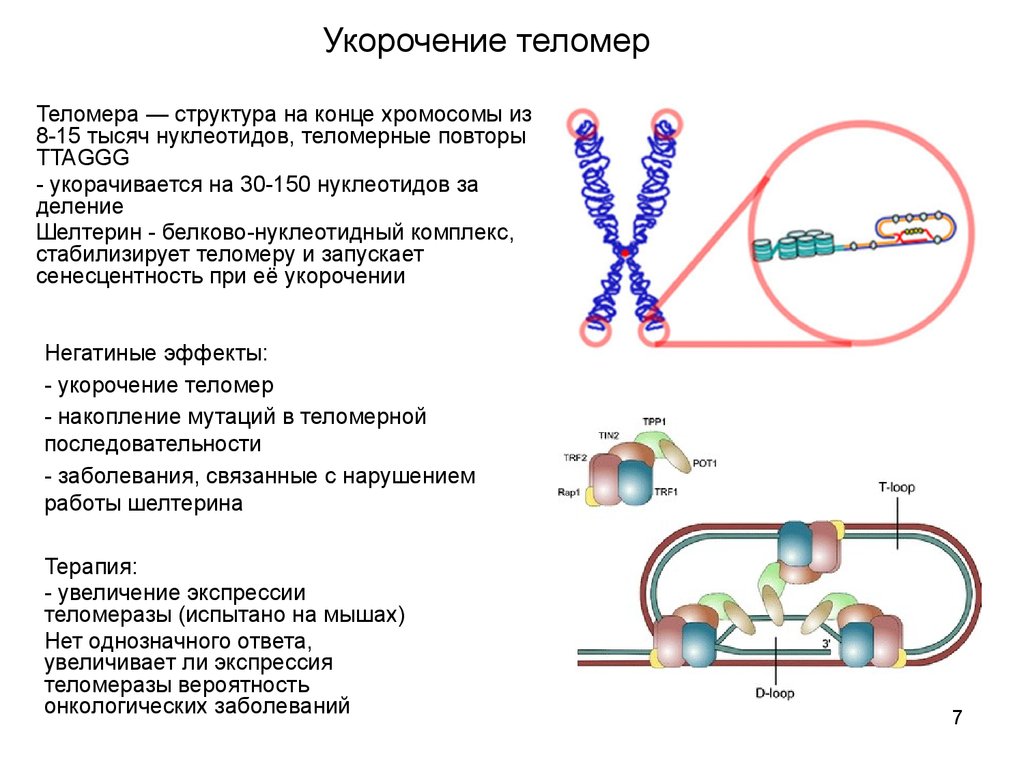 Это в некотором роде омолодило клетки и позволило им совершить еще около 30 делений после времени наступления старости.
Это в некотором роде омолодило клетки и позволило им совершить еще около 30 делений после времени наступления старости.
© Фото : K. AdamalaИзображение процесса репликации молекулы РНК
© Фото : K. Adamala
— Расскажите подробно, как именно вы планируете использовать теломеры для борьбы со старостью и ее внешними проявлениями?
— Если вы помните, Нобелевская премия 2009 года была присуждена за открытие, которое на самом деле совершил наш ученый, Алексей Оловников, но вопреки протоколу премию дали не ему, а тем людям, которые подтвердили его теорию и доказали существование теломер и выделили теломеразу как фермент.
Сейчас весь мир работает над тем, чтобы найти какой-то «спусковой механизм», который бы заставил теломеразу работать в соматических клетках тела человека. Почему это важно? Теломераза в естественном виде присутствует или в половых клетках, или в онкологических клетках. Это объясняет, почему из двух половых клеток может вырасти целый организм, и при этом они не становятся престарелыми. То же самое характерно и для раковых клеток – благодаря активным теломеразам они являются фактически бессмертными.
То же самое характерно и для раковых клеток – благодаря активным теломеразам они являются фактически бессмертными.
15 сентября 2016, 16:22
Голые землекопы станут ключом к бессмертию человека, считает биологАкадемик Владимир Скулачев рассказал РИА «Новости» о том, зачем Московский университет создал первую в России колонию капских голых землекопов, необыкновенно долгоживущих грызунов, и почему старение и смерть являются «бесполезной» для нас эволюционной программой, которую можно и нужно отключить.
С другой стороны, «нормальные» клетки могут делиться ограниченное число раз из-за того, что теломеры не обновляются и сокращаются. Соответственно, чем ближе мы к этому пределу и чем больше наше тело содержит престарелых клеток, тем больше риски вырождения и перерождения клеток, развития онкологических заболеваний, снижения иммунитета и всего прочего. Поэтому мы сегодня, как и наши коллеги за рубежом, пытаемся найти такое вещество, которое бы включало бы теломеразы в обычных клетках и заставляло их удлинять теломеры.
Подобная процедура удлинения теломер вызывает множество эффектов в разных органах тела, в том числе омоложение в некоторых тканях организма, которые подвержены естественной возрастной деградации – к примеру, в сетчатке глаза, в хрящевой ткани суставов, в половых железах.
С другой стороны, подобный прием может дать большую отсрочку, может быть даже ремиссию на всю жизнь, например, для носителей ВИЧ. Почему?
© Фото : из личного архива Петра БелогоЛаборатория, где разрабатывается лекарство для «торможения старости»
© Фото : из личного архива Петра Белого
— ВИЧ?
— Когда ВИЧ заражает человека, с ним начинают бороться целые «полки» лимфоцитов, тучных клеток, макрофагов и других компонентов иммунной системы. Этот полк появляется не просто так, а в результате деления клеток. В итоге иммуннокомпетентные клетки тела у таких людей исчерпывают пределы деления и становятся «престарелыми». Тогда вирус спокойно выходит и без всякого сопротивления размножается в организме.
С другой стороны, если мы будем искусственно поддерживать длину теломер у таких больных, то понятно, что ВИЧ в таком случае никогда не перейдет в СПИД. Это, конечно, не излечение вируса как такового, но пожизненная ремиссия, которая позволит таким людям жить полноценной жизнью и не умирать от неизлечимого заболевания.
30 июля 2016, 08:30
Ученые выяснили, почему зарядка продлевает жизньФизические упражнения и высокий уровень активности в старости могут продлевать жизнь человека по той причине, что они активируют ген NRF1, защищающий концы молекул ДНК от повреждений.
В принципе, последствий от того, что мы научимся управлять теломеразами, может быть огромное количество, и их фактически невозможно все перечислить. Что интереснее всего? И наши люди, занимающиеся разработкой таких препаратов, и их западные коллеги говорят, что часы, управляющие ходом нашей жизни, заключаются в другом, они скрыты где-то в структуре мозга. Если мы их откроем, то только тогда мы сможем обратить возраст вспять.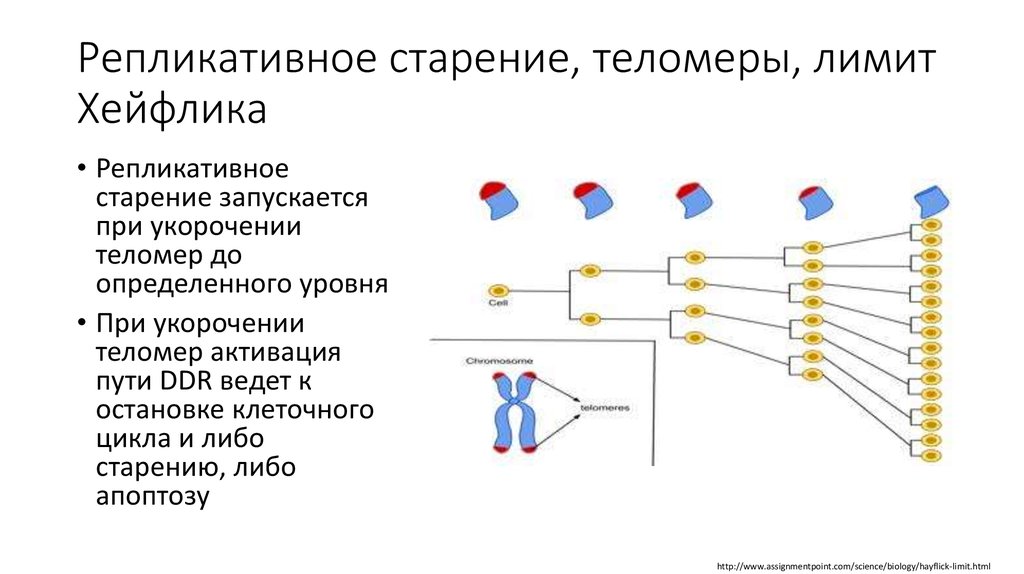
Все это кажется невероятным сегодня, однако так же на теломеры смотрели ученые до 1973 года, когда они были открыты в живых клетках. Этот же ученый говорит, что если мы их откроем и докажем их существование, мы совершим огромный рывок в увеличении продолжительности жизни, здорового молодого возраста.
— Как именно действует на теломеразы препарат, над которым работают ваши специалисты?
— Существует бесчисленное множество путей, которыми мы можем влиять на работу и длину теломер и экспрессию теломераз. Мы взяли и разобрались с тем, как работают препараты, созданные в прошлом американской компанией Geron (ТА-65), одной из первой работавшей над подобными веществами, и поняли, из чего состоит их продукт.
Второе, мы задумались о том, что произойдет, если соединить эти вещества с теми очень небольшими белковыми молекулами, над которыми на протяжении более 30 лет работали наши исследователи. Наши предварительные результаты показывают, что это очень и очень многообещающая комбинация.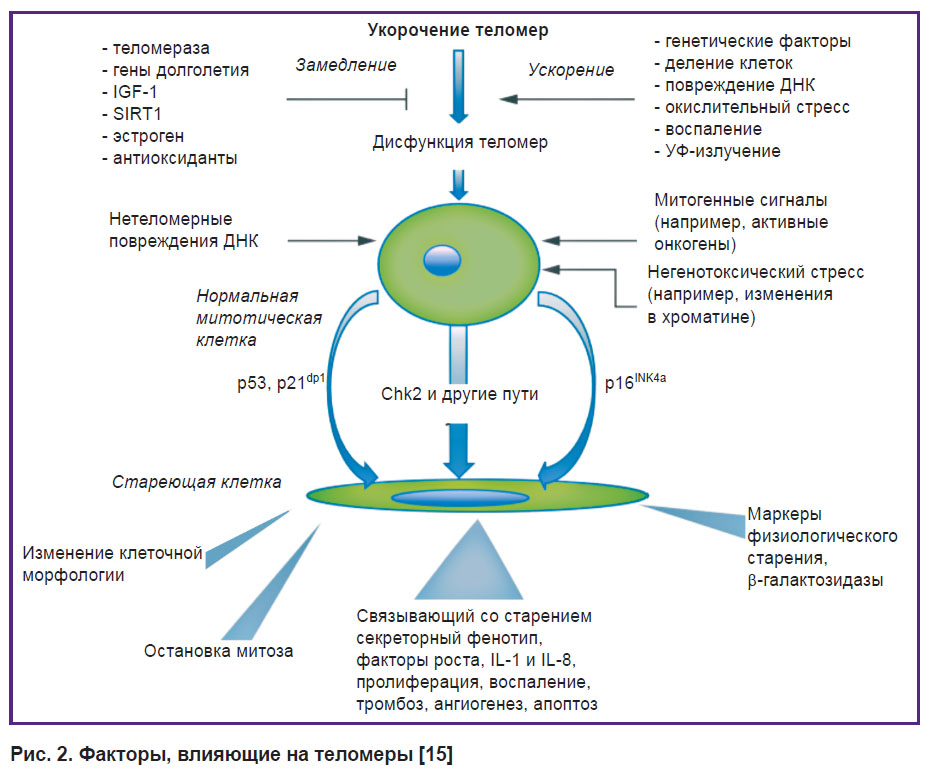
Сейчас мы работаем над тем, чтобы провести клинические исследования и разрабатываем систему инъекций, причиняющей минимальные неудобства человеку. Пока, конечно, у нас нет лекарства в готовой инъекционной форме, которую можно было бы показать публике.
Обе части нашего продукта уже проходили или проходят клинические исследования, и мы хотим показать, что их сочетание является большим шагом вперед, и на предварительных данных мы это видим. Здесь, как ни странно, наша наука успела уйти вперед, и то, что Нобелевку 2009 года дали фактически за русское открытие, показывает, что мы здесь что-то действительно имеем.
— Когда будет готов ваш препарат?
— Мы ожидаем, что он будет готов уже в ближайшее время, и что через два-три года мы получим регистрационное удостоверение. Сначала в России, а дальше уже будет сложнее из-за сложной регуляторной системы в США и Европе. В странах с менее строгим контролем все будет протекать гораздо быстрее.
5 октября 2009, 15:10
Скулачев: Нобелевский комитет «забыл» дать премию российскому биологуНобелевский комитет несправедливо «забыл» дать премию по медицине и физиологии российскому ученому Алексею Оловникову, впервые теоретически описавшему механизм работы теломер в клетках, присудив в то же время премию американским ученым, обнаружившим его на практике.
— Это будет лекарство или некая форма БАД?
— Вообще мы фармацевтическая компания, и в нашем портфолио более 100 лекарственных средств, у нас есть большой завод, тысячи рабочих, мы производим все виды препаратов. Поэтому история с БАДами для нас является исключением – нам хочется иметь на руках что-то, что мы могли бы использовать, и поэтому нам пришлось пойти таким путем и сделать простую сертификацию, чтобы иметь хотя бы какой-то легальный статус.
Но мы гордимся не этим – мы гордимся тем, что мы ведем реальные исследования и занимаемся доказательной медициной, мы разрабатываем новые формы лекарств, которых пока не применяются на практике. И в данном случае у нас есть очень перспективная медицинская разработка.
— Одной из причин того, почему клетки перестают делиться, является защита от рака. Если мы включим теломеразы, не повысит ли это вероятность развития онкологических заболеваний?
— Это вопрос номер один, который возникает всегда, когда мы обсуждаем последствия от включения теломераз.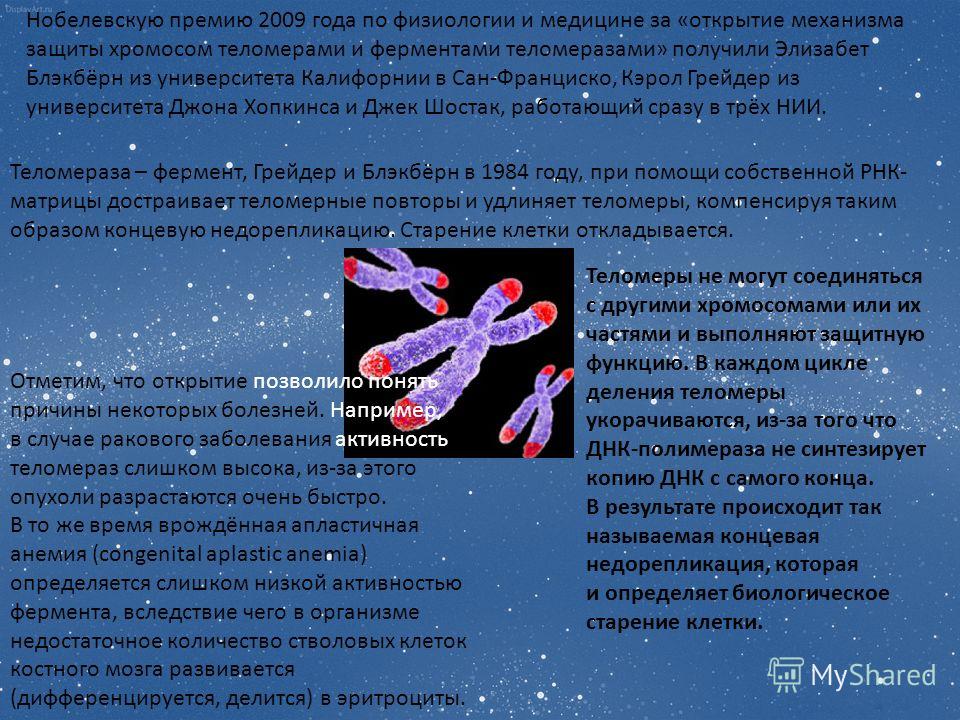 Здесь нужно понимать, что речь идет об очень небольшом сегменте состояний, когда такое возможно. Обычные клетки с нормальными теломерами не поменяют своей жизнедеятельности в том случае, если их теломеры удлинить. Наоборот, это, скорее всего, омолодит их и сделает их более энергичными.
Здесь нужно понимать, что речь идет об очень небольшом сегменте состояний, когда такое возможно. Обычные клетки с нормальными теломерами не поменяют своей жизнедеятельности в том случае, если их теломеры удлинить. Наоборот, это, скорее всего, омолодит их и сделает их более энергичными.
4 октября 2016, 11:04
Ученые: тяготы в детстве сокращают жизнь на клеточном уровнеЛишения и тяжелые испытания в детстве искусственно старят клетки человека, сокращая длину защитных участков на концах хромосом, оберегающих ДНК от повреждений.
Если клетка уже и так является раковой, то тогда у нее теломеры и так являются длинными, и она сама по себе будет бессмертной и без нашей помощи. Соответственно, у нас есть только те состояния, которые мы можем считать условно опасными – так называемые предраковые клетки, возвращение способности к делению которых может привести к опасным последствиям.
Этот вопрос беспокоил не одних нас, и опыты американских ученых показывают, что включение теломераз в таких клетках не приводит к увеличению числа новообразований при приеме того вещества, которое нас интересует.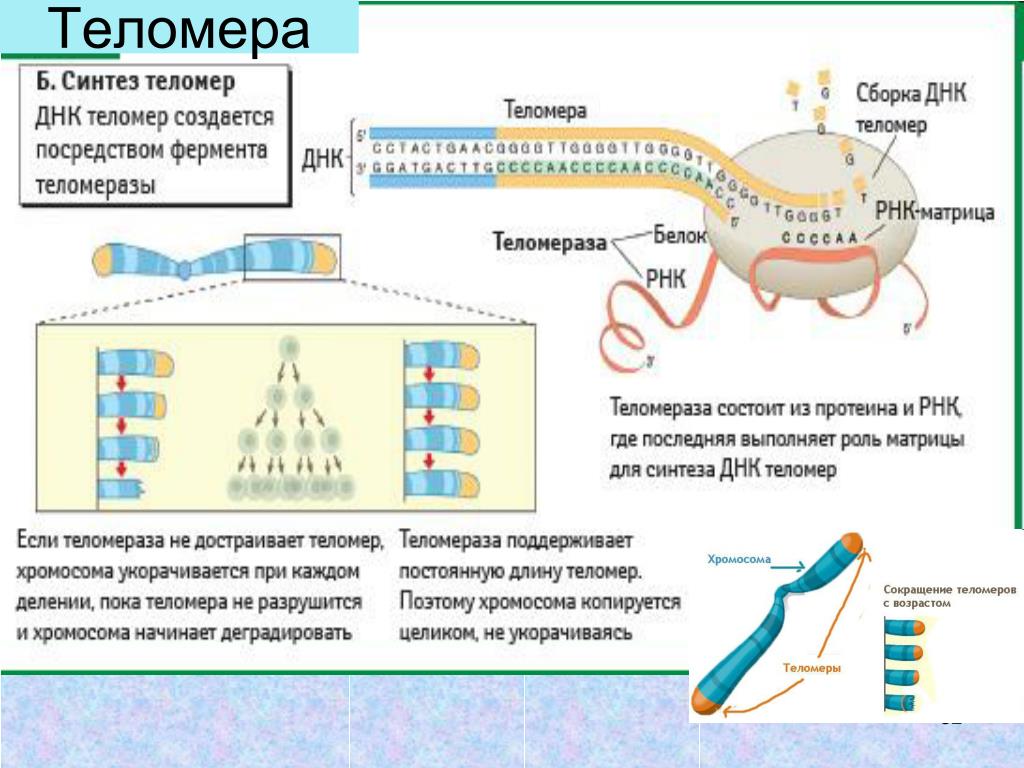 Поэтому мы считаем, что на этот вопрос уже есть ответ на общетеоретическим уровне, но конечно, тесты на онкогенность проводятся и при проверке любого лекарства, и для наших препаратов такие опыты тоже будут проводиться.
Поэтому мы считаем, что на этот вопрос уже есть ответ на общетеоретическим уровне, но конечно, тесты на онкогенность проводятся и при проверке любого лекарства, и для наших препаратов такие опыты тоже будут проводиться.
© Фото : Ghada M. Sharif/GeorgetownКультура раковых клеток в «перенаселенной» пробирке
© Фото : Ghada M. Sharif/Georgetown
— Многие перспективные лекарства и вакцины, особенно от ВИЧ и ряда других опасных болезней, часто работают в опытах на грызунах и приматах, но проваливаются в ходе клинических испытаний на добровольцах. Опасаетесь ли вы подобного исхода событий?
— У нас есть основания думать, что наши шансы в данном случае гораздо выше нормы по следующей причине: и тот, и другой компонент нашего препарата уже проверялся на человеке, и эти опыты показали интересные результаты. Мы добиваемся синергетического эффекта в том случае, когда уже есть задокументированные положительные эффекты в испытаниях на людях.
— Как отреагируют на появление таких лекарств представители церкви и различных религиозных конфессий? Совместимы ли подобные препараты с их духовными принципами?
— Если говорить конкретно о теломерах и наших веществах, то он не имеет глубокой философской подоплеки, о которой можно подумать.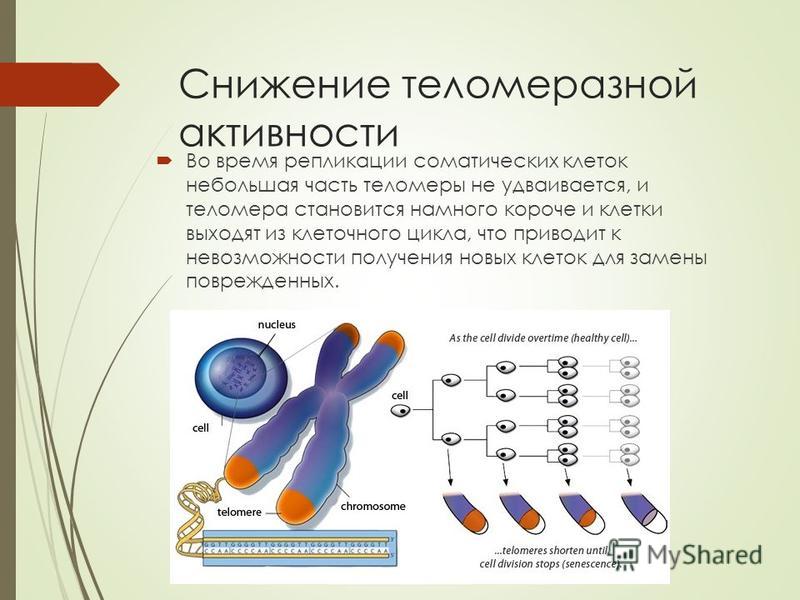 Скорее, подобные мысли могут возникнуть, если говорить и думать о тех структурах в мозге, которые сейчас пытаются найти ученые и о которых думал Оловников. В тех случаях мы действительно можем говорить о продлении жизни как таковой, на лишние 20-30 лет относительно средней продолжительности жизни человека.
Скорее, подобные мысли могут возникнуть, если говорить и думать о тех структурах в мозге, которые сейчас пытаются найти ученые и о которых думал Оловников. В тех случаях мы действительно можем говорить о продлении жизни как таковой, на лишние 20-30 лет относительно средней продолжительности жизни человека.
10 января 2012, 01:33
Длину жизни птицы можно узнать по длине хвостов ее хромосомБританские ученые научились вычислять примерную продолжительность жизни певчих птиц зебровых амадин по длине теломер — концевых участков на хромосомах.
Здесь, поскольку теломеры и их длина не являются в строгом смысле часами, отмеряющими наш срок на Земле, мы не можем говорить об этом. Теломеры управляют и являются индикатором не возраста человека в целом, а отдельных функциональных органов и тканей, в основном тех, которые подвержены возрастной деградации.
Соответственно, мы говорим не о том, что мы продлеваем жизнь, а о том, что мы существенно улучшаем качество жизни человека в рамках отмеренного ему срока. Иными словами, человек существенно дольше будет оставаться молодым и здоровым, но к сожалению или счастью, мы не меняем общий срок жизни.
Иными словами, человек существенно дольше будет оставаться молодым и здоровым, но к сожалению или счастью, мы не меняем общий срок жизни.
— В последние годы геронтологи активно спорят о том, есть ли какой-то предельный возраст человека, при достижении которого большинство из нас умирает. Насколько возможно перешагнуть через него?
— Пока геронтологи склоняются к тому, что 100-120 лет возраста являются пределом для человека. И пока никто еще не подошел к тому, чтобы увидеть то, что находится за этим рубежом. С другой стороны, мы можем констатировать следующее: за последние 70 лет средняя продолжительность жизни увеличилась на 20 лет.
18 октября 2016, 14:49
Ученые из США заключили новое пари о пределах жизни человекаДва ведущих американских геронтолога, Джей Ольшанский и Стивен Остэд, удвоили свои ставки в пари о том, что к 2150 году максимальная продолжительность жизни человека достигнет или не достигнет 150 лет.
Произошло это по целому ряду факторов, в том числе и благодаря неожиданным вещам, таким как появление антибиотиков. Тогда никто из нас не думал о том, что простое влияние на жизнь и развитие бактерий может так существенно отразиться на продолжительности жизни человека в целом. Средний возраст в 80 лет сейчас считается чем-то само собой разумеющимся в большинстве развитых и средне-развитых стран. И даже наше правительство сегодня задумывается о том, чтобы увеличить возраст выхода на пенсию.
Тогда никто из нас не думал о том, что простое влияние на жизнь и развитие бактерий может так существенно отразиться на продолжительности жизни человека в целом. Средний возраст в 80 лет сейчас считается чем-то само собой разумеющимся в большинстве развитых и средне-развитых стран. И даже наше правительство сегодня задумывается о том, чтобы увеличить возраст выхода на пенсию.
Соответственно, вопросы, касающиеся долгожителей, затрагивают не только жителей Японии и других регионов с самыми долгоживущими людьми в мире, а всех нас, по крайней мере, тех, кто имеет трехразовое питание и живет более-менее нормально в стране, где есть дороги и электричество. Нам хотя бы нужно адаптироваться к этой реальности, к 80 годам, и только потом думать о ста годах и больше. Мы только сделали большой рывок, но пока не видно биологических механизмов, которые позволили бы выйти на рубеж в 140-150 лет.
© AP Photo / Antonio Calanni, File Старейшая жительница земли Эмма Морано
© AP Photo / Antonio Calanni, File
Москва
Теломеры и старение — PubMed
Обзор
.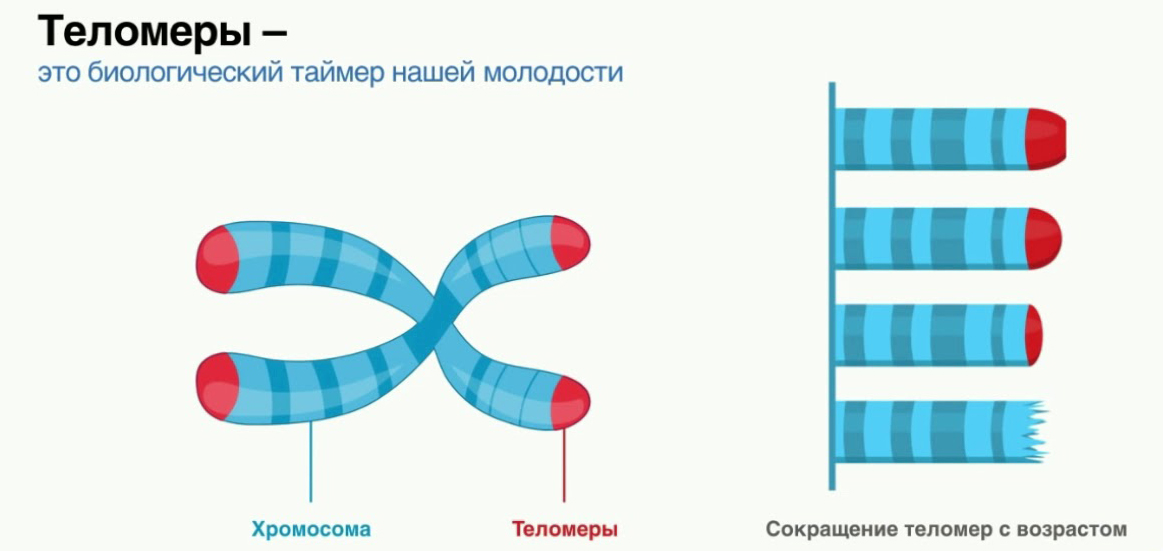 2008 г., апрель; 88 (2): 557-79.
2008 г., апрель; 88 (2): 557-79.
doi: 10.1152/physrev.00026.2007.
Джеральдин Обер
1
, Питер М Лансдорп
принадлежность
- 1 Лаборатория Терри Фокса, Агентство по борьбе с раком Британской Колумбии, Ванкувер, Британская Колумбия, Канада.
PMID:
18391173
DOI:
10.1152/физрев.00026.2007
Бесплатная статья
Обзор
Geraldine Aubert et al.
Физиол Рев.
2008 Апрель
Бесплатная статья
. 2008 г., апрель; 88 (2): 557-79.
2008 г., апрель; 88 (2): 557-79.
doi: 10.1152/physrev.00026.2007.
Авторы
Джеральдин Обер
1
, Питер М Лансдорп
принадлежность
- 1 Лаборатория Терри Фокса, Агентство по борьбе с раком Британской Колумбии, Ванкувер, Британская Колумбия, Канада.
PMID:
18391173
DOI:
10.1152/физрев.00026.2007
Абстрактный
Теломеры играют центральную роль в судьбе клеток и старении, регулируя клеточный ответ на стресс и стимуляцию роста на основе предыдущих клеточных делений и повреждений ДНК. По крайней мере, несколько сотен нуклеотидов теломерных повторов должны «закрывать» каждый конец хромосомы, чтобы избежать активации путей репарации ДНК. Восстановление критически коротких или «незакрытых» теломер с помощью теломеразы или рекомбинации ограничено в большинстве соматических клеток, и апоптоз или клеточное старение запускается, когда накапливается слишком много «незакрытых» теломер. Вероятность последнего увеличивается по мере уменьшения средней длины теломер. Средняя длина теломер устанавливается и поддерживается в клетках зародышевой линии, которые обычно экспрессируют высокие уровни теломеразы. В соматических клетках длина теломер очень неоднородна, но обычно уменьшается с возрастом, создавая барьер для роста опухоли, но также способствуя потере клеток с возрастом. Потеря (стволовых) клеток из-за истощения теломер обеспечивает сильный отбор аномальных и злокачественных клеток, процесс, которому способствует нестабильность генома и анеуплоидия, вызванная дисфункциональными теломерами.
По крайней мере, несколько сотен нуклеотидов теломерных повторов должны «закрывать» каждый конец хромосомы, чтобы избежать активации путей репарации ДНК. Восстановление критически коротких или «незакрытых» теломер с помощью теломеразы или рекомбинации ограничено в большинстве соматических клеток, и апоптоз или клеточное старение запускается, когда накапливается слишком много «незакрытых» теломер. Вероятность последнего увеличивается по мере уменьшения средней длины теломер. Средняя длина теломер устанавливается и поддерживается в клетках зародышевой линии, которые обычно экспрессируют высокие уровни теломеразы. В соматических клетках длина теломер очень неоднородна, но обычно уменьшается с возрастом, создавая барьер для роста опухоли, но также способствуя потере клеток с возрастом. Потеря (стволовых) клеток из-за истощения теломер обеспечивает сильный отбор аномальных и злокачественных клеток, процесс, которому способствует нестабильность генома и анеуплоидия, вызванная дисфункциональными теломерами. Решающая роль теломер в клеточном обновлении и старении подчеркивается пациентами с 50% нормальным уровнем теломеразы в результате мутации в одном из генов теломеразы. Короткие теломеры у таких пациентов связаны с различными заболеваниями, включая врожденный дискератоз, апластическую анемию, легочный фиброз и рак. Здесь рассматривается роль теломер и теломеразы в старении человека и связанных со старением заболеваниях.
Решающая роль теломер в клеточном обновлении и старении подчеркивается пациентами с 50% нормальным уровнем теломеразы в результате мутации в одном из генов теломеразы. Короткие теломеры у таких пациентов связаны с различными заболеваниями, включая врожденный дискератоз, апластическую анемию, легочный фиброз и рак. Здесь рассматривается роль теломер и теломеразы в старении человека и связанных со старением заболеваниях.
Похожие статьи
Короткие теломеры, возникающие в результате наследственных мутаций в гене теломеразы обратной транскриптазы, предрасполагают к различным злокачественным новообразованиям.
Hills M, Lansdorp PM.
Хиллс М. и др.
Энн Н.Ю. Академия наук. 2009 сен; 1176: 178-90. doi: 10.1111/j.1749-6632.2009.04565.x.
Энн Н.Ю. Академия наук. 2009.PMID: 19796246
Теломеры, стволовые клетки и гематология.

Лансдорп PM.
Лансдорп ПМ.
Кровь. 2008 г., 15 февраля; 111(4):1759-66. doi: 10.1182/blod-2007-09-084913.
Кровь. 2008.PMID: 18263784
Бесплатная статья ЧВК.Обзор.
Роль теломер и теломеразы в патологии рака и старения человека.
Шин Дж.С., Хонг А., Соломон М.Дж., Ли К.С.
Шин Дж. С. и др.
Патология. 2006 г., апрель; 38 (2): 103–13. дои: 10.1080/00313020600580468.
Патология. 2006.PMID: 16581649Обзор.
Теломеры, теломераза и биология гемопоэтических стволовых клеток.
Гринвуд MJ, Lansdorp PM.
Гринвуд М.Дж. и др.
Арх Мед Рез. 2003 г., ноябрь-декабрь; 34(6):489-95. doi: 10.1016/j.arcmed.2003.07.003.
Арх Мед Рез. 2003.PMID: 14734088
Обзор.
Множественные пути клеточного старения: роль репрессоров теломеразы.

Ошимура М., Барретт Д.С.
Ошимура М. и соавт.
Евр Джей Рак. 1997 г., апрель; 33 (5): 710-5. doi: 10.1016/S0959-8049(97)00090-7.
Евр Джей Рак. 1997.PMID: 9282109
Обзор.
Посмотреть все похожие статьи
Цитируется
Относительная длина теломер лейкоцитов и генетические варианты генов, связанных с теломерами, и роль уровней в сыворотке в возрастной макулярной дегенерации.
Вилкевичуте А., Гедвилайте Г., Банявичюс М., Кряучюнене Л., Залюнене Д., Добилиене О., Люткевичене Р.
Вилкевичуте А. и др.
Клетки. 2022 30 ноября; 11 (23): 3847. doi: 10.3390/ячейки11233847.
Клетки. 2022.PMID: 36497103
Бесплатная статья ЧВК.Укороченная длина теломер и суицидальные мысли при семейном биполярном расстройстве.

Мартинес Д., Лавебратт С., Миллишер В., де Хесус Р., де Паула В., Пирес Т., Мишелон Л., Камило С., Эстебан Н., Перейра А., Шаллинг М., Валлада Х.
Мартинес Д. и соавт.
ПЛОС Один. 2022 5 декабря; 17 (12): e0275999. doi: 10.1371/journal.pone.0275999. Электронная коллекция 2022.
ПЛОС Один. 2022.PMID: 36469522
Бесплатная статья ЧВК.Возможная связь длины теломер с продолжительностью сна. Предварительное экспериментальное исследование сицилийской группы долгожителей.
Айелло А., Аккарди Г., Али С., Карузо К., Чен М., Де Виво И., Лиготти М.Е., Скапанини Г., Давинелли С., Кандор Г.
Айелло А. и др.
Трансл Мед ЮниСа. 2021 23 декабря; 24 (1): 24-29. дои: 10.37825/2239-9754.1031. Электронная коллекция 2021.
Трансл Мед ЮниСа. 2021.PMID: 36447745
Бесплатная статья ЧВК.Влияние женских репродуктивных факторов на продолжительность жизни: систематизированный описательный обзор эпидемиологических исследований.

Костаниан С., Фарах Р., Саламе Р., Мейснер Б.А., Аун Бахус С., Сибай А.М.
Костаниан С. и др.
Геронтол Гериатр Мед. 2022, 18 ноября; 8:23337214221138663. дои: 10.1177/23337214221138663. электронная коллекция 2022 янв-дек.
Геронтол Гериатр Мед. 2022.PMID: 36419639
Бесплатная статья ЧВК.Обзор.
Старение эпителиальных клеток альвеолярного типа 2 и радиационно-индуцированный легочный фиброз.
Чжоу С., Чжу Дж., Чжоу П.К., Гу Ю.
Чжоу С. и др.
Front Cell Dev Biol. 2022 2 ноября; 10:999600. doi: 10.3389/fcell.2022.999600. Электронная коллекция 2022.
Front Cell Dev Biol. 2022.PMID: 36407111
Бесплатная статья ЧВК.Обзор.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- AI-29524/AI/NIAID NIH HHS/США
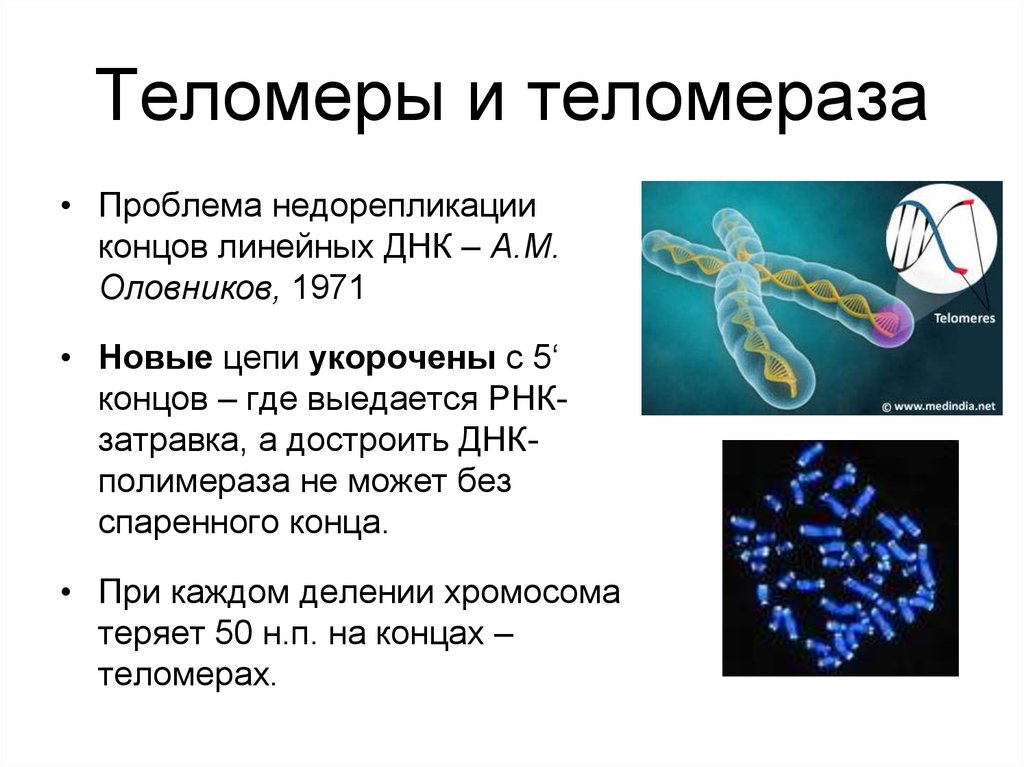
Теломеры и теломераза при клеточном старении (старение)
Теломеры и теломераза при клеточном старении (старение)
//
//
Теломеры — это фрагменты ДНК на концах хромосом,
защищают хромосомы от слипания друг с другом или запутывания, что
может привести к аномальному функционированию ДНК.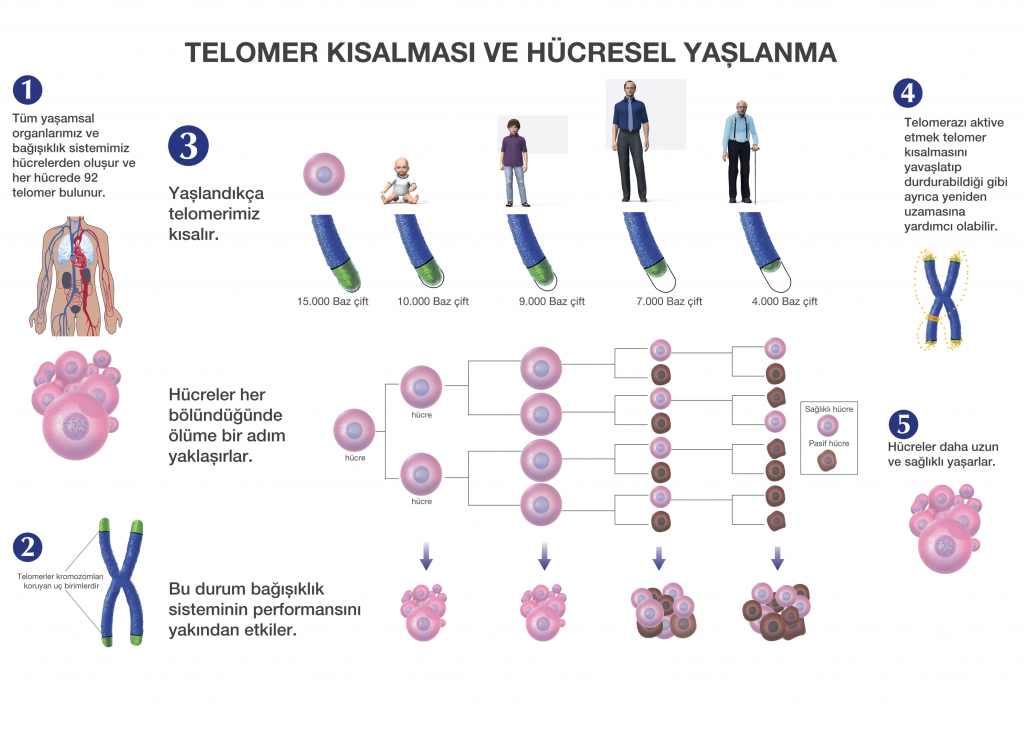 По мере репликации клеток
По мере репликации клеток
теломеры укорачиваются на концах хромосом, и этот процесс
коррелирует со старением или клеточным старением. Неотъемлемая часть этого процесса
теломераза — фермент, восстанавливающий теломеры и
присутствуют в различных клетках человеческого тела, особенно во время человеческого
рост и развитие. Теломеры и теломераза необходимы для
нормальное развитие животных, потому что они защищают ДНК при ее дублировании
копии самого себя.
В 1965 году исследование Леонарда Хейфлика в Институте Вистар в
Филадельфия, Пенсильвания, показала предел, до которого клетки
дублировать себя до старения. Хейфлик установил, что стало
называется пределом Хейфлика, который гласит, что клетка может делиться на сорок
до шестидесяти раз, прежде чем он не сможет дальше делиться и начнет стареть. В
В 1970-х ученые исследовали теломеры. Элизабет Блэкберн
изучала теломеры, пока работала в Йельском университете в Нью-Хейвене,
Коннектикут. Алексей Оловников в России связал теломеры с
клеточное старение и предел Хейфлика.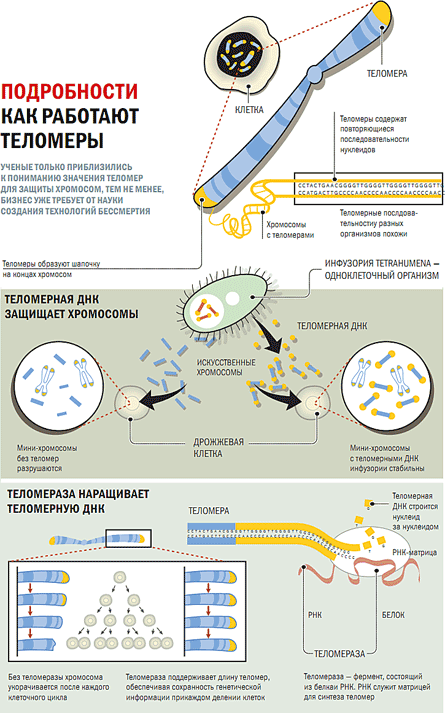 Хотя у Блэкберна
Хотя у Блэкберна
помог открыть теломеры в 1975, двумя годами ранее, в 1973 г.
Оловников выдвинул гипотезу о существовании теломеразы, длина
теломер и их связь с клеточным старением в своем исследовании
на пределе Хейфлика. Не зная об исследованиях Оловникова, Блэкберн
и Джозеф Г. Галл независимо друг от друга обнаружили повторяющуюся последовательность ДНК.
на конце хромосом дрожжей, Tetrahymena
термофила . Блэкберн и Галл опубликовали результаты
свои исследования в 1978 году. В 1982 году Блэкберн, затем в Университете
Калифорния в Беркли, штат Калифорния, сотрудничал с Джеком У.
Шостак в Гарвардской медицинской школе в Бостоне, штат Массачусетс.
Пара изолировала и клонировала теломеры в Тетрагимена ДНК. Блэкберн,
с помощью своей ученицы Кэрол Грейдер, затем определила
теломеразы в 1984 г. и выделил ее из Tetrahymena в 1989 г.
Блэкберн, Джек Шостак и Кэрол Грейдер получили Нобелевскую премию.
в физиологии или медицине в 2009 году за их работу по выявлению
и выделить теломеры и теломеразу.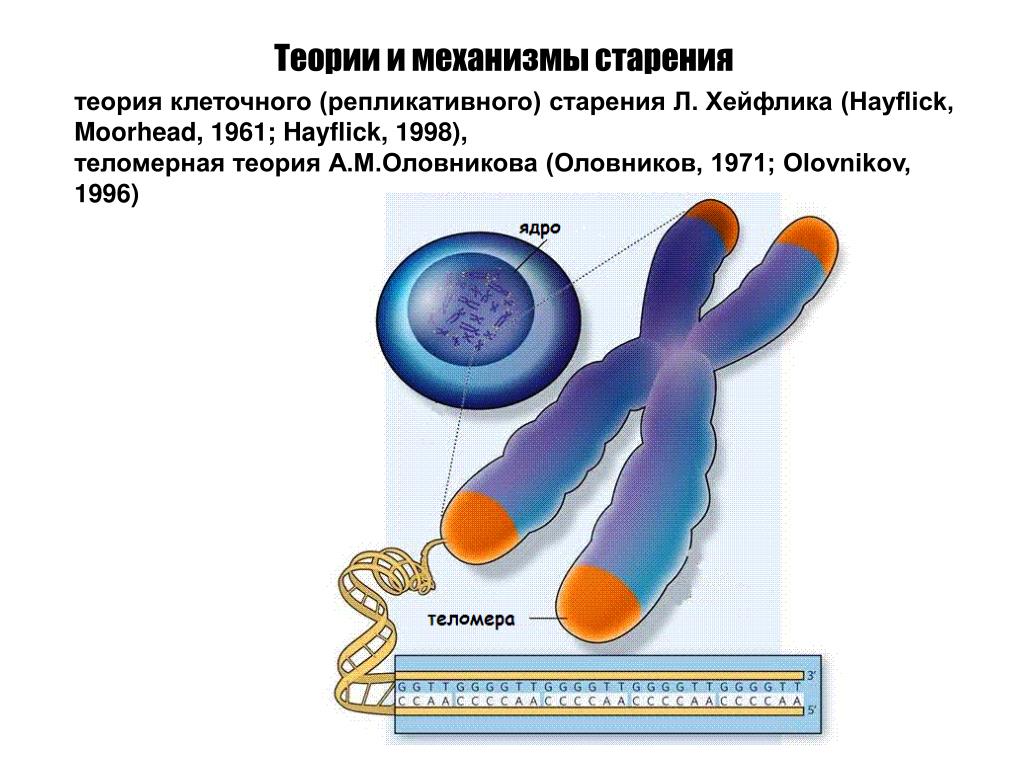
Блэкберн и другие обнаружили, что клетки стареют, когда
длина теломер в клетках укорачивается. Каждый раз, когда ячейка
реплицируется, конец нити ДНК или теломера сжимается в
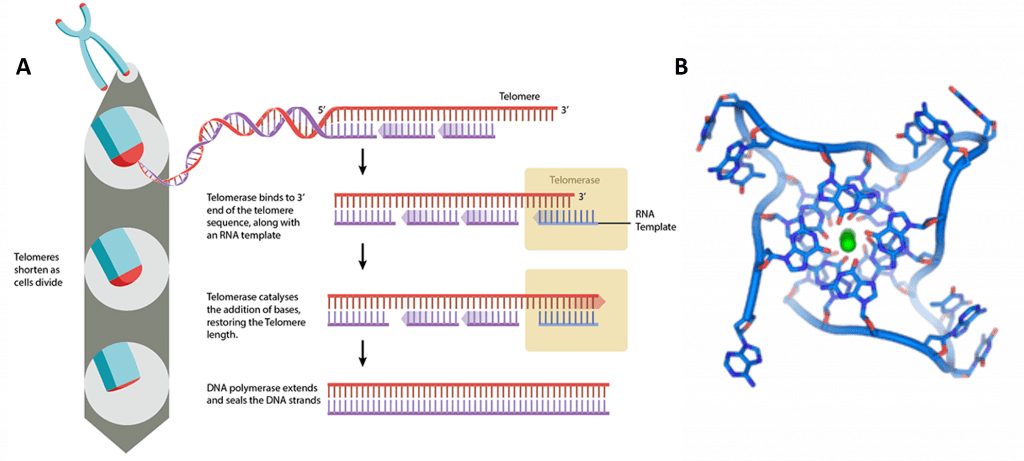
длина. Теломеры сокращаются при репликациях, потому что фермент
которая реплицирует ДНК, ДНК-полимераза, работает только в одном конкретном
направление на цепи ДНК. Он создает то, что называется ведущим и
отстающая цепь дупликации. Ведущая нить получает свое
название потому, что ДНК-полимераза постоянно движется в одном направлении и
реплицирует ДНК до тех пор, пока не завершит цепочку ДНК без каких-либо разрывов. Отстающие
цепь состоит из отдельных фрагментов ДНК, созданных ДНК
полимераза, называемая фрагментами Окадзаки, которые позже соединяются вместе
с помощью фермента ДНК-лигазы для создания одной непрерывной цепи. Название
отстающая нить возникает из-за того, что она отстает от ведущей
прядь, так как запечатывание отстающей или ведущей пряди может занять больше времени
вместе отдельные фрагменты ДНК. ДНК-полимераза отсоединяется
ДНК-полимераза отсоединяется
из ДНК на конце отстающей цепи и оставляет пространство, которое
имеет длину несколько нуклеотидов. Теломераза обычно заполняет
разрыв на конце ДНК после отрыва полимеразы от
Это.
Теломераза, фермент, восстанавливающий теломеры, существует в
количества в развивающихся организмах и в эмбриональных стволовых клетках. Некоторые
клетки имеют более высокую активность теломеразы, чем другие. В качестве
человек развивается и клетки реплицируются с большей частотой, избыток
теломераза используется и в дальнейшем восполняется лишь в минуту
количества. В конце процесса ДНК
репликации, без теломеразы для заполнения пробелов новой цепи DAN, теломеры укорачиваются с каждым клеточным делением.
Согласно Блэкберну, лимит Хейфлика является результатом
уменьшение длины теломер. Уменьшение длины теломер также приводит к
хромосомные аномалии, приводящие к генетическим мутациям
код, мутации, которые могут вызвать рак и дальнейшее старение человека.
Однако слишком много теломеразы также может привести к раку, помогая
клетки, чтобы стать функционально бессмертными, избегая предела Хейфлика. Бессмертные клетки могут нести
Бессмертные клетки могут нести
мутации в нерепарированных участках ДНК, и они проходят
раковые мутации в другие клетки путем репликации.
Ученые продолжили исследования теломеразы, активности теломер,
и клеточное старение после экспериментов Блэкберна в
1980-е годы. Ученые изучили, как факторы окружающей среды могут влиять на
длины теломер и, как следствие, клеточного старения. В 2008,
Джеральдин Обер и Питер Лангсдорп в лаборатории Терри Фокса в
Ванкувер, Канада, опубликовал исследование, показывающее, что клетки реплицируются.
в ответ на мутации в генетическом коде или в ответ на стресс. Обер и
Лангсдорп показал, что клетка будет реплицироваться, чтобы попытаться
восстановить поврежденную ДНК и, в свою очередь, укоротить теломеры.
В 2012 году Блэкберн, Джу Линь и Элисса Эпель из Университета
Калифорния в Сан-Франциско, штат Калифорния, показали влияние образа жизни на длину теломер и
клеточное старение у человека. Они обнаружили, что стресс, питание и
личность влияет на длину теломер и фермента теломеразы
активность. Они определили стресс как неблагоприятные жизненные события, такие как смерть.
Они определили стресс как неблагоприятные жизненные события, такие как смерть.
в семье или у хронически больных детей, и они обнаружили, что
личность также влияет на то, как человек воспринимает стрессовые события.
Авторы отмечают, что те, кто воспринимал события как менее
стресс, чем ожидали исследователи, имел более длинные теломеры.
длины по сравнению с людьми, которые воспринимали события как более
напряженнее, чем ожидали исследователи. Поведение такое
поскольку курение или употребление в пищу переработанного мяса также коррелирует с более коротким, чем обычно,
длины теломер. Также те, кто принимал витамин С или Е
добавки имели более длинные, чем обычно, длины теломер. Результат
Эксперимент Блэкберн и ее команды подтвердил, что окружающая среда
факторы влияют на длину теломер.
Некоторые люди критиковали исследования теломер. Гарри Рубин из Университета г.
Калифорния в Беркли утверждала, что исследователи, изучавшие теломеры в связи с раком, иногда дают подозрительные данные.
Другие утверждали, что ученые уделяют слишком много внимания
исследование теломер, когда они должны также изучать другие вовлеченные факторы
в клеточном цикле.
- Обер,
Джеральдин и Питер М. Лангсдорп «Теломеры и старение».
Физиологические обзоры 88 (2008): 557–79. http://physrev.physiology.org/content/physrev/88/2/557.full.pdf (по состоянию на 17 февраля 2015 г.). - Блэкберн, Элизабет Х. и Джозеф Г. Галл. «Тандемный
повторяющаяся последовательность на концах внехромосомной
гены рибосомной РНК у Tetrahymena». Journal of Molecular
Биология 120 (1978): 33–53. - Грейдер, Кэрол В. и Элизабет Х. Блэкберн. «теломерный
последовательность в РНК теломеразы Tetrahymena, необходимая для
синтез теломерных повторов». Природа 337 (1989):
331–7. - Хейфлик, Леонард. «Ограниченная продолжительность жизни человека in vitro
штаммы диплоидных клеток». Experimental Cell Research 37
(1965): 614–36. - Хейфлик, Леонард и Пол С.
 Мурхед. «Сериал
Мурхед. «Сериал
культивирование штаммов диплоидных клеток человека». Experimental Cell
Research 25 (1961): 585–621. - Цзян, Лицзин. «Дегенерация в миниатюре: история клеточного
Исследования смерти и старения в двадцатом веке», докторская диссертация,
Университет штата Аризона, , 2013 г. http://repository.asu.edu/
вложения/114558/content/Jiang_asu_0010E_13292.pdf
(По состоянию на 6 июня 2014 г.). - Лин, Джу, Элиссас Эпель и Элизабет Блэкберн. «Теломеры
и факторы образа жизни: роль в клеточном старении». Мутация
Исследование 730 (2012): 85–9. - Нобелевская премия. «Нобелевская премия по физиологии и медицине
2009. Nobel Media. http://www.nobelprize.org/nobel_prizes/medicine/laureates
/2009/ (По состоянию на 5 октября 2013 г.). - Оловников Алексей Михайлович «Теория маргинотомии.
неполное копирование края матрицы при ферментативном синтезе
полинуклеотиды и биологическое значение явления».
Журнал теоретической биологии 41 (1973): 181–90.
- Рубин, Гарри. «Теломераза и клеточная продолжительность жизни: прекращение
дебаты?» Nature Biotechnology 16 (1998): 396–7. - Штраус, Эвелин. «Премия Альберта Ласкера за особые
Достижения в медицинской науке». Фонд Ласкера. http://www.laskerfoundation.org/awards/2006_s_description.
htm (по состоянию на 20 октября 2013 г.). - Шостак, Джек В. и Элизабет Х. Блэкберн. «Клонирование дрожжей
теломеры на линейных плазмидных векторах». Cell 29 (1982):
245–55.
Бартлетт, Зейн, «Теломеры и теломераза при клеточном старении (старение)». Энциклопедия проекта «Эмбрио» (11 февраля 2015 г.). ISSN: 1940-5030 http://embryo.asu.edu/handle/10776/8301.
Университет штата Аризона. Школа наук о жизни. Центр биологии и общества. Энциклопедия проекта «Эмбрион».
Авторские права Попечительского совета штата Аризона Лицензия Creative Commons Attribution-NonCommercial-Share Alike 3.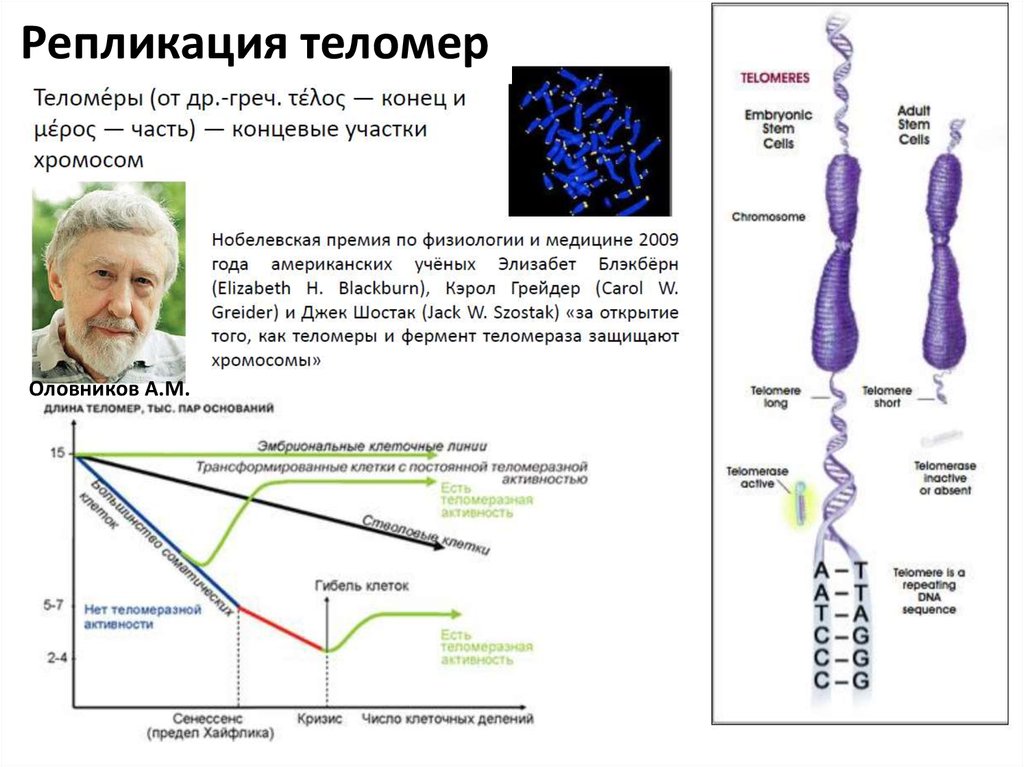

 Мурхед. «Сериал
Мурхед. «Сериал