Содержание
Вакцину от ВИЧ не изобрели и спустя 40 лет. Почему? – DW – 05.06.2021
1 декабря — Всемирный день борьбы со СПИДом Фото: picture-alliance/dpa/A. Dedert
Политика
Гудрун Хайзе | Наталья Позднякова
5 июня 2021 г.
40 лет назад был впервые зарегистрирован СПИД — болезнь, вызываемая вирусом иммунодефицита человека (ВИЧ). Но вакцины против ВИЧ нет до сих пор. Почему?
https://p.dw.com/p/3m1vq
Реклама
40 лет назад, 5 июня 1981 года, Американский центр контроля над заболеваниями зарегистрировал новую болезнь — СПИД (синдром приобретенного иммунодефицита). СПИД является конечной стадией ВИЧ-инфекции — заболевания, вызываемого вирусом иммунного дефицита человека (ВИЧ), который поражает клетки иммунной системы. ВИЧ уже унес более 33 миллионов жизней. По данным ВОЗ, в конце 2019 года в мире насчитывалось 38 миллионов человек, живущих с ВИЧ.
В российском обществе ВИЧ является стигмой, поскольку многие до сих пор ошибочно считают, что им болеют только представители сексуальных меньшинств и наркозависимые. Между тем уже давно установлено, что ВИЧ передается при незащищенном половом акте, переливании зараженной крови, использовании зараженных игл, а также от матери ребенку.
Между тем уже давно установлено, что ВИЧ передается при незащищенном половом акте, переливании зараженной крови, использовании зараженных игл, а также от матери ребенку.
Несмотря на то, что с момента обнаружения этого заболевания прошло уже сорок лет, вакцины против ВИЧ до сих пор нет. Почему? Ответ прост: вирус иммунодефицита человека — хамелеон среди всех других вирусов, он постоянно изменяется, мутирует, что сводит на нет все попытки ученых создать вакцину от ВИЧ.
Как выглядит вирус иммунодефицита человека
Вирус иммунодефицита человека имеет сложную трехмерную структуру поверхности, при этом половина ее покрыта сахарной оболочкой, гликолизирована, как говорят ученые. Именно гликолизированные поверхности блокируют действие вакцины.
Если бы ВИЧ вел себя так, как остальные вирусы, это бы существенно облегчило задачу разработчикам вакцины. Но вирус иммунодефицита человека постоянно и очень быстро меняет свою оболочку. Чтобы одержать победу над этим вирусом, иммунная система должна его распознать, но его быстрые мутации ведут к том, что иммунитет не видит в нем опасности.
Вирус иммунодефицита человека принадлежит к группе ретровирусов. Они обладают способностью сохранять свой ДНК-геном в клетке человека. Ученые уже многие годы пытаются понять, как размножаются ретровирусы, чтобы разработать стратегию борьбы с ними. Но пока безрезультатно.
Какие вакцины разрабатываются против ВИЧ
Разработка вакцины под названием HVTN 7026, которая началась в 2016 году в Южной Африке, вызвала большие надежды. 5407 человек, ВИЧ-негативных, в возрасте от 18 до 35 лет, принимали участие в испытаниях этой вакцины. При вакцинации использовался метод Prime Boost, при котором комбинировали две прививки. Во время первой (Prime) вакцины человек получал совсем другую сыворотку, чем во время второй (Boost). Таким образом шансы для иммунной системы должны были удвоиться, но этого не произошло.
Основой для HVTN 7026 послужила вакцина RV 144. Это единственная сыворотка, которая во время испытаний в Таиланде показала довольно скромный уровень эффективности в 31 процент. Правда, эта вакцина способна защищать человека от вируса лишь на протяжении нескольких месяцев. В феврале 2020 года ее испытания были прерваны, потому что не наблюдалось очевидного успеха.
Правда, эта вакцина способна защищать человека от вируса лишь на протяжении нескольких месяцев. В феврале 2020 года ее испытания были прерваны, потому что не наблюдалось очевидного успеха.
Следующей попыткой разработать вакцину от ВИЧ/СПИДа стал проект MOSAICO. Он так же был основан на методе комбинирования двух вакцин. Вакцину MOSAICO тестировали на обезьянах и результаты были многообещающими. С помощью этой вакцины риск заражения ВИЧ/ СПИДом в 90 процентах случаев мог бы уменьшиться. С конца 2019 года в США проходят клинические испытания этой вакцины. 3800 человек принимают в них участие.
Третья вакцина разрабатывается под названием IMBOKODO. В ее испытаниях участвуют 2600 человек из различных африканских стран. Эффективность вакцины пока составляет 67 процентов. Ее испытания закончатся в феврале 2022 года.
Пока, уверены ученые, любая из разработанных вакцин не сможет обеспечить 100 процентную защиту от ВИЧ. Но успехом считалась бы вакцина, которая обеспечивала бы от 60 до 70 процентов защиты. До этого момента остается лишь возможность лечить ВИЧ/СПИД антиретровирусными препаратами.
До этого момента остается лишь возможность лечить ВИЧ/СПИД антиретровирусными препаратами.
Почему важна доконтактная профилактика
Поскольку пока вакцину против вируса иммунодефицита человека изобрести не удалось, большие надежды возлагают на медикаментозную профилактику ВИЧ/СПИДа, так называемую доконтактную — это профилактическая мера по предотвращению передачи ВИЧ-инфекции, которую проводит с собой ВИЧ-отрицательный партнер. В настоящее время ученые ищут альтернативу таблеткам, которые необходимо принимать каждый день. Речь идет, в частности, об уколах или имплантах, которые способствуют накоплению необходимого препарата против вируса в организме.
Смотрите также:
Страшный диагноз СПИД: как бороться?
To view this video please enable JavaScript, and consider upgrading to a web browser that supports HTML5 video
Написать в редакцию
Реклама
Пропустить раздел Еще по теме
Еще по теме
Пропустить раздел Топ-тема
1 стр. из 3
из 3
Пропустить раздел Другие публикации DW
На главную страницу
Зачем Moderna вакцина от ВИЧ, которая не поможет — Перспективы новых исследований
Зачем Moderna вакцина от ВИЧ, которая не поможет — Перспективы новых исследований
08.02.2022
27 января компания Moderna объявила о начале I фазы клинических исследований (КИ) связки вакцины/усилителя eOD-GT8 60mer (mRNA-1644)/Core-g28v2 (mRNA-1644v2-Core).
Если не вдаваться в детали, то эта та же технология, что применена при создании мРНК вакцины Moderna (и Pfizer) против COVID-19. eOD-GT8 60mer — РНК репликон иммуногена, инкапсулированный в липидную наночастицу. Данная конструкция запускает каскад событий, в которых участвуют B-лимфоциты человека, и итогом становится продукция gp120-специфические антител широкого спектра, которые, в свою очередь, способны блокировать ВИЧ. Core-g28v2 — абсолютно аналогичная структура, но в финале воздействие должно запускать продукцию антител широкого спектра к другому белку ВИЧ, что, по задумке исследователей, должно усилить качество иммунного ответа.
История открытия антител широкого спектра (bNAbs) против ВИЧ начинается в 1990 году. Первое активное антитело было описано уже в 1994, с тех пор счет идет на десятки, а обобщены данные о нейтрализующих антителах против ВИЧ на ресурсе bNAber.
Попытки использовать такие антитела как терапевтическую вакцину происходили не раз, но особым успехом не увенчались — антитела довольно быстро исчезали, они «накрывали» далеко не все варианты ВИЧ, а их эффективность также была недостаточной — классические подходы явно не работали в полной мере. Рекомбинантные вакцины первой волны точно так же «не взлетели» как и векторные технологии: лучшее, что удалось получить тут — векторная вакцина RV144, чей «недолет» был все же невероятно вдохновляющим.
Разработка eOD-GT8 60mer была закончена еще в 2018 году в некоммерческой исследовательской компании Scripps Research, в их Центре нейтрализующих антител IAVI под руководством William Schief. Идея eOD-GT8 60mer не нова — получить в крови bNAbs против ВИЧ, антитела широкого спектра, однако реализация в этот раз иная — доставить предельно точные и окончательные инструкции B-клеткам, чтобы они сами, огромной массой, производили эти антитела, и ровно в том виде, как задумано создателями, а не по своему «разумению». И идея разработки именно в создании терапевтической вакцины, а не профилактический, и тем более не средства для окончательного решения проблемы ВИЧ-инфекции.
И идея разработки именно в создании терапевтической вакцины, а не профилактический, и тем более не средства для окончательного решения проблемы ВИЧ-инфекции.
Почему же данная разработка лежала в столе несколько лет? Окно возможностей открыла пандемия COVID. Произошел слом скепсиса и настороженности в отношении мРНК-вакцин, данный подход стал своего рода мейнстримом, открыв путь к запуску вакцин на данной технологии от гриппа, малярии, онкологических заболеваний, ВИЧ и так далее. Moderna, и многие другие компании, не замедлили воспользоваться такой возможностью.
Момент выбран верно, ресурсы, накопленные за время пандемии, колоссальные — время делать задел на будущее.
Что тут может смущать? Некоторая революционность, а не эволюционный характер процесса: довольно очевидно, что если бы не пандемия, технологии на базе мРНК шли бы к практическому применению медленно, годы, и, скорее пришли бы в более продвинутом виде. Не вызывает большого оптимизма и сама механика: подход с использованием антител широкого спектра действия в текущем виде имеет довольно понятные ограничения — любые антитела не будут воздействовать на покоящиеся клетки и провирусную ДНК ВИЧ, антитела не попадут за гистогематические барьеры, то есть нет никаких сомнений в том, что текущий технологический уровень не даст окончательного решения. Лучшее, на что мы можем рассчитывать, — новый терапевтический подход с периодическими инъекциями, который в сочетании с антиретровирусными препаратами позволит осуществлять подавление ВИЧ.
Лучшее, на что мы можем рассчитывать, — новый терапевтический подход с периодическими инъекциями, который в сочетании с антиретровирусными препаратами позволит осуществлять подавление ВИЧ.
Почему это важно? Это важно для акционеров Moderna — такая передовая разработка в портфеле будет увеличивать капитализацию компании не один год. Это важно для развития технологии и фундаментальных изысканий — это очень новая сфера, острие прогресса науки, где есть неиллюзорные шансы на великие открытия. Да, мы осознаем, что вакцина Moderna от ВИЧ почти наверняка не станет прорывом и не изменит «правил игры» в проблеме ВИЧ.
Весьма вероятно, что разработка вовсе не увенчается продуктом, однако в процессе будут точно получены ценнейшие знания в одной из самых важных сфер биотехнологии, и это не может не вдохновлять — еще один шаг на пути поиска Святого Грааля биотеха.
Источники:
-
IAVI Announces Clinical Trial of Next-Generation HIV Vaccine Candidate Designed to Induce Antibodies to Block HIV Infection. October 8, 2018, iavi.org. https://www.iavi.org/news-resources/press-releases/2018/iavi-announces-clinical-trial-of-next-genera…;
October 8, 2018, iavi.org. https://www.iavi.org/news-resources/press-releases/2018/iavi-announces-clinical-trial-of-next-genera…; -
Eroshkin AM, LeBlanc A, Weekes D, et al. bNAber: database of broadly neutralizing HIV antibodies. Nucleic Acids Res. 2014;42(Database issue):D1133-D1139. doi:10.1093/nar/gkt1083; -
J&J vaccine fails to protect women against HIV infection, September 1, 2021. pharmaphorum.com. https://pharmaphorum.com/news/jj-vaccine-fails-to-protect-women-against-hiv-infection/; -
Gray GE, Bekker LG, Laher F, et al. Vaccine Efficacy of ALVAC-HIV and Bivalent Subtype C gp120-MF59 in Adults. N Engl J Med. 2021;384(12):1089-1100. doi:10.1056/NEJMoa2031499; -
IAVI (https://www.iavi.org/news-resources/press-releases/2018/iavi-announces-clinical-trial-of-next-genera…; -
eOD-GT8 60mer – IAVI; -
eOD-GT8 60mer — IAVI. Phase I trial to evaluate safety and immunogenicity of vaccine candidate engineered to elicit targeted immune response against HIV.
Автор:
Врач-психиатр, редактор проекта hiv.plus Илья Антипин.
Возврат к списку
Вакцины против ВИЧ/СПИДа: 2018 г. — PMC
1.
Майр, Л.М.
&
Золла-Пазнер, С.
. Антитела, нацеленные на оболочку ВИЧ-1. микробиол. Спектр.
3, AID-0025-2014 (2015). [PubMed] [Google Scholar]
2.
Бертон, Д.Р.
&
Хангартнер, Л.
Широко нейтрализующие антитела к ВИЧ и их роль в разработке вакцин. Анну. Преподобный Иммунол.
34, 635–659 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
3.
Фаутс, Т.Р.
и др.
Баланс клеточного и гуморального иммунитета определяет уровень защиты вакцинами против ВИЧ в моделях ВИЧ-инфекции у макак-резусов. проц. Натл. акад. науч. США
112, Е992–E999 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
4.
Льюис, Г.К.
,
ДеВико, А.Л.
&
Галло, Р.К.
Стойкость антител и баланс Т-клеток: два ключевых фактора, препятствующих разработке вакцины против ВИЧ. проц. Натл. акад. науч. США
науч. США
111, 15614–15621 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
5.
Конник, Э.
и др.
ЦТЛ не накапливаются в местах репликации ВИЧ-1 в лимфоидной ткани. Дж. Иммунол.
178, 6975–6983 (2007). [PubMed] [Академия Google]
6.
Кил, Б.Ф.
и др.
Ректальная инокуляция малых доз макак-резусов SIVsmE660 или SIVmac251 повторяет инфицирование слизистой оболочки человека ВИЧ-1. Дж. Эксп. Мед.
206, 1117–1134 (2009). [Бесплатная статья PMC] [PubMed] [Google Scholar]
7.
Бойли, М.К.
и др.
Гетеросексуальный риск заражения ВИЧ-1 при половом акте: систематический обзор и метаанализ обсервационных исследований. Ланцет Инфекция. Дис.
9, 118–129 (2009). [Бесплатная статья PMC] [PubMed] [Google Scholar]
8.
Гилберт, П.Б.
и др.
Корреляция между иммунологическим ответом на рекомбинантную вакцину с гликопротеином 120 и заболеваемостью ВИЧ-1 в 3-й фазе испытания профилактической вакцины против ВИЧ-1. Дж. Заразить. Дис.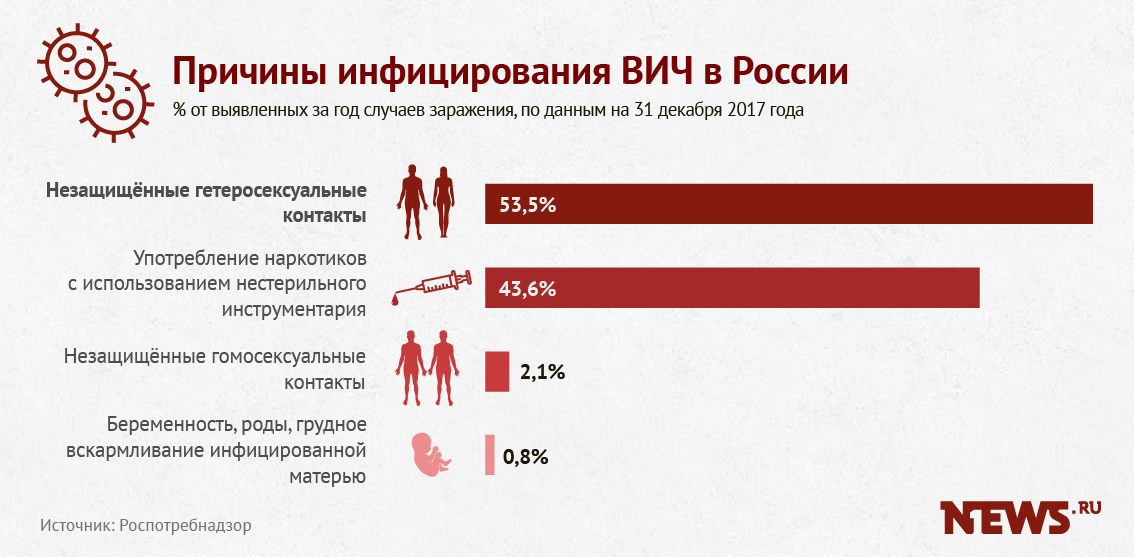
191, 666–677 (2005). [PubMed] [Google Scholar]
9.
Питисуттитум, П.
и др.
Рандомизированное двойное слепое плацебо-контролируемое исследование эффективности двухвалентной рекомбинантной вакцины против ВИЧ-1 на основе гликопротеина 120 среди потребителей инъекционных наркотиков в Бангкоке, Таиланд. Дж. Заразить. Дис.
194, 1661–1671 (2006). [PubMed] [Google Scholar]
10.
Бухбиндер, С.П.
и др.
Оценка эффективности вакцины против ВИЧ-1 с клеточно-опосредованным иммунитетом (шаговое исследование): двойное слепое, рандомизированное, плацебо-контролируемое испытание с проверкой концепции. Ланцет
372, 1881–1893 (2008). [Бесплатная статья PMC] [PubMed] [Google Scholar]
11.
Грей, Г.Э.
и др.
Безопасность и эффективность исследования HVTN 503/Phambili вакцины против ВИЧ-1 на основе клады B в Южной Африке: двойное слепое, рандомизированное, плацебо-контролируемое исследование фазы 2b проверки концепции. Ланцет Инфекция. Дис.
11, 507–515 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
12.
Оклер, С.
и др.
Отчетливая восприимчивость Т-клеток CD4, индуцированных вектором вакцины против ВИЧ, к ВИЧ-инфекции. PLoS Патог.
14, e1006888 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
13.
Бертон, Д.Р.
и др.
Здравоохранение. Для фазы III испытаний вакцины против ВИЧ-1 необходимо разумное обоснование. Наука
303, 316 (2004). [PubMed] [Google Scholar]
14.
Реркс-Нгарм, С.
и др.
Вакцинация ALVAC и AIDSVAX для предотвращения заражения ВИЧ-1 в Таиланде. Н. англ. Дж. Мед.
361, 2209–2220 (2009 г.). [PubMed] [Google Scholar]
15.
Робб, М.Л.
и др.
Поведение, связанное с риском, и время как коварианты эффективности схемы вакцинации против ВИЧ ALVAC-HIV (vCP1521) и AIDSVAX B/E: постфактум анализ тайской фазы 3 исследования эффективности RV 144. Lancet Infect. Дис.
12, 531–537 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
16.
Куп, Р. А.
А.
и др.
Примирующая иммунизация ДНК увеличивает иммуногенность рекомбинантных аденовирусных векторов как в отношении ВИЧ-1-специфических антител, так и Т-клеточных ответов. PLoS один
5, е9015 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
17.
Хаммер, С.М.
и др.
Испытание эффективности ДНК/rAd5 профилактической вакцины против ВИЧ-1. Н. англ. Дж. Мед.
369, 2083–2092 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
18.
Хейнс, Б.Ф.
и др.
Иммунокорреляционный анализ испытаний эффективности вакцины против ВИЧ-1. Н. англ. Дж. Мед.
366, 1275–1286 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
19.
Чанг, А.В.
и др.
Полифункциональные профили Fc-эффекторов, опосредованные отбором подкласса IgG, отличают вакцины RV144 и VAX003. науч. Перевод Мед.
6, 228ра38 (2014). [PubMed] [Академия Google]
20.
Йейтс, Н.Л.
и др.
Индуцированный вакциной Env V1-V2 IgG3 коррелирует с более низким риском инфицирования ВИЧ-1 и снижается вскоре после вакцинации. науч. Перевод Мед.
науч. Перевод Мед.
6, 228ра39 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
21.
Роллан, М.
и др.
Повышенная эффективность вакцины против ВИЧ-1 против вирусов с генетическими сигнатурами в Env V2. Природа
490, 417–420 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
22.
Феррари, Г.
и др.
Моноклональное антитело человека gp120 оболочки ВИЧ-1, которое распознает конформационный эпитоп C1, опосредует мощную активность антителозависимой клеточной цитотоксичности (ADCC) и определяет общий эпитоп ADCC в сыворотке ВИЧ-1 человека. Дж. Вирол.
85, 7029–7036 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
23.
Бонсиньори, М.
и др.
Антитело-зависимые антитела, опосредующие клеточную цитотоксичность, из испытания эффективности вакцины против ВИЧ-1 нацелены на несколько эпитопов и предпочтительно используют семейство генов Vh2. Дж. Вирол.
86, 11521–11532 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
24.
Томасас, Г.Д.
и др.
Вакцино-индуцированный плазменный IgA, специфичный к области C1 оболочки ВИЧ-1, блокирует связывание и эффекторную функцию IgG. проц. Натл. акад. науч. США
110, 9019–9024 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
25.
Лин, Л.
и др.
COMPASS идентифицирует подмножества Т-клеток, коррелирующие с клиническими исходами. Нац. Биотехнолог.
33, 610–616 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
26.
Грабер, П.
,
Моряк, М.С.
,
Бейлер, Р.Т.
,
Маскола, Дж.Р.
,
Монтефиори, округ Колумбия
&
Корбер, Б.Т.
Преобладание широкого нейтрализующего ответа антител при хронической инфекции ВИЧ-1. СПИД
28, 163–169 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
27.
Баласубраманян, П.
и др.
Функциональный гуморальный ответ против V1V2 и V3 gp120 ВИЧ в испытаниях вакцин VAX003 и VAX004. науч. Респ.
8, 542 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
28.
Карнасута, С.
и др.
Сравнение ответов антител, индуцированных схемами вакцинации RV144, VAX003 и VAX004. СПИД рез. Гум. Ретровирусы
33, 410–423 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
29.
Поллара, Дж.
и др.
Высокопроизводительный количественный анализ ответов антител, опосредующих ADCC, специфичных для ВИЧ-1 и SIV. Цитометрия А.
79, 603–612 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
30.
Макура, Н.
,
Чжан, Т.
&
Касадеваль, А.
Зависимость фагоцитарной эффективности макрофагов от концентрации антител. Заразить. Иммун.
75, 1904–1915 (2007). [Бесплатная статья PMC] [PubMed] [Google Scholar]
31.
Таборда, С.П.
,
Ривера, Дж.
,
Сарагоса, О.
&
Касадеваль, А.
Больше не обязательно лучше: прозоноподобные эффекты при пассивной иммунизации IgG. Дж. Иммунол.
170, 3621–3630 (2003). [PubMed] [Академия Google]
32.
Гуань, Ю.
и др.
Различная специфичность и эффекторная функция человеческих антител к гликопротеиновым эпитопам оболочки ВИЧ-1, подвергающимся воздействию CD4-связывания. проц. Натл. акад. науч. США
проц. Натл. акад. науч. США
110, E69–E78 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
33.
Панчера, М.
и др.
Структура gp120 ВИЧ-1 с gp41-интерактивной областью демонстрирует многослойную архитектуру оболочки и основу конформационной подвижности. проц. Натл. акад. науч. США
107, 1166–1171 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
34.
Хессел, А.Дж.
и др.
Рецептор Fc, но не связывание комплемента, важен для защиты антител от ВИЧ. Природа
449, 101–104 (2007). [PubMed] [Google Scholar]
35.
Менгисту, М.
,
Рэй, К.
,
Льюис, Г.К.
&
ДеВико, А.Л.
Антигенные свойства гликопротеина gp120 оболочки вируса иммунодефицита человека на вирионы, связанные с клетками-мишенями. PLoS Патог.
11, e1004772 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
36.
Фернандес-Ларссон, Р.
,
Шривастава, К.К.
,
Лу, С.
&
Робинсон, Х.Л.
Репликация изолятов вируса иммунодефицита человека типа 1 в Т-клетках: спектр скоростей и эффективности проникновения. проц. Натл. акад. науч. США
проц. Натл. акад. науч. США
89, 2223–2226 (1992). [Бесплатная статья PMC] [PubMed] [Google Scholar]
37.
Моряк, М.С.
и др.
Многоуровневая категоризация разнообразной панели псевдовирусов Env ВИЧ-1 для оценки нейтрализующих антител. Дж. Вирол.
84, 1439–1452 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
38.
Муке, Х.
и др.
Полиреактивность увеличивает кажущуюся аффинность анти-ВИЧ-антител путем гетеролигирования. Природа
467, 591–595 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
39.
Веркоци, Л.
&
Диаз, М.
Автореактивность широко нейтрализующих антител к ВИЧ-1: влияние на их функцию и индукцию вакцинацией. Курс. мнение ВИЧ СПИД
9, 224–234 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
40.
Хейнс, Б.Ф.
,
Келсо, Г.
,
Харрисон, С.К.
&
Кеплер, Т.Б.
Дизайн иммуногена В-клеточной линии при разработке вакцины против ВИЧ-1 в качестве тематического исследования. Нац. Биотехнолог.
30, 423–433 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
41.
Маккерли, Н.П.
и др.
Передаваемые ВИЧ/основные вакцины вызывают аутологичные нейтрализующие антитела уровня 2 для сайта связывания CD4. PLoS один
12, e0177863 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
42.
Шен, X.
и др.
gp120 ВИЧ-1 и модифицированный gp140 вируса коровьей оспы Ankara (MVA) усиливают иммуногенность ДНК/MVA вакцины против ВИЧ-1. Дж. Вирол.
91, e01077-17 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
43.
Бухбиндер, С.П.
и др.
Иммуногенность новой комбинации вакцин против ВИЧ-1 клады B: результаты фазы 1 рандомизированного плацебо-контролируемого исследования примирования ДНК, экспрессирующей ГМ-КСФ, с модифицированной вакциной против коровьей оспы Анкара у здоровых, не инфицированных ВИЧ-1 взрослых. PLoS один
12, e0179597 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
44.
Лю, П.
и др.
Инфекционный захват вириона ВИЧ-1 gp120-специфическим IgG от вакцинированных RV144. Дж. Вирол.
Дж. Вирол.
87, 7828–7836 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
45.
Муг, С.
и др.
Защитный эффект вагинального применения нейтрализующих и ненейтрализующих ингибирующих антител против вагинального заражения SHIV у макак. Иммунол слизистых оболочек.
7, 46–56 (2014). [PubMed] [Google Scholar]
46.
Бертон, Д.Р.
и др.
Ограниченная защита или отсутствие защиты слабыми или ненейтрализующими антителами против вагинального заражения SHIV макак по сравнению с сильными нейтрализующими антителами. проц. Натл. акад. науч. США
108, 11181–11186 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
47.
Льюис, Г.К.
,
Пазгер, М.
&
ДеВико, А.Л.
Раскаяние выживших: опосредованная антителами защита от ВИЧ-1. Иммунол. преп.
275, 271–284 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
48.
Гепферт, П.А.
и др.
Специфичность и 6-месячная устойчивость иммунных ответов, индуцированных ДНК и рекомбинантными модифицированными вакцинами коровьей оспы Ankara, экспрессирующими вирусоподобные частицы ВИЧ-1. Дж. Заразить. Дис.
Дж. Заразить. Дис.
210, 99–110 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
49.
Вятт, Л.С.
,
Беляков, И.М.
,
Эрл, П.Л.
,
Берзофски, Я.А.
&
Мосс, Б.
Повышенная экспрессия клеточной поверхности, иммуногенность и генетическая стабильность в результате спонтанного укорочения Env ВИЧ, экспрессируемого рекомбинантным MVA. Вирусология
372, 260–272 (2008). [Бесплатная статья PMC] [PubMed] [Google Scholar]
50.
Иган, Массачусетс
,
Каррут, Л.М.
,
Роуэлл, Дж.Ф.
,
Ю, Х.
&
Силициано, Р.Ф.
Эндоцитоз белка оболочки вируса иммунодефицита человека типа 1, опосредованный высококонсервативным внутренним сигналом интернализации в цитоплазматическом домене gp41, подавляется в присутствии белка-предшественника Pr55gag. Дж. Вирол.
70, 6547–6556 (1996). [Бесплатная статья PMC] [PubMed] [Google Scholar]
51.
Эдвардс, Т.Г.
и др.
Усечение цитоплазматического домена индуцирует экспозицию консервативных областей в эктодомене белка оболочки вируса иммунодефицита человека типа 1. Дж. Вирол.
Дж. Вирол.
76, 2683–2691 (2002). [Бесплатная статья PMC] [PubMed] [Google Scholar]
52.
Сандерс, Р.В.
&
Мур, Дж.П.
Нативные тримеры Env как платформа для разработки вакцины против ВИЧ-1. Иммунол. преп.
275, 161–182 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
53.
Ринге, Р.П.
и др.
Расщепление сильно влияет на то, принимают ли растворимые тримеры гликопротеина оболочки ВИЧ-1 нативную конформацию. проц. Натл. акад. науч. США
110, 18256–18261 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
54.
Брико, К.А.
и др.
Нейтрализующий ответ антител после длительной вакцинации вирусом ВИЧ-1 Env gp140 у морских свинок. Дж. Вирол.
92, e00369-18 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
55.
Чен, Л.
и др.
Структурная основа уклонения от иммунного ответа в месте прикрепления CD4 к gp120 ВИЧ-1. Наука
326, 1123–1127 (2009). [Бесплатная статья PMC] [PubMed] [Google Scholar]
56.
Алам, С.М.
и др.
Антигенность и иммуногенность вакцины RV144. Иммуноген оболочки AIDSVAX clade E усиливается N-концевой делецией gp120. Дж. Вирол.
87, 1554–1568 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
57.
Брэдли, Т.
и др.
Пентавалентная вакцина против ВИЧ-1 защищает от заражения обезьяньим вирусом иммунодефицита человека. Нац. коммун.
8, 15711 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
58.
Фаутс, Т.Р.
,
Льюис, Г.К.
&
Хон, Д.М.
Конструирование и характеристика векторной вакцины против вируса иммунодефицита человека типа 1 на основе Salmonella typhi. вакцина
13, 561–569 (1995). [PubMed] [Google Scholar]
59.
Фаутс, Т.Р.
и др.
Экспрессия и характеристика одноцепочечного полипептидного аналога рецепторного комплекса gp120-CD4 вируса иммунодефицита человека типа 1. Дж. Вирол.
74, 11427–11436 (2000). [Бесплатная статья PMC] [PubMed] [Google Scholar]
60.
Дуэк, округ Колумбия
и др.
ВИЧ преимущественно инфицирует ВИЧ-специфические CD4+ Т-клетки. Природа
Природа
417, 95–98 (2002). [PubMed] [Google Scholar]
61.
Стамататос, Л.
,
Панчера, М.
&
Макгуайр, А.Т.
Иммуногены, нацеленные на зародышевую линию. Иммунол. преп.
275, 203–216 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
62.
Ляо, Х.Х.
и др.
Коэволюция широко нейтрализующего антитела к ВИЧ-1 и вируса-основателя. Природа
496, 8 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
63.
Джардин, Дж.
и др.
Рациональный дизайн иммуногена ВИЧ для нацеливания на специфические рецепторы В-клеток зародышевой линии. Наука
340, 711–716 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
64.
Сюй, К.
и др.
Дизайн вакцины на основе эпитопов дает направленные на слияние пептиды антитела, которые нейтрализуют различные штаммы ВИЧ-1. Нац. Мед.
24, 857–867 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
65.
Бомсель, М.
и др.
Иммунизация виросомами субъединицы gp41 ВИЧ-1 индуцирует антитела слизистой оболочки, защищающие нечеловекообразных приматов от вагинального заражения SHIV. Иммунитет
Иммунитет
34, 269–280 (2011). [PubMed] [Google Scholar]
66.
Чакрабарти, Б.К.
и др.
Модификации гликопротеина оболочки вируса иммунодефицита человека повышают иммуногенность при генетической иммунизации. Дж. Вирол.
76, 5357–5368 (2002). [Бесплатная статья PMC] [PubMed] [Google Scholar]
67.
Уильямс, У.Б.
,
Хан, К.
&
Хейнс, Б.Ф.
Перекрестная реактивность реакций на вакцину против ВИЧ и микробиома. Курс. мнение ВИЧ СПИД
13, 9–14 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
68.
Буге, С.Л.
и др.
Повышение Gp120 квасцами вакцины против СПИДа Gag-Pol-Env DNA/MVA: более плохой контроль над патогенной вирусной нагрузкой. СПИД рез. Гум. Ретровирусы
19, 891–900 (2003). [PubMed] [Google Scholar]
69.
Чо, М.В.
и др.
Поливалентная оболочечная гликопротеиновая вакцина вызывает более широкий ответ нейтрализующих антител, но не может обеспечить стерилизующую защиту от инфицирования гетерологичным вирусом иммунодефицита обезьян/человека у макак с косичками. Дж. Вирол.
Дж. Вирол.
75, 2224–2234 (2001). [Бесплатная статья PMC] [PubMed] [Google Scholar]
70.
Мартинес, Д.Р.
,
Пермар, С.Р.
&
Фуда, Г.Г.
Сравнение иммунных реакций взрослых и младенцев на ВИЧ-инфекцию и вакцинацию. клин. Вакцина Иммунол.
23, 84–94 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
71.
Истерхофф, Д.
и др.
Усиление антител к сайту связывания CD4 оболочки ВИЧ с длинной вариабельной тяжелой третьей областью, определяющей комплементарность, в рандомизированном двойном слепом испытании вакцины RV305 ВИЧ-1. PLoS Патог.
13, e1006182 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
72.
Иоахим, А.
и др.
Трехлетняя устойчивость иммунных ответов, индуцированных ДНК ВИЧ и ВИЧ-модифицированным вирусом коровьей оспы Ankara, и эффект позднего ВИЧ-модифицированного вируса осповакцины Ankara Boost у танзанийских добровольцев. СПИД рез. Гум. Ретровирусы
33, 880–888 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
73.
Фукс, С.П.
&
Дерозье, Р.К.
Перспективы и проблемы, связанные с использованием рекомбинантных ААВ для доставки антител к ВИЧ. Мол. тер. Методы клин. Дев.
3, 16068 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
74.
Брэди, Дж.М.
,
Балтимор, Д.
&
Балаш, А.Б.
Перенос генов антител с помощью аденоассоциированных вирусных векторов как метод профилактики ВИЧ. Иммунол. преп.
275, 324–333 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
75.
Гилберт, П.Б.
и др.
Основа и статистический дизайн исследований эффективности пассивной профилактики, опосредованной антителами к ВИЧ-1 (AMP). Стат. коммун. Заразить. Дис.
9 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
76.
Саксена, А.
&
Ву, Д.
Достижения в терапевтической инженерии Fc – модуляция IgG-ассоциированных эффекторных функций и период полувыведения из сыворотки. Фронт. Иммунол.
7, 580 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
77.
Юлг, Б.
и др.
Защита от смешанного заражения SHIV с помощью коктейля нейтрализующих антител широкого спектра действия. науч. Перевод Мед.
науч. Перевод Мед.
9, eaao4235 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
78.
Ваг, К.
и др.
Потенциал обычных и биспецифических широко нейтрализующих антител для профилактики инфекций ВИЧ-1 подтипов A, C и D. PLoS Патог.
14, e1006860 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
79.
Сюй, Л.
и др.
Триспецифические широко нейтрализующие антитела к ВИЧ обеспечивают мощную защиту от SHIV у макак. Наука
358, 85–90 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
80.
Кулькарни, В.
и др.
Измененная иерархия ответов и увеличенная ширина Т-клеток после вакцинации ДНК с консервативным элементом ВИЧ-1 у макак. PLoS один
9, e86254 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
81.
Фишер, В.
и др.
Поливалентные вакцины для оптимального охвата потенциальных эпитопов Т-клеток в глобальных вариантах ВИЧ-1. Нац. Мед.
13, 100–106 (2007). [PubMed] [Академия Google]
82.
Барух, Д.Х.
и др.
Мозаичные вакцины против ВИЧ-1 расширяют широту и глубину клеточных иммунных реакций у макак-резусов. Нац. Мед.
16, 319–323 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
83.
Бинту, Л.
и др.
Динамика эпигенетической регуляции на уровне одной клетки. Наука
351, 720–724 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
84.
Хансен, С.Г.
и др.
Цитомегаловирусные векторы нарушают парадигмы распознавания эпитопов CD8+ Т-клеток. Наука
340, 1237874 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
85.
Хансен, С.Г.
и др.
Глубокий ранний контроль высокопатогенного ВИО с помощью эффекторной Т-клеточной вакцины памяти. Природа. 473, 523–527 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
86.
Карасаввас, Н.
и др.
Реакция антител IgG на рекомбинантные белки gp120, каркасы gp70V1/V2 и циклический пептид V2 в испытаниях вакцин фазы I/II в Таиланде с использованием различных схем вакцинации. СПИД рез. Гум. Ретровирусы
СПИД рез. Гум. Ретровирусы
31, 1178–1186 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
87.
Барух, Д.Х.
и др.
Оценка мозаичной вакцины против ВИЧ-1 в многоцентровом рандомизированном двойном слепом плацебо-контролируемом клиническом исследовании фазы 1/2а (APPROACH) и на макаках-резусах (NHP 13-19). Ланцет
392, 232–243 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
88.
Гу, Л.
,
Чохан, В.
,
Ндуати, Р.
&
Овербо, Дж.
Раннее развитие широко нейтрализующих антител у ВИЧ-1-инфицированных детей. Нац. Мед.
20, 655–658 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
89.
Фуда, Г.Г.
и др.
Вакцинация младенческого ВИЧ типа 1 gp120 вызывает сильные и устойчивые ответы иммуноглобулина G против V1V2 и только редкие ответы иммуноглобулина А, специфичного для оболочки. Дж. Заразить. Дис.
211, 508–517 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
90.
Робинсон, Х.Л.
Вакцины против ВИЧ/СПИДа: 2007. Клин.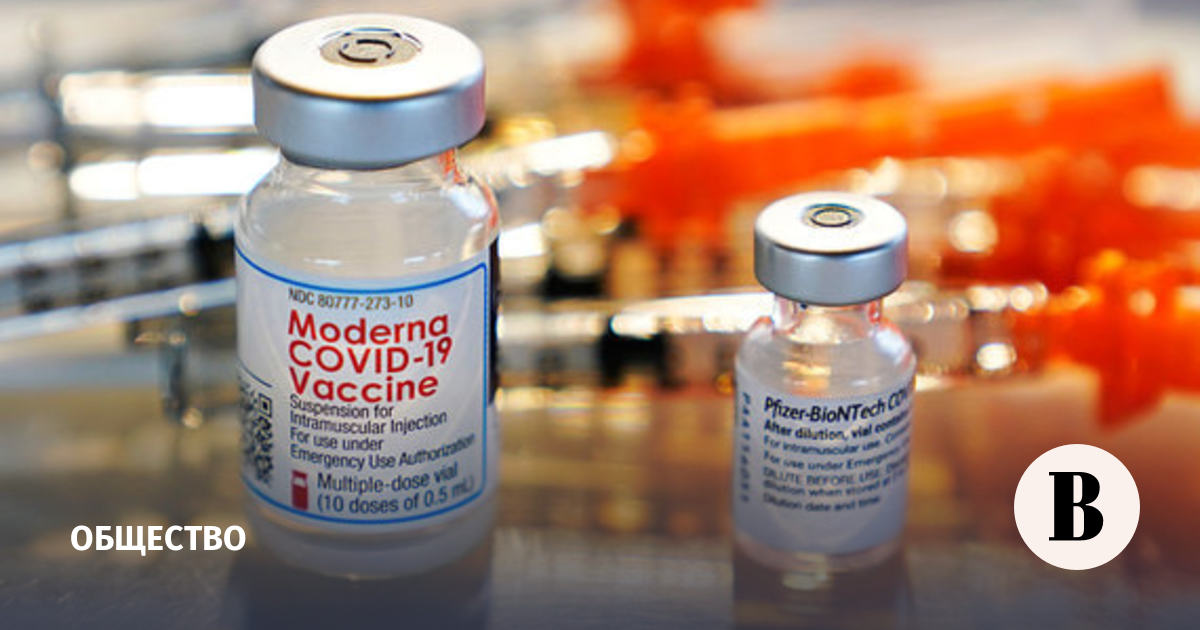 Фармакол. тер.
Фармакол. тер.
82, 686–693 (2007). [PubMed] [Google Scholar]
Ведущие испытания вакцины против ВИЧ остановлены из-за неэффективности | ВИЧ | Ведущее испытание вакцины против ВИЧ JAMA
остановлено из-за неэффективности | ВИЧ | ДЖАМА | Сеть ДЖАМА
[Перейти к навигации]
Эта проблема
Просмотр показателей
- Скачать PDF
- Полный текст
Поделиться
Твиттер
Фейсбук
Электронное письмо
LinkedIn- Процитировать это
- Разрешения
Обновление клинических испытаний
24/31 марта 2020 г.

 October 8, 2018, iavi.org. https://www.iavi.org/news-resources/press-releases/2018/iavi-announces-clinical-trial-of-next-genera…;
October 8, 2018, iavi.org. https://www.iavi.org/news-resources/press-releases/2018/iavi-announces-clinical-trial-of-next-genera…;