Содержание
Вирусы против бактерий
Бактериофаги – одни из самых загадочных препаратов аптечного ассортимента. Сейчас они переживают второе рождение – и в нашей стране, и за рубежом снова возник к ним интерес, в журналах появляется не только пересмотр старых результатов, но и масса новых публикаций. Что можно рассказать покупателю, который заинтересовался именно этими средствами?
Вехи истории
Ученые обнаруживали следы жизнедеятельности бактериофагов задолго до того, как возникла вирусология. Британский бактериолог Эрнест Ханкин еще в 1896 году обратил внимание, что некий агент, способный проходить через очень тонкий фарфоровый фильтр, убивает возбудителя холеры. Развитию науки в новом направлении помешала Первая мировая, поскольку финансирование было перенаправлено разработчикам боевых газов, взрывчатых веществ и других более актуальных вещей.
Первооткрывателями бактериофагов считаются два исследователя – британский бактериолог Фредерик Творт, описавший странный фильтрующийся агент в 1915 году, и канадский микробиолог французского происхождения Феликс Д’Эрелль, независимо от Творта сообщивший о точно такой же находке в 1917-м.

За рубежом бактериофагами интересовались в первую очередь микробиологи, так что их находки не имели прикладного значения. Очень долгое время, например, фаг считался не вирусом, а ферментом. В СССР работы изначально велись медиками, в Грузии в 1923 году был создан будущий Всесоюзный центр фаготерапии, собравший на пике своего расцвета коллекцию из более чем 3 тыс. образцов. Однако затем и у нас, и за рубежом дело фаготерапии было практически уничтожено появившимися антибиотиками. Их массовое распространение после Второй мировой создавало впечатление, что изобретена панацея против инфекций и остальные направления исследований – тупиковые.
О бактериофагах ученые вспомнили, когда перед ними в полный рост встала проблема антибиотикорезистентности. Вирусы снова стали объектом экспериментов, в них увидели реальную альтернативу морально и иногда даже физически устаревшим противомикробным препаратам.
Натуральный враг
Бактериофаг, как следует хотя бы из названия, – вирус, пожирающий бактерии. По сути, это такой «грипп бактерий», только летальные исходы случаются куда чаще, чем в человеческом варианте.
По сути, это такой «грипп бактерий», только летальные исходы случаются куда чаще, чем в человеческом варианте.
Фаги гораздо разнообразнее, чем какие-либо другие известные вирусы, нельзя сказать, что они выглядят однотипно. Чаще всего в качестве иллюстрации используется изображение вирусов группы А по классификации Бредли, она же – группа V по классификации Тихоненко. Такие вирусы устроены сложнее всего, в них имеется головка и отросток с множеством дополнительных элементов (рис. 1). Всего групп выделяют шесть, только в одной из них геном фага представлен одноцепочечной РНК, во всех остальных случаях – это одна- или двухцепочечная ДНК.
Бактериофаги нельзя назвать гигантами, но по своим размерам они, скорее, относятся к крупным и занимают промежуточное положение между самыми большими вирусами табачной мозаики и вирусом иммунодефицита человека 1-го типа (рис. 2).
Вирусы группы А (V) вводят свою ДНК в клетку-мишень очень красиво, процесс чем-то напоминает посадку исследовательского модуля на поверхность Луны или Марса – точно так же он сначала «присаживается» на «опоры», а затем прижимается к мембране бактерии своей базальной пластиной, «пробуравливает» оболочку жертвы и впрыскивает в цитоплазму свой геном.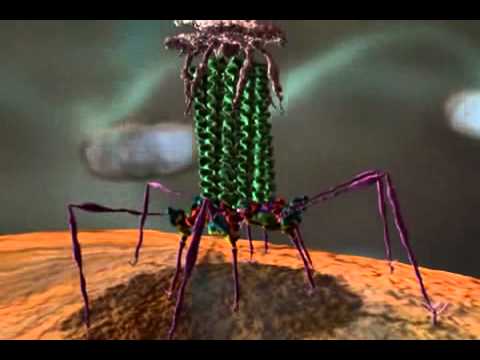 После этого бактериофаг можно считать мертвым, если так вообще можно сказать о вирусах.
После этого бактериофаг можно считать мертвым, если так вообще можно сказать о вирусах.
Быстро или помучиться?
По механизму действия все бактериофаги можно разделить на две большие группы. Первая – литические, или вирулентные фаги, которые в 100% случаев убивают инфицированную клетку сразу. В случае, показанном на рисунке 3, вирус сразу же уничтожает геном бактерии, используя его исключительно для целей собственной репликации. После наработки максимально возможного числа новых вирусных частиц микроб либо сразу гибнет в момент их выхода, просто разрываясь на части, либо погибает в ближайшее время из-за того, что все критически важные внутренние механизмы физически уничтожены.
Вторая группа – лизогенные, или умеренные фаги. Их геном встраивается в геном носителя и может существовать там в стелс-режиме долгое время, передаваясь из поколения в поколение. Активируется эта «бомба с замедленным действием» под влиянием различных неблагоприятных внешних факторов вроде дефицита питательных веществ. Единичные фаги умеют сочетать оба варианта, отпочковываясь и не разрушая бактериальную клетку сразу, лишь используя часть ее мембраны в качестве оболочки, одновременно оставляя «закладку» в ее геноме. На одного микроба могут напасть сразу несколько фагов с разными механизмами взаимодействия.
Единичные фаги умеют сочетать оба варианта, отпочковываясь и не разрушая бактериальную клетку сразу, лишь используя часть ее мембраны в качестве оболочки, одновременно оставляя «закладку» в ее геноме. На одного микроба могут напасть сразу несколько фагов с разными механизмами взаимодействия.
Плюсы и минусы
К несомненным достоинствам фагов можно отнести их прицельность, они специализируются на конкретных видах бактерий, так что можно отобрать именно те вирусы, которые уничтожают только патогенную флору, в отличие от антибиотиков, «бьющих по площадям», не разбирая при этом, свой или чужой попадает под обстрел.
По той же причине у фагов либо меньше побочных эффектов, либо их совсем нет. С резистентностью история схожая, она если и развивается, то только у конкретной бактерии-мишени. С помощью генной инженерии реально перепрограммировать вирус и натравить его на какого-нибудь другого возбудителя, еще не знакомого с вирусом.
Немаловажным фактором в пользу бактериофагов можно считать дешевизну и простоту их производства, особенно по сравнению с новыми перспективными антибиотиками.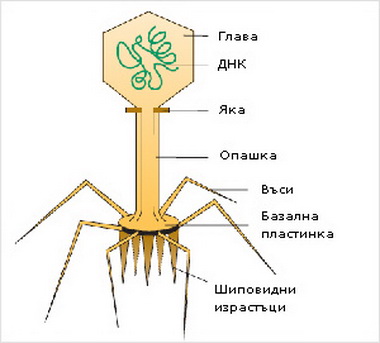 Действительно получается не менее, а иногда и более эффективная альтернатива с кратно меньшими вложениями.
Действительно получается не менее, а иногда и более эффективная альтернатива с кратно меньшими вложениями.
Недостатки тоже есть, и они тесно связаны с вирусной природой фагов. Прежде всего, их сложно хранить и перевозить, они весьма требовательны к условиям содержания. Кроме того, фаги способны нападать только на свободно плавающие бактерии, внутрь человеческих клеток их никто не пустит. Агрессивная среда желудка уничтожает многие вирусы, не разбирая, кто пришел с миром, а кто нет. И главное, для достижения максимального эффекта терапии бактерию-возбудителя нужно фаготипировать, то есть выделить и в лабораторных условиях доказать, что против нее может быть применен вот этот конкретный вирус.
Тем не менее фаги остаются перспективным направлением разработок, особенно после открытия канадского биолога Джозефа Бонди-Деноми, работающего в Калифорнийском университете. Он обнаружил новый вирус, прицельно уничтожающий синегнойную палочку, к которому устойчивость не развивалась. Изучая феномен, ученый выяснил, что ДНК этого фага защищена белковой оболочкой, с которой не справляется иммунитет бактерии. Если такой «чехол» надевать на все остальные ДНК и РНК бактериофагов, они могут стать еще более грозным оружием для своих естественных врагов. Главное, чтобы на человека не переключились.
Если такой «чехол» надевать на все остальные ДНК и РНК бактериофагов, они могут стать еще более грозным оружием для своих естественных врагов. Главное, чтобы на человека не переключились.
Факты
В СССР активно изучали медицинское применение бактериофагов, но публикации были либо на русском, либо на грузинском языках, поэтому мировая наука о них не знала и с удивлением изучает и цитирует их уже в наше время.
Работы по бактериофагам удостоены Нобелевской премии. В 1969 году она была присуждена американским исследователям Максу Дельбрюку, Альфреду Херши и Сальвадору Лурия за открытия, касающиеся механизма репликации и генетической структуры вирусов.
В ГРЛС зарегистрированы и обращаются на российском рынке следующие разновидности бактериофагов: брюшнотифозный, дизентерийный, против клебсиелл и отдельно – против клебсиеллы пневмонии, против кишечной палочки, протейный, сальмонеллезный, стафилококковый и против синегнойной палочки. Самый часто используемый в амбулаторной практике препарат – стафилококковый фаг.
1. Keen E.C. Phage Therapy: Concept to Cure // Frontiers in Microbiology. 2012. 3: 238. doi: 10.3389/fmicb.2012.00238. 2. Keen E.C. Tradeoffs in bacteriophage life histories // Bacteriophage. 2014. 4 (1): e28365. doi: 10.4161/bact.28365. 3. Kutter Elizabeth et al. (2010). Phage Therapy in Clinical Practice: Treatment of Human Infections // Current Pharmaceutical Biotechnology. 11 (1): 69–86. doi: 10.2174/138920110790725401. 4. McGrath S. and van Sinderen D. (editors). Bacteriophage: Genetics and Molecular Biology (1st ed.). Caister Academic Press. 2007. ISBN 978-1-904455-14-1. 5. Stineke van Houte et al. The diversity-generating benefits of a prokaryotic adaptive immune system // Nature. 2016. DOI: 10.1038/nature17436. 6. Поздеев О.К., Федорова Е.Р., Валеева Ю.В. Микробиология. Бактериофаги/Учебно-методическое пособие для студентов медицинских вузов. Казань, 2012.
Алексей Водовозов
Журнал «Российские аптеки» №1-2, 2020
Вам могут понравиться другие статьи:
Подробности
Полезные свойства ламинарии
Морская капуста – продукт на любителя. Кому-то нравится характерный привкус, кто-то его на дух не переваривает. Впрочем, фармакологи ее не едят, а изучают и ищут потенциально полезные веще…
Кому-то нравится характерный привкус, кто-то его на дух не переваривает. Впрочем, фармакологи ее не едят, а изучают и ищут потенциально полезные веще…
Подробнее
Подробности
В облаке брызг
Формат спрея подходит не только для теплого сезона – пользоваться им удобно во все времена года, причем в любом месте. Покупатель наверняка оценит эти качества.
Подробнее
Подробности
Операция «утилизация»
Есть масса тонкостей, которые зачастую не позволяют людям разобраться с правилами списания лекарственных средств, тем более что единая государственная система в этом направлении пока …
Подробнее
Подробности
Что может глина?
Казалось бы, чем может быть полезен для здоровья строительный материал? Но на самом деле медицине уже давно известно о лечебных свойствах глины.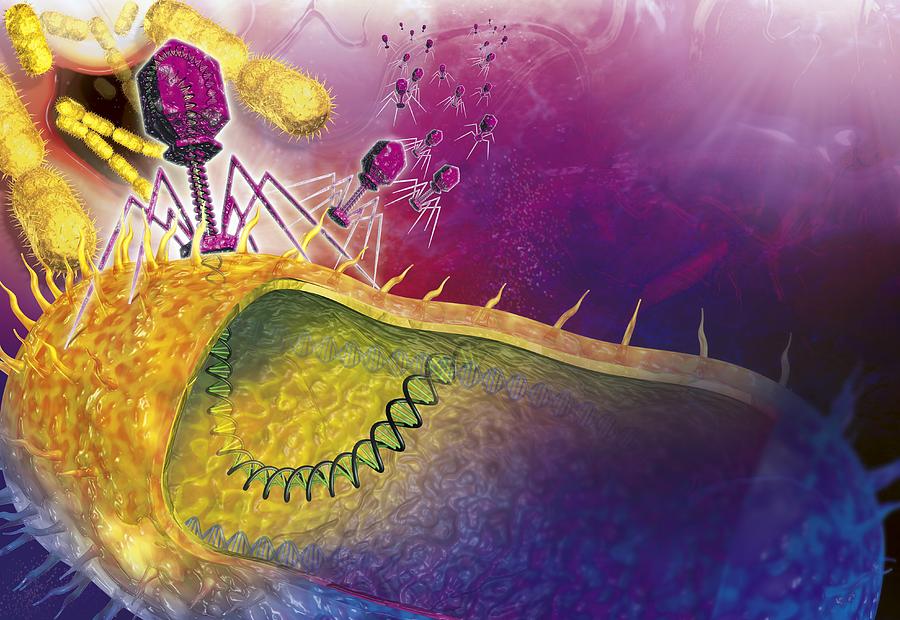 И не случайно сегодня ее мож…
И не случайно сегодня ее мож…
Подробнее
Подробности
Кожа на восстановлении
После косметологических процедур, таких как пилинги или шлифовки, кожа нуждается в реабилитационном периоде и применении специальных средств, помогающих ей быстро «прийти в себя». Впрочем, такие пр…
Подробнее
Подробности
5 идей для отпуска
По понятным причинам поездки для отдыха остаются внутрироссийскими. Впрочем, в нашей стране – невероятное разнообразие интереснейших мест с необычной природой и памятниками истории и культуры. Куда…
Подробнее
Как вирусы решают судьбу бактерии
Попавшим вместе в бактериальную клетку бактериофагам приходится решать, вступать ли им друг с другом в непримиримую борьбу или же начать сотрудничать.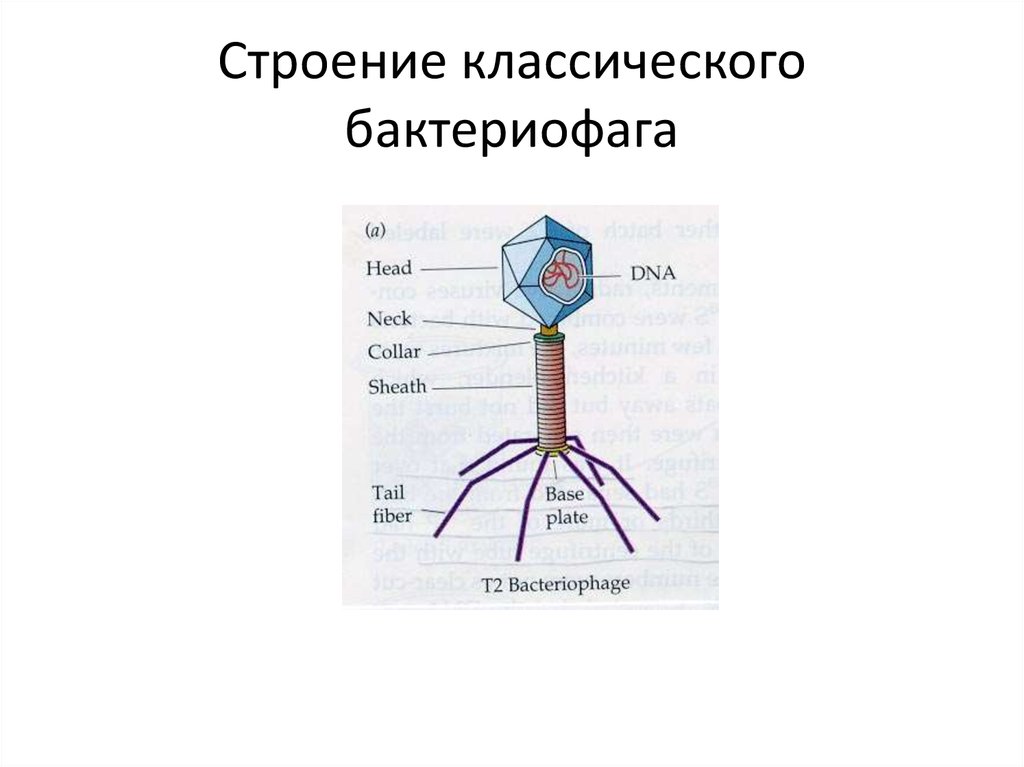
Бактериофагами называют вирусы, поражающие бактериальные клетки. В целом план строения у них такой же, как у прочих вирусов – это нуклеиновая кислота (чаще всего – ДНК) с записанными в ней генами вируса, заключенная в белковую оболочку-капсид.
Бактериофаги на кишечной палочке.(Фото Dennis Kunkel Microscopy, Inc. / Visuals Unlimited / Corbis.)
Бактериофаги под электронным микроскопом. (Фото Dr. Harold Fisher / Visuals Unlimited / Corbis.)
‹
›
Открыть в полном размере
Внешний облик у бактериофагов довольно своеобразен: их частицы состоят из головки, которая выглядит как правильная геометрическая фигура и в которой находится нуклеиновая кислота, и хвоста, с помощью которого фаг впрыскивает свою нуклеиновую кислоту в бактерию. У некоторых фагов на хвосте есть еще нити, похожие на ножки, помогающие им удерживаться на поверхности бактериальной клетки. Со стороны они похожи на какой-то зловещий механизм, и, когда говорят о вирусах, то чаще всего представляют именно фагов, с их хвостами и «ножками».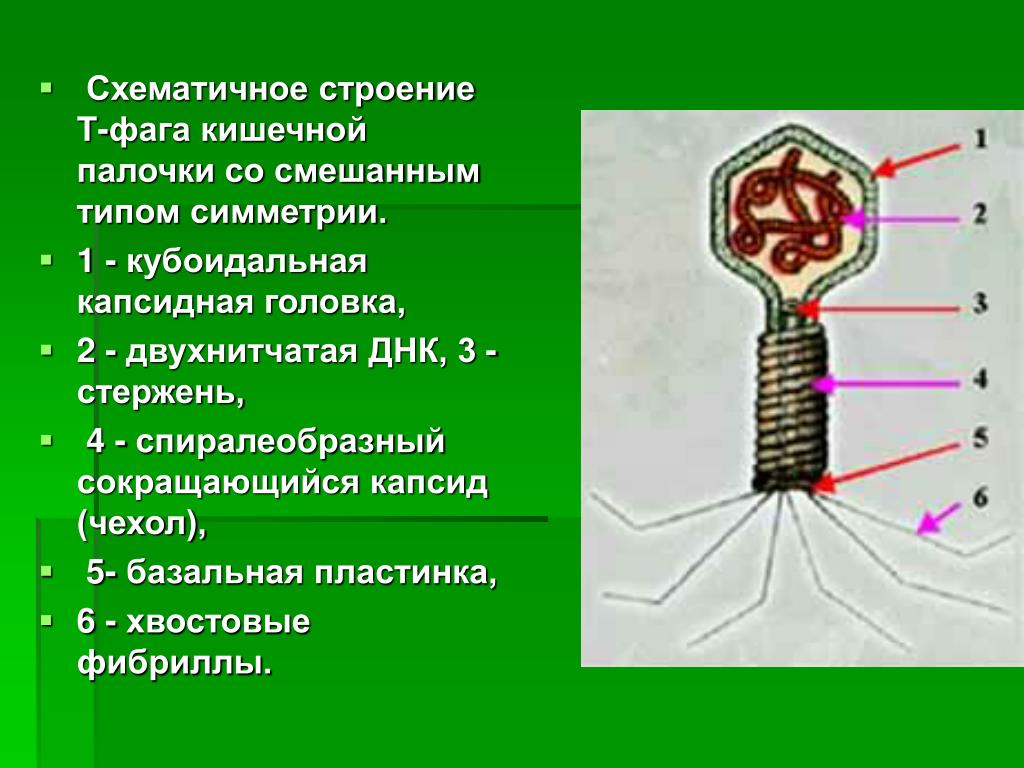
В зараженной клетке бактериофаги ведут себя так же, как обычные вирусы: их нуклеиновая кислота переключает на себя все ресурсы клетки, заставляя бактерию синтезировать вирусные белки и копировать вирусный генетический материал; белки и ДНК вируса собираются в полноценные вирусные частицы, которые заполняют клетку до отказа, и она в конце концов гибнет. Возможен и другой путь: геном фага встраивается в ДНК бактерии и остаётся в ней на какое-то время, переходя в таком виде из поколения в поколение. Потом, когда фагу это покажется удобным, он активируется и запускает «штамповку» новых копий самого себя.
Разные вирусы обычно специализируются на разных хозяевах, и бактериофаги – не исключение. Но часто случается так, что в одну и ту же клетку проникают два фага одной разновидности. Что происходит в таком случае? Соперничают ли они, стремясь вытеснить один другого, или же сотрудничают? Исследователи из Техасского университета A&M говорят, что бывает и так, и так, в зависимости от условий, в которых приходится жить бактериофагам.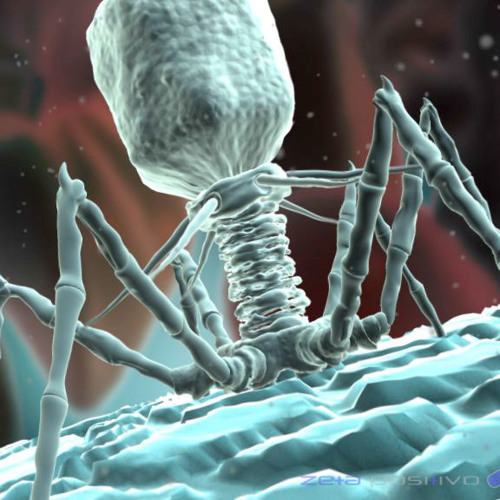
Эксперименты ставили с кишечной палочкой и бактериофагом лямбда. Чтобы можно было следить за двумя разными фагами и их потомками, их метили четырьмя флуоресцентными метками. Две из них принадлежали белкам вирусной оболочки, и, если в клетке появлялись именно белковые метки, это означало, что фаги спешно собирают готовые частицы.
Другие две метки становились видимыми, если у фагов включались гены, отвечающие за сохранение вирусного генома в бактериальной ДНК. Оказалось, что, когда дело доходило до сборки частиц, фаги начинали прямо конкурировать друг с другом – в конце концов в клетке оставался только кто-то один. Напротив, если вирусы решали «поспать» в клеточной ДНК, они начинали сотрудничать, помогая друг другу встроиться в чужой геном.
То есть фагам, оказавшимся вместе в одной клетке, приходилось решать, как жить дальше. Решение во многом зависело от внешних условий: если бактерий вокруг было много, если среда вокруг была благоприятна для роста бактериальной колонии, то вирусы вступали в гонку, стараясь подавить друг друга числом потомков.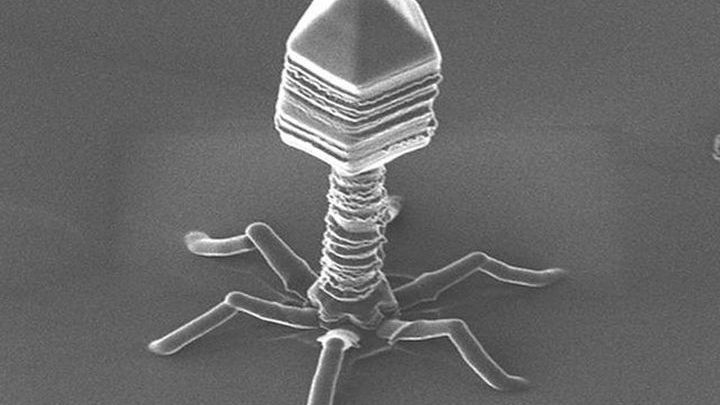 Преимущество получал тот, кто успел насинтезировать больше ДНК-копий – вирусная ДНК, как мы сказали выше, оттягивает на себя клеточные ресурсы, необходимые для собственного удвоения, поэтому тот, чьей ДНК оказалось больше, лишал ресурсов не только клетку-хозяина, но и конкурента. (Здесь немаловажно, кто когда проникает в клетку – у того, кто сделал это первым, будет определенная фора).
Преимущество получал тот, кто успел насинтезировать больше ДНК-копий – вирусная ДНК, как мы сказали выше, оттягивает на себя клеточные ресурсы, необходимые для собственного удвоения, поэтому тот, чьей ДНК оказалось больше, лишал ресурсов не только клетку-хозяина, но и конкурента. (Здесь немаловажно, кто когда проникает в клетку – у того, кто сделал это первым, будет определенная фора).
Если же клеток для размножения оказывалось мало, и если сама клетка жила плохо (так, что в ней нельзя было быстро наделать много вирусной ДНК), вирусы вместе укладывались спать. Причем они действительно помогали друг другу, что было видно в экспериментах с мутантными бактериофагами: если в клетку попадали два вируса с плохими мутациями в разных генах, отвечающих за встраивание в чужой геном, то для успешного внедрения они пользовались оставшимися нормальными белками друг друга – иными словами, решали проблему сообща. Будучи вместе, мутантные фаги эффективнее вставляли себя в бактериальный геном, чем если бы они попали в клетку поодиночке.
Такие совместные действия, как пишут авторы работы в Nature Communications, повышают разнообразие вирусного генома: встраиваясь в бактериальную ДНК, их гены перемешиваются, так что в перспективе, когда дело доходит до синтеза вирусных частиц, из таких сотрудничавших в прошлом вирусов могут получиться особи с новым генетическими вариантами. Короче говоря, взаимопомощь в трудные времена увеличивала генетическое разнообразие вирусов, а разнообразие – это всегда хорошо, поскольку повышает шансы на выживание.
В перспективе полученные результаты могут помочь в создании антибактериальных лекарств нового поколения. Как известно, к антибиотикам у микробов быстро появляется устойчивость, и потому сейчас часто говорят о том, чтобы пойти принципиально другим путем – например, начать использовать бактериофаги в качестве противоинфекционного средства, и чем больше мы будем знать о взаимоотношения фагов друг с другом и с бактериями, тем эффективней будут такие препараты.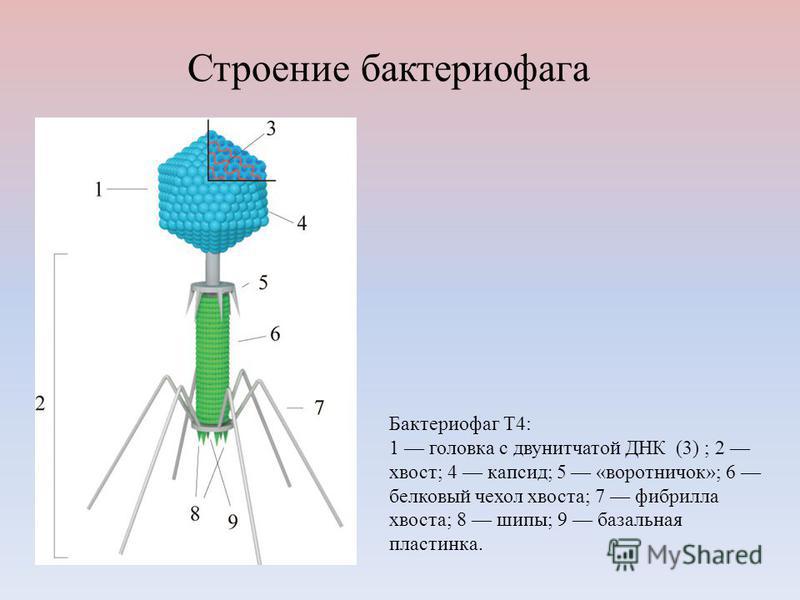
Бактериофаги – враги наших врагов
: 22 Июл 2013 , «Но чтоб сие здание [Академия] непременно и полезно было, то имеет оное само себя править» , том 50,
№2
Бактериофаги – это вирусы, способные уничтожать бактерии. Основная роль в природе этих «пожирателей» наиболее многочисленных клеточных организмов на Земле заключается в существенном ускорении разложения органического вещества. Тем самым фаги, влияя на глобальные геохимические процессы, поддерживают круговорот вещества и энергии в биосфере Земли. Что касается человека, то поскольку многие из бактерий являются нашими врагами, кажется естественным использовать фаги в качестве эффективного и безопасного «биологического оружия» для уничтожения или контроля численности вредных и болезнетворных микроорганизмов.
Наша страна была пионером фаготерапии, ставшей сегодня актуальным биомедицинским направлением.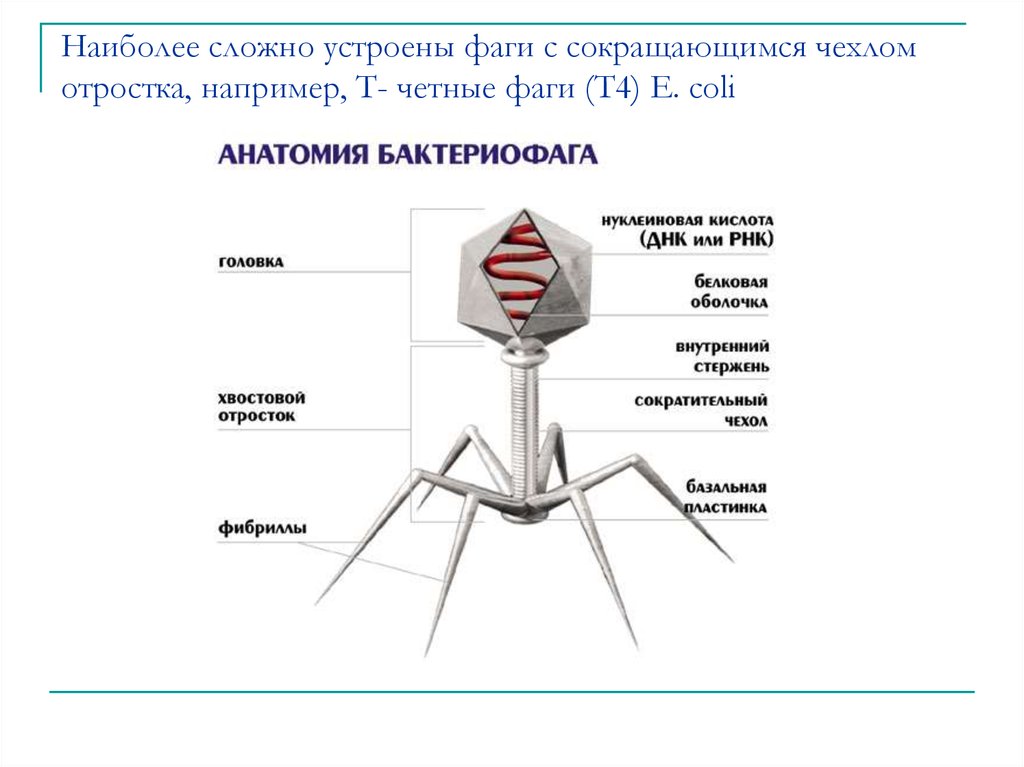 Первые отечественные фаговые препараты были разработаны в Тбилиси еще в 1930-е гг., а в настоящие дни они выпускаются в широком ассортименте. В отличие от обычных антибиотиков они обладают высокой избирательностью, не приводят к возникновению лекарственной устойчивости у патогенов и не имеют негативного побочного действия на организм больного. Однако их применение в клинической практике до сих пор ограничено в силу ряда объективных и субъективных причин, от противодействия крупных фармацевтических компаний до отсутствия квалифицированных специалистов и хорошо оборудованных микробиологических центров
Первые отечественные фаговые препараты были разработаны в Тбилиси еще в 1930-е гг., а в настоящие дни они выпускаются в широком ассортименте. В отличие от обычных антибиотиков они обладают высокой избирательностью, не приводят к возникновению лекарственной устойчивости у патогенов и не имеют негативного побочного действия на организм больного. Однако их применение в клинической практике до сих пор ограничено в силу ряда объективных и субъективных причин, от противодействия крупных фармацевтических компаний до отсутствия квалифицированных специалистов и хорошо оборудованных микробиологических центров
Бактериофаги (с древнегреч. – «пожирающие бактерии»), или просто фаги, – это вирусы, способные поражать бактерии. Согласно современным данным, основная роль в природе этих «убийц» бактерий, которые являются наиболее многочисленными клеточными организмами на Земле, заключается в существенном ускорении разложения органического вещества (в конечном счете до углекислого газа и воды).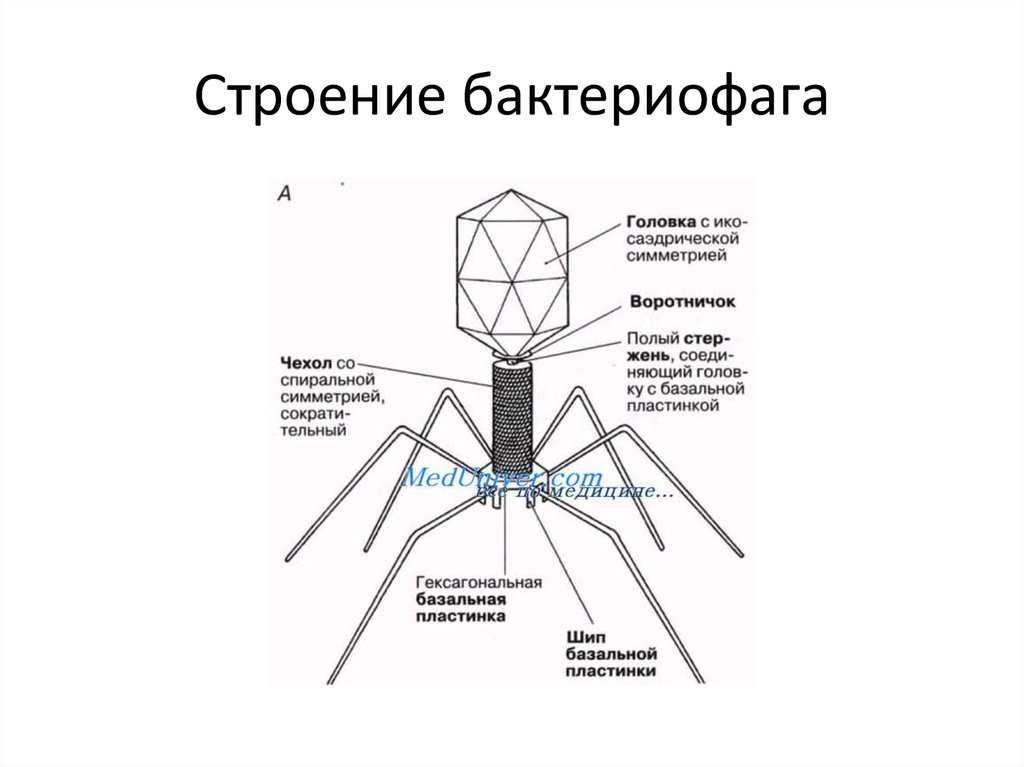 Тем самым фаги, влияя на глобальные геохимические процессы, поддерживают круговорот вещества и энергии в биосфере Земли. Что касается человека, то поскольку многие бактерии являются нашими врагами, кажется естественным использовать фаги в качестве эффективного и безопасного «биологического оружия» для уничтожения или контроля численности вредных и болезнетворных бактерий
Тем самым фаги, влияя на глобальные геохимические процессы, поддерживают круговорот вещества и энергии в биосфере Земли. Что касается человека, то поскольку многие бактерии являются нашими врагами, кажется естественным использовать фаги в качестве эффективного и безопасного «биологического оружия» для уничтожения или контроля численности вредных и болезнетворных бактерий
Бактериофаги обитают в почве (в 1 г – около 108 фагов), в реках, озерах и океанах (в 1 мл морской воды – 106 фагов), в других живых организмах (в желудочно-кишечном тракте человека – около 1012 фагов). Общая же численность бактериофагов, по оценке ученых, достигает астрономической цифры – 1031 фагов или 109 т вещества. Это своеобразная биологическая «темная материя», пронизывающая всю земную биосферу.
Еще несколько цифр: если предположить, что средний диаметр фаговой частицы составляет 50 нм, то все бактериофаги планеты, построенные «в одну шеренгу», составят линию протяженностью 5*1020 км или 5*107 световых лет! Именно на таком расстоянии расположено ближайшее к нам скопление галактик в созвездии Девы, а до ближайшей звезды Проксима Центавра всего 4,2 световых года
Как и все вирусы, бактериофаги находятся на границе между живым и неживым.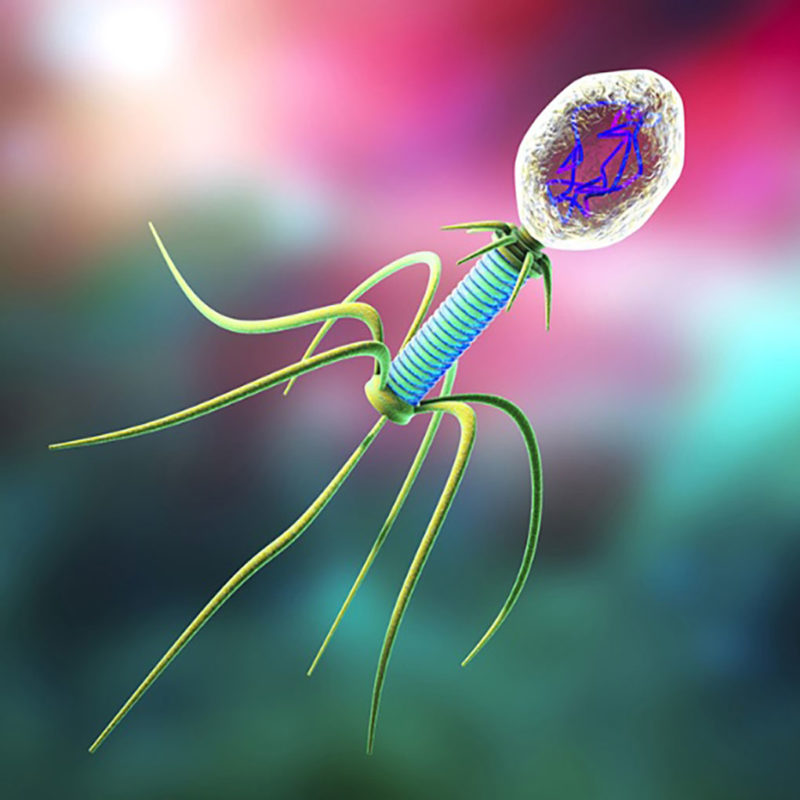 Вне клеток-хозяев большинство фагов существует в виде вирионов – объектов, напоминающих сложные молекулярные кристаллы. А «живут» фаги, т. е. размножаются, только внутри бактериальных клеток, поскольку их генома недостаточно для автономного существования.
Вне клеток-хозяев большинство фагов существует в виде вирионов – объектов, напоминающих сложные молекулярные кристаллы. А «живут» фаги, т. е. размножаются, только внутри бактериальных клеток, поскольку их генома недостаточно для автономного существования.
В 1915 г. англичанину В. Туорту и французу Ф. д’Эрелю удалось выделить эти агенты (впоследствии д’Эрелю пришлось многие годы бороться за свой приоритет с Туортом). Именно д’Эрель назвал вновь открытые частицы «бактериофагами». Он сразу понял, что они могут найти применение в качестве противобактериальных препаратов, и в 1919 г. впервые применил фаговый препарат для лечения дизентерии у детей
Бактериофаги были открыты свыше ста лет назад в исследованиях, проводившихся в разных странах почти одновременно. Еще в конце XIX в. исследователи, в том числе российский микробиолог Н. Ф. Гамалея, обнаружили некие мельчайшие агенты, проходящие сквозь поры фарфоровых фильтров, которые были способны убивать бактерии.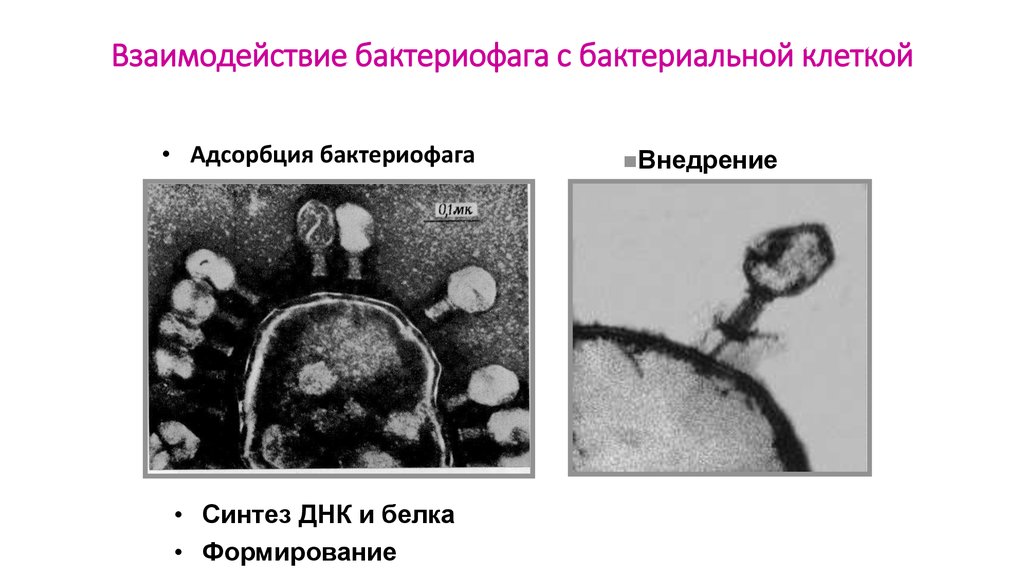
Мир бактериофагов весьма разнообразен: на сегодня известно более 500 разных видов фагов, отличающихся формой и строением. По отношению к бактериям фаги делятся на умеренные и литические. Умеренные фаги встраивают свой геном в геном бактерии, но проявляют свою «убийственную» активность не сразу: затаившись в нем, они размножаются вместе с бактериями и затем уничтожают их расплодившееся потомство. Лизирующие же фаги, заражая бактерию, сразу убивают ее. Именно такие простые фаги являются на сегодня наиболее привлекательными, с точки зрения использования в биотехнологиях и для терапевтических целей.
Боевые «машины»
Бактериофаги, эти настоящие природные боевые машины, устроены крайне просто: их генетический материал, ДНК или РНК, упакован в белковую оболочку, снабженную «орудиями» – специальными устройствами для нападения на бактерии.
Размер генома у разных фагов может различаться. У некоторых он очень мал – (от 3,5 тыс.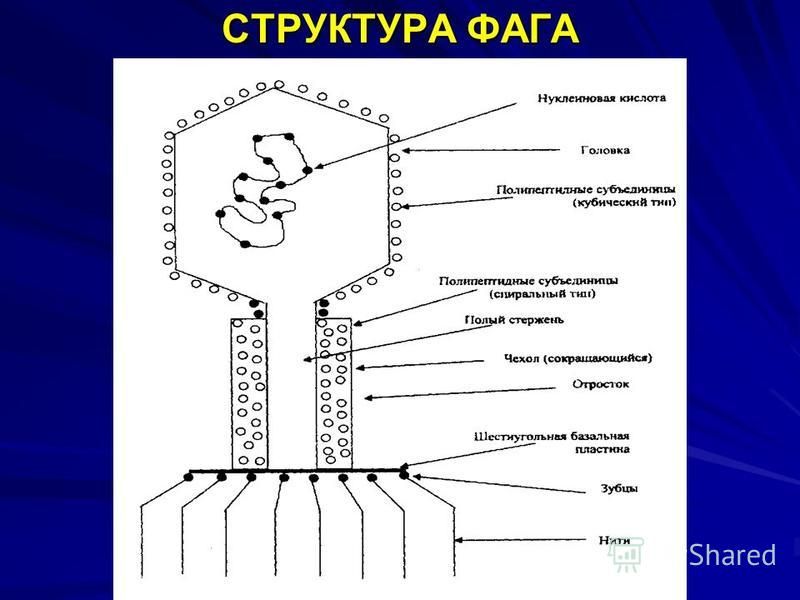 пар нуклеотидов), в таком геноме хранится информация всего лишь о 3—4 белках. Более того, гены, кодирующие эти белки, вынуждены перекрываться (накладываться друг на друга). Размер геномов у других фагов сопоставим с размером геномов крупных, сложно организованных вирусов многоклеточных животных, достигая 170 тыс. пар нуклеотидов (самый крупный из известных фагов содержит около 480 тыс. пар оснований!). Такой геном может кодировать уже до двухсот различных белков. Именно такие фаги обычно имеют большие размеры и сложно организованы.
пар нуклеотидов), в таком геноме хранится информация всего лишь о 3—4 белках. Более того, гены, кодирующие эти белки, вынуждены перекрываться (накладываться друг на друга). Размер геномов у других фагов сопоставим с размером геномов крупных, сложно организованных вирусов многоклеточных животных, достигая 170 тыс. пар нуклеотидов (самый крупный из известных фагов содержит около 480 тыс. пар оснований!). Такой геном может кодировать уже до двухсот различных белков. Именно такие фаги обычно имеют большие размеры и сложно организованы.
ЧУДЕСА БАКТЕРИОФАГОВ
Люди издавна сталкивались с чудесными случаями исцелений от инфекционных заболеваний. Сегодня мы имеем право считать, что зачастую их можно объяснить неосознанным использованием бактериофагов. Ведь эти бактерицидные агенты встречаются на Земле повсеместно – в почве и в воде, а для лечения воспалений и ран с древнейших времен применяли грязи и смеси на основе природных продуктов. Не исключено, что подобные случаи чудесного исцеления вызвали к жизни такие обряды, как омывание в священных водах Ганга и крещение в Иордане.
Не исключено, что подобные случаи чудесного исцеления вызвали к жизни такие обряды, как омывание в священных водах Ганга и крещение в Иордане.
Антибактериальную активность природных продуктов пытались использовать и не в столь далекие времена. В 1920-х гг. великий хирург-архиепископ Святитель Лука (Войно-Ясенецкий), находясь в ссылке в глухой деревне, узнал о местной знахарке, умеющей излечивать гнойные раны и чирьи с помощью смеси из земли, кислого молока и золы. Лука попытался разобраться в природе этого явления, экспериментируя с составом композиции. Однако результаты лечения плохо воспроизводились (впрочем, как и у всех работавших в то время с бактериофагами). Иногда оно приводило к фантастически быстрому излечению больных, иногда вовсе не помогало. Не имея необходимых условий для работы и возможности ознакомиться с медицинской литературой, Лука вынужден был оставить свои исследования. Сейчас мы знаем, что эффективность фагового препарата будет зависеть от того, имеются ли в его составе бактериофаги, «специализирующиеся» на патогенных бактериях конкретного пациента
Лизирующий фаг своим видом больше всего напоминает космический корабль-робот, способный стыковаться с заданным объектом. К головке фага, представляющей собой белковый резервуар с упакованной в ней ДНК, присоединен «хвост» − белковая структура наподобие щупалец, на которых расположены так называемые узнающие элементы, способные прочно связываться с рецепторами (особыми белками или полисахаридами) на поверхности бактерии.
К головке фага, представляющей собой белковый резервуар с упакованной в ней ДНК, присоединен «хвост» − белковая структура наподобие щупалец, на которых расположены так называемые узнающие элементы, способные прочно связываться с рецепторами (особыми белками или полисахаридами) на поверхности бактерии.
После такой «стыковки» с бактерией-мишенью фаг прочно прилипает к ее поверхности. На одну бактериальную клетку могут одновременно напасть сотни бактериофагов, но чтобы убить ее, достаточно и одного. При этом взаимодействие фаг-клетка очень специфично: конкретный фаг может взаимодействовать лишь с определенными (целевыми) видами бактерий и не способен присоединяться к клеткам человека.
Когда фаг закрепится на поверхности бактерии, его «хвост» с помощью специальных белков внедряется в бактериальную стенку, протыкая ее. Сквозь хвостовой канал генетический материал фага вбрасывается в клетку. Генетические программы фага берут под контроль все жизнеобеспечение клетки: с этого момента все ее материальные и энергетические ресурсы, все молекулярные «машины» переключаются на синтез белков и копий генома фага.
Бактерия обречена. В течение следующего получаса в клетке синтезируются сотни и тысячи новых фаговых частиц, после чего она разрушается, высвобождая очередной отряд бактериальных «убийц».
Гонка вооружений
По оценке специалистов, каждые двое суток бактериофаги уничтожают половину мировой популяции бактерий. Вот почему эти быстро размножающиеся организмы не покрыли толстым слоем всю поверхность нашей планеты – в отсутствии фагов они сделали бы это за несколько дней.
Удивительно, но зачастую бактериофаги убивают не все целевые бактерии. Так, из одного фекального образца можно высеять одновременно как живые бактериальные клетки, так и фаги, их инфицировавшие. Между тем в фекалиях человека концентрация бактерий составляет 105—108 КОЕ/г, что намного превышает концентрацию, необходимую для экспоненциального размножения фагов. Бактериофаг может очень эффективно убивать бактерии в культуре, но оказывается неспособен подавить их размножение в организме. Вероятно, имеется какой-то природный механизм, обеспечивающий одновременное сосуществование «охотников» и их «жертв»
Вероятно, имеется какой-то природный механизм, обеспечивающий одновременное сосуществование «охотников» и их «жертв»
Но несмотря на такую высочайшую антибактериальную эффективность фагов, бактерии все же не исчезли с лица планеты. Дело в том, что в течение многих миллионов лет шла совместная эволюция этих организмов, которую было бы точнее назвать «гонкой вооружений». Благодаря мутациям фаги «изобретали» все новые средства и приемы ведения войны, а бактерии, в свою очередь, хитроумные средства защиты.
Например, ДНК всех бактерий несет на себе особые метки (метилированные основания), и специальные бактериальные ферменты рестрикции расщепляют любую ДНК, на которой таких меток нет, в том числе и фаговую. Однако некоторые фаги научились имитировать такие метки и таким способом обходить защиту.
Еще один защитный механизм бактерий – изменение поверхностных рецепторов: в этом случае фаг просто не может узнать «свою» бактерию.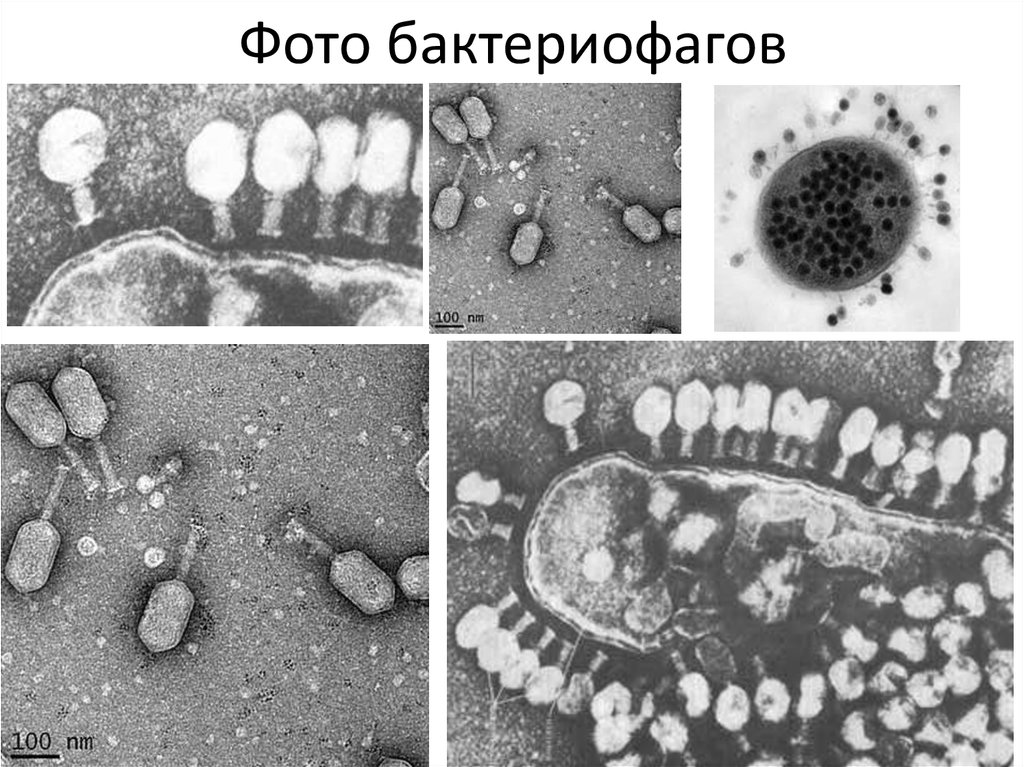 В ответ на это появляются фаги, несущие измененные узнающие элементы, которые способны связываться с новыми бактериальными рецепторами. Имеется несколько механизмов подобной модификации генетических программ у фагов и бактерий. Мутации могут возникать случайно, в ходе генетического копирования. Кроме того, с помощью рекомбинации (генетического перераспределения) разные виды фагов могут обмениваться фрагментами своего генома и даже захватывать фрагменты генома бактерий.
В ответ на это появляются фаги, несущие измененные узнающие элементы, которые способны связываться с новыми бактериальными рецепторами. Имеется несколько механизмов подобной модификации генетических программ у фагов и бактерий. Мутации могут возникать случайно, в ходе генетического копирования. Кроме того, с помощью рекомбинации (генетического перераспределения) разные виды фагов могут обмениваться фрагментами своего генома и даже захватывать фрагменты генома бактерий.
К слову сказать, с точки зрения медицины, изменение рецепторов болезнетворной бактерии может быть благом для человека, поскольку именно бактериальные рецепторы служат факторами вирулентности, определяющими выживание и размножение возбудителя в организме-хозяине. И устойчивые к фагу мутанты обычно являются менее патогенными по сравнению со своими предшественниками.
Фаготерапия: сквозь тернии
Открытие вирусов, убивающих бактерии, дало начало новому способу контроля за численностью бактерий. Самое очевидное приложение – фаготерапия, применение бактериофагов для лечения бактериальных инфекций человека. Ее преимуществом является крайняя специфичность фагов, поражающих только «избранные» болезнетворные агенты.
Самое очевидное приложение – фаготерапия, применение бактериофагов для лечения бактериальных инфекций человека. Ее преимуществом является крайняя специфичность фагов, поражающих только «избранные» болезнетворные агенты.
В медицинских целях бактериофаги были впервые применены в 1915 г., когда один из их первооткрывателей, Ф. д’Эрель, использовал такой препарат для лечения дизентерии у детей. Однако дальнейшая история развития фаговой терапии была непростой. Дело в том, что предложения д’Эреля намного опередили свое время, и долгие годы ему пришлось бороться за признание своего открытия. В том числе со знаменитыми французскими коллегами, которые не признавали точку зрения д’Эреля на природу этих бактерицидных агентов, считая их ферментами. Истина восторжествовала лишь в 1940-х гг., но задолго до этого, устав от борьбы, д’Эрель уехал работать в США.
В 1934 г. он приехал в Грузию, в Тбилиси, где к тому времени сложились уникальные возможности для развития фаговой терапии. Еще с 1918 г. там существовала лаборатория (впоследствии − институт) микробиологии, руководитель которой, Г. Элиава, был командирован в знаменитый Институт Пастера для освоения методик и приобретения оборудования. Именно там он и познакомился с д’Эрелем и его удивительным открытием.
Еще с 1918 г. там существовала лаборатория (впоследствии − институт) микробиологии, руководитель которой, Г. Элиава, был командирован в знаменитый Институт Пастера для освоения методик и приобретения оборудования. Именно там он и познакомился с д’Эрелем и его удивительным открытием.
Так у Элиавы родилась мечта создать в Тбилиси мировой центр исследования бактериофагов. Эта идея заинтересовала И. В. Сталина, и в 1930 г. было построено и оснащено здание будущего Института бактериофагов, микробиологии и вирусологии, который сейчас носит имя его основателя. Однако далее события развивались по сценарию, характерному для СССР тех лет: в 1937 г. Элиава вместе с женой был арестован и расстрелян как «враг народа», а д’Эрель вернулся в Париж. Однако сам институт не погиб и продолжал успешно функционировать.
С начала 1940-х гг. фаговая терапия начала применяться в странах Европы и США. Такие препараты получили миллионы пациентов, однако результаты лечения оказались противоречивы и невоспроизводимы.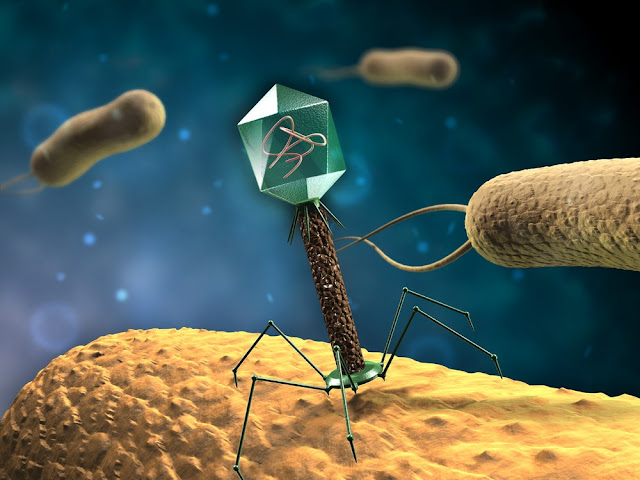 Реклама обещала чудеса, но их не было – сама идея фаготерапии была скомпрометирована. Причина заключалась в том, что в то время не только производители препаратов, но и сами ученые не располагали необходимыми знаниями о свойствах фагов и о механизме их действия, да к тому же не имелось и надежных технологий работы с вирусами.
Реклама обещала чудеса, но их не было – сама идея фаготерапии была скомпрометирована. Причина заключалась в том, что в то время не только производители препаратов, но и сами ученые не располагали необходимыми знаниями о свойствах фагов и о механизме их действия, да к тому же не имелось и надежных технологий работы с вирусами.
Неудачи следовали за неудачами, поэтому неудивительно, что аптекари и врачи вздохнули с облегчением с появлением антибиотиков. Эти относительно дешевые, с широким спектром антибактериальной активности, хорошо хранящиеся химические вещества, казалось, радикально решили проблему лечения инфекционных заболеваний. Бактериофаги на Западе были забыты на много лет. Основанная д’Эрелем французская компания по выпуску коммерческих фаговых препаратов переключилась на другие проекты (на ее основе выросла знаменитая косметическая компания L’Oreal).
Исследования фагов продолжались только в СССР, Польше и Чехословакии. Самым большим производителем фаговых препаратов был грузинский институт, созданный Элиавой: к 1980-х гг.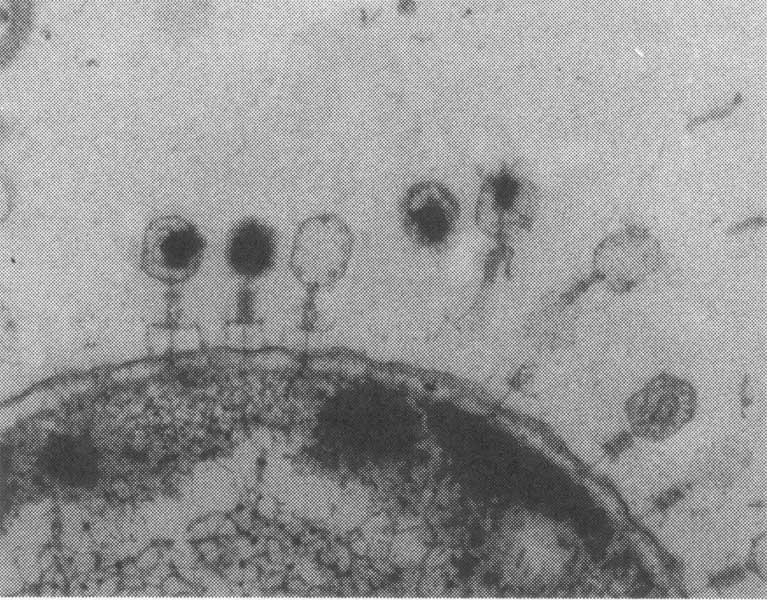 там работало около 1200 человек, а препараты рассылались для испытаний в клиниках по всему СССР. Производство бактериофагов было организовано также в Уфе и Горьком.
там работало около 1200 человек, а препараты рассылались для испытаний в клиниках по всему СССР. Производство бактериофагов было организовано также в Уфе и Горьком.
Кстати сказать, в прекращении работ с бактериофагами за рубежом, помимо успеха антибиотиков, большую роль сыграл и политический аспект. Ведь фаговая терапия развивалась в СССР, и западным ученым было политически «неправильным» работать по тематике, связанной с именем Сталина. К тому же это были времена лысенковщины, когда западная наука воспринимала со скептицизмом все, что делалось советскими биологами.
Коктейли из фагов
Новый виток интереса к фаговой терапии пришелся на последние годы. Дело в том, что антибиотики тоже не стали панацеей при лечении бактериальных инфекций: в наши дни разработка новых препаратов не поспевает за ростом числа бактерий с приобретенной устойчивостью к существующим антибиотикам. Уже сегодня в госпиталях Англии около 40 % стафилококковых инфекций вызвано такими штаммами, а в США от госпитальных инфекций, вызванных лекарственно устойчивыми бактериями, ежегодно умирает около 90 тыс. пациентов. При пересчете на население Земли это число составляет 3—5 млн смертей в год!
пациентов. При пересчете на население Земли это число составляет 3—5 млн смертей в год!
ВОЗ предупреждает, что мир вскоре вступит в «постантибиотиковую» эру, когда лечить обычные бактериальные инфекции будет нечем. И на этом фоне фаготерапия выглядит весьма перспективным направлением, развитие которого может привести к созданию эффективных персонализированных методов лечения заболеваний. Для этого есть как необходимые знания о фагах и механизмах их взаимодействия с бактериальными клетками, так и технологии работы с вирусными агентами.
Для фаговой терапии сегодня используют только вирулентные лизирующие фаги, в основном «хвостатые» фаги порядка Caudovirales, а также нитчатые фаги семейств Leviviridae (с одноцепочечным РНК-геномом) и Inoviridae (с одноцепочечным кольцевым ДНК-геномом).
Как говорилось выше, спектры активности фагов обычно очень узки и ограничены одним или несколькими близкородственными видами бактерий. С одной стороны, такая узкая специфичность хороша для терапии, поскольку позволяет устранить конкретный микроорганизм, не нарушая всего бактериального сообщества человеческого организма. С другой стороны, при необходимости экстренного лечения (когда нет времени для выявления конкретной бактерии, вызывающей развитие болезнетворного процесса в ране или на обожженной поверхности) необходимо иметь препарат, поражающий сразу несколько видов бактерий, возможных возбудителей инфекции. Для решения этой проблемы обычно используют коктейли фагов – препараты, содержащие несколько фагов, отличающихся по специфичности.
С одной стороны, такая узкая специфичность хороша для терапии, поскольку позволяет устранить конкретный микроорганизм, не нарушая всего бактериального сообщества человеческого организма. С другой стороны, при необходимости экстренного лечения (когда нет времени для выявления конкретной бактерии, вызывающей развитие болезнетворного процесса в ране или на обожженной поверхности) необходимо иметь препарат, поражающий сразу несколько видов бактерий, возможных возбудителей инфекции. Для решения этой проблемы обычно используют коктейли фагов – препараты, содержащие несколько фагов, отличающихся по специфичности.
Такой подход использовал еще д’Эрель. Коктейль д’Эреля, привезенный им из Парижа еще в 1930 г., до сих пор является одним из основных фаговых препаратов: он лежит в основе грузинского пиофага и российского интестифага. В Тбилиси на основе фаговых коктейлей разрабатывались препараты для лечения желудочно-кишечных заболеваний и гнойных ран для массового применения в случае возникновения эпидемий или военных действий.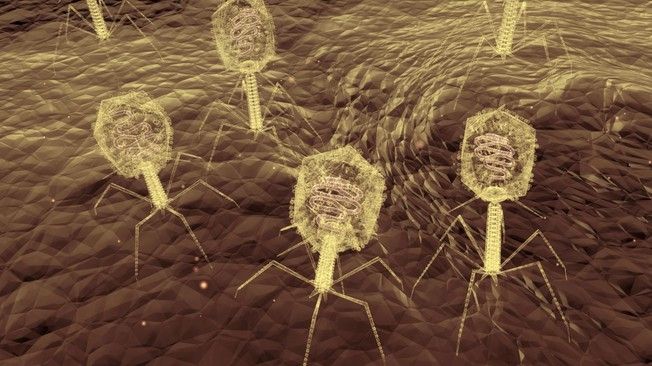 Результаты армейских испытаний и широкого эксперимента по предотвращению детских желудочно-кишечных расстройств, проведенного в Тбилиси, показали хорошую эффективность таких препаратов.
Результаты армейских испытаний и широкого эксперимента по предотвращению детских желудочно-кишечных расстройств, проведенного в Тбилиси, показали хорошую эффективность таких препаратов.
Фаговые коктейли производятся стандартными, и ориентированы они на сообщества бактерий, часто встречающиеся при конкретных заболеваниях. Конечно, более эффективные коктейли получаются в том случае, когда их компоненты подбирают к бактериальному сообществу конкретного пациента. Для получения такого коктейля необходимо протестировать бактерии пациента на чувствительность к фагам из коллекции, чтобы подобрать наиболее эффективные фаговые штаммы. Если нужных фагов в коллекции не окажется, специфичные для бактерий фаги ищут в природных субстратах.
Вообще поиск бактериофагов довольно прост: на бактериальную культуру воздействуют образцами из различных источников: водоемов, почвы, канализационных стоков и т. п. Если бактерии погибают, их отделяют от раствора центрифугированием, а оставшийся раствор тестируют на активность.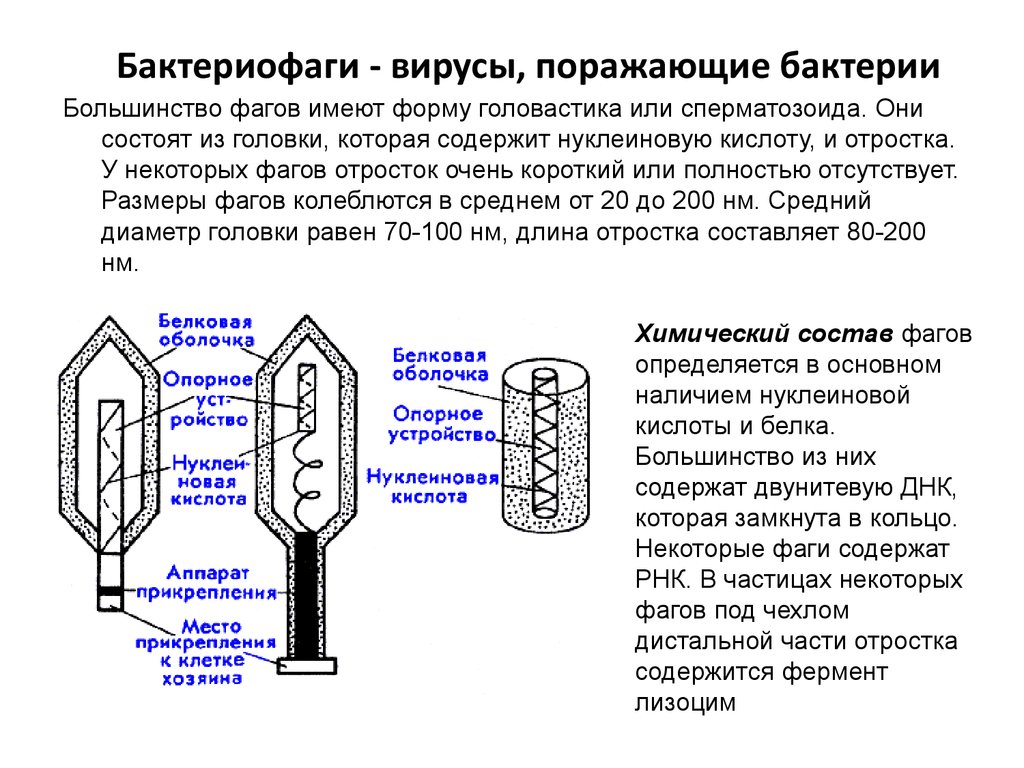 Затем фаг размножают, выращивая на соответствующей бактериальной культуре. Более того, фаги можно лиофилизировать (высушить в вакууме) и непосредственно использовать в капсулах. В таком виде препарат сохраняют стабильность в течение 14 месяцев при температуре до 55 °С.
Затем фаг размножают, выращивая на соответствующей бактериальной культуре. Более того, фаги можно лиофилизировать (высушить в вакууме) и непосредственно использовать в капсулах. В таком виде препарат сохраняют стабильность в течение 14 месяцев при температуре до 55 °С.
Современная история
К настоящему времени самый большой опыт фаготерапии имеют специалисты из Тбилиси и специализированного центра Института иммунологии и экспериментальной терапии им. Л. Хиршфельда (Вроцлав, Польша), где в небольших количествах производятся препараты бактериофагов для испытаний.
Польские исследователи изначально делали акцент на персонализированную терапию. Они использовали фаготерапию для экспериментального лечения пациентов с хроническими заболеваниями, которым не помогают антибиотики. Через центр прошли уже тысячи пациентов, многие из которых были полностью излечены.
Результаты этих клинических испытаний доказали высокую эффективность фагов при лечении инфекционных легочных заболеваний: для подавления инфекции в горле, носу и в легких достаточно однократного интраназального введения препарата. Не менее эффективно фаги элиминируют патогенные бактерии из желудочно-кишечного тракта. Высокая эффективность бактериофагов была также продемонстрирована практически во всех случаях гноеродной язвы диабетической стопы, заболеваний легких, мастита, урогенитальных инфекциях. Список таких заболеваний можно продолжить, при этом важно отметить, что ни в одном из испытаний не наблюдалось каких-либо побочных эффектов, вызванных бактериофагами.
Не менее эффективно фаги элиминируют патогенные бактерии из желудочно-кишечного тракта. Высокая эффективность бактериофагов была также продемонстрирована практически во всех случаях гноеродной язвы диабетической стопы, заболеваний легких, мастита, урогенитальных инфекциях. Список таких заболеваний можно продолжить, при этом важно отметить, что ни в одном из испытаний не наблюдалось каких-либо побочных эффектов, вызванных бактериофагами.
В качестве специфичных агентов, уничтожающих бактерии, бактериофаги сегодня находят применение в терапии заболеваний не только людей, но и животных, а также для защиты растений и при консервации пищевой продукции.
Так, в 2006 г. FDA разрешила применение бактериофаговых коктейлей для обработки мясных и других сельскохозяйственных продуктов. В этом случае фаги получили статус пищевых добавок. Они также были разрешены к применению в качестве средства дезинфекции.
Препараты фагов (в виде аэрозолей) были успешно испытаны в экспериментах по защите сельскохозяйственных птиц на крупных фермах, а также в рыбоводческих хозяйствах
В Англии фаговые препараты были успешно испытаны для лечения хронического отита, трудно излечимого заболевания вследствие образования так называемых бактериальных биофильмов – лекарственно-устойчивых микробных пленок. Во Франции –колыбели фаговой терапии – исследования в этой области сейчас почти не ведутся, хотя до последнего времени Институт Пастера делал фаговые коктейли на заказ.
Во Франции –колыбели фаговой терапии – исследования в этой области сейчас почти не ведутся, хотя до последнего времени Институт Пастера делал фаговые коктейли на заказ.
В промышленных масштабах фаговые препараты сегодня производит российская компания Микроген. Подобные лекарства можно купить в аптеках в России, Белоруссии и на Украине. Фаговые препараты производства Микроген и Тбилисского центра для лечения ожоговых инфекций были успешно испытаны и в Бельгии.
Тем не менее до сих пор в большинстве стран применение бактериофагов в терапии официально не разрешено: это касается как FDA, американского Управления по контролю качества пищевых продуктов и лекарственных препаратов, так и аналогичных европейских агентств. На территории Евросоюза фаги для лечения больных используют только в вышеупомянутом польском Институте иммунологии и экспериментальной терапии.
Поэтому лечение заинтересованных больных проводится в режиме медицинского туризма. Компания «Phage international» (Калифорния, США) направляет пациентов из разных стран, страдающих от хронических заболеваний, вызванных лекарственно устойчивыми бактериями, либо в Центр фаговой терапии в Тбилиси, либо в свою клинику в Мексике.
Компания «Phage international» (Калифорния, США) направляет пациентов из разных стран, страдающих от хронических заболеваний, вызванных лекарственно устойчивыми бактериями, либо в Центр фаговой терапии в Тбилиси, либо в свою клинику в Мексике.
Выбираем фаги
Почему же фаговая терапия до сих пор не нашла широкого применения? Ведь очевидно, что антибиотики должны быть препаратом выбора при остром, угрожающем жизни заболевании, когда нет времени для подбора специфичного агента. Зато при хронических инфекциях предпочтение следует отдать бактериофагам, как более дружественным агентам.
Среди причин, сдерживающих применения фагов в медицине, в первую очередь следует отметить скептическое отношение многих специалистов, особенно зарубежных. По сложившейся недоброй традиции западные исследователи, несмотря на свое отставание в этой области, до сих пор выражают недоверие к результатам исследований, в свое время успешно проводимых в СССР.
Но есть и более весомые причины, связанные с тем, что в бактериофагах не заинтересованы большие фармацевтические компании.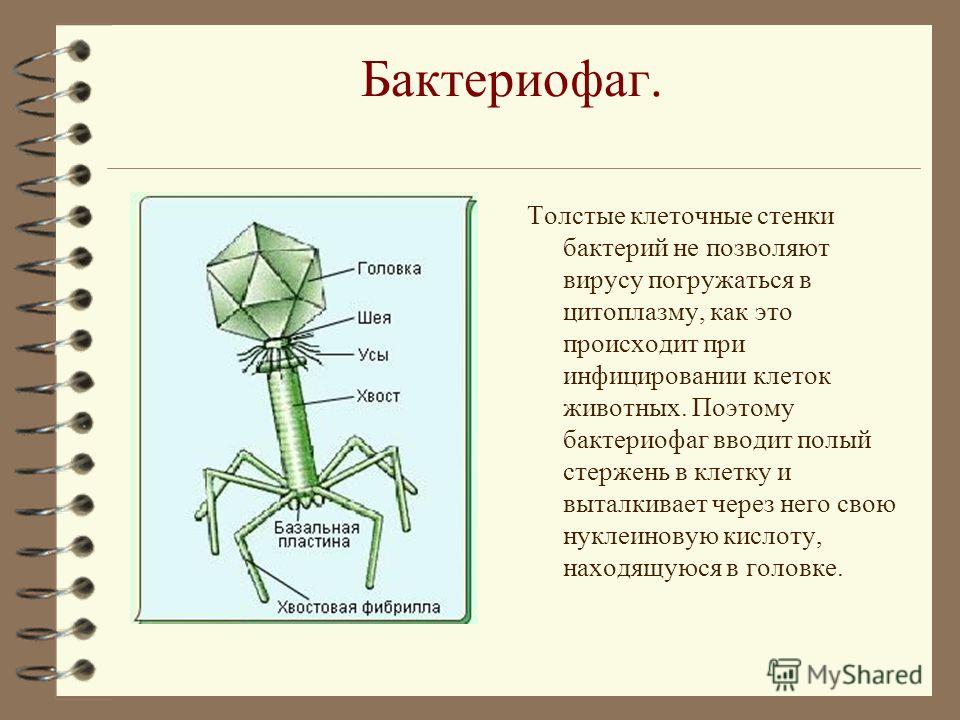 Им нужны исключительные права на изобретения, но фаги – природные агенты, поэтому запатентовать их не так просто, а сама идея фаговой терапии опубликована давно. Кроме того, эти компании вложили огромные средства в производство антибиотиков, поэтому им не нужна конкуренция с дешевыми фаговыми препаратами.
Им нужны исключительные права на изобретения, но фаги – природные агенты, поэтому запатентовать их не так просто, а сама идея фаговой терапии опубликована давно. Кроме того, эти компании вложили огромные средства в производство антибиотиков, поэтому им не нужна конкуренция с дешевыми фаговыми препаратами.
Что касается самих врачей, то они стандартно обучены применять для достижения максимального эффекта антибиотики широкого спектра действия. При фаговой же терапии нужно иметь большой арсенал препаратов, каждый из которых нужно тестировать и подбирать индивидуально для каждого больного. Это в конечном счете приводит к значительному удорожанию такого персонализированного лечения. К тому же хотя люди продолжают умирать от заражения лекарственно устойчивыми бактериями, однако с экономической точки зрения, этот рынок не слишком велик, а лече-ние таких тяжелых больных чревато юридическими проблемами.
Вместе с тем та же FDA сегодня признает, что благодаря своей высокоспецифичности и нетоксичности фаги помогают там, где альтернативные методы оказываются неэффективными.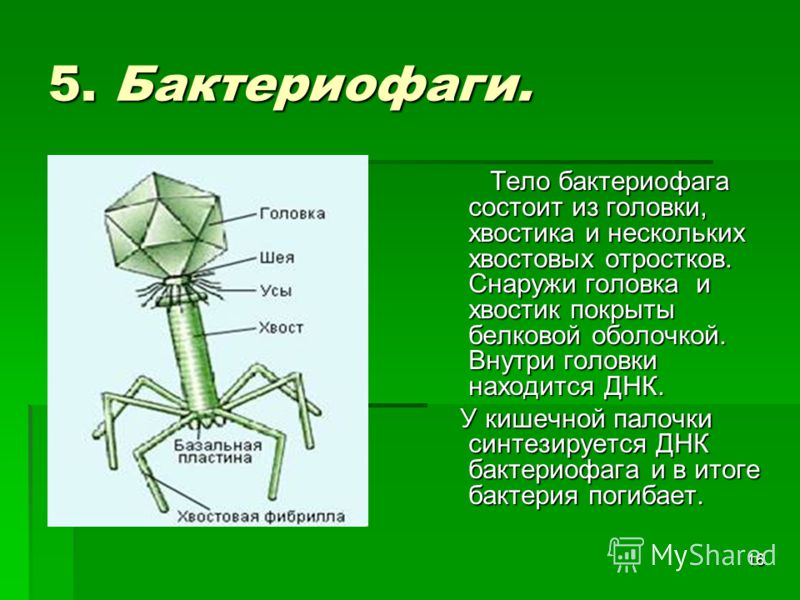 Поэтому FDA планирует выработать практические рекомендации по использованию литических фагов в терапии. Для этого необходимо секвенировать их геномы, определить безопасные условия культивирования, провести современное стандартное тестирование токсичности на животных. В случае использования фаговых коктейлей каждый их компонент должен быть охарактеризован. И, наконец, для доказательства эффективности этих препаратов необходимы контролируемые клинические испытания.
Поэтому FDA планирует выработать практические рекомендации по использованию литических фагов в терапии. Для этого необходимо секвенировать их геномы, определить безопасные условия культивирования, провести современное стандартное тестирование токсичности на животных. В случае использования фаговых коктейлей каждый их компонент должен быть охарактеризован. И, наконец, для доказательства эффективности этих препаратов необходимы контролируемые клинические испытания.
Кстати сказать, применение фагов в медицине может оказаться шире, чем это сегодня представляется. Так, современные технологии позволяют создавать фаги, производящие антибактериальные токсины, которые фаги будут доставлять непосредственно в бактериальную клетку. С помощью генетической инженерии сегодня можно заниматься настоящим дизайном фагов, например, получить фаги с измененной и расширенной специфичностью. Совершенно реалистичной задачей является и полный синтез фаговых геномов.
АНТИБИОТИКИДостоинства:
широкий спектр действия;
простота патентования
Недостатки:
разрушают собственную микрофлору организма,
что создает угрозу вторичных инфекций;
не способны концентрироваться в области
инфекционного поражения;
вызывают побочные эффекты: аллергии, кишечные
расстройства и т. д.;
приводят к возникновению бактериальных штаммов с лекарственной устойчивостью;
создание новых антибиотиков – длительный
и дорогостоящий процесс БАКТЕРИОФАГИДостоинства:
специфичность действия, для любой бактерии можно найти убивающий ее бактериофаг;
поиск нового фага занимает несколько дней или недель;
производство недорогое и экологически чистое;
не вызывают дисбактериоза;
не токсичны и не вызывают побочных эффектов;
после уничтожения патогенного агента элиминируются из организма
Недостатки:
слишком высокая избирательность – для гарантии
успеха лечения нужно идентифицировать патоген;
патентование затруднено из-за многообразия агентов
Уже испытываются в качестве противобактериальных средств отдельные компоненты фагов и вещества, используемые ими для поражения бактерий. Например, бактериоцины, фрагменты хвостовой структуры фагов, которые повреждают клеточную стенку бактерий, образуя в ней поры, что приводит к быстрой потере важных для клетки ионов и ее гибели.
Например, бактериоцины, фрагменты хвостовой структуры фагов, которые повреждают клеточную стенку бактерий, образуя в ней поры, что приводит к быстрой потере важных для клетки ионов и ее гибели.
Также разрабатываются подходы к применению фагов в качестве носителей лекарств – антител или химических терапевтических препаратов. На одну фаговую частицу можно присоединить до тысячи молекул антител и до нескольких тысяч молекул антибиотика. А благодаря присоединению к поверхности бактериофагов молекул полиэтиленгликоля удается получать фаги, способные долгое время циркулировать в кровотоке. Кроме того, фаги, несущие на поверхности определенные пептидные антигены, можно использовать в качестве вакцин.
Очевидно, что в XXI в. стимуляция дальнейшего развития фаготерапии должна стать делом государственным. Необходимо создать все условия для создания и поддержания коллекции фагов против устойчивых к антибиотикам патогенов. Что касается всевозможных разрешительных документов, то есть простое решение проблемы: рассматривать фаговые препараты наравне с вакцинами от гриппа.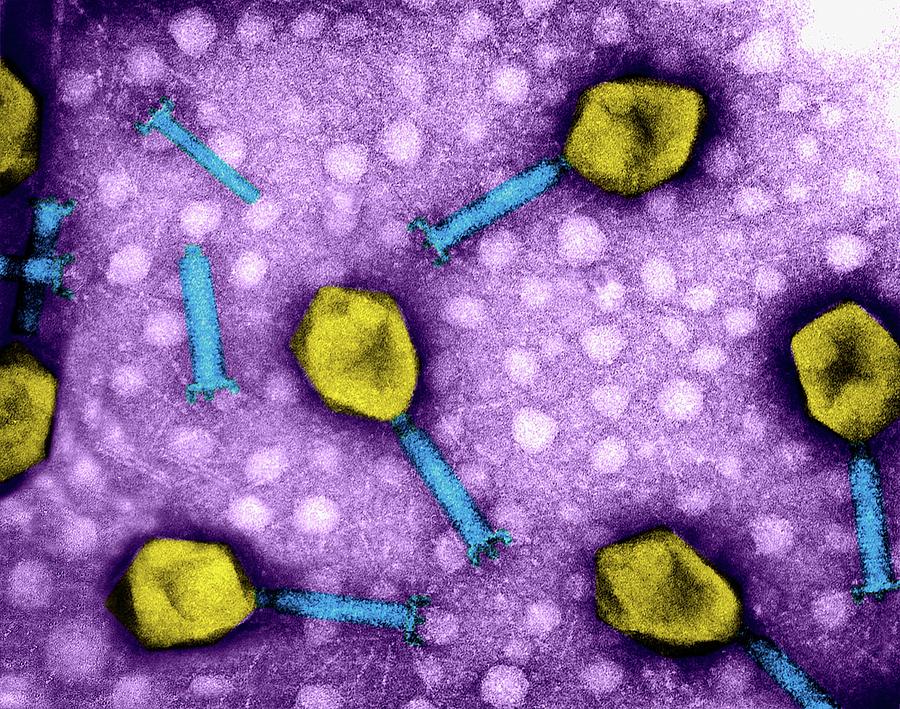 Ведь каждый год готовятся живые противогриппозные вакцины, представляющие собой коктейли нескольких вирусных штаммов, при этом их состав постоянно меняется. И разрешение распространяется на все эти вирусные коктейли, – а чем хуже фаги?
Ведь каждый год готовятся живые противогриппозные вакцины, представляющие собой коктейли нескольких вирусных штаммов, при этом их состав постоянно меняется. И разрешение распространяется на все эти вирусные коктейли, – а чем хуже фаги?
В России сегодня сложилась уникальная ситуация: фаговая терапия у нас разрешена, производится широкий ассортимент «индивидуальных» фаговых препаратов и фаговых коктейлей. Почему же их так редко применяют? Главным образом по причине уже упоминавшейся необходимости персонализированного подхода при фаготерапии. Ведь стандартные фаговые препараты не гарантируют результата, а если препарат не срабатывает, то это не только разочаровывает лечащего врача, но и в случае острого заболевания создает рискованную ситуацию для пациента.
Выход в данной ситуации очевиден: нужно обязательно тестировать бактерии пациента на восприимчивость к фаговому препарату. Это можно делать лишь в хорошо оборудованных центрах, располагающих коллекциями фагов и лабораториями для микробиологического тестирования. Если сеть таких центров будет создаваться в рамках планируемого развития персонализированной медицины, то у нашей страны будут все шансы попасть в лидеры этого важнейшего биомедицинского направления.
Если сеть таких центров будет создаваться в рамках планируемого развития персонализированной медицины, то у нашей страны будут все шансы попасть в лидеры этого важнейшего биомедицинского направления.
Литература
Козлова Ю. Н., Репин В. Е., Анищенко и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки // Патент RU 2455355 C1. 2011.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Acte Naturae. 2009. № 3б. С. 6—15.
Kropinski A., Lingohr E., Moyles D. et al. Endemic bacteriophages: a cautionary tale for evaluation of bacteriophage therapy and other interventions for infection control in animals // Virology J. 2012. V.9. P. 207—215.
Miedzybrodzki R., Borysowski J., Weber-Dabrowska B.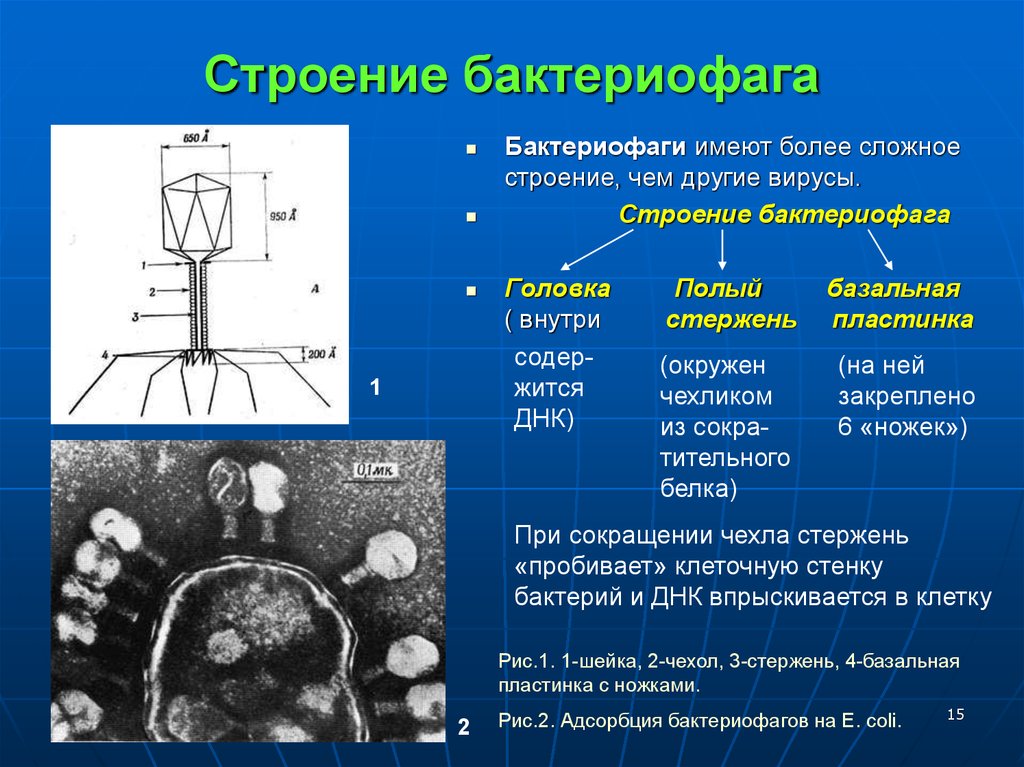 et al. Clinical aspects of phage therapy //Advances in virus res. 2012. V. 83. P. 73—121.
et al. Clinical aspects of phage therapy //Advances in virus res. 2012. V. 83. P. 73—121.
Summers W. Bacteriophage therapy // Annu. Rev. Microbiol. 2001. V. 55. P. 437—451.
Работа была поддержана АНО «Центром Новых Медицинских Технологий» в Академгородке (Новосибирск)
: 22 Июл 2013 , «Но чтоб сие здание [Академия] непременно и полезно было, то имеет оное само себя править» , том 50,
№2
Бактериофаги — StatPearls — Книжная полка NCBI
Лаура М. Касман; Ла Донна Портер.
Информация об авторе
Последнее обновление: 28 сентября 2021 г.
Введение
Бактериофаги, также известные как фаги, представляют собой вирусы, которые инфицируют и размножаются только в бактериальных клетках. Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Как и все вирусы, бактериофаги очень видоспецифичны в отношении своих хозяев и обычно заражают только один вид бактерий или даже определенные штаммы внутри вида. Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной. Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков. Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Функция
Хотя бактериофаги не могут инфицировать и размножаться в клетках человека, они являются важной частью микробиома человека и важным посредником генетического обмена между патогенными и непатогенными бактериями [5][6].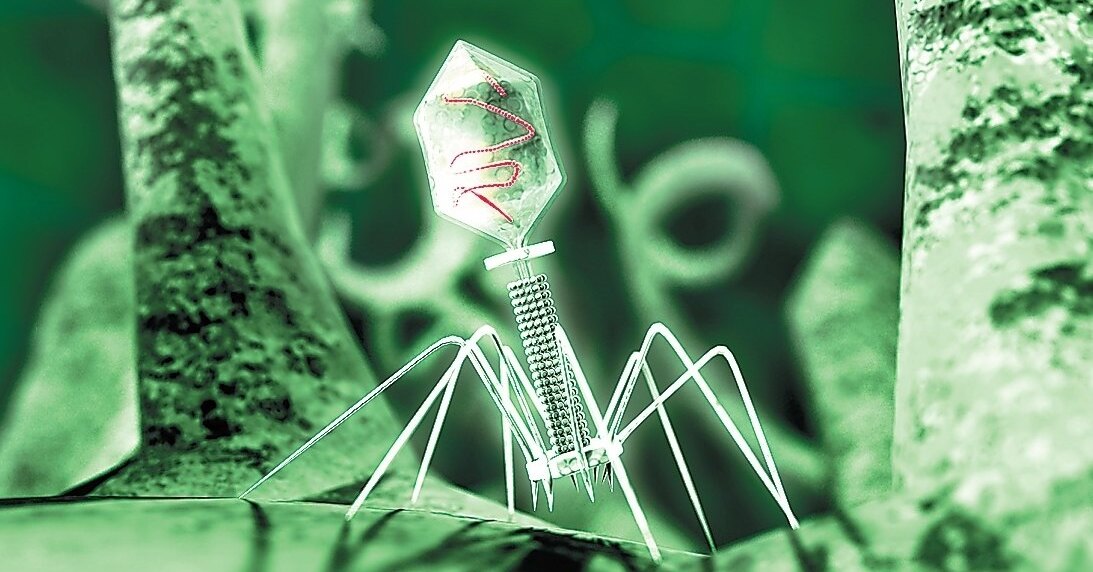 Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
При «генерализованной» трансдукции случайные фрагменты бактериальной геномной ДНК упаковываются внутри фаговых капсидов вместо фаговой геномной ДНК по мере распада клетки-хозяина в результате литической репликации. Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
При «специализированной» трансдукции считается, что лизогенные фаги, которые были амплифицированы в популяции бактерий, вырезают некоторую бактериальную ДНК вместе со своим геномом при запуске цикла литической репликации. Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Помимо генетического обмена, бактериофаги могут изменять микробные популяции, потому что они охотятся на определенные виды бактерий, оставляя другие невредимыми. На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли.
На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам. Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9.0034
[11] , ботулинический нейротоксин в Clostridium botulinum [12], бинарный токсин Clostridium difficile [13] и шига-токсин видов Shigella [10][14]. Без токсинов, кодируемых фагами, эти виды бактерий либо намного менее патогенны, либо вообще не патогенны.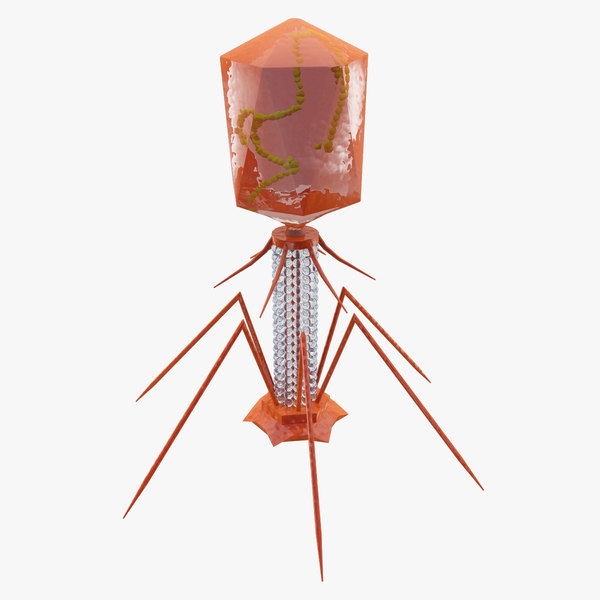 Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам [5]. Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение можно использовать в качестве биомаркера присутствия их хозяина в сложной пробе окружающей среды. Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].
Хотя бактериофаги в основном вытеснены более новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру чувствительности и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].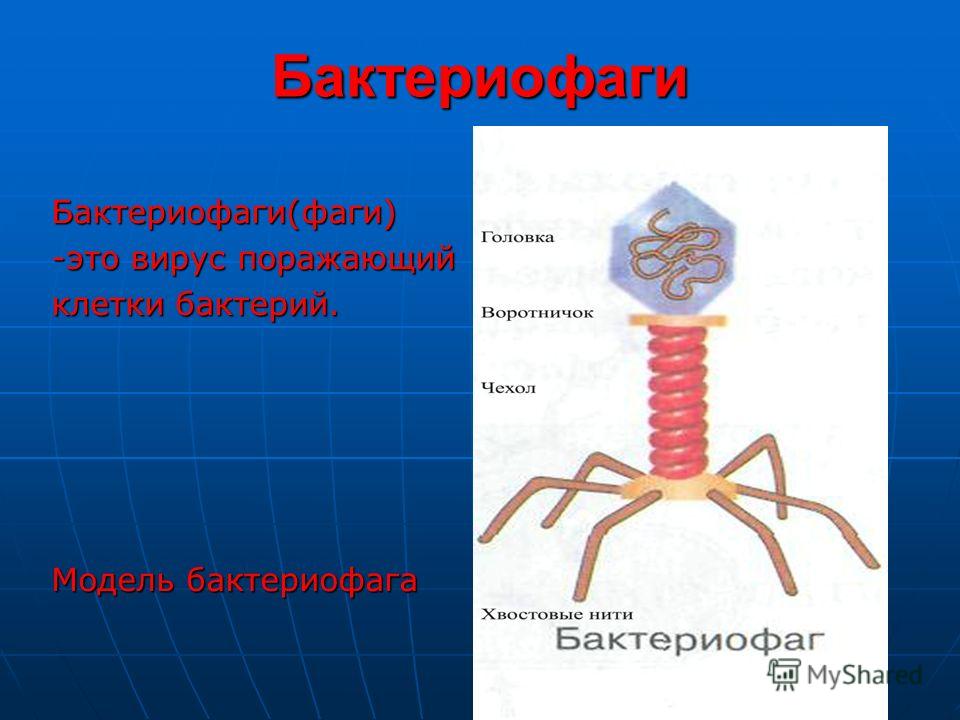
Наконец, бактериофаги были первым открытым типом вирусов и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательства того, что ДНК является молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.
Улучшение результатов работы команды здравоохранения
Устойчивость к антибиотикам и инфекционный контроль
Бактериофаги являются движущей силой эволюции бактерий в микробиоме человека (уровень доказательности II). Профаг можно заставить переключиться на литический цикл репликации с помощью стресса клетки-хозяина, включая противомикробные препараты. Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.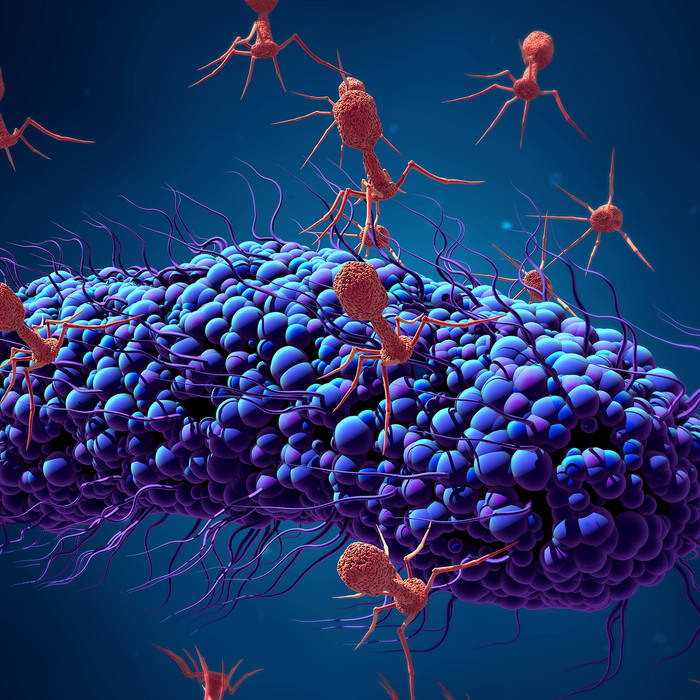
Заболевание, опосредованное бактериальными токсинами
Для всех членов бригады, ухаживающих за пациентом с заболеванием, вызываемым токсинами, такими как холера или шигелла, важно, чтобы процедуры дезинфекции выбирались с учетом их способности инактивировать как вирусы, так и бактерии. Хотя бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Симмондс П., Айевсакун П. Классификация вирусов – где провести черту? Арх Вирол. 2018 авг; 163(8):2037-2046. [Бесплатная статья PMC: PMC6096723] [PubMed: 30039318]
- 2.
Hatfull GF, Hendrix RW. Бактериофаги и их геномы. Карр Опин Вирол. 2011 окт;1(4):298-303.
 [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
[Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]- 3.
Doore SM, Fane BA. Микровирусы: разнообразие, сборка и экспериментальная эволюция. Вирусология. 2016 Апрель; 491: 45-55. [PubMed: 26874016]
- 4.
Переключатель Пташне М. Лямбда: уроки обмена модулями. Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
- 5.
Бойд Э.Ф. Кодируемые бактериофагами бактериальные факторы вирулентности и взаимодействия фаг-остров патогенности. Adv вирус Res. 2012;82:91-118. [PubMed: 22420852]
- 6.
Watson BNJ, Staals RHJ, Fineran PC. CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 13 февраля 2018 г., 9(1) [бесплатная статья PMC: PMC5821089] [PubMed: 29440578]
- 7.
Де Сорди Л., Лоуренсо М., Дебарбье Л. Битва внутри: Взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте тракт.
 Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]- 8.
Кристин Дж.Р., Беккерт М.В. Происхождение и применение CRISPR-опосредованного редактирования генома. Эйнштейн Дж. Биол. Мед. 2016;31(1-2):2-5. [Бесплатная статья PMC: PMC5319590] [PubMed: 28232776]
- 9.
Maciejewska B, Olszak T, Drulis-Kawa Z. Применение бактериофагов по сравнению с фаговыми ферментами для борьбы и лечения бактериальных инфекций: амбициозный и реалистичный заявление? Приложение Microbiol Biotechnol. 2018 март; 102(6):2563-2581. [Бесплатная статья PMC: PMC5847195] [PubMed: 29442169]
- 10.
Pham TD, Nguyen TH, Iwashita H, Takemura T, Morita K, Yamashiro T. Сравнительный анализ области профага CTX штаммов Vibrio cholerae седьмой пандемической волны 1, выделенных в Азии . Микробиол Иммунол. 2018 Октябрь; 62 (10): 635-650. [Бесплатная статья PMC: PMC6220881] [PubMed: 30211956]
- 11.
Холмс РК.
 Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]- 12.
Fortier LC. Вклад бактериофагов в биологию и вирулентность патогенных клостридий. Adv Appl Microbiol. 2017;101:169-200. [PubMed: 2
- 13.
Fortier LC. Бактериофаги способствуют формированию видов Clostridioides (Clostridium) difficile . Фронт микробиол. 2018;9:2033. [Бесплатная статья PMC: PMC6127314] [PubMed: 30233520]
- 14.
Doore SM, Schrad JR, Dean WF, Dover JA, Parent KN. Фаги шигелл, выделенные во время вспышки дизентерии, обнаруживают необычные структуры и широкое видовое разнообразие. Дж Вирол. 2018 15 апр;92(8) [Статья бесплатно PMC: PMC5874400] [PubMed: 29437962]
- 15.
Motlagh AM, Bhattacharjee AS, Goel R. Контроль биопленки с помощью природных и генетически модифицированных фагов. World J Microbiol Biotechnol.
 2016 апр;32(4):67. [PubMed: 26931607]
2016 апр;32(4):67. [PubMed: 26931607]- 16.
Schofield DA, Sharp NJ, Westwater C. Фаговые платформы для клинического обнаружения бактериальных патогенов человека. Бактериофаг. 2012 01 апреля; 2(2):105-283. [Бесплатная статья PMC: PMC3442824] [PubMed: 23050221]
- 17.
Wiśniewska K, Szewczyk A, Piechowicz L, Bronk M, Samet A, Swieć K. Использование spa и фагового типирования для характеристики клинических изолятов метициллин-резистентного Staphylococcus aureus в Университетском клиническом центре в г. Гданьск, Польша. Folia Microbiol (Прага). 2012 май; 57(3):243-9. [Бесплатная статья PMC: PMC3345334] [PubMed: 22532090]
66]
Бактериофаги — StatPearls — Книжная полка NCBI
Лаура М. Касман; Ла Донна Портер.
Информация об авторе
Последнее обновление: 28 сентября 2021 г.
Введение
Бактериофаги, также известные как фаги, представляют собой вирусы, которые инфицируют и размножаются только в бактериальных клетках. Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Как и все вирусы, бактериофаги очень видоспецифичны в отношении своих хозяев и обычно заражают только один вид бактерий или даже определенные штаммы внутри вида. Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной. Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков.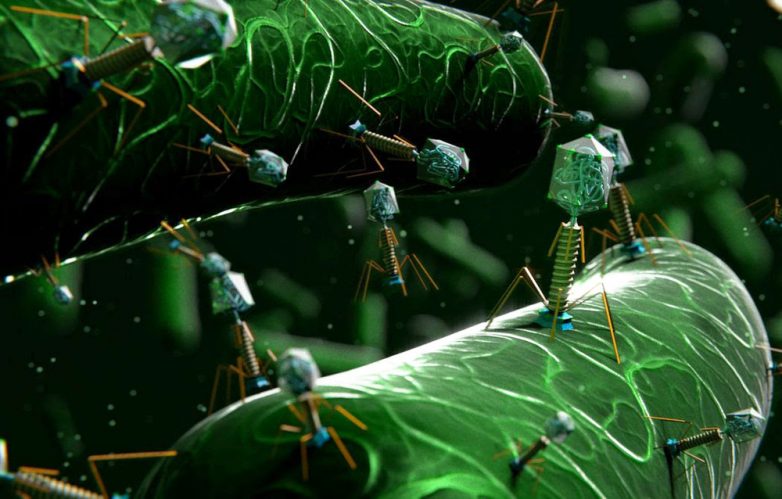 Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Функция
Хотя бактериофаги не могут инфицировать и размножаться в клетках человека, они являются важной частью микробиома человека и важным посредником генетического обмена между патогенными и непатогенными бактериями [5][6].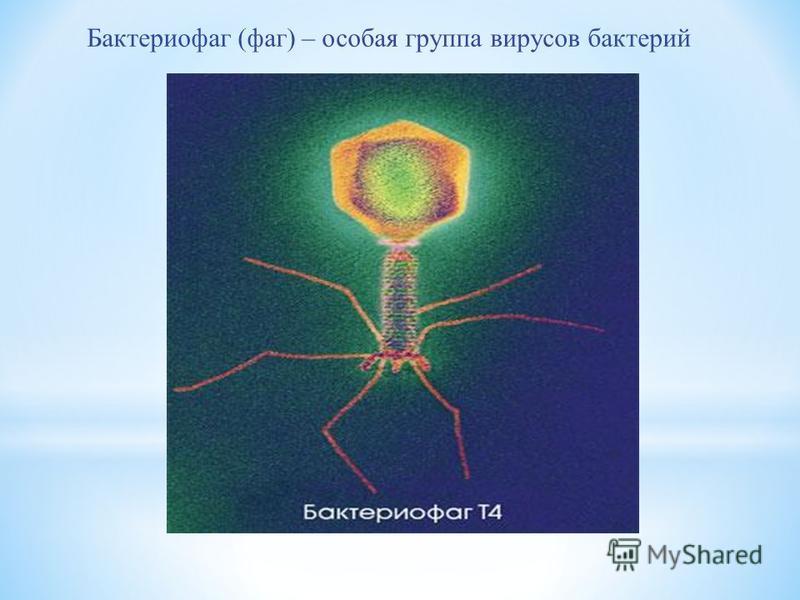 Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
При «генерализованной» трансдукции случайные фрагменты бактериальной геномной ДНК упаковываются внутри фаговых капсидов вместо фаговой геномной ДНК по мере распада клетки-хозяина в результате литической репликации. Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
При «специализированной» трансдукции считается, что лизогенные фаги, которые были амплифицированы в популяции бактерий, вырезают некоторую бактериальную ДНК вместе со своим геномом при запуске цикла литической репликации. Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Помимо генетического обмена, бактериофаги могут изменять микробные популяции, потому что они охотятся на определенные виды бактерий, оставляя другие невредимыми.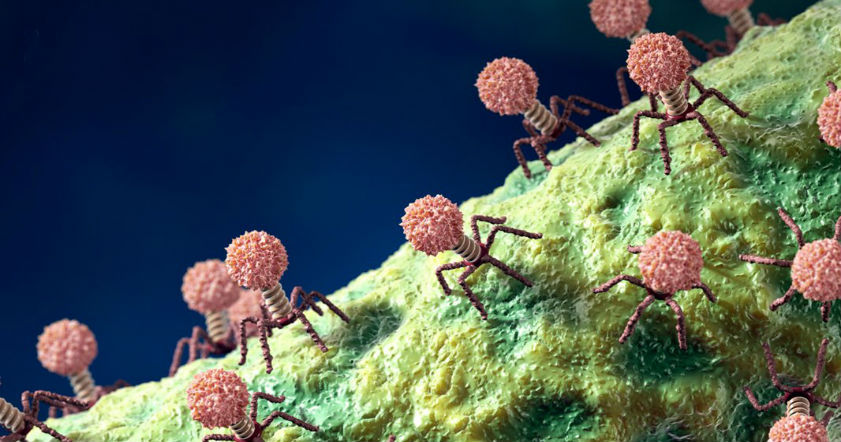 На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли.
На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам. Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9.0034
[11] , ботулинический нейротоксин в Clostridium botulinum [12], бинарный токсин Clostridium difficile [13] и шига-токсин видов Shigella [10][14]. Без токсинов, кодируемых фагами, эти виды бактерий либо намного менее патогенны, либо вообще не патогенны. Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам [5]. Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение можно использовать в качестве биомаркера присутствия их хозяина в сложной пробе окружающей среды. Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].
Хотя бактериофаги в основном вытеснены более новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру чувствительности и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Наконец, бактериофаги были первым открытым типом вирусов и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательства того, что ДНК является молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.
Улучшение результатов работы команды здравоохранения
Устойчивость к антибиотикам и инфекционный контроль
Бактериофаги являются движущей силой эволюции бактерий в микробиоме человека (уровень доказательности II). Профаг можно заставить переключиться на литический цикл репликации с помощью стресса клетки-хозяина, включая противомикробные препараты. Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.
Заболевание, опосредованное бактериальными токсинами
Для всех членов бригады, ухаживающих за пациентом с заболеванием, вызываемым токсинами, такими как холера или шигелла, важно, чтобы процедуры дезинфекции выбирались с учетом их способности инактивировать как вирусы, так и бактерии. Хотя бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Симмондс П., Айевсакун П. Классификация вирусов – где провести черту? Арх Вирол. 2018 авг; 163(8):2037-2046. [Бесплатная статья PMC: PMC6096723] [PubMed: 30039318]
- 2.
Hatfull GF, Hendrix RW. Бактериофаги и их геномы. Карр Опин Вирол. 2011 окт;1(4):298-303.
 [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
[Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]- 3.
Doore SM, Fane BA. Микровирусы: разнообразие, сборка и экспериментальная эволюция. Вирусология. 2016 Апрель; 491: 45-55. [PubMed: 26874016]
- 4.
Переключатель Пташне М. Лямбда: уроки обмена модулями. Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
- 5.
Бойд Э.Ф. Кодируемые бактериофагами бактериальные факторы вирулентности и взаимодействия фаг-остров патогенности. Adv вирус Res. 2012;82:91-118. [PubMed: 22420852]
- 6.
Watson BNJ, Staals RHJ, Fineran PC. CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 13 февраля 2018 г., 9(1) [бесплатная статья PMC: PMC5821089] [PubMed: 29440578]
- 7.
Де Сорди Л., Лоуренсо М., Дебарбье Л. Битва внутри: Взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте тракт.
 Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]- 8.
Кристин Дж.Р., Беккерт М.В. Происхождение и применение CRISPR-опосредованного редактирования генома. Эйнштейн Дж. Биол. Мед. 2016;31(1-2):2-5. [Бесплатная статья PMC: PMC5319590] [PubMed: 28232776]
- 9.
Maciejewska B, Olszak T, Drulis-Kawa Z. Применение бактериофагов по сравнению с фаговыми ферментами для борьбы и лечения бактериальных инфекций: амбициозный и реалистичный заявление? Приложение Microbiol Biotechnol. 2018 март; 102(6):2563-2581. [Бесплатная статья PMC: PMC5847195] [PubMed: 29442169]
- 10.
Pham TD, Nguyen TH, Iwashita H, Takemura T, Morita K, Yamashiro T. Сравнительный анализ области профага CTX штаммов Vibrio cholerae седьмой пандемической волны 1, выделенных в Азии . Микробиол Иммунол. 2018 Октябрь; 62 (10): 635-650. [Бесплатная статья PMC: PMC6220881] [PubMed: 30211956]
- 11.
Холмс РК.
 Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]- 12.
Fortier LC. Вклад бактериофагов в биологию и вирулентность патогенных клостридий. Adv Appl Microbiol. 2017;101:169-200. [PubMed: 2
- 13.
Fortier LC. Бактериофаги способствуют формированию видов Clostridioides (Clostridium) difficile . Фронт микробиол. 2018;9:2033. [Бесплатная статья PMC: PMC6127314] [PubMed: 30233520]
- 14.
Doore SM, Schrad JR, Dean WF, Dover JA, Parent KN. Фаги шигелл, выделенные во время вспышки дизентерии, обнаруживают необычные структуры и широкое видовое разнообразие. Дж Вирол. 2018 15 апр;92(8) [Статья бесплатно PMC: PMC5874400] [PubMed: 29437962]
- 15.
Motlagh AM, Bhattacharjee AS, Goel R. Контроль биопленки с помощью природных и генетически модифицированных фагов. World J Microbiol Biotechnol.
 2016 апр;32(4):67. [PubMed: 26931607]
2016 апр;32(4):67. [PubMed: 26931607]- 16.
Schofield DA, Sharp NJ, Westwater C. Фаговые платформы для клинического обнаружения бактериальных патогенов человека. Бактериофаг. 2012 01 апреля; 2(2):105-283. [Бесплатная статья PMC: PMC3442824] [PubMed: 23050221]
- 17.
Wiśniewska K, Szewczyk A, Piechowicz L, Bronk M, Samet A, Swieć K. Использование spa и фагового типирования для характеристики клинических изолятов метициллин-резистентного Staphylococcus aureus в Университетском клиническом центре в г. Гданьск, Польша. Folia Microbiol (Прага). 2012 май; 57(3):243-9. [Бесплатная статья PMC: PMC3345334] [PubMed: 22532090]
66]
Бактериофаги — StatPearls — Книжная полка NCBI
Лаура М. Касман; Ла Донна Портер.
Информация об авторе
Последнее обновление: 28 сентября 2021 г.
Введение
Бактериофаги, также известные как фаги, представляют собой вирусы, которые инфицируют и размножаются только в бактериальных клетках. Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Как и все вирусы, бактериофаги очень видоспецифичны в отношении своих хозяев и обычно заражают только один вид бактерий или даже определенные штаммы внутри вида. Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной. Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков. Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Функция
Хотя бактериофаги не могут инфицировать и размножаться в клетках человека, они являются важной частью микробиома человека и важным посредником генетического обмена между патогенными и непатогенными бактериями [5][6].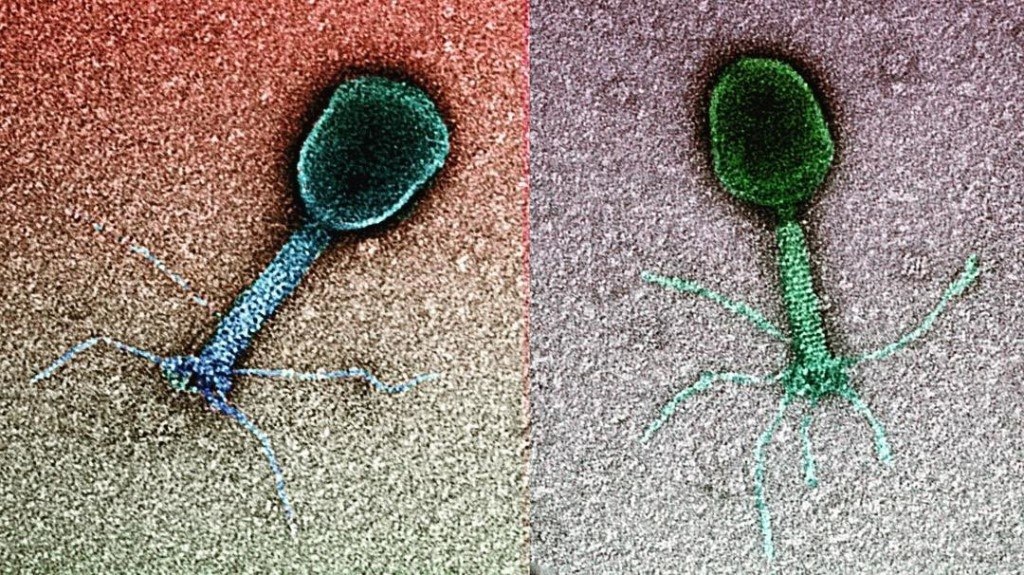 Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
При «генерализованной» трансдукции случайные фрагменты бактериальной геномной ДНК упаковываются внутри фаговых капсидов вместо фаговой геномной ДНК по мере распада клетки-хозяина в результате литической репликации. Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
При «специализированной» трансдукции считается, что лизогенные фаги, которые были амплифицированы в популяции бактерий, вырезают некоторую бактериальную ДНК вместе со своим геномом при запуске цикла литической репликации. Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Помимо генетического обмена, бактериофаги могут изменять микробные популяции, потому что они охотятся на определенные виды бактерий, оставляя другие невредимыми.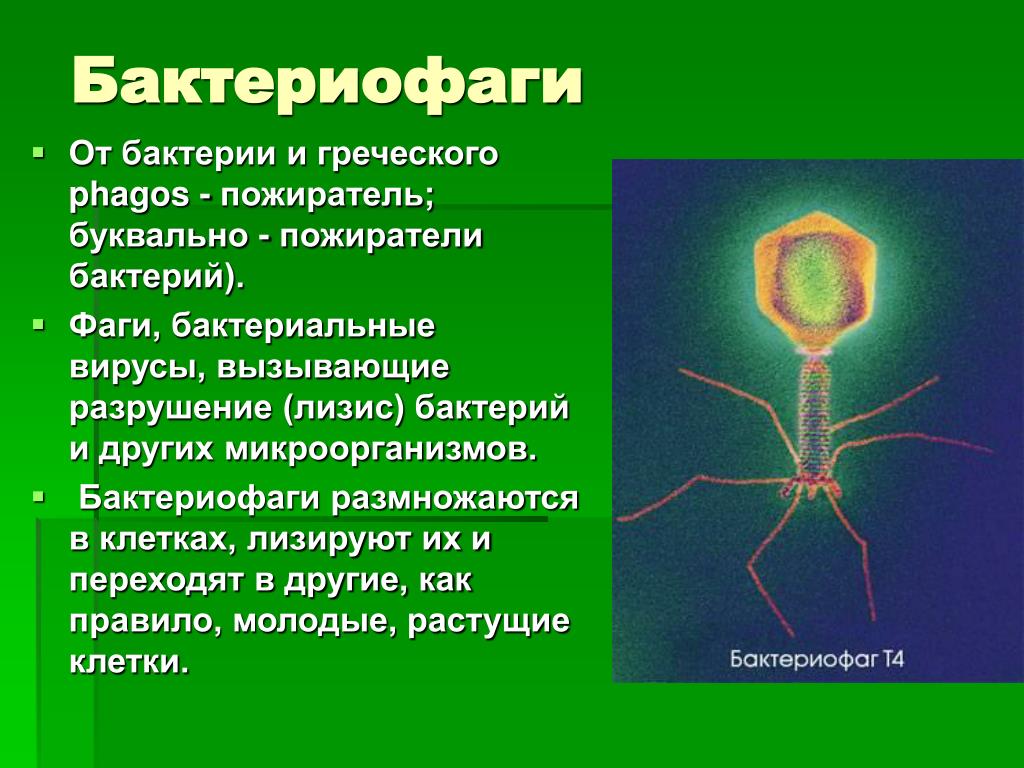 На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли.
На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам. Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9.0034
[11] , ботулинический нейротоксин в Clostridium botulinum [12], бинарный токсин Clostridium difficile [13] и шига-токсин видов Shigella [10][14]. Без токсинов, кодируемых фагами, эти виды бактерий либо намного менее патогенны, либо вообще не патогенны. Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам [5]. Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение можно использовать в качестве биомаркера присутствия их хозяина в сложной пробе окружающей среды. Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].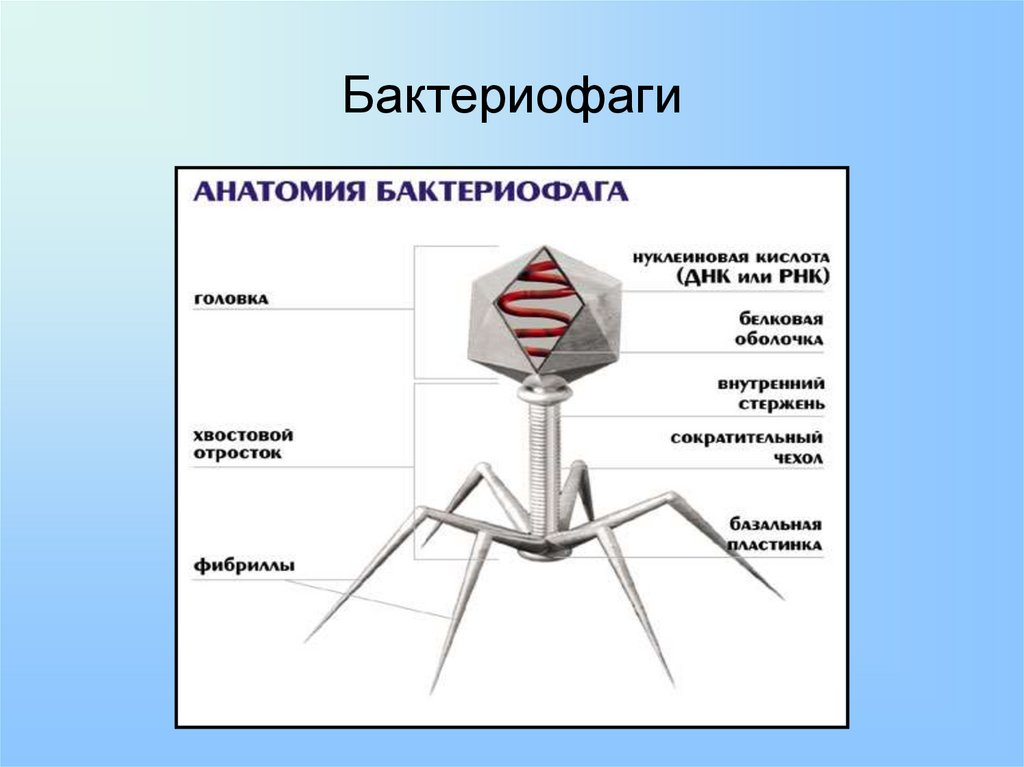
Хотя бактериофаги в основном вытеснены более новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру чувствительности и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Наконец, бактериофаги были первым открытым типом вирусов и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательства того, что ДНК является молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.
Улучшение результатов работы команды здравоохранения
Устойчивость к антибиотикам и инфекционный контроль
Бактериофаги являются движущей силой эволюции бактерий в микробиоме человека (уровень доказательности II). Профаг можно заставить переключиться на литический цикл репликации с помощью стресса клетки-хозяина, включая противомикробные препараты. Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.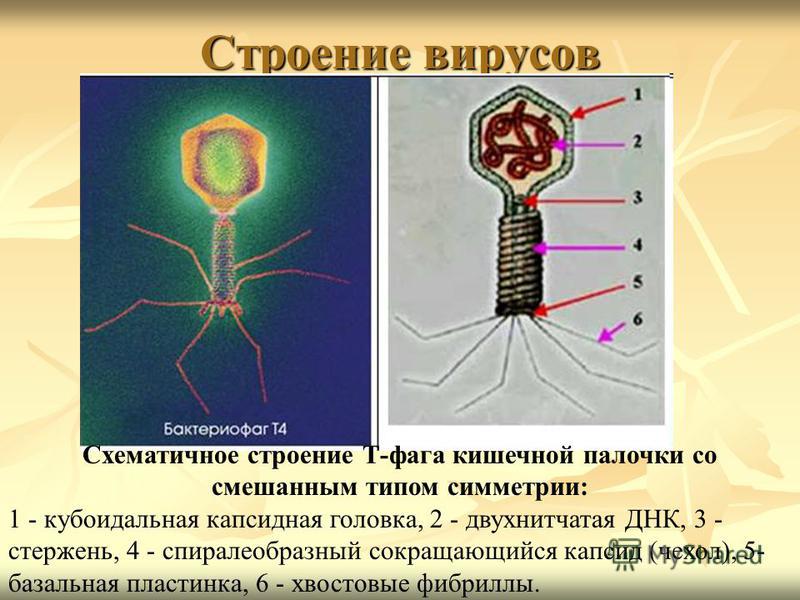
Заболевание, опосредованное бактериальными токсинами
Для всех членов бригады, ухаживающих за пациентом с заболеванием, вызываемым токсинами, такими как холера или шигелла, важно, чтобы процедуры дезинфекции выбирались с учетом их способности инактивировать как вирусы, так и бактерии. Хотя бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Симмондс П., Айевсакун П. Классификация вирусов – где провести черту? Арх Вирол. 2018 авг; 163(8):2037-2046. [Бесплатная статья PMC: PMC6096723] [PubMed: 30039318]
- 2.
Hatfull GF, Hendrix RW. Бактериофаги и их геномы. Карр Опин Вирол. 2011 окт;1(4):298-303.
 [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
[Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]- 3.
Doore SM, Fane BA. Микровирусы: разнообразие, сборка и экспериментальная эволюция. Вирусология. 2016 Апрель; 491: 45-55. [PubMed: 26874016]
- 4.
Переключатель Пташне М. Лямбда: уроки обмена модулями. Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
- 5.
Бойд Э.Ф. Кодируемые бактериофагами бактериальные факторы вирулентности и взаимодействия фаг-остров патогенности. Adv вирус Res. 2012;82:91-118. [PubMed: 22420852]
- 6.
Watson BNJ, Staals RHJ, Fineran PC. CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 13 февраля 2018 г., 9(1) [бесплатная статья PMC: PMC5821089] [PubMed: 29440578]
- 7.
Де Сорди Л., Лоуренсо М., Дебарбье Л. Битва внутри: Взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте тракт.
 Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]- 8.
Кристин Дж.Р., Беккерт М.В. Происхождение и применение CRISPR-опосредованного редактирования генома. Эйнштейн Дж. Биол. Мед. 2016;31(1-2):2-5. [Бесплатная статья PMC: PMC5319590] [PubMed: 28232776]
- 9.
Maciejewska B, Olszak T, Drulis-Kawa Z. Применение бактериофагов по сравнению с фаговыми ферментами для борьбы и лечения бактериальных инфекций: амбициозный и реалистичный заявление? Приложение Microbiol Biotechnol. 2018 март; 102(6):2563-2581. [Бесплатная статья PMC: PMC5847195] [PubMed: 29442169]
- 10.
Pham TD, Nguyen TH, Iwashita H, Takemura T, Morita K, Yamashiro T. Сравнительный анализ области профага CTX штаммов Vibrio cholerae седьмой пандемической волны 1, выделенных в Азии . Микробиол Иммунол. 2018 Октябрь; 62 (10): 635-650. [Бесплатная статья PMC: PMC6220881] [PubMed: 30211956]
- 11.
Холмс РК.
 Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]- 12.
Fortier LC. Вклад бактериофагов в биологию и вирулентность патогенных клостридий. Adv Appl Microbiol. 2017;101:169-200. [PubMed: 2
- 13.
Fortier LC. Бактериофаги способствуют формированию видов Clostridioides (Clostridium) difficile . Фронт микробиол. 2018;9:2033. [Бесплатная статья PMC: PMC6127314] [PubMed: 30233520]
- 14.
Doore SM, Schrad JR, Dean WF, Dover JA, Parent KN. Фаги шигелл, выделенные во время вспышки дизентерии, обнаруживают необычные структуры и широкое видовое разнообразие. Дж Вирол. 2018 15 апр;92(8) [Статья бесплатно PMC: PMC5874400] [PubMed: 29437962]
- 15.
Motlagh AM, Bhattacharjee AS, Goel R. Контроль биопленки с помощью природных и генетически модифицированных фагов. World J Microbiol Biotechnol.

66]

 [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
[Бесплатная статья PMC: PMC3199584] [PubMed: 22034588] Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535] Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]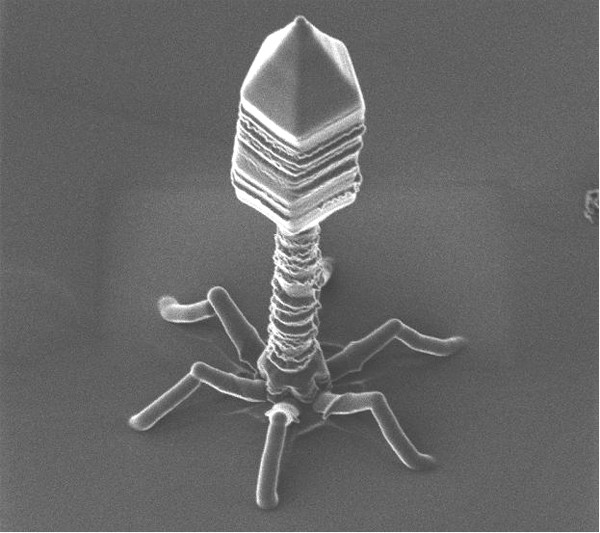 2016 апр;32(4):67. [PubMed: 26931607]
2016 апр;32(4):67. [PubMed: 26931607]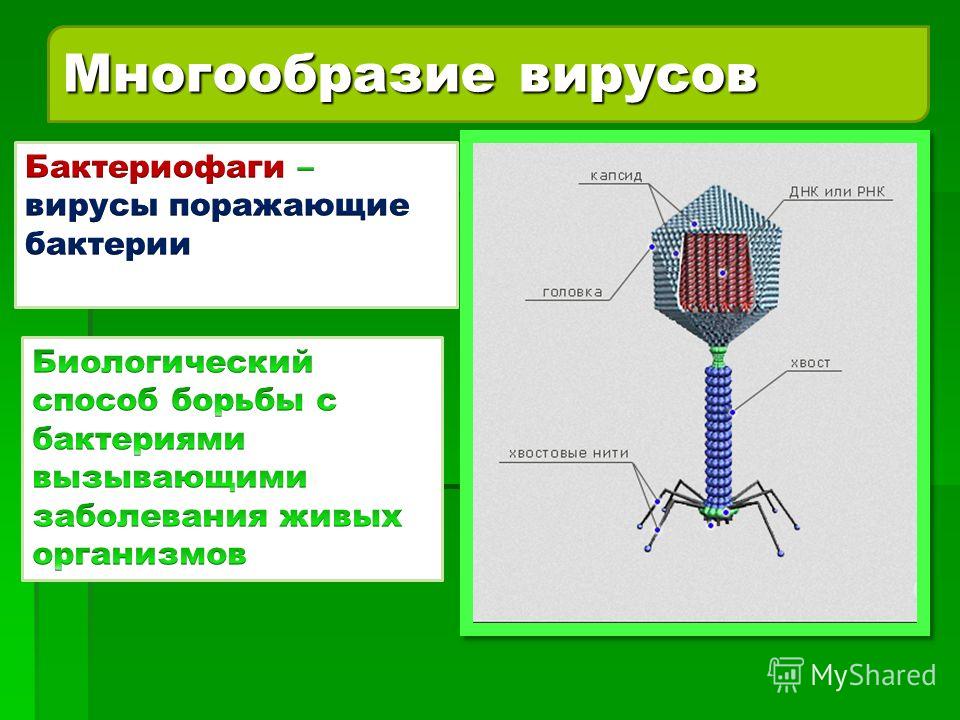 [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
[Бесплатная статья PMC: PMC3199584] [PubMed: 22034588] Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]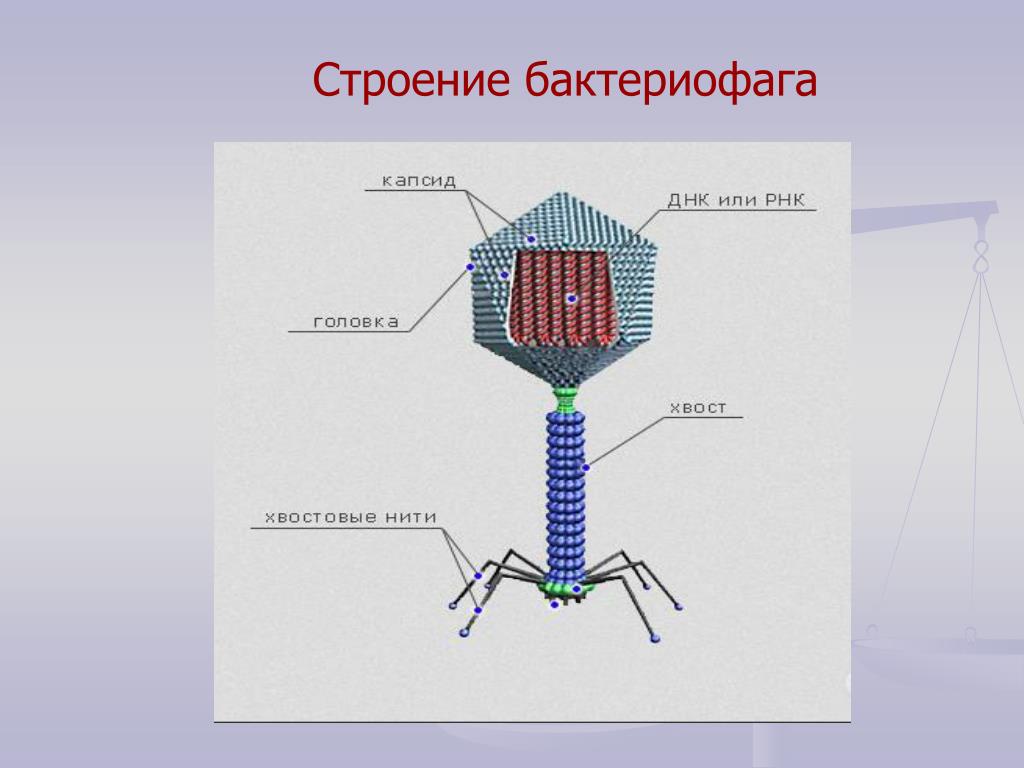 Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208] 2016 апр;32(4):67. [PubMed: 26931607]
2016 апр;32(4):67. [PubMed: 26931607]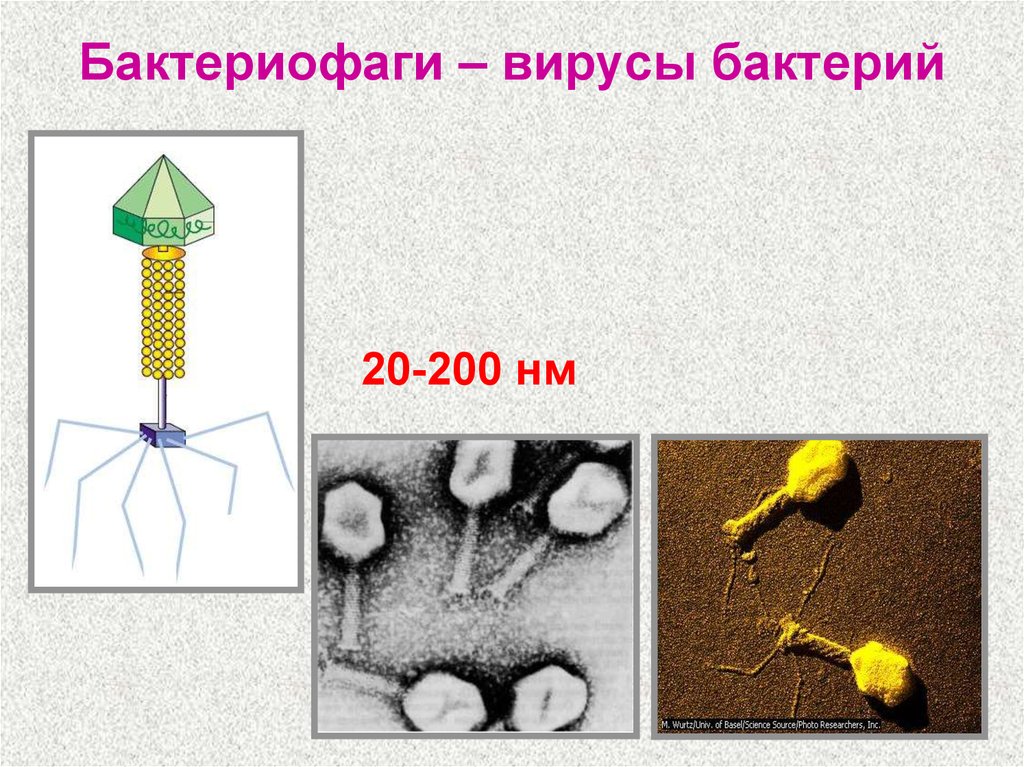 [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
[Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]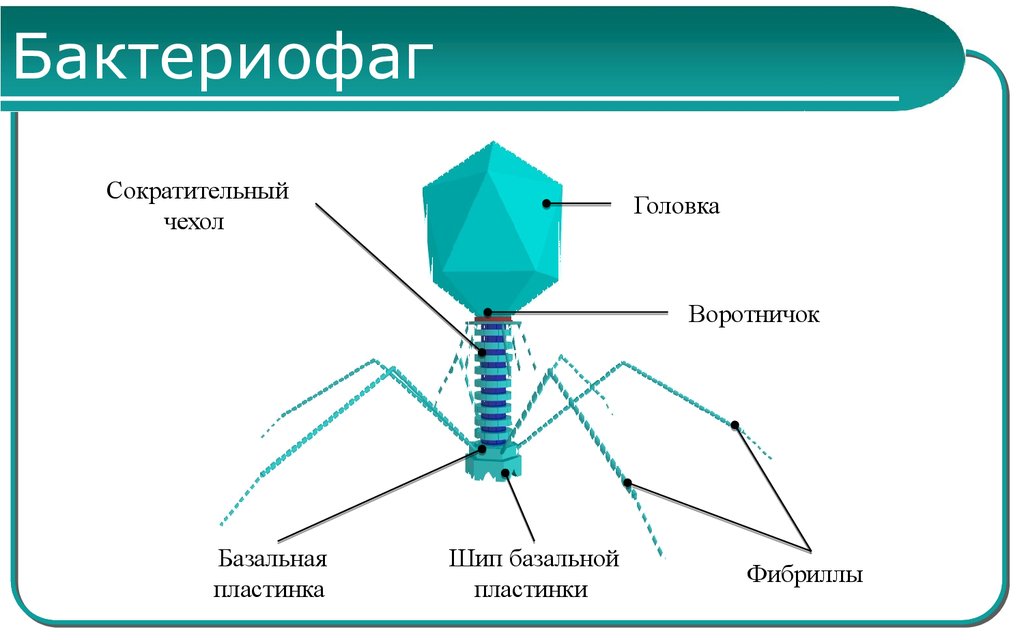 Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]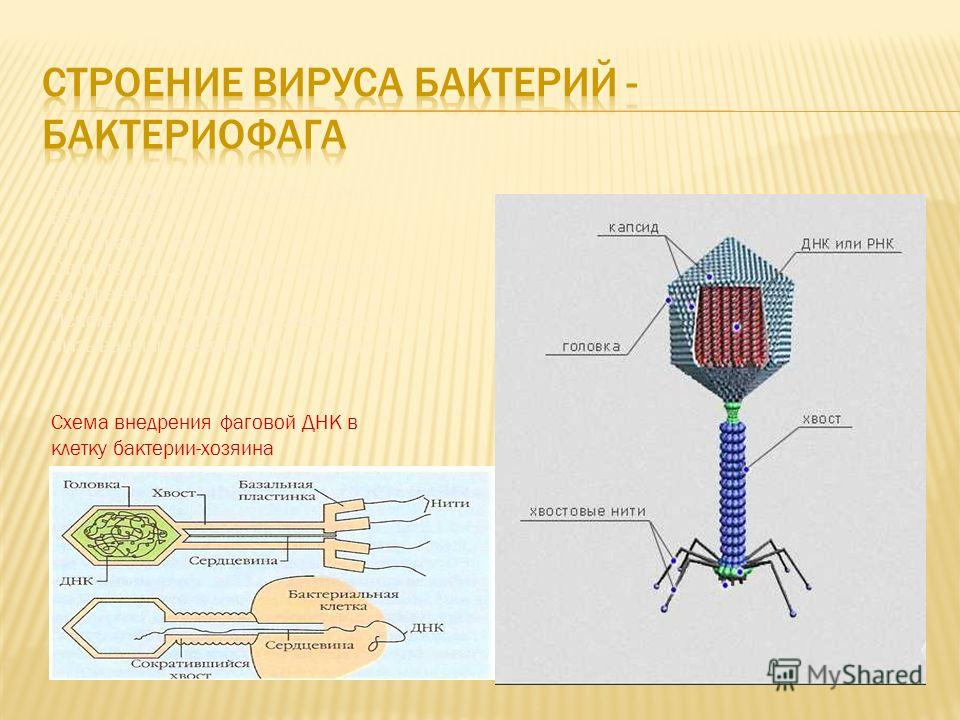 Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить дис. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]