Содержание
Как ученые пытаются создать искусственные человеческие органы
Здоровье
И станет ли замена печени такой же привычной манипуляцией, как смена тормозных колодок в автомобиле.
Вадим Рощин
unsplash.com
В начале XXI века наука только-только подступалась к идее создания искусственных человеческих органов, которые можно было бы использовать для трансплантации. Спустя 20 лет десятки лабораторий по всему миру проводят эксперименты в этой области, мыши с искусственно выращенными яичниками приносят потомство, а производители косметики тестируют новинки на выращенной в пробирке коже – потому что на мышах и кроликах это делать теперь запрещено (по крайней мере в Европе). GQ поговорил с экспертами из трех российских центров, в которых пытаются наладить производство «запчастей» для человека, и о совершенно фантастических разработках, которые вот-вот изменят медицину и мир.
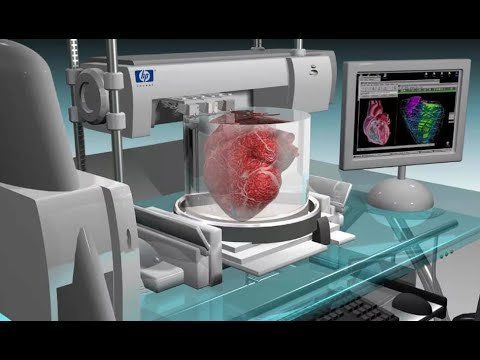
Биопринтинг
Биопринтинг – это «печать» тканей живых существ. Принцип такой же, как и в обычном офисном устройстве для распечатки документов, только вместо чернил из картриджа подается биоматериал – клетки различных тканей организма. К слову, первый биопринтер, созданный в 2001 году, представлял собой как раз модернизированный офисный девайс Hewlett Packard.
Юсеф Хесуани
Соучредитель и управляющий партнер лаборатории 3D Bioprinting Solutions.
«Многие представляют себе 3D-принтинг как послойную печать объектов из пластика согласно заданной цифровой модели – и это действительно самая близкая аналогия биопринтинга, – рассказывает Юсеф Хесуани, глава лаборатории 3D Bioprinting Solutions. – Естественно, мы избегаем в работе высоких температур, чтобы не повредить «расходный материал», в основе которого – белки. Способы печати бывают разными – мы, например, придумали технологию управления клетками с помощью магнитных полей. Исходный материал «левитирует» в жидкой питательной среде, а когда он попадает в магнитную ловушку – клетки начинают взаимодействовать друг с другом, и формируется нужная нам ткань. Еще одна технология – печать прямо в зоне дефекта, например, на месте повреждения кожи. Всю работу в этом случае выполняет роботический манипулятор, к которому мы приделали нашу форсунку с биоматериалами и для которого написали софт. Оператор выводит механическую руку в «точку ноль», а дальше робот сам начинает латать дефект».
Еще одна технология – печать прямо в зоне дефекта, например, на месте повреждения кожи. Всю работу в этом случае выполняет роботический манипулятор, к которому мы приделали нашу форсунку с биоматериалами и для которого написали софт. Оператор выводит механическую руку в «точку ноль», а дальше робот сам начинает латать дефект».
В российской лаборатории с помощью такого манипулятора уже проводили эксперименты по устранению дефектов кожи у крыс и минипигов. (За границей пошли еще дальше: в прошлом году интернациональная команда ученых в ОАЭ впервые сделала «заплатку» на коже человека.) Кроме того, в 2015 году в России напечатали мышиную щитовидную железу, которую потом успешно трансплантировали. Эксперимент доказал: биопринтинг позволяет создавать и заменять целые органы не только в теории, но и на практике. Щитовидную железу выбрали для опыта по нескольким причинам. Во-первых, легко проверить ее работоспособность – просто измерив уровень гормонов в крови. Во-вторых, в структуре щитовидки нет сложных участков, которые не могли бы воспроизвести существующие на данный момент принтеры. Тем временем ученые из Чикаго поставили схожий эксперимент – пересадили мышке напечатанный яичник. Опыт также был удачным, мышь дала потомство.
Тем временем ученые из Чикаго поставили схожий эксперимент – пересадили мышке напечатанный яичник. Опыт также был удачным, мышь дала потомство.
Биопринтер Fabion
На таком устройстве был создан «тканеинженерный конструкт» щитовидной железы мыши. Искусственную щитовидку успешно пересадили, гормональный баланс у грызуна был в норме.
А вот печатать жизнеспособные человеческие органы пока что мешают два ограничения. Первое – большой размер этих самых органов и, как следствие, их сложная структура. Современные технологии не позволяют создать внутри искусственного органа систему сосудов, необходимых для его нормальной работы после пересадки, – клетки внутри напечатанного объекта не получают питания и погибают от нехватки кислорода. В случае с мышиной щитовидной железой ученые использовали эмбриональные клетки, в которых уже заложена необходимая информация о сосудах, то есть условия для их прорастания были созданы заранее. Да и тот факт, что мышиный орган в десятки раз меньше человеческого, тоже сыграл важную роль в успешном завершении эксперимента.
Вторая проблема – нехватка материала. Для биопечати нужны клетки, которые сначала необходимо вырастить, а для этого требуется время. В случае с кожей, например, на подготовку уходит порядка 4–6 недель, но в целом у каждого типа клеток свои скорость и возможность деления. Клетки кожи и крови, например, постоянно обновляются – у них высокий регенеративный потенциал. А клетки эндокринных органов делают это значительно реже и воспроизводятся намного медленнее. Для печати мышиной щитовидной железы экспериментаторы взяли эмбриональные клетки, которые, по словам ученых, «дают отличный прирост в сотни процентов». Использование эмбриональных клеток человека в России запрещено, а клетки той же щитовидной железы растут заметно хуже, их прирост – всего 5–10 процентов.
Биопринтеры уже умеют «печатать» работоспособные органы животных и фрагменты кожи человека.
Наука развивается скачкообразно, и прорыв в сфере биопринтинга может случиться в любой момент: «В 2014 году Общество биофабрикации, членом которого является наша лаборатория, выпустило прогноз развития отрасли.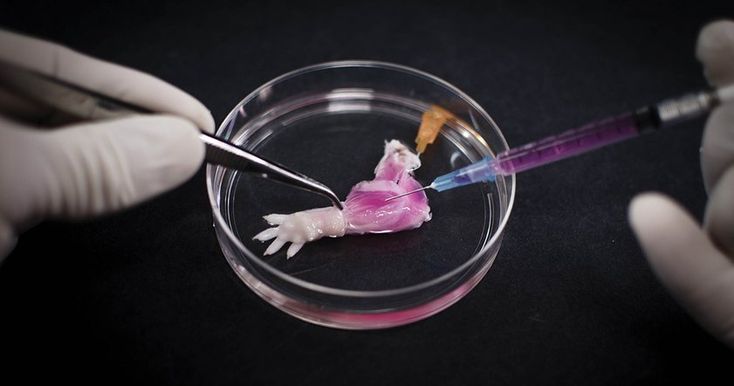 И там говорилось, что искусственная кожа будет пересажена человеку примерно в 2030 году. А произошло это с опережением на десять лет, – говорит Юсеф Хесуани. – Поэтому вопрос о будущем – сложный. Биопринтинг – игра со множеством неизвестных. Когда мы открылись в 2013 году, мы были всего лишь шестой в мире коммерческой компанией, которая осваивала технологию трехмерной биопечати. А сейчас только производством биопринтеров занимаются больше 80 компаний в разных частях планеты, в том числе в Белоруссии и Армении».
И там говорилось, что искусственная кожа будет пересажена человеку примерно в 2030 году. А произошло это с опережением на десять лет, – говорит Юсеф Хесуани. – Поэтому вопрос о будущем – сложный. Биопринтинг – игра со множеством неизвестных. Когда мы открылись в 2013 году, мы были всего лишь шестой в мире коммерческой компанией, которая осваивала технологию трехмерной биопечати. А сейчас только производством биопринтеров занимаются больше 80 компаний в разных частях планеты, в том числе в Белоруссии и Армении».
В мире примерно половина компаний, экспериментирующих в области биопринтинга, существует с поддержкой государства, причем внимание этой технологии уделяют на самом высоком уровне. Так, весной президент США Джо Байден представил новый комитет по науке и объявил биопринтинг приоритетным направлением развития. Американцы уже готовят большую государственную программу, которая предусматривает солидные вложения в эту отрасль, поэтому можно предположить, что лучшие умы со всего мира будут переезжать поближе к этим деньгам.
По словам Юсефа Хесуани, заниматься наукой, запершись у себя в кабинете, сейчас крайне сложно, поэтому специалисты по биопринтингу из разных стран активно сотрудничают. Одновременно с этим развивается и конкуренция, ведь многие компании берут научные выкладки за основу бизнеса и уже могут похвастаться успешными кейсами их монетизации. Зарабатывать сегодня можно на производстве биопринтеров, расходных материалов к ним или же на печати образцов тканей – например, для исследования свойств лекарственных или косметических средств. Особенно это актуально в случае с клетками кожи: с 2012 года в Европе запрещены испытания косметики на животных, а тесты проводить нужно. Именно по этой причине гиганты уровня L’Oréal и BASF активно поддерживают компании, которые занимаются биопечатью кожи.
Биореакторы
Еще одно перспективное направление – выращивание органов в устройствах, именуемых биореакторами. В России этим занимаются в Национальном медицинском исследовательском центре трансплантологии и искусственных органов, а об особенностях технологии GQ рассказал глава центра Сергей Готье.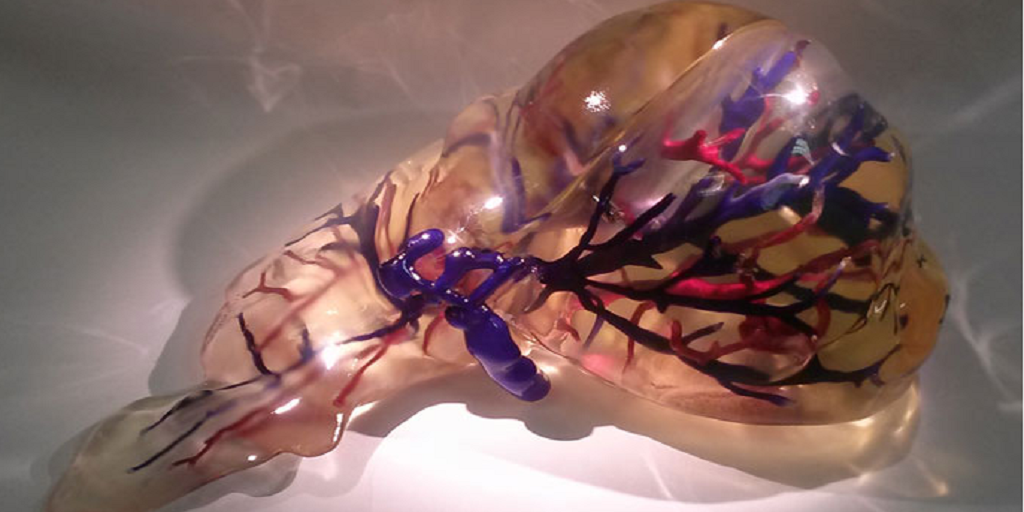
«Клетки не могут существовать в организме сами по себе – они закреплены на тонкой соединительнотканной основе, им там хорошо. В своих экспериментах мы в качестве такой основы используем специальные «подложки» – матриксы. У нас в институте разработаны и опробованы десятки матриксов и в итоге выбраны лучшие – те, которые могут обеспечить, например, жизнедеятельность хрящевых клеток и на основе которых можно вырастить новый хрящ. Но все-таки хрящ – это ткань, не орган. Основная задача, которую мы сейчас пытаемся решить, – обеспечить совместное существование большого количества клеток в одном конгломерате. Для этого нужно создать такую среду, которая могла бы не только питать клетки, но и выводить продукты распада, обмена веществ. Именно эту функцию и выполняют биореакторы, но в них пока что невозможно вырастить большой орган. Казалось бы, самая простая задача – создать миокардиоциты (мышечные клетки сердца. – Прим. GQ) и построить из них сердце. Мы делали такие попытки, и они были успешными, но пока только в случае с маленьким органом. С сердцем мыши. Проблема в том, что сейчас у нас нет технологических возможностей для создания большого объема функционирующей ткани».
С сердцем мыши. Проблема в том, что сейчас у нас нет технологических возможностей для создания большого объема функционирующей ткани».
Сергей Готье
Директор НМИЦ трансплантологии и искусственных органов имени академика В. И. Шумакова Минздрава России.
Результаты экспериментов с биореактором помогают медикам и в других сферах – в том числе при восстановлении поврежденных донорских органов перед пересадкой. В российском Центре трансплантологии ежегодно проводят около 200 трансплантаций сердца (по мировым меркам это огромная цифра), а вот донорские легкие для пересадки используют намного реже. Причина в том, что легкие очень часто оказываются поврежденными при жизни человека и не годятся для операции. Что делать? Пытаться восстановить «некачественный» донорский орган вне организма. Выглядит это так: через кровеносную систему легких пропускают специально разработанный раствор, дыхательный аппарат имитирует вдохи и выдохи – создаются идеальные условия для регенерации клеток. Таким образом можно восстановить до половины поврежденной ткани, а потом имплантировать «отремонтированный» орган пациенту.
Таким образом можно восстановить до половины поврежденной ткани, а потом имплантировать «отремонтированный» орган пациенту.
«Пока мы с вами ведем эту беседу, кто-то может совершить открытие, которое изменит медицину».
В ответ на вопрос, когда же в биореакторе получится вырастить полноценный орган, Сергей Готье просит воздержаться от каких-либо предсказаний: «Пока мы с вами ведем эту беседу, где-нибудь в Гонконге, в США или в России кто-то может воскликнуть: «Эврика!» – и совершить открытие, которое изменит медицину».
«Призрачные органы»
Третья технология, которая в будущем может лечь в основу производства «запасных частей» для человечества, – децеллюляризация. Необходимый орган (или его часть) в этом случае создается не с нуля. В качестве «каркаса» берется донорский орган, причем не обязательно человеческий. Затем будущую основу «отмывают» от клеток прошлого хозяина и «высаживают» на нее биоматериал будущего владельца. Полученный орган после трансплантации с меньшей вероятностью вызовет отторжение, так как организм будет воспринимать его как что-то знакомое и даже родное.
«Поместив донорский орган в специальные растворы, мы можем добиться того, что все его клетки будут смыты – останется только сетчатый каркас из фибриллярных белков, его «архитектурная основа», – объясняет Елена Петерсен из Центра внедрения геномных технологий МФТИ. – Далее мы заселяем каркас клетками пациента и при дальнейшем выращивании можем получить искусственный орган, который будет максимально естественным для будущего хозяина. Фактически речь идет о воссоздании взрослого органа с использованием донорского каркаса и специальным образом обработанных и пересаженных клеток пациента».
Эпитет «призрачные» появился из‑за бледно-белого цвета, который органы приобретают после децеллюляризации. А получающийся в итоге каркас, по сути, тот же матрикс. И трудности, с которым сталкивается технология, – такие же, как и у двух предыдущих. Метод выращивания полноценных трансплантатов на основе «бесклеточных заготовок» не может преодолеть барьер, связанный с доставкой кислорода и питательных веществ внутрь органа – наладить этот процесс пока не получается.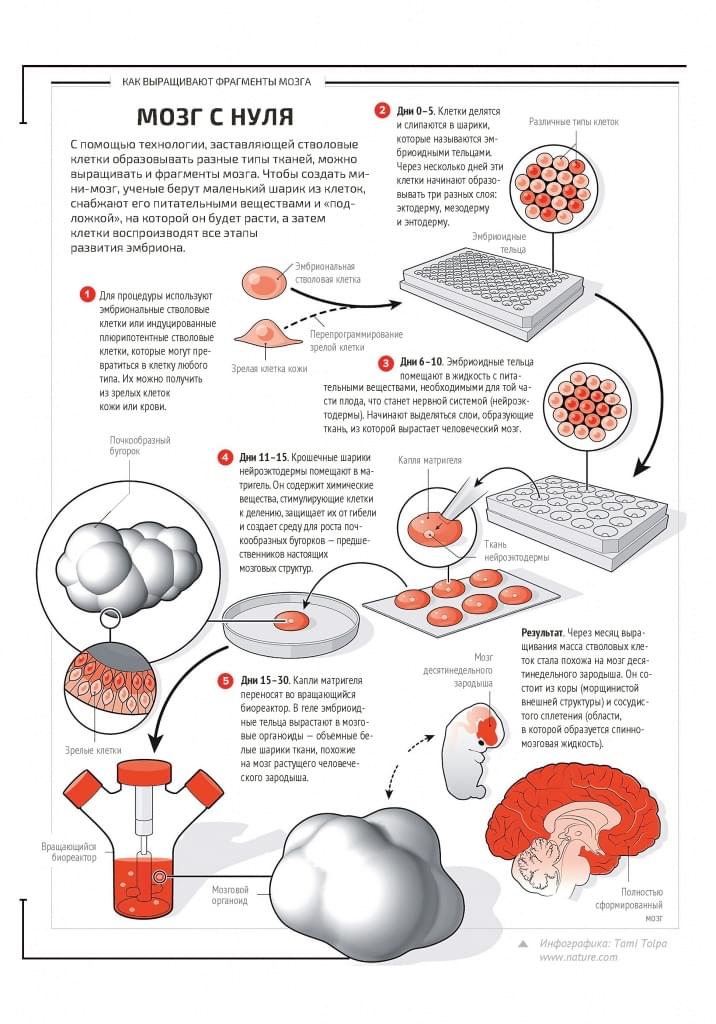 Да, к любому объекту, пересаженному человеку, все равно прорастают сосуды – организм таким образом пытается его опознать, подвести к нему иммунные клетки. Загвоздка в том, что естественное формирование сосудов происходит медленнее, чем процесс гибели клеток внутри «призрачного органа» от нехватки питания и кислорода.
Да, к любому объекту, пересаженному человеку, все равно прорастают сосуды – организм таким образом пытается его опознать, подвести к нему иммунные клетки. Загвоздка в том, что естественное формирование сосудов происходит медленнее, чем процесс гибели клеток внутри «призрачного органа» от нехватки питания и кислорода.
Елена Петерсен
К. м. н., доцент департамента молекулярной и биологической физики МФТИ, заведующая лабораторией молекулярно-биологических и нейробиологических проблем и биоскрининга Центра внедрения геномных технологий МФТИ.
KUPRIANOFFOTO
Тем не менее эксперименты в этой области приносят все больше результатов. Так, наука уже дошла до пересадки человеку отдельных «отмытых» деталей – например, клапанов сердца. Раньше для этой операции использовались высушенные бычьи клапаны, которые сохраняли в себе клетки животного-донора. Сейчас человеку стараются трансплантировать «отмытые» части органов – иммунная реакция в этом случае менее выражена, риск отторжения ниже. В худшем случае картина выглядит так: иммунные клетки пациента обнаруживают чужеродные белки, начинается воспалительный процесс, пересаженный клапан перестает работать, возникают осложнения, и хирургам приходится проводить операцию по замене пересаженного клапана. А если заранее убрать все «враждебные» для человеческого организма клетки, то пересаженная деталь будет исправно выполнять свои функции и прослужит намного дольше. По словам Елены Петерсен, даже в сухих костных трансплантатах, используемых при протезировании зубов, сохраняются чужие клетки, и наш иммунитет их распознает. Когда чужих клеток не остается в принципе, реакция воспаления протекает практически незаметно, не приводя к каким-либо побочным эффектам.
В худшем случае картина выглядит так: иммунные клетки пациента обнаруживают чужеродные белки, начинается воспалительный процесс, пересаженный клапан перестает работать, возникают осложнения, и хирургам приходится проводить операцию по замене пересаженного клапана. А если заранее убрать все «враждебные» для человеческого организма клетки, то пересаженная деталь будет исправно выполнять свои функции и прослужит намного дольше. По словам Елены Петерсен, даже в сухих костных трансплантатах, используемых при протезировании зубов, сохраняются чужие клетки, и наш иммунитет их распознает. Когда чужих клеток не остается в принципе, реакция воспаления протекает практически незаметно, не приводя к каким-либо побочным эффектам.
«Я думаю, что в ближайшие лет 10–15 произойдет большой скачок в этой области, – резюмирует Елена, – а технология, которая приведет к созданию искусственных органов, скорее всего, будет смешанной, на стыке биопринтинга, трехмерных клеточных структур и сегментированной пересадки органов. Как пример – трансплантация долей печени, которая позволит постепенно вводить пересаженный орган в общую систему организма. Возможно, все это станет доступно нам уже в обозримом будущем».
Как пример – трансплантация долей печени, которая позволит постепенно вводить пересаженный орган в общую систему организма. Возможно, все это станет доступно нам уже в обозримом будущем».
Вероятно, вам также будет интересно:
Печать зубов на принтере и роботизированный осмотр. Какой будет стоматология завтра?
Что получается, когда мода и медицина объединяются
Фото: Gettyimages.com; Shutterstock/Fotodom; Владимир Купринов; архив пресс-службы
ТегимедицинаТехнологиитехнологии будущего
Мозг из пробирки: как выращивают искусственные органы
Полученные в лабораториях «органоиды» позволяют разрабатывать новые лекарства и технологии
Великим достижением начала XX века было то, что люди научились культивировать клетки млекопитающих вне организма. Вначале это культивирование происходило в висячей капле, без прикрепления клеток к поверхности. То есть капля свешивалась, и в этой капле, ни к чему не прикрепленные, плавали клетки. Потом техника стала совершенствоваться, и мы научились растить клетки в чашках Петри, рассматривая в микроскоп, что с ними происходит. Это достижение дало мощный импульс развитию клеточной биологии и генетики.
То есть капля свешивалась, и в этой капле, ни к чему не прикрепленные, плавали клетки. Потом техника стала совершенствоваться, и мы научились растить клетки в чашках Петри, рассматривая в микроскоп, что с ними происходит. Это достижение дало мощный импульс развитию клеточной биологии и генетики.
С развитием технологий у исследователей появилась возможность изучать уже не плоские культуры, а трехмерные или, как их стали сейчас называть, органоиды. Подобное направление появилось совсем недавно, буквально в последние пять лет.
Понятно, что у ученых всегда было желание собрать какой-нибудь объемный орган, но надо понимать, что в процессе онтогенеза (индивидуального формирования организма) его никто не собирает «снаружи» — клетки сами по себе находят нужное место. А те, которые не нашли, погибают, не получив помощи от соседних клеток. Здесь же задача обратная: собрать различные клетки так, чтобы они были дружны между собой и продолжали расти. Это удается сделать не для всех типов клеток и культур. Но в последнее время наметился очень большой прогресс в искусственном выращивании органов.
Это удается сделать не для всех типов клеток и культур. Но в последнее время наметился очень большой прогресс в искусственном выращивании органов.
В 2013 году австрийскими учеными было опубликовано пионерское исследование, в котором описывалось выращивание трехмерной структуры, напоминающей головной мозг.
Эта структура достигла размера в несколько миллиметров и получила название церебрального органоида. Исследователи работали со стволовыми клетками человека и, как и многие, выращивали их в чашке, на плоской поверхности, но потом решили оторвать от поверхности и перенести клетки в плавающую, суспензионную культуру. Для этого они поместили их в биореактор, который все время перемешивал делящиеся клетки и не давал им прикрепиться к поверхности. Группы делящихся клеток формировали маленькие сферы, а потом, что удивительно, эти сферы стали все больше и больше увеличиваться в размерах. Оказалось, что в биореакторе — в условиях, когда мы активно меняем культуральную среду вокруг растущей ткани и тем самым обеспечиваем клетки кислородом и питанием — в этих растущих сфероидах протекают процессы, сходные с природными. Там идет специализация клеток и формирование структуры органа.
Там идет специализация клеток и формирование структуры органа.
Ученые использовали в своих экспериментах эмбриональные стволовые клетки, в которых во время специализации в нейроны, конечно же, проявляется и потенциал формирования всей структуры мозга. И когда нейрональной культуре предоставили возможность расти в трехмерном пространстве, получились зачатки мозга. Более детальный анализ этих органоидов показал, что в них происходят процессы, похожие на те, что происходят в мозге человека. Удивительным образом получилось, что вне человеческого организма (а исследователи использовали и эмбриональные стволовые, и репрограммированные стволовые клетки в качестве источника нейронов) сформировались структуры, соответствующие такому уникальному органу, как мозг. Более того, в случае использования репрограммированных клеток от больных микроцефалией (болезнью недоразвитого мозга) в культуре образовывались недоразвитые церебральные органоиды.
Таким образом, сегодня мы уже можем выращивать некоторые небольшие органоиды, которые будут повторять структуры отдельных органов человека. Тем самым мы получаем возможность более детально изучать какие-то процессы или что-то моделировать.
Немного по-другому был получен органоид кишечника. В качестве исходных клеток, как и в предыдущем случае, были взяты плюрипотентные стволовые клетки человека. Ученые определенным образом воздействовали на них с помощью ростовых факторов, а потом, дорастив до определенной стадии, поняли, что в чашке или биореакторе они не смогут хорошо расти, так как стали уже слишком большими и питательные вещества вовнутрь не проникают. Тогда исследователи решили пойти на такой трюк: они трансплантировали эти зачатки органоидов в лабораторную мышь, и в мышке эти клеточные структуры стали развиваться дальше.
В том месте, куда их трансплантировали, действительно развился кишечник — с криптами, ворсинками и другими необходимыми структурами.
Более того, когда этот кишечник человека, который развился в мышке, заразили Helicobacter pylori — бактерией, которая вызывает язвенную болезнь у человека, — органоид оказался инфицированным и проявил все признаки язвенной болезни.
Таким образом, получилось, что мы, с одной стороны, начали создавать что-то вне человеческого организма в лаборатории, а затем, чтобы получить более адекватную модель, перенесли это в животное, как в биореактор. Но и в этом случае органоид полностью имитировал то, что происходит в организме человека.
Органоиды дают сегодня уникальную возможность использовать их в первую очередь для разработки новых технологий, для поиска новых лекарств, для моделирования тех или иных заболеваний. Это уже относится не столько к области научного знания, сколько к его использованию для разработки определенной технологии создания человеческих органов.
Академик Хубутия: Из стволовых клеток человека можно будет вырастить орган
Александр Корольков/РГ
Изменить точку зрения заставил космос, который поставил перед наукой множество совершенно новых проблем. Это не только невесомость, перегрузки, нахождение космонавта в замкнутом пространстве. Как сложится жизнь человека, побывавшего в космосе? Отразится ли это, скажем, на работе сердечно-сосудистой системы, внутренних органов, зрения, слуха? Сможет ли человек, облетевший планету, стать родителем нормальных детей и так далее до бесконечности. Проблемы «выходили» за пределы медицины. Но, к счастью, всегда в нашей стране были провидцы, умеющие предвидеть будущее. Это прежде всего, ректор Московского физико-технического института Олег Михайлович Белоцерковский, директор Института медико-биологических проблем Олег Георгиевич Газенко, один из основателей космической медицины Василий Васильевич Парин. Этому трио блистательных ученых мы обязаны созданием кафедры физики живых систем в Московском Физтехе. Последние 12 лет ее возглавляет академик РАН, знаменитый трансплантолог Анзор Шалвович Хубутия. С ним и беседуем об этой необычной кафедре, которая сегодня востребована не менее, чем в год создания.
Это не только невесомость, перегрузки, нахождение космонавта в замкнутом пространстве. Как сложится жизнь человека, побывавшего в космосе? Отразится ли это, скажем, на работе сердечно-сосудистой системы, внутренних органов, зрения, слуха? Сможет ли человек, облетевший планету, стать родителем нормальных детей и так далее до бесконечности. Проблемы «выходили» за пределы медицины. Но, к счастью, всегда в нашей стране были провидцы, умеющие предвидеть будущее. Это прежде всего, ректор Московского физико-технического института Олег Михайлович Белоцерковский, директор Института медико-биологических проблем Олег Георгиевич Газенко, один из основателей космической медицины Василий Васильевич Парин. Этому трио блистательных ученых мы обязаны созданием кафедры физики живых систем в Московском Физтехе. Последние 12 лет ее возглавляет академик РАН, знаменитый трансплантолог Анзор Шалвович Хубутия. С ним и беседуем об этой необычной кафедре, которая сегодня востребована не менее, чем в год создания.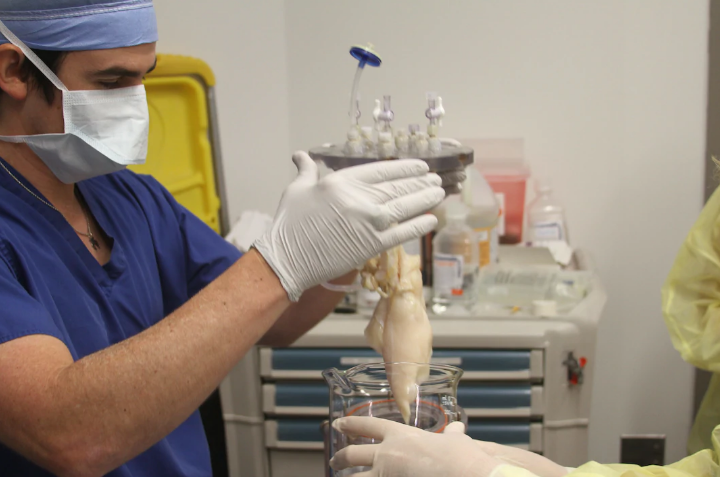
Анзор Шалвович, что значит физика живых систем?
Анзор Хубутия: Главная задача кафедры — теоретические, экспериментальные и медико-биологические исследования процессов, происходящих в живых системах в норме, патологии, при различных экстремальных состояниях. Мы изучаем то, что происходит в клетках человеческого организма. То, что не видно простым глазом, что возможно только при умении проникать в жизнь клетки.
Расшифруйте!
Анзор Хубутия: Расшифрую конкретным примером: биомеханика кровообращения, дыхания и движения. Если перевести это на совсем доступный язык, то мы отслеживаем физико-химическое состояние крови, органов дыхания в норме, патологии и экстремальной ситуации.
Стоп! Это же очень ныне актуально. Мы же достоверно не знаем, как тот же проклятый ковид калечит легкие, приводит к образованию тромбов? Не знаем, влияет ли он на наше поведение…
Анзор Хубутия: Вы правы.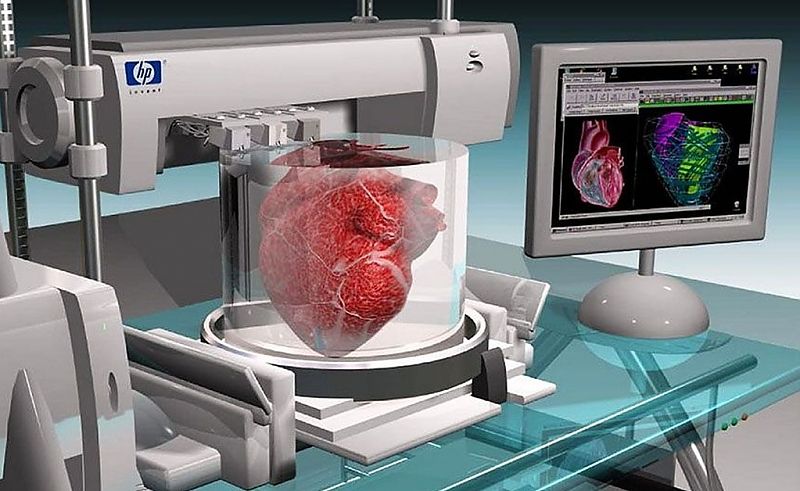 Наши исследования весьма ко двору в этой пандемической ситуации. Есть уже наработки нашей кафедры, которые помогают понять причины таких осложнений при ковиде и дать свои предложения по преодолению этих последствий. Выпускники Физтеха разработали и уже серийно производят специальные колонки для удаления из крови цитокинов, которые образуются в большом количестве при ковиде. Эти цитокины повреждают сосудистую стенку и тем самым приводят к образованию микротромбов.
Наши исследования весьма ко двору в этой пандемической ситуации. Есть уже наработки нашей кафедры, которые помогают понять причины таких осложнений при ковиде и дать свои предложения по преодолению этих последствий. Выпускники Физтеха разработали и уже серийно производят специальные колонки для удаления из крови цитокинов, которые образуются в большом количестве при ковиде. Эти цитокины повреждают сосудистую стенку и тем самым приводят к образованию микротромбов.
Спасибо за пример. Он подчеркивает прозорливость ученых, которые 55 лет назад доказали необходимость подобного научного подразделения и создали кафедру физики живых систем.
Анзор Хубутия: Я бы не хотел, чтобы о нашей кафедре судили только по ее работам в области борьбы с нынешней пандемией. На нашей встрече старожил кафедры, работающий на ней со времени основания, Валерий Михайлович Заико. Он занимается важнейшей проблемой — разработкой и созданием искусственных органов.
Анзор Шалвович, вы показываете мне искусственный левый желудочек сердца. Вот я держу его в руках. Трудно представить, что эта довольно тяжелая железяка может заменить важнейший человеческий орган — само сердце. Но он два с половиной года работал в грудной клетке пациента. И позволил заменить больное сердце, провести его пересадку. Того пациента когда-то видела в НИИ имени Склифосовского. Но не представляла, что пациент жил с таким устройством в груди.
Вот я держу его в руках. Трудно представить, что эта довольно тяжелая железяка может заменить важнейший человеческий орган — само сердце. Но он два с половиной года работал в грудной клетке пациента. И позволил заменить больное сердце, провести его пересадку. Того пациента когда-то видела в НИИ имени Склифосовского. Но не представляла, что пациент жил с таким устройством в груди.
Анзор Хубутия: А теперь они в серийном производстве. Не являются дефицитом. Наше устройство на уровне лучших мировых стандартов, а стоимость в три раза ниже зарубежных аналогов.
Вы показали мне и прежнее устройство левого желудочка. То, которое когда-то использовал в своей практике наш другой великий соотечественник, уникальный человек — я была с ним знакома — академик Валерий Иванович Шумаков. Не могу не вспомнить о нем в этом разговоре. Ведь Валерий Иванович 24 года возглавлял кафедру, о которой мы сегодня рассказываем.
Анзор Хубутия: Сейчас одна из главных тем кафедры — создание культуры сердечной ткани из стволовых клеток. Это позволит из собственных клеток выращивать жизненно важные органы.
Это позволит из собственных клеток выращивать жизненно важные органы.
Анзор! Вы рискуете? Не боитесь, что тем самым главное, чему посвящена ваша жизнь, пересадка, то есть трансплантация, органов станет не нужна? Не нужны будут доноры. Можно будет из собственных стволовых клеток самого человека вырастить тот орган, который заменит пораженный болезнью. И уйдет необходимость в специалистах-трансплантологах. Утратят актуальность «листы ожидания», проблемы подавления иммунитета. Вот вышло из строя у человека то же сердце. Нужно его заменить, чтобы спасти жизнь. И вы берете у него стволовые клетки. Начинается над ними научное колдовство. И в лаборатории вашей кафедры появляется выращенное в данном случае сердце. А если надо, то почки, печень…
Вот вышло из строя у человека сердце. Нужно его заменить, чтобы спасти жизнь. Вы берете у него стволовые клетки, и начинается научное колдовство
Анзор Хубутия: Ответить честно? Я об этом мечтаю. Но добавлю: безработица мне, трансплантологу, не грозит. Заведующий кафедры физики живых систем не подсиживает меня, трансплантолога. Ведь выращенный искусственный орган надо пересадить на место вышедшего из строя. Хотелось бы дожить до того момента, когда выращенные органы станут практикой спасения.
Заведующий кафедры физики живых систем не подсиживает меня, трансплантолога. Ведь выращенный искусственный орган надо пересадить на место вышедшего из строя. Хотелось бы дожить до того момента, когда выращенные органы станут практикой спасения.
А мне набраться терпения, чтобы посмотреть пересадку выращенного органа…
Познакомьтесь с ученым-зоотехником, пытающимся вырастить человеческие органы — у свиней
Тяжеловесы
Автор Уша Ли МакФарлинг
20 октября 2017 г.
Доктор Пабло Хуан Росс держит йоркширского поросенка, породу, используемую в экспериментах с химерами, в свиноводческом комплексе Калифорнийского университета в Дэвисе.
Брайан Бэр для STAT
Репринты
ДЭВИС, Калифорния. — Как и многие ученые, которые в начале этого года помогли открыть новаторское создание химеры наполовину человека, наполовину животного, биолог доктор Пабло Хуан Росс не привыкать к передовым инструментам, таким как CRISPR и стволовые клетки.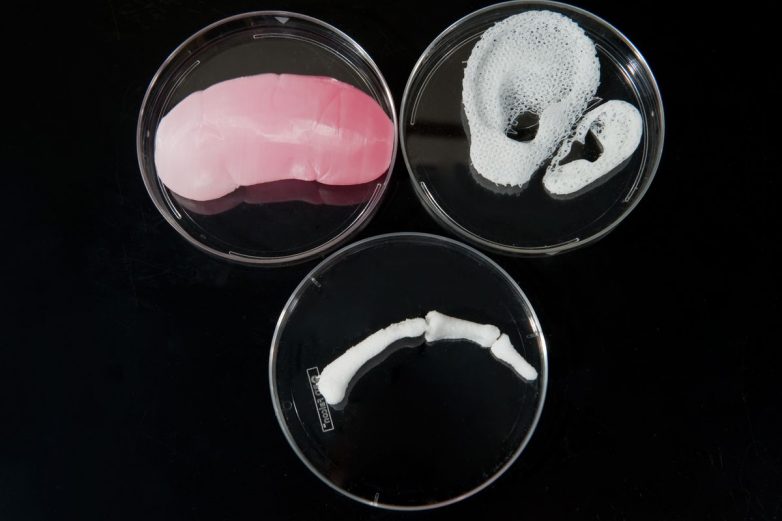 Но он также хорошо разбирается в свиных матках.
Но он также хорошо разбирается в свиных матках.
В то время как выращивание человеческих клеток внутри зародышей свиньи включало в себя некоторые из самых причудливых новых научных приемов, для этого также требовалось нечто гораздо более приземленное: ферма, забитая домашним скотом и укомплектованная такими людьми, как Росс, которые знают, как с ними обращаться.
Получив образование ветеринара и зоотехника, Росс работает в Калифорнийском университете в Дэвисе, где сено свалено в два этажа на Дейри-роуд, вывески гласят: «Сегодня распродажа мяса», коровы пасутся рядом с футбольными полями и свиноводческим комплексом. , наполненный визжащими черно-белыми поросятами Хэмпшира, имеет собственную страницу в Facebook.
реклама
Без Росса и его глубокого понимания особенностей различных видов домашнего скота и их эмбрионов пугающие эксперименты с химерами, возможно, были бы невозможны.
«Он был незаменим», — сказал Цзюнь Ву, эксперт по стволовым клеткам человека из Института Солка, который во время одного из своих визитов сюда для работы с Россом оказался в маловероятной ситуации — помогать поднимать 200-фунтовую свиноматку на операционный стол.
Эксперименты, проведенные Ву и его коллегой из Солка Хуаном Карлосом Изписуа Бельмонте и опубликованные в январе, были признаны огромным достижением. Первое в истории создание организмов, которые были наполовину человеческими, а наполовину крупными животными, представляет собой огромный и обнадеживающий первый шаг на пути к выращиванию человеческих органов для трансплантации. Но эта цель остается недостижимой: химеры теперь содержат лишь крошечную долю человеческих клеток — возможно, 1 из 100 000 — поэтому создатели пытаются найти способы увеличить долю человеческих клеток в своих химерах до полезного уровня. Росс делает все, что в его силах, при ограниченном финансировании, чтобы разобраться с животной стороной уравнения.
реклама
Его опыт настолько востребован, что Росс также был завербован главным соперником Солка, доктором Хиромицу Накаучи из Стэнфордского университета, который открыл поле химер, проведя в 2010 году эксперимент, показавший, что он может вырастить крысиную поджелудочную железу у мыши, а затем последующие эксперименты показали, что мышей можно вылечить от диабета с помощью химерных поджелудочных желез мышей, выращенных у крыс. Накаучи сейчас работает с Россом над химерами человека и овцы, надеясь, что овцы, которые оказались более восприимчивыми, чем свиньи, для выращивания клеток крови человека, могут стать лучшим шаблоном для выращивания человеческих органов.
Накаучи сейчас работает с Россом над химерами человека и овцы, надеясь, что овцы, которые оказались более восприимчивыми, чем свиньи, для выращивания клеток крови человека, могут стать лучшим шаблоном для выращивания человеческих органов.
«Это намного сложнее, чем я думал, — сказал Накаучи. «Но если нашей конечной целью является создание функциональных человеческих органов для трансплантации, мыши слишком малы. Нам нужно подтянуться».
Росс сам в некотором роде химера: он наполовину ирландец из семьи, которая готовила сливовый пудинг каждое Рождество, но он говорит с мелодичным акцентом из своей родной Аргентины и иногда спотыкается о английские идиомы, говоря что-то вроде «это что-то сверкнуло в моей голове». ».
Коллеги описали его как скромного, чрезвычайно эффективного, но, прежде всего, прагматичного человека, Росс первым признал, что путь к выращиванию человеческих органов — или даже клеток — у животных остается трудным. «Поле сделало свой первый шаг», — сказал он. «Но это все равно, что полететь на Марс. С первого раза не получится».
«Но это все равно, что полететь на Марс. С первого раза не получится».
Свиньи стоят в загоне Калифорнийского университета в Дэвисе. Брайан Баер для STAT
Росс, 40 лет, родился ветеринаром, специализирующимся на крупных животных. Его отцу был один год, и он вырос в коровьем городке в Аргентине, таком маленьком и сельском, что в детстве он никогда не видел телевизора. Сначала он надеялся стать инженером. Он хорошо разбирался в математике и отчаянно хотел покинуть свой родной город и увидеть большой мир. Ветеринарная школа в конце концов победила, но его страсть к решению проблем оказалась бесценной.
Росс решил получить докторскую степень. получил степень доктора зоотехники и после некоторых споров получил место в Мичиганском государственном университете вместе с Хосе Сибелли, аргентинцем, который окончил ту же ветеринарную школу, что и Росс, и прославился клонированием первого человеческого эмбриона в 2001 году.0003
Он погрузился в лабораторные исследования — работал над клонированием, стволовыми клетками, трансгенными клетками и выяснял, как заставить клонированные коровьи эмбрионы развиваться без использования спермы. Он совершенствовал навык, которого потребуют эксперименты с химерами, — манипулирование привередливыми эмбрионами животных для экспериментов, введение в них тончайших иголок, иногда сотни раз в день.
Он совершенствовал навык, которого потребуют эксперименты с химерами, — манипулирование привередливыми эмбрионами животных для экспериментов, введение в них тончайших иголок, иногда сотни раз в день.
Росс считал, что ему повезло попасть в лабораторию такой яркой звезды, как Сибелли. Но Чибелли говорит, что ему повезло. «Его кривая обучения была потрясающей. Он опубликовал восемь или девять статей», — сказал Чибелли. «Он просто держит голову опущенной и толкается вперед».
Кандидат наук. работа в области зоотехники показала Россу из первых рук, что яйца, эмбрионы и репродуктивные особенности различных домашних животных могут сильно различаться и быть гораздо более сложными, чем у более часто изучаемых лабораторных животных или людей.
Возьмем, к примеру, процедуры экстракорпорального оплодотворения. По сравнению с коровами и свиньями, «люди на самом деле проще простого», — сказал Джордж Зайдель-младший, физиолог-репродуктолог животных из Университета штата Колорадо и работающий владелец ранчо, у которого около 20 бывших студентов-зоотехников сейчас руководят лабораториями ЭКО человека.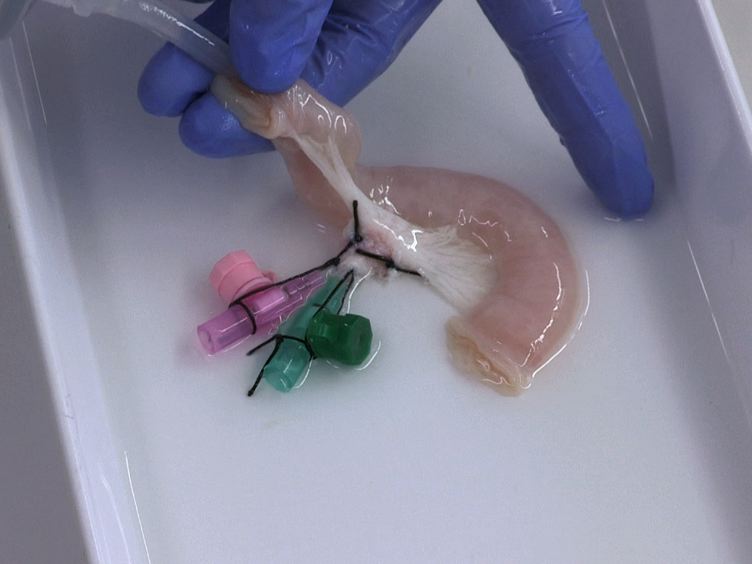 «Люди, которые работают с людьми или мышами и пытаются работать с коровой, очень быстро упираются в кирпичную стену», — сказал он. «Вот почему вам нужны такие люди, как Пабло».
«Люди, которые работают с людьми или мышами и пытаются работать с коровой, очень быстро упираются в кирпичную стену», — сказал он. «Вот почему вам нужны такие люди, как Пабло».
Чибелли считает, что ветеринарная подготовка, которая включает в себя изучение анатомии, физиологии и размножения многих различных видов, сыграла решающую роль в успехе Росса. «Дело не только в мышах», — сказал Сибелли, отметив, что Джеймс Томсон из Университета Висконсина в Мэдисоне, известный тем, что в конце 90-х получил первую линию эмбриональных стволовых клеток человека, также имеет ветеринарный опыт. «Мы не боимся других видов».
Росс также работал со стволовыми клетками человека. По иронии судьбы, для человека, который сейчас помогает создавать химер, он потратил много времени, пытаясь выяснить, как уберечь человеческие клетки в своих экспериментах от загрязнения материалом животного происхождения. Поскольку исследования с человеческими яйцеклетками были запрещены, он и Чибелли задались вопросом, может ли быть вместо этого способ взращивания человеческих стволовых клеток внутри животных.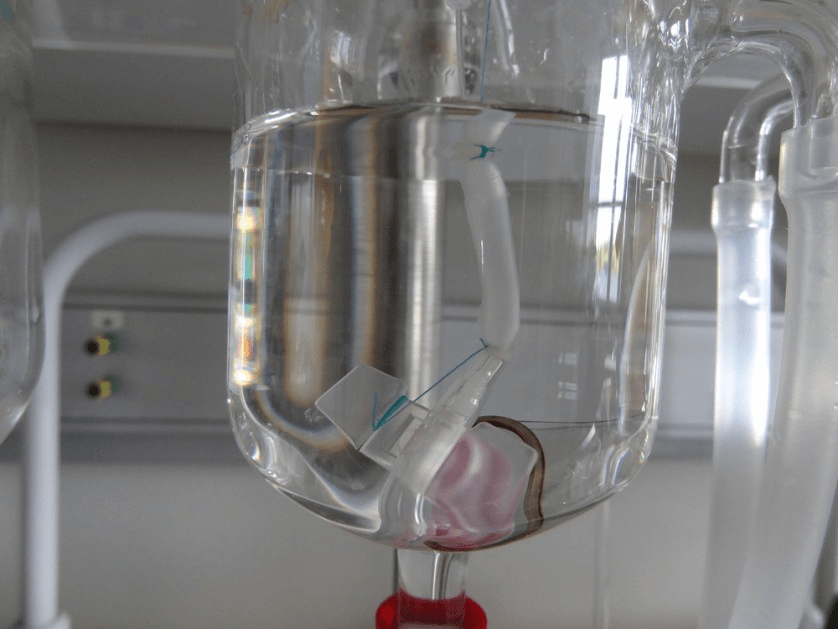 (В одном из ранних экспериментов с химерами Чибелли поместил свою собственную ДНК в коровье яйцо; эксперимент вызвал много споров, но мало что сказалось на результатах.)
(В одном из ранних экспериментов с химерами Чибелли поместил свою собственную ДНК в коровье яйцо; эксперимент вызвал много споров, но мало что сказалось на результатах.)
В середине 2000-х подобные химерические возможности казались чем-то из области фантастики. «Но это все время было у меня в голове», — сказал Росс.
У Росса есть человеческие стволовые клетки, которые он вводит в эмбрионы свиней. Брайан Баер для STAT
Перенесемся в 2014 год, когда Изписуа Бельмонте и Ву готовились осуществить свою мечту о выращивании человеческих клеток и органов у свиней. Понимая, что им нужен университет с домашним скотом, они просматривали веб-сайт Калифорнийского университета в Дэвисе, когда наткнулись на Росса и его опыт работы с эмбрионами и клонированием.
«Мы были так взволнованы, когда нашли его, — сказал Ву. «Его опыт идеально подходил для проекта».
Команда Солка поговорила с Россом по скайпу и сразу же поладила. Ученые из Солка объяснили, что у них есть методы создания различных видов стволовых клеток человека, которые могли бы лучше выживать внутри эмбрионов животных. И они использовали технологию редактирования генома CRISPR, чтобы удалить гены органов из эмбрионов животных, надеясь, что человеческие клетки заполнят пробел.
И они использовали технологию редактирования генома CRISPR, чтобы удалить гены органов из эмбрионов животных, надеясь, что человеческие клетки заполнят пробел.
«Хуан Карлос сказал: «Как вы думаете, это сработает?» Я просто сказал: «Да, это должно сработать. В этом так много смысла», — вспоминает Росс. Он был готов начать эксперименты на следующий день.
Но сначала наблюдательные советы в Дэвисе должны были одобрить сложные эксперименты, которые вызывают обеспокоенность у некоторых специалистов по этике, поскольку они потенциально стирают грань между людьми и другими животными. Был принят ряд мер безопасности, в том числе обеспечение того, чтобы свиноматки с имплантированными химерными эмбрионами содержались отдельно от других свиней и уничтожались в конце эксперимента. Несмотря на то, что свиньи-хозяева не содержали человеческих клеток, их не разрешалось использовать на мясо после того, как они были убиты или даже превращены в жир в качестве меры предосторожности.
Как только пришло одобрение, Росс вмешался, отложив в сторону такие задачи, как написание документов и заявок на гранты. «В течение двух лет я полностью пренебрегал своим офисом, — сказал он.
«В течение двух лет я полностью пренебрегал своим офисом, — сказал он.
Поскольку ни у кого из его учеников не было достаточного опыта, Росс сам проводил сложные эксперименты. Процедура требовала сидя за микроскопом и введения стволовых клеток человека в эмбрион свиньи через защитный слой клеток, называемый трофобластом. Это легко сделать у мышиного эмбриона, у которого тонкий трофобласт. Но у более крупных животных, таких как свиньи и коровы, этот слой намного толще; для того, чтобы протолкнуть иглу внутрь, требуется столько силы, что весь клубок клеток может просто разрушиться.
«Манипулирование эмбрионами, микроинъекции эмбрионов. Он один из тех редких людей, которые могут выполнять такую работу», — сказал Накаучи.
Росс установил систему для взрыва эмбрионов с помощью лазерного импульса, который создавал небольшое отверстие, через которое он мог вводить человеческие стволовые клетки или молекулы для CRISPR генов внутри, в зависимости от того, что требовал эксперимент.
У него были и другие специальные знания, необходимые для исследования химер. Он знал, какие скотобойни могут предоставить коровьи и свиные яичники, необходимые для сбора яиц. Он знал рецепты клеточных культур — смесей натрия, глюкозы и альбумина — которые могли поддерживать жизнь свиных эмбрионов в чашке Петри.
И в Дэвисе есть потрясающие помещения и персонал для выращивания и выращивания скота, в том числе Центр обучения и исследования свиней площадью 9000 квадратных футов, заполненный сотнями свиней всех возрастов, который управляющий Аарон Принц содержит в порядке, лучше, чем любой свинокомплекс.
Подсадить свиноматке химерные эмбрионы непросто. Требуется целая бригада хирургов, сильные люди, чтобы правильно расположить крупных животных на операционных столах, и такие эксперты, как ветеринар из Калифорнийского университета в Дэвисе Джоан Дин Роу, обладающая ловким чутьем, чтобы имплантировать эмбрионы — химерные или иные — точно в нужное место в огромном свином животе. и сложная двурогая матка.
и сложная двурогая матка.
В этих экспериментах многое может пойти не так, и у Росса это часто случалось. Это был деликатный танец — синхронизация животных с овуляцией, подготовка человеческих стволовых клеток, осторожное введение эмбрионов без их повреждения и наличие бригады хирургов для точного имплантирования 50 эмбрионов свиноматке. Иногда животное было готово к операции, но эмбрионы умирали до того, как их удавалось имплантировать. Иногда стволовые клетки были готовы для инъекции в то время, когда животное не могло быть подготовлено к операции.
«Это очень расстраивает, — сказал Росс. «Это потребовало так много работы, так много людей. И много раз это не срабатывало».
Даже когда операции прошли хорошо, разочарование Росса не закончилось: свиньи часто теряют имплантированные эмбрионы, особенно когда эти эмбрионы несут человеческие клетки или находятся в течение нескольких дней вне матки. Но Росс в конце концов смог заставить несколько эмбрионов химер выжить внутри их свиней-хозяев в течение 28 дней — продолжительность времени, в течение которого этические комиссии позволили ему вынашивать химер.
В июне 2016 года он взял эмбрион длиной в полдюйма и поместил его под микроскоп в поисках характерной флуоресценции, которой были помечены человеческие стволовые клетки. Он был усеян флуоресцентными точками.
«Я подумал, что это настоящая вещь», — вспоминает Росс. «У меня до сих пор в голове этот образ».
Испытания, проведенные его сотрудниками Солком, подтвердили, что человеческие клетки выжили в эмбрионе свиньи. Затем эксперименты были расширены на обширной свиноферме в Испании, где Росс и Ву обучали команды работать со стволовыми клетками и вводить эмбрионы. Для финального эксперимента потребовалось около 2000 эмбрионов свиней.
В бластоцисту свиньи вводят стволовые клетки человека. Пабло Хуан Росс/UC Davis
4-недельный эмбрион свиньи, который был генетически модифицирован, чтобы не образовывалась поджелудочная железа. Джун Ву/Институт Солка
Публикация результатов в январе вызвала огромный ажиотаж, но Росс лучше, чем кто-либо, знает, сколько работы еще предстоит сделать.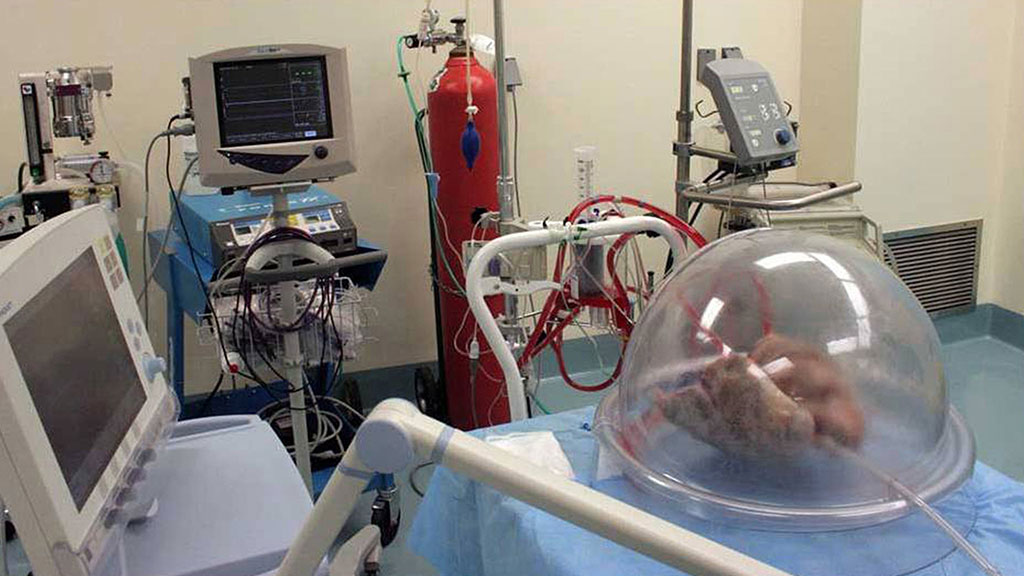 Он знал, что у эмбрионов свиньи не будет огромного количества выживших человеческих клеток, потому что свиньи и люди — очень дальние родственники. Даже химеры между близкородственными крысами и мышами содержат только от 20 до 30 процентов введенных клеток. Он надеялся на 3 процента. Но команда получила менее 0,001 процента — слишком мало для создания человеческих органов.
Он знал, что у эмбрионов свиньи не будет огромного количества выживших человеческих клеток, потому что свиньи и люди — очень дальние родственники. Даже химеры между близкородственными крысами и мышами содержат только от 20 до 30 процентов введенных клеток. Он надеялся на 3 процента. Но команда получила менее 0,001 процента — слишком мало для создания человеческих органов.
Больше всего он хотел бы узнать, что случилось с человеческими клетками и почему они погибли. Но он поставлен в тупик из-за моратория Национального института здравоохранения на финансирование исследований химер животных и людей. Запрет означает, что он не может подать заявку на крупный многолетний грант, который мог бы помочь ему решить проблему.
«Вся эта работа действительно была проделана без реальных денег, без реальной поддержки», — сказал Росс. «Все это было сделано, когда у нас есть несколько лишних эмбрионов, и мы говорим: «Вот, давайте сделаем это». Ничто не делается так, как должно быть».
Ограниченный в средствах, Росс сам выполняет большую часть работы, которую в лабораториях с более высоким финансированием мог бы сделать технический специалист, от извлечения пипеток до изготовления микроманипуляторов, необходимых для инъекции эмбрионов, и аспирации яйцеклеток из выброшенных яичников.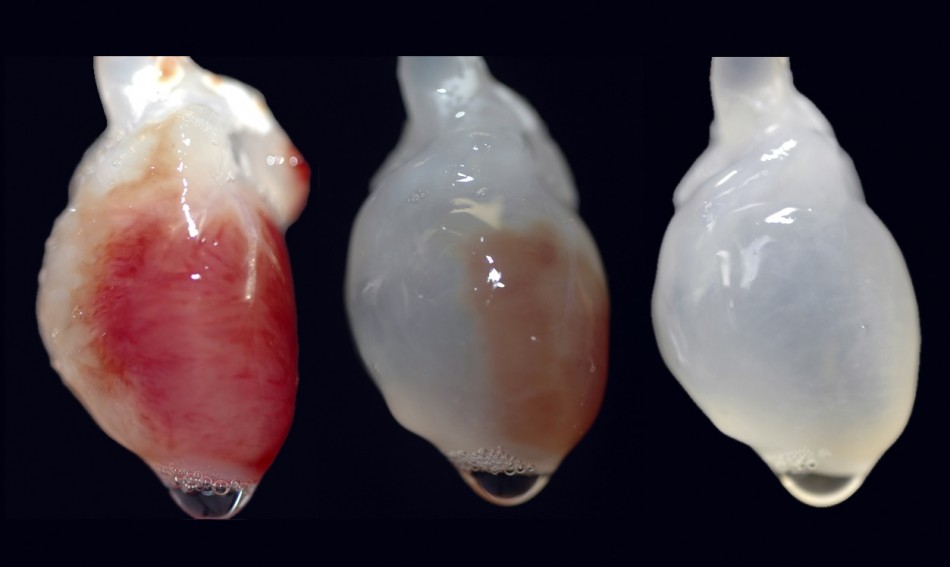 Уже пять или шесть раз он восстанавливал унаследованную два десятилетия назад микрогорн, который он использует для изготовления инструментов. «Он сделал что-то за небольшую часть затрат, которые потребовались бы другим лабораториям», — сказал Зайдель.
Уже пять или шесть раз он восстанавливал унаследованную два десятилетия назад микрогорн, который он использует для изготовления инструментов. «Он сделал что-то за небольшую часть затрат, которые потребовались бы другим лабораториям», — сказал Зайдель.
Тем временем Росс продвигается вперед вместе с Накаучи из Стэнфорда, пытаясь увеличить производство человеческих клеток, полезных для органов у овец. Они используют человеческие стволовые клетки, уже предназначенные для превращения в органы, и ищут способы защитить полученные от человека клетки от естественных механизмов гибели клеток.
В конечном счете, он считает, что трансплантацию можно делать с промежуточными органами. Он считает, что свиной орган, наполненный человеческими клетками, является более реалистичным конечным результатом и может прекрасно работать, потому что органы свиньи очень похожи на человеческие по размеру и форме. Он также открыт для идеи, что некоторые методы лечения, основанные на химерах, могут вообще не требовать органов. Например, при диабете исследователи могли бы использовать химеру для выращивания островков поджелудочной железы, скоплений клеток, вырабатывающих инсулин, которые затем можно было бы имплантировать вместо совершенно нового органа.
Например, при диабете исследователи могли бы использовать химеру для выращивания островков поджелудочной железы, скоплений клеток, вырабатывающих инсулин, которые затем можно было бы имплантировать вместо совершенно нового органа.
Но для того, чтобы все это стало клинической реальностью, Росс и его коллеги должны выяснить, как получить больше человеческих клеток, чтобы выжить внутри их овец, свиней или коров-хозяев. «Чего не хватает?» — спросил Росс. «Это может быть одно. Это может быть сотня вещей».
Он настроен оптимистично, сказал он, потому что работа только начинается. Подумайте о Долли, клонированной овце, сказал он, одной из самых больших историй успеха зоотехники. На ее создание ушло 277 попыток.
Об авторе
КУЛЬТИВИРОВАНИЕ ВЗРОСЛЫХ ТКАНЕЙ И ОРГАНОВ ВНЕ ТЕЛА | JAMA
КУЛЬТИВИРОВАНИЕ ВЗРОСЛЫХ ТКАНЕЙ И ОРГАНОВ ВНЕ ТЕЛА | ДЖАМА | Сеть ДЖАМА
[Перейти к навигации]
Эта проблема
- Скачать PDF
- Полный текст
Поделиться
Твиттер
Фейсбук
Эл. адрес
адрес
LinkedIn- Процитировать это
- Разрешения
Артикул
15 октября 1910 г.
АЛЕКСИС КАРРЕЛ, MD ; МОНТРОЗ Т БЕРРОУЗ, MD
Принадлежности авторов
НЬЮ-ЙОРК
Из лабораторий Рокфеллеровского института медицинских исследований.
ДЖАМА. 1910;55(16):1379-1381. дои: 10.1001/jama.1910.04330160047018
Полный текст
Эта статья доступна только в формате PDF. Загрузите PDF-файл, чтобы просмотреть статью, а также связанные с ней рисунки и таблицы.
Абстрактный
Решение многих проблем патологии человека в значительной мере зависит от нахождения неизвестных до сих пор физиологических закономерностей зарождения, роста и эволюции клеток.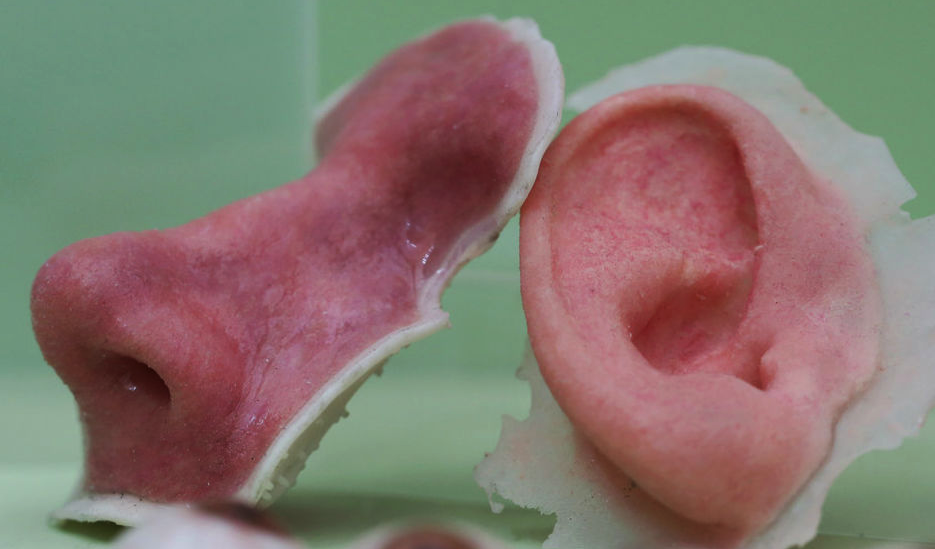 Поэтому мы должны разработать новые методы, позволяющие открывать эти законы. Несколько недель назад мы начали систематически исследовать один из этих будущих методов, а именно культивирование взрослых тканей вне тела. Отправной точкой наших исследований послужила прекрасная работа Харрисона о зародышевых тканях лягушки. Несколько лет назад Харрисон наблюдал развитие нервов из центральной нервной системы зародышей лягушек, культивируемых в капле лимфы. В 1910, Берроуз, работая с Харрисоном, значительно усовершенствовал этот метод и адаптировал его к эмбриональным тканям теплокровных животных. Ему удалось культивировать нервы и мезенхимные клетки шестидесятичасовых куриных эмбрионов.
Поэтому мы должны разработать новые методы, позволяющие открывать эти законы. Несколько недель назад мы начали систематически исследовать один из этих будущих методов, а именно культивирование взрослых тканей вне тела. Отправной точкой наших исследований послужила прекрасная работа Харрисона о зародышевых тканях лягушки. Несколько лет назад Харрисон наблюдал развитие нервов из центральной нервной системы зародышей лягушек, культивируемых в капле лимфы. В 1910, Берроуз, работая с Харрисоном, значительно усовершенствовал этот метод и адаптировал его к эмбриональным тканям теплокровных животных. Ему удалось культивировать нервы и мезенхимные клетки шестидесятичасовых куриных эмбрионов.
Потом в Рокфеллеровском институте пытались разработать на
Предварительный просмотр первой страницы
Просмотреть большой
Полный текст
Добавить или изменить учреждение
- Кислотно-щелочное, электролиты, жидкости
- Наркологическая медицина
- Аллергия и клиническая иммунология
- Анестезиология
- Антикоагулянты
- Искусство и изображения в психиатрии
- Кровотечение и переливание крови
- Кардиология
- Уход за тяжелобольным пациентом
- Проблемы клинической электрокардиографии
- Клиническая задача
- Поддержка принятия клинических решений
- Клинические последствия базовой нейронауки
- Клиническая фармация и фармакология
- Дополнительная и альтернативная медицина
- Заявления о консенсусе
- Коронавирус (COVID-19)
- Медицина интенсивной терапии
- Культурная компетенция
- Стоматология
- Дерматология
- Диабет и эндокринология
- Интерпретация диагностического теста
- Разнообразие, равенство и инклюзивность
- Разработка лекарств
- Электронные медицинские карты
- Скорая помощь
- Конец жизни
- Гигиена окружающей среды
- Этика
- Пластическая хирургия лица
- Гастроэнтерология и гепатология
- Генетика и геномика
- Геномика и точное здоровье
- Гериатрия
- Глобальное здравоохранение
- Справочник по статистике и медицине
- Рекомендации
- Заболевания волос
- Модели медицинского обслуживания
- Экономика здравоохранения, страхование, оплата
- Качество медицинской помощи
- Реформа здравоохранения
- Медицинская безопасность
- Медицинские работники
- Различия в состоянии здоровья
- Несправедливость в отношении здоровья
- Информатика здравоохранения
- Политика здравоохранения
- Гематология
- История медицины
- Гуманитарные науки
- Гипертония
- Изображения в неврологии
- Наука внедрения
- Инфекционные болезни
- Инновации в оказании медицинской помощи
- JAMA Инфографика
- Право и медицина
- Ведущее изменение
- Чем меньше, тем лучше
- ЛГБТК
- Образ жизни
- Медицинский код
- Медицинские приборы и оборудование
- Медицинское образование
- Медицинское образование и обучение
- Медицинские журналы и публикации
- Меланома
- Мобильное здравоохранение и телемедицина
- Нарративная медицина
- Нефрология
- Неврология
- Неврология и психиатрия
- Примечательные примечания
- Сестринское дело
- Питание
- Питание, Ожирение, Упражнения
- Ожирение
- Акушерство и гинекология
- Гигиена труда
- Онкология
- Офтальмологические изображения
- Офтальмология
- Ортопедия
- Отоларингология
- Лекарство от боли
- Патология и лабораторная медицина
- Уход за пациентами
- Информация для пациентов
- Педиатрия
- Повышение производительности
- Показатели эффективности
- Периоперационный уход и консультация
- Фармакоэкономика
- Фармакоэпидемиология
- Фармакогенетика
- Фармация и клиническая фармакология
- Физическая медицина и реабилитация
- Физиотерапия
- Руководство врачей
- Поэзия
- Здоровье населения
- Профилактическая медицина
- Профессиональное благополучие
- Профессионализм
- Психиатрия и поведенческое здоровье
- Общественное здравоохранение
- Легочная медицина
- Радиология
- Регулирующие органы
- Исследования, методы, статистика
- Реанимация
- Ревматология
- Управление рисками
- Научные открытия и будущее медицины
- Совместное принятие решений и общение
- Медицина сна
- Спортивная медицина
- Трансплантация стволовых клеток
- Хирургия
- Хирургические инновации
- Хирургические жемчужины
- Обучаемый момент
- Технологии и финансы
- Искусство JAMA
- Искусство и медицина
- Рациональное клиническое обследование
- Табак и электронные сигареты
- Токсикология
- Травмы и травмы
- Приверженность лечению
- УЗИ
- Урология
- Руководство пользователя по медицинской литературе
- Вакцинация
- Венозная тромбоэмболия
- Здоровье ветеранов
- Насилие
- Женское здоровье
- Рабочий процесс и процесс
- Уход за ранами, инфекция, заживление
Сохранить настройки
Политика конфиденциальности | Условия использования
исследователей из Стэнфордского университета сделали важный шаг на пути к выращиванию органов | Центр новостей
Исследователи продемонстрировали первоначальную жизнеспособность эмбриона, содержащего клетки как шимпанзе, так и макаки, в ходе предварительного исследования, в ходе которого изучалась возможность органогенеза приматов.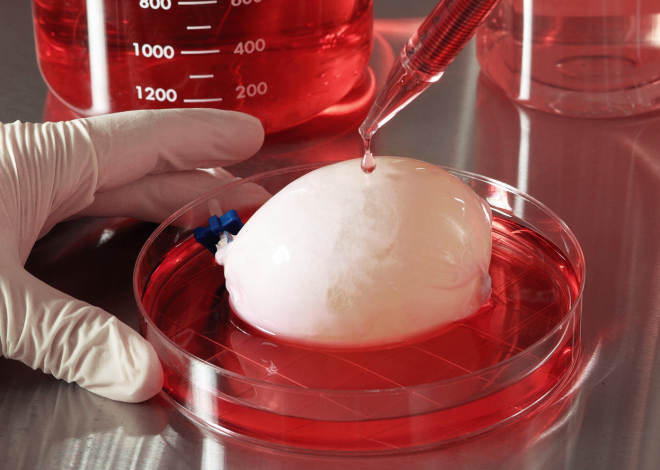
30 августа 2022 г.
— By Hanae Armitage
Острая нехватка органов, доступных для пересадки человеку, вынудила исследователей проявить творческий подход к созданию новых органов. Некоторые связывали свои надежды со свиньями; другие стремятся вырастить органы в чашке, но эти усилия в основном бесплодны или сопровождаются осложнениями.
Подход, который был одновременно и наиболее многообещающим, и наименее успешным, — разработка органов человека у животных. Но новое исследование, проведенное учеными из Стэнфордской школы медицины и их сотрудниками, закладывает предварительную основу для метода, который может предоставить ученым возрожденный путь для этого типа генерации органов.
Чтобы показать, что такой подход осуществим, необходимо продемонстрировать, что стволовые клетки человека (которые вырастают в специализированные клетки и части тела, включая органы) могут выживать в раннем эмбрионе животного, который выступает своего рода биологического инкубатора. Но возможности для разработки этих клеток должным образом ограничены: законы в Соединенных Штатах и научная этика тщательно запрещают экспериментировать с химерами (смесь двух генетически разных клеток) между людьми и приматами, объяснил Майкл Снайдер, доктор философии, профессор. и кафедрой генетики.
Но возможности для разработки этих клеток должным образом ограничены: законы в Соединенных Штатах и научная этика тщательно запрещают экспериментировать с химерами (смесь двух генетически разных клеток) между людьми и приматами, объяснил Майкл Снайдер, доктор философии, профессор. и кафедрой генетики.
Вместо этого команда обратилась к клеткам нечеловеческих приматов, чтобы действовать как прокси. «В этом исследовании мы используем клетки шимпанзе, потому что знаем, что они генетически очень близки к человеческим клеткам. Мы показываем, что стволовые клетки шимпанзе могут выживать на другой животной модели — в данном случае на макаке-резусе — в надежде, что жизнеспособность позволит нам дополнительно изучить генезис органов в будущем», — сказал Хиромицу Накаучи, доктор медицинских наук, профессор генетики. . «Это наша долгосрочная цель. И это непросто».
Другие исследовательские группы пробовали этот подход, но ни одна из них не увенчалась успехом. Только когда стэнфордский ветеринарный исследователь Мортеза Рудгар, DVM, PhD, разработал новый метод получения более стабильных, надежных плюрипотентных стволовых клеток шимпанзе, обладающих способностью расти в ткани любого типа, команда обрела новую надежду на этот метод.
Статья, описывающая выводы группы, была опубликована в Cell Reports 30 августа. Снайдер, доктор медицины, FASC, профессор генетики Стэнфордского университета Ашермана; Накаучи; и Кэтрин ВандеВорт, доктор философии, профессор Исследовательского центра приматов Калифорнийского университета в Дэвисе, являются соавторами исследования. Рудгар является ведущим автором.
Дверь, когда-то закрытая, теперь приоткрытая
Ученые годами гонялись за перспективой создания человеческих органов у животных — многие даже считают это святым Граалем органогенеза. Использование собственных стволовых клеток человека для выращивания, скажем, новой печени позволит избежать любой возможности отторжения, поскольку новая ткань будет отражать их естественную биологическую структуру, а также устранит часто мучительно долгое время ожидания в списках трансплантатов.
Накаучи — пионер и давний сторонник межвидового образования органов. В своей ранней работе он продемонстрировал, что крысиную поджелудочную железу можно создать у мыши.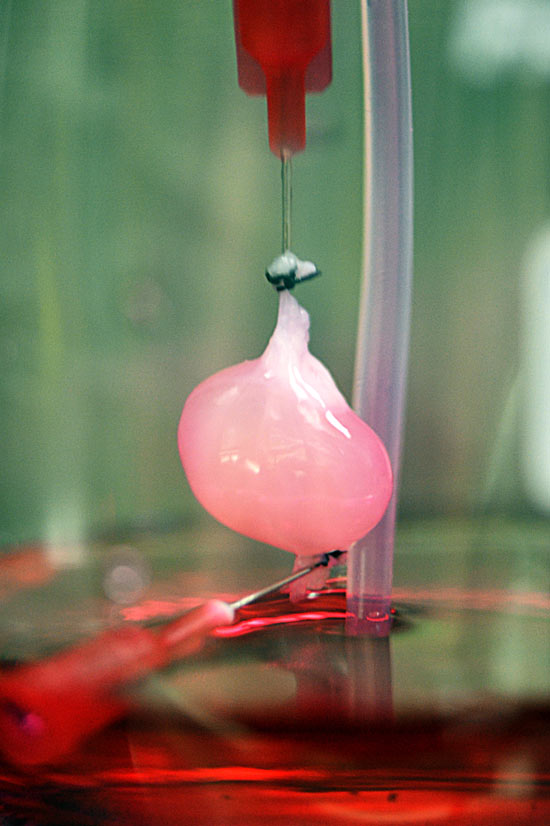 Затем его команда показала, что органы, созданные внутри тела другого вида, могут быть пересажены обратно исходному виду без отторжения. «Если бы этот принцип работал между людьми и крупными животными, можно было бы производить человеческие органы у животного, такого как свинья», — сказал Накаучи.
Затем его команда показала, что органы, созданные внутри тела другого вида, могут быть пересажены обратно исходному виду без отторжения. «Если бы этот принцип работал между людьми и крупными животными, можно было бы производить человеческие органы у животного, такого как свинья», — сказал Накаучи.
Однако биология приматов и грызунов может сильно отличаться друг от друга, поэтому ученым необходимо воспроизвести результаты исследования грызунов на приматах. Но культивировать стволовые клетки шимпанзе оказалось непросто. Они были привередливы, коварны и неуправляемы в чашке, преждевременно умирая и дифференцируясь или вырастая в определенные типы клеток, когда им не положено. (Часть создания стволовых клеток хорошего качества заключается в обеспечении стабильности клеток, чтобы их можно было запрограммировать на трансформацию в определенный тип ткани, сказал Рудгар.) После многих неудачных экспериментов импульс в этой области иссяк.
Новая методика Рудгара, которая точно настраивает генную активность стволовых клеток шимпанзе, наделяя их большей стабильностью, открывает двери для этих исследований и возможность продолжения исследований.
Самой большой победой стала жизнеспособность, которую команда продемонстрировала с клетками нечеловеческих приматов в раннем эмбрионе, который был больше похож на скопление клеток, чем на что-либо, напоминающее живой орган или животное, сказал Рудгар. Более надежные стволовые клетки, полученные из клеток крови, взятых у шимпанзе в Юго-Западном национальном центре приматов в Техасе во время обычного медицинского осмотра, были объединены с эмбрионом макаки-резус. Два дня спустя имплантированные клетки были еще живы. «Мы смогли показать, что клетки выживают, размножаются и растут», — сказал Снайдер. «Эти улучшенные стволовые клетки станут неотъемлемой частью нашей модели и исследований».
Хотя открытие, подтверждающее принцип работы, является захватывающим, еще слишком рано говорить о том, предвещает ли наблюдаемая жизнеспособность эмбриона химеры подход к персонализированной трансплантации органов. Однако это дает ученым повод продолжить следующий этап своих исследований.
Этический прогресс
Команда исследует, могут ли стволовые клетки эмбрионов-химер принимать новые клеточные формы и создавать другие ткани. По словам Рудгара, по мере того, как стволовые клетки трансформируются и превращаются в различные типы тканей, крайне важно установить биологические барьеры. «Есть способы помешать стволовым клеткам стать определенными типами клеток, такими как клетки мозга или нервной системы», — сказал он. «Создание примата, не являющегося человеком, с клетками человеческого мозга — это граница, которую мы не переступим».
Помимо того, что высококачественные стволовые клетки играют центральную роль в изучении формирования органов у людей, они могут принести пользу шимпанзе. Например, многие протоколы оценки в фармацевтической промышленности тестируют новые лекарства или методы лечения на живых приматах. Если бы стволовые клетки нечеловеческих приматов могли надежно генерировать органы, они могли бы заменить, уменьшить или даже устранить потребность в тестировании живых приматов, кроме человека.
Рудгар подчеркивает, что исследование носит поэтапный характер. «Мы не должны забегать вперед. Нам нужно отвечать на один научный вопрос за раз, активно оценивая научную и этическую обратную связь», — сказал он. «По мере того, как наука растет, этические дискуссии будут расти вместе с ней, и вместе, как сообщество, мы сможем понять, как действовать дальше».
Финансирование этого исследования было предоставлено Национальным институтом здравоохранения (гранты P51OD011133 и T32HL120824-6) и премией Калифорнийского института регенеративной медицины за лидерство в исследованиях.
Исследователи из Медицинской школы Университета Джона Хопкинса внесли свой вклад в это исследование.
Контакты для СМИ
Стэнфордская медицина объединяет исследования, медицинское образование и здравоохранение в трех своих учреждениях — Стэнфордской школе медицины, Стэнфордском здравоохранении и Стэнфордском детском здравоохранении. Для получения дополнительной информации посетите веб-сайт Управления по связям с общественностью по адресу http://mednews.

 адрес
адрес