Самый легкий газ в мире и его характеристики. Есть просто газ легчайший водород
Что легче? Гелий или водород?
водород легче!<br><br>P.S. Прочитал отсальный ответы и чуть со стула не упал! ВОДОРО ЛЕГЧЕ, ЭТО ФАКТ! ЗАГЛЯНИТЕ В ТАБЛИЦУ МЕНДЕЛЕЕВА И ВСПОМНИТЕ КАК ОН ФОРМУЛИРОВАЛ СВОЙ ЗАКОН. А формулировал он его так: Свойства атомов находятся в переодической зависимости от их атомных масс. Это потом уже переформулировали что от заряда ядра.<br><br>Так вот, в табоице Менделеева слева направо сверху вниз масса увеличивается. ВОДОРОД стоит раньше. <br><br>Если речь идет от молях, то опять же водород легче! Водород - это молекула h3 с массой 2 а.е.м., Гелий инертен, молекулы гелия в природе не существует. масса He равна 4 а.е.м. И ГЕЛИЙ БОЛЕЕ ИНЕРТНЫЙ, Т.Е. ОН НЕ ВСТУПАЕТ ВО ВЗАИМОДЕЙСВТВИЯ С ДРУГИМИ АТОМАМИ. И ДОБЫВАТЬ ЕГО СЛОЖНЕЕ, ПРОСТО ВОДОРОД ВЗРЫВООПАСЕН! НАПОЛНЯТЬ ИМ ВОЗДУШНЫЕ ШАРИКИ МОЖЕТ ТОЛЬКО ДУРАК. В свое время водородом наполняли дерижабли. После офигенной катострофы, перестали.<br><br>ну я не знаю как тебя еще убедить!
Водород, но он часто вступает в реакции с другими газами, а гелий нет, поэтому для надувания шариков используют гелий. и получить его легче
гейлий и легче и менее энертный
водород легче
водород легче определенно. поверьте на слово....химию сдавала....
Молярная масса Н- 1г/моль, у Не-4г/моль. Легче водород, как элемент. Как газ, в принципе, тож, тк. Н2- 2 г/моль, а Не-4
Продолжение к Ольге:<br>т.е. при нормальных условиях 22,4 литра водорода весят 2 г, а гелия - 4 г.<br>Использование "тяжелого" и дорогого гелия в дирижаблях-шариках и т.п. обусловлено его химической инертностью - водород горит и взрывается.
Одинаковый объём газа, и водорода и гелия, будет содержать при одинаковых условиях (температуре и давлении) одинаковое количество молекул. Молекула водорода состоит из двух атомов весом 1 а.е.м., то есть весит 2 а.е.м. Молекула гелия состоит из одного атома весом 4 а.е.м. Таким образом водород имеет вдвое меньшую плотность.
Все будет зависеть от давления: плотность любого газа пропорциональна давлению. Когда Вы один газ держите при очень большом давлении, у него и плотность будет очень большая, а другой газ под маленьким давлением будет иметь маленькую плотность.<br>Если же давление одно и тоже, тогда водород легче гелия. Вспомните периодическую таблицу элементов. Самый первый элемент - водород. Его ядро состоит всего из одного протона. Вторым элементом в таблице идет гелий. В ядре гелия содержится два протона и два нейтрона. Нейтрон имеет очень близкую к протону массу, можно даже сказать, что они имеют примерно одинаковую массу. Вот теперь сами и подумайте, что легче: один протон или четыре в сумме?<br>Вот данные из справочника по плотностям: водород - 0.09кг/ммм (ммм это не микромиллиметр, а метр в кубе), гелий - 0.179кг/ммм. То есть водород почти в 2 раза легче гелия.
Легче вообще об этом не думать!
Точно гелий легче водорода.
Водород определенно легче,но для надувания шариков используют гелий,т.к. он не взрывается (взрыв-быстропротекающий процесс горения,а горение-процесс окисления(взаимодействие с кислородом),а гелий-газ инертный,с другими элементами не взаимодействует.)<br>В таблице Менделеева элементы расположены в зависимости от их молярной массы.Водород под номером один.Значит один атом водорода 1 а.е.м( атомная единица массы) а молекулярный водород (Н2) весит 2 а.е.м.<br>Ядро водорота содержит 1 протон(масса 1),чем и обусловливается масса атома.(электрон невесом)<br>Гелий - под номером 2.Ядро етома гелия содержит 2 протона и 2 нейтрона (всего масса получается 4).
Посмотри таблицу Менделеева, если так и не понятно. Какой элемент раньше стоит, тот и легче (химия, 7 класс). Водород раньше, значит легче.
сборище идиотов в комментариях. элементарных вещей не знают. жесть
Водород тест на химию сдовал
touch.otvet.mail.ru
Урок 21. Водород - самый лёгкий газ – HIMI4KA
В уроке 21 «Водород — самый лёгкий газ» из курса «Химия для чайников» рассмотрим водород как простое вещество и химический элемент; узнаем об истории открытия водорода и о его физических свойствах.

Название водорода происходит от латинского слова Hydrohenium, что означает «воду родящий». Химический символ (знак) Н — это первая буква латинского названия. И действительно, атомы водорода входят в состав молекулы воды Н2О.
Атомы водорода образуют двухатомные молекулы простого вещества водорода, формула которого Н2. Рассмотрим, что имеют в виду, когда говорят о химическом элементе водороде.
Водород как химический элемент
Атом водорода самый легкий, самый простой по строению и один из самых маленьких по размерам. Относительная атомная масса водорода равна:
Сравните ее с относительной атомной массой кислорода и убедитесь, что атомы водорода во много раз легче.
Атомы водорода соединяются с атомами других химических элементов, образуя сложные вещества. Как химический элемент водород входит в состав воды, кислот, природного газа, нефти, глюкозы и многих других веществ. В растительных и животных организмах, включая и человеческий, химический элемент водород содержится главным образом в составе воды и самых разнообразных органических веществ.
Водород как простое вещество
Молекулы водорода образованы двумя атомами химического элемента водорода. Формула его Н2. Относительная молекулярная масса простого вещества водорода равна:
Следовательно, молярная масса водорода равна:
Молярный объем водорода, как кислорода и других газов при нормальных условиях, равен:
В виде простого вещества водород встречается на Земле лишь в небольшом количестве в вулканических и некоторых других природных газах. Молекулы водорода Н2 обнаружены в верхних слоях земной атмосферы. В Солнечной системе простое вещество водород входит в состав атмосферы планет — Юпитера, Сатурна, Урана.
На заметку: Недавние исследования Юпитера, самой большой планеты Солнечной системы, позволили ученым высказать предположение, что под водородной атмосферой этой планеты находится океан жидкого водорода. Глубина этого океана — десятки тысяч километров. Ядро планеты составляет оболочка, состоящая из твердого водорода.
История открытия водорода
Еще в XVI в. Парацельсом было замечено, что при действии кислот на железо и другие металлы выделяется газ. Первоначально его назвали «горючим воздухом». Спустя примерно 100 лет горение водорода на воздухе описал Р. Бойль и этот газ научились собирать. Во второй половине XVIII в. английский ученый Г. Кавендиш подробно исследовал свойства «горючего воздуха». Он установил, что этот газ при сгорании на воздухе образует воду. Г. Кавендиша считают первооткрывателем водорода (1766).
Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 г. французским химиком А. Лавуазье. Он и дал этому веществу латинское название, которое происходило от греческих слов «хюдор» — вода и «геннао» — рождаю. В те годы под элементами подразумевали простые вещества, которые нельзя далее разложить на составные части. Поэтому у химического элемента водорода такое же название, как и у простого вещества Н2.
Физические свойства водорода
Водород при нормальных условиях находится в газообразном состоянии. Это бесцветный газ, у которого нет запаха и вкуса.
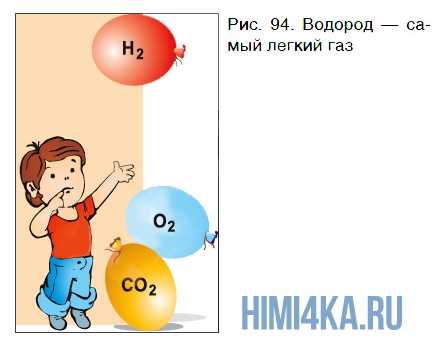
Молекула водорода самая легкая из молекул всех веществ. Поэтому газообразный водород по плотности значительно уступает воздуху и кислороду — он в 14,5 раза легче воздуха и в 16 раз легче кислорода. В этом легко убедиться на опыте.
Если наполнить три одинаковых резиновых шарика водородом, углекислым газом и кислородом, крепко завязать их ниткой и выпустить из рук одновременно, то они поведут себя по-разному (рис. 94). Шарик с водородом быстро поднимется к потолку, а шарики с углекислым газом и кислородом опустятся на пол. Быстрее окажется на полу шарик суглекислым газом.
На заметку: Поскольку водород, как мы знаем, в 14,5 раза легче воздуха, им заполняли воздушные шары и дирижабли. Первыми поднялись на воздушном шаре французские физики Ф. Робер и Ж. Шарль (1783). В августе 1887 г. полет на воздушном шаре, наполненном водородом, с научной целью совершил Д. И. Менделеев.
Из-за своей малой массы и размеров молекулы водорода способны проникать через стенки сосуда, в котором содержится этот газ. Убедимся в этом на примере того же шарика с водородом. Даже если тщательно завязать его ниткой, спустя некоторое время шарик «сдуется». При повышенной температуре и давлении водород способен проникать и через стенки металлических сосудов.
На заметку: Некоторые металлы при повышенной температуре поглощают водород, впитывая его, как губка воду. Например, в образце металла палладия объемом 1 дм3 растворяется водород объемом свыше 800 дм3. При нагревании насыщенного водородом палладия этот газ легко выделяется обратно. Палладий и некоторые другие металлы могут служить как бы аккумуляторами водорода.
При нормальных условиях растворимость водорода в воде меньше, чем кислорода, — 0,0016 г водорода на 1 дм3 воды. Поскольку водород малорастворим, в лаборатории его собирают методом вытеснения воды или воздуха.
У водорода самые низкие после благородного газа гелия температуры кипения (−252,8 °С) и плавления (−259,2 °С).
Краткие выводы урока:
- Водород — наиболее распространенный элемент во Вселенной.
- Простое вещество водород Н2 — самый легкий газ, у которого нет запаха, цвета, вкуса.
- Водород мало растворяется в воде, его можно собирать методом вытеснения воды и воздуха.
Надеюсь урок 21 «Водород — самый лёгкий газ» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
himi4ka.ru
Самые легкие газы. Особенности водорода, кислорода и азота
Газ – одно из состояний вещества. Он не обладает конкретным объемом, заполняя собой всю емкость, в которой находится. Зато обладает текучестью и плотностью. Какие самые легкие газы существуют? Чем они характеризуются?
Самые легкие газы
Название «газ» было придумано ещё в XVII веке из-за созвучия со словом "хаос". Частицы вещества и вправду, хаотичны. Они движутся в произвольном порядке, меняя траекторию каждый раз, когда сталкиваются друг с другом. Они стараются заполнить все доступное пространство.

Молекулы газа слабо связаны между собой, в отличие от молекул жидких и твердых веществ. Большинство его видов невозможно ощутить при помощи органов чувств. Но газы обладают другими характеристиками, например, температурой, давлением, плотностью.
Их плотность увеличивается по мере возрастания давления, а при увеличении температуры они расширяются. Самым легким газом является водородом, тяжелым – гексафторид урана. Газы всегда смешиваются. Если действуют силы тяготения, то смесь становится неоднородной. Легкие поднимаются вверх, тяжелые, наоборот опускаются вниз.
Самые легкие газы – это:
Первые три относятся к нулевой группе таблицы Менделеева, о них и поговорим ниже.
Водород
Какой газ является самым легким? Ответ очевиден – водород. Это первый элемент периодической таблицы, который в 14,4 раза легче воздуха. Он обозначаете буквой Н, от латинского названия Hydrogenium (рождающий воду). Водород является наиболее распространенным элементом во Вселенной. Он входит в состав большинства звезд и межзвездной материи.
В нормальных условиях водород абсолютно безвреден и нетоксичен, не обладает запахом вкусом и цветом. В определенных условиях может значительно изменять свойства. Например, смешиваясь с кислородом, этот газ запросто взрывается.

Может растворяться в платине, железе, титане, никеле и в этаноле. От воздействия больших температур он переходит в металлическое состояние. Его молекула двухатомная и обладает большой скоростью, что обеспечивает отличную теплопроводность газа (в 7 раз выше, чем у воздуха).
На нашей планете водород находится в основном в соединениях. По своей важности и задействованности в химических процессах он является вторым после кислорода. Водород содержится в атмосфере, входит в состав воды и органических веществ в клетках живых организмов.
Кислород
Кислород обозначается буквой О (Oxygenium). Он также не обладает запахом, вкусом и цветом в нормальных условиях, и находится в газообразном состоянии. Его молекулу часто называют дикислород, так как она содержит два атома. Существует его аллотропная форма или же модификация – газ озон (О3), состоящий из трех молекул. Он имеет голубой цвет и отличается многими характеристиками.
Кислород и водород – самые распространенные и самые легкие газы на Земле. В коре нашей планеты больше кислорода, он составляет примерно 47 % её массы. В связанном состоянии в воде его содержится больше 80 %.

Газ является важнейшим элементом жизнедеятельности растений, животных, человека и многих микроорганизмов. В теле человека он способствует осуществлению окислительно-восстановительных реакций, попадая в наши легкие с воздухом.
Благодаря особым свойствам кислорода, его широко используют в медицинских целях. С его помощью устраняют гипоксию, патологии ЖКТ, приступы бронхиальной астмы. В пищевой промышленности его применяют в качестве упаковочного газа. В сельском хозяйстве кислород используют для обогащения воды, при разведении рыбы.
Азот
Как и два предыдущих газа, азот состоит из двух атомов, не обладает выраженными вкусовыми качествами, цветом и запахом. Символ для его обозначения – латинская буква N. Вместе с фосфором и мышьяком он относится к подгруппе пниктогенов. Газ очень инертный, за что и получил название azote, которое переводится с французского как «безжизненный». Латинское название Nitrogenium, то есть «рождающий селитру».
Азот содержится в нуклеиновых кислотах, хлорофилле, гемоглобине и белках, является основной составляющей воздуха. Его содержание в гумусе и земной коре многие ученые объясняют извержением вулканов, которые переносят его с мантии Земли. Во Вселенной газ существует на Нептуне и Уране, входит в состав солнечной атмосферы, межзвездного пространства и некоторых туманностей.

Человек использует азот в основном в жидком виде. Его применяют в криотерапии, в качестве среды для упаковки и хранения продуктов. Он считается наиболее эффективным для тушения пожаров, вытесняет кислород и лишает огонь «потпитки». Вместе с кремнием он образует керамику. Азот нередко используют для синтеза различных соединений, например, красителей, аммиака, взрывчатых веществ.
Заключение
Какой газ самый легкий? Теперь вы и сами знаете ответ. Самыми легкими считаются водород, азот и кислород, относящиеся к нулевой группе периодической системы. После них следуют метан (углерод+водород) и оксид углерода (углерод+кислород).
fb.ru
Самый легкий газ в мире и его характеристики :: SYL.ru
Газ – одно из агрегатных состояний веществ. В таком виде они чаще всего существуют во Вселенной, образуя туманности, звезды и межзвёздное вещество. Без газов не обходится и Земля. Они входят в состав воздуха, присутствуют в живых организмах. А какой газ самый лёгкий? Какими особенностями он обладает? Давайте это выясним.
Самый лёгкий газ
Химический элемент, молекулы которого образуют легчайший газ – это водород. В периодической системе он обозначается символом H и стоит на первом месте. Он уникален по своей природе, ведь может быть опасен, но вместе с тем он крайне необходим любому живому существу.
Водород – самый лёгкий газ, когда два его атома соединяются в молекулу, образуя h3. По легкости он превосходит воздух в 14,5 раз. В смеси с кислородом или воздухом он может взрываться. Но если соединить два его атома с атомом оксигена, то получится обыкновенная вода, в которой мы так нуждаемся. На это указывает и его латинское название Hydrogenium, что можно перевести как «порождающий воду».

Если соединить два атома водорода и два атома кислорода, то выйдет уже другое вещество. Они образуют перекись водорода – бесцветную жидкость, которую используют для обеззараживания ран, отбеливания волос, а также в качестве ракетного топлива.
Состояния и свойства вещества водорода
Самый легкий химический газ при нормальных условиях не обладает цветом, вкусом и запахом. Его плотность на один кубический сантиметр составляет всего 0,0000899 грамма. Температура его кипения - 252,6 °С. В свободном состоянии в природе он встречается именно в виде газа h3.
Водород прекрасно растворяется во многих металлах (в палладие, титане, ниобие, платине, никеле), диффундируя с ними. Он также растворим в этаноле, а вот с серебром не смешивается.
Он обладает высокой теплопроводностью, которая в семь раз выше, чем у воздуха. Жидкий водород лёгкий и тоже бесцветный. При сжижении его объём уменьшается, а вещество приобретает криогенные свойства. В таком виде он опасен для человека – может вызвать обморожение кожи, а его пары вызывают отёк лёгких.
В твёрдом состоянии вещество выглядит как снегоподобная масса белого цвета. Она плавится при температуре −259,2 °C, и обладает практически самой маленькой плотностью среди твёрдых простых веществ - 0,08667 г/см³. При давлении 300 Гпа он переходит в металлическое состояние. Предполагается, что металлический водород есть в ядрах некоторых планет, например Сатурна и Юпитера.

Реакции с водородом
Сам по себе самый лёгкий газ неактивный. Однако при нагревании он способен вступать в реакции с различными веществами, например азотом, кислородом, серой и т. д. Горение водорода сопровождается выделением воды, это в XVIII веке обнаружил ещё химик Лавуазье, который и дал газу его название.
Смешиваясь с кислородом, происходит его окисление. Но при обычной температуре реакция протекает медленно и малозаметна со стороны. Тем не менее, смесь прозвали «гремучей», так как при нагревании она взрывается, сопровождаясь громким хлопком. Чтобы активировать смесь достаточно даже одной искры.

С участием света и тепла реагирует со многими металлами и неметаллами. С хлором образует хлороводород – устойчивый газ с ярко выраженным запахом. Он растворяется в воде и дымится на влажном воздухе. С азотом образует аммиак, с серой – сильно пахнущий сероводород.
При обычных температурах самый лёгкий газ реагирует только фтором и с очень активными, щелочными металлами, например, кальцием. С фтором он очень взрывоопасен, и вступает в реакцию даже при нулевой температуре и в темноте.
С оксидами он отнимает кислород и ведет себя как восстановитель. Так, из CuO на выходе образуется медь и вода, а из WO3 – вольфрам и 3h3O.
Распространение в природе
Водород – самый распространённый элемент во Вселенной, но на Земле он уступает первенство кислороду. В космосе самый лёгкий газ присутствует в межзвёздном веществе, образует туманности, звёзды и ядра планет.
На Солнце и других звездах температура слишком высокая, поэтому водород становится плазмой. С его помощью в них происходят термоядерные реакции, сопровождающиеся выделением огромного количества энергии. Именно сжигание водорода и его превращения позволяют звездам светить и отдавать тепло.
На Земле водород находится преимущественно в связанном виде. В свободном состоянии в сухом воздухе содержится только 0,00005 % этого газа. Он присутствует почти во всех живых клетках. Так, около 64% атомов в организме приходится на водород. Он входит в состав белков, жиров, гормонов и других соединений.
Где его применяют?
Когда-то самый лёгкий газ использовали для поднятия в воздухе воздушных шаров и дирижаблей. Однако это не было безопасным. Если каким-то образом к нему поступал кислород, установка загоралась. Из-за возгорания самого крупного дирижабля «Гинденбурга» в 1937 году погибло 35 человек. После этого опасный газ заменили гелием.

Сейчас из водорода делают хлороводород и соляную кислоту, а также аммиак, необходимый для производства удобрений. С помощью него изготавливают мыло, пластмассы. Соединяя его с CO2, получают синтез-газ, для производства энергии. Пропуская через него жидкие растительные жиры, получают твердые, из которых делают маргарин.
Восстановительные качества водорода помогают получать чистые металлы из их оксидов (медь, вольфрам, молибден и т. д.). При его горении образуются очень высокие температуры (3000-4000 градусов), с их помощью варят тугоплавкие металлы.
Эффективное топливо
Водород обладает высокой теплотой сгорания и не представляет вред для окружающей среды Когда он горит, то в атмосферу выделяются кислород и вода. Он вполне мог бы заменить дорогие нефть и газ, тяжело добываемый уголь, а также остановить выделение вредного углекислого газа, которое неизбежно при их переработке.
Над этим вопросом сейчас и задумываются учёные. Программы по водородной энергетики уже озвучили Исландия, США, Япония, ЮАР, Индия, Южная Корея. В Италии компания Enel уже запустила электростанцию на этом газе, Япония заявила, что откроет свою станцию в 2018 году. Автомобильные компании уже давно представили свои водородные модели.

Возможно, такое топливо могло бы решить некоторые проблемы. Однако оно может породить и новые. Пока неизвестно, как эффективно получать водород, затрачивая минимум средств и не нарушая природный баланс. Поэтому все идеи об использовании самого легкого газа находятся в разработке.
www.syl.ru
Сравнение водородного топлива и природного газа
1. Извините, идея использовать водород как ТОПЛИВО "для промышленных ТЭЦ" - НЕЛЕПА. Просто потому, что НЕ СУЩЕСТВУЕТ месторождений водорода. Откуда вы собираетесь его брать???? Тратить энергию для его получения, а потом сжигать? Зачем?? ? Модная ныне "ВОДОРОДНАЯ ЭНЕРГЕТИКА" предполагает использовать водорода ВОВСЕ НЕ как ТОПЛИВО, а как ЭНЕРГОНОСИТЕЛЬ!! ! Для ЗАПАСАНИЯ энергии. То есть для - резервных источников питания - мобильных применений - для энергетики транпортных систем - на автомобилях, самолётах (ВСУ) , подводных лодках, ж/д вагонах, космических кораблях - для питания удалённых автономных объектов (каких-нибудь автоматических метеостанций и т. п. ) НО использовать водород "для промышленных ТЭЦ" - НЕЛЕПОСТЬ Есть правда исключение - можно использовать тот же газ, конвертируя его в водород, а потом получая из водорода электроэнергию, МИНУЯ тепловой цикл. Это имеет смысл, поскольку для такого типа установок легко получить КПД 50-60% Но это имеет смысл именно для получения ЭЛЕКТРИЧЕСТВА, а когенерация (ТЭЦ, Электричество+тепло) всё-таки проще по традиционной схеме. И в этом случае водород НЕ транспортируется и НЕ хранится... . 2. Собственно ответ на вопрос. Транспортировать проще газ: энергоёмкость природного газа - около 40 МДж/кг, а водорода = 140, однако 1 кг метана - это 1400 нормальных литров, а водорода - 11200, то есть почти в ДЕСЯТЬ раз больше Хранить.. . чёрт его знает. Природный газ можно хранить в баллонах в сжиженном виде, для водорода это невозможно. Зато водород можно хранить в виде гидридов переходных металлов. Это не очень компактно (баллоны получаются небольшими, но очень тяжёлыми) , но зато практически безопасно, взорвать гидридный баллон нельзя.
"Водородное топливо рассматривается в качестве топлива на промышленных ТЭЦ. ". Если найдёте способ реализировать это, Анна, то Вы будете очень богатой! Предлагаю Вам почитать больше о данном вопросе. Кстати, есть некоторая разница между углеродами и водородом.
По технике безопастности газовые магистрали, поредством которых подается чистый водород должны быть окрашены в ЧЕРНЫЙ цвет. Водород отосися к самым взрывопасным веществам. Как говорится, в этом вопросе еще и физики путаются под ногами, но.. . Проблема была и остается а эффекте Джолуля-Томпсона. У водорода он положительный. Это значит, что неконтроллируемый поток газа может привести к нагерву - и взрыву. На водорде будут ездить машины - главное, чтобы у них не срывало капот.
(Сравнение водородного топлива и природного газа) Я думал в энергоэффективности, а жаль ! Это очень насущный сейчас вопрос.. Как сказал "большой искусственный интеллект") - да это верно, по книгам и обще утвержденным положения для населения, эти нормы строго пропускались по цензуре. А цензуру жестко устанавливали правящая элита ! (которая всегда обманывает людей) В обычных стандартных условиях - Для получения 1 м3 газа ННО - нужно затратить около 4 кВт эл. энергии. А теперь подход с утаенной стороны, - разлаживать воду на кислород и водород - можно и импульсным однополярным напряжением, 300-600 вольт, частотой 660 кГц, и выше, при таких частотах - диэлектрический слой воды пробивается, и напряжение не просаживается как при прямоточном напряжении. Только никуда траспортировать ничего не нужно, поставил электролизер и импульный блок питания возле своей печки, и подливаешь только чистую воду, литра 4-5 на сутки работы.. Вода начинает мгновенно разлагаться, при чем затраты на разложение - уменьшаются до 17 раз. Значит и стоить такое топливо для обычных людей - будет стоить в 17 раз дешевле чем обыкновенный природный газ. Хотя у газа - энергоэффективность раза в полтора меньше чем у водородного топлива. <img src="//otvet.imgsmail.ru/download/256251086_3da05ecb60c29d0565486de1b352e14d_120x120.jpg" data-hsrc="//otvet.imgsmail.ru/download/256251086_3da05ecb60c29d0565486de1b352e14d_800.jpg" ><img src="//otvet.imgsmail.ru/download/256251086_58347d198a78c9a8856a6fa24d4c24ae_120x120.jpg" data-hsrc="//otvet.imgsmail.ru/download/256251086_58347d198a78c9a8856a6fa24d4c24ae_800.jpg" ><img src="//otvet.imgsmail.ru/download/256251086_76b0e3fcb554166798c96479401ba017_120x120.jpg" data-hsrc="//otvet.imgsmail.ru/download/256251086_76b0e3fcb554166798c96479401ba017_800.jpg" ><img src="//otvet.imgsmail.ru/download/256251086_2df87a278cf082041b2828f9654a20a3_120x120.jpg" data-hsrc="//otvet.imgsmail.ru/download/256251086_2df87a278cf082041b2828f9654a20a3_800.jpg" ><img src="//otvet.imgsmail.ru/download/256251086_9bd5bccda88d6285e2865c10f2733c97_120x120.jpg" data-hsrc="//otvet.imgsmail.ru/download/256251086_9bd5bccda88d6285e2865c10f2733c97_800.jpg" ><img src="//otvet.imgsmail.ru/download/256251086_26f38c506e815e9c806d999c2a411584_120x120.jpg" data-hsrc="//otvet.imgsmail.ru/download/256251086_26f38c506e815e9c806d999c2a411584_800.jpg" >
touch.otvet.mail.ru
Можно ли отделить водород от кислорода, как это легко сделать?
в смысле разложить воду? Электричеством! В раствор пищевой соды погружаем два электрода из графита или нержавейки, подключаем мощный источник постоянного тока. С минуса пойдет водород, с плюса кислород и углекислый газ. > есть смесь водорода и кислорода в газообразном состоянии как разделить эти два газа? возможно ли это и какой самый простой способ это сделать? сжечь это, и разложить образовавшуюся воду :)) 2 STYLEFLIP Вы ЭТО пробовали на практике, или умных книжек начитались? Вам рассказать что будет если использовать соль (поваренную) и электроды из ЛЮБОГО металла? :) ЗЫ как разделить смесь газов. Через мембрану пропустить, у которой поры больше молекулы h3 и меньше молекулы O2.
Смесь водорода и кислорода в газообразном состоянии это водяной пар Электролиз - электрохимический процесс, при котором раствор (жидкость, электролит и т. д. ) по действием электрического тока распадаются на ионы (разлагается) . В промышленности такой метод применяют для получения металлов и других веществ. Электролиз - энергоёмкий процесс. Нужно затратить немало энергозатрат на получение определенного вещества. Электролиз воды в домашних условиях. Для того чтобы провести электролиз воды домашних условиях, нужно подготовить оборудование. Итак, вам потребуется ёмкость, куда наливать воду, соль (служит для усиления проводящих способностей) , источник питания, два электрода (из любого металла). Порядок работы: в ёмкость наливают воду, к воде на четверть объёма емкости присыпают соль и перемешивают, в емкость опускают электроды, соединенные с источником питания (ток не менее 0.5А) . При включении источника питания происходит вскипание раствора, о чем будут свидетельствовать пузырьки на одном из электродов. Это и будет электролиз воды в процессе. Продуктом электролиза будет водород и кислород. Так что электролиз может быть доступен не только производстве. Поваренная соль- гораздо более сильный электролит чем пищевая сода
Водород отделяется от остальных газов с помощью диффузионных фильтров на основе палладиевой фольги. Ну, а вообще проще будет организовать электролиз воды так, чтоб смесь не образовывалась, и ее не требовалось разделять. Например, разделить объем (и электролит) электролизера проницаемой перегородкой, например, из брезента на анодную и катодную половины. В раздельных половинах газы не будут смешиваться.
Сжать, кислород станет жидким при 180 атмосферах ( или около этого ) , а водород не сжижается . Снизу слил жидкий кислород и ВСЁ .
Наиболее простой способ - центробежная сепарация. Берёте обыкновенную трубу и запускаете в неё смесь по касательной к боковой поверхности. Смесь будет крутиться и разделяться под действием центробежных сил: более тяжёлый кислород отжимается к периферии, более лёгкий водород собирается в центре. И если Вы теперь сделаете два отвода в противоположных торцах - один строго по центру, а другой впритык к боковой поверхности - то из первого пойдёт смесь обогащённая волородом, а из второго пойдт смесь, обогащённая кислородом. Но всё же будет идти смесь, а не чистые газы. Повторной сепарацией и увеличением скорости подачи в камеру можно добиться очень высокй степении разделения газов, но 100%-ная степень таким способом всё равно будет недостижима. Однако, здесь будет наблюдаться побочный процесс: водород будет выходить из камеры очень холодным, а кислород сильно горячим. А если надо добиться именно абсолютного разделения, здесь подойдут только селективные мембраны. Размер молекулы водорода намного меньше размера молекулы кислорода. И если подавать смесь под большим давлением на мембрану, диаметр пор которой превышает размер водородных молекул, но меньше размера кислородных, то просачиваться через неё будет исклчительно водород.
Физически - элементарно. Охладить до сжижения кислорода (примерно -180...-190). Водород при этой температуре останется в газообразном состоянии. Второй вариант - титановые насосы. Отожжёный титан впитывает водород как губка. Химически намного сложнее - учитывая реакционную способность кислорода. Почти всякий процесс с его участием идёт с выделением энергии, так что запросто рванёт. Можно попробовать порошок жёлеза в присутствии воды - оно будет ржаветь, связывая кислород. Но не быстро...
вечный двигатель <a rel="nofollow" href="https://funding2.webmoney.ru/vechnyjj-dvigotel" target="_blank">https://funding2.webmoney.ru/vechnyjj-dvigotel</a>
поваренная соль + вода + постоянный ток (электролиз) и вы надышитесь газ хлором
ебанутые ответы все
touch.otvet.mail.ru
Содержание
В периодической таблице Менделеева есть много химических элементов с самыми разными химическими свойствами. Наиболее легким газом среди них является водород – первый элемент, который в таблице обозначен символом H. Этот газ широко распространен в окружающей среде – какова же его история и что представляют собой свойства водорода? Порождающий водуВодород с латинского языка переводится как «порождающий воду». Этот бесцветный легкий газ может стать горючим и взрывоопасным, если соединить его с кислородом или воздухом. Водород не является токсичным и легко растворяется в этаноле и таких металлах как платина, железо, никель, титан и палладий. Впервые выделение водорода при взаимодействии металлов с кислотами ученые отметили еще в 16-17 веках, когда химия, как наука, только зарождалась.Водород имеет три изотопа с собственными названиями – протий, дейтерий и радиоактивный тритий.В 1766 году водород был исследован английским химиком и физиком Генри Кавендишем, который назвал этот газ горючим воздухом, который при сжигании выделял воду. В 1783 году французским химиком Антуаном Лавуазье и инженером Жаком Менье с помощью специальных газометров был осуществлен синтез воды из водорода. Затем ученые разложили водяной пар на атомы, используя раскаленное железо, в результате чего было выявлено, что «горючий воздух» можно получать из воды, в состав которой он входит.Водород во ВселеннойСамый легкий газ является наиболее распространенным химическим элементом во Вселенной – его доля составляет 88,6% всех атомов. Из водорода состоит основная часть межзвездного газа и самих звезд. В условиях чудовищных космических температур водород может существовать только в виде плазмы, тогда как межзвездное пространство позволяет ему образовывать облака из отдельных атомов, ионов и молекул. Эти молекулярные облака существенно различаются по температуре, размерам и плотности.В земной коре водород является десятым по распространенности элементом – его массовая доля в ней составляет всего 1%.Роль самого легкого газа в природе определяет не масса, а число атомов, доля которых – 17% среди остальных элементов. Водород находится на втором месте после кислорода с его 52% атомов, поэтому значение водорода в химических земных процессах не менее велико, чем значение кислорода. Однако, в отличие от воздуха, дающего жизнь, который существует на планете как в свободном, так и в связанном состоянии, почти весь земной водород представляет собой соединения. В виде простого вещества, входящего в состав атмосферы, он находится лишь в очень малом количестве - 0,00005 %. Также водород есть в составе почти всех органических веществ. Его можно найти во всех живых клетках, где по числу атомов на его долю приходится около 63 %. |
completerepair.ru