Жевнеров Алексей Валерьевич — Доцент
- Главная
- Справочник
- Жевнеров Алексей Валерьевич
Жевнеров Алексей Валерьевич
Доцент
Кафедра: химии
Ученая степень: К.х.н.
Ученое звание: Доцент
(499) 976-16-28
a.zhevnerov@rgau-msha.ru
Биография
Перечень преподаваемых дисциплин: Химия неорганическая; Химия аналитическая; инструментальные методы анализа; химия окружающей среды.
Образование
Высшее образование: окончил 1996, (специалитет), по специальности: разделение изотопов, получение особо чистых веществ/химическая технология материалов современной энергетики, квалификация «инженер химик технолог», РХТУ имени Д.И. Менделеева).
Подготовка научных кадров: 2006, ученая степень по специальности 02.00.01 неорганическая химия и 02.00.02 аналитическая химия.
Трудовая деятельность
Общий стаж работы – 24 года
Стаж работы по специальности – 24 года
Сведения о повышении квалификации и профессиональной переподготовке
- РГАУ МСХА английский язык для преподавания специальных дисциплин 2010, 144 часа,
- РХТУ имени Д.И. Менделеева «Проточно-инжекционный спектрофотометрический и рентгенофлуоресуентный анализ», 2014, 36 часов,
- Центр онлайн-обучения Нетология-групп, наименование программы: «Традиции и новации в преподавании химии», 2018, 72 часа
- РГАУ-МСХА имени К.
 А. Тимирязева, «Обучение навыкам оказания первой помощи пострадавшим при несчастных случаях», 2020 г., 24 часа.
А. Тимирязева, «Обучение навыкам оказания первой помощи пострадавшим при несчастных случаях», 2020 г., 24 часа.
В настоящее время А.В. Жевнеров является участником: Грант Правительства Москвы Некоммерческая организация «Ассоциация московских ВУЗов» 2010, 2011, 2013. Руководитель направления, Грант правительства РФ № 11.G34.31.0079 – ведущий научный сотрудник лаборатории агроэкологического мониторинга. Моделирования и прогнозирования экосистем (начальник отдела химико-аналитических исследований) 2011-н.вр. А.В. Жевнеров участник Проекта ЕС: Tempus 2009, Tempus 530397-TEMPUS -1-2012-1-SK-TEMPUS-SMHES «Развитие обучения в течение всей жизни в области оценки воздействия на окружающую среду и экологического менеджмента в России» (сертификаты университета природных ресурсов BOKU (Вена, Австрия), Университет высшего образования Agrosup Освоение платформы Moodle и программ Xmind, Prezi, Hotpotatoes, active images с последующей интеграцией на платформу Moodle (Дижон, Франция) и Проекта Erasmus Mundus (стажировка в университете природных ресурсов BOKU (Вена, Австрия февраль-май 2011).
Сфера научных интересов: аналитическая химия, экология. Тема научной работы: «Методологические основы и инструментально-методическое обеспечение экологического мониторинга базовых компонентов наземных экосистем c комплексным анализом их экологических сервисов в условиях центрального региона России».
Публикации
Построение и коррекция градуировочной шкалы для визуального полуколичественного экспресс-определения фосфат-ионов в сельскохозяйственных объектах
Князев Д.А., Жевнеров А.В., Иванов В.М., Князев В.Д. Построение и коррекция градуировочной шкалы для визуального полуколичественного экспресс-определения фосфат-ионов в сельскохозяйственных объектах. // Журн. аналит. химии., том 61, № 12, 2006 г.
Блистерно-колориметрическое определение фосфат-ионов в воде, сельско-хозяйственных объектах и биологических жидкостях
Князев Д. А., Жевнеров А.В., Иванов В.М., Князев В.Д. Блистерно-колориметрическое определение фосфат-ионов в воде, сельско-хозяйственных объектах и биологических жидкостях. // Журн. аналит. химии. 2007, том 62, №1, С. 45-49.
А., Жевнеров А.В., Иванов В.М., Князев В.Д. Блистерно-колориметрическое определение фосфат-ионов в воде, сельско-хозяйственных объектах и биологических жидкостях. // Журн. аналит. химии. 2007, том 62, №1, С. 45-49.
Оценка влияния различных видов осадков сточных вод на качество дерно-подзолистых почв легкого гранулометрического состава
Бадарч Б., Васенев И.И, Сюняев Н.К., Жевнеров А.В. Оценка влияния различных видов осадков сточных вод на качество дерно-подзолистых почв легкого гранулометрического состава// Биологийн ХYрээлэн Эрдэм Шинжилгрээний Бутээл (Proceedings of the Insitute of biology). 2011. № 28. C 61-65.
Микроэлементный состав льняного масла
Белопухов С.Л., Дмитревская И.И., Жевнеров А.В., Волков А.Ю. Микроэлементный состав льняного масла // Достижения науки и техники АПК, №7-2012, стр. 54-56
Все публикации
Елисеева Ольга Владимировна — Доцент
Биография
Учебные дисциплины:
Неорганическая химия, химия неорганическая, аналитическая химия, химия аналитическая, физико-химические методы исследования, инструментальные методы анализа, химия окружающей среды и др.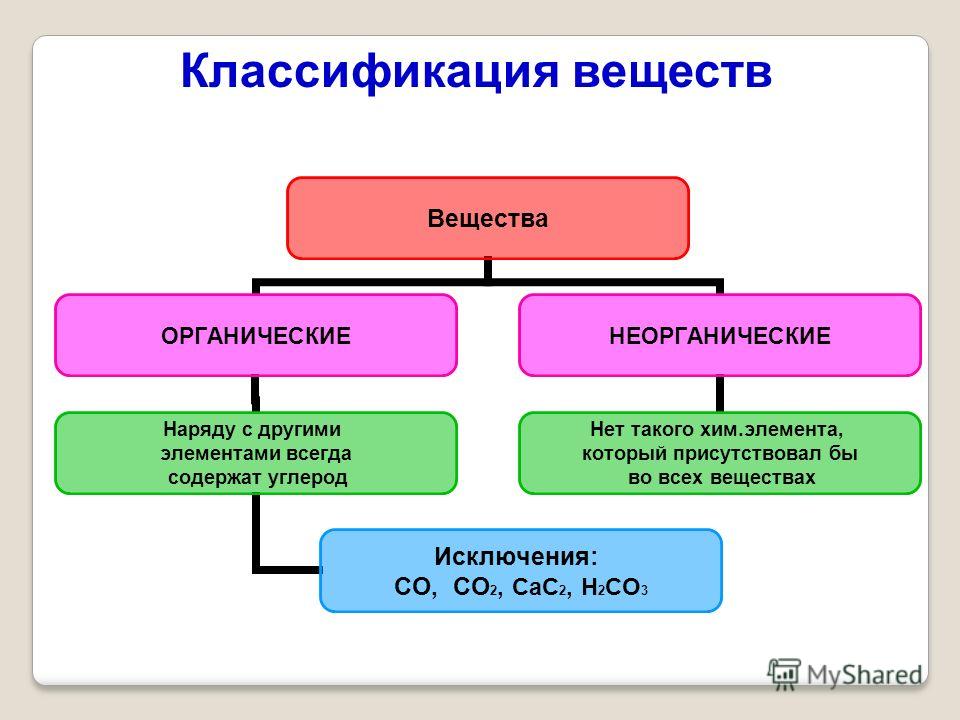
Образование
Образование высшее, 1998 г., специалитет, квалификация: учёный агроном-агрохимик-почвовед по специальности «Агрохимия и агропочвоведение», МСХА им. К.А. Тимирязева.
Ученая степень кандидата биологических наук по специальности 06.01.04 – агрохимия присвоена в 2007 г.
Повышение квалификации:
- Сканирующий электронный микроскоп COXEM EM-30AX PLUS с модулем ЭДС OXFORD и Сушка в критической точке Critical Point Drier K850, 72 ч., Сертификат о повышении квалификации №3/18 от 11.06.2018 г.
- Тренинг и работа на Инфракрасном анализаторе SpectraStar 2600XT-1, 48 ч., Свидетельство рег. №7/19 от 25.04.2019 г.
- Охрана труда, 36 ч., Удостоверение о повышении квалификации № 7718020085512, Рег № 11271 от 19.06.2020 г. ;
- Оказание первой помощи пострадавшим при несчастных случаях, 24 ч., Удостоверение о повышение квалификации № 771802084724, Рег. № 10493 от 28. 02.2020 г. ;
- Электронная информационно-образовательная среда Университета, 72 ч.
 , Удостоверение о повышении квалификации № 77180208515, Рег. № 10780 от 03.04.2020 г.;
, Удостоверение о повышении квалификации № 77180208515, Рег. № 10780 от 03.04.2020 г.; - Физико-химические методы в почвоведении, агрохимии и экологии, 36 ч., Удостоверение о повышении квалификации №7718020863740, Рег.№12124 от 31.07.2020 г.;
- Теория и методика инклюзивного образование в условиях реализации ФГОС, 72 ч., Удостоверение о повышении квалификации № 180002360504, Рег№ ППК 3496-27 от 22.07.2020 г.
Биография и трудовая деятельность:
Родилась в г. Москва.
В 1992 г. пришла работать в МСХА им. К.А. Тимирязева лаборантом на кафедру микробиологии.
С мая 1993 по февраль 1994 г. секретарь АОЗТ «Прогресстех Лтд.».
С ноября 1993 по февраль 1994 г. – лаборант кафедры неорганической и аналитической химии МСХА им. К.А. Тимирязева.
С 1993 по 1998 г. студентка факультета почвоведения, агрохимии и экологии.
С июля 1994 по июль 1996 г. – лаборант кафедры микробиологии МСХА им. К.А. Тимирязева.
С сентября 1996 по май 1998 г. – старший лаборант кафедры микробиологии МСХА им. К.А. Тимирязева.
– старший лаборант кафедры микробиологии МСХА им. К.А. Тимирязева.
С сентября 1998 по март 2002 г. – сначала учебный мастер, затем старший лаборант кафедры овощеводства МСХА им. К.А. Тимирязева.
С апреля 2002 по август 2004 г. – заведующая лабораторией кафедры неорганической и аналитической химии МСХА им. К.А. Тимирязева. Одновременно совмещала должность ассистента кафедры (0,5 ст.).
С сентября 2004 по сентябрь 2007 г. – ассистент кафедры неорганической и аналитической химии МСХА им. К.А. Тимирязева (РГАУ-МСХА имени К.А. Тимирязева).
С октября 2007 по август 2012 г. – старший преподаватель кафедры неорганической и аналитической химии РГАУ-МСХА имени К.А. Тимирязева.
С сентября 2012 г. по настоящее время – доцент кафедры неорганической и аналитической химии (с 2016 г. кафедры химии) РГАУ-МСХА имени К.А. Тимирязева.
Общий стаж работы 28 лет
Стаж работы преподавателем 18 лет
Область научных интересов:
Биологические особенности формирования урожая сельскохозяйственных культур семейства Brassicáceae и зеленных культур других семейств. Микроэлементный состав овощных культур семейства Brassicáceae и зеленных культур других семейств. Влияние различных агротехнических приемов на формирование урожая и качество продукции овощных культур семейства Brassicáceae и зеленных культур других семейств.
Микроэлементный состав овощных культур семейства Brassicáceae и зеленных культур других семейств. Влияние различных агротехнических приемов на формирование урожая и качество продукции овощных культур семейства Brassicáceae и зеленных культур других семейств.
Публикационная активность: индекс Хирша 3
Награды и премии:
- Почетная грамота ректора РГАУ-МСХА имени К.А. Тимирязева.
- Диплом III степени, как автору учебного пособия «Подкормка растений диоксидом углерода в защищенном грунте» в номинации «Агрохимия и агропочвоведение» VII Всероссийского конкурса «Аграрная учебная книга».
- Почетная грамота за III место по стрельбе в VIII Спартакиаде «Здоровье» среди профессорско-преподавательского состава и сотрудников РГАУ-МСХА имени К.А. Тимирязева.
Публикации
Действие биологически активных веществ на прорастание семян редьки сорта Зимняя круглая чёрная
Елисеева О. В., Елисеев А.Ф. Действие биологически активных веществ на прорастание семян редьки сорта Зимняя круглая чёрная // Доклады ТСХА. Сборник статей. Вып. 283.Часть 1. М.: Издательство РГАУ-МСХА имени К.А. Тимирязева, 2011. С. 449-452.
В., Елисеев А.Ф. Действие биологически активных веществ на прорастание семян редьки сорта Зимняя круглая чёрная // Доклады ТСХА. Сборник статей. Вып. 283.Часть 1. М.: Издательство РГАУ-МСХА имени К.А. Тимирязева, 2011. С. 449-452.
Некорневая обработка растений редьки (Raphanus sativus) хромокалиевыми квасцами как способ получения обогащённой хромом продукции
Елисеева О.В., Елисеев А.Ф. Некорневая обработка растений редьки (Raphanus sativus) хромокалиевыми квасцами как способ получения обогащённой хромом продукции // Бутлеровские сообщения. 2012. Т. 30. № 4. С. 153-156.
Инструментальные методы анализа: Лабораторный практикум
Князев Д.А., Смарыгин С.Н., Елисеева О.В. и др. Инструментальные методы анализа: Лабораторный практикум. М.: Издательство РГАУ-МСХА имени К.А. Тимирязева, 2012. — 127 с.
«Неорганическая химия»: рабочая тетрадь
Смарыгин С.Н., Елисеева О.В. «Неорганическая химия»: рабочая тетрадь. М.: Издательство РГАУ-МСХА, 2013. — 53 с.
М.: Издательство РГАУ-МСХА, 2013. — 53 с.
Все публикации
Неорганическая химия (Факультет физико-математических и естественных наук, аспирантура, очная)
О профессии
Область профессиональной деятельности выпускников, освоивших программу аспирантуры по направлению «Химические науки», включает решение комплексных профессиональных задач в сфере наукоемких технологий и химического образования, охватывающих совокупность направлений теоретической и прикладной химии, а также смежных естественнонаучных дисциплин.
Основными задачами программы являются:
— формирование навыков самостоятельной научно-исследовательской и педагогической деятельности;
— углубленное изучение теоретических и методологических основ химических наук;
— совершенствование философского образования, в том числе ориентированного на профессиональную деятельность;
— совершенствование знаний иностранного языка, в том числе для использования в профессиональной деятельности;
— выполнение итогового оригинального научного исследования, вносящего вклад в создание, расширение и развитие научного знания.
Выпускники аспирантуры могут заниматься научно-исследовательской деятельностью как в области химии, так и в смежных областях (биохимии, геохимии, нефтехимии, экологии, фармацевтике), преподавательской деятельностью в системе высшего образования, а также планированием и организацией работы структурных подразделений для решения конкретных технологических задач химической направленности.
Учебный процесс
Программа аспирантуры по направлению «Химические науки» на факультете физико-математических и естественных наук РУДН направлена на подготовку научных и научно-педагогических кадров высшей квалификации, способных к инновационной деятельности в соответствующей области химии и в смежных областях науки и высшего образования.
Программа аспирантуры состоит из нескольких блоков.
Блок 1. «Дисциплины»:
Базовая часть:
«Английский язык»;
«Философия».
Вариативная часть:
«Методология научных исследований»;
«Приоритетные направления развития химии»;
«Методика преподавания химии в высшей школе».
Дисциплины по выбору:
«Химия координационных соединений»;
«Химия твердого тела»;
«Супрамолекулярная химия каркасных соединений»;
«Применение синхротронного излучения в исследовании неорганических материалов».
Блок 2. «Практики»:
— научно-исследовательская практика;
— педагогическая практика.
Блок 3. «Научные исследования».
Блок 4. «Государственная аттестация»:
— подготовка и сдача государственного экзамена;
— подготовка и презентация научного доклада.
Практические занятия и научные исследования проводятся в учебных и исследовательских лабораториях, оснащенных современным приборным и аналитическим оборудованием.
Направления исследований:
— новые типы функционально-замещенных соединений элементов 14 и 16 групп в необычном валентном состоянии и координационном окружении;
— структурно замещённые сложно оксидные керамики, обладающие специфическими электрофизическими свойствами;
— координационные соединения редких платиновых металлов с азот- и серосодержащими лигандами;
— металлоксидные и металлнитридные кластеры как основа для создания материалов нового типа с регулируемыми магнитными, люминесцентными, светочувствительными и каталитическими свойствами;
— синтез, исследование строения и свойств молекулярных кластеров и супрамолекулярных композиций на основе комплексов, содержащих щелочные и переходные металлы.
Обучение по программе аспирантуры завершается подготовкой и защитой диссертации на соискание ученой степени кандидата химических наук.
Практика
Педагогическая и научно-исследовательская практики, научные исследования – реальные возможности для аспирантов попробовать себя в качестве преподавателей и химиков-исследователей. Предусмотренные учебным планом практики проводятся на базе научных лабораторий кафедры неорганической химии факультета физико-математических и естественных наук, центра коллективного пользования «Физико-химические исследования новых материалов, веществ и каталитических систем», центров Объединенного института химических исследований.
В рамках освоения программы аспиранты активно участвуют в работах по научным грантам. Широко используется сотрудничество с ведущими вузами России в плане совместных научно-исследовательских проектов. Имеется возможность международного сотрудничества и обучения за рубежом. Кафедра неорганической химии активно сотрудничает с лабораториями Института элементоорганических соединений РАН, Института нефтехимического синтеза им. А.В. Топчиева РАН, Института металлургии и материаловедения им. А.А. Байкова РАН, НИЦ «Курчатовский институт», НИФХИ им. Л.Я. Карпова, Университетом Нью-Мексико (США).
А.В. Топчиева РАН, Института металлургии и материаловедения им. А.А. Байкова РАН, НИЦ «Курчатовский институт», НИФХИ им. Л.Я. Карпова, Университетом Нью-Мексико (США).
Карьера
Выпускники программы продолжают свою карьеру в зарубежных университетах и институтах Российской академии наук; лабораториях научных центров, ведущих исследования в области химии, биохимии, геохимии, нефтехимии, экологии, фармацевтики; в исследовательских и аналитических лабораториях различных производств; учреждениях системы высшего профессионального образования.
Университет Глазго создаст «неорганическую» жизнь
Источник новостей
- BBC: «Университет Глазго намерен создать «неорганическую жизнь»»
Неорганическая жизнь? Является ли это возможным? Это то, что пытается создать профессор Университета Глазго Ли Кронин. Вся жизнь, какой мы ее знаем, основана на углероде, элементе удивительной универсальности. Но могла ли жизнь существовать с другим типом химии — химией, не основанной на углероде?
Усилия Кронина включают получение «полиоксометаллатов» в растворе для самосборки в сферы, которые он называет iCHELLS. Он смог заставить их самовоспроизводиться, используя друг друга в качестве шаблонов. Теперь он пытается заставить их реагировать на изменения окружающей среды по принципу выживания наиболее приспособленных. Он говорит: «Я думаю, мы только что показали первые капельки, которые могут эволюционировать».0009
Он смог заставить их самовоспроизводиться, используя друг друга в качестве шаблонов. Теперь он пытается заставить их реагировать на изменения окружающей среды по принципу выживания наиболее приспособленных. Он говорит: «Я думаю, мы только что показали первые капельки, которые могут эволюционировать».0009
Реклама вокруг целей профессора Кронина фокусируется на эволюционных последствиях его исследований.
Реклама вокруг целей профессора Кронина фокусируется на эволюционных последствиях его исследований. Как мы определяем жизни ? Откровенно говоря, ни креационисты, ни эволюционисты не могут дать хорошего определения жизни , а вместо этого описывают ее атрибуты. Профессор Кронин говорит: «Мы пытаемся создать самовоспроизводящиеся, эволюционирующие, неорганические клетки, которые, по сути, были бы живыми. Вы могли бы назвать это неорганической биологией». Эти клетки будут разделены на отсеки, связанные мембраной, чтобы обеспечить контролируемое взаимодействие различных химических реакций внутри клетки, «точно так же, как в биологических клетках».
Таким образом, мы видим, что основными атрибутами, которые Кронин хочет, чтобы его новые формы жизни обладали, являются способности к воспроизведению и развитию. Определение самовоспроизводящегося довольно очевидно. Но как Кронин определяет, что эволюционирует в ? Некоторые люди настаивают на том, что всякая адаптация и изменение внутри какого-либо организма — это эволюция. Они обычно утверждают, что такие наблюдаемые явления демонстрируют, что накопление мутаций также приведет к возникновению новых видов организмов. Дополнительный аспект ненаблюдаемого эволюция — это представление от молекулы к человеку, что жизнь может спонтанно возникнуть в результате случайного взаимодействия неживых компонентов. Замечания Кронина предполагают, что он выбрал бы оба последних определения.
Объясняя свою основную цель, Кронин говорит: «Главная цель состоит в том, чтобы сконструировать сложные химические клетки с жизнеподобными свойствами, которые могли бы помочь нам понять, как возникла жизнь, а также использовать этот подход для определения новой технологии, основанной на эволюции материала. мир — своего рода неорганическая живая техника. . . . Бактерии — это, по сути, одноклеточные микроорганизмы, состоящие из органических химических веществ, так почему же мы не можем создать микроорганизмы из неорганических химических веществ и позволить им развиваться?»
мир — своего рода неорганическая живая техника. . . . Бактерии — это, по сути, одноклеточные микроорганизмы, состоящие из органических химических веществ, так почему же мы не можем создать микроорганизмы из неорганических химических веществ и позволить им развиваться?»
«В случае успеха, — добавляет он, — это даст нам невероятное представление об эволюции и покажет, что это не просто биологический процесс. Это также означало бы, что мы доказали бы, что жизнь, не основанная на углероде, может существовать, и полностью изменили бы наши представления о дизайне».
Что ж, проект Кронина уже не подходит для демонстрации превращения молекулы в человека, поскольку в лучшем случае он начинался как разумный замысел. «Создание» и «конструирование» крошечных самоподдерживающихся, самовоспроизводящихся многокамерных плавучих батарей может «улучшить наши идеи дизайна», но ничего не продемонстрирует «как возникла жизнь» посредством случайных ненаправленных молекулярных взаимодействий.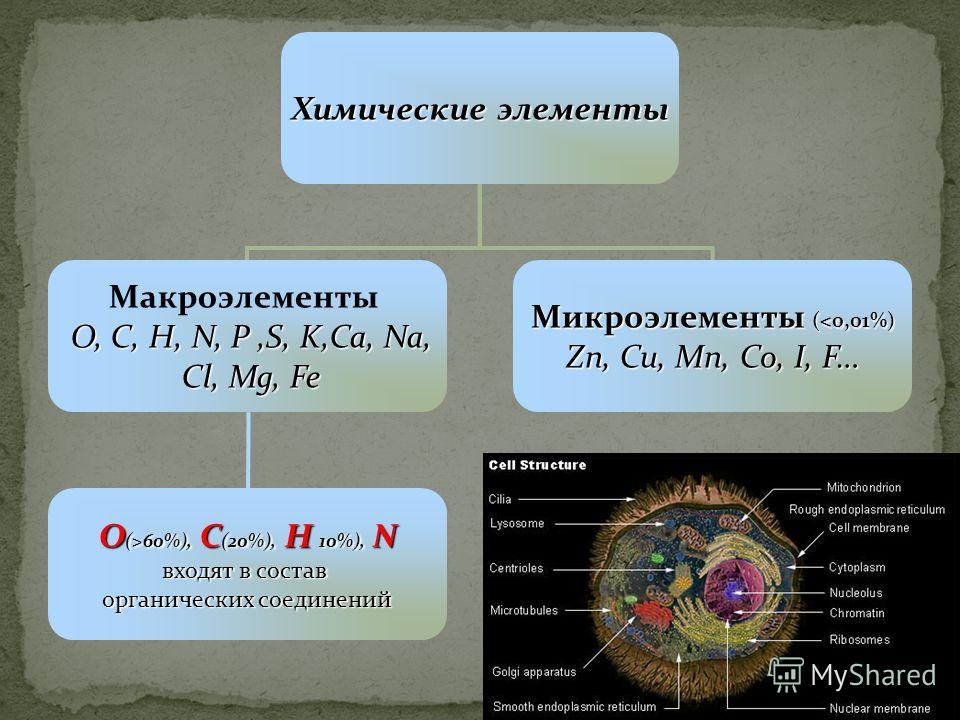 .
.
Что касается разработки «новой технологии, основанной на эволюции в материальном мире», мы опасаемся, что рынок для ее приложений будет ограниченным, по крайней мере, ненадолго.
Что касается разработки «новой технологии, основанной на эволюции в материальном мире», мы опасаемся, что рынок для ее приложений будет ограниченным, по крайней мере, ненадолго. Если бы эта новая технология была своего рода биомимикрией, основанной на истинно эволюционных принципах, то ошибки и дефекты никогда не должны были бы исправляться, а должны были бы продолжать работать до тех пор, пока они не самоуничтожатся.
Ожидает ли Кронин, что его неорганические клетки будут независимо получать информацию, чтобы стать клетками совершенно нового типа — и сделать это, совершив целую кучу ошибок? В биологии эти ошибки в репликации называются мутациями , и согласно эволюционным принципам, благоприятные мутации могут накапливаться до тех пор, пока не произведут совершенно новый вид организма. Однако в инженерном мире дефекты считаются изъянами, а не ступеньками на совершенно новый уровень существования.
Однако в инженерном мире дефекты считаются изъянами, а не ступеньками на совершенно новый уровень существования.
Когда дефект приводит к полезному открытию, он делает это, теряя информацию и не функционируя должным образом. Возьмем, к примеру, знаменитое счастливое открытие стикеров. Недостаточное прилипание имеет свои преимущества для определенных применений, но не в большинстве случаев, когда необходима адгезия. Инженер не останется без работы, если он просто оставит машину без обслуживания, надеясь, что она в конечном итоге накопит достаточно ошибок, чтобы стать новым типом улучшенной машины.
Крошечные машины, которые могут поддерживать и клонировать себя, могли бы иметь интригующее применение, но предполагать, что этот проект даст нам представление о том, как развивалась жизнь, — нонсенс.
Предыдущая статья
Соответствующий след найден под протоцератопсом
Следующая статья
Прыгающая рыба считается успешным переходным существом
Интеллектуальные неорганические полимеры: синтез, свойства и новые применения в материаловедении и науках о жизни
Предисловие xi
1 Текущее состояние и перспективы использования функциональных и интеллектуальных материалов в повседневной жизни 1
Rudolf Pietschnig
8 9. 1 Введение 1
1 Введение 1
1.2 Свойства и применение 1
1.2.1 Применение на основе механических и реологических свойств 1
1.2.2 Применение на основе электронного возбуждения 2
1.2.3 Заявки, основанные на оптических характеристиках 6
1.2.4 Заявки, основанные на супрамолекулярном распознавании 9
1.2.5 Заявки, основанные на химической активности 10
1.2.6 Дополнительные применения 12 30
1.3 Перспектива
Ссылки 13
2 Борсодержащие полимеры 17
2.1Группа 13–Группа 15 Связи элементов, заменяющие углерод-углеродные связи в основной группе Аналоги полиолефинов 19
Anne Staubitz, Jonas Hoffmann, and Philipp Gliese
2.1.1 Введение 19
2.1.2 Группа 13–Группа 15 Элементосодержащие аналоги полиолефинов с гетероатомами в основной цепи 20
2.1.2.1 Поли(фосфан) 20
2.1.2.1.1 Металлокомплексы как катализаторы дегидросочетания фосфин–бораны 21
2.1.2.1.2 Дегидросочетание фосфина–борана, промотируемое кислотой Льюиса Боранес 24
2. 1.2.1.4 Материалы на основе поли(фосфиноборана) 25
1.2.1.4 Материалы на основе поли(фосфиноборана) 25
2.1.2.1.5 Возможное применение поли(фосфиноборана) 25
2.1.2.2 Поли(аминоборана) 27
Группа 5–группа 5
1.3 Элементсодержащие аналоги полиолефинов с гетероатомами в боковой цепи 32
2.1.3.1 Боразинсодержащие аналоги полистирола 32
2.1.3.2 Азаборининсодержащие аналоги полиолефинов 33
2.1.4 Заключение и прогноз 39 60009
Благодарности Ссылки 36
2.2 Выявление связывающего поведения икосаэдрических кластеров бора, включенных в полимеры: синтоны, получение полимеров и соответствующие свойства 41
Clara Viñas, Rosario Núñez, Isabel Romero, and Francesc Teixidor 2
4.2.2.1. 2 Проводящие органические полимеры, содержащие икосаэдрические кластеры бора 42
2.2.2.1 Икосаэдрические кластеры бора как легирующие агенты в COP 43
2.2.2.2 Икосаэдрические кластеры бора в боковых цепях COP для модификации химического состава и действия в качестве легирующего агента 44
2. 2.2.3 Икосаэдрические кластеры бора, включенные в основную цепь полимера КС 45
2.2.3 Икосаэдрические кластеры бора, включенные в основную цепь полимера КС 45
2.2.3 Флуоресцентные карборансодержащие полимеры 46
2.2.4 Термостойкие полимеры на основе карборанов 2 Включение Closo -карборан-кластеров 50
2.2.5.1. Карбоксилат-функционализированные карборан 50
2.2.5.2. Фосфинатные и фосфино-функционализированные карбораны 51
2.2.5.3 Наногибридные материалы, основанные на функциональных карборан 51
2.2.5.3.0009
2.2.6 Conclusion and Outlook 55
Acknowledgments 55
References 55
3 Synthesis of Group 14 Metal-Containing Polymers 61
Ana Torvisco, Frank Uhlig, and David Scheschkewitz
3.1 Introduction 61
3.2 Органогидриды группы 14, RnEH 4-n 62
3.3 Диорганодигидриды группы 14, R2EH 2 , в качестве строительных блоков для полимеров цепного типа 65
3.3.1 Металлокатализируемая дегидрополимеризация0009
3. 3.2 Дегидрирование с использованием аминовой основы 65
3.2 Дегидрирование с использованием аминовой основы 65
3.3.3 Дегидрирование без растворителей и катализаторов 67
3.3.4 Конденсация 68
3.4 Моноорганотригидриды группы 14, as05s 7 05 9, REH 3 Трехмерные полимеры 68
3.4.1 Дегидрополимеризация, катализируемая металлами 68
3.4.2 Дегидрирование с использованием аминовой основы 69
3.5 Применение 72
3.6 Заключение и перспективы 7 9 9
Список литературы 75
4 Синтез полимеров, содержащих группу 15 Элементы 85
Андреас Ортабер и Алехандро П. Сото
4.1 Введение 85
4.2 Конкурированные полимеры Содержание 1569
4.2. СОПРЕДАНИЕ ПОЛИМЕРЫ. , и дифосфены 86
4.2.2 Гетеролы на основе группы 15 89
4.3 Полимеры с двумя ненасыщенными органическими фрагментами, соседними с мотивом гетероэлемента 93
4.3.1 Кросс-сопряженная группа 153
4.3.2 Группа 15 Элементы с двумя соседними алкиновыми, алкеновыми или ареновыми мотивами полимерной цепи 94
4. 3.2.1 Полимеризация с раскрытием цикла 95
3.2.1 Полимеризация с раскрытием цикла 95
4.4 Органо-неорганические гибридные полимеры, содержащие насыщенные фосфорные центры 90 8 40 90 96 .1 Прочие полимеры 97
4.5 Полифосфазен 97
4.6 Полифосфоэфиры 104
4.7 Заключение и перспективы 107
Благодарности 107
9 Ссылки 0 107
0063 5 Синтез неорганических дендримеров 115
Anne-Marie Caminade
5.1 Введение 115
5.2 Основные методы синтеза синтеза синтеза Dendrimers 110009
5.2.1.1 Dendrimers 110009
5.2.1. Другие типы кремнийсодержащих дендримеров 118
5.3 Основные методы синтеза фосфорсодержащих дендримеров 120
5.3.1 Синтез фосфоргидразоновых дендримеров 120
5.3.2 Синтез других типов фосфорсодержащих дендримеров 121
5.4 Синтез различных типов неорганических дендримеров 129
5.4.1 Синтез дендримеров, содержащих элементы основной группы, кроме Si и P 129
900 Дендримеры, содержащие не менее двух типов элементов основной группы 132
5. 5.0064 Jirí Vohlídal and Muriel Hissler
5.0064 Jirí Vohlídal and Muriel Hissler
6.1 Введение 141
6.2 Конституционные динамические полимеры: динамики 142
6.3 Основные типы металло-субпрозлоловых полимеров (MSPS) и терминологии, связанные с тем, что связаны с 143
999999999999999999
9999999999999999999999
9999999999999
999999999999999999999999999999999999989999999899999999998989989989898989.SPURELCULE (MSPS). с определенной структурой 144
6.4.1 Синтез унимеров 144
6.4.2 Центральные блоки сопряженных унимеров 146
6.4.3 Сборка и характеристика СМЧ-динамеров 148
6.4.4 Свойства сопряженных МСП 151
6.5 Возможности применения и перспективы 155
6.5.1 Электрохромные устройства на основе модификации абсорбционных свойств 155
6.5.2 Электрохромные устройства на основе модификации эмиссионных свойств156
6.5.3 Ионная проводимость 157
6.5.4 Приводы 157
6.5.5 Образцы 157
Благодарности 158
СПИСОК 158
7 Применение Олигомеров и полимерных на основе Heteroatom. 0064 Matthew P. Duffy, Pierre-Antoine Bouit и Muriel Hissler
0064 Matthew P. Duffy, Pierre-Antoine Bouit и Muriel Hissler
7.1 Введение 163
7.2 Органические светоизлучающие диоды (OLED) 164
090 2 2 Применение в качестве основы для фосфоресцирующих комплексов 169
7.2.3 Применение в качестве излучающих материалов 171
7.3 Фотоэлектрические элементы (органические солнечные элементы [OSC] и чувствительные к красителю солнечные элементы [DSSC]) 181
7.3.1 Красители для красителей Сенсибилизированные солнечные элементы (DSSC) 183
7.3.2 Доноры в органических солнечных батареях (OSCS) 184
7.4 Применение в электрохромных клетках 188
7,5 Заключение 189
Благодарности 189
Сократите 190
Список 197
Raghvendra KumarMishra, Tarik Eren, and De-YiWang
8.1 Введение 197
8.2 Важность огнезащитных материалов 198
0009
8.3.1 Polysiloxanes 201
8.3.2 Полифосфазен 210
8.3.3 Полисилан и полисилинес 220
8. 3.4 Полимеры на основе ферроцена 222
3.4 Полимеры на основе ферроцена 222
8.3.5, сдерживающие карборан. Карборнилэзилоксан) 226
8.3.5.2.2, содержащие Карборан, высокоэффективные термопластики 229
8.3.5.3. Карборан.0009
9 неорганические полимеры для потенциальных лекарственных применений 243
Андрея Валенте, Рафаэлла Л. М. Пракеер и Эвамария Хей-Хокинс
9,1 Введение 243
9.2 Инорганические полимеры и металлические полимеры и металлические полимеры.
9.2.1 Неорганические полимеры 243
9.2.1.1 Полисилоксаны 244
9.2.1.2 Полифосфазены 247
9.2.2 Металлосодержащие полимеры 250
9.2.2.1 Платиновые-Полимерные конъюгаты 251
9.2.2.2 Рутениум-Полимер-конъюгаты 251
9.2.2.3 Конъюгаты карбона-полимер 254
9,3 Новые и потенциальные применения для металлических рамков для доставки лекарств 255
9.3.1.13.1. Металлоорганические каркасы (MOF) 257
9.3.2 Применение MOF в системах доставки лекарств 257
9. 3.2.1 Отдельные примеры MIL-n каркасов в доставке лекарств 258
3.2.1 Отдельные примеры MIL-n каркасов в доставке лекарств 258
9.3.2.2 Другие выбранные металлоорганические каркасы, используемые в Доставка лекарств 262
9.3.3 Токсичность и стабильность 263
9.3.3.1 Токсичность 263
9.3.3.2 Стабильность 265
9.3.4 Биодеградация 265
9.4. Неорганические дендримеры и их применение 277
Anne-Marie Caminade
10.1 Введение 277
10.2 Неорганические дендримеры в качестве катализаторов0009
10.2.2 Эффект дендримера, проиллюстрированный с каталитическими неорганическими дендримерами 280
10.2.3. Восстановление и повторное использование каталитических неорганических дендримеров 283
10.3. неорганических дендримеров 288
10.3.2 Гибридные материалы, содержащие неорганические дендримеры 291
10.3.3 Модификация поверхности материалов неорганическими дендримерами для биологического использования 293
10,4 неорганические дендримеры в биологии/наномедицине 296
10. 4.1 Неорганические дендримеры для биоизображения 296
4.1 Неорганические дендримеры для биоизображения 296
10.4.2 Неорганические дендримеры для генной терапии 298
10.4.3 Dorganic Dendrimers против Viruses 29999999999.4.4.4.4. 10.4.3. Заболевания головного мозга 301
10.4.5 Неорганические дендримеры против рака 301
10.4.6 Неорганические дендримеры против воспалительных заболеваний 302
10.5 Заключение и перспективы 304
Благодарности 304
Список литературы 305
11 Другие примеры неорганических полимеров в качестве функциональных материалов 317
Ireneweymuth и Walter Caseri
11.1 Введение 317
11.1.11111.4-Triaole in.
11.1.2 Спин-кроссовер 319
11.2 Координационные полимеры 4-аминотриазола и железа(II) 322
11.2.1 Растворы 322
II) 327
11.4 Координационные полимеры 1,2,4 -триазолов и других металлов 330
11,5 Заключение и перспективы 332
Благодарности 333
Ссылки 333
Индекс 337
Глава 4 -inorganic Compunds Essentive To Human Fetecting — Bio 1409
Глава 4 -Inorganic Assireds для человека. — Биология человека I — Учебник
— Биология человека I — Учебник
Глава 4
Неорганические соединения, необходимые для жизнедеятельности человека
OpenStax, Неорганические соединения, необходимые для жизнедеятельности человека. OpenStax CNX. 25 февраля 2016 г. http://cnx.org/contents/e4e45509-bfc0-4aee-b73e-17b7582bf7e1@4. © 25 февраля 2016 г. OpenStax. Контент учебников, созданный OpenStax, находится под лицензией Creative Commons Attribution License 4.0.
Цели обучения
- Сравнение неорганических и органических соединений
- Определите свойства воды, которые делают ее необходимой для жизни
- Объясните роль солей в функционировании организма
- Различать кислоты и основания и объяснять их роль в рН
- Обсудите роль буферов в поддержании организмом гомеостаза pH
Понятия, которые вы уже изучили в этой главе, управляют всеми формами материи и могут служить основой как для геологии, так и для биологии. Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения являются либо неорганическими, либо органическими.
Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения являются либо неорганическими, либо органическими.
- Ан неорганическое соединение – это вещество, которое не содержит ни углерода, ни водорода. Многие неорганические соединения содержат атомы водорода, например, вода (H 2 O) и соляная кислота (HCl), вырабатываемая желудком. Напротив, только несколько неорганических соединений содержат атомы углерода. Углекислый газ (CO 2 ) является одним из немногих примеров.
- Таким образом, органическое соединение представляет собой вещество, содержащее как углерод, так и водород. Органические соединения синтезируются посредством ковалентных связей в живых организмах, в том числе в организме человека. Вспомните, что углерод и водород являются вторым и третьим по распространенности элементами в вашем теле. Вскоре вы обнаружите, как эти два элемента сочетаются в пище, которую вы едите, в соединениях, из которых состоит структура вашего тела, и в химических веществах, питающих ваше функционирование.

В следующем разделе рассматриваются три группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе.
Вода
До 70 процентов массы тела взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько ее функций делают воду незаменимой для жизнедеятельности человека.
Вода в качестве смазки и прокладки
Вода является основным компонентом многих смазочных жидкостей организма. Подобно тому, как масло смазывает дверные петли, вода в синовиальной жидкости смазывает движения суставов тела, а вода в плевральной жидкости помогает легким расширяться и сжиматься при дыхании. Водянистые жидкости способствуют прохождению пищи по пищеварительному тракту и обеспечивают движение соседних органов брюшной полости без трения.
Вода также защищает клетки и органы от физических травм, например, амортизирует мозг внутри черепа и защищает нежную нервную ткань глаз. Вода смягчает развивающийся плод и в утробе матери.
Вода смягчает развивающийся плод и в утробе матери.
Вода как поглотитель тепла
Поглотитель тепла — это вещество или объект, который поглощает и рассеивает тепло, но не подвергается соответствующему повышению температуры. В организме вода поглощает тепло, выделяемое химическими реакциями, без значительного повышения температуры. Более того, когда температура окружающей среды резко возрастает, вода, хранящаяся в организме, помогает охлаждать тело. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам прямо под кожей и переносится в окружающую среду. В то же время потовые железы выделяют теплую воду вместе с потом. Когда вода испаряется в воздух, она уносит тепло, а затем более холодная кровь с периферии циркулирует обратно к ядру тела.
Вода как компонент жидких смесей
Смесь представляет собой комбинацию двух или более веществ, каждое из которых сохраняет свою химическую идентичность. Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если подумать о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их вместе в миске, они, очевидно, не связываются, образуя новое соединение. Комнатный воздух, которым вы дышите, представляет собой смесь газов, состоящую из трех отдельных элементов — азота, кислорода и аргона — и одного соединения — двуокиси углерода. Существует три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента. Это растворы, коллоиды и суспензии.
Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если подумать о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их вместе в миске, они, очевидно, не связываются, образуя новое соединение. Комнатный воздух, которым вы дышите, представляет собой смесь газов, состоящую из трех отдельных элементов — азота, кислорода и аргона — и одного соединения — двуокиси углерода. Существует три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента. Это растворы, коллоиды и суспензии.
Чтобы клетки тела выжили, их необходимо поддерживать во влажном состоянии в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, растворяющего вещество, называемое растворенным веществом. Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределены по всему раствору. Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Отношение сахара к воде в левой части стакана будет таким же, как отношение сахара к воде в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара и воды изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Отношение сахара к воде в левой части стакана будет таким же, как отношение сахара к воде в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара и воды изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Вода считается «универсальным растворителем», и считается, что жизнь не может существовать без воды из-за этого. Вода, безусловно, самый распространенный растворитель в организме; практически все химические реакции в организме происходят между соединениями, растворенными в воде. Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называются гидрофильными или «водолюбивыми». Как было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным. Неполярные молекулы, плохо растворяющиеся в воде, называются гидрофобными или «водобоязненными».
Концентрации растворенных веществ
Различные смеси растворенных веществ и воды описаны в химии. Концентрация данного растворенного вещества — это количество частиц этого растворенного вещества в данном пространстве (кислород составляет около 21 процента атмосферного воздуха). В кровотоке человека концентрация глюкозы обычно измеряется в миллиграммах (мг) на децилитр (дл), а у здорового взрослого человека она составляет в среднем около 100 мг/дл. Другой метод измерения концентрации растворенного вещества — его молярность, то есть количество молей (М) молекул на литр (л). Моль элемента — это его атомный вес, а моль соединения — это сумма атомных весов его компонентов, называемая молекулярной массой. Часто используемый пример — расчет моля глюкозы с химической формулой C 6 Н 12 О 6 . Используя периодическую таблицу, атомный вес углерода (С) составляет 12,011 грамма (г), а в глюкозе шесть атомов углерода, что дает общий атомный вес 72,066 г.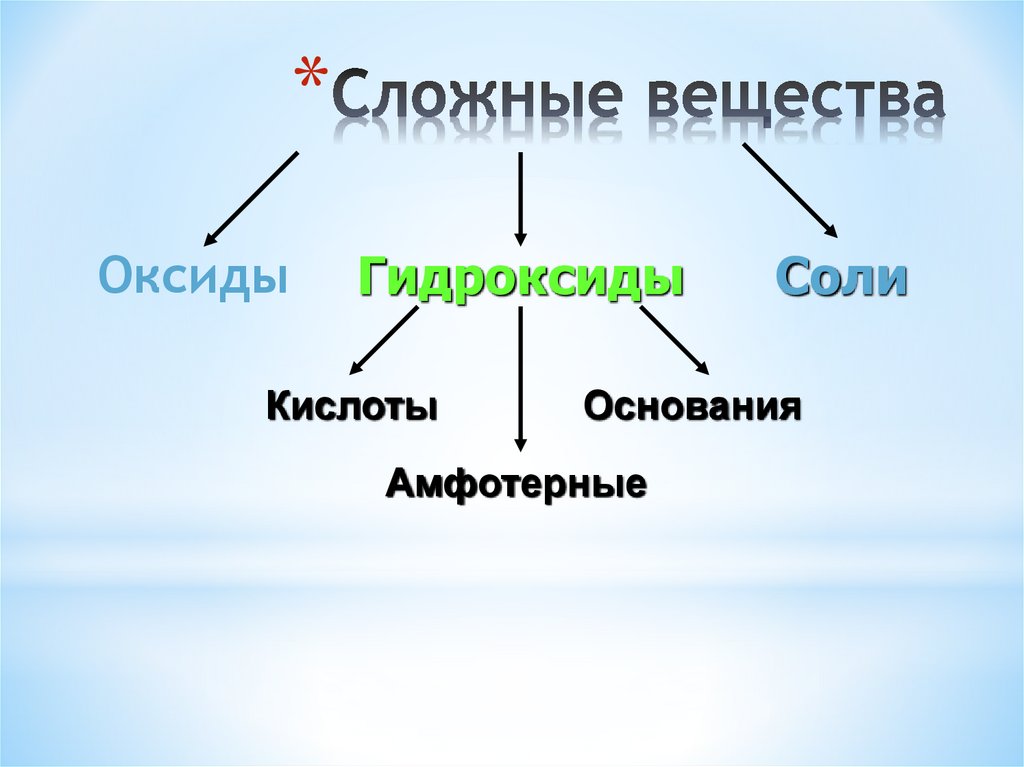 Делая те же расчеты для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («молекулярная масса грамма» глюкозы). При добавлении воды для получения одного литра раствора получается один моль (1М) глюкозы. Это особенно полезно в химии из-за связи молей с «числом Авогадро». В моле любого раствора содержится одинаковое количество частиц: 6,02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются тысячными долями моля или миллимолями (мМ).
Делая те же расчеты для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («молекулярная масса грамма» глюкозы). При добавлении воды для получения одного литра раствора получается один моль (1М) глюкозы. Это особенно полезно в химии из-за связи молей с «числом Авогадро». В моле любого раствора содержится одинаковое количество частиц: 6,02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются тысячными долями моля или миллимолями (мМ).
Коллоид – это смесь, похожая на тяжелый раствор. Частицы растворенного вещества состоят из крошечных сгустков молекул, достаточно больших, чтобы сделать жидкую смесь непрозрачной (поскольку частицы достаточно велики, чтобы рассеивать свет). Знакомыми примерами коллоидов являются молоко и сливки. В щитовидной железе гормон щитовидной железы хранится в виде густой белковой смеси, также называемой коллоидом.
Суспензия – это жидкая смесь, в которой более тяжелое вещество временно взвешено в жидкости, но со временем оседает. Такое отделение частиц от суспензии называется седиментацией. Пример оседания происходит в анализе крови, который устанавливает скорость оседания или скорость седации. Тест измеряет, как быстро эритроциты в пробирке оседают из водянистой части крови (известной как плазма) в течение установленного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но аспекты некоторых заболеваний могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Такое отделение частиц от суспензии называется седиментацией. Пример оседания происходит в анализе крови, который устанавливает скорость оседания или скорость седации. Тест измеряет, как быстро эритроциты в пробирке оседают из водянистой части крови (известной как плазма) в течение установленного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но аспекты некоторых заболеваний могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Роль воды в химических реакциях
Два типа химических реакций связаны с образованием или потреблением воды: дегидратация, синтез и гидролиз.
- В синтезе дегидратации один реагент отдает атом водорода, а другой реагент отдает гидроксильную группу (ОН) при синтезе нового продукта. При образовании их ковалентной связи в качестве побочного продукта выделяется молекула воды (рис. 1). Это также иногда называют реакцией конденсации.

- При гидролизе молекула воды разрушает соединение, разрывая его связи. Вода сама расщепляется на Н и ОН. Затем одна часть разорванного соединения связывается с атомом водорода, а другая часть связывается с гидроксильной группой.
Эти реакции являются обратимыми и играют важную роль в химии органических соединений (которая будет обсуждаться в ближайшее время).
Дегидратация, синтез и гидролиз
Рисунок 1: Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера). (а) При дегидратационном синтезе два мономера ковалентно связываются в результате реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды высвобождается как побочный продукт при реакциях дегидратации. (б) При гидролизе ковалентная связь между двумя мономерами расщепляется за счет присоединения атома водорода к одному и гидроксильной группы к другому, что требует вклада одной молекулы воды.
Соли
Напомним, что соли образуются, когда ионы образуют ионные связи. В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH – . Этот факт важен для отличия солей от кислот и оснований, о чем пойдет речь далее.
Типичная соль NaCl полностью диссоциирует в воде (рис. 2). Положительные и отрицательные участки молекулы воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга. Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить электрический ток в растворе. Это свойство имеет решающее значение для функции ионов в передаче нервных импульсов и стимулировании сокращения мышц.
Это свойство имеет решающее значение для функции ионов в передаче нервных импульсов и стимулировании сокращения мышц.
Диссоциация хлорида натрия в воде
Рисунок 2: Обратите внимание, что кристаллы хлорида натрия диссоциируют не на молекулы NaCl, а на катионы Na + и анионы Cl – , каждый из которых полностью окружен молекулами воды.
Многие другие соли важны для организма. Например, соли желчных кислот, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей.
Кислоты и основания
Кислоты и основания, как и соли, диссоциируют в воде на электролиты. Кислоты и основания могут очень сильно изменять свойства растворов, в которых они растворены.
Кислоты
Кислота – это вещество, которое высвобождает ионы водорода (H + ) в растворе (рис. 3а). Поскольку атом водорода имеет только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот уединенный протон с большой долей вероятности может участвовать в химических реакциях. Сильные кислоты — это соединения, которые высвобождают весь свой H + в растворе; то есть они полностью ионизируются. Соляная кислота (HCl), которая высвобождается из клеток слизистой оболочки желудка, является сильной кислотой, поскольку она высвобождает все свои H + в водянистой среде желудка. Эта сильная кислота способствует пищеварению и убивает проглоченные микробы. Слабые кислоты полностью не ионизируются; то есть некоторые из их водородных ионов остаются связанными внутри соединения в растворе. Примером слабой кислоты является уксус или уксусная кислота; его называют ацетатом после того, как он отдает протон.
Поскольку атом водорода имеет только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот уединенный протон с большой долей вероятности может участвовать в химических реакциях. Сильные кислоты — это соединения, которые высвобождают весь свой H + в растворе; то есть они полностью ионизируются. Соляная кислота (HCl), которая высвобождается из клеток слизистой оболочки желудка, является сильной кислотой, поскольку она высвобождает все свои H + в водянистой среде желудка. Эта сильная кислота способствует пищеварению и убивает проглоченные микробы. Слабые кислоты полностью не ионизируются; то есть некоторые из их водородных ионов остаются связанными внутри соединения в растворе. Примером слабой кислоты является уксус или уксусная кислота; его называют ацетатом после того, как он отдает протон.
Кислоты и основания
Рис. 3: (a) В водном растворе кислота диссоциирует на ионы водорода (H + ) и анионы. Почти каждая молекула сильной кислоты диссоциирует с образованием высокой концентрации H + . (б) В водном растворе основание диссоциирует на гидроксильные ионы (ОН – ) и катионы. Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию ОН – .
Почти каждая молекула сильной кислоты диссоциирует с образованием высокой концентрации H + . (б) В водном растворе основание диссоциирует на гидроксильные ионы (ОН – ) и катионы. Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию ОН – .
Основания
Основание – это вещество, которое высвобождает гидроксильные ионы (OH – ) в растворе или принимает H + , уже присутствующие в растворе (см. Рисунок 3b). Ионы гидроксила или другое основание объединяются с присутствующими H + с образованием молекулы воды, тем самым удаляя H + и снижая кислотность раствора. Сильные основания высвобождают большую часть или все свои гидроксильные ионы; слабые основания выделяют только некоторые гидроксильные ионы или поглощают только несколько H + . Пища, смешанная с соляной кислотой из желудка, обожгла бы тонкую кишку, следующую за желудком часть пищеварительного тракта, если бы не выделение бикарбоната (HCO 3 — ), слабая база, притягивающая H + . Бикарбонат принимает часть протонов H + , тем самым снижая кислотность раствора.
Бикарбонат принимает часть протонов H + , тем самым снижая кислотность раствора.
Понятие рН
Относительная кислотность или щелочность раствора может быть указана его рН. pH раствора – это отрицательный логарифм по основанию 10 концентрации ионов водорода (H + ) в растворе. Например, раствор с pH 4 имеет H + 9059.4 концентрация, в десять раз превышающая концентрацию раствора с pH 5. То есть раствор с pH 4 в десять раз более кислый, чем раствор с pH 5. Концепция pH станет более понятной, когда вы изучите шкалу pH, как показано на Рисунке 4. Шкала состоит из ряда приращений от 0 до 14. Раствор с рН 7 считается нейтральным — ни кислым, ни щелочным. Чистая вода имеет рН 7. Чем меньше число ниже 7, тем более кислый раствор или тем выше концентрация Н + . Концентрация ионов водорода при каждом значении рН в 10 раз отличается от следующего значения рН. Например, значение рН 4 соответствует концентрации протонов 10 –4 М, или 0,0001 М, а значение рН 5 соответствует концентрации протонов 10 –5 М, или 0,00001 М. Чем выше число выше 7, тем более щелочным (щелочным) является раствор или тем ниже концентрация H + . Человеческая моча, например, в десять раз более кислая, чем чистая вода, а HCl в 10 000 000 раз более кислая, чем вода. 9Рисунок 4 При этом слегка щелочном рН кровь может снизить кислотность, возникающую из-за того, что двуокись углерода (CO 2 ) постоянно выделяется в кровоток триллионами клеток тела. Гомеостатические механизмы (наряду с выдыханием CO 2 при дыхании) обычно удерживают pH крови в этом узком диапазоне. Это очень важно, потому что колебания — слишком кислые или слишком щелочные — могут привести к опасным для жизни расстройствам.
Чем выше число выше 7, тем более щелочным (щелочным) является раствор или тем ниже концентрация H + . Человеческая моча, например, в десять раз более кислая, чем чистая вода, а HCl в 10 000 000 раз более кислая, чем вода. 9Рисунок 4 При этом слегка щелочном рН кровь может снизить кислотность, возникающую из-за того, что двуокись углерода (CO 2 ) постоянно выделяется в кровоток триллионами клеток тела. Гомеостатические механизмы (наряду с выдыханием CO 2 при дыхании) обычно удерживают pH крови в этом узком диапазоне. Это очень важно, потому что колебания — слишком кислые или слишком щелочные — могут привести к опасным для жизни расстройствам.
Все клетки организма зависят от гомеостатической регуляции кислотно-щелочного баланса при рН примерно 7,4. Следовательно, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, которые в совокупности называются буферами, в жидкости организма. Буфер представляет собой раствор слабой кислоты и сопряженного с ней основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже незначительное снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действующий как слабое основание — будет связывать избыток ионов водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Буфер представляет собой раствор слабой кислоты и сопряженного с ней основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже незначительное снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действующий как слабое основание — будет связывать избыток ионов водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Гомеостатический дисбаланс: кислоты и основания
Повышенная кислотность крови и других жидкостей организма известна как ацидоз. Распространенными причинами ацидоза являются ситуации и расстройства, которые снижают эффективность дыхания, особенно способность человека к полному выдоху, что вызывает накопление CO 2 (и H + ) в кровотоке. Ацидоз также может быть вызван метаболическими проблемами, которые снижают уровень или функцию буферов, действующих как основания, или которые способствуют выработке кислот. Например, при тяжелой диарее организм может терять слишком много бикарбоната, что приводит к накоплению кислот в жидкостях организма. У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для тела. Они могут накапливаться в крови, вызывая серьезное состояние, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Например, при тяжелой диарее организм может терять слишком много бикарбоната, что приводит к накоплению кислот в жидкостях организма. У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для тела. Они могут накапливаться в крови, вызывая серьезное состояние, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Напротив, алкалоз представляет собой состояние, при котором кровь и другие жидкости организма имеют слишком щелочную реакцию (щелочную реакцию). Как и в случае с ацидозом, респираторные расстройства являются основной причиной; однако при респираторном алкалозе уровень углекислого газа падает слишком низко. Заболевания легких, передозировка аспирина, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + .
Метаболический алкалоз часто возникает в результате длительной сильной рвоты, которая вызывает потерю ионов водорода и хлора (как компонентов HCl). Лекарства также могут вызвать алкалоз. К ним относятся мочегонные средства, которые заставляют организм терять ионы калия, а также антациды, принимаемые в чрезмерных количествах, например, при постоянной изжоге или язве.
Обзор главы
Неорганические соединения, необходимые для жизнедеятельности человека, включают воду, соли, кислоты и основания. Эти соединения неорганические; то есть они не содержат ни водорода, ни углерода. Вода является смазкой и подушкой, теплоотводом, компонентом жидких смесей, побочным продуктом реакций дегидратационного синтеза, реагентом в реакциях гидролиза. Соли — это соединения, которые при растворении в воде диссоциируют на ионы, отличные от H 9059.3 + или OH – . Напротив, кислоты выделяют H + в раствор, делая его более кислым.

 А. Тимирязева, «Обучение навыкам оказания первой помощи пострадавшим при несчастных случаях», 2020 г., 24 часа.
А. Тимирязева, «Обучение навыкам оказания первой помощи пострадавшим при несчастных случаях», 2020 г., 24 часа. , Удостоверение о повышении квалификации № 77180208515, Рег. № 10780 от 03.04.2020 г.;
, Удостоверение о повышении квалификации № 77180208515, Рег. № 10780 от 03.04.2020 г.;  — Биология человека I — Учебник
— Биология человека I — Учебник
