Содержание
База непонятных данных – Огонек № 31 (5337) от 11.08.2014
Ученые заявили, что более 90 процентов ДНК человека — это эволюционный «мусор», не имеющий никакого смысла. Означает ли это, что изучение генома можно значительно сузить, сэкономив колоссальные средства?
В нашей ДНК загадок не меньше, чем в космосе: более или менее понятно, как работает всего 8 процентов этой молекулы
Фото: AFP
Елена Кудрявцева
Сто миллионов лет назад будущий человек не особо отличался от мыши, утконоса и лошади, по крайней мере, с точки зрения генетики.
Этот милый парадокс — вывод, к которому пришли ученые из Оксфордского университета, когда решили сравнить, как на протяжении эволюции менялись геномы разных млекопитающих. С этой целью исследователи для начала попробовали выделить какие-то общие части геномов у разных видов. А в итоге пришли к тому, что все животные имеют огромную часть древних спящих генов и лишь незначительную долю работающих. У человека, к примеру, эта доля составляет всего 8,2 процента.
У человека, к примеру, эта доля составляет всего 8,2 процента.
— Мы, как правило, ожидаем, что все части нашей ДНК должны что-то делать,— говорит один из авторов работы, доктор Крис Рэндс из лаборатории функциональной геномики Оксфордского университета,— но это далеко не так. В действительности функционирует лишь небольшая часть.
Все же остальное, уточняют его соавторы по нашумевшей публикации об этом исследовании в авторитетном журнале PLoS Genetics, по всей вероятности, бесполезно и является эволюционным «мусором». Вообще, работа британских ученых возродила давнюю войну между сторонниками теории «мусорной ДНК» и теми, кто считает геном человека полностью функциональным. Подобный поворот в принципиальном научном диспуте примечателен уже потому, что несколько лет назад сторонники теории «полностью функционального генома», потратив на доказательство своей правоты почти 10 лет и 200 млн долларов в рамках проекта ENCODE, праздновали окончательную победу. Другое дело, что их оппоненты уже тогда намекали, что за такие огромные деньги они, в принципе, не могли не найти того, что искали. ..
..
Очень темная материя
«Мусорная ДНК» — это, по сути, гигантский эволюционный шлейф, который тянется за человеком миллионы лет и бережно хранится в кладовых его клеток. Долгое время считалось, что этого шлейфа нет только у вирусов и бактерий, которые столь малы, что еле умещают в себе необходимые для жизни гены, не то, что какие-то «скелеты» из прошлого. Огромный объем этого «мусора» по сравнению с полезной частью давно ставит ученых в тупик, и они даже сравнивают эту непонятную область нашего генома с темной материей во Вселенной, которая составляет ее гигантскую часть, но до сих пор скрыта от человека.
Впрочем, уже есть технологии, которые позволяют эту самую «мусорную ДНК» пощупать. Оказалось, что она состоит из весьма не похожих друг на друга частей. Например, из древних ретровирусов, которые когда-то свирепствовали на Земле, а потом по неизвестной причине перестали размножаться и застыли в нашем геноме, как след от каблука в бетоне. Еще есть не работающие лишние копии генов, которые отвечали за что-то тысячи лет назад. Еще есть спящие гены, которые отвечают, к примеру, за способность отбрасывать хвост, и так далее.
Еще есть спящие гены, которые отвечают, к примеру, за способность отбрасывать хвост, и так далее.
— Все знают, что ДНК является носителем генетической информации человека и других организмов,— говорит Дмитрий Штокало из Института систем информатики им. А.П. Ершова СО РАН, который занимается изучением «мусорной» части ДНК.— Код последовательности ДНК определяет, что человек является человеком, мышь — мышью, а муха — мухой. Но как все это работает, ученым до сих пор неясно: сегодня известен механизм работы примерно 3-8 процентов генома, а функция остальных покрыта мраком, так что часть ученых относит ее к бесполезному «мусору». Правда, оппоненты этой теории говорят, что если сравнивать мышь и человека, то окажется, что те самые функциональные 3-8 процентов у нас почти одинаковы. Напрашивается вывод, что именно «мусорная ДНК» на самом деле несет в себе какую-то функцию, которая, собственно, и делает человека человеком.
О пользе мусора
Разговоры о том, что гигантский багаж, который человечество тащит за собой в собственных генах, не такое уж пассивное наследие, начались после расшифровки генома в 2003-м. По одной из версий, «мусорная ДНК» вообще двигатель эволюции: ученые посчитали, что если бы эволюция шла постепенно за счет мутаций в функциональной части ДНК, человек так бы и не возник до сих пор — не хватило бы времени. Но, на наше счастье, эволюция шла рывками, которые выводили виды на новые витки развития. Возможно, происходило это именно благодаря «мусорной ДНК», вернее, ее особой части, которую окрестили «прыгучим геномом». Так называют небольшие кусочки генома, которые ведут себя по типу вирусов — могут вырезать себя из одного места хромосомы и переставлять в другое.
По одной из версий, «мусорная ДНК» вообще двигатель эволюции: ученые посчитали, что если бы эволюция шла постепенно за счет мутаций в функциональной части ДНК, человек так бы и не возник до сих пор — не хватило бы времени. Но, на наше счастье, эволюция шла рывками, которые выводили виды на новые витки развития. Возможно, происходило это именно благодаря «мусорной ДНК», вернее, ее особой части, которую окрестили «прыгучим геномом». Так называют небольшие кусочки генома, которые ведут себя по типу вирусов — могут вырезать себя из одного места хромосомы и переставлять в другое.
В прошлом году биологи из Йельского университета (США) установили, что именно так, к примеру, 100 млн лет назад будущий человек потерял сумку на животе и стал вынашивать детей в утробе: кусок «мусорной ДНК» вытеснил из генома часть, соответствующую сумчатым. Если бы этого не произошло, мы бы, как кенгуру, носили детей в кармашках. По мнению биолога Александра Маркова из Палеонтологического института РАН, вполне может оказаться, что собственно эволюция человека, то есть увеличение мозга, членораздельная речь и вообще «превращение обезьяны в человека», тоже шло под контролем этих подвижных кусочков генома.
Великое раскодирование
Самой крупной попыткой разобраться в генетическом эволюционном «мусоре» стал проект ENCODE, стартовавший в 2003-м с подачи Национального института по изучению генома человека США. В нем приняли участие более 400 ученых из 32 лабораторий США, Великобритании, Японии, Испании и Сингапура. Цель проекта — понять, как работает геном, особенно те его части, которые не производят белок. Прорыв в работе столь солидной группы ученых произошел примерно 5 лет назад, когда появились технологии ускоренного прочтения генома: если в первый раз его читали 14 лет, то теперь ту же работу научились делать за две недели. Участники проекта изучили огромный массив информации и выяснили: так называемая мусорная ДНК содержит некие переключатели, которые сами не работают, но каким-то образом регулируют работу других генов и от них в том числе зависит вероятность возникновения той или иной болезни — от диабета и рака до сердечно-сосудистых или психических расстройств.
Россия в ENCODE не участвовала, но работала в схожих группах, например в «Проекте по исследованию некодирующей РНК» вместе с французами и американцами.
— Мы взяли самые современные технологии прочтения генома человека и поискали те участки, которые, с нашей точки зрения, могли бы исполнять какие-то функции,— рассказывает Дмитрий Штокало.— Чтобы проверить догадку, коллеги на Западе заблокировали эти участки в геноме раковых клеток и у тех включился механизм запрограммированной смерти. А рак, как известно, зачастую возникает именно из-за того, что клетки начинают бесконтрольно делиться и теряют способность к самоуничтожению. Так что в перспективе эти данные можно использовать для создания нового поколения лекарств и диагностики онкологических заболеваний.
Правда, сторонники «мусорной теории», включая оксфордских ученых, уверены: пока не изучен механизм действия этих загадочных участков генома, делать выводы преждевременно. Что мы получим на выходе — суперэффективные генетические лекарства или пустышку,— пока тоже не ясно. Как известно всем, кто изучает древности, шансы обнаружить мусор и шансы набрести на сокровища — примерно равны.
Спящие гены человека. Как разбудить молчащие гены? «Волшебный порошок» доктора Бэдилэка
Ученые заявили, что более 90 процентов ДНК человека — это эволюционный «мусор», не имеющий никакого смысла. Означает ли это, что изучение генома можно значительно сузить, сэкономив колоссальные средства?
Елена Кудрявцева
Сто миллионов лет назад будущий человек не особо отличался от мыши, утконоса и лошади, по крайней мере, с точки зрения генетики.
Этот милый парадокс — вывод, к которому пришли ученые из Оксфордского университета, когда решили сравнить, как на протяжении эволюции менялись геномы разных млекопитающих. С этой целью исследователи для начала попробовали выделить какие-то общие части геномов у разных видов. А в итоге пришли к тому, что все животные имеют огромную часть древних спящих генов и лишь незначительную долю работающих. У человека, к примеру, эта доля составляет всего 8,2 процента.
Мы, как правило, ожидаем, что все части нашей ДНК должны что-то делать,- говорит один из авторов работы, доктор Крис Рэндс из лаборатории функциональной геномики Оксфордского университета,- но это далеко не так. В действительности функционирует лишь небольшая часть.
В действительности функционирует лишь небольшая часть.
Все же остальное, уточняют его соавторы по нашумевшей публикации об этом исследовании в авторитетном журнале PLoS Genetics, по всей вероятности, бесполезно и является эволюционным «мусором». Вообще, работа британских ученых возродила давнюю войну между сторонниками теории «мусорной ДНК» и теми, кто считает геном человека полностью функциональным. Подобный поворот в принципиальном научном диспуте примечателен уже потому, что несколько лет назад сторонники теории «полностью функционального генома», потратив на доказательство своей правоты почти 10 лет и 200 млн долларов в рамках проекта ENCODE, праздновали окончательную победу. Другое дело, что их оппоненты уже тогда намекали, что за такие огромные деньги они, в принципе, не могли не найти того, что искали…
Очень темная материя
«Мусорная ДНК» — это, по сути, гигантский эволюционный шлейф, который тянется за человеком миллионы лет и бережно хранится в кладовых его клеток. Долгое время считалось, что этого шлейфа нет только у вирусов и бактерий, которые столь малы, что еле умещают в себе необходимые для жизни гены, не то, что какие-то «скелеты» из прошлого. Огромный объем этого «мусора» по сравнению с полезной частью давно ставит ученых в тупик, и они даже сравнивают эту непонятную область нашего генома с темной материей во Вселенной, которая составляет ее гигантскую часть, но до сих пор скрыта от человека.
Долгое время считалось, что этого шлейфа нет только у вирусов и бактерий, которые столь малы, что еле умещают в себе необходимые для жизни гены, не то, что какие-то «скелеты» из прошлого. Огромный объем этого «мусора» по сравнению с полезной частью давно ставит ученых в тупик, и они даже сравнивают эту непонятную область нашего генома с темной материей во Вселенной, которая составляет ее гигантскую часть, но до сих пор скрыта от человека.
Впрочем, уже есть технологии, которые позволяют эту самую «мусорную ДНК» пощупать. Оказалось, что она состоит из весьма не похожих друг на друга частей. Например, из древних ретровирусов, которые когда-то свирепствовали на Земле, а потом по неизвестной причине перестали размножаться и застыли в нашем геноме, как след от каблука в бетоне. Еще есть не работающие лишние копии генов, которые отвечали за что-то тысячи лет назад. Еще есть спящие гены, которые отвечают, к примеру, за способность отбрасывать хвост, и так далее.
Все знают, что ДНК является носителем генетической информации человека и других организмов,- говорит Дмитрий Штокало из Института систем информатики им. А.П. Ершова СО РАН, который занимается изучением «мусорной» части ДНК.- Код последовательности ДНК определяет, что человек является человеком, мышь — мышью, а муха — мухой. Но как все это работает, ученым до сих пор неясно: сегодня известен механизм работы примерно 3-8 процентов генома, а функция остальных покрыта мраком, так что часть ученых относит ее к бесполезному «мусору». Правда, оппоненты этой теории говорят, что если сравнивать мышь и человека, то окажется, что те самые функциональные 3-8 процентов у нас почти одинаковы. Напрашивается вывод, что именно «мусорная ДНК» на самом деле несет в себе какую-то функцию, которая, собственно, и делает человека человеком.
А.П. Ершова СО РАН, который занимается изучением «мусорной» части ДНК.- Код последовательности ДНК определяет, что человек является человеком, мышь — мышью, а муха — мухой. Но как все это работает, ученым до сих пор неясно: сегодня известен механизм работы примерно 3-8 процентов генома, а функция остальных покрыта мраком, так что часть ученых относит ее к бесполезному «мусору». Правда, оппоненты этой теории говорят, что если сравнивать мышь и человека, то окажется, что те самые функциональные 3-8 процентов у нас почти одинаковы. Напрашивается вывод, что именно «мусорная ДНК» на самом деле несет в себе какую-то функцию, которая, собственно, и делает человека человеком.
О пользе мусора
Разговоры о том, что гигантский багаж, который человечество тащит за собой в собственных генах, не такое уж пассивное наследие, начались после расшифровки генома в 2003-м. По одной из версий, «мусорная ДНК» вообще двигатель эволюции: ученые посчитали, что если бы эволюция шла постепенно за счет мутаций в функциональной части ДНК, человек так бы и не возник до сих пор — не хватило бы времени. Но, на наше счастье, эволюция шла рывками, которые выводили виды на новые витки развития. Возможно, происходило это именно благодаря «мусорной ДНК», вернее, ее особой части, которую окрестили «прыгучим геномом». Так называют небольшие кусочки генома, которые ведут себя по типу вирусов — могут вырезать себя из одного места хромосомы и переставлять в другое.
Но, на наше счастье, эволюция шла рывками, которые выводили виды на новые витки развития. Возможно, происходило это именно благодаря «мусорной ДНК», вернее, ее особой части, которую окрестили «прыгучим геномом». Так называют небольшие кусочки генома, которые ведут себя по типу вирусов — могут вырезать себя из одного места хромосомы и переставлять в другое.
В прошлом году биологи из Йельского университета (США) установили, что именно так, к примеру, 100 млн лет назад будущий человек потерял сумку на животе и стал вынашивать детей в утробе: кусок «мусорной ДНК» вытеснил из генома часть, соответствующую сумчатым. Если бы этого не произошло, мы бы, как кенгуру, носили детей в кармашках. По мнению биолога Александра Маркова из Палеонтологического института РАН, вполне может оказаться, что собственно эволюция человека, то есть увеличение мозга, членораздельная речь и вообще «превращение обезьяны в человека», тоже шло под контролем этих подвижных кусочков генома.
Великое раскодирование
Самой крупной попыткой разобраться в генетическом эволюционном «мусоре» стал проект ENCODE, стартовавший в 2003-м с подачи Национального института по изучению генома человека США. В нем приняли участие более 400 ученых из 32 лабораторий США, Великобритании, Японии, Испании и Сингапура. Цель проекта — понять, как работает геном, особенно те его части, которые не производят белок. Прорыв в работе столь солидной группы ученых произошел примерно 5 лет назад, когда появились технологии ускоренного прочтения генома: если в первый раз его читали 14 лет, то теперь ту же работу научились делать за две недели. Участники проекта изучили огромный массив информации и выяснили: так называемая мусорная ДНК содержит некие переключатели, которые сами не работают, но каким-то образом регулируют работу других генов и от них в том числе зависит вероятность возникновения той или иной болезни — от диабета и рака до сердечно-сосудистых или психических расстройств.
В нем приняли участие более 400 ученых из 32 лабораторий США, Великобритании, Японии, Испании и Сингапура. Цель проекта — понять, как работает геном, особенно те его части, которые не производят белок. Прорыв в работе столь солидной группы ученых произошел примерно 5 лет назад, когда появились технологии ускоренного прочтения генома: если в первый раз его читали 14 лет, то теперь ту же работу научились делать за две недели. Участники проекта изучили огромный массив информации и выяснили: так называемая мусорная ДНК содержит некие переключатели, которые сами не работают, но каким-то образом регулируют работу других генов и от них в том числе зависит вероятность возникновения той или иной болезни — от диабета и рака до сердечно-сосудистых или психических расстройств.
Россия в ENCODE не участвовала, но работала в схожих группах, например в «Проекте по исследованию некодирующей РНК» вместе с французами и американцами.
Мы взяли самые современные технологии прочтения генома человека и поискали те участки, которые, с нашей точки зрения, могли бы исполнять какие-то функции,- рассказывает Дмитрий Штокало. — Чтобы проверить догадку, коллеги на Западе заблокировали эти участки в геноме раковых клеток и у тех включился механизм запрограммированной смерти. А рак, как известно, зачастую возникает именно из-за того, что клетки начинают бесконтрольно делиться и теряют способность к самоуничтожению. Так что в перспективе эти данные можно использовать для создания нового поколения лекарств и диагностики онкологических заболеваний.
— Чтобы проверить догадку, коллеги на Западе заблокировали эти участки в геноме раковых клеток и у тех включился механизм запрограммированной смерти. А рак, как известно, зачастую возникает именно из-за того, что клетки начинают бесконтрольно делиться и теряют способность к самоуничтожению. Так что в перспективе эти данные можно использовать для создания нового поколения лекарств и диагностики онкологических заболеваний.
Правда, сторонники «мусорной теории», включая оксфордских ученых, уверены: пока не изучен механизм действия этих загадочных участков генома, делать выводы преждевременно. Что мы получим на выходе — суперэффективные генетические лекарства или пустышку,- пока тоже не ясно. Как известно всем, кто изучает древности, шансы обнаружить мусор и шансы набрести на сокровища — примерно равны.
Огонек http://www.kommersant.ru/doc/2538727
Какие генетические болезни считаются самыми распространенными? Можно ли предупредить их развитие? Как это сделать? Рассказывает доктор медицинских наук, руководитель лаборатории молекулярной генетики человека НИИ экспериментальной медицины в Санкт-Петербурге Михаил Михайлович Шавловский.
«Спящий» ген
Всем известно, что человек получает двойной набор генов: один от матери, другой от отца. Работает только один из них. Его можно назвать «сильным». Если мутация произошла в «сильном» гене, то вероятность передачи болезни высока – она составляет как минимум 50%. А чаще всего этот показатель приближается к 75–100%. Если же «поломка» произошла в «спящем» гене, то вероятность болезни у потомства составляет от 0 до 50%.
Такое утверждение справедливо только в том случае, если болезнь определяется одним геном. Здесь можно привести в пример хорошо известное заболевание – муковисцидоз.
Как предупредить?
Если болезнь определяется всего одним геном, то ее проявление не зависит ни от чего – ни от факторов внешней среды, ни от внутреннего состояния организма. Все дело в наследственности. Поэтому предупредить заболевание можно одним способом – пойти в медико-генетическую консультацию и рассчитать вероятность рождения ребенка с муковисцидозом.
Бытовая астма
Если болезнь зависит сразу от нескольких генов, то вероятность ее передачи очень сложно отразить в процентах. Показатель будет сильно варьировать. Это видно на примере бронхиальной астмы. Риск ее передачи исчисляется от 3 до 12%.
Дело в том, что болезни, которые кодируются разными генами, зависят от внешних факторов. Если они благоприятны, то заболевание может «проспать» всю жизнь и никак не проявить себя.
Как предупредить?
Человек, в роду у которого есть астматики, должен жить в определенных бытовых условиях. Для начала надо привыкнуть к ежедневной уборке дома: каждое утро мыть полы и протирать влажной тряпкой все гладкие поверхности. Кроме того, следует убрать все ковры, паласы и напольные покрытия, которые являются настоящими пылесборниками. Занавески на окнах должны быть заменены на жалюзи. Если в доме много книг, то держать их надо только на застекленных полках.
Огромную роль играет и постельное белье. Нужно избавиться от всех шерстяных и пуховых одеял. Подушки не должны быть поролоновыми. Лучше всего купить постельные принадлежности с гипоаллергенным наполнителем, например полиэфирным волокном.
Подушки не должны быть поролоновыми. Лучше всего купить постельные принадлежности с гипоаллергенным наполнителем, например полиэфирным волокном.
Что касается питания, то из рациона следует исключить все цитрусовые, все орехи, рыбу, морепродукты, красно-оранжевые овощи и фрукты.
Женская мигрень
По данным голландских ученых, риск возникновения мигрени зависит сразу от нескольких факторов. Например, если больна мать, то вероятность появления мигрени у дочери будет колебаться от 5 до 28%, а у сына – от 3 до 7%. Если больны оба родителя, то риск появления мигрени у дочери составит 30–55%, а у сына – всего лишь 12%.
Женские гормоны эстрогены способствуют проявлению множества наследственных заболеваний, в частности мигрени.
Как предупредить?
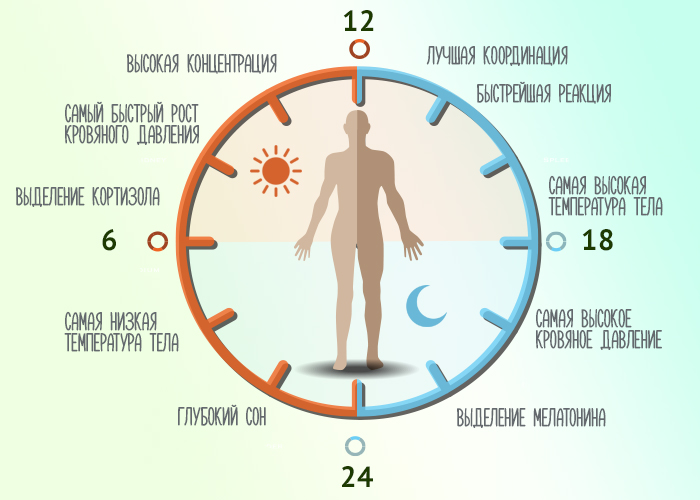
Если у женщины в роду есть мигрень, то нужно с детства выполнять некоторые правила. Спать нужно полноценно,
ложась в 10–11 часов вечера и просыпаясь около 7 утра. Нельзя устраиваться на суточную работу – там обострения мигрени будут учащаться из-за недосыпа и неправильного режима.
То же самое будет происходить и при слишком активной работе с компьютером. Его мерцание провоцирует приступ мигрени. Поэтому нужно покупать защитные экраны, защитные очки и проводить за монитором не более полутора часов подряд.
Что касается диеты, то при мигрени не рекомендуется есть мороженое, шоколад, плесневые сыры, красную и белую рыбу. Придется отказаться и от алкоголя, особенно от красного вина.
Семейный варикоз
Одним из наследственных заболеваний является синдром слабости соединительной ткани. Нарушается ее структура, и это имеет абсолютно разные проявления. Чаще всего эта патология проявляет себя варикозной болезнью. У мужчин она почти не встречается, страдают в основном женщины. Эстрогены способствуют тому, чтобы «спящая» болезнь перешла в активное состояние.
Как предупредить?
Если у девочки в роду есть варикоз, то о ее здоровье нужно заботиться с самого детства. Для начала надо сводить малышку на прием к ортопеду. Тот порекомендует наиболее подходящую обувь и даст совет по подбору кресла и стола для занятий. Нельзя допускать развития у ребенка плоскостопия или нарушения осанки. И то, и другое изменяет центр тяжести – значит, нагрузка на скелет будет распределена неправильно.
Нельзя допускать развития у ребенка плоскостопия или нарушения осанки. И то, и другое изменяет центр тяжести – значит, нагрузка на скелет будет распределена неправильно.
Нужно очень внимательно относиться к тому, что влияет на формирование скелета. Это не только стол, стул и кровать. Это еще и одежда. Например, нельзя покупать девочкам-подросткам тесные брюки или джинсы.
Врожденный диабет
Сахарный диабет также имеет генетическую предрасположенность. Это заболевание кодируется сразу несколькими генами. Их мутации опять-таки проявляются под воздействием внешних факторов.
Избыток жиров и углеводов «вытаскивает» болезнь наружу. Самым опасным фактором риска здесь становится лишний вес.
В семьях, где болен один из родителей, частота развития сахарного диабета у детей, вне зависимости от пола, составляет 5%. Когда больны оба родителя, то риск появления болезни возрастает до 25%. Эти цифры для нормального веса. Если он становится хотя бы на 10–15% выше нормы, то вероятность развития диабета увеличивается до 35–38%.
Как предупредить?
Все люди, у которых в роду есть сахарный диабет, с молодости должны придерживаться определенных правил питания. Нельзя злоупотреблять сладким и мучным. Нужно ограничить потребление
каш – манной, рисовой и гречневой. Очень аккуратно надо вести себя с картофелем и черным хлебом. И того, и другого можно съедать не более 200 граммов в сутки.
Некоторые же овощи можно есть практически без ограничений – это все виды капусты, томаты, баклажаны, салат, спаржа, морковь, огурцы, кабачки, сладкий перец и репа. Их можно съедать до 800–900 граммов в день. А вот от винограда, ананасов, бананов, киви и хурмы лучше отказаться.
Капуста от рака
В последнее время ученые многое узнали о наследственных формах рака. Классическим примером здесь является ретинобластома – злокачественный процесс, развивающийся в сетчатке глаза. Степень риска его передачи потомству составляет более 80%. У рака молочной железы этот показатель ниже – 20–30%.
Как предупредить?
Помочь может правильное питание. Еще в конце прошлого столетия английские ученые опубликовали список антираковых продуктов, которые в несколько раз снижают риск развития опухолей молочной железы. На первом месте здесь стоит капуста. В ней содержатся специфические вещества, защищающие женщину от злокачественного перерождения клеток. Поэтому всем представительницам прекрасного пола надо включить в свой ежедневный рацион капусту, причем неважно какую – белокочанную, краснокочанную, брюссельскую или цветную. Главное, чтобы она была сырой.
Еще в конце прошлого столетия английские ученые опубликовали список антираковых продуктов, которые в несколько раз снижают риск развития опухолей молочной железы. На первом месте здесь стоит капуста. В ней содержатся специфические вещества, защищающие женщину от злокачественного перерождения клеток. Поэтому всем представительницам прекрасного пола надо включить в свой ежедневный рацион капусту, причем неважно какую – белокочанную, краснокочанную, брюссельскую или цветную. Главное, чтобы она была сырой.
Екатерина ИРИСОВА
Сотрудники академика Д.К. Беляева
экспериментально воспроизвели процесс одомашнивания лисиц в 50-ти
поколениях.
Важно, что отбор лисиц осуществлялся по их поведению по отношению к человеку.
«О необычайно интересном (хочется сказать, красивом эксперименте) рассказал академик Д.К. Беляев. Группа новосибирских генетиков, возглавляемая Д.К. Беляевым, задалась целью получить домашних серебристо-чёрных лисиц. Не прирученных, а по-настоящему домашних, у которых от рождения, как у собак, отсутствуют агрессивность и страх перед человеком.
Это важно не только для удобства работников звероферм: боязливые и агрессивные лисы плохо питаются, плохо растут и дают мех худшего качества.
Превращение волка в собаку, судя по данным археологии, затянулось на добрую тысячу лет.
Новосибирские генетики решили уложиться в один-два десятка. Метод был прост: отбор из поколения в поколение на «хорошее отношение к человеку». И он дал блестящие результаты. Лисы, полученные таким способом, по поведению практически не
отличались от собак. Биохимический анализ показал, что у этих лис низкий уровень синтеза стероидных гормонов надпочечников. Эти гормоны сильно влияют на поведение (недаром исследователи шутя называют их «стервоидными»). Работой надпочечников управляет гипофиз, а тем, как вы помните, гипоталамус. Пока трудно сказать, в каком месте этой цепи произошло наследственное изменение, подхваченное отбором.
Но самое интересное оказалось впереди.
Хотя отбор шёл только по поведению, подопытная популяция стала изменяться и внешне — произошёл взрыв изменчивости, причём гомологичной той, которая произошла при переходе от волка к собаке.
В самом деле: сроки течки у таких лис резко сдвинулись; некоторые, как собаки, оказались способными к размножению два раза в год; линька, у диких животных чётко приуроченная к определённому сезону, начала растягиваться на весь год; появились «пегие» лисы, с пятнами меха разной окраски; стали рождаться лисята с висячими, как у такс, ушами; наконец, у некоторых лис хвост стал закручиваться на спину крючком, как у лаек!
Гомология с породами домашних собак, действительно, блестящая . Но как она возникла за столь короткий срок? Д.К. Беляев
объясняет это так: в геноме лисиц были «спящие» гены, не проявляющиеся до поры в фенотипе. В стрессовых условиях отбора они стали выражаться в признаках организмов.
По-видимому, подобные процессы широко распространены, особенно при одомашнивании (доместикации).
Понятие «спящие гены» требует пояснения. Такие гены есть у каждого из нас. Если у вас, например, глаза чёрные, а у отца или матери голубые, то в вашем геноме имеется ген, ответственный за возникновение голубого цвета глаз. Но этот ген рецессивен и проявляется лишь в том случае, если унаследован от отца и матери.
Но этот ген рецессивен и проявляется лишь в том случае, если унаследован от отца и матери.
Выщепление рецессивных признаков, т. е. выявление спящих генов, широко распространено в малых популяциях, когда велика роль близкородственного скрещивания — инбридинга. Тогда вероятность получить один и тот же ген от обоих родителей возрастает (вспомните хотя бы описанную английскими генетиками наследственную глухоту в сельской местности). Об этом механизме я уже писал, говоря о возникновении пород собак. Вряд ли первобытные люди, проживая маленькими общинами, могли содержать много собак. Скрещивание неизбежно было близкородственным.
Но в опыте Д.К. Беляева
инбридинга не было. Подопытная популяция лис превышала 500
; в таких условиях вероятность встречи двух одинаковых генов в одном потомке чрезвычайно мала. Поэтому мы должны принять иной механизм «пробуждения» спящих генов. В сказке спящую принцессу разбудил принц (гомологичный ген) — это схема первого механизма. Здесь принцесса должна проснуться сама.
Это возможно лишь при одном условии — когда рецессивный ген становится доминантным. Отбор в этом случае затрагивает гормональную ось: гипоталамус – гипофиз – надпочечники и другие железы внутренней секреции.
А ведь гормоны недаром называют «полномочными посланцами генов». Накопилось уже достаточно фактов, свидетельствующих о том, что изменение концентрации гормона изменяет экспрессию гена — степень его проявления в признаках фенотипа.
Как мы видим, и тут не обходится без гормонов. Молекулярный механизм удивительных фактов, обнаруженных в опытах Д.К. Беляева, ещё не расшифрован. Однако дальнейшие опыты в этом направлении обещают многое — в первую очередь управление доминантностью генов».
Исследователи обнаружили лекарство, позволяющее включить спящую отцовскую копию гена взамен сломавшейся материнской.
Наш геном складывается из двух копий — отцовского и материнского набора хромосом. Каждый ген имеет своего двойника; оба могут выполнять одну функцию, но делают это по-разному. Очень часто случается, что одна из копий засыпает, а всю работу выполняет другая. Это нормально: например, у нас работает только материнская копия гена UBE3A, расположенного на 15-й хромосоме. Белок, кодируемый этим геном, принимает участие в развитии нервной системы и регулирует деградацию ненужных белков. Если же этот ген по какой-то причине не работает, у человека развивается генетическое неврологическое заболевание, называемое синдромом Ангельмана. Для него характерны и задержка в развитии, и неконтролируемые резкие, хаотические движения, и приступы смеха. Недуг не такой уж редкий, встречается у одного человека из 15 тысяч.
Очень часто случается, что одна из копий засыпает, а всю работу выполняет другая. Это нормально: например, у нас работает только материнская копия гена UBE3A, расположенного на 15-й хромосоме. Белок, кодируемый этим геном, принимает участие в развитии нервной системы и регулирует деградацию ненужных белков. Если же этот ген по какой-то причине не работает, у человека развивается генетическое неврологическое заболевание, называемое синдромом Ангельмана. Для него характерны и задержка в развитии, и неконтролируемые резкие, хаотические движения, и приступы смеха. Недуг не такой уж редкий, встречается у одного человека из 15 тысяч.
Итак, при синдроме Ангельмана ситуация такова: отцовская копия гена, как ей и полагается, находится в спящем состоянии, а материнская, которая в норме должна работать, сломана. Решение проблемы кажется очевидным: нужно разбудить отцовскую копию гена. Но это проще сказать, чем сделать. Исследователи из Университета Северной Каролины (США) перебрали около 2300 разных соединений в надежде, что какое-нибудь из них сможет включить отцовскую копию UBE3A. В конце концов они попробовали ингибитор топоизомеразы I, известный противораковый препарат. Топоизомераза представляет собой фермент, помогающий клетке удваивать генетический материал; без нее невозможна репликация ДНК и размножение. Оказалось, что ингибитор топоизомеразы обладает еще и генно-терапевтическими свойствами. Авторы сообщили, что этот медикамент пробуждал от спячки отцовскую копию гена UBE3A. Причем эффект длился целых 12 недель после введения мышам этого ингибитора – белок Ube3a начинал синтезироваться во всех важнейших участках центральной нервной системы, включая гиппокамп, мозжечок, кору полушарий и спинной мозг.
В конце концов они попробовали ингибитор топоизомеразы I, известный противораковый препарат. Топоизомераза представляет собой фермент, помогающий клетке удваивать генетический материал; без нее невозможна репликация ДНК и размножение. Оказалось, что ингибитор топоизомеразы обладает еще и генно-терапевтическими свойствами. Авторы сообщили, что этот медикамент пробуждал от спячки отцовскую копию гена UBE3A. Причем эффект длился целых 12 недель после введения мышам этого ингибитора – белок Ube3a начинал синтезироваться во всех важнейших участках центральной нервной системы, включая гиппокамп, мозжечок, кору полушарий и спинной мозг.
Необходимо подчеркнуть, что все эти данные относятся к нервным клеткам, и исследователи пока не знают, как подействует ингибитор топоизомеразы на другие типы здоровых клеток. С другой стороны, хотя препарат давно используется в химиотерапии, будет ли он лечить у человека еще и нервную систему, сказать заранее невозможно, пишет Compulenta.ru .
Сейчас все лечение больных синдромом Ангельмана сводится лишь к облегчению симптомов, а ингибитор топоизомеразы позволяет надеяться на то, что можно будет устранить саму причину болезни. И, пожалуй, самым главным результатом можно назвать то, что исследователи показали реальность такого способа терапии, когда на замену неработающему гену встает его копия из нашего же генома. Таким образом можно лечить самые разные генетические заболевания, не прибегая к редактированию человеческой ДНК.
И, пожалуй, самым главным результатом можно назвать то, что исследователи показали реальность такого способа терапии, когда на замену неработающему гену встает его копия из нашего же генома. Таким образом можно лечить самые разные генетические заболевания, не прибегая к редактированию человеческой ДНК.
Годы молодости — это повествование о дремлющих силах природы, заложенных в нас, о спящих генах молодости, а вовсе не об итальянском фильме, под названием Лучшие годы молодости. Годы молодости, в каком возрасте они заканчиваются? Как долго длятся годы молодости?
Американка Тина Дженкинс стать взрослой женщиной сможет только через пятьсот лет! Сегодня же Тина лепечет, пускает пузыри и забавляется с куклами, как самый обычный младенец. Между тем она родилась в 1970 году и ей уже 40 лет! Все остальное, кроме возраста, у нее в норме.
Ученые в один голос твердят, что это совершенно нормальная здоровая девочка с физиологией и поведением годовалого ребенка. И, кстати, добавляют, что если она и впредь будет развиваться такими темпами, то имеет шансы прожить 1500 лет.
Всем кажется, что Тина — грудной ребенок, — говорит ее мама Санди Дженкинс. — Но я родила ее в 1970 году, и, если бы все шло, как положено, она была бы сейчас взрослой женщиной. Но она все еще ребенок — с виду, самый обычный. Ее муж Карл вспоминает, что, родившись, Тина со всех точек зрения была самым нормальным ребенком. Врачи не находили никаких отклонений. Однако через некоторое время родителям пришлось признать, что их дочь отстает в развитии.
Обратились к педиатру, — рассказывает отец девочки. — И он был удивлен так же, как и мы. Несколько месяцев подряд нашу дочурку обследовали всеми известными в науке методами. Но безрезультатно.
Впрочем, врач нас утешил: постепенно, мол, организм ребенка разовьется, и к школе Тина догонит других детей. Однако и в шесть лет она выглядела всего лишь на трехмесячную малютку — еле-еле научилась держать головку.
Санди Дженкинс говорит, что лепетать Тина начала лет в десять.
Но и теперь она не может обходиться без подгузника. Девочка развивается замедленно, но гармонично.
Тину нельзя назвать недоразвитой. Любой посторонний человек скажет, что ей около 12 месяцев. И для этого возраста она — умненький и подвижный ребенок. Конечно, и нормальной её не назовешь.
Другими словами, мы с вами до этой даты не доживем, если ученые в ближайшие годы так и не разбудят спящий ген молодости — для нас. Годы молодости — у каждого из нас есть спящий ген молодости.
Сколько живут деревья? Средний возрастдерева 110- 120 лет. Предельный возраст — 400 лет.
Прыгающие гены, или Зачем эволюция замусорила ДНК
https://ria.ru/20180515/1520545382.html
Прыгающие гены, или Зачем эволюция замусорила ДНК
Прыгающие гены, или Зачем эволюция замусорила ДНК — РИА Новости, 15.05.2018
Прыгающие гены, или Зачем эволюция замусорила ДНК
Большая часть ДНК человека приходится на разнообразный генетический мусор: простые повторы нуклеотидов, фрагменты вирусных геномов, гены, переставшие. .. РИА Новости, 15.05.2018
.. РИА Новости, 15.05.2018
2018-05-15T08:00
2018-05-15T08:00
2018-05-15T08:27
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/sharing/article/1520545382.jpg?15203225281526362038
сша
ссср
мюнстер
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2018
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
сша, ссср, мюнстер
Наука, США, СССР, Мюнстер
МОСКВА, 15 мая — РИА Новости, Татьяна Пичугина. Большая часть ДНК человека приходится на разнообразный генетический мусор: простые повторы нуклеотидов, фрагменты вирусных геномов, гены, переставшие функционировать миллионы лет назад, или обрывки генов, не выполняющие никакой функции. Некоторые последовательности нуклеотидов могут внезапно менять расположение в геноме или плодить многочисленные копии — это так называемые прыгающие, эгоистичные гены, мобильные элементы (транспозоны). Ученые раньше рассматривали их как паразитов, сейчас считается, что они влияют на эволюцию.
29 января 2015, 20:00
Генетические паразиты помогли млекопитающим «изобрести» беременностьМолекулярные биологи выяснили, почему наши далекие предки внезапно перешли от откладывания яиц к вынашиванию плода внутри утробы — оказалось, что в этом могут быть виноваты транспозоны, своеобразные внутренние генетические паразиты, осуществившие масштабную «перестройку» генома.
Мобильные элементы в ДНК открыла американская исследовательница Барбара Мак-Клинток в конце 1940-х годов. Прошло почти тридцать лет, прежде чем научное сообщество поверило в то, что геном организма не статичен, а способен меняться, причем в течение жизни одной особи. Пониманию этого помогли работы советских ученых, которые в 1976 году выявили мобильные элементы в геноме мухи-дрозофилы. И все же научный мир долго не осознавал того факта, что, как выяснилось после полной расшифровки генома человека в 2000 году, половина его занята этими странными блуждающими образованиями.
Сейчас известно, что ДНК многих животных, включая человека, в той или иной степени состоит из мобильных элементов. Большая их часть «молчит», то есть никак себя не проявляет. Но некоторые способны мобилизоваться и запустить цепочку реакций, приводящих к опасной мутации.
Большая их часть «молчит», то есть никак себя не проявляет. Но некоторые способны мобилизоваться и запустить цепочку реакций, приводящих к опасной мутации.
© Иллюстрация РИА Новости . Алина ПолянинаМобильные элементы в ДНК человека
© Иллюстрация РИА Новости . Алина Полянина
«Мобильные элементы представляют собой паразитические последовательности ДНК. Смысл их существования — в увеличении числа собственных копий в геноме. Однако эволюция иногда использует их в интересах организма-хозяина. Например, ген RAG участвует в перестроении иммуноглобулиновых цепей в процессе созревания лимфоцитов. Гены синситинов, которые произошли от эндогенных ретровирусов, способствуют образованию плаценты у млекопитающих», — рассказывает РИА Новости Геннадий Чураков, сотрудник Института экспериментальной патологии Университета Мюнстера (Германия).
Мобильные элементы — это по-разному организованные небольшие последовательности нуклеотидов размером от семидесяти до десяти тысяч нуклеотидных пар, что, вообще говоря, сравнимо с некоторыми короткими рабочими генами. Как и вирусы, они не могут функционировать самостоятельно, вне клетки хозяина. Однако устроены мобильные элементы проще, чем вирусы, и в отличие от них не способны самостоятельно покинуть клетку организма.
Как и вирусы, они не могут функционировать самостоятельно, вне клетки хозяина. Однако устроены мобильные элементы проще, чем вирусы, и в отличие от них не способны самостоятельно покинуть клетку организма.
21 апреля 2018, 08:00
Красивые и опасные: вирусы, от которых нет спасения
Запертые в геноме, транспозоны тем не менее перемещаются по ДНК, создают и встраивают в нее свои копии. Ученые полагают, что мобильные элементы легче приспособить для какой-то полезной работы.
«Это строительный материал эволюции. При получении полезной функции копия теряет мобильность», — подчеркивает Чураков.
Патогены или помощники эволюции?
Некоторые мобильные элементы вырезают сами себя из ДНК с помощью фермента транспозазы и вставляют в другое место — довольно случайным образом. Их называют ДНК-транспозонами. В геноме бактерий они выполняют важную функцию обмена генетической информацией между разными видами. Так, например, переносятся гены устойчивости к антибиотикам. У человека ДНК-транспозоны неактивны.
У человека ДНК-транспозоны неактивны.
Другой класс генетических паразитов — ретротранспозоны, названные так из-за особого механизма размножения. С элемента снимается копия в виде РНК и затем копируется в ДНК с помощью фермента обратной транскриптазы.
Ретротранспозоны могут самостоятельно хозяйничать в геноме, выполняя как полезные функции, так и портя ДНК хозяина.
26 ноября 2013, 02:17
Российские биологи исследовали у растений «человеческие» геныРоссийские ученые исследовали группу транспозонов — «генетических паразитов» — распространенных в ДНК людей и других млекопитающих, в геномах растений.
Например, эндогенные ретровирусы (HERV) особо активны у больных ревматоидным артритом, множественными склерозами, амиотрофическим латеральным склерозом и определенными видами рака желудочно-кишечного тракта. Однако прямых доказательств того, что эта разновидность ретротранспозонов влечет за собой болезнь, а не просто сопутствует ей, нет. Влияние этих прыгающих генов на нервные патологии, такие как шизофрения, тоже пока исследуется.
Влияние этих прыгающих генов на нервные патологии, такие как шизофрения, тоже пока исследуется.
Ретротранспозоны связаны с мутациями, вызывающими гемофилию А — несвертываемость крови, миодистрофию Дюшенна, бета-талассемию (недостаток гемоглобина). Мышечная дистрофия типа Фукуяма, распространенная среди японцев, тоже связана со вставкой копии ретротранспозонов. В целом мобильные элементы имеют отношение примерно к сотне генетических заболеваний.
С точки зрения эволюции встраивание ретротранспозона в какой-то ген не всегда играет негативную роль. Так, у большинства видов китов нет зубов. И это связано с тем, что в один из генов, необходимых для их роста, внедрена копия ретротранспозона. Зато киты приобрели замечательный фильтрующий планктон орган из китового уса, который ближе по структуре к волосу.
Ретротранспозоны помогают отследить эволюцию вида. Ведь однажды встроенная в ДНК копия никуда из этого места генома не перемещается. И если мы ее видим у двух видов, но не видим у третьего, то первые два вида, скорее всего, ближе друг к другу.
4 марта 2014, 02:23
Большую часть генома овощного перца составляют «генетические паразиты»Более 81% перечного генома состоит из транспозонов — небольших участков генома, которые способны копировать сами себя и встраивать новые копии в разные участки генома. При этом они не кодируют никаких полезных для организма белков, за что их иногда называют генетическими паразитами.
Возможна ли зачистка генома
Излишняя подвижность геномных паразитов, их способность плодить свои копии, которые могут поломать ДНК, вынудила клетку изобрести механизмы избавления от них. В частности, для этого используется особый тип коротких РНК — пивиРНК, помогающие специальному белку распознать опасность и убить активность транспозона. Это своего род иммунная система ДНК, блокирующая угрожающие генам мобильные элементы.
Другой механизм защиты — «каталог врагов». Если паразитическая ДНК мобилизуется, короткая РНК делает с нее копию, сравнивает с каталогом и, обнаружив совпадение, разрезает опасный элемент с помощью ферментов.
2 января 2014, 23:04
«Генетические паразиты» в клетках мозга являются причиной шизофренииИвамото и его коллеги расшифровали геномы клеток мозга умерших людей, страдавших при жизни шизофренией, и обнаружили там ненормально большое количество копий транспозона LINE-1.
«Одноклеточная инфузория располагает двумя ядрами и специальным механизмом, который очищает вегетативное ядро от всех мобильных элементов. При этом система очистки (ДНК-сплайсинг) использует один из компонентов, полученный из «одомашненного» транспозона», — приводит еще один пример Геннадий Чураков.
Полностью очищать геном от транспозонов нельзя. По словам исследователя, часть их связана с работой клетки, как, например, Alu-повторы — вид ретротранспозонов, который есть у всех приматов, включая человека. Они регулируют активность генов, участвуют в процессах сплайсинга — собирания РНК генов из кусочков.
«Убрать все мобильные элементы мы не в состоянии, но, допустим, вырежем только те элементы, которые не играют активной роли в жизни клетки. Что будет? Размер нашего генома уменьшится примерно в два раза. Упадет неравномерная рекомбинация и резко замедлится… эволюция. Возможно, человеку придется распрощаться с разумной деятельностью, поскольку есть точка зрения, что активность ретротранспозонов типа LINE в нейронах помогает создавать необходимое разнообразие для образования ассоциативных цепочек», — поясняет исследователь.
Что будет? Размер нашего генома уменьшится примерно в два раза. Упадет неравномерная рекомбинация и резко замедлится… эволюция. Возможно, человеку придется распрощаться с разумной деятельностью, поскольку есть точка зрения, что активность ретротранспозонов типа LINE в нейронах помогает создавать необходимое разнообразие для образования ассоциативных цепочек», — поясняет исследователь.
4 июля 2017, 15:16
ДНК-рекордсмены: как соотносятся между собой геномы человека и червяка
Наверное, имеет смысл удалить те мобильные элементы, которые однозначно вызывают генетические дефекты. Это позволило бы избавиться от нескольких десятков генетических заболеваний. Но для этого сначала требуется тщательно изучить все функции «паразитов» в геноме человека.
Полностью чистый от транспозонов геном существует разве что у вирусов. У многоклеточного организма геном обычно сильно «заражен» паразитами, и это, как полагают ученые, расплата за возможность быстро меняться из поколения в поколение, приспосабливаясь к разным окружающим условиям, в том числе экстремальным. Если мобильных элементов в геноме ничтожно мало, то не исключено, что виду грозит вымирание, как, скажем, пчелам.
Если мобильных элементов в геноме ничтожно мало, то не исключено, что виду грозит вымирание, как, скажем, пчелам.
Между тем генные инженеры уже приспособили прыгающие гены для своих целей. Создав искусственный ДНК-транспозон под названием «спящая красавица», они выводят трансгенных животных для лабораторных опытов.
Спящие истоки как встроенная защита репликации эукариотической ДНК от нестабильности генома и развития болезней
1. Rivera-Mulia JC, Gilbert DM. Репликация больших геномов: разделяй и властвуй. Мол Ячейка. 2016;62(5):756–765. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Prioleau MN, MacAlpine DM. Истоки репликации ДНК — с чего начать? Гены Дев. 2016;30(15):1683–1697. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Fragkos M, et al. Активация ориджина репликации ДНК в пространстве и времени. Nat Rev Mol Cell Biol. 2015;16(6):360–374. [PubMed] [Академия Google]
4. Склафани Р.А., Holzen TM. Регуляция клеточного цикла репликации ДНК. Анну Рев Жене. 2007; 41: 237–280. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Анну Рев Жене. 2007; 41: 237–280. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Masai H, et al. Репликация ДНК хромосом эукариот: где, когда и как? Анну Рев Биохим. 2010;79:89–130. [PubMed] [Google Scholar]
6. Паркер М.В., Ботчан М.Р., Бергер Дж.М. Механизмы и регуляция инициации репликации ДНК у эукариот. Crit Rev Biochem Mol Biol. 2017: 1–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Сиддики К., Он К.Ф., Диффли Дж.Ф. Регуляция репликации ДНК у эукариот. Колд Спринг Харб Перспект Биол. 2013;5(9) [бесплатная статья PMC] [PubMed] [Google Scholar]
8. Белл С.П., Лабиб К. Удвоение хромосом у saccharomyces cerevisiae. Генетика. 2016;203(3):1027–1067. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Evrin C, et al. Двойной гексамерный комплекс MCM2-7 загружается в исходную ДНК во время лицензирования репликации эукариотической ДНК. Proc Natl Acad Sci U S A. 2009;106(48):20240–20245. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Remus D, et al. Согласованная загрузка двойных гексамеров Mcm2-7 вокруг ДНК во время лицензирования источника репликации ДНК. Клетка. 2009;139(4):719–730. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Remus D, et al. Согласованная загрузка двойных гексамеров Mcm2-7 вокруг ДНК во время лицензирования источника репликации ДНК. Клетка. 2009;139(4):719–730. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Gambus A, et al. MCM2-7 образуют двойные гексамеры лицензированного происхождения в экстракте яиц Xenopus. Дж. Биол. Хим. 2011;286(13):11855–11864. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Deegan TD, Diffley JF. MCM: одно кольцо, чтобы править всеми. Curr Opin Struct Biol. 2016; 37: 145–151. [PubMed] [Академия Google]
13. Ilves I, et al. Активация хеликазы MCM2-7 путем ассоциации с белками cdc45 и GINS. Мол Ячейка. 2010;37(2):247–258. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Moyer SE, Lewis PW, Botchan MR. Выделение комплекса Cdc45/Mcm2-7/GINS (CMG): кандидат в геликазу вилки репликации эукариотической ДНК. Proc Natl Acad Sci U S A. 2006;103(27):10236–10241. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Yeeles JT, et al. Регулируемая активация начала репликации эукариотической ДНК с помощью очищенных белков. Природа. 2015;519(7544): 431–435. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Yeeles JT, et al. Регулируемая активация начала репликации эукариотической ДНК с помощью очищенных белков. Природа. 2015;519(7544): 431–435. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Tognetti S, Riera A, Speck C. Включите двигатель: как активируется эукариотическая репликативная геликаза MCM2-7. Хромосома. 2015;124(1):13–26. [PubMed] [Google Scholar]
17. Блоу Дж. Дж., Датта А. Предотвращение повторной репликации хромосомной ДНК. Nat Rev Mol Cell Biol. 2005;6(6):476–486. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Ариас Э.Э., Уолтер Дж.К. Сила в количестве: предотвращение повторной репликации с помощью нескольких механизмов в эукариотических клетках. Гены Дев. 2007;21(5):497–518. [PubMed] [Google Scholar]
19. Truong LN, Wu X. Предотвращение повторной репликации ДНК в эукариотических клетках. J Mol Cell Biol. 2011;3(1):13–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Alver RC, Chadha GS, Blow JJ. Вклад дремлющего происхождения в стабильность генома: от клеточной биологии до генетики человека. Ремонт ДНК (Амст) 2014; 19: 182–189. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ремонт ДНК (Амст) 2014; 19: 182–189. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Blow JJ, Ge XQ, Jackson DA. Как спящие истоки способствуют полной репликации генома. Тенденции биохимических наук. 2011;36(8):405–414. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Макинтош Д., Блоу Дж.Дж. Спящие истоки, контрольная точка лицензирования и реакция на репликативный стресс. Колд Спринг Харб Перспект Биол. 2012;4(10) [бесплатная статья PMC] [PubMed] [Google Scholar]
23. Woodward AM, et al. Избыток Mcm2-7 лицензирует дремлющие ориджины репликации, которые можно использовать в условиях репликативного стресса. Джей Селл Биол. 2006;173(5):673–683. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Ge XQ, Jackson DA, Blow JJ. Спящие истоки, лицензируемые избытком Mcm2-7, необходимы клеткам человека для выживания в условиях репликативного стресса. Гены Дев. 2007;21(24):3331–3341. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Ibarra A, Schwob E, Mendez J. Избыточные белки MCM защищают клетки человека от репликативного стресса, лицензируя резервные источники репликации. Proc Natl Acad Sci U S A. 2008;105(26):8956–8961. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Избыточные белки MCM защищают клетки человека от репликативного стресса, лицензируя резервные источники репликации. Proc Natl Acad Sci U S A. 2008;105(26):8956–8961. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Ryu S, et al. Истощение поддерживающего белка 5 минихромосомы в сетчатке рыбок данио вызывает дефект клеточного цикла и апоптоз. Proc Natl Acad Sci U S A. 2005;102(51):18467–18472. [бесплатная статья PMC] [PubMed] [Google Scholar]
27. Kunnev D, et al. Реакция на повреждение ДНК и онкогенез у мышей с дефицитом Mcm2. Онкоген. 2010;29(25): 3630–3638. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Kawabata T, et al. Спасение от остановленной вилки через спящие точки начала репликации в незатронутой S-фазе способствует правильной сегрегации хромосом и подавлению опухоли. Мол Ячейка. 2011;41(5):543–553. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Yekezare M, Gomez-Gonzalez B, Diffley JF. Контроль источников репликации ДНК в ответ на повреждение ДНК — ингибировать глобально, активировать локально. Дж. Клеточные науки. 2013; 126 (часть 6): 1297–1306. [PubMed] [Академия Google]
Дж. Клеточные науки. 2013; 126 (часть 6): 1297–1306. [PubMed] [Академия Google]
30. Белл С.П., Стиллман Б. АТФ-зависимое распознавание эукариотических источников репликации ДНК мультибелковым комплексом. Природа. 1992;357(6374):128–134. [PubMed] [Google Scholar]
31. Miotto B, Ji Z, Struhl K. Избирательность сайтов связывания ORC и связь со временем репликации: хрупкие сайты и делеции при раке. Proc Natl Acad Sci U S A. 2016;113(33):E4810–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Hua XH, Newport J. Идентификация этапа преинициации в репликации ДНК, который не зависит от комплекса распознавания происхождения и cdc6, но зависит от cdk2. Джей Селл Биол. 1998;140(2):271–281. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Gros J, Devbhandari S, Remus D. Исходная пластичность во время репликации ДНК почкующихся дрожжей in vitro. EMBO J. 2014;33(6):621–636. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Rowles A, Tada S, Blow JJ. Изменения в ассоциации комплекса распознавания ориджинов Xenopus с хроматином при лицензировании ориджинов репликации. Дж. Клеточные науки. 1999; 112 (часть 12): 2011–2018. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Изменения в ассоциации комплекса распознавания ориджинов Xenopus с хроматином при лицензировании ориджинов репликации. Дж. Клеточные науки. 1999; 112 (часть 12): 2011–2018. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Edwards MC, et al. Комплексы MCM2-7 связывают хроматин распределенным образом, окружая комплекс распознавания происхождения в экстрактах яиц Xenopus. Дж. Биол. Хим. 2002;277(36):33049–33057. [PubMed] [Google Scholar]
36. Sonneville R, et al. Динамика лицензирования репликации живых эмбрионов Caenorhabditis elegans. Джей Селл Биол. 2012;196(2):233–246. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Bowers JL, et al. Гидролиз АТФ с помощью ORC катализирует повторную сборку Mcm2-7 в определенном месте начала репликации. Мол Ячейка. 2004;16(6):967–978. [PubMed] [Google Scholar]
38. Das SP, et al. Время репликации регулируется количеством MCM, загруженных в источниках. Геном Res. 2015; 25(12):1886–1892. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Wong PG, et al. Cdc45 ограничивает использование репликона из-за низкой плотности preRCs в клетках млекопитающих. ПЛОС Один. 2011;6(3):e17533. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Wong PG, et al. Cdc45 ограничивает использование репликона из-за низкой плотности preRCs в клетках млекопитающих. ПЛОС Один. 2011;6(3):e17533. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Powell SK, et al. Динамическая загрузка и перераспределение геликазного комплекса Mcm2-7 по клеточному циклу. EMBO J. 2015;34(4):531–543. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Gros J, et al. Постлицензионная спецификация эукариотических источников репликации путем облегчения скольжения mcm2-7 по ДНК. Мол Ячейка. 2015;60(5):797–807. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Burkhart R, et al. Взаимодействие ядерных белков человека P1Mcm3 и P1Cdc46. Евр Дж Биохим. 1995;228(2):431–438. [PubMed] [Google Scholar]
43. Lei M, Kawasaki Y, Tye BK. Физические взаимодействия между белками Mcm и влияние дозы Mcm на репликацию ДНК в Saccharomyces cerevisiae. Мол Селл Биол. 1996;16(9):5081–5090. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Donovan S, et al. Cdc6p-зависимая загрузка белков Mcm на пререпликативный хроматин у почкующихся дрожжей. Proc Natl Acad Sci U S A. 1997;94(11):5611–5616. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Donovan S, et al. Cdc6p-зависимая загрузка белков Mcm на пререпликативный хроматин у почкующихся дрожжей. Proc Natl Acad Sci U S A. 1997;94(11):5611–5616. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Mahbubani HM, et al. Регуляция клеточного цикла системы лицензирования репликации: участие Cdk-зависимого ингибитора. Джей Селл Биол. 1997;136(1):125–135. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Symeonidou IE, et al. Многоступенчатая загрузка поддерживающих белков минихромосомы человека в живых клетках человека. Дж. Биол. Хим. 2013;288(50):35852–35867. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Kuipers MA, et al. Высокостабильная загрузка белков Mcm на хроматин в живых клетках требует репликации для разгрузки. Джей Селл Биол. 2011;192(1):29–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Бейли Р., Приего Морено С., Гамбус А. Прекращение вилок репликации ДНК: расщепление трудно сделать. Ядро. 2015;6(3):187–19.6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Maric M, et al. Cdc48 и убиквитинлигаза запускают разборку геликазы CMG в конце репликации ДНК. Наука. 2014;346(6208):1253596. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Moreno SP, et al. Полиубиквитилирование запускает разборку реплисом при прекращении репликации ДНК. Наука. 2014;346(6208):477–481. [PubMed] [Google Scholar]
51. Dewar JM, Budzowska M, Walter JC. Механизм терминации репликации ДНК у позвоночных. Природа. 2015;525(7569): 345–350. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Farkash-Amar S, et al. Глобальная организация часовых поясов репликации генома мыши. Геном Res. 2008;18(10):1562–1570. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Hiratani I, et al. Глобальная реорганизация доменов репликации во время дифференцировки эмбриональных стволовых клеток. PLoS биол. 2008;6(10):e245. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Besnard E, et al. Раскрытие характерных для типа клеток и репрограммируемых сигнатур источника репликации человека, связанных с консенсусными мотивами G-квадруплекса. Nat Struct Mol Biol. 2012;19(8): 837–844. [PubMed] [Google Scholar]
Раскрытие характерных для типа клеток и репрограммируемых сигнатур источника репликации человека, связанных с консенсусными мотивами G-квадруплекса. Nat Struct Mol Biol. 2012;19(8): 837–844. [PubMed] [Google Scholar]
55. Ge XQ, Blow JJ. Chk1 ингибирует активацию фабрики репликации, но допускает активацию неактивного источника в существующих фабриках. Джей Селл Биол. 2010;191(7):1285–1297. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Letessier A, et al. Программы инициации репликации, специфичные для типа клеток, устанавливают хрупкость сайта ломкости FRA3 B. Природа. 2011; 470(7332):120–123. [PubMed] [Google Scholar]
57. Ozeri-Galai E, et al. Неспособность активации происхождения в ответ на остановку вилки приводит к хромосомной нестабильности на хрупких участках. Мол Ячейка. 2011;43(1):122–131. [PubMed] [Академия Google]
58. Палакодети А. и др. Нарушенная динамика репликации в общем хрупком сайте FRA3 B. Хум Мол Жене. 2010;19(1):99–110. [бесплатная статья PMC] [PubMed] [Google Scholar]
59. Kunnev D, et al. Влияние дефицита поддерживающего белка 2 минихромосомы на места начала репликации ДНК. Геном Res. 2015;25(4):558–569. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Kunnev D, et al. Влияние дефицита поддерживающего белка 2 минихромосомы на места начала репликации ДНК. Геном Res. 2015;25(4):558–569. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Shreeram S, et al. Типоспецифические ответы клеток человека на ингибирование лицензирования репликации. Онкоген. 2002;21(43):6624–6632. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Невис К.Р., Кордейро-Стоун М., Кук Дж.Г. Лицензирование происхождения и статус p53 регулируют активность Cdk2 во время клеточного цикла G(1) ABBV. 2009;8(12):1952–1963. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Alvarez S, et al. Стресс репликации, вызванный низкой экспрессией MCM, ограничивает эритропоэз плода и функциональность гемопоэтических стволовых клеток. Нац коммун. 2015;6:8548. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Ciccia A, Elledge SJ. Реакция на повреждение ДНК: безопасные игры с ножами. Мол Ячейка. 2010;40(2):179–204. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Orr SJ, et al. Снижение уровня MCM в первичных Т-клетках человека во время перехода G(0) > G(1) вызывает нестабильность генома в течение первого клеточного цикла. Онкоген. 2010;29(26):3803–3814. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Orr SJ, et al. Снижение уровня MCM в первичных Т-клетках человека во время перехода G(0) > G(1) вызывает нестабильность генома в течение первого клеточного цикла. Онкоген. 2010;29(26):3803–3814. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Nusse M, et al. Анализ распределения содержания ДНК в микроядрах с помощью проточной сортировки и флуоресцентной гибридизации in situ с центромерным ДНК-зондом. Мутагенез. 1996;11(4):405–413. [PubMed] [Академия Google]
66. Lukas C, et al. Ядерные тельца 53BP1 формируются вокруг повреждений ДНК, вызванных митотической передачей хромосом в условиях стресса репликации. Nat Cell Biol. 2011;13(3):243–253. [PubMed] [Google Scholar]
67. Harrigan JA, et al. Стресс репликации индуцирует 53BP1-содержащие домены OPT в клетках G1. Джей Селл Биол. 2011;193(1):97–108. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Luebben SW, et al. Сопутствующая потеря дремлющего происхождения и FANCC усугубляет нестабильность генома, нарушая прогрессирование вилки репликации ДНК. Нуклеиновые Кислоты Res. 2014;42(9): 5605–5615. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res. 2014;42(9): 5605–5615. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Moreno A, et al. Нереплицированная ДНК, оставшаяся от невозмущенных S-фаз, проходит через митоз для разрешения в дочерних клетках. Proc Natl Acad Sci U S A. 2016;113(39):E5757–64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Passerini V, et al. Наличие дополнительных хромосом приводит к нестабильности генома. Нац коммун. 2016;7:10754. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Minocherhomji S, et al. Стресс репликации активирует синтез репарации ДНК в митозе. Природа. 2015; 528(7581):286–290. [PubMed] [Google Scholar]
72. Bergoglio V, et al. Синтез ДНК с помощью Pol η способствует стабильности хрупких сайтов, предотвращая недореплицирование ДНК в митозе. Джей Селл Биол. 2013;201(3):395–408. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Shima N, et al. Жизнеспособный аллель Mcm4 вызывает нестабильность хромосом и аденокарциному молочной железы у мышей. Нат Жене. 2007;39(1):93–98. [PubMed] [Google Scholar]
Нат Жене. 2007;39(1):93–98. [PubMed] [Google Scholar]
74. Pruitt SC, Bailey KJ, Freeland A. Снижение экспрессии mcm2 приводит к тяжелому дефициту стволовых клеток/клеток-предшественников и раку. Стволовые клетки. 2007;25(12):3121–3121. [PubMed] [Академия Google]
75. Chuang CH, et al. Дополнительные генетические нарушения экспрессии MCM2-7 и внутриклеточного распределения показывают исключительную чувствительность мышей к стрессу репликации ДНК. Генетика PLoS. 2010;6(9) [бесплатная статья PMC] [PubMed] [Google Scholar]
76. Shima N, et al. Идентификация на основе фенотипа мутантов нестабильности хромосом мыши. Генетика. 2003;163(3):1031–1040. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Bai G, Smolka MB, Schimenti JC. Хронический стресс репликации ДНК снижает репликативную продолжительность жизни клеток за счет TRP53-зависимого подавления MCM2-7 с помощью микроРНК. Генетика PLoS. 2016;12(1):e1005787. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Wallace MD, et al. Роль путей ответа на повреждение ДНК в предотвращении канцерогенеза, вызванного внутренним стрессом репликации. Онкоген. 2014;33(28):3688–3695. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Wallace MD, et al. Роль путей ответа на повреждение ДНК в предотвращении канцерогенеза, вызванного внутренним стрессом репликации. Онкоген. 2014;33(28):3688–3695. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Pan H, Deng Y, Pollard JW. Прогестерон блокирует эстроген-индуцированный синтез ДНК посредством ингибирования лицензирования репликации. Proc Natl Acad Sci U S A. 2006;103(38):14021–14026. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Kong S, et al. MCM2 опосредует индуцированную прогестероном пролиферацию и дифференцировку стромальных клеток эндометрия у мышей. Эндокринный. 2016;53(2):595–606. [PubMed] [Google Scholar]
81. Bagley BN, et al. Доминантно действующий мышиный аллель Mcm4 вызывает хромосомные аномалии и способствует онкогенезу. Генетика PLoS. 2012;8(11):e1003034. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Rusiniak ME, et al. Дефицит Mcm2 приводит к коротким делециям, позволяющим с высоким разрешением идентифицировать гены, способствующие лимфобластной лимфоме. Онкоген. 2012;31(36):4034–4044. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Онкоген. 2012;31(36):4034–4044. [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Wallace MD, et al. Сравнительная онкогеномика предполагает, что ген нейрофибромина 1 (NF1) является движущей силой рака молочной железы. Генетика. 2012;192(2):385–396. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Kartha N, et al. Компонент ремоделирования хроматина arid1a является супрессором спонтанных опухолей молочных желез у мышей. Генетика. 2016;203(4):1601–1611. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Maser RS, et al. Хромосомно нестабильные опухоли мыши имеют геномные изменения, сходные с различными видами рака человека. Природа. 2007;447(7147):966–971. [Бесплатная статья PMC] [PubMed] [Google Scholar]
86. Li J, et al. PTEN: предполагаемый ген протеинтирозинфосфатазы, мутировавший при раке головного мозга, молочной железы и предстательной железы человека. Наука. 1997; 275 (5308): 1943–1947. [PubMed] [Google Scholar]
87. Suzuki A, et al. Высокая предрасположенность к раку и эмбриональная летальность связаны с мутацией гена-супрессора опухоли PTEN у мышей. Карр Биол. 1998;8(21):1169–1178. [PubMed] [Google Scholar]
Высокая предрасположенность к раку и эмбриональная летальность связаны с мутацией гена-супрессора опухоли PTEN у мышей. Карр Биол. 1998;8(21):1169–1178. [PubMed] [Google Scholar]
88. Ashworth TD, et al. Основанные на делеции механизмы активации Notch2 при T-ALL: ключевые роли рекомбиназы RAG и консервативного внутреннего сайта начала трансляции в Notch2. Кровь. 2010;116(25):5455–5464. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Weng AP, et al. Активирующие мутации NOTCh2 при остром Т-клеточном лимфобластном лейкозе человека. Наука. 2004;306(5694):269–271. [PubMed] [Google Scholar]
90. Cornen S, et al. Мутации и делеции ARID1A в опухолях молочной железы. Онкоген. 2012;31(38):4255–4256. [PubMed] [Google Scholar]
91. Cho HD, et al. Потеря экспрессии белка-супрессора опухоли ARID1A коррелирует с плохим прогнозом у пациентов с первичным раком молочной железы. J Рак молочной железы. 2015;18(4):339–346. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Мамо А. и др. Интегрированный геномный подход идентифицирует ARID1A как кандидатный ген-супрессор опухоли при раке молочной железы. Онкоген. 2012;31(16):2090–2100. [PubMed] [Google Scholar]
Мамо А. и др. Интегрированный геномный подход идентифицирует ARID1A как кандидатный ген-супрессор опухоли при раке молочной железы. Онкоген. 2012;31(16):2090–2100. [PubMed] [Google Scholar]
93. Kawabata T, et al. Сокращение лицензированных источников показывает специфическую для штамма динамику репликации у мышей. Геном Мамм. 2011;22(9-10):506–517. [Бесплатная статья PMC] [PubMed] [Google Scholar]
94. Bunz F, et al. Требование к p53 и p21 для поддержания ареста G2 после повреждения ДНК. Наука. 1998;282(5393):1497–1501. [PubMed] [Google Scholar]
95. Lee JH, Paul TT. Активация ATM двухцепочечной ДНК разрывает комплекс Mre11-Rad50-Nbs1. Наука. 2005;308(5721):551–554. [PubMed] [Google Scholar]
96. Shiloh Y, Ziv Y. Протеинкиназа ATM: регулирование клеточного ответа на генотоксический стресс и многое другое. Nat Rev Mol Cell Biol. 2013;14(4):197–210. [PubMed] [Google Scholar]
97. Kanu N, et al. RAD18: WRNIP1 и ATMIN способствуют передаче сигналов ATM в ответ на стресс репликации. Онкоген. 2016;35(30):4009–4019. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Онкоген. 2016;35(30):4009–4019. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Schmidt L, et al. ATMIN необходим для ATM-опосредованной передачи сигналов и привлечения 53BP1 к участкам повреждения ДНК при репликационном стрессе. Ремонт ДНК (Амст) 2014; 24: 122–130. [Бесплатная статья PMC] [PubMed] [Google Scholar]
99. Barlow C, et al. Мыши с дефицитом Атм: парадигма атаксии телеангиэктазии. Клетка. 1996;86(1):159–171. [PubMed] [Google Scholar]
100. Elson A, et al. Плейотропные дефекты у мышей с дефицитом белка атаксия-телеангиэктазия. Proc Natl Acad Sci U S A. 1996;93(23):13084–13089. [Бесплатная статья PMC] [PubMed] [Google Scholar]
101. Matsuoka S, Huang M, Elledge SJ. Связь ATM с регуляцией клеточного цикла протеинкиназой Chk2. Наука. 1998; 282 (5395): 1893–1897. [PubMed] [Google Scholar]
102. Chaturvedi P, et al. Chk2 млекопитающих является нижестоящим эффектором ATM-зависимого пути контрольной точки повреждения ДНК. Онкоген. 1999;18(28):4047–4054. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
103. Hirao A, et al. Chk2 является опухолевым супрессором, который регулирует апоптоз как в зависимости от мутации атаксии и телеангиэктазии (АТМ), так и независимо от АТМ. Мол Селл Биол. 2002;22(18):6521–6532. [Бесплатная статья PMC] [PubMed] [Google Scholar]
104. Клейбл З., Кристенсен В.Н. Женщины с высоким риском рака молочной железы: молекулярные характеристики, клиническая картина и лечение. Грудь. 2016;28:136–144. [PubMed] [Google Scholar]
105. Kee Y, D’Andrea AD. Молекулярный патогенез и клиническое лечение анемии Фанкони. Джей Клин Инвест. 2012;122(11):3799–3806. [Бесплатная статья PMC] [PubMed] [Google Scholar]
106. Kottemann MC, Smogorzewska A. Анемия Фанкони и восстановление перекрестных связей ДНК Уотсона и Крика. Природа. 2013;493 (7432): 356–363. [Бесплатная статья PMC] [PubMed] [Google Scholar]
107. Михл Дж., Циммер Дж., Тарсунас М. Взаимодействие между анемией Фанкони и путями гомологичной рекомбинации в целостности генома. EMBO J. 2016;35(9):909–923. [Бесплатная статья PMC] [PubMed] [Google Scholar]
EMBO J. 2016;35(9):909–923. [Бесплатная статья PMC] [PubMed] [Google Scholar]
108. Мамрак Н.Е., Шимамура А., Хоулетт Н.Г. Недавние открытия в молекулярном патогенезе синдрома наследственной недостаточности костного мозга анемии Фанкони. Blood Rev. 2017; 31 (3): 93–99. [Бесплатная статья PMC] [PubMed] [Google Scholar]
109. Garcia-Higuera I, et al. Взаимодействие белков анемии Фанкони и BRCA1 по общему пути. Мол Ячейка. 2001;7(2):249–262. [PubMed] [Google Scholar]
110. Taniguchi T, et al. Специфическое для S-фазы взаимодействие белка анемии Фанкони: FANCD2, с BRCA1 и RAD51. Кровь. 2002;100(7):2414–2420. [PubMed] [Google Scholar]
111. Howlett NG, et al. Путь анемии Фанкони необходим для ответа на стресс репликации ДНК и для регуляции стабильности общего хрупкого сайта. Хум Мол Жене. 2005;14(5):693–701. [PubMed] [Google Scholar]
112. Chan KL, et al. Стресс репликации индуцирует образование мостиков между сестринскими хроматидами в локусах хрупких сайтов в митозе. Nat Cell Biol. 2009;11(6):753–760. [PubMed] [Google Scholar]
Nat Cell Biol. 2009;11(6):753–760. [PubMed] [Google Scholar]
113. Naim V, Rosselli F. Путь FANC и BLM взаимодействуют во время митоза, чтобы предотвратить микронуклеацию и хромосомные аномалии. Nat Cell Biol. 2009;11(6):761–768. [PubMed] [Google Scholar]
114. Ying S, et al. MUS81 способствует экспрессии общего хрупкого сайта. Nat Cell Biol. 2013;15(8):1001–1007. [PubMed] [Академия Google]
115. Houghtaling S, et al. Эпителиальный рак у нокаутных мышей группы D2 (Fancd2) с комплементацией анемии Фанкони. Гены Дев. 2003;17(16):2021–2035. [Бесплатная статья PMC] [PubMed] [Google Scholar]
116. Carreau M. Не совсем новые фенотипы в модели мыши D2 группы анемии Фанкони. Кровь. 2004;103(6):2430. [PubMed] [Google Scholar]
117. Lossaint G, et al. FANCD2 связывает белки MCM и контролирует функцию реплисом при активации передачи сигналов контрольной точки s-фазы. Мол Ячейка. 2013;51(5):678–69.0. [PubMed] [Google Scholar]
118. Panneerselvam J, et al. Базовый уровень моноубиквитинирования FANCD2 необходим для поддержания достаточного количества источников лицензированной репликации для запуска с нормальной скоростью. Онкотаргет. 2014;5(5):1326–1337. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Базовый уровень моноубиквитинирования FANCD2 необходим для поддержания достаточного количества источников лицензированной репликации для запуска с нормальной скоростью. Онкотаргет. 2014;5(5):1326–1337. [Бесплатная статья PMC] [PubMed] [Google Scholar]
119. Chen YH, et al. Опосредованное ATR фосфорилирование FANCI регулирует возбуждение покоящегося начала в ответ на стресс репликации. Мол Ячейка. 2015;58(2):323–338. [Бесплатная статья PMC] [PubMed] [Google Scholar]
120. Song IY, et al. Новая роль эффекторного белка пути анемии Фанкони (FA) FANCD2 в развитии клеточного цикла нетрансформированных первичных клеток человека. Клеточный цикл ABBV. 2010;9(12):2375–2388. [PubMed] [Google Scholar]
121. Madireddy A, et al. FANCD2 облегчает репликацию через общие хрупкие сайты. Мол Ячейка. 2016;64(2):388–404. [Бесплатная статья PMC] [PubMed] [Google Scholar]
122. Smogorzewska A, et al. Идентификация белка FANCI: моноубиквитинированного паралога FANCD2, необходимого для репарации ДНК. Клетка. 2007;129(2): 289–301. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клетка. 2007;129(2): 289–301. [Бесплатная статья PMC] [PubMed] [Google Scholar]
123. Sims AE, et al. FANCI является вторым моноубиквитинированным представителем пути развития анемии Фанкони. Nat Struct Mol Biol. 2007;14(6):564–567. [PubMed] [Google Scholar]
124. Ishiai M, et al. Фосфорилирование FANCI действует как молекулярный переключатель, который включает путь анемии Фанкони. Nat Struct Mol Biol. 2008;15(11):1138–1146. [Бесплатная статья PMC] [PubMed] [Google Scholar]
125. Ge XQ, et al. Эмбриональные стволовые клетки лицензируют высокий уровень спящих источников для защиты генома от стресса репликации. Отчет о стволовых клетках, 2015; 5(2):185–19.4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
126. Flach J, et al. Репликационный стресс является мощным фактором функционального снижения стареющих гемопоэтических стволовых клеток. Природа. 2014;512(7513):198–202. [Бесплатная статья PMC] [PubMed] [Google Scholar]
127. Gineau L, et al. Частичный дефицит MCM4 у пациентов с задержкой роста, надпочечниковой недостаточностью и дефицитом естественных клеток-киллеров. Джей Клин Инвест. 2012;122(3):821–832. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Инвест. 2012;122(3):821–832. [Бесплатная статья PMC] [PubMed] [Google Scholar]
128. Hughes CR, et al. Мутация MCM4 вызывает надпочечниковую недостаточность: низкий рост и дефицит естественных клеток-киллеров у людей. Джей Клин Инвест. 2012;122(3):814–820. [Бесплатная статья PMC] [PubMed] [Google Scholar]
129. Casey JP, et al. Рецессивные мутации в MCM4/PRKDC вызывают новый синдром, включающий первичный иммунодефицит и нарушение репарации ДНК. J Med Genet. 2012;49(4):242–245. [PubMed] [Google Scholar]
130. Моритани М., Ишими Ю. Ингибирование ДНК-связывания комплекса MCM2-7 путем фосфорилирования циклинзависимыми киназами. Дж Биохим. 2013;154(4):363–372. [PubMed] [Google Scholar]
131. Lee C, et al. Структурная основа ингибирования фактора лицензирования репликации Cdt1 геминином. Природа. 2004;430(7002):913–917. [PubMed] [Google Scholar]
132. Ishimi Y, et al. Уровни фосфорилирования MCM4 и синтеза ДНК в контрольной точке блока репликации ДНК. J Struct Biol. 2004;146(1-2):234–241. [PubMed] [Google Scholar]
J Struct Biol. 2004;146(1-2):234–241. [PubMed] [Google Scholar]
133. Bicknell LS, et al. Мутации в ORC1: кодирующая самую большую субъединицу комплекса распознавания происхождения, вызывают микроцефальную примордиальную карликовость, напоминающую синдром Мейера-Горлина. Нат Жене. 2011;43(4):350–355. [PubMed] [Google Scholar]
134. Guernsey DL, et al. Мутации в гене комплекса распознавания происхождения ORC4 вызывают синдром Мейера-Горлина. Нат Жене. 2011;43(4):360–364. [PubMed] [Академия Google]
135. Bicknell LS, et al. Мутации в пререпликационном комплексе вызывают синдром Мейера-Горлина. Нат Жене. 2011;43(4):356–359. [Бесплатная статья PMC] [PubMed] [Google Scholar]
136. de Munnik SA, et al. Исследования генотипа-фенотипа синдрома Мейера-Горлина: 35 человек с пререпликационными сложными генными мутациями и 10 без молекулярного диагноза. Eur J Hum Genet. 2012;20(6):598–606. [Бесплатная статья PMC] [PubMed] [Google Scholar]
137. de Munnik SA, et al. Синдром Мейера-Горлина. Orphanet J Rare Dis. 2015;10:114. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Синдром Мейера-Горлина. Orphanet J Rare Dis. 2015;10:114. [Бесплатная статья PMC] [PubMed] [Google Scholar]
138. Шэнь З. Комплекс распознавания происхождения болезней человека. Biosci Rep. 2013;33(3) [бесплатная статья PMC] [PubMed] [Google Scholar]
139. de Munnik SA, et al. Синдром Мейера-Горлина: рост и вторичное половое развитие микроцефальной первичной карликовости. Am J Med Genet A. 2012;158A(11):2733–2742. [PubMed] [Google Scholar]
140. Шалев С.А., и соавт. Дальнейшее понимание фенотипа, связанного с мутацией в гене ORC6: вызывает синдром Мейера-Горлина 3. Am J Med Genet A. 2015;167(3):607–611. [PubMed] [Академия Google]
141. Burrage LC, et al. Мутации GMNN de novo вызывают аутосомно-доминантную примордиальную карликовость, связанную с синдромом Мейера-Горлина. Am J Hum Genet. 2015;97(6):904–913. [Бесплатная статья PMC] [PubMed] [Google Scholar]
142. Wohlschlegel JA, et al. Ингибирование репликации эукариотической ДНК за счет связывания геминина с Cdt1. Наука. 2000;290(5500):2309–2312. [PubMed] [Google Scholar]
Наука. 2000;290(5500):2309–2312. [PubMed] [Google Scholar]
143. McGarry TJ, Kirschner MW. Геминин, ингибитор репликации ДНК, разрушается во время митоза. Клетка. 1998;93(6):1043–1053. [PubMed] [Google Scholar]
144. Fenwick AL, et al. Мутации в CDC45: кодирующий важный компонент преинициативного комплекса, вызывают синдром Мейера-Горлина и краниосиностоз. Am J Hum Genet. 2016;99(1):125–138. [Бесплатная статья PMC] [PubMed] [Google Scholar]
145. Kuo AJ, et al. Домен BAH ORC1 связывает h5K20me2 с лицензированием репликации ДНК и синдромом Мейера-Горлина. Природа. 2012;484(7392):115–119. [Бесплатная статья PMC] [PubMed] [Google Scholar]
146. Kerzendorfer C, et al. Синдром Мейера-Горлина и синдром Вольфа-Хиршхорна: два нарушения развития, подчеркивающие важность эффективной репликации ДНК для нормального развития и нейрогенеза. Восстановление ДНК (Амст) 2013;12(8):637–644. [PubMed] [Google Scholar]
147. Zhang W, et al. Мутация синдрома Мейера-Горлина нарушает ассоциацию ORC1-нуклеосома. ACS Chem Biol. 2015;10(5):1176–1180. [PMC free article] [PubMed] [Google Scholar]
ACS Chem Biol. 2015;10(5):1176–1180. [PMC free article] [PubMed] [Google Scholar]
148. Баласов М., Ахметова К., Чесноков И. Модель синдрома Мейера-Горлина у дрозофил, основанная на мутации в консервативном С-концевом домене Orc6. Am J Med Genet A. 2015;167A(11):2533–2540. [Бесплатная статья PMC] [PubMed] [Google Scholar]
149. Bleichert F, et al. Мутация синдрома Мейера-Горлина в консервативной С-концевой спирали Orc6 препятствует образованию комплекса распознавания происхождения. Элиф. 2013;2:e00882. [Статья бесплатно PMC] [PubMed] [Google Scholar]
150. Хоссейн М., Стиллман Б. Мутации синдрома Мейера-Горлина нарушают ингибирующий домен Orc1 CDK и вызывают редупликацию центросом. Гены Дев. 2012;26(16):1797–1810. [Бесплатная статья PMC] [PubMed] [Google Scholar]
151. Stiff T, et al. Дефицит белков лицензирования происхождения нарушает формирование ресничек: последствия для этиологии синдрома Мейера-Горлина. Генетика PLoS. 2013;9(3):e1003360. [Бесплатная статья PMC] [PubMed] [Google Scholar]
152. Vetro A, et al. MCM5: новый участник связи между репликацией ДНК и синдромом Мейера-Горлина. Eur J Hum Genet. 2017;25(5):646–650. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Vetro A, et al. MCM5: новый участник связи между репликацией ДНК и синдромом Мейера-Горлина. Eur J Hum Genet. 2017;25(5):646–650. [Бесплатная статья PMC] [PubMed] [Google Scholar]
153. Cottineau J, et al. Наследственный дефицит GINS1 лежит в основе задержки роста наряду с нейтропенией и дефицитом NK-клеток. Джей Клин Инвест. 2017;127(5):1991–2006. [Бесплатная статья PMC] [PubMed] [Google Scholar]
154. Gao J, et al. Секвенирование полного экзома идентифицировало MCM2 как новый причинный ген аутосомно-доминантной несиндромальной глухоты в китайской семье. ПЛОС Один. 2015;10(7):e0133522. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Человеческая способность впадать в спячку может быть скрыта в генетическом коде
Это делают медведи. Как и сурки, белки, черепахи и многие другие животные. Однако люди не могут впадать в спячку — по крайней мере, сейчас.
Но ученые, изучающие генетические основы зимней спячки у животных, думают, что они могут разблокировать ту же самую биологическую сверхспособность у людей. Этот подвиг может трансформировать медицинскую помощь как во время обычных операций, так и при тяжелых неотложных состояниях, когда пациенты не могут немедленно получить доступ к жизненно важному лечению. Это также может позволить астронавтам отложить свой путь в длительных миссиях на Марс и в другие пункты назначения в глубоком космосе.
Этот подвиг может трансформировать медицинскую помощь как во время обычных операций, так и при тяжелых неотложных состояниях, когда пациенты не могут немедленно получить доступ к жизненно важному лечению. Это также может позволить астронавтам отложить свой путь в длительных миссиях на Марс и в другие пункты назначения в глубоком космосе.
Ученые считают, что способность впадать в спячку возникла у первых предков млекопитающих — мохнатых древесных существ, которые жили 65 миллионов лет назад и в конечном итоге дали начало большинству современных млекопитающих, включая человека. Если они правы, ключи к гибернации могут быть скрыты в геноме человека.
«Это звучит как научная фантастика, но в этом есть абсолютная биологическая правда, и мы использовали все виды сравнительной геномики и другие инструменты, чтобы понять универсальность», — говорит Энн Йодер, биолог из Университета Дьюка, изучающая гибернацию. «Практически все в этой области согласны с тем, что это наследственная способность млекопитающих, которую большинство млекопитающих утратили или просто не используют».
Основы гибернации
Спящий режим — это гораздо больше, чем продолжительный сон. Это приводит к резким изменениям в обмене веществ, в том числе к падению температуры тела и снижению частоты сердечных сокращений и дыхания. Некоторые теплокровные животные проводят недели, в течение которых температура их тела падает с примерно 37 градусов по Цельсию до всего лишь 3 градусов по Цельсию, их сердце бьется всего несколько раз в минуту, а потребление энергии телом резко падает.
Ученых особенно интересуют механизмы, позволяющие входящим в спячку животным возвращаться к полной активности вскоре после пробуждения и избегать проблем со здоровьем, которые возникают у людей после нескольких недель пребывания в постели. К ним относятся потеря костной массы, сердечно-сосудистые проблемы и истощение мышц.
«Приложения, которые мы рассматриваем, основаны на нашем понимании того, что эти животные должны делать, чтобы пережить спячку в течение года», — говорит Эшли Цендер, генеральный директор Fauna Bio, стартапа из Сан-Франциско, который работает над разработкой препараты для введения человека в спячку.
По крайней мере с 2002 года врачи отделения неотложной помощи используют защитную силу гибернации, используя пакеты со льдом и охлаждающие одеяла для временного снижения температуры тела пациентов, которые находятся в критическом состоянии в результате сердечного приступа, черепно-мозговой травмы, инсульта. или шок. Снижение температуры тела всего на несколько градусов Цельсия может защитить мозг, в частности, за счет замедления метаболизма, уменьшения отека и задержки гибели клеток головного мозга, которая обычно может происходить из-за недостатка кровотока.
Но цель состоит в том, чтобы заменить этот грубый метод охлаждения, который может вызывать проблемы со свертываемостью крови и мешать иммунным реакциям, на процесс, который работает «естественно, безопасно и обратимо», — говорит Ханна Кэри, профессор сравнительных биологических наук. в Школе ветеринарной медицины Университета Висконсин-Мэдисон. Ее лаборатория работает с Fauna Bio над обменом данными о гибернации в рамках более широкого сотрудничества между стартапом, финансируемым из частных источников, и научным сообществом по гибернации.
Если такое исследование увенчается успехом, Fauna Bio надеется заменить пакеты со льдом лекарством, которое может вводить людей в спячку, напрямую снижая их метаболизм. В результате естественным образом следовало бы более мягкое охлаждение тела.
Расшифровка прошлого гибернации для будущего
Чтобы создать чудо-лекарство от гибернации, исследователи должны сначала выяснить, какие группы генов активируются в процессе гибернации. Вот почему Fauna Bio обращается ко многим независимым группам по исследованию зимней спячки, чтобы объединить коллекции биологических тканей разных животных, впадающих в спячку, с новыми базами данных секвенированных геномов.
Например, Кэти Грабек, соучредитель и руководитель отдела корпоративного управления Fauna Bio, разработала анализ секвенирования генома генома суслика с 13 линиями. Таких сусликов, как правило, гораздо легче изучать, чем других животных, впадающих в спячку, таких как находящиеся под угрозой исчезновения лемуры и потенциально опасные медведи, хотя некоторые упрямые исследователи зимней спячки тоже изучают этих животных.
Все эти разные животные не обязательно имеют специальные гены, уникальные для каждого вида, говорит Уилл Исраэльсен, научный сотрудник в области биохимии в Юго-западном медицинском центре Техасского университета в Далласе, штат Техас, который изучает спячку у прыгающих мышей. Вместо этого у гибернаторов, вероятно, есть все те же гены, связанные со спячкой, но каждый вид использует их немного по-разному. «Если мы сможем выяснить, как они регулируют свою биологию, мы сможем манипулировать этим у людей на благо медицины», — говорит Исраэльсен.
Конечно, медицинские льготы на Земле также могут быть переведены на медицинские льготы в космосе. SpaceWorks, аэрокосмическая инженерная фирма из Атланты, использует финансирование НАСА для изучения того, как спящий режим может защитить астронавтов от радиационного поражения, потери костей и мышц и других проблем со здоровьем во время шестимесячных космических миссий на Марс. Компания составляет техническое руководство по погружению будущих астронавтов в спячку на основе текущих медицинских процедур скорой помощи.
Даже подход современной медицины к «целевому управлению температурой», который не соответствует полной гибернации, все же может защитить астронавтов и сделать будущие космические миссии более доступными и выполнимыми, говорит Дуг Толк, акушер и ведущий медицинский консультант SpaceWorks Enterprises. Перевод большей части экипажа в состояние с низким метаболизмом по сменам может устранить большую часть массы космического корабля, обычно предназначенную для хранения продуктов питания или увеличения жилого пространства.
Такой космический корабль мог бы обойтись даже меньшей радиационной защитой, если бы ее было достаточно для защиты спального отсека экипажа. Вся эта экономия массы космического корабля имеет огромное значение в то время, когда запуск чего-либо в космос все еще может стоить около 10 000 долларов за фунт. «Это медицинское решение инженерной проблемы», — говорит Толк.
Истинное пробуждение способности к гибернации у людей по-прежнему зависит от того, насколько верна теория предков млекопитающих. Но если спящие астронавты когда-нибудь проснутся и обнаружат, что готовы выйти на орбиту Марса, они смогут воздать должное биологической сверхспособности, которая создавалась миллионы лет.
Но если спящие астронавты когда-нибудь проснутся и обнаружат, что готовы выйти на орбиту Марса, они смогут воздать должное биологической сверхспособности, которая создавалась миллионы лет.
Хотите больше историй о биологии?
- Ученые подсчитали скорость смерти в клетках, и она на удивление медленная
- Таинственный ген, помогающий слонам бороться с раком И ИНСТАГРАМ.
Пробуди дремлющую ДНК, эпигенетически
1 сентября 2016 г. (Том 36, № 15)
Роб Ранульф Джонс Внештатный писатель GEN
Эпигенетика не ограничивается изучением меток на хроматине
Сначала это был просто предвестник: в 2001 году собрали воедино рудиментарный полный человеческий геном. Затем, всего два года спустя, произошло потрясающее извержение: завершение проекта «Геном человека». Это взрывное событие потрясло ландшафт молекулярной генетики и высвободило бионаучные силы, которые и по сей день не проявляют признаков ослабления.
Непрекращающиеся потоки академического мозгового штурма и коммерческих инноваций изменяют старые области и создают новые, в конечном итоге распространяя плодотворность на последующие дисциплины, такие как эпигенетика и эпигеномика.

Когда геномный вулкан извергся, даже самые дальновидные наблюдатели не могли предвидеть, какое влияние возрожденные и совершенно новые области биологии окажут на господствующую клиническую медицину и терапию. Более того, с тех пор были обнаружены эпигенетические связи с неврологией, нейропсихологией, физиологией и дюжиной популярных дисциплин исследований.
По сути, геномные и эпигеномные границы открыты. В настоящее время они используются учеными, решившими изучить разнообразие жизненных функций, синдромов, черт, предрасположенностей и моделей поведения, способствующих здоровью и благополучию.
В авангарде области эпигенетики основное внимание уделяется семейству белков бромодомена и экстратерминального домена (BET), которые нековалентно и селективно связываются с эпигенетически модифицированными (маркированными) боковыми цепями аминокислотных остатков на некоторых субъединицах гистоновых белков. Эти субъединицы гистонового белка находятся в хроматине.
ДНК обвивается вокруг каждого гистона, образуя компактную нуклеосому.
 Когда последовательность нуклеосом соединена линкерной ДНК, в результате получается структура хроматина «бусинка на нитке», которая служит для компактной упаковки ДНК внутри клеточного ядра. В хроматине стерическое взаимодействие, связывающее нуклеосомы и бромодомены, конформационно индуцирует множественные регуляторные эффекты транскрипции на пораженные гены в ДНК раны.
Когда последовательность нуклеосом соединена линкерной ДНК, в результате получается структура хроматина «бусинка на нитке», которая служит для компактной упаковки ДНК внутри клеточного ядра. В хроматине стерическое взаимодействие, связывающее нуклеосомы и бромодомены, конформационно индуцирует множественные регуляторные эффекты транскрипции на пораженные гены в ДНК раны.Существует много свидетельств того, что рациональное, преднамеренное молекулярное вмешательство или манипулирование этим нуклеосомным взаимодействием часто является мощным средством для благоприятного изменения паттерна транскрипции заболевания или биологического состояния расстройства.
ДНК связывается с гистоновыми белками с образованием хроматина. Автор Zephyris в англоязычной Википедии, CC BY-SA 3.0, BY-SA 3.0
Компании, ориентированные на эпигенетику
Были основаны новые специализированные предприятия для изучения и обнаружения клинических проявлений взаимодействия БЭТ.
 Ключевыми игроками в области эпигенетики бромодомена, особенно в том, что касается передовых клинических исследований, являются Resverlogix и Zenith Epigenetics. (Первая компания, созданная в 2001 году с целью изучения сердечно-сосудистых заболеваний, выделилась из второй в 2013 году). Обе компании занимаются почти исключительно эпигенетической регуляцией бромодомена или транскрипцией в исследованиях хроматина. У них есть разнообразный репертуар продуктов-кандидатов, проектов, а также экспериментальных и клинических знаний.
Ключевыми игроками в области эпигенетики бромодомена, особенно в том, что касается передовых клинических исследований, являются Resverlogix и Zenith Epigenetics. (Первая компания, созданная в 2001 году с целью изучения сердечно-сосудистых заболеваний, выделилась из второй в 2013 году). Обе компании занимаются почти исключительно эпигенетической регуляцией бромодомена или транскрипцией в исследованиях хроматина. У них есть разнообразный репертуар продуктов-кандидатов, проектов, а также экспериментальных и клинических знаний.Текущий основной клинический кандидат Resverlogix, RVX-208, теперь называемый апабеталоном, является селективным ингибитором бромодомена для BRD4 в сайте BD2. Он находится в фазе III испытаний для пациентов с сердечно-сосудистыми заболеваниями и сахарным диабетом 2 типа, и это единственный кандидат в эпигенетические препараты, имеющий такой статус.
Zenith Epigenetics занимается клиническими исследованиями в области онкологии и имеет ингибитор бромодомена, ZEN-3694, в фазе I испытаний для лечения формы трудноизлечимого метастатического рака предстательной железы (мКРРПЖ).
 Есть несколько известных сотрудничающих исследователей и групп, в том числе Эрик Смолл, доктор медицины, заведующий отделением гематологии и онкологии в Калифорнийском университете в Сан-Франциско, и Говард Шер, доктор медицины, руководитель онкологической службы мочеполовой системы в Мемориальном онкологическом центре имени Слоана Кеттеринга. Центр.
Есть несколько известных сотрудничающих исследователей и групп, в том числе Эрик Смолл, доктор медицины, заведующий отделением гематологии и онкологии в Калифорнийском университете в Сан-Франциско, и Говард Шер, доктор медицины, руководитель онкологической службы мочеполовой системы в Мемориальном онкологическом центре имени Слоана Кеттеринга. Центр.Ингибитор связывается с двумя участками бромодомена, BD1 и BD2, с относительно хорошей аффинностью при субмикромолярном уровне K D , что приводит к сильному благотворному эффекту за счет усиления определенных программ генов, подавляющих опухоль. Он также подавляет суперэнхансерную оркестровку нескольких генов, которые участвуют в транскрипции, которая способствует патогенезу многочисленных гематологических и солидных злокачественных опухолей. Кроме того, лекарство-кандидат, по-видимому, действует синергетически со стандартной химиотерапией и иммунотерапией.
Эрик Кампо, доктор философии, директор отдела биологии в Zenith Epigenetics.
 Что касается исследования фазы I, касающегося любого анализа транскриптомного и протеомного профиля пациентов, он отметил, что исследование включает вариации подтипов для терапевтической оптимизации. Первый пациент получил дозу в июне этого года.
Что касается исследования фазы I, касающегося любого анализа транскриптомного и протеомного профиля пациентов, он отметил, что исследование включает вариации подтипов для терапевтической оптимизации. Первый пациент получил дозу в июне этого года.Дональд Дж. Маккефри, соучредитель и главный исполнительный директор обеих компаний, сказал, что фирмы добились успеха, потому что они не только хорошо разбирались в клинических исследованиях, но и были способны разгадывать биологические сложности. В то время как многие другие фирмы могут иметь единую платформу для исследований, он утверждал, что у его компании была дюжина разработанных каркасов со многими соединениями в собственном банке, которые хорошо охарактеризованы и будущие кандидаты на испытания.
Помимо многообещающих результатов в лечении сердечно-сосудистых заболеваний и рака, ингибиторы-кандидаты продемонстрировали потенциал в отношении многих других заболеваний, таких как хроническая болезнь почек и деменция, вызванная болезнью Альцгеймера.

Компания каждую неделю получает звонки с предложениями от корпоративных или государственных учреждений, таких как Национальный институт старения США (NIA), о сотрудничестве в проектах, отметил МакКэффри, добавив, что такие предложения о сотрудничестве приветствуются, поскольку у них есть разнообразие продуктов и проектов с широким потенциалом применения. требует специализированных сотрудников.
NIA особенно обеспокоена любым лекарством, которое обещает облегчить социальное бремя, которое будет наложено слабоумием и истощением, вызванным болезнью Альцгеймера, угрозой, которая нависла над расширенным сегментом населения. По словам МакКэффри, апабеталон Resverlogix, будучи модулятором каскада комплемента и взаимодействуя с аполипопротеином A1, может иметь двоякое положительное действие при болезни Альцгеймера с ранним началом.
Эвелина Куликовски, доктор философии, является старшим вице-президентом по исследованиям и разработкам в Resverlogix. Отвечая на вопрос о любых других эпигенетических проектах, которые могут способствовать пониманию синдромов, расстройств или, возможно, субъектов, не являющихся болезнями, как это делается в геномных исследованиях, д-р Куликовский объяснил, что хорошо известно, что генетика и эпигенетика играют роль в различных расстройствах и как в поле растут новые связи.

Более того, в отличие от геномного профиля, эпигеномные профили поддаются модификации не только прямыми фармакологическими методами, но и экологическими или другими внешними факторами, такими как загрязнение, стресс, диета или питание. Эти факторы могут подключаться к биохимическим путям и приводить к эпигенетическим эффектам посредством метилирования/деметилирования или других способов маркировки ДНК, или посредством ацетилирования/деацетилирования или записи/стирания гистонов для последующего считывания бромодомена и транскриптивной регуляции генов.
Доктор Куликовский сослался на работу Крейга Б. Томпсона, доктора медицинских наук, президента и генерального директора Мемориального онкологического центра имени Слоана Кеттеринга. У доктора Томпсона есть целенаправленный проект, посвященный биохимическому метаболическому влиянию ацетил-КоА на эпигеном. Проект включает в себя исследование лежащих в основе механизмов, таких как те, которые участвуют в изменении доступности молекул донора ацетила для модификации гистонов.
 Аналогичная связь метаболического пути глутамина для молекул донора метила была исследована для эпигенетического метилирования ДНК и гистонов.
Аналогичная связь метаболического пути глутамина для молекул донора метила была исследована для эпигенетического метилирования ДНК и гистонов.Доктор Куликовский также упомянул о проекте компании по орфанным заболеваниям, а также о проверке концепции, которая может дополнительно охарактеризовать роль эпигенетики в модулировании критических путей, лежащих в основе ряда редких заболеваний.
Иммуноонкологические разработки
Constellation Pharmaceuticals, в первую очередь эпигенетическая компания, специализирующаяся на онкологии и иммуноонкологии, проводит испытания ингибитора BRD, CPI-610, и молекулы-мишени ацетилтрансферазы, CPI-1205. Роберт Симс, доктор философии, вице-президент по исследованиям, сказал, что около восьми других малых молекул находятся в доклинической разработке. В настоящее время не исследуются целевые препараты для нейронауки, но представляют интерес целевые препараты в других областях. К ним относятся мишени в вирусологии, воспалении и иммунологии.

Что касается проектов, не связанных с болезнями, доктор Симс отметил, что Constellation разработала инструменты сопоставления эпигенетических данных для опросных исследований, которые доступны в качестве информационно-просветительской работы для исследовательского сообщества. Что касается протеомики, он сказал, что у компании есть опыт в области протеомного анализа гистонов, который расширил ее базу знаний в области эпигенетической биологии. Он согласен с тем, что масс-спектрометрический анализ имеет ограничения и недостатки в анализе третичной и четвертичной структуры конформационных изменений гистоновой субъединицы, связанной с бромдоменом, в отношении биологической активности.
Отвечая на вопрос о будущих разработках, доктор Симс заявил, что основная цель и текущая миссия компании — разработка низкомолекулярных терапевтических средств. Constellation — это частное предприятие, которое имеет хороший портфель поддержки инвесторов и партнеров. Этот портфель продолжал расширяться с тех пор, как давний партнер Constellation, Genentech, прекратил сотрудничество и отказался от сделки по приобретению.
 В краткосрочной перспективе нет явного рассмотрения вопроса о стратегическом слиянии, поглощении или публичном размещении акций.
В краткосрочной перспективе нет явного рассмотрения вопроса о стратегическом слиянии, поглощении или публичном размещении акций.Доля поставщика
Ведущие поставщики биотехнологических материалов также следят за быстро развивающейся областью эпигенетики. Их цель состояла в том, чтобы предоставить исследователям эффективные наборы и оборудование для экономии времени, предназначенные для соответствующих экспериментальных процедур.
PerkinElmer, например, имеет каталог продуктов, готовых к использованию, а также другие продукты, находящиеся в разработке. Чтобы не отставать от достижений в области эпигенетики, компания наняла специализированный персонал из различных корпоративных или академических программ эпигенетических исследований. Компания ожидает, что ее эксперты, такие как старший научный сотрудник Даниэль Кардилло, будут использовать свое знакомство с литературой по экспериментальным протоколам для реализации коммерческих возможностей продажи.

У PerkinElmer есть несколько наборов для анализа, нацеленных на гистоны. Некоторые из них используют гомогенную AlphaLISA для связывания BRD4 и BRD2 и полезны для оптимизации исследований ингибиторов. Наборы для анализа на основе клеток готовы к продаже и разрабатываются для считывания белков бромодомена.
Epigentek и Zymo Research входят в число других поставщиков с обширным портфолио инструментов и расходных материалов для эпигенетических исследований.
Как и геномика, эпигенетика и эпигеномика продемонстрировали значительный прогресс за короткое время. Эти дисциплины, однако, также стали довольно сложными и запутанными с появлением новых открытий. Один факт бесспорен. В этих еще молодых областях есть глубокий и богатый неиспользованный ресурс знаний, который еще предстоит добыть.
Количественная оценка глобальных уровней 5-mC и 5-hmC
Глобальные изменения в статусе метилирования ДНК генома коррелируют с различными биологическими состояниями, включая развитие, старение и болезни.
 Глобальное гипометилирование цитозинов является отличительной чертой рака и в первую очередь отражает деметилирование повторяющихся элементов ДНК.
Глобальное гипометилирование цитозинов является отличительной чертой рака и в первую очередь отражает деметилирование повторяющихся элементов ДНК.«Точно так же глобальные изменения в уровнях варианта метилирования ДНК, 5-гидроксиметилцитозин (5-hmC), служат прогностическим индикатором при некоторых видах рака и нейродегенеративных расстройствах», — сказала Йоханна Самуэльссон, доктор философии, старший научный сотрудник Active. мотив Она указала, что для лучшего понимания того, как изменения в модификациях ДНК влияют на нормальные и болезненные состояния, крайне необходимы методы точного количественного определения глобального 5-метилцитозина (5-mC) и 5-hmC.
Active Motif предлагает анализы на основе чашек для проведения сравнительных исследований глобальных изменений 5-mC и 5-hmC, по словам Мабель Эш, доктора философии, менеджера по маркетинговым коммуникациям компании.
Набор Global DNA Methylation-LINE-1 фирмы измеряет метилирование консенсусной последовательности в человеческом повторяющемся длинном перемежающемся нуклеотидном элементе 1 (LINE-1), обычно используемом заменителе для глобальных уровней 5-mC, отметил д-р Эш, добавив, что это метод обеспечивает «более простую альтернативу традиционным методам количественного определения глобальных уровней 5-мС.



 Но и теперь она не может обходиться без подгузника. Девочка развивается замедленно, но гармонично.
Но и теперь она не может обходиться без подгузника. Девочка развивается замедленно, но гармонично.
 Когда последовательность нуклеосом соединена линкерной ДНК, в результате получается структура хроматина «бусинка на нитке», которая служит для компактной упаковки ДНК внутри клеточного ядра. В хроматине стерическое взаимодействие, связывающее нуклеосомы и бромодомены, конформационно индуцирует множественные регуляторные эффекты транскрипции на пораженные гены в ДНК раны.
Когда последовательность нуклеосом соединена линкерной ДНК, в результате получается структура хроматина «бусинка на нитке», которая служит для компактной упаковки ДНК внутри клеточного ядра. В хроматине стерическое взаимодействие, связывающее нуклеосомы и бромодомены, конформационно индуцирует множественные регуляторные эффекты транскрипции на пораженные гены в ДНК раны. Ключевыми игроками в области эпигенетики бромодомена, особенно в том, что касается передовых клинических исследований, являются Resverlogix и Zenith Epigenetics. (Первая компания, созданная в 2001 году с целью изучения сердечно-сосудистых заболеваний, выделилась из второй в 2013 году). Обе компании занимаются почти исключительно эпигенетической регуляцией бромодомена или транскрипцией в исследованиях хроматина. У них есть разнообразный репертуар продуктов-кандидатов, проектов, а также экспериментальных и клинических знаний.
Ключевыми игроками в области эпигенетики бромодомена, особенно в том, что касается передовых клинических исследований, являются Resverlogix и Zenith Epigenetics. (Первая компания, созданная в 2001 году с целью изучения сердечно-сосудистых заболеваний, выделилась из второй в 2013 году). Обе компании занимаются почти исключительно эпигенетической регуляцией бромодомена или транскрипцией в исследованиях хроматина. У них есть разнообразный репертуар продуктов-кандидатов, проектов, а также экспериментальных и клинических знаний. Есть несколько известных сотрудничающих исследователей и групп, в том числе Эрик Смолл, доктор медицины, заведующий отделением гематологии и онкологии в Калифорнийском университете в Сан-Франциско, и Говард Шер, доктор медицины, руководитель онкологической службы мочеполовой системы в Мемориальном онкологическом центре имени Слоана Кеттеринга. Центр.
Есть несколько известных сотрудничающих исследователей и групп, в том числе Эрик Смолл, доктор медицины, заведующий отделением гематологии и онкологии в Калифорнийском университете в Сан-Франциско, и Говард Шер, доктор медицины, руководитель онкологической службы мочеполовой системы в Мемориальном онкологическом центре имени Слоана Кеттеринга. Центр. Что касается исследования фазы I, касающегося любого анализа транскриптомного и протеомного профиля пациентов, он отметил, что исследование включает вариации подтипов для терапевтической оптимизации. Первый пациент получил дозу в июне этого года.
Что касается исследования фазы I, касающегося любого анализа транскриптомного и протеомного профиля пациентов, он отметил, что исследование включает вариации подтипов для терапевтической оптимизации. Первый пациент получил дозу в июне этого года.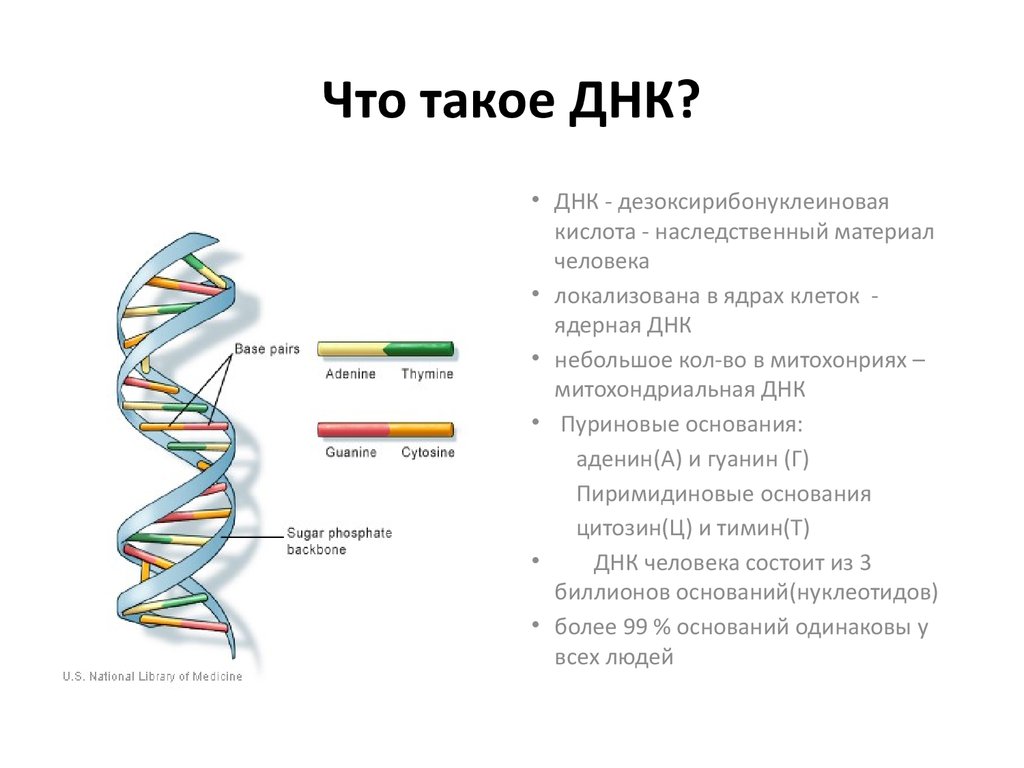

 Аналогичная связь метаболического пути глутамина для молекул донора метила была исследована для эпигенетического метилирования ДНК и гистонов.
Аналогичная связь метаболического пути глутамина для молекул донора метила была исследована для эпигенетического метилирования ДНК и гистонов.
 В краткосрочной перспективе нет явного рассмотрения вопроса о стратегическом слиянии, поглощении или публичном размещении акций.
В краткосрочной перспективе нет явного рассмотрения вопроса о стратегическом слиянии, поглощении или публичном размещении акций.
 Глобальное гипометилирование цитозинов является отличительной чертой рака и в первую очередь отражает деметилирование повторяющихся элементов ДНК.
Глобальное гипометилирование цитозинов является отличительной чертой рака и в первую очередь отражает деметилирование повторяющихся элементов ДНК.