Содержание
бактериофаг
бактериофаг
иначе фаг; вирус бактерий
(англ. bacteriophage)
— (от бактерии и греч. φᾰγω — «пожираю») – вирус, способный паразитировать в бактериальных клетках.
Описание
Вирусы, вызывающие гибель (лизис) инфицированных бактерий, известны как литические бактериофаги (фаги). Так называемые умеренные бактериофаги встраивают собственную ДНК в хромосому бактерии. Синтез вирус-специфических белков и нуклеиновых кислот у таких фагов подавлен специфическим репрессором, поэтому бактерия не погибает и становится «иммунной» к повторному заражению (лизогения). Ассоциация фаговой ДНК с геномом бактерии способна качественно изменять антигенные или морфологические свойства бактериальной клетки, обуславливать синтез факторов вирулентности (лизогенная конверсия). ДНК умеренных вирусов реплицируется синхронно с размножением лизогенной бактерии, но иногда (примерно в одной из 102–105 подобных бактерий) фаг начинает спонтанно размножаться и лизировать клетку. Размножаясь в клетке, некоторые умеренные бактериофаги способны захватывать гены бактерии и, инфицируя другие клетки, передавать гены новому хозяину (трансдукция). Трансдуцирующие фаги переносят только бактериальную ДНК (общая трансдукция) или вирусную ДНК, участок которой замещен на бактериальную ДНК (специфическая трансдукция). Такие фаги не способны образовывать дочерние популяции, т. е. являются дефектными. Дефектные фаги используют в генной инженерии в качестве векторов. Исследования на бактериофагах позволили разрешить ряд важнейших проблем молекулярной биологии и молекулярной генетики. На модели бактериофагов было доказано, что материальным носителем наследственности является ДНК; были открыты феномены модификации-рестрикции, транскрипции; проведены исследования по изучению репликации, рекомбинации, морфогенезу. В основу классификации фагов положены антигенная структура, морфология фагов, спектр действия, химический состав и др. Большинство фагов относится к ДНК-содержащим вирусам с нуклео-капсидом, организованным по принципу смешанной симметрии.
Размножаясь в клетке, некоторые умеренные бактериофаги способны захватывать гены бактерии и, инфицируя другие клетки, передавать гены новому хозяину (трансдукция). Трансдуцирующие фаги переносят только бактериальную ДНК (общая трансдукция) или вирусную ДНК, участок которой замещен на бактериальную ДНК (специфическая трансдукция). Такие фаги не способны образовывать дочерние популяции, т. е. являются дефектными. Дефектные фаги используют в генной инженерии в качестве векторов. Исследования на бактериофагах позволили разрешить ряд важнейших проблем молекулярной биологии и молекулярной генетики. На модели бактериофагов было доказано, что материальным носителем наследственности является ДНК; были открыты феномены модификации-рестрикции, транскрипции; проведены исследования по изучению репликации, рекомбинации, морфогенезу. В основу классификации фагов положены антигенная структура, морфология фагов, спектр действия, химический состав и др. Большинство фагов относится к ДНК-содержащим вирусам с нуклео-капсидом, организованным по принципу смешанной симметрии. По спектру действия выделяют типовые фаги (Т-фаги), лизирующие бактерии отдельных типов внутри вида; моновалентные фаги, лизирующие бактерии одного вида; и поливалентные фаги, лизирующие бактерии нескольких видов.
По спектру действия выделяют типовые фаги (Т-фаги), лизирующие бактерии отдельных типов внутри вида; моновалентные фаги, лизирующие бактерии одного вида; и поливалентные фаги, лизирующие бактерии нескольких видов.
Бактериофаг phi29 обладает сложной системой для упаковки ДНК в капсид. Этот хорошо изученный наномотор можно химически и генетически модифицировать для того, чтобы встроить его в липосомальную мембрану и использовать в системах доставки лекарственных средств для их контролируемого высвобождения в патологическом очаге. На основе массивов из модифицированных наномоторов, распознающих различные биомаркеры, разрабатываются чувствительные сенсоры для in vitro диагностики.
Бактериофаги (их капсиды), так же как и другие вирусы, могут быть использованы как строительные леса, задающие определенное пространственное расположение небиогенным наночастицам. Подобные «строительные леса» позволяют не только создавать планарные структуры определенной формы и размера, но и перейти к проектированию и созданию трехмерных наноконструкций, таких сложных, как тетраэдр или сфера. В результате могут быть получены наноструктуры или материалы с новыми полезными свойствами для применения в самых различных областях нанотехнологий.
В результате могут быть получены наноструктуры или материалы с новыми полезными свойствами для применения в самых различных областях нанотехнологий.
Иллюстрации
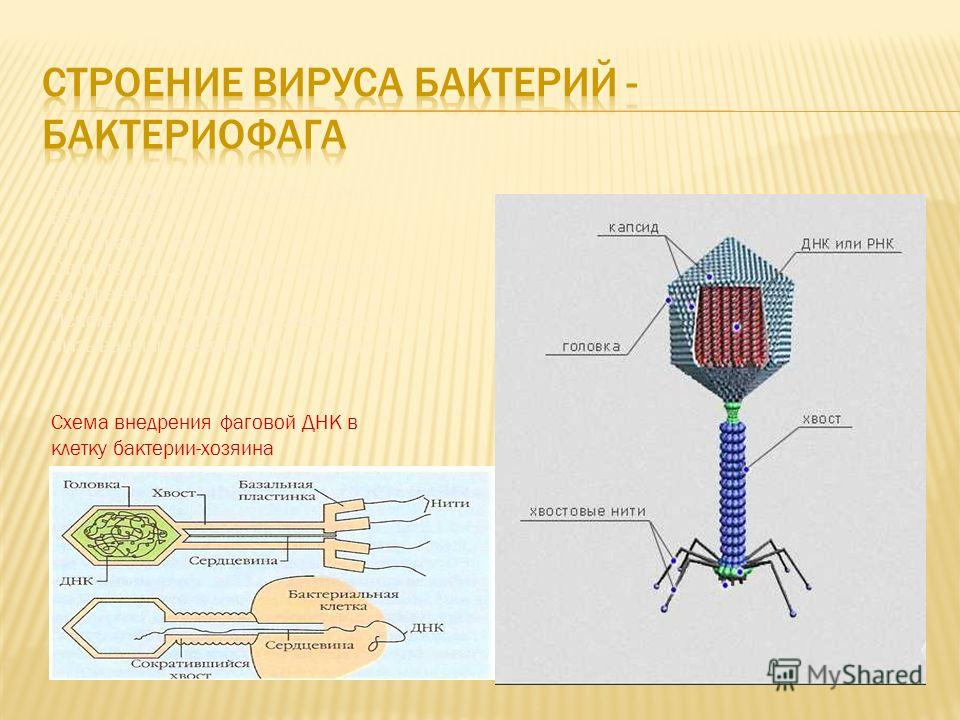
Строение бактериофага Т4: 1 — головка; 2 — хвост; 3 — нуклеиновая кислота; 4 — капсид; 5 — «воротничок»; 6 — белковый чехол хвоста; 7 — фибрилла хвоста; 8 — шипы; 9 — базальная пластинка. |
Авторы
- Курочкин Илья Николаевич
- Народицкий Борис Савельевич
- Борисенко Григорий Геннадиевич
- Нестеренко Людмила Николаевна
Источники
- Жданов В.М. Эволюция вирусов. Монография. — М.: Медицина, 1990. — 376 с.
- Бактериофаги // Википедия, свободная энциклопедия. —www.ru.wikipedia.org/wiki/Бактериофаги (дата обращения: 24.07.2010).
- NIH Nanomedicine Development Center // Peixuan Guo, 2006. —www.vet.purdue.edu/PeixuanGuo/NDC/
Напишите нам
- А
- Б
- В
- Г
- Д
- Ж
- З
- И
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Э
- Я
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Z
Вирусы использовали белок бактерии в своих целях
Ученые из Испании и США узнали, что бактериофаг vB_BsubS-Delta может использовать белок CtrA в своих целях. Вещество активно синтезируется некоторыми прокариотами, но оказалось, что вирусы сумели отслеживать уровень CtrA и менять экспрессию своих генов, исходя из ситуации. Ученые считают, что это может быть частью стратегии по выбору оптимального времени выхода вирусных частиц из клетки. Результаты исследования опубликованы в Frontiers in Microbiology.
Вещество активно синтезируется некоторыми прокариотами, но оказалось, что вирусы сумели отслеживать уровень CtrA и менять экспрессию своих генов, исходя из ситуации. Ученые считают, что это может быть частью стратегии по выбору оптимального времени выхода вирусных частиц из клетки. Результаты исследования опубликованы в Frontiers in Microbiology.
Вирусы размножаются, используя ресурсы клетки хозяина. Некоторые из них выбирают тактику лизогенного цикла: сначала вирус прикрепляется к клетке и делает дырку на поверхности, а затем встраивает свою генетическую информацию. Она начинает работать на увеличение числа вирусных частиц, которые высвобождаются, разрушая клетку. Стать такой копировальной машиной может и гриб, и растение, и даже бактерия. Последние называют бактериофагами или просто фагами. Среди них выделяют те вирусы, которые прикрепляются не к самой клетке, а к белковым выростам на поверхности бактерии — жгутики и пили.
Чтобы успешно существовать вирусу приходится «мониторить» своего хозяина и менять планы, исходя из ситуации. Если хозяин переживает не лучшие времена фаг может спрятаться внутри, ожидая подходящих условий. Однако до конца не понятно, как именно вирус может «понять», что происходит с клеткой хозяина.
Если хозяин переживает не лучшие времена фаг может спрятаться внутри, ожидая подходящих условий. Однако до конца не понятно, как именно вирус может «понять», что происходит с клеткой хозяина.
Иван Эрилл (Ivan Erill) из Университет Мэриленда и его коллеги пронаблюдали за недавно обнаруженным фагом vB_BsubS-Delta. Его особенность заключается в том, что он использует специальные выросты на поверхности бактерий — пили, для внедрения в клетку. Вирус инфицирует прокариот рода Brevundimonas. Для передвижения бактерия использует жгутики, и на ней также есть пили. Развитие этих структур, а также жизненный цикл клетки регулируется белком CtrA. При изучении vB_BsubS-Delta оказалось, что в геноме фага есть специальные последовательности, которые связываются с CtrA.
После обнаружения этого факта, ученые решили поискать похожие последовательности у других вирусов, поражающих бактерий. Оказалось, что схожие участки генома есть у других пилитропных и жгутикотропных фагов, которые при этом не являются родственниками vB_BsubS-Delta. Получается, что сразу несколько далеких друг от друга вирусов «научились» следить за уровнем CtrA.
Получается, что сразу несколько далеких друг от друга вирусов «научились» следить за уровнем CtrA.
Чтобы понять зачем это было нужно, ученые сравнили, что происходит с vB_BsubS-Delta, а также похожими на него фагами в присутствии CtrA. Выяснить это удалось с помощью бактерии Caulobacter crescentus. Прокариот синтезирует CtrA, но также есть штамм LS2195, в котором белок разрушается при повышенной температуре. Ученые внедрили и в дикий, и в чувствительный штаммы бактерии плазмиду, которая содержит гены вирусов, связывающие CtrA, а также ген синтеза бета-галактозидазы. По изменению содержания последнего исследователи и отслеживали, что происходит с генами вируса. Если встроить в плазмиду ген vB_BsubS-Delta, то содержание бета-галактозидазы выше в клетках с нарушенным синтезом CtrA. При этом активация генов других фагов, наоборот, происходит в бактериях дикого штамма, то есть с нормальным содержанием CtrA.
Авторы исследования выдвинули гипотезу, почему такое взаимодействие фагов и CtrA может быть полезно для вирусов. Концентрация белка в клетке падает, когда она готовится к делению хромосом и переходит в неподвижное состояние в виде биопленки. Тогда создается ситуация, когда, скорее всего, бактерия находится в комфортных условиях, а значит ей точно хватит ресурсов на производство вирусных частиц, и она окружена другими прокариотами, что дарит вирусу шанс заразить больше новых клеток. Тогда вирусу было бы удобно «затаиться» при большой концентрации белка и активироваться при ее падении.
Концентрация белка в клетке падает, когда она готовится к делению хромосом и переходит в неподвижное состояние в виде биопленки. Тогда создается ситуация, когда, скорее всего, бактерия находится в комфортных условиях, а значит ей точно хватит ресурсов на производство вирусных частиц, и она окружена другими прокариотами, что дарит вирусу шанс заразить больше новых клеток. Тогда вирусу было бы удобно «затаиться» при большой концентрации белка и активироваться при ее падении.
Уже в процессе деления хромосом бактерия снова активно нарабатывает CtrA. Отследить момент роста концентрации белка и активироваться для вируса — это тоже удобная стратегия. Если клетке хватает ресурсов на производство новых хромосом, она точно сможет сделать достаточно вирусных частиц. Но исследователям только предстоит проверить свое предположение.
Ученые давно наблюдают за отношениями бактерий и фагов. В связи с растущей устойчивостью к антибиотикам, вирусы прокариот рассматривают в качестве альтернативных вариантов терапии или ее дополнения. Однако есть некоторые опасения, что бактериофаги могут даже навредить.
Однако есть некоторые опасения, что бактериофаги могут даже навредить.
Полина Гребенкина
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Бактериофаг
Для поиска по всей книге введите термин или фразу в форму ниже Бактериофаг (стр. 1) (Эта глава состоит из 2 страниц) © Кеннет Тодар, доктор философии Бактериофаги Вирусы, поражающие бактерии, наблюдались Туортом и д’Эрелем в 1915 и 1917. Они заметили, что бульонные культуры некоторых кишечных бактерии могут быть растворены добавлением безбактериального фильтрата полученный из сточных вод. Считается, что лизис бактериальных клеток вызванный вирусом, что означало «фильтрующийся яд» («вирус» на латыни означает «яд»). Вероятно, каждая известная бактерия подвержена заражению одним или несколькими вирусы или «бактериофаги», как их называют («фаги» для краткости, от греч. «фагеин» означает «есть» или «грызть»). Большинство исследований было проведено на фагах, атакующих E. coli, особенно Т-фаги и фаг лямбда. Как и большинство вирусов, бактериофаги обычно несут только генетическую Информация необходимы для репликации их нуклеиновых кислот и синтеза их белковые оболочки. Когда фаги заражают свою клетку-хозяина, порядок бизнес состоит в том, чтобы реплицировать их нуклеиновую кислоту и производить защитная белковая оболочка. Но они не могут сделать это в одиночку. Они требуют предшественники, производство энергии и рибосомы, поставляемые их бактериальными клетка-хозяин. Бактериальные клетки могут подвергаться одному из двух типов заражения вирусами называемые литические инфекции и лизогенный (умеренный) инфекции. Литические инфекции вызываются фагами группы 7, известными как Т-фаги, тогда как лизогенные инфекции вызываются фагом лямбда. Литические инфекции Т-фаги, от T1 до T7 называются литическими фагами, потому что они всегда вызывают лизис и гибель клетки-хозяина, бактерия Кишечная палочка . Т-фаги содержат двухцепочечную ДНК в качестве генетического материала. В дополнение к их белковой оболочке или капсиду (также называемому «голова»), Т-фаги также обладают хвостом и некоторыми родственными ему структурами. А Схема и электронная микрофотография бактериофага Т4 приведены ниже. хвост включает в себя сердечник, хвостовую оболочку, опорную пластину, хвостовые штифты и хвост волокна, все из которых состоят из разных белков. Хвост и родственные структуры бактериофагов обычно участвуют в прикрепление фага и обеспечение проникновения вирусной нуклеиновой кислоты кислоту в клетку-хозяина. Оставил. Электронная микрофотография бактериофага Т4. Верно. Модель фага Т4. фаг обладает геномом из линейной двухцепочечной ДНК, содержащейся в икосаэдрическая голова. Хвост состоит из полого стержня, через который ДНК вводят в клетку-хозяина. Волокна хвоста участвуют в распознавание специфических вирусных «рецепторов» на поверхности бактериальной клетки. Перед вирусной инфекцией клетка участвует в репликации своих собственных ДНК и транскрипция и трансляция собственной генетической информации для переноса вне биосинтеза, рост и деление клеток. После заражения ДНК вируса захватывает механизм клетки-хозяина и использует его для производства нуклеиновых кислот и белков, необходимых для образования новых вирусных частиц. Вирусная ДНК заменяет ДНК клетки-хозяина в качестве матрицы для репликации (чтобы произвести больше вирусная ДНК) и транскрипция (для получения вирусной мРНК). затем транслируется с помощью рибосом клетки-хозяина, тРНК и аминокислот в вирусные белки, такие как белки оболочки или хвоста. Процесс ДНК репликация, синтез белков и сборка вируса тщательно скоординированное и своевременное мероприятие. Общий процесс литической инфекции схематично на рисунке ниже. Обсуждение конкретных шагов следует. литический цикл бактериального вируса, напр. бактериофаг Т4. Первый этап репликации фага в клетке-хозяине называется адсорбция . фаговая частица получает шанс столкновение в химически комплементарном месте на поверхности бактерий, затем прикрепляется к этому участку с помощью своих хвостовых волокон. После адсорбции фаг вводит свою ДНК в бактериальный клетка. Хвостовая оболочка сжимается, и ядро проходит сквозь стенку. к мембране. Этот процесс называется проникновением , и он может быть как механические и ферментативные. немного лизоцима в основании его хвоста от предыдущей инфекции и затем использует лизоцим для деградации части бактериальной клеточной стенки для вставки хвостового сердечника. ДНК вводят в периплазму бактерии, и вообще неизвестно, как проникает ДНК мембрана. Проиллюстрированы процессы адсорбции и проникновения. ниже. Адсорбция, проникновение и введение ДНК бактериофага Т4 в клетку E. coli . Т4 присоединяется к пориновому белку наружной мембраны, ompC. Сразу после введения вирусной ДНК происходит процесс инициировал синтез под названием ранние белки . Это относится к транскрипция и трансляция участка ДНК фага для создания набор белков, необходимых для репликации ДНК фага. Среди продуцируемые ранние белки представляют собой восстанавливающий фермент для восстановления отверстия в бактериальной клеточной стенке — фермент ДНКаза, расщепляющий ДНК хозяина в предшественники фаговой ДНК и вирусспецифическую ДНК-полимеразу, которая будет копировать и реплицировать ДНК фага. энергогенерирующие и белково-синтезирующие способности. поддерживаются, но они были подорваны вирусом. Результат синтез нескольких копий ДНК фага . Следующим этапом является синтез поздних белков. Каждый из теперь можно использовать несколько реплицированных копий фаговой ДНК для транскрипцию и трансляцию второго набора белков, называемого поздние белки . Опоздание белки в основном структурные белки, составляют капсомеры и различные компоненты хвостового оперения. Лизоцим также является поздним белком, который будет упакован в хвосте фаг и использоваться для побега из клетки-хозяина на последнем этапе процесса репликации. Повторив все свои части, следует сборка процесс. Белки, из которых состоят капсомеры, собираются сами в головы и «намотать» копию ДНК фага. Хвост и вспомогательные структуры собираются и включают немного лизоцима в хвостовая пластина. процесс сборки. Пока вирусы собираются, лизоцим вырабатывается как поздний вирусный белок. Часть этого лизосома используется для побега от хозяина. клетка путем лизиса пептидогликана клеточной стенки изнутри. Этот осуществляет лизис клетка-хозяин и выпуск зрелый вирусы , которые распространяются на близлежащие клетки, заражают их и завершают в цикл. Жизненный цикл Т-фага занимает около 25-35 минут. полный. Поскольку клетки-хозяева в конечном итоге погибают в результате лизиса, это Тип вирусной инфекции называется литической инфекцией. продолжение главы Следующая страница © Кеннет Тодар, доктор философии. Все права защищены. — www.textbookofbacteriology.net |
МОРСКИЕ ФАГИ | Главная
Сезон секвенирования почти начался!
Связаться с нами/Вопросы
Пожалуйста, направляйте любые вопросы по приведенной ниже информации Дэну (dar78@pitt.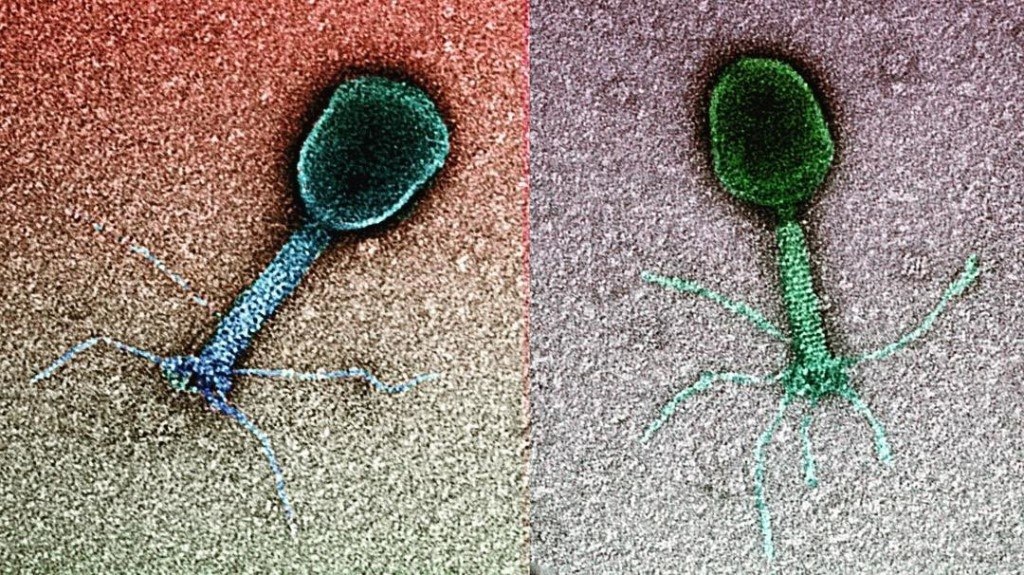 edu).
edu).
Форма отправки образца
Пожалуйста, предоставьте информацию об образцах, которые вы отправляете, используя эту форму Google. Это поможет нам отслеживать образцы, исправлять орфографические ошибки и обеспечивать учет ваших образцов. Пожалуйста, заполните копию этой формы для каждого образца, который вы отправляете . Лучшее время для ее заполнения – когда вы упаковываете посылку, чтобы к моменту прибытия вашей коробки у нас уже была информация о ваших фагах в нашей базе данных.
Если возможно, добавьте номер отслеживания в соответствующее место формы. Наша ситуация с доставкой все еще не на 100% нормальная, и мы хотим убедиться, что все посылки учтены. Обратите внимание, является ли каждый образец «Приоритетным» или «Резервным» в поле «Примечания», а также любую другую информацию, которую мы должны иметь.
https://docs.google.com/forms/d/e/1faipqlsfdhzpw1lhl42zxaotevqhmrr8rbn9-kupl_42ioymubu-4-q/viewform
Seculity
. , что он преподает в текущем учебном году. Пожалуйста, укажите любой порядок предпочтения, если он у вас есть.
, что он преподает в текущем учебном году. Пожалуйста, укажите любой порядок предпочтения, если он у вас есть.
Крайние сроки
Поскольку Бекки перешла на другую работу, в этом году у нас немного больше нехватки кадров, чем обычно. Раннее получение образцов, если они у вас есть, очень ценится!
Семестровые школы
Пожалуйста, отправьте свою геномную ДНК, чтобы она прибыла в Питтсбург ко вторнику, 22 ноября. 10 января года.
Если по какой-либо причине у вас возникнут проблемы с соблюдением этих сроков, свяжитесь с нами.
Руководящие принципы для ДНК
Буфер
Образцы, ресуспендированные в ТЕ, проблематичны, поскольку ЭДТА может мешать ферментативному расщеплению ДНК. Вы можете ресуспендировать свою ДНК в буфере для элюции (Tris), T(1/10)E или в очищенной воде.
Количество
Нам нужно минимум 4 мкг (микрограммов) геномной ДНК.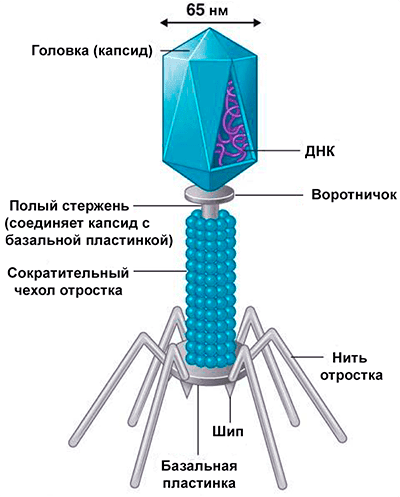 Если вы находитесь на приблизительном уровне этого числа, но не совсем там, свяжитесь с Дэном и Бекки, чтобы узнать, все ли в порядке.
Если вы находитесь на приблизительном уровне этого числа, но не совсем там, свяжитесь с Дэном и Бекки, чтобы узнать, все ли в порядке.
Концентрация
Не менее 40 нг/мкл. Идеально 100-300 нг/мкл. Если у вас выше 300 нг/мкл, рассмотрите возможность разбавления до рабочей концентрации и рабочего объема. Не рекомендуется перевозить объемы менее 20 мкл. Имейте в виду, что количественные оценки на основе спецификаций (например, Nanodrop) учитывают всю абсорбцию при 260 нм, а не только геномную ДНК, поэтому они часто завышают реальную концентрацию. Ошибаетесь в большом количестве ДНК, которое вы отправляете.
Изображение геля
Пожалуйста, отправьте — либо по электронной почте, либо в транспортной коробке — изображение гДНК, запускаемой на агарозном геле. Мы используем их для проверки целостности образца (еще не разложившегося/разложившегося) и чистоты (нет РНК).
Маркировка
Пожалуйста, четко маркируйте пробирки, которые вы отправляете, названием фага, как оно указано в PhagesDB .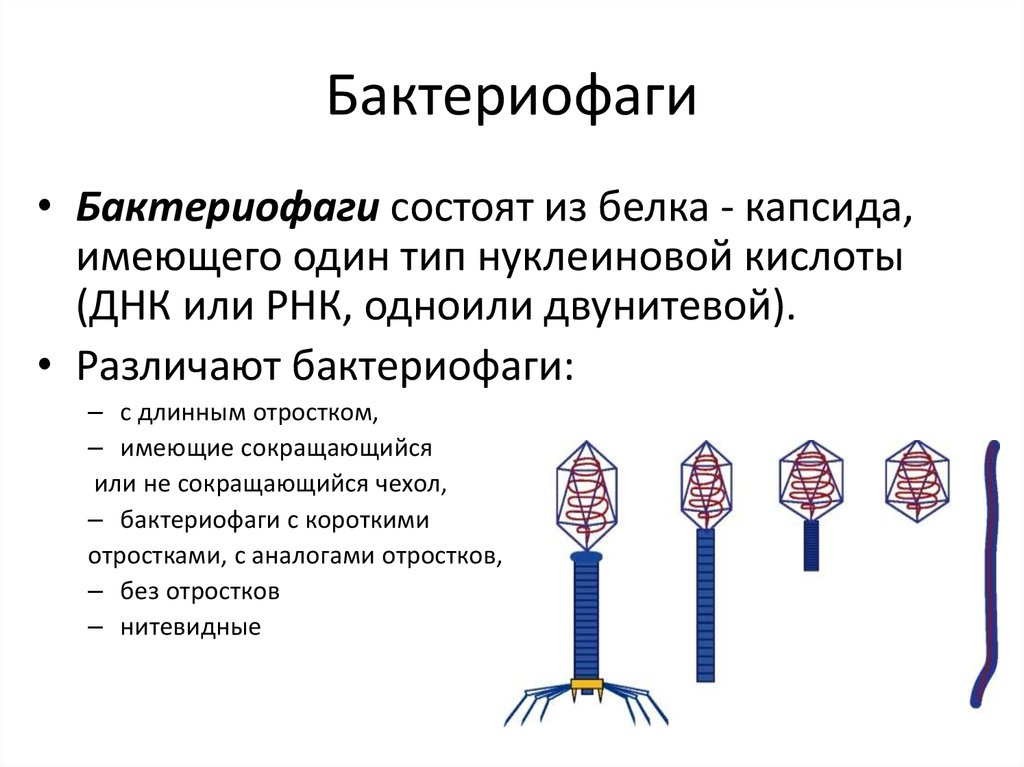 Не маркируйте пробирки только инициалами учащихся или другими двусмысленными именами, такими как «Phage1» или «PittPhage». Если возможно, наклейте небольшую круглую наклейку на верхнюю часть пробирки и напишите название фага только на ней.
Не маркируйте пробирки только инициалами учащихся или другими двусмысленными именами, такими как «Phage1» или «PittPhage». Если возможно, наклейте небольшую круглую наклейку на верхнюю часть пробирки и напишите название фага только на ней.
Доставка
Пожалуйста, отправьте образцы, как описано ниже, для доставки в Питтсбург с понедельника по четверг. Иногда у нас возникают проблемы с доставкой в пятницу, и мы не хотим, чтобы какие-либо образцы оставались на выходных.
Кроме того, мы не можем получать образцы с 23 ноября по 28 ноября и снова с 22 декабря по 3 января. Пожалуйста, избегайте доставки в это время.
Упаковка
Мы предпочитаем стандартные микроцентрифужные пробирки и настоятельно рекомендуем обернуть крышки парафильмом, чтобы предотвратить проливание или испарение. Пробирки можно упаковать в коническую пробирку объемом 50 мл с несколькими салфетками KimWipes для стабилизации во время транспортировки. При отправке в ночное время (предпочтительно) вы можете просто отправить образцы при комнатной температуре, так как ДНК должна быть в порядке в течение 24 часов в пути.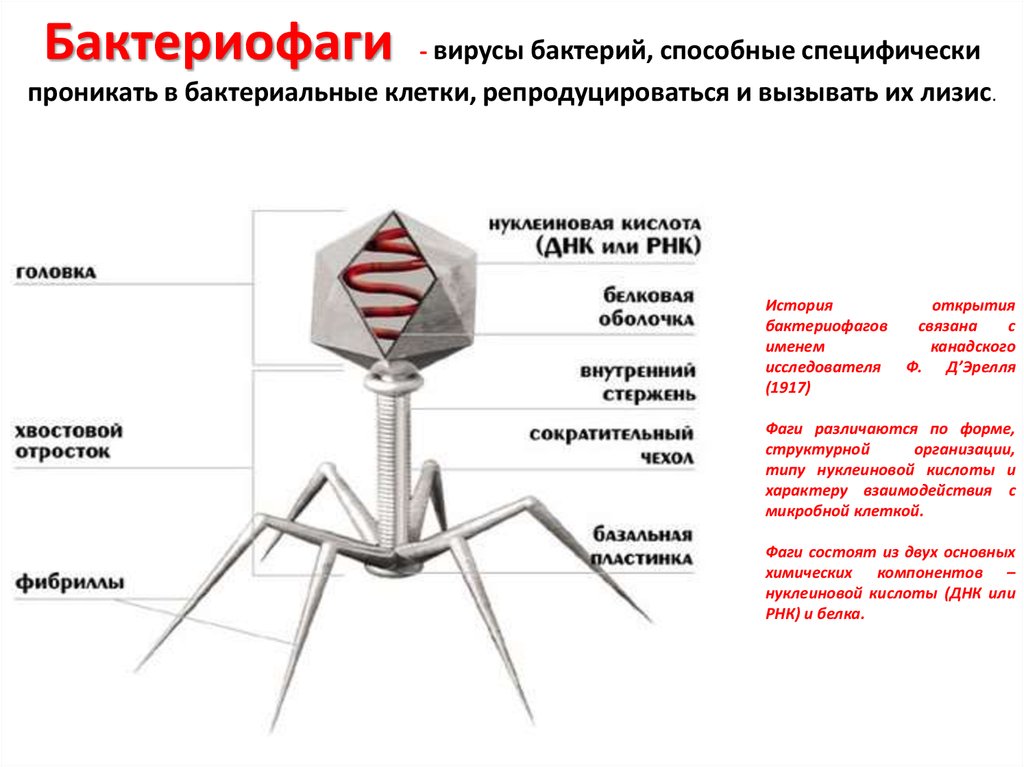 Если вы отправляете по более медленному графику, вы должны использовать холодные пакеты. Стремитесь к доставке в Питтсбург во вторник-пятницу. Если доставка осуществляется в предпраздничные дни, пожалуйста, уточните у нас, когда мы сможем получить образцы.
Если вы отправляете по более медленному графику, вы должны использовать холодные пакеты. Стремитесь к доставке в Питтсбург во вторник-пятницу. Если доставка осуществляется в предпраздничные дни, пожалуйста, уточните у нас, когда мы сможем получить образцы.
Вы можете приложить упаковочный лист с любой информацией, которую, по вашему мнению, мы должны иметь о прилагаемых фагах.
Адрес
Кому: Дэн Рассел
Университет Питтсбурга
303 Клапп Холл
4249 Пятая авеню
Питтсбург, Пенсильвания 15260
(412) 624-6976
Секвенирование дополнительных образцов
В течение последних нескольких лет Лаборатория геномных наук в штате Северная Каролина предоставляла высококачественные платные услуги по секвенированию школам, участвующим в программе SEA-PHAGES, желающим для секвенирования дополнительных геномов помимо тех, которые отведены программой. Стоимость секвенирования обычно составляет 250 долларов за геном.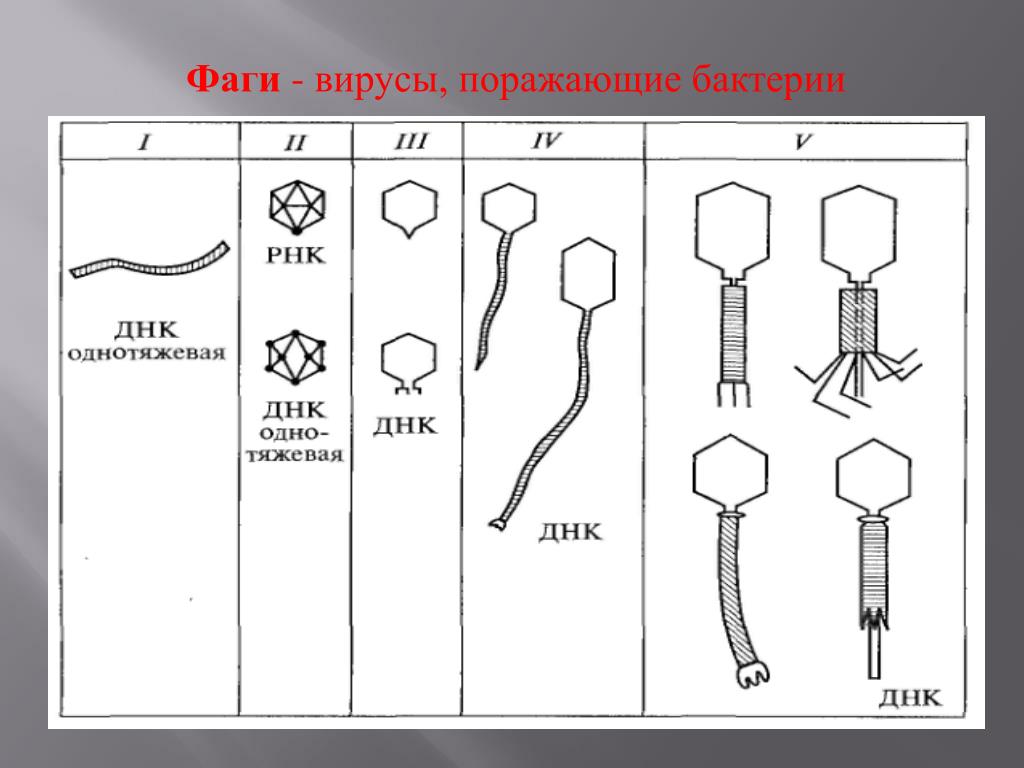


 В E. coli ,
В E. coli ,
 Вирусные мРНК
Вирусные мРНК Phage T4 упаковывает
Phage T4 упаковывает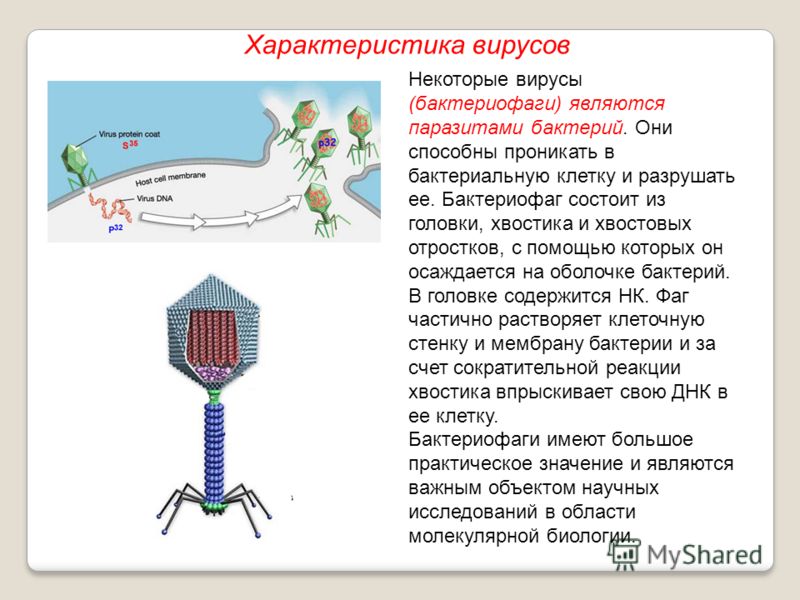 В этот период клетка
В этот период клетка Вирусы организуют свой выход из клетки-хозяина во время
Вирусы организуют свой выход из клетки-хозяина во время