Создатель «мирного» атома. Курчатов изобрёл бомбу, чтобы избежать войны | Наука | Общество
Дмитрий Писаренко
Примерное время чтения: 7 минут
19110
Еженедельник «Аргументы и Факты» № 1. Мировая экономика: каждый плывёт своим курсом 09/01/2013
Игорь Васильевич Курчатов. / Didenko / Commons.wikimedia.org
Без сомнения, Курчатов был одним из тех людей, кто оказал влияние на ход ХХ в. и его историю.
Ядерная «дробилка»
В XVIII в. некий промышленник Твердышев набирал на свой горный завод рабочую силу. Заехал в Болышево, что в Смоленской губернии, в гости к знакомому помещику. Да обыграл того в карты в пух и прах. Расплатился помещик двумя семьями крепостных — Курчатовыми. Так предки будущего академика оказались на Южном Урале. Дед его, Алексей Константинович, был неграмотен, но арифметикой интересовался. Научился считать и дослужился до казначея завода. Дал образование детям. Так что любовь к науке у молодого Курчатова была в генах.
Научился считать и дослужился до казначея завода. Дал образование детям. Так что любовь к науке у молодого Курчатова была в генах.
Родился он на Урале, но семья вскоре перебралась на юг, в Симферополь. Там Игорь окончил гимназию и вечернюю ремесленную школу по специальности слесаря. Поступил на физмат Таврического университета. За три года завершил 4-летний курс учёбы и блестяще защитился. Но этого Курчатову показалось мало, и он подался в Петроград — сразу на 3-й курс Политеха. А в 1925 г. был принят ассистентом в Физико-технический институт, в лабораторию знаменитого Иоффе, чьё имя сейчас носит легендарный НИИ.
Игорь Курчатов — сотрудник Радиевого института. Ленинград. 1930-е. Фото: Commons.wikimedia.org
Иногда спрашивают: почему именно Курчатова назначили руководить атомным проектом СССР? Ведь он был так молод — на момент начала этих грандиозных научных работ ему не исполнилось и 40! Абрам Фёдорович Иоффе легко бы ответил на этот вопрос. В Физтехе работало много энергичной молодёжи, но Курчатова он называл «первым среди равных». И оставлял вместо себя, когда уезжал в командировки. Говорят, что Сталин предложил Иоффе самому возглавить атомный проект. Но тот ответил: «Я уже стар. А здесь должен быть молодой и такой, который превзошёл бы меня. Это мой ученик Игорь Васильевич Курчатов». К тому моменту Курчатов уже вёл исследования на запущенном в 1937 г. циклотроне — ядерной «дробилке», как его называли. Это был первый в Европе циклический ускоритель тяжёлых заряженных частиц, и, конечно, никто тогда не предполагал, какими важными вскоре станут эти работы для обороны страны. Ведь в Большой советской энциклопедии тех лет было сказано: «Уран практического значения не имеет».
И оставлял вместо себя, когда уезжал в командировки. Говорят, что Сталин предложил Иоффе самому возглавить атомный проект. Но тот ответил: «Я уже стар. А здесь должен быть молодой и такой, который превзошёл бы меня. Это мой ученик Игорь Васильевич Курчатов». К тому моменту Курчатов уже вёл исследования на запущенном в 1937 г. циклотроне — ядерной «дробилке», как его называли. Это был первый в Европе циклический ускоритель тяжёлых заряженных частиц, и, конечно, никто тогда не предполагал, какими важными вскоре станут эти работы для обороны страны. Ведь в Большой советской энциклопедии тех лет было сказано: «Уран практического значения не имеет».
«Когда он только пришёл в Физтех, то занимался проблемой физики твёрдого тела. Это было нужно для плана ГОЭЛРО, требовались новые материалы, — рассказывает Раиса Кузнецова, директор мемориального Дома-музея И. В. Курчатова. — Игорь Васильевич изучал свойства диэлектриков и открыл новый класс явлений, который назвал сегнетоэлектричеством. На этом мог бы и успокоиться, но надо было знать его характер! Когда он познакомился с экспериментальными работами в области ядерной физики, то понял — будущее здесь. Он ведь с юности мечтал узнать, откуда берётся энергия звёзд».
На этом мог бы и успокоиться, но надо было знать его характер! Когда он познакомился с экспериментальными работами в области ядерной физики, то понял — будущее здесь. Он ведь с юности мечтал узнать, откуда берётся энергия звёзд».
Ещё один штрих. В первый же день войны (о создании ядерного оружия тогда даже не задумывались) Курчатов пришёл к Иоффе: «Ухожу в ополчение». У того волосы встали дыбом: «Как вы можете пойти? Вас там убьют!» Курчатов настоял на своём, и его направили заниматься системами размагничивания боевых кораблей. Созданная им и А. П. Александровым за пару месяцев установка помогала защищать советский военно-морской флот от немецких мин.
Разложение атома
С сентября 1941 г. разведка доносила: в Великобритании и США идут интенсивные работы по использованию атомной энергии для военных целей. Появление бомбы огромной разрушительной силы, безусловно, повлияло бы на ход и итоги войны. Через год в СССР возобновляются работы по расщеплению ядра урана, а весной 1943 г. Сталин подписывает распоряжение о создании специальной Лаборатории № 2 АН СССР. Задача — яснее не скажешь: разработка советской атомной бомбы. Учёные взялись за её решение воистину ударными темпами.
Сталин подписывает распоряжение о создании специальной Лаборатории № 2 АН СССР. Задача — яснее не скажешь: разработка советской атомной бомбы. Учёные взялись за её решение воистину ударными темпами.
Все материалы, добытые разведчиками в Англии и США, ложатся на стол к Бороде. Так Курчатова называли давно — бороду он начал носить ещё в молодости. Документов было много. А ему нужно было не только разобраться в их содержании, но и понять, нет ли там дезинформации, не хотят ли «друзья» направить советских физиков по ложному следу.
Тут уместно вспомнить об одном казусе, упоминаемом Владимиром Губаревым, журналистом и писателем: «Как-то в секретариат тов. Сталина обратился американец. Он предложил метод получения энергии из воздуха. Письмо дошло до самого вождя, который распорядился внимательно изучить его. Академикам пришлось подготовить подробное заключение и представить его в ЦК. Там, в частности, говорилось: «Предложение Генри Морея о методе получения энергии из воздуха для промышленных целей несерьёзно, так как проблемой разложения атома занимаются у нас в Союзе академик Иоффе и несколько институтов, а также виднейшие физики мира». О письме и предложении американца «разлагать атом» стало широко известно в академии. С тех пор И. В. Курчатов и его ближайшие сотрудники частенько шутили, что их основное занятие — разложение атома и они от этого получают большое удовольствие». Любой физик сразу поймёт эту шутку. Ядерщики занимаются не разложением атома, а расщеплением его ядра. А точнее — делением.
О письме и предложении американца «разлагать атом» стало широко известно в академии. С тех пор И. В. Курчатов и его ближайшие сотрудники частенько шутили, что их основное занятие — разложение атома и они от этого получают большое удовольствие». Любой физик сразу поймёт эту шутку. Ядерщики занимаются не разложением атома, а расщеплением его ядра. А точнее — делением.
А. Сахаров и И. Курчатов. Фото: Commons.wikimedia.org
В 1946 г. в Лаборатории № 2 пущен первый советский атомный реактор, а в 1949 г. на полигоне в Семипалатинске испытана атомная бомба. По многим достижениям «Курчатов и его команда» превзошли американцев: первыми испытали термоядерную (водородную) бомбу, построили промышленную атомную электростанцию, реактор для подводных лодок и ледоколов. Кстати, испытание водородной бомбы ввергло Курчатова в депрессию. Об этом писал уже упомянутый академик А. П. Александров: «Он был подавлен. Не говорил никаких технических подробностей, но сказал так: я теперь вижу, какую страшную вещь мы сделали. Единственное, что нас должно заботить, чтобы это дело запретить и исключить ядерную войну… Курчатов понимал, что мир находится на грани катастрофы».
Единственное, что нас должно заботить, чтобы это дело запретить и исключить ядерную войну… Курчатов понимал, что мир находится на грани катастрофы».
Именно тогда он стал пропагандировать использование «мирного» атома — на транспорте, в энергетике, авиации. Выступил инициатором создания Объединённого института ядерных исследований в Дубне. Ещё более 60 лет назад Курчатов ломал голову над проблемой управляемого термоядерного синтеза. Ведь если её решить и запустить реактор (а сейчас только начинается строительство международного реактора ИТЭР), люди получат неисчерпаемый источник энергии. По сути, ту самую энергию звёзд.
Дом-музей Игоря Курчатова: памятник истории с личными вещами академика | Фотогалерея
В этом домике жил и работал академик Игорь Васильевич Курчатов.
© АиФ / фото Евгения Талыпова
Общий вид рабочего кабинета Курчатова.
© АиФ / фото Евгения Талыпова
На рабочем столе академика всегда было множество документов.
© АиФ / фото Евгения Талыпова
Такая литература вполне могла лежать на столе Курчатова.
© АиФ / фото Евгения Талыпова
Телефон без диска — это была пряма связь с Берия и Сталиным.
© АиФ / фото Евгения Талыпова
Стол причудливой формы обеспечивал секретность — ученые седели лицом к научном руководителю и не видели документы друг друга.
© АиФ / фото Евгения Талыпова
Столовая-гостиная.
© АиФ / фото Евгения Талыпова
Печка на кухне.
© АиФ / фото Евгения Талыпова
Радио в гостиной.
© АиФ / фото Евгения Талыпова
Спальня.
© АиФ / фото Евгения Талыпова
Дом-музей Игоря Курчатова: памятник истории с личными вещами академика | Фотогалерея
В этом домике жил и работал академик Игорь Васильевич Курчатов.
© АиФ / фото Евгения Талыпова
Общий вид рабочего кабинета Курчатова.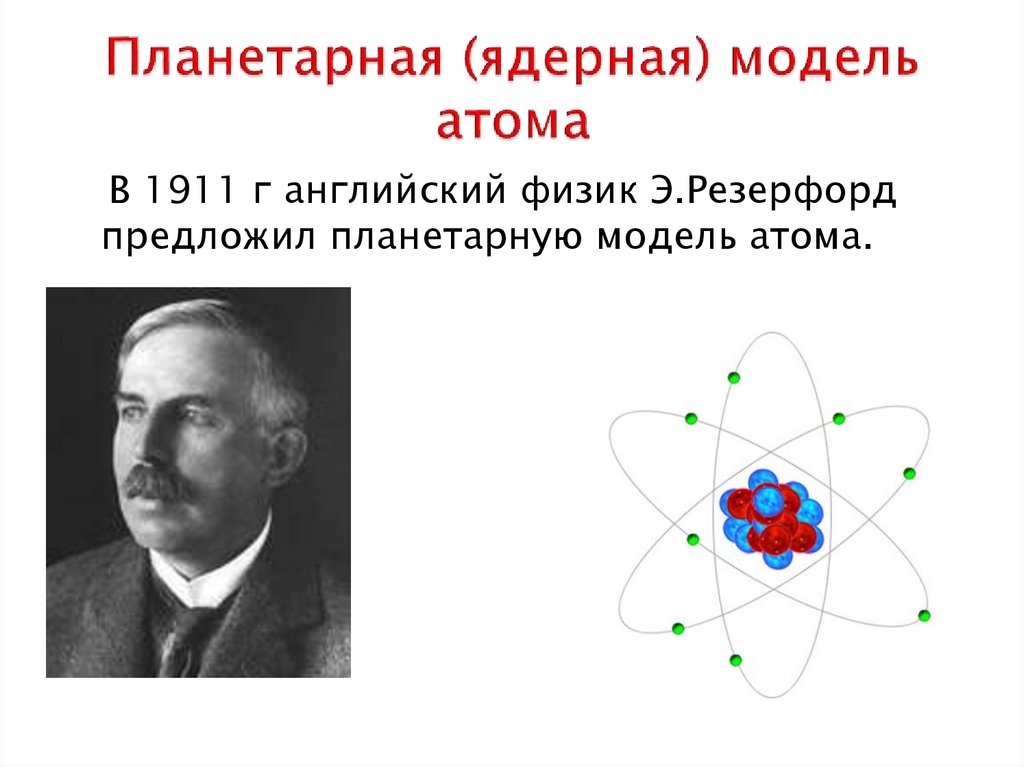
© АиФ / фото Евгения Талыпова
На рабочем столе академика всегда было множество документов.
© АиФ / фото Евгения Талыпова
Такая литература вполне могла лежать на столе Курчатова.
© АиФ / фото Евгения Талыпова
Телефон без диска — это была пряма связь с Берия и Сталиным.
© АиФ / фото Евгения Талыпова
Стол причудливой формы обеспечивал секретность — ученые седели лицом к научном руководителю и не видели документы друг друга.
© АиФ / фото Евгения Талыпова
Столовая-гостиная.
© АиФ / фото Евгения Талыпова
Печка на кухне.
© АиФ / фото Евгения Талыпова
Радио в гостиной.
© АиФ / фото Евгения Талыпова
Спальня.
© АиФ / фото Евгения Талыпова
атомная бомбаИгорь Курчатоввеликие ученые
Следующий материал
Также вам может быть интересно
Ярче тысячи солнц.
 65 лет назад наша страна создала ядерное оружие
65 лет назад наша страна создала ядерное оружиеМир в подарок. Как атомная бомба спасла миллионы жизней
Атомный блеф Сталина. Харьковскую бомбу сделали немцы, а Штаты взорвали ее в Японии
Легенды и мифы вокруг советской атомной бомбы
Новости СМИ2
28 февраля 1913 г.
 Нильс Бор представил новую модель атома
Нильс Бор представил новую модель атома
8044
Добавить в закладки
Фото: https://www.studenterforeningen.dk
Модель атома Бора пришла на смену планетарной модели атома
Эрнеста Резерфорда.
108 лет назад датский физик-теоретик Нильс
Бор предложил свою теорию строения атома, где
электроны не подчиняются законам классической физики. В
боровской модели атома электроны могут находиться только на
разрешенных орбитах и способны мгновенно перескакивать между
орбитами при поглощении и испускании фотонов (совершать
квантовые скачки).
Ранее, летом 1912 года, ученый прислал своему
наставнику Эрнесту Резерфорду черновик статьи,
посвященной проблеме устойчивости атома. По сути, Нильс Бор
впервые смог объяснить, почему электроны не падают на ядро атома:
когда электроны движутся с ускорением по
строго стационарным орбитам, они не
излучают электромагнитных волн, а значит, не теряют
энергию и не сходят с орбиты. Чтобы найти радиусы
Чтобы найти радиусы
устойчивых орбит, пришлось обращаться к новой на тот момент,
квантовой теории Макса Планка.
Справка.
Состояние атома, в котором все электроны находятся на
стационарных орбитах с наименьшей возможной энергией,
называется основным, а все другие состояния —
возбужденными. Стационарным состояниям соответствуют определенные
стационарные орбиты, по которым движутся электроны.
Бором были сформулированы квантовые постулаты, которые резко
расходились с классической механикой и классической
электродинамикой, однако успешно позволяли описать простейший
атом водорода. Нильс Бор впервые показал, что электрон
делает квантовые скачки по орбитам в атоме, и это изменило наше
понимание микромира.
Кроме того, Бор ввел понятие об атомном номере, понял, что такое
изотопы, высказал и осмыслил закон радиоактивного смещения. Он
также внес огромный вклад в понимание некоторых процессов,
происходящих внутри тяжелых атомных ядер, что имело решающее
значение для начала исследований, приведших к освобождению
ядерной энергии.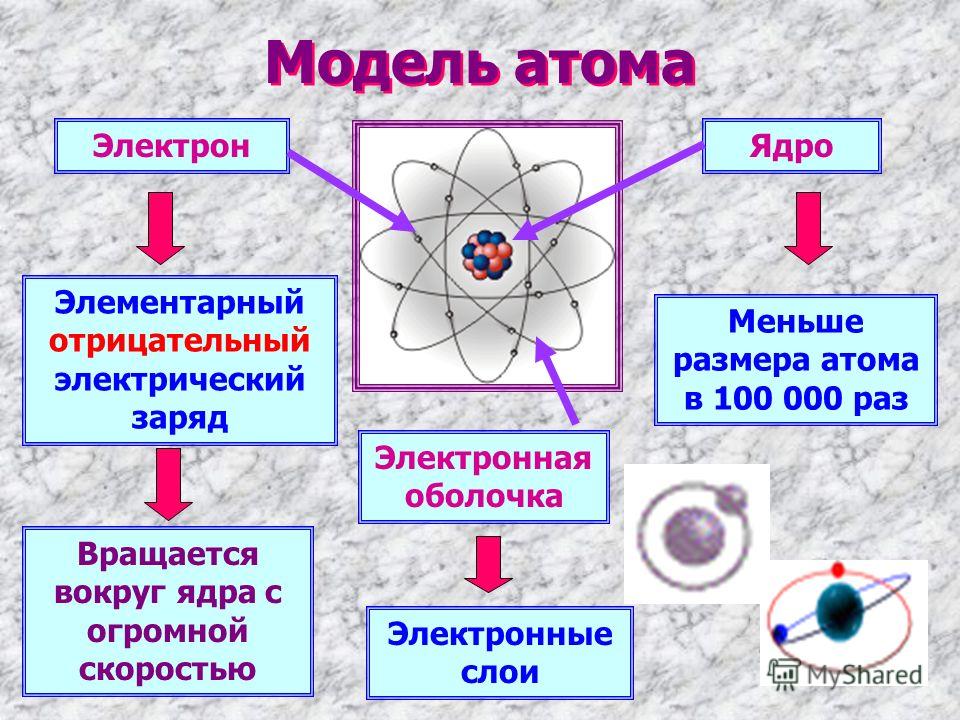 (© «Нильс Бор. Жизнь и творчество», изд-во
(© «Нильс Бор. Жизнь и творчество», изд-во
«Наука», 1967 г.).
Фото: из презентации физика-теоретика Д.И. Казакова.
Согласно теории Бора, электрон вращается вокруг атома по строго стационарным орбитам. Бор ввел понятие квантового соотношения между радиусом орбиты и скоростью электрона.
«Исходным пунктом атомной теории Бора является признание того
факта, что модель атома Резерфорда вместе с классической физикой
не могут объяснить той устойчивости, которой, как мы знаем из
нашего повседневного опыта, обладают атомы. <…> Исходя из
нового положения Бора о существовании атома только в
стационарных состояниях, теперь можно было описать эти
состояния без какой-либо ссылки на такие классические
представления, как электронные орбиты», — писали о вкладе
Бора в развитие физики Х. Меллер и М. Пиль.
Теория датского физика объяснила не только стабильность атомов,
но и линейчатый характер спектров — еще
один важнейший вопрос физики того времени.
Орбитальная модель атома Бора, позже
усовершенствованная Арнольдом Зоммерфельдом, стала
итогом старой квантовой теории.
Рождение новой квантовой теории состоялось в
1925-1926 годах и связано оно было с учеником Нильса Бора —
Вернером Гейзенбергом (и его матричной механикой), а также с
Эрвином Шредингером и Полем Дираком.
«Решающим моментом в атомной модели Резерфорда было то, что она
со всей ясностью показала, что устойчивость атомов нельзя
объяснить на основе классической физики и что квантовый
постулат — единственно возможный выход из острой дилеммы, и
эта острота несоответствия заставила меня абсолютно поверить в
правильность квантового постулата», — говорил сам Нильс
Бор.
В июле 1913 года в одном из старейших научных журналов
Великобритании — Philosophical Magazine — вышла
знаменитая статья Бора,
посвященная строению атомов и молекул. Эта публикация имела
фундаментальное значение для развития теоретической физики.
Автор Янина Хужина
атом
квантование
квантовая модель атома
нильс бор
орбитальная модель атома
орбиты электрона
планетарная модель атома
строение атома
электроны
эрнест резерфорд
Информация предоставлена Информационным агентством «Научная Россия». Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано
Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
НАУКА ДЕТЯМ
Астрономы нашли самые далекие звезды в нашей галактике
19:20 / Астрономия
Ученые Пермского Политеха разработали экологичный клей для изготовления фанеры
17:30 / Новые технологии
Две сотни научных организаций получат гранты на обновление приборной базы в 2023 году
17:15 / Наука и общество
ЮФУ совместно с ГАО РАН изучают локальную окрестность Солнца
16:30 / Астрономия, Астрофизика
«Интерфакс»: Таит ли «король вирусов» новую угрозу?
15:30 / Здравоохранение
В России еще остались села, зараженные после Чернобыльской аварии, их будут реабилитировать
14:30 / Экология
Биологи выяснили молекулярный механизм возникновения вторичных лейкозов
13:30 / Биология, Медицина
Ученые предложили новый подход к адресному лечению бактериальных инфекций
12:30 / Медицина, Химия
Ученые ТПУ разработали стабильные катализаторы для утилизации и переработки углекислого газа
11:30 / Инженерия, Химия
63 года назад в СССР был создан центр подготовки космонавтов
10:00 / Космонавтика, Наука и общество
Памяти великого ученого. Наука в глобальном мире. «Очевиднное — невероятное» эфир 10.05.2008
Наука в глобальном мире. «Очевиднное — невероятное» эфир 10.05.2008
04.03.2019
Памяти великого ученого. Нанотехнологии. «Очевидное — невероятное» эфир 3.08.2002
04.03.2019
Вспоминая Сергея Петровича Капицу
14.02.2017
История новогодних праздников
01.08.2014
Смотреть все
Атом | Определение, структура, история, примеры, схема и факты
модель атомной оболочки
Посмотреть все медиа
- Ключевые люди:
- Эрнест Резерфорд
Нильс Бор
Лев Давидович Ландау
Стивен Чу
Уильям Д. Филлипс
- Похожие темы:
- субатомная частица
радиоактивность
изотоп
атомизм
периодическая таблица
Просмотреть весь связанный контент →
Популярные вопросы
Что такое атом?
Атом является основным строительным элементом химии. Это наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента.
Это также наименьшая единица материи, обладающая характерными свойствами химического элемента.
Все ли атомы одного размера?
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем, определяемый как 10 −10 метра.
Из чего состоит масса атома?
Масса атома состоит из массы ядра плюс массы электронов. Это означает, что единица атомной массы не совсем такая же, как масса протона или нейтрона.
Как определяется атомный номер атома?
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z, равный 6, это углерод, а Z, равный 92, соответствует урану.
Сводка
Прочтите краткий обзор этой темы
атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Исследование различных конфигураций электронов в электронных оболочках вокруг ядра атома
Просмотреть все видео к этой статье
Большая часть атома представляет собой пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств. В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья начинается с широкого обзора фундаментальных свойств атома и составляющих его частиц и взаимодействий. После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, которые были сформулированы на протяжении веков. Для получения дополнительной информации, касающейся структуры ядра и элементарных частиц, см. субатомные частицы.
Большая часть материи состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать. Каждый отдельный атом состоит из более мелких частиц, а именно электронов и ядер. Эти частицы электрически заряжены, и электрические силы на заряде ответственны за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Эти частицы электрически заряжены, и электрические силы на заряде ответственны за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом в основном состоит из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, имеющих положительный заряд, и нейтронов, не имеющих заряда. Протоны, нейтроны и окружающие их электроны являются долгоживущими частицами, присутствующими во всех обычных атомах природного происхождения. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем (Å), определяемый как 10 −10 метра. Радиус атома составляет 1–2 Å. По сравнению с общим размером атома ядро еще меньше. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метра пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метра. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе.
Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем (Å), определяемый как 10 −10 метра. Радиус атома составляет 1–2 Å. По сравнению с общим размером атома ядро еще меньше. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метра пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метра. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе. Самое легкое ядро, атом водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Самое легкое ядро, атом водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Основные свойства
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z из 6, это углерод, а Z из 92 соответствует урану. Нейтральный атом имеет равное количество протонов и электронов, поэтому положительные и отрицательные заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
Страница не найдена | OSTI.GOV
Если вы видите эту страницу, это значит, что запрошенный вами URL не может быть найден. Возможно, он не существует или вы неправильно набрали его в своем браузере. Но, если вы считаете, что это наша ошибка, сообщите нам об этом. В противном случае у вас есть несколько вариантов: попробуйте использовать нашу панель навигации в верхней части этой страницы, посетите нашу домашнюю страницу или просмотрите наши продукты ниже.
В противном случае у вас есть несколько вариантов: попробуйте использовать нашу панель навигации в верхней части этой страницы, посетите нашу домашнюю страницу или просмотрите наши продукты ниже.
Посетите любой из продуктов ниже, чтобы найти результаты исследований и разработок Министерства энергетики и многое другое.
Основной инструмент поиска
Рис. 271948: ОСТИ.ГОВ 250
OSTI.GOV является основным инструментом поиска данных Министерства энергетики США по науке, технологиям и инженерным исследованиям. OSTI.GOV содержит более чем 70-летнюю научную и техническую информацию от DOE и учреждений-предшественников DOE и использует инновационный инструмент семантического поиска, позволяющий ученым, исследователям и общественности получать более актуальную информацию. Всего в OSTI.GOV около 3 миллионов записей.
Информация о научных, технических и инженерных исследованиях, финансируемая Министерством энергетики
Специализированные инструменты поиска для конкретных ресурсов
Публичный портал Министерства энергетики США по энергетике и науке (DOE PAGES ® ) — это инструмент поиска научных публикаций, включая рецензируемые журнальные статьи и принятые рукописи, полученные в результате исследований, финансируемых Министерством энергетики.
Научные публикации, полученные в результате исследований, финансируемых Министерством энергетики
DOE Data Explorer — это инструмент поиска наборов данных, коллекций данных и проектов данных, финансируемых DOE.
Данные научных исследований, полученные в результате исследований, финансируемых Министерством энергетики
DOE CODE — это новая платформа программных услуг Министерства энергетики США и средство поиска, заменяющее ESTSC. DOE CODE позволяет пользователям отправлять код, предлагает услуги репозитория и обнаружение программного обеспечения, финансируемого DOE.
Открытый исходный код, инструмент отправки и поиска для программного обеспечения, финансируемого Министерством энергетики
DOE Patents — это всеобъемлющий инструмент поиска патентной информации, полученной в результате исследований и разработок (НИОКР), финансируемых Министерством энергетики. Сюда включены патенты, которые Министерство энергетики спонсировало с помощью различных механизмов финансирования, включая гранты, контракты или соглашения о сотрудничестве.
Сюда включены патенты, которые Министерство энергетики спонсировало с помощью различных механизмов финансирования, включая гранты, контракты или соглашения о сотрудничестве.
Патенты, полученные в результате исследований, финансируемых Министерством энергетики
DOE ScienceCinema — это инструмент поиска мультимедийных научных видеороликов и аудиофайлов из национальных лабораторий Министерства энергетики, других исследовательских центров Министерства энергетики и ЦЕРН (Европейской организации ядерных исследований), использующий технологию поиска с распознаванием речи.
Научные видеоролики, посвященные исследованиям, финансируемым Министерством энергетики США
Федеральное агентство США и международные средства поиска научной и технической информации
Рисунок 276758: SciGov250-min.png
Science.

 65 лет назад наша страна создала ядерное оружие
65 лет назад наша страна создала ядерное оружие
 Помимо этого, предусмотрены девять новых программ повышения квалификации и четыре программы профессиональной переподготовки по актуальным научно-технологическим направлениям и «сквозным» цифровым технологиям, по которым пройдут обучение 360 инженеров «КАМАЗа».
Помимо этого, предусмотрены девять новых программ повышения квалификации и четыре программы профессиональной переподготовки по актуальным научно-технологическим направлениям и «сквозным» цифровым технологиям, по которым пройдут обучение 360 инженеров «КАМАЗа».
 Победителями стали 30 вузов из 15 регионов. 1 сентября в них по новым образовательным программам начнут обучение 200 будущих инженеров нового формата.
Победителями стали 30 вузов из 15 регионов. 1 сентября в них по новым образовательным программам начнут обучение 200 будущих инженеров нового формата.
 оборудования на многих автомобилях настоящего, и вполне возможно, что и на вашей машине тоже.
оборудования на многих автомобилях настоящего, и вполне возможно, что и на вашей машине тоже.
 Жестикулировать в будущем за рулем автомобиля водителям придется повидимому много и часто.
Жестикулировать в будущем за рулем автомобиля водителям придется повидимому много и часто.

 Те же самые приложения, те же значки, такое же самое удобство.
Те же самые приложения, те же значки, такое же самое удобство. Особенно это заметно при создании монокока у BMW, очень похожего на те, которые некоторое время уже делаются для самых дорогих суперкаров.
Особенно это заметно при создании монокока у BMW, очень похожего на те, которые некоторое время уже делаются для самых дорогих суперкаров. Следующий логический шаг, это использование чипов непосредственно в телефоне самого владельца.
Следующий логический шаг, это использование чипов непосредственно в телефоне самого владельца. (?) С OLED технологией это вполне возможно.
(?) С OLED технологией это вполне возможно. От таких мелких препятствий беззащитен любой современный и опытный водитель. В этом случае система сама будет автоматически останавливать автомобиль для предотвращения от дорогостоящей ошибки.
От таких мелких препятствий беззащитен любой современный и опытный водитель. В этом случае система сама будет автоматически останавливать автомобиль для предотвращения от дорогостоящей ошибки.
 Да, роботы заменят людей на многих работах, точно так же, как инновационное сельскохозяйственное оборудование заменило людей и лошадей во время промышленной революции. Однако после этих изменений люди потребуются для создания и предоставления ценности совершенно новыми способами для совершенно новых бизнес-моделей». Несмотря на то, что прошло всего несколько месяцев с тех пор, как я написал эту статью, сегодня я как никогда убежден, что это правда!
Да, роботы заменят людей на многих работах, точно так же, как инновационное сельскохозяйственное оборудование заменило людей и лошадей во время промышленной революции. Однако после этих изменений люди потребуются для создания и предоставления ценности совершенно новыми способами для совершенно новых бизнес-моделей». Несмотря на то, что прошло всего несколько месяцев с тех пор, как я написал эту статью, сегодня я как никогда убежден, что это правда! Заводские цеха используют роботов, которые все чаще управляются алгоритмами машинного обучения, чтобы они могли приспосабливаться к людям, работающим вместе с ними. Точно так же ИИ используется для превращения нарисованных от руки эскизов (сделанных людьми) в цифровой исходный код.
Заводские цеха используют роботов, которые все чаще управляются алгоритмами машинного обучения, чтобы они могли приспосабливаться к людям, работающим вместе с ними. Точно так же ИИ используется для превращения нарисованных от руки эскизов (сделанных людьми) в цифровой исходный код.
 дисциплина». В этом случае человеческие творческие усилия преобразуются и улучшаются машинами для удобства использования и масштабирования.
дисциплина». В этом случае человеческие творческие усилия преобразуются и улучшаются машинами для удобства использования и масштабирования.

 Во многих случаях люди и машины будут находиться в симбиотических отношениях, помогая друг другу делать то, что у них получается лучше всего. Люди и машины могут и будут работать вместе в будущем… и они уже делают это сегодня.
Во многих случаях люди и машины будут находиться в симбиотических отношениях, помогая друг другу делать то, что у них получается лучше всего. Люди и машины могут и будут работать вместе в будущем… и они уже делают это сегодня. Компании совместного использования или гиг-экономики, такие как Uber и Lyft, были первыми, кто разработал автоматические инструменты для управления своими удаленными работниками, включая системы рейтинга пользователей и автоматические «подталкивания».
Компании совместного использования или гиг-экономики, такие как Uber и Lyft, были первыми, кто разработал автоматические инструменты для управления своими удаленными работниками, включая системы рейтинга пользователей и автоматические «подталкивания». Сегодня более 90% используемых алгоритмов машинного обучения по-прежнему основаны на обучении с учителем.
Сегодня более 90% используемых алгоритмов машинного обучения по-прежнему основаны на обучении с учителем.
 Это происходит сейчас с кем-то, кого мы знаем, и скоро затронет каждого из нас.
Это происходит сейчас с кем-то, кого мы знаем, и скоро затронет каждого из нас. С помощью этих автоматизированных инструментов управление работниками становится более эффективным и масштабируемым. Но производительность не должна быть единственной целью. Необходимо учитывать прозрачность и эмпатию.
С помощью этих автоматизированных инструментов управление работниками становится более эффективным и масштабируемым. Но производительность не должна быть единственной целью. Необходимо учитывать прозрачность и эмпатию.
 Виноделие
Виноделие
 Зарубежная
Зарубежная

 С ранних лет он проявлял тягу к живописи и искусству в целом, Леонардо был одержим идеями творить и писать свои собственные произведения.
С ранних лет он проявлял тягу к живописи и искусству в целом, Леонардо был одержим идеями творить и писать свои собственные произведения.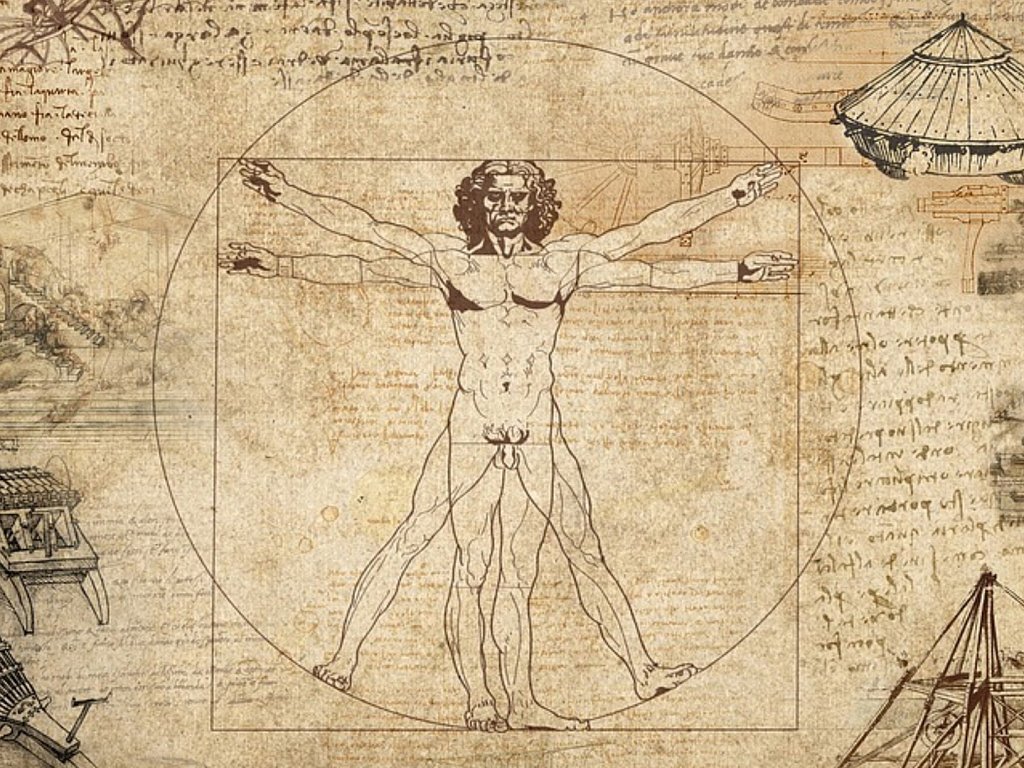
 В Британском музее хранятся два предварительных эскиза Леонардо к этому произведению. Изучение этих эскизов и самой картины позволяет предположить, что Леонардо концентрировался на идее зрения.
В Британском музее хранятся два предварительных эскиза Леонардо к этому произведению. Изучение этих эскизов и самой картины позволяет предположить, что Леонардо концентрировался на идее зрения.
 Такое орудие можно было повернуть, и стрелять из одного ряда пушек, пока другой перезаряжался, а еще один — охлаждался.
Такое орудие можно было повернуть, и стрелять из одного ряда пушек, пока другой перезаряжался, а еще один — охлаждался. Об этом можно и понять по его проекту вертолёта, описанного выше.
Об этом можно и понять по его проекту вертолёта, описанного выше. Она покровительственно кладёт руку на голову Иоанна Крестителя. Справа ангел придерживает младенца Иисуса, который поднял руку в жесте благословения. Вся сцена исполнена в нежностях и покое, что очень контрастирует с пейзажным фоном, состоящим из отвесных скал.
Она покровительственно кладёт руку на голову Иоанна Крестителя. Справа ангел придерживает младенца Иисуса, который поднял руку в жесте благословения. Вся сцена исполнена в нежностях и покое, что очень контрастирует с пейзажным фоном, состоящим из отвесных скал. Рентген показал большие аналогии в наброске с подготовительным рисунком «Джоконды» (Моны Лизы), кроме того, имеются записи: волосы вначале не прикрывали уши, была переписана форма челюсти, украшения добавлены позже.
Рентген показал большие аналогии в наброске с подготовительным рисунком «Джоконды» (Моны Лизы), кроме того, имеются записи: волосы вначале не прикрывали уши, была переписана форма челюсти, украшения добавлены позже. Моделью выступала любовница миланского герцога Сфорца — Чечилия Галлерани. Чечилия изображена в повороте головы чуть в сторону, что, несмотря на сильный наклон головы к левому плечу, смотрится весьма естественно.
Моделью выступала любовница миланского герцога Сфорца — Чечилия Галлерани. Чечилия изображена в повороте головы чуть в сторону, что, несмотря на сильный наклон головы к левому плечу, смотрится весьма естественно.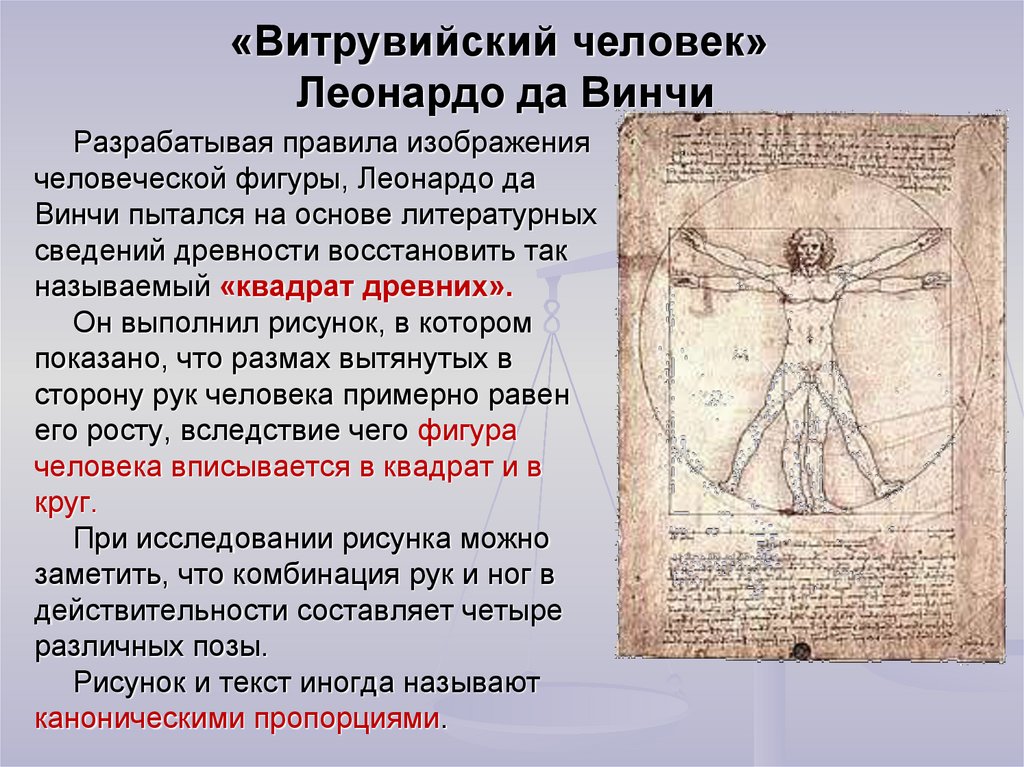 и представляет собой «кристаллическую сферу» небес, как это было воспринято в эпоху Возрождения.
и представляет собой «кристаллическую сферу» небес, как это было воспринято в эпоху Возрождения.


 Поэтому глаза имеют тот блеск и ту влажность, какие обычно видны у живого человека, а вокруг них переданы все те красноватые отсветы и волоски, которые поддаются изображению лишь при величайшей тонкости мастерства. Ресницы, сделанные наподобие того как действительно растут на теле волосы, где гуще, а где реже, и расположенные соответственно порам кожи, не могли бы быть изображены с большей естественностью. Нос со своими прелестными отверстиями, розоватыми и нежными, кажется живым. Рот, слегка приоткрытый, с краями, соединёнными алостью губ, с телесностью своего вида, кажется не красками, а настоящей плотью. В углублении шеи при внимательном взгляде можно видеть биение пульса. И поистине можно сказать, что это произведение было написано так, что повергает в смятение и страх любого самонадеянного художника, кто бы он ни был.
Поэтому глаза имеют тот блеск и ту влажность, какие обычно видны у живого человека, а вокруг них переданы все те красноватые отсветы и волоски, которые поддаются изображению лишь при величайшей тонкости мастерства. Ресницы, сделанные наподобие того как действительно растут на теле волосы, где гуще, а где реже, и расположенные соответственно порам кожи, не могли бы быть изображены с большей естественностью. Нос со своими прелестными отверстиями, розоватыми и нежными, кажется живым. Рот, слегка приоткрытый, с краями, соединёнными алостью губ, с телесностью своего вида, кажется не красками, а настоящей плотью. В углублении шеи при внимательном взгляде можно видеть биение пульса. И поистине можно сказать, что это произведение было написано так, что повергает в смятение и страх любого самонадеянного художника, кто бы он ни был. У Леонардо же в этом произведении улыбка дана столь приятной, что кажется, будто бы созерцаешь скорее божественное, нежели человеческое существо; самый же портрет почитается произведением необычайным, ибо и сама жизнь не могла бы быть иной.
У Леонардо же в этом произведении улыбка дана столь приятной, что кажется, будто бы созерцаешь скорее божественное, нежели человеческое существо; самый же портрет почитается произведением необычайным, ибо и сама жизнь не могла бы быть иной.
 В Южной Италии, он создал сложный и вычурный стиль, в котором было великолепное сочетание классицизма и раннего маньеризма.
В Южной Италии, он создал сложный и вычурный стиль, в котором было великолепное сочетание классицизма и раннего маньеризма.
 Он создал «миры», где проходили спектакли, парады и другие публичные зрелища. Его целью было развлечь толпу и погрузить зрителей в созданные им вселенные.
Он создал «миры», где проходили спектакли, парады и другие публичные зрелища. Его целью было развлечь толпу и погрузить зрителей в созданные им вселенные. Для да Винчи талант к воображению у мужчин и женщин находится в желудочке, где он тесно взаимодействует с их способностью к рациональному мышлению. Их объединение было не противоречием, а усилением обоих способностей.
Для да Винчи талант к воображению у мужчин и женщин находится в желудочке, где он тесно взаимодействует с их способностью к рациональному мышлению. Их объединение было не противоречием, а усилением обоих способностей. Хороший художник должен научиться наблюдать за природой и познавать ее законы. Он или она должны стать сведущими в науке оптики и математике перспективы и приучить ум видеть мир на чистом холсте.
Хороший художник должен научиться наблюдать за природой и познавать ее законы. Он или она должны стать сведущими в науке оптики и математике перспективы и приучить ум видеть мир на чистом холсте.


 Его называют самым разносторонним человеком всех времен и признают главным человеком эпохи Возрождения.
Его называют самым разносторонним человеком всех времен и признают главным человеком эпохи Возрождения.
 с ним, а не то, чем он является на самом деле».
с ним, а не то, чем он является на самом деле». То, что он увидел, заставило его пересмотреть свои взгляды, преобразовав в процессе инженерные и научные теории.
То, что он увидел, заставило его пересмотреть свои взгляды, преобразовав в процессе инженерные и научные теории. С ранее неизвестными фактами вы будете рассуждать лучше других и превращать идеи в разумные решения проблем. Агрессивное любопытство, умение слушать и фиксированные наблюдения ведут к большему опыту, живому суждению, удивительному творчеству и инновациям.
С ранее неизвестными фактами вы будете рассуждать лучше других и превращать идеи в разумные решения проблем. Агрессивное любопытство, умение слушать и фиксированные наблюдения ведут к большему опыту, живому суждению, удивительному творчеству и инновациям. Таким образом, он собрал более полную информацию для превосходной проницательности, выполнения и реализации.
Таким образом, он собрал более полную информацию для превосходной проницательности, выполнения и реализации. Леонардо да Винчи учит, что слияние с большим миром, мысли о большом, прежде чем начать думать о маленьком, должным образом упорядочивает детали творчества.
Леонардо да Винчи учит, что слияние с большим миром, мысли о большом, прежде чем начать думать о маленьком, должным образом упорядочивает детали творчества.
 Детализируйте атрибуты обоих, а затем соедините их. Задавайте наводящие вопросы, оценивая их с разных точек зрения. Встретьтесь с людьми, у которых есть взаимодополняющие интересы на совершенно разных рынках, и узнайте, что они могут предложить. Где бы вы ни были, чем бы вы ни занимались, ищите идеи. Ищите закономерности и связи с проектом, над которым вы работаете.
Детализируйте атрибуты обоих, а затем соедините их. Задавайте наводящие вопросы, оценивая их с разных точек зрения. Встретьтесь с людьми, у которых есть взаимодополняющие интересы на совершенно разных рынках, и узнайте, что они могут предложить. Где бы вы ни были, чем бы вы ни занимались, ищите идеи. Ищите закономерности и связи с проектом, над которым вы работаете.
 Тем не менее, тщательно изучите эти точки зрения, прежде чем делать окончательный вывод. Всегда сохраняйте свою независимость и думайте сами.
Тем не менее, тщательно изучите эти точки зрения, прежде чем делать окончательный вывод. Всегда сохраняйте свою независимость и думайте сами. Это включает в себя разработку дизайна, его тестирование, нарушение правил, риск и совершение ошибок. Размышляйте над истинной жизнью, ее глубоким смыслом, осложнениями и вероятностями, чтобы сохранять уверенность и самообладание. Это говорит о том, что быть философом и псевдоученым фундаментально.
Это включает в себя разработку дизайна, его тестирование, нарушение правил, риск и совершение ошибок. Размышляйте над истинной жизнью, ее глубоким смыслом, осложнениями и вероятностями, чтобы сохранять уверенность и самообладание. Это говорит о том, что быть философом и псевдоученым фундаментально. Это прольет свет на неизвестное и поможет вам найти лучшие решения.
Это прольет свет на неизвестное и поможет вам найти лучшие решения. Создавайте гипотетические ситуации для исследования. Испытайте и бросьте вызов каждой предпосылке. Применяйте каждое из них к реальным жизненным ситуациям, если это возможно, и предусмотрительно оценивайте последствия.
Создавайте гипотетические ситуации для исследования. Испытайте и бросьте вызов каждой предпосылке. Применяйте каждое из них к реальным жизненным ситуациям, если это возможно, и предусмотрительно оценивайте последствия. Никто не идеален, так что перестаньте бояться ошибиться. Это произойдет; ожидать этого. Умение признавать свои ошибки и взрослеть на них — вот главные стратегии творчества. Наверняка Леонардо да Винчи при жизни совершал огромные промахи. Он не только обучал навыкам творчества, но также учил, что совершать ошибки — это нормально и допустимо. Новые вещи изучаются, и творчество достигается методом проб и ошибок… с ляпами и промахами.
Никто не идеален, так что перестаньте бояться ошибиться. Это произойдет; ожидать этого. Умение признавать свои ошибки и взрослеть на них — вот главные стратегии творчества. Наверняка Леонардо да Винчи при жизни совершал огромные промахи. Он не только обучал навыкам творчества, но также учил, что совершать ошибки — это нормально и допустимо. Новые вещи изучаются, и творчество достигается методом проб и ошибок… с ляпами и промахами. Совсем неплохо для ошибки.
Совсем неплохо для ошибки.

 Об этом заявила министр обороны ФРГ Кристина Ламбрехт.
Об этом заявила министр обороны ФРГ Кристина Ламбрехт. Их используют для перехвата самолетов или крылатых ракет при запуске как с моря, так и с суши.
Их используют для перехвата самолетов или крылатых ракет при запуске как с моря, так и с суши.


 Мы постарались, чтобы число тех, кто получил награду Best of Show, не превышало пяти-семи. Все в этом списке соответствуют хотя бы одному из следующих критериев.
Мы постарались, чтобы число тех, кто получил награду Best of Show, не превышало пяти-семи. Все в этом списке соответствуют хотя бы одному из следующих критериев. Этот гигантский зверь телевизора сочетает в себе фантастическую технологию изображения с огромными размерами, что делает его одним из самых захватывающих телевизоров за последнее время. Однако, что действительно превосходит его, так это то, что он полностью беспроводной.
Этот гигантский зверь телевизора сочетает в себе фантастическую технологию изображения с огромными размерами, что делает его одним из самых захватывающих телевизоров за последнее время. Однако, что действительно превосходит его, так это то, что он полностью беспроводной. Устройство находится перед вашим унитазом. Когда вы мочитесь — а, по-видимому, лучше всего сидеть, когда вы делаете это, чтобы получить точный образец — он собирает мочу, анализирует ее, а затем отправляет результаты на ваш телефон через Wi-Fi.
Устройство находится перед вашим унитазом. Когда вы мочитесь — а, по-видимому, лучше всего сидеть, когда вы делаете это, чтобы получить точный образец — он собирает мочу, анализирует ее, а затем отправляет результаты на ваш телефон через Wi-Fi.


 Он улучшен по сравнению с моделью предыдущего года благодаря улучшенной антибликовой технологии и более ярким изображениям. В частности, на нашего телеэксперта Дэвида Кацмайера больше всего произвел впечатление цвет; однако отделка экрана немного серее, чем у LG, что несколько размывает изображение.
Он улучшен по сравнению с моделью предыдущего года благодаря улучшенной антибликовой технологии и более ярким изображениям. В частности, на нашего телеэксперта Дэвида Кацмайера больше всего произвел впечатление цвет; однако отделка экрана немного серее, чем у LG, что несколько размывает изображение. Скажем так, у меня появляется как минимум еще несколько седых волос, когда приходит новый счет. Система позволит пользователям экономить деньги, планируя, когда определенные розетки потребляют энергию, контролируя выключатели, переключатели и розетки, чтобы предотвратить потребление энергии энергетическими вампирами, такими как телевизоры и зарядные устройства, когда они нам не нужны.
Скажем так, у меня появляется как минимум еще несколько седых волос, когда приходит новый счет. Система позволит пользователям экономить деньги, планируя, когда определенные розетки потребляют энергию, контролируя выключатели, переключатели и розетки, чтобы предотвратить потребление энергии энергетическими вампирами, такими как телевизоры и зарядные устройства, когда они нам не нужны.
 Команда работает над адаптацией технологии к традиционной установке с шестью динамиками, но пока не сообщается, когда именно.
Команда работает над адаптацией технологии к традиционной установке с шестью динамиками, но пока не сообщается, когда именно. Кэтрин Лэтэм
Кэтрин Лэтэм Затем она вернулась к своим корням, взяв с собой свой опыт.
Затем она вернулась к своим корням, взяв с собой свой опыт.


 Один использует свет синего конца спектра для получения кислорода из воды. Другой использует свет с красного конца спектра для преобразования углекислого газа и протонов в синтетический газ или водород.
Один использует свет синего конца спектра для получения кислорода из воды. Другой использует свет с красного конца спектра для преобразования углекислого газа и протонов в синтетический газ или водород.

 Поэтому Феррара старается либо раздеть девушку, либо занять ее творческим процессом, требующим физического труда. Часы перед глобальным катаклизмом героиня Ли посвящает живописи: щедро льет на расстеленный на полу холст краску, главным образом черную, и сушит ее вентилятором.
Поэтому Феррара старается либо раздеть девушку, либо занять ее творческим процессом, требующим физического труда. Часы перед глобальным катаклизмом героиня Ли посвящает живописи: щедро льет на расстеленный на полу холст краску, главным образом черную, и сушит ее вентилятором.
 Удастся ли им исполнить свои последние мечты или они так и останутся нереализованными, смотрите в фильме «Ищу друга на конец света». В главных ролях талантливый комик Стив Каррел и непосредственная, обаятельная Кира Найтли.
Удастся ли им исполнить свои последние мечты или они так и останутся нереализованными, смотрите в фильме «Ищу друга на конец света». В главных ролях талантливый комик Стив Каррел и непосредственная, обаятельная Кира Найтли.


 Концовка отличная.
Концовка отличная. Оказывайте гостеприимство друг другу без ропота. Каждый должен использовать полученный им дар для служения другим, верно преподнося Божью благодать в ее различных формах. Если кто и говорит, то должен делать это как говорящий сами слова Божьи. Служит ли кто, по силе, которую дает Бог, дабы во всем прославлялся Бог через Иисуса Христа. Ему слава и сила во веки веков. Аминь» (1 Петра 4:7-11).
Оказывайте гостеприимство друг другу без ропота. Каждый должен использовать полученный им дар для служения другим, верно преподнося Божью благодать в ее различных формах. Если кто и говорит, то должен делать это как говорящий сами слова Божьи. Служит ли кто, по силе, которую дает Бог, дабы во всем прославлялся Бог через Иисуса Христа. Ему слава и сила во веки веков. Аминь» (1 Петра 4:7-11). Когда я упомянул об этом в воскресенье утром, кто-то заговорил и сказал: «Это страшно». Первая молитва благодарит Бога как источник всех наших благословений. Второй признает неопределенность жизни. Хотя я никогда не думал об этом, когда был маленьким, пятилетнему ребенку тяжело молиться: «Если я умру до того, как проснусь».
Когда я упомянул об этом в воскресенье утром, кто-то заговорил и сказал: «Это страшно». Первая молитва благодарит Бога как источник всех наших благословений. Второй признает неопределенность жизни. Хотя я никогда не думал об этом, когда был маленьким, пятилетнему ребенку тяжело молиться: «Если я умру до того, как проснусь». Каждый день в Америке умирает 7000 человек, а это значит, что каждый день колокол звонит еще по 7000 человек.
Каждый день в Америке умирает 7000 человек, а это значит, что каждый день колокол звонит еще по 7000 человек. Несомненно, Питер имеет в виду, по крайней мере, это. Но его слова выходят за рамки этого и охватывают Второе пришествие Господа Иисуса Христа. Когда он вернется на землю, всему земному порядку придет конец. Как скоро мы до дня его возвращения? Новый Завет говорит нам, что день его возвращения не за горами:
Несомненно, Питер имеет в виду, по крайней мере, это. Но его слова выходят за рамки этого и охватывают Второе пришествие Господа Иисуса Христа. Когда он вернется на землю, всему земному порядку придет конец. Как скоро мы до дня его возвращения? Новый Завет говорит нам, что день его возвращения не за горами: Тысяча лет — всего лишь день в его глазах, а день — как тысяча лет. Когда Петр говорит: «Всему конец близок», он использует слово, означающее «близкий» или «приближающийся». Позвольте мне проиллюстрировать. Предположим, вы едете с семьей в отпуск во Флориду. До Оук-Парка далеко ехать, и у ваших детей нет четкого представления о времени и расстоянии. Вскоре после пересечения границы штата Индиана вы оказываетесь в Меррилвилле. Там вы увидите последний ресторан Cracker Barrel, пока не доберетесь до Индианаполиса. Проезжая мимо Меррилвилля, вы слышите голос с заднего сиденья: «Мы уже на месте?» Через несколько часов вы проедете через Индианаполис. «Мы уже на месте?» Потом Луисвилл. «Мы уже на месте?» Когда вы попадете в Нэшвилл, вы остановитесь, чтобы заправиться. Загружая машину, вы слышите знакомый вопрос: «Мы уже на месте?» Наконец вы приезжаете в Алабаму, последний штат перед Флоридой. Но Алабама (мой родной штат) длинная. Если вы едете по I-65, вы будете в Алабаме довольно много часов.
Тысяча лет — всего лишь день в его глазах, а день — как тысяча лет. Когда Петр говорит: «Всему конец близок», он использует слово, означающее «близкий» или «приближающийся». Позвольте мне проиллюстрировать. Предположим, вы едете с семьей в отпуск во Флориду. До Оук-Парка далеко ехать, и у ваших детей нет четкого представления о времени и расстоянии. Вскоре после пересечения границы штата Индиана вы оказываетесь в Меррилвилле. Там вы увидите последний ресторан Cracker Barrel, пока не доберетесь до Индианаполиса. Проезжая мимо Меррилвилля, вы слышите голос с заднего сиденья: «Мы уже на месте?» Через несколько часов вы проедете через Индианаполис. «Мы уже на месте?» Потом Луисвилл. «Мы уже на месте?» Когда вы попадете в Нэшвилл, вы остановитесь, чтобы заправиться. Загружая машину, вы слышите знакомый вопрос: «Мы уже на месте?» Наконец вы приезжаете в Алабаму, последний штат перед Флоридой. Но Алабама (мой родной штат) длинная. Если вы едете по I-65, вы будете в Алабаме довольно много часов. Поэтому, когда вы проезжаете мимо Хантсвилля, дети (теперь нетерпеливые) спрашивают: «Мы уже на месте?» Затем вы попали в Бирмингем. «Мы уже на месте?» Когда вы доберетесь до Монтгомери, вы еще будете в нескольких часах пути. «Мы уже на месте?» В конце концов вы пересекаете границу штата Флорида. «Мы уже на месте?» Ответ во всех случаях один и тот же: «Нет, мы еще не там, но мы в пути, и это уже недалеко». Это утверждение справедливо как для Меррилвилля, так и для Монтгомери. Ты еще не там, ты в пути, и это не так далеко. И каждая миля, которую вы проезжаете, приближает вас к месту назначения.
Поэтому, когда вы проезжаете мимо Хантсвилля, дети (теперь нетерпеливые) спрашивают: «Мы уже на месте?» Затем вы попали в Бирмингем. «Мы уже на месте?» Когда вы доберетесь до Монтгомери, вы еще будете в нескольких часах пути. «Мы уже на месте?» В конце концов вы пересекаете границу штата Флорида. «Мы уже на месте?» Ответ во всех случаях один и тот же: «Нет, мы еще не там, но мы в пути, и это уже недалеко». Это утверждение справедливо как для Меррилвилля, так и для Монтгомери. Ты еще не там, ты в пути, и это не так далеко. И каждая миля, которую вы проезжаете, приближает вас к месту назначения. В наших Символах веры для описания пришествия Христа используются два конкретных слова. Оно личное, в том смысле, что вернется сам Господь, и оно неизбежно, в том смысле, что он может прийти в любой момент.
В наших Символах веры для описания пришествия Христа используются два конкретных слова. Оно личное, в том смысле, что вернется сам Господь, и оно неизбежно, в том смысле, что он может прийти в любой момент. Позвольте мне проиллюстрировать. Вот две команды, играющие за национальный чемпионат. Когда часы отсчитывают последние секунды, одна команда, одетая в бело-голубое, нервничает, обезумевает и напугана. Они вдруг начинают бросать мяч. Другая команда, одетая в оранжевое, спокойна, хладнокровна, нетороплива и решительна. В их глазах нет страха. Толпа отсчитывает секунды, 5, 4, 3, 2, Ди Браун из Мэйвуда наносит удар сверху. Как сказал бы Дик Витале: «Ничего, кроме сети, детка». И Иллинойс выигрывает национальный чемпионат, 78-77. Почему? Потому что они сохраняли самообладание в ситуации давления. (Примечание: я использовал эту иллюстрацию в воскресенье. Увы, она доказывает, что я не очень хороший пророк.)
Позвольте мне проиллюстрировать. Вот две команды, играющие за национальный чемпионат. Когда часы отсчитывают последние секунды, одна команда, одетая в бело-голубое, нервничает, обезумевает и напугана. Они вдруг начинают бросать мяч. Другая команда, одетая в оранжевое, спокойна, хладнокровна, нетороплива и решительна. В их глазах нет страха. Толпа отсчитывает секунды, 5, 4, 3, 2, Ди Браун из Мэйвуда наносит удар сверху. Как сказал бы Дик Витале: «Ничего, кроме сети, детка». И Иллинойс выигрывает национальный чемпионат, 78-77. Почему? Потому что они сохраняли самообладание в ситуации давления. (Примечание: я использовал эту иллюстрацию в воскресенье. Увы, она доказывает, что я не очень хороший пророк.) Сегодня мы говорим даже о наносекундах. И Тоффлер писал до появления персональных компьютеров, Интернета, электронной почты и обмена мгновенными сообщениями. Многие люди не выдерживают давления жизни. Они просто не могут с этим справиться. В наши дни, чтобы выжить, вам нужно иметь ясный ум, чтобы видеть вещи в правильном ракурсе.
Сегодня мы говорим даже о наносекундах. И Тоффлер писал до появления персональных компьютеров, Интернета, электронной почты и обмена мгновенными сообщениями. Многие люди не выдерживают давления жизни. Они просто не могут с этим справиться. В наши дни, чтобы выжить, вам нужно иметь ясный ум, чтобы видеть вещи в правильном ракурсе. Но в тот момент, когда мы начинаем молиться, мы вдруг слышим музыку за милю и вспоминаем разговор, который у нас был на прошлой неделе, и вскоре мы не молимся, потому что отвлеклись. Суть в том, что в свете приближающегося конца века не паникуйте — молитесь! Держите его вместе между ушами, чтобы вы могли молиться. И единственный совет, который я могу добавить, — начать молиться рано утром — как только вы проснетесь — до того, как давление дня охватит вас своими руками. Начните день с молитвы, и вы, вероятно, останетесь хладнокровными, спокойными и собранными в течение всего дня.
Но в тот момент, когда мы начинаем молиться, мы вдруг слышим музыку за милю и вспоминаем разговор, который у нас был на прошлой неделе, и вскоре мы не молимся, потому что отвлеклись. Суть в том, что в свете приближающегося конца века не паникуйте — молитесь! Держите его вместе между ушами, чтобы вы могли молиться. И единственный совет, который я могу добавить, — начать молиться рано утром — как только вы проснетесь — до того, как давление дня охватит вас своими руками. Начните день с молитвы, и вы, вероятно, останетесь хладнокровными, спокойными и собранными в течение всего дня. Мы должны приложить такие усилия, потому что настоящая любовь трудна. Это чего-то стоит. Как только вы действительно узнаете другого человека, настоящая любовь означает пойти на все ради него, вытянуться до предела, поставить себя в место, где вам могут причинить боль. В своей книге «Четыре любви» К. С. Льюис описывает это так:0005
Мы должны приложить такие усилия, потому что настоящая любовь трудна. Это чего-то стоит. Как только вы действительно узнаете другого человека, настоящая любовь означает пойти на все ради него, вытянуться до предела, поставить себя в место, где вам могут причинить боль. В своей книге «Четыре любви» К. С. Льюис описывает это так:0005 Они поняли, что Бог дал им место для жизни не только для того, чтобы убежать от мира, но и для служения другим.
Они поняли, что Бог дал им место для жизни не только для того, чтобы убежать от мира, но и для служения другим. Это даже не замок, в котором вы развлекаете своих родственников и избранных друзей, или музей для вашего фарфора, галерея для ваших картин, сад для ваших цветов, игровая площадка для ваших детей или выставочный зал для вашей мебели. . Какими бы хорошими ни были эти вещи, они не затрагивают глубочайшей причины, по которой Бог дал вам дом. Он дал его вам, чтобы вы приютили свою семью и служили другим.
Это даже не замок, в котором вы развлекаете своих родственников и избранных друзей, или музей для вашего фарфора, галерея для ваших картин, сад для ваших цветов, игровая площадка для ваших детей или выставочный зал для вашей мебели. . Какими бы хорошими ни были эти вещи, они не затрагивают глубочайшей причины, по которой Бог дал вам дом. Он дал его вам, чтобы вы приютили свою семью и служили другим.
 Это включает в себя любую из 1001 другой вещи, которая поддерживает жизнь церкви. Каким бы ни был ваш дар, делайте это с могущественной силой, которую дает Бог.
Это включает в себя любую из 1001 другой вещи, которая поддерживает жизнь церкви. Каким бы ни был ваш дар, делайте это с могущественной силой, которую дает Бог.
 Они думали, что статую придется снести, пока один человек не поместил на ее дно золотую табличку с надписью: «У него нет других рук, кроме наших».
Они думали, что статую придется снести, пока один человек не поместил на ее дно золотую табличку с надписью: «У него нет других рук, кроме наших». Аминь.
Аминь.
 «Более 400 000 американцев отдали свои жизни, чтобы обеспечить свободу нашей нации, и посреди ликования было признано, что истинное значение дня лучше всего представлено теми, кто не присутствовал на праздновании», — сказал Роберт Ситино, доктор философии, Исполнительный директор Института изучения войны и демократии Национального музея Второй мировой войны.
«Более 400 000 американцев отдали свои жизни, чтобы обеспечить свободу нашей нации, и посреди ликования было признано, что истинное значение дня лучше всего представлено теми, кто не присутствовал на праздновании», — сказал Роберт Ситино, доктор философии, Исполнительный директор Института изучения войны и демократии Национального музея Второй мировой войны. Трумэна, устных рассказов мужчин и женщин, которые пережили это, и многого другого. . Присоединяйтесь к Национальному музею Второй мировой войны и исследуйте трагедии, триумфы и трудные решения, сделанные одним из самых неожиданных лидеров в истории.
Трумэна, устных рассказов мужчин и женщин, которые пережили это, и многого другого. . Присоединяйтесь к Национальному музею Второй мировой войны и исследуйте трагедии, триумфы и трудные решения, сделанные одним из самых неожиданных лидеров в истории.
 Вмешательство императора Хирохито имело решающее значение.
Вмешательство императора Хирохито имело решающее значение. Величественные сегодня, 75 лет назад кладбища были совсем в другом состоянии.
Величественные сегодня, 75 лет назад кладбища были совсем в другом состоянии. Благодаря его твердому руководству страна в конечном итоге вышла победителем.
Благодаря его твердому руководству страна в конечном итоге вышла победителем. Корабль затонул за 12 минут. Более 900 членов ее экипажа покинули корабль и начали дрейфовать в море.
Корабль затонул за 12 минут. Более 900 членов ее экипажа покинули корабль и начали дрейфовать в море. Затем приложение откроется, и вы войдете в комнату для веб-семинаров. Для участия в вебинаре вам нужно будет указать свой адрес электронной почты.
Затем приложение откроется, и вы войдете в комнату для веб-семинаров. Для участия в вебинаре вам нужно будет указать свой адрес электронной почты.


 45
45 Коллекция музея содержит предметы некоторых из этих посетителей, американских военнослужащих, которые хотели присутствовать на одном из самых значительных судебных процессов в истории.
Коллекция музея содержит предметы некоторых из этих посетителей, американских военнослужащих, которые хотели присутствовать на одном из самых значительных судебных процессов в истории.
 12.2022
12.2022 Путешественники – счастливые люди. Во время поездок по стране они могут повстречать уникальных представителей фауны, которых никогда не видели жители больших городов. Представляем список диких животных России.
Путешественники – счастливые люди. Во время поездок по стране они могут повстречать уникальных представителей фауны, которых никогда не видели жители больших городов. Представляем список диких животных России. Красный волки – социальные животные, которые живут группами по 7-16 особей. Они моногамны и очень дорожат своей стаей. Раньше красный волк обитал в горах Алтая, южнее Станового хребта и в низовьях реки Уды. Массовое истребление ради красивого меха привело к тому, что теперь этот вид почти исчез с территории России.
Красный волки – социальные животные, которые живут группами по 7-16 особей. Они моногамны и очень дорожат своей стаей. Раньше красный волк обитал в горах Алтая, южнее Станового хребта и в низовьях реки Уды. Массовое истребление ради красивого меха привело к тому, что теперь этот вид почти исчез с территории России.  Здесь можно увидеть то, чего не увидишь больше нигде, и ради этого многие готовы преодолевать тысячи километров.
Здесь можно увидеть то, чего не увидишь больше нигде, и ради этого многие готовы преодолевать тысячи километров. Из-за клыков в старину кабаргу считали хищником и даже “вампиром, который пьет кровь других животных”. На самом деле это вполне безобидное существо. Считается, что клыки на верхней челюсти помогают ему защищаться от врагов – волков, тигров, рысей и других крупных хищников.
Из-за клыков в старину кабаргу считали хищником и даже “вампиром, который пьет кровь других животных”. На самом деле это вполне безобидное существо. Считается, что клыки на верхней челюсти помогают ему защищаться от врагов – волков, тигров, рысей и других крупных хищников. Еще недавно лесная соня в больших количествах обитала в Курской, Орловской, Тамбовской и Липецкой областях. Она живет здесь и теперь, но встречается очень редко. Уменьшение популяции произошло потому, что зверек обладает роскошной шкуркой. Ради меха, из которого шили дамские шубки и шапки, на соню вели активную охоту. Сейчас это охраняемый вид, поэтому соню больше не истребляют.
Еще недавно лесная соня в больших количествах обитала в Курской, Орловской, Тамбовской и Липецкой областях. Она живет здесь и теперь, но встречается очень редко. Уменьшение популяции произошло потому, что зверек обладает роскошной шкуркой. Ради меха, из которого шили дамские шубки и шапки, на соню вели активную охоту. Сейчас это охраняемый вид, поэтому соню больше не истребляют. В нашей стране осталось всего 87 особей дальневосточных леопардов.
В нашей стране осталось всего 87 особей дальневосточных леопардов. Весьма социальное животное, которое отличается высоким интеллектом и игривостью.
Весьма социальное животное, которое отличается высоким интеллектом и игривостью.  На восстановление популяции ушло немало сил. Сегодня дикие пятнистые олени численностью около 3000 особей находятся под охраной и живут на территории Приморского края.
На восстановление популяции ушло немало сил. Сегодня дикие пятнистые олени численностью около 3000 особей находятся под охраной и живут на территории Приморского края.
 Полярные медведи встречаются у побережья морей – Карского, Баренцева, Лаптевых, Чукотского, Берингова и Восточно-Сибирского. К сожалению, ежегодно браконьеры убивают 150-200 самых крупных представителей семейства медвежьих, поэтому их численность с каждым годом сокращается.
Полярные медведи встречаются у побережья морей – Карского, Баренцева, Лаптевых, Чукотского, Берингова и Восточно-Сибирского. К сожалению, ежегодно браконьеры убивают 150-200 самых крупных представителей семейства медвежьих, поэтому их численность с каждым годом сокращается. Популярны «притравочные станции», когда на диких животных с целью дрессировки натравливают охотничьих собак. Эти и другие проблемы пытаются решить зоозащитные организации, которые работают в разных регионах страны. Волонтеры и зоозащитники борются за сохранение редких исчезающих видов и против жестокого обращения с животными.
Популярны «притравочные станции», когда на диких животных с целью дрессировки натравливают охотничьих собак. Эти и другие проблемы пытаются решить зоозащитные организации, которые работают в разных регионах страны. Волонтеры и зоозащитники борются за сохранение редких исчезающих видов и против жестокого обращения с животными.
 Львы, главные хищники зебр, дальтоники. Черно-белый камуфляж зебр не обязательно должен сливаться с их средой обитания — золотой саванной Центральной Африки.
Львы, главные хищники зебр, дальтоники. Черно-белый камуфляж зебр не обязательно должен сливаться с их средой обитания — золотой саванной Центральной Африки. Узоры на краю тела ходячего листа напоминают следы укусов, оставленные гусеницами на листьях. Насекомое даже раскачивается из стороны в сторону при ходьбе, чтобы лучше имитировать раскачивание листа на ветру.
Узоры на краю тела ходячего листа напоминают следы укусов, оставленные гусеницами на листьях. Насекомое даже раскачивается из стороны в сторону при ходьбе, чтобы лучше имитировать раскачивание листа на ветру. Виды, демонстрирующие предупреждающую окраску, включают личиночную и взрослую стадии бабочки-монарха. Гусеница монарха имеет ярко-желтые, черные и белые полосы. Бабочка монарх окрашена в оранжевый, черный и белый цвета. Монархи едят молочай, который является ядом для многих птиц. Монархи сохраняют яд в своих телах. Ток молочая не смертелен, но у птицы будет рвота. Яркая окраска предупреждает птиц-хищников, что расстройство желудка, вероятно, не стоит трапезы монарха.
Виды, демонстрирующие предупреждающую окраску, включают личиночную и взрослую стадии бабочки-монарха. Гусеница монарха имеет ярко-желтые, черные и белые полосы. Бабочка монарх окрашена в оранжевый, черный и белый цвета. Монархи едят молочай, который является ядом для многих птиц. Монархи сохраняют яд в своих телах. Ток молочая не смертелен, но у птицы будет рвота. Яркая окраска предупреждает птиц-хищников, что расстройство желудка, вероятно, не стоит трапезы монарха. Акулы используют затенение. Если смотреть сверху, они сливаются с более темной океанской водой внизу. Из-за этого рыбакам и пловцам трудно их увидеть. Если смотреть снизу, они сливаются с более светлой поверхностной водой. Это помогает им охотиться, потому что виды добычи внизу могут не заметить акулу, пока не станет слишком поздно.
Акулы используют затенение. Если смотреть сверху, они сливаются с более темной океанской водой внизу. Из-за этого рыбакам и пловцам трудно их увидеть. Если смотреть снизу, они сливаются с более светлой поверхностной водой. Это помогает им охотиться, потому что виды добычи внизу могут не заметить акулу, пока не станет слишком поздно. Виды с биохромами на самом деле меняют цвет. У многих видов осьминогов есть множество биохромов, которые позволяют им изменять цвет, рисунок и непрозрачность кожи.
Виды с биохромами на самом деле меняют цвет. У многих видов осьминогов есть множество биохромов, которые позволяют им изменять цвет, рисунок и непрозрачность кожи.
 Когда хищник, такой как иглобрюх, проходит мимо, краб-одежда замирает, сливаясь с морским дном. Краб-одежда так хорошо приспосабливается к окружающей среде, что даже если его поместить в аквариум, полный человеческих предметов, таких как кружева и жемчужные ожерелья, существо будет «наряжаться» по этому случаю, представляя собой просто еще одну безделушку на дне. танка.
Когда хищник, такой как иглобрюх, проходит мимо, краб-одежда замирает, сливаясь с морским дном. Краб-одежда так хорошо приспосабливается к окружающей среде, что даже если его поместить в аквариум, полный человеческих предметов, таких как кружева и жемчужные ожерелья, существо будет «наряжаться» по этому случаю, представляя собой просто еще одну безделушку на дне. танка.
 Окрас коралловых змей красно-желто-черный. Рисунок алых королевских змей красно-черно-желтый.
Окрас коралловых змей красно-желто-черный. Рисунок алых королевских змей красно-черно-желтый. Чтобы не выделяться из окружающей среды, они обычно двигаются очень медленно, лежат очень неподвижно в ожидании добычи и наносят очень быстрые удары.
Чтобы не выделяться из окружающей среды, они обычно двигаются очень медленно, лежат очень неподвижно в ожидании добычи и наносят очень быстрые удары. Фактически, их яд способен убить их самых больших и сильных хищников и даже способен убить взрослого человека менее чем за один час.
Фактически, их яд способен убить их самых больших и сильных хищников и даже способен убить взрослого человека менее чем за один час.
 С выступами в форме листьев, прикрепленными к их телам, которые на самом деле не имеют никакой цели, кроме маскировки, они могут идеально сливаться с водорослями и водорослями, живущими в их окружении. Перемещаясь из одного места в другое, они используют два плавника рядом с головой и плывут очень медленно, создавая впечатление, что они плывут по водорослям.
С выступами в форме листьев, прикрепленными к их телам, которые на самом деле не имеют никакой цели, кроме маскировки, они могут идеально сливаться с водорослями и водорослями, живущими в их окружении. Перемещаясь из одного места в другое, они используют два плавника рядом с головой и плывут очень медленно, создавая впечатление, что они плывут по водорослям.

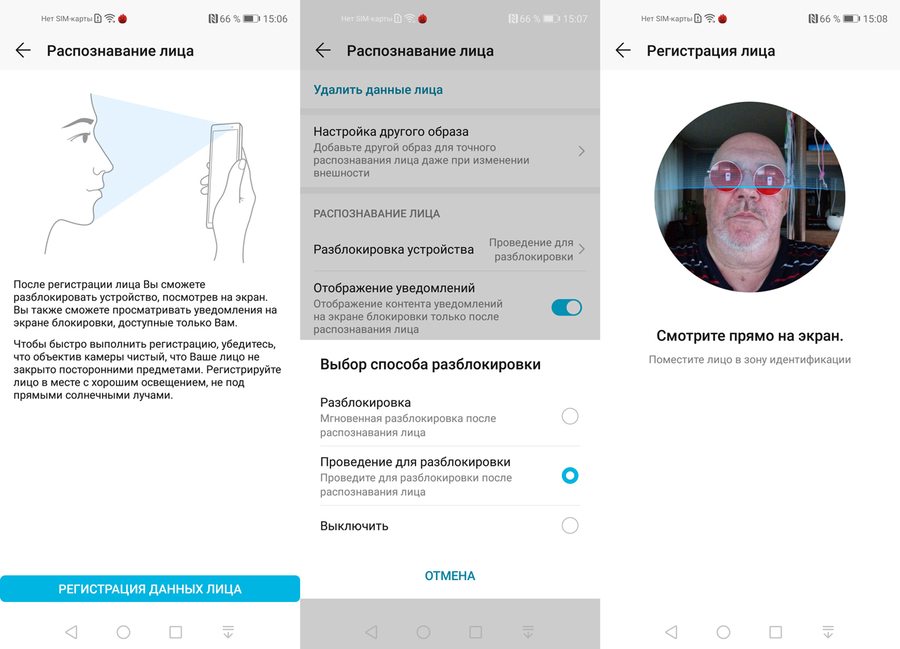
 «
« The response time from the Face API is incredible, enabling us to verify our drivers without slowing them down.»
The response time from the Face API is incredible, enabling us to verify our drivers without slowing them down.» «
« Программное обеспечение распознает личность человека и его образ на фотографии, подтверждая или опровергая, что образ принадлежит одному и тому же лицу. Сервис включает в себя систему идентификации лица человека по фотографии. IDX, сравнивая фотографию в паспорте или ином документе с присланным селфи и проведя дополнительные проверки, способен:
Программное обеспечение распознает личность человека и его образ на фотографии, подтверждая или опровергая, что образ принадлежит одному и тому же лицу. Сервис включает в себя систему идентификации лица человека по фотографии. IDX, сравнивая фотографию в паспорте или ином документе с присланным селфи и проведя дополнительные проверки, способен: Человеческий мозг идентифицирует детали и характеристики черт лица стоящего напротив человека за несколько секунд и делает это настолько быстро и естественно, что сам процесс остается незамеченным.
Человеческий мозг идентифицирует детали и характеристики черт лица стоящего напротив человека за несколько секунд и делает это настолько быстро и естественно, что сам процесс остается незамеченным. Первая – верификация, при которой сравниваются две фотографии, и определятся, принадлежат ли они одному лицу. Вторая — поиск фотографии среди многих (идентификация). На вход поступает фотография лица, и алгоритм должен выбрать максимально похожую фотографию из базы лиц заказчика.
Первая – верификация, при которой сравниваются две фотографии, и определятся, принадлежат ли они одному лицу. Вторая — поиск фотографии среди многих (идентификация). На вход поступает фотография лица, и алгоритм должен выбрать максимально похожую фотографию из базы лиц заказчика.

 В это время наш агент будет:
В это время наш агент будет:


 Вы всегда будете проинформированы о сумме местных налогов, добавленных к базовой цене нашей услуги, в начале транзакции в платежной форме FastSpring.
Вы всегда будете проинформированы о сумме местных налогов, добавленных к базовой цене нашей услуги, в начале транзакции в платежной форме FastSpring.  onfastspring.com/account. Заполните форму и ждите дальнейших инструкций по электронной почте. После входа в Управление учетной записью следуйте инструкциям здесь: https://fastspring.com/question-a-charge/#update-billing-info.
onfastspring.com/account. Заполните форму и ждите дальнейших инструкций по электронной почте. После входа в Управление учетной записью следуйте инструкциям здесь: https://fastspring.com/question-a-charge/#update-billing-info.

 Вы можете выполнять 25 поисковых запросов в день , отобразить результаты менее чем за 5 секунд и проверить их все, то есть открыть ссылки на веб-сайты, на которых мы нашли ваши фотографии, и получить доступ к исходным изображениям . Кроме того, вы можете установить 3 автоматических уведомления, называемых Оповещениями, которые отправляются, когда мы сталкиваемся с новой фотографией, содержащей ваше лицо . Вы также можете воспользоваться помощью нашей высококвалифицированной службы поддержки. Узнайте, где ваше изображение было опубликовано. Выполните поиск и станьте подписчиком прямо сейчас!
Вы можете выполнять 25 поисковых запросов в день , отобразить результаты менее чем за 5 секунд и проверить их все, то есть открыть ссылки на веб-сайты, на которых мы нашли ваши фотографии, и получить доступ к исходным изображениям . Кроме того, вы можете установить 3 автоматических уведомления, называемых Оповещениями, которые отправляются, когда мы сталкиваемся с новой фотографией, содержащей ваше лицо . Вы также можете воспользоваться помощью нашей высококвалифицированной службы поддержки. Узнайте, где ваше изображение было опубликовано. Выполните поиск и станьте подписчиком прямо сейчас! Вы можете использовать эту информацию для отслеживания изображений, которые были опубликованы без вашего согласия, и защитить себя от мошенничества, ловли рыбы или кражи личных данных.
Вы можете использовать эту информацию для отслеживания изображений, которые были опубликованы без вашего согласия, и защитить себя от мошенничества, ловли рыбы или кражи личных данных. 
 Мы не можем достичь этой цели в бесплатной или пробной версии.
Мы не можем достичь этой цели в бесплатной или пробной версии.  Однако мы не можем этого гарантировать.
Однако мы не можем этого гарантировать. com/en/opt-out-request-form.
com/en/opt-out-request-form. Таким образом, ваша покупка может быть сделана безопасно и быстро.
Таким образом, ваша покупка может быть сделана безопасно и быстро. Однако во многих странах наша базовая цена является окончательной ценой. Вы всегда будете проинформированы о сумме местных налогов, добавленных к базовой цене нашей услуги, в начале транзакции в платежной форме FastSpring.
Однако во многих странах наша базовая цена является окончательной ценой. Вы всегда будете проинформированы о сумме местных налогов, добавленных к базовой цене нашей услуги, в начале транзакции в платежной форме FastSpring.  Надлежащее изображение должно соответствовать следующим техническим требованиям:
Надлежащее изображение должно соответствовать следующим техническим требованиям:
 Изображение не обязательно должно быть сохранено на сервере веб-сайта, на котором оно используется, хотя там оно и отображается. В таких случаях исходное изображение сохраняется на внешнем сервере, обычно называемом CDN (Content Delivery Network), и может отображаться на любом веб-сайте, имеющем доступ к его ссылке.
Изображение не обязательно должно быть сохранено на сервере веб-сайта, на котором оно используется, хотя там оно и отображается. В таких случаях исходное изображение сохраняется на внешнем сервере, обычно называемом CDN (Content Delivery Network), и может отображаться на любом веб-сайте, имеющем доступ к его ссылке.

 Однако с планом PROtect вы можете управлять всеми результатами, содержащими ваше лицо. Купить план PROtect можно здесь: https://pimeyes.com/en/premium#pro-tect.
Однако с планом PROtect вы можете управлять всеми результатами, содержащими ваше лицо. Купить план PROtect можно здесь: https://pimeyes.com/en/premium#pro-tect.


 Если вы не видите сообщение электронной почты сразу, проверьте папки СПАМ или НЕЖЕЛАТЕЛЬ, поскольку сообщение могло быть отправлено туда.
Если вы не видите сообщение электронной почты сразу, проверьте папки СПАМ или НЕЖЕЛАТЕЛЬ, поскольку сообщение могло быть отправлено туда.  Вы будете перенаправлены к списку ваших подписок и заказов.
Вы будете перенаправлены к списку ваших подписок и заказов.


 Свет от Солнца до Земли доходит за восемь минут. Так, если подача света прекратится, то человечество узнает об этом только спустя 8 минут. Таким образом, изображение Солнца – это то, как оно выглядело в прошлом. Из-за этой особенности Вселенная заполучила название «машина времени».
Свет от Солнца до Земли доходит за восемь минут. Так, если подача света прекратится, то человечество узнает об этом только спустя 8 минут. Таким образом, изображение Солнца – это то, как оно выглядело в прошлом. Из-за этой особенности Вселенная заполучила название «машина времени».
 Обычно на таком расстоянии его оптика способна разглядеть лишь крупные галактики, в каждой из которых миллионы звезд. И все же космической обсерватории НАСА удалось разглядеть на краю вселенной древнюю звезду Эрендел (Earendel) — благодаря физическому явлению, предсказанному теорией относительности.
Обычно на таком расстоянии его оптика способна разглядеть лишь крупные галактики, в каждой из которых миллионы звезд. И все же космической обсерватории НАСА удалось разглядеть на краю вселенной древнюю звезду Эрендел (Earendel) — благодаря физическому явлению, предсказанному теорией относительности.

 Это весьма распространенное явление, но в таком случае одна из звезд должна быть существенно массивнее другой, и именно ее световой сигнал будет доминирующим.
Это весьма распространенное явление, но в таком случае одна из звезд должна быть существенно массивнее другой, и именно ее световой сигнал будет доминирующим. И лишь после того, как звезды «разжились» тяжелыми элементами, космическое пространство стало выглядеть таким, как мы привыкли.
И лишь после того, как звезды «разжились» тяжелыми элементами, космическое пространство стало выглядеть таким, как мы привыкли.
 Особенно примечательны в изображении «Хаббла» вид горячих голубых молодых звезд, только что сформированных, и розовые облака из раскаленного водорода, излучающие под воздействием ультрафиолетового света от недавно родившихся звезд.
Особенно примечательны в изображении «Хаббла» вид горячих голубых молодых звезд, только что сформированных, и розовые облака из раскаленного водорода, излучающие под воздействием ультрафиолетового света от недавно родившихся звезд.





 NGC 1566, на этот раз в еще более длинных волнах среднего инфракрасного света (самые длинные инфракрасные волны, называемые дальними инфракрасными лучами, теперь недоступны для нас, поскольку НАСА сняло с эксплуатации свой бортовой телескоп дальнего инфракрасного диапазона).
NGC 1566, на этот раз в еще более длинных волнах среднего инфракрасного света (самые длинные инфракрасные волны, называемые дальними инфракрасными лучами, теперь недоступны для нас, поскольку НАСА сняло с эксплуатации свой бортовой телескоп дальнего инфракрасного диапазона). Преобразование необработанных данных с таких телескопов, как Уэбб или Хаббл, в реальное изображение — это смесь науки, точного представления различных длин волн света, улавливаемого телескопом, и искусства, позволяющего творчески подходить к созданию красивого и интересного изображения. Даже командам профессиональных процессоров изображений Научного института космического телескопа, которые превратили необработанные данные Уэбба в умопомрачительные изображения, опубликованные летом, приходится сталкиваться с аналогичными проблемами.
Преобразование необработанных данных с таких телескопов, как Уэбб или Хаббл, в реальное изображение — это смесь науки, точного представления различных длин волн света, улавливаемого телескопом, и искусства, позволяющего творчески подходить к созданию красивого и интересного изображения. Даже командам профессиональных процессоров изображений Научного института космического телескопа, которые превратили необработанные данные Уэбба в умопомрачительные изображения, опубликованные летом, приходится сталкиваться с аналогичными проблемами.
 военный коллиматор анблик, waffe ziele ziele fokus spektrum-anzeige. scharfschütze waffe ziel hud mit dem ziel набор векторных иконок — футуристический пистолет-графика, -клипарт, -мультфильмы и -символ
военный коллиматор анблик, waffe ziele ziele fokus spektrum-anzeige. scharfschütze waffe ziel hud mit dem ziel набор векторных иконок — футуристический пистолет-графика, -клипарт, -мультфильмы и -символ i518.002.S.m005.c10.cowboy Tierschädel Emblem Logo…
i518.002.S.m005.c10.cowboy Tierschädel Emblem Logo… isolierter blasterangriff mit flammenstrom oder blitzen. вельтраум-кампфваффен гезецт. vektor fiktive handfeuerwaffen — футуристическое оружие, графика, клипарт, мультфильмы и символы
isolierter blasterangriff mit flammenstrom oder blitzen. вельтраум-кампфваффен гезецт. vektor fiktive handfeuerwaffen — футуристическое оружие, графика, клипарт, мультфильмы и символы Фильмконцепт. Mischtechnik
Фильмконцепт. Mischtechnik — фото и изображения футуристического оружия
— фото и изображения футуристического оружия графика, клипарт, мультфильмы и символы
графика, клипарт, мультфильмы и символы HUD-Zielsteuerung und Zielradar oder Fadenkreuz auf dem digitalen Bildschirm, der Spiel-UI и dem Raumschiff-Dashboard
HUD-Zielsteuerung und Zielradar oder Fadenkreuz auf dem digitalen Bildschirm, der Spiel-UI и dem Raumschiff-Dashboard Технологии и технологии UI-элемент, оптические элементы. Zielen und Schießen, Spielen
Технологии и технологии UI-элемент, оптические элементы. Zielen und Schießen, Spielen Vektor futuristisches militärisches optisches Zielen, Raumschiff Fadenkreuz. Moderne Techno-Bildschirmelemente, Kollimatorvisier, Fokusbereichsanzeige für Geschützziele
Vektor futuristisches militärisches optisches Zielen, Raumschiff Fadenkreuz. Moderne Techno-Bildschirmelemente, Kollimatorvisier, Fokusbereichsanzeige für Geschützziele Geschützziele, Fokusbereichsindikatoren. Fadenkreuz Spiel Kollimator, zukünftige Ziele Focus. Scharfschützenzielzeiger.
Geschützziele, Fokusbereichsindikatoren. Fadenkreuz Spiel Kollimator, zukünftige Ziele Focus. Scharfschützenzielzeiger.